癌症疗法
1.相关申请的交叉引用
2.本技术要求于2019年2月8日提交的美国临时申请no.62/802,813的优先权和权益,所述美国临时申请以引用的方式整体并入本文。
技术领域
3.本文提供了关于癌症治疗和预防的技术,并且特别地但非排他地是关于与前列腺癌疗法相关的组合物和方法的技术。
背景技术:
4.在美国(u.s.),前列腺癌是男性最常见的癌症。在2017年,美国癌症协会(american cancer society)预测将有约161,360例前列腺癌的新诊断,并且将因此发生约26,730例死亡。
5.早期前列腺癌通常用观察等待或监测、根治性前列腺切除术、放射疗法(单独或与雄激素剥夺疗法(adt)组合)来治疗。
6.晚期前列腺癌用adt治疗。根治性前列腺切除术目前不是晚期病例的选择,因为它不能治疗已经扩散到身体其他部位的癌症。
7.需要对于晚期和侵袭性前列腺癌的其他治疗。
技术实现要素:
8.本文提供了关于癌症治疗和预防的技术,并且特别地但非排他地是与前列腺癌疗法相关的组合物和方法。
9.与用于治疗前列腺癌的现有方案相比,本文所述的组合物和方法提供了改进的治疗。通过提供用雄激素受体拮抗剂与一种或多种dna疫苗和pd
‑
1阻断剂(blockade)组合的间歇性治疗,本文所述的方法允许患有晚期前列腺癌的受试者避免或延迟睾酮降低疗法的副作用,并从而提供改进的生活质量。
10.例如,在一些实施方案中,本文提供了用于治疗受试者(例如,人受试者)中的前列腺癌的方法,所述方法包括:(a)向受试者施用至少一种疫苗,所述疫苗包括含有选自由前列腺酸性磷酸酶(pap)基因和雄激素受体(ar)基因的配体结合结构域组成的组的核苷酸序列的核酸;(b)向所述受试者施用人程序化死亡受体
‑
1(pd
‑
1)抑制剂;以及(c)向所述受试者施用雄激素受体拮抗剂,其中,并行施用所述疫苗、所述pd
‑
1抑制剂和所述雄激素受体拮抗剂。
11.进一步的实施方案提供了包括含有来自前列腺酸性磷酸酶(pap)基因和/或ar基因的核苷酸序列的核酸的疫苗、人程序化死亡受体
‑
1(pd
‑
1)抑制剂和雄激素受体拮抗剂用于治疗有需要的受试者中的前列腺癌的用途,其中并行施用所述疫苗、所述pd
‑
1抑制剂和所述雄激素受体拮抗剂。
12.在一些实施方案中,所述并行施用包括施用所述疫苗,随后在施用所述疫苗的24
小时内施用所述pd
‑
1抑制剂和所述雄激素受体拮抗剂。
13.本发明不限于特定的pap或ar基因。在一些实施方案中,所述pap或ar基因是人或啮齿动物pap基因。在一些实施方案中,所述核苷酸序列编码包括来自seq id no:1、seq id no:2、seq id no:3、seq id no:6的氨基酸序列的多肽或者其部分或经取代变体。在一些实施方案中,所述核酸包括ptvg4
‑
hp。在一些实施方案中,所述核酸进一步包括转录调控元件和/或免疫刺激性序列。在一些实施方案中,来自pap或ar基因的所述核苷酸序列可操作地连接于转录调控元件。
14.本发明不限于特定的pd
‑
1抑制剂。在一些实施方案中,所述pd
‑
1抑制剂是单克隆抗体(例如,派姆单抗(帕博利珠单抗,pembrolizumab)、jnj
‑
63723283或尼鲁单抗(纳武利尤单抗,nivolumab))。在一些实施方案中,在1至5mg/kg的剂量下施用所述pd
‑
1抑制剂。在一些实施方案中,在以下剂量下施用所述pd
‑
1抑制剂:每三周或每4周150至250mg、优选180至200mg和最优选约200mg,或每2周220至260mg和最优选约240mg,或每4周450至510mg和最优选480mg。在一些实施方案中,静脉内施用所述pd
‑
1抑制剂。
15.本发明不限于特定的雄激素受体拮抗剂。在一些实施方案中,所述雄激素受体拮抗剂是恩杂鲁胺(enzalutamide)或阿帕鲁胺(apalutamide)。在一些实施方案中,在以下剂量下施用恩杂鲁胺:每日120至200mg、优选140至180mg和最优选约160mg,或每日210至270mg和更优选约240mg,以及在以下剂量下施用所述阿帕鲁胺:每日210至270mg和更优选约240mg。
16.在一些实施方案中,所述疫苗进一步包括佐剂(例如,gm
‑
csf)。在一些实施方案中,真皮内或经皮施用所述疫苗。在一些实施方案中,以大约100μg的量施用所述疫苗。在一些实施方案中,约每1至4(例如每3周)施用所述疫苗。
17.在一些实施方案中,施用所述疫苗、所述雄激素受体拮抗剂和所述pd
‑
1抑制剂多次,并且其中在首次并行施用所述疫苗和所述pd
‑
1抑制剂之后,每10至21天施用所述疫苗,每17至30天施用所述pd
‑
1抑制剂,持续多达90天的时期,并且在首次施用所述疫苗之后1至16周和最优选约12周开始,每日施用所述雄激素受体拮抗剂,持续多达90天的时期。在一些实施方案中,每日施用雄激素受体拮抗剂持续90天,随后是不施用所述雄激素受体拮抗剂的时期。例如,在一些实施方案中,在不施用所述雄激素受体拮抗剂的90天休息时期后,每90天重复每日施用所述雄激素受体拮抗剂。在一些实施方案中,每10至28天并行施用所述疫苗和所述pd
‑
1抑制剂,持续长达90天的时期。在一些实施方案中,每10至28天施用所述疫苗和所述pd
‑
1抑制剂,持续91天至365天的时期或366天至730天的时期。在一些实施方案中,所述疫苗包括针对pap的第一疫苗和针对ar的第二疫苗,并且并行施用所述第一疫苗和所述第二疫苗(例如,在分开的或相同的药物组合物中)。
18.在一些实施方案中,所述方法或用途在所述受试者中产生相对于施用单独所述疫苗或所述疫苗与所述pd
‑
1抑制剂组合得以改进的抗肿瘤应答。在一些实施方案中,所述方法或用途使所述受试者中pap和/或ar特异性t细胞或抗体的数目增加。在一些实施方案中,所述方法或用途导致不可检测的psa水平(例如,在中断施用所述雄激素受体拮抗剂后持续(例如,在中断施用所述雄激素受体拮抗剂后持续至少1、4、6、12、24或更多个月)。
19.进一步的实施方案提供了试剂盒,其包括:1)包括疫苗的第一药物组合物,所述疫苗包括含有选自由前列腺酸性磷酸酶(pap)基因和雄激素受体(ar)基因的配体结合结构域
组成的组的核苷酸序列的核酸;2)包括pd
‑
1抑制剂的第二药物组合物;3)包括雄激素受体拮抗剂的第三药物组合物。在一些实施方案中,呈单次剂量形式提供所述第一、第二和第三药物组合物。在一些实施方案中,所述试剂盒包括的所述第一药物组合物的量、所述第二药物组合物的量和所述第三药物组合物的量足以提供用于给药时程的足够剂量,在所述给药时程中,施用所述核酸疫苗、所述pd
‑
1抑制剂和雄激素受体拮抗剂多次。
20.基于本文包含的教导,额外的实施方案对于相关领域的技术人员将是显而易见的。
附图说明
21.参考以下附图将更充分理解本发明技术的这些和其他特征、方面和优势:
22.应了解附图未必按比例绘制,附图中的物体也未必以相对于彼此的关系按比例绘制。附图是对本文公开的设备、系统和方法的各种实施方案的意图带来明晰性和理解性的描绘。只要可能,相同参照编号将在整个附图中用于指代相同或同样部分。此外,应了解附图不意图以任何方式限制本教义的范围。
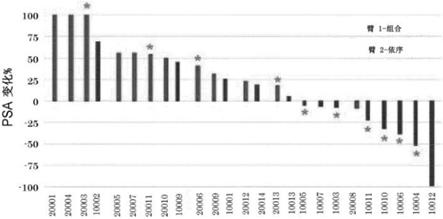
23.图1a示出了从研究的第1天起血清psa的最佳%变化。星号指示具有pap特异性th1免疫证据的那些患者(治疗后至少两次检测到显著ifnγ和/或颗粒酶b应答)。
24.图1b示出了在6个月(左)和24个月(右)中血清psa相对于基线的最佳变化。
25.图2示出了示例性临床研究方案。
26.图3示出了示例性pap序列。
27.图4示出了示例性ar序列。
28.图5a
‑
b示出了对a)ar肽和b)ar蛋白具有和不具有免疫应答的受试者中的无进展存活期。
29.图6a
‑
b示出了在对于ar疫苗与adt组合具有和不具有对ar的应答的受试者中对ar的患者响应。c)pcwg2准则;d)具有和不具有对ar的应答的受试者中psa进展的时间。
30.图7a
‑
b示出了ar疫苗加检查点抑制剂在携带前列腺肿瘤的小鼠中提供改进的抗肿瘤作用。a)ar疫苗加pd
‑
1抑制剂。b)ar疫苗和adt加pd
‑
1抑制剂。
具体实施方式
31.本文提供了关于癌症治疗和预防的技术,并且特别地但非排他地是关于与前列腺癌疗法相关的组合物和方法的技术。在对各种实施方案的这个详细描述中,出于解释的目的,阐述众多特定细节以提供对所公开实施方案的彻底理解。然而,本领域技术人员将了解,这些各种实施方案可在有或无这些特定细节下实施。在其他情况下,结构和装置以框图形式显示。此外,本领域技术人员可易于了解呈现和进行方法所采用的特定顺序是说明性的,并且预期顺序可变化,并且仍然在本文公开的各种实施方案的精神和范围内。
32.本技术中引用的所有文献和类似材料,包括但不限于专利、专利申请、文章、书籍、专著和因特网网页,出于任何目的以引用的方式整体明确并入本文。除非另外定义,否则本文所用的所有技术和科学术语都具有与由本文所述的各种实施方案所属领域中的普通技术人员通常理解相同的含义。当并入的参考文献中的术语定义似乎不同于本教义中提供的定义时,将以本教义中提供的定义为准。本文所用的章节标题仅出于组织目的,并且不应解
释为以任何方式限制所述主题。
33.定义
34.为有助于理解本发明技术,以下定义了许多术语和短语。额外定义遍及详细描述加以阐述。
35.除非上下文另外明确规定,否则遍及说明书和权利要求,以下术语采用本文明确关联的含义。如本文所用的短语“在一个实施方案中”未必是指同一实施方案,但这可能是指同一实施方案。此外,如本文所用的短语“在另一实施方案中”未必是指不同实施方案,但这可能是指不同实施方案。因此,如下所述,可在不脱离本发明的范围或精神下易于组合本发明的各种实施方案。
36.另外,除非上下文另外明确规定,否则如本文所用,术语“或”是包括性“或”运算符,并且等效于术语“和/或”。除非上下文另外明确规定,否则术语“基于”不具有排它性,并且允许基于未描述的额外因素。另外,遍及说明书,“一个(种)(a/an)”和“所述(该)(the)”的含义包括复数个(种)指示物。“在
…
中”的含义包括“在
…
中”和“在
…
上”。
37.如本文所用,“最佳总体响应”是从基线直至疾病进展/复发所记录的最佳响应,采用在基线之后记录的最小测量结果作为进行性疾病的参照。
38.如本文所用,“对响应的首次文件记载”是指启动疗法与首次文件记载如本文定义的对疗法的部分响应或完全响应之间的时间。
39.如本文所用,“响应的持续时间”是指从满足完全响应或部分响应(无论首先记录哪个状况)的测量准则的时间直至客观地文件记载复发性或进行性疾病的第一日期所测量的时期,采用从治疗开始以来记录的最小测量结果作为参照。
40.如本文所用,“总体完全响应的持续时间”是指从满足完全响应的测量准则的时间直至客观地文件记载复发性疾病的第一日期所测量的时期。
41.如本文所用,“稳定疾病的持续时间”是指从基线直至满足疾病进展的准则的测量结果,采用从基线以来记录的最小测量结果作为参照。
42.如本文所用,“存活期”是指从启动根据所述技术进行的治疗至由于任何原因的死亡或在删截患者的情况下至末次跟踪的时间间隔。
43.如本文所用,术语“蛋白质”和“多肽”是指包括经由肽键接合的氨基酸的化合物,并且可互换使用。由基因编码的“蛋白质”或“多肽”不限于由所述基因编码的氨基酸序列,而是包括蛋白质的翻译后修饰。当术语“氨基酸序列”在本文中被叙述来指代蛋白质分子的氨基酸序列时,“氨基酸序列”和类似术语诸如“多肽”或“蛋白质”不意指将氨基酸序列限于与所叙述蛋白质分子相关的完整天然氨基酸序列。此外,“氨基酸序列”可以从编码蛋白质的核酸序列推导。常规单字母和三字母氨基酸代码如下在本文中使用
–
丙氨酸:ala,a;精氨酸:arg,r;天冬酰胺:asn,n;天冬氨酸:asp,d;半胱氨酸:cys,c;谷氨酸:glu,e;谷氨酰胺:gln,q;甘氨酸:gly,g;组氨酸:his,h;异亮氨酸:ile,i;亮氨酸:leu,l;赖氨酸:lys,k;甲硫氨酸:met,m;苯丙氨酸:phe,f;脯氨酸:pro,p;丝氨酸:ser,s;苏氨酸:thr,t;色氨酸:trp,w;酪氨酸:tyr,y;缬氨酸:val,v。如本文所用,代码xaa和x是指任何氨基酸。
44.术语“部分”在关于蛋白质使用(如在“给定蛋白质的一部分”中)时是指那个蛋白质的片段,诸如蛋白质的“肽”。片段的大小可在4个氨基酸残基至整个氨基序列减去1个氨基酸的范围内(例如大小范围包括4、5、6、7、8、9、10个或更多个氨基酸直至整个氨基酸序列
nomenclature in molecular diagnostics:practical and educational challenges”,j.mol.diagn.9(1):1
–
6(2007年2月),其出于所有目的以引用的方式整体并入本文。
49.术语“结构域”在关于多肽使用时是指多肽的具有独特结构和/或功能特征的子段;通常,这个特征在不同多肽之间是类似的。子段通常包括邻接氨基酸,但它也可包括协力起作用或者由于折叠而紧密邻近或处于其他构型的氨基酸。蛋白质结构域的实例包括跨膜结构域和糖基化位点。
50.术语“基因”是指包括为产生rna或多肽或它的前体(例如胰岛素原(proinsulin))所必需的编码序列的核酸(例如dna或rna)序列。功能性多肽可以由全长编码序列或由编码序列的任何部分编码,只要多肽的所需活性或功能性质(例如酶活性、配体结合、信号转导等)得以保留即可。术语“部分”在关于基因使用时是指那个基因的片段。片段的大小可在少许核苷酸至整个基因序列减去一个核苷酸的范围内。因此,“包括基因的至少一部分的核苷酸”可包括所述基因的片段或整个基因。
51.术语“基因”也涵盖结构基因的编码区,并且包括在5
′
末端与3
′
末端两者上邻近于编码区定位的序列,在任一末端上持续约1kb的距离,以致基因对应于全长mrna的长度。位于编码区的5
′
,并且存在于mrna上的序列被称为5
′
非翻译序列。位于编码区的3
′
或下游,并且存在于mrna上的序列被称为3
′
非翻译序列。术语“基因”涵盖基因的cdna形式与基因组形式两者。基因的基因组形式或克隆包含被称为“内含子”或“间插区”或“间插序列”的非编码序列中断的编码区。内含子是基因的被转录成核rna(hnrna)的区段;内含子可包含调控元件诸如增强子。内含子被从核转录物或初级转录物移除或“剪接掉”;因此,内含子不存在于信使rna(mrna)转录物中。mrna在翻译期间起对初生多肽中的氨基酸序列或顺序进行指定的作用。
52.除包含内含子之外,基因的基因组形式也可包括位于存在于rna转录物上的序列的5
′
末端与3
′
末端两者上的序列。这些序列被称为“侧接”序列或区域(这些侧接序列位于存在于mrna转录物上的非翻译序列的5
′
或3
′
)。5
′
侧接区域可包含控制或影响基因转录的调控序列,诸如启动子和增强子。3
′
侧接区域可包含指导转录终止、转录后裂解和多聚腺苷酸化的序列。
53.术语“野生型”在关于基因采用时是指基因具有从天然存在的来源分离的基因特征。术语“野生型”在关于基因产物采用时是指基因产物具有从天然存在的来源分离的基因产物特征。如应用于对象的术语“天然存在”是指对象可见于自然界中的事实。举例来说,可以从自然界中的来源分离,并且尚未由实验室中的人进行故意修饰的存在于生物体(包括病毒)中的多肽或多核苷酸序列是天然存在的。野生型基因常常是最常在群体中观察到,并且因此被任意指定为基因的“正常”或“野生型”形式的那个基因。相比之下,术语“修饰”或“突变”在关于基因或基因产物采用时分别是指当相较于野生型基因或基因产物时,在序列和/或功能性质方面显示改变(即改变的特征)的基因或基因产物。应注意可以分离天然存在的突变体;这些突变体根据它们在相较于野生型基因或基因产物时具有改变的特征的事实来鉴定。
54.术语“基因表达”是指使基因中编码的遗传信息通过所述基因的“转录”(即经由rna聚合酶的酶促作用)转化成rna(例如mrna、rrna、trna或snrna),以及通过mrna的“翻译”转化成蛋白质的过程。基因表达可以在过程中的许多阶段加以调控。
55.如本文所用,术语“可操作地连接”意指核苷酸序列的转录或翻译处于另一功能性核苷酸序列诸如启动子、增强子、转录因子结合位点等的影响下。“可操作地连接”也意指两个核苷酸序列接合以使各dna片段的编码序列保持在适当阅读框中。以这个方式,启动子、增强子等的核苷酸序列连同用于在受试者中表达的目标核苷酸序列例如编码pap的核苷酸序列一起提供在dna构建体中。术语“异源性核苷酸序列”意指不与启动子序列天然可操作地连接的序列。尽管这个核苷酸序列对于启动子序列是异源性的,但它对于受试者可为同源性的(“天然”)或异源性的(“外来”)。
56.如本文所用,术语“治疗”定义为向患有疾病,具有疾病症状,或具有疾病倾向的患者施加或施用本文所述的治疗剂(例如dna疫苗、pd
‑
1抑制剂、和/或雄激素受体拮抗剂)或通过本文所述的方法鉴定的治疗剂,或向来自所述患者的经分离组织或细胞系施加或施用所述治疗剂,目的是治愈、愈合、减轻、解除、改变、医冶、改善、改进或影响所述疾病、所述疾病症状或所述疾病倾向。
57.根据技术的组合物可以以药学上可接受的盐形式施用。术语“药学上可接受的盐”是指具有母体化合物的有效性,并且不在生物学上或在其他方面不合需要(例如对于其接受者既不有毒又不另外有害)的盐。适合盐包括可例如通过使本技术的化合物的溶液与药学上可接受的酸诸如盐酸、硫酸、乙酸、三氟乙酸或苯甲酸的溶液混合来形成的酸加成盐。本技术中采用的某些化合物可携带酸性部分(例如cooh或酚基团),在所述情况下,其适合药学上可接受的盐可以包括碱金属盐(例如钠盐或钾盐)、碱土金属盐(例如钙盐或镁盐)以及与适合有机配体形成的盐,诸如季铵盐。此外,在酸(cooh)或醇基团存在的情况下,药学上可接受的酯可以应用于改变化合物的溶解或水解特征。举例来说,药学上可接受的盐包括金属(无机)盐与有机盐两者,其清单在remington’s pharmaceutical sciences,第17版,第1418页(1985)中给出。本领域技术人员熟知的是基于物理和化学性质选择适当盐形式。如将由本领域技术人员所理解,药学上可接受的盐包括但不限于无机酸的盐,诸如盐酸盐、硫酸盐、磷酸盐、二磷酸盐、氢溴酸盐和硝酸盐;或有机酸的盐,诸如苹果酸盐、顺丁烯二酸盐、反丁烯二酸盐、酒石酸盐、丁二酸盐、柠檬酸盐、乙酸盐、乳酸盐、甲烷磺酸盐、对甲苯磺酸盐或双羟萘酸盐(palmoate)、水杨酸盐和硬脂酸盐。类似地,药学上可接受的阳离子包括但不限于钠、钾、钙、铝、锂和铵(尤其是与仲胺的铵盐)。也包括在这个技术的范围内的是晶体形式、水合物和溶剂合物。
58.关于化合物的术语“施用”及其变化形式(例如“施用”化合物、疫苗、药物等)意指向需要治疗或防治的个体提供化合物或化合物的前药。当技术的化合物或其前药与一种或多种其他活性剂组合提供时,“施用”和它的变化形式应各自理解为包括在相同时间或在不同时间提供所述化合物或前药以及其他药剂。如本文所用,术语“并行施用”是指优选在彼此的24小时内施用两种药剂。当组合的药剂被“并行”(例如在彼此的24小时内)施用时,它们可以于单一组合物中一起施用,或它们可以分开施用。在其中它们被分开施用的情况下,施用第一药剂诸如pap疫苗,监测患者,并且接着在优选24小时的指定时期内施用第二药剂诸如pd
‑
1抑制剂和和雄激素受体拮抗剂。如本文所用,术语“组合物”旨在涵盖以指定量包括指定成分的产品,以及由以指定量使指定成分组合所直接或间接得到的任何产品。
59.如本文所用,术语“共同施用(co
‑
administration/co
‑
administering)”是指向受试者施用至少两种药剂(例如dna疫苗和pd
‑
1抑制剂和/或雄激素受体拮抗剂)或疗法。在一
卷;comprehensive heterocyclic chemistry ii,a.r.katritzky和c.w.rees(编)pergamon,oxford 1996,第1
–
11卷;以及organic reactions,wiley&sons:new york,1991,第1
–
40卷。
64.如本文所用,术语“用于诱导免疫应答的组合物”是指一旦向受试者施用(例如一次、两次、三次或更多次(例如分隔数周、数月或数年)),即在所述受试者中刺激、产生和/或引发免疫应答(例如导致产生cd8 和或cd4 t细胞和/或产生抗体)的组合物。在一些实施方案中,组合物包括核酸和一种或多种其他化合物或药剂,包括但不限于治疗剂、生理上可耐受液体、凝胶、载体、稀释剂、佐剂、赋形剂、水杨酸盐、类固醇、免疫抑制剂、免疫刺激剂、抗体、细胞因子、抗生素、粘合剂、填充剂、防腐剂、稳定剂、乳化剂和/或缓冲剂。免疫应答可为先天性(例如非特异性)免疫应答或习得(例如获得性)免疫应答。
65.如本文所用,术语“佐剂”是指可以刺激免疫应答的任何物质。一些佐剂可以导致免疫系统的细胞活化(例如佐剂可以导致免疫细胞产生和分泌细胞因子)。可以导致免疫系统的细胞活化的佐剂的实例包括但不限于粒细胞
‑
巨噬细胞集落刺激因子(gm
‑
csf)、从皂树(q.saponaria)的树皮纯化的皂素,诸如qs21(在hplc分级分离的情况下在第21峰中洗脱的糖脂;aquila biopharmaceuticals,inc.,worcester,mass.);聚(二(羧基苯氧基)磷腈)(pcpp聚合物;virus research institute,usa);脂多糖的衍生物,诸如单磷酰基脂质a(mpl;ribi immunochem research,inc.,hamilton,mont.)、胞壁酰基二肽(mdp;ribi)和苏氨酰基
‑
胞壁酰基二肽(t
‑
mdp;ribi);om
‑
174(与脂质a相关的葡糖胺二糖;om pharma sa,meyrin,switzerland);以及利什曼原虫(leishmania)延伸因子(纯化利什曼原虫蛋白;corixa corporation,seattle,wash.)。传统佐剂在本领域中是熟知的,并且包括例如磷酸铝或氢氧化铝盐(“明矾”)。在一些实施方案中,本技术的组合物与一种或多种佐剂一起施用。
66.如本文所用,术语“(例如用于诱导免疫应答的组合物的)有效诱导免疫应答的量”是指为在受试者中刺激、产生和/或引发免疫应答所需(例如当向受试者施用时)的剂量水平。有效量可以以一次或多次施用(例如经由相同或不同途径)、施加或剂量加以施用,并且不旨在限于特定制剂或施用途径。
67.如本文所用,术语“在使得所述受试者产生免疫应答的条件下”是指任何定性或定量诱导、产生和/或刺激免疫应答(例如先天性或获得性免疫应答)。
68.如本文所用,术语“免疫应答”是指通过受试者的免疫系统达成的应答。举例来说,免疫应答包括但不限于toll样受体(tlr)活化、淋巴因子(例如细胞因子(例如th1或th2型细胞因子)或趋化因子)表达和/或分泌、巨噬细胞活化、树突状细胞活化、t细胞活化(例如cd4 或cd8 t细胞)、nk细胞活化和/或b细胞活化(例如抗体产生和/或分泌)的可检测改变(例如增加)。免疫应答的额外实例包括免疫原(例如抗原(例如免疫原性多肽))结合mhc分子并诱导细胞毒性t淋巴细胞(“ctl”)应答,诱导针对免疫原性多肽所源于的抗原的b细胞应答(例如抗体产生)和/或t辅助淋巴细胞应答和/或延迟型过敏(dth)应答,免疫系统的细胞(例如t细胞、b细胞(例如任何发育阶段的b细胞(例如浆细胞)))扩增(例如细胞群体的生长),以及由抗原递呈细胞对抗原的加工和递呈增加。免疫应答可针对受试者的免疫系统识别为外来的免疫原(例如识别为外来的非自身抗原或自身抗原)。因此,应理解,如本文所用,“免疫应答”是指任何类型的免疫应答,包括但不限于先天性免疫应答(例如toll受体信
号传导级联的活化)、细胞介导的免疫应答(例如由免疫系统的t细胞(例如抗原特异性t细胞)和非特异性细胞介导的应答)、以及体液免疫应答(例如由b细胞介导的应答(例如经由产生抗体以及向血浆、淋巴和/或组织液中分泌抗体))。术语“免疫应答”意指涵盖受试者的免疫系统对抗原和/或免疫原起应答的能力的所有方面(例如对免疫原的初始应答以及作为适应性免疫应答的结果的获得性(例如记忆性)应答两者)。
69.如本文所用,术语“免疫原”和“抗原”是指能够在受试者中引发免疫应答的药剂(例如pap和/或ar多肽)和/或其部分或组分(例如来自pap多肽和或ar多肽的肽)。
70.如本文所用,术语“疾病进展”是指根据诊断测定诸如分子测定或成像测定,出现新的疾病进展迹象,例如在骨扫描时出现新的病变。
71.描述
72.尽管本文公开内容涉及某些说明的实施方案,但应理解这些实施方案通过举例的方式而非通过限制的方式来呈现。
73.用pd
‑
1/pd
‑
l1抑制剂观察到的显著临床响应是癌症免疫疗法被science评为2013年的年度科学突破的部分原因之一[1]。事实上,靶向pd
‑
1可以是通用的抗癌疗法,因为它直接靶向t细胞而不是肿瘤。然而,迄今为止的临床试验经验指示,相比于具有其他组织结构(包括前列腺癌)的患者,具有一些实体瘤类型的患者经历更大益处[2]。这种不一致可能是由于响应和非响应患者预先存在的t细胞的差异。已经证明,前列腺癌可以表达pd
‑
l1并具有浸润性pd
‑
1表达t细胞,尽管相对于某些癌症而言,这些是低频率的[3]。综上所述,这些结果指示,通过与旨在增加功能活性、肿瘤特异性cd8 t细胞的频率的治疗组合,可以增加pd
‑
1/pd
‑
配体阻断剂对较弱响应的肿瘤(包括前列腺癌)的功效。
[0074]
评估了患有早期psa复发(非转移性)前列腺癌的患者对靶向前列腺酸性磷酸酶(mv
‑
816)的dna疫苗的响应[4,5]。在经治疗的38名患者中,未观察到显著的不良事件。此外,几名患者出现了pap特异性cd4 和cd8 t细胞的证据,并且几名患者经历了psa倍增时间的延长,证明了免疫功效并指示可能的抗肿瘤作用[4,5]。对pap的长期分泌ifnγ的免疫应答的存在,其在免疫后数月可多次检测到,与psa倍增时间的增加有关,指示这可作为功效的合理生物标志物[6]。此外,发现几个月后重复免疫可以增强免疫应答,指示dna疫苗可能提供了引发肿瘤特异性cd8 t细胞的简单手段[5]。进一步的初步研究已经示出,先前用mvi
‑
816治疗的患者具有携带pd
‑
l1表达的epcam 循环上皮细胞(cec),类似于小鼠模型中的发现[7]。这些发现进一步支持mvi
‑
816疫苗可以用于引发对前列腺肿瘤具有特异性的cd8 t细胞,其功效可能会随着pd
‑
1阻断剂的并行治疗而增强。
[0075]
在本公开实施方案的开发过程期间进行的研究证明,通过dna疫苗接种的t细胞活化导致cd8 t细胞上的pd
‑
1上调,并且在接种疫苗时pd
‑
1的阻断导致小鼠模型中更好的抗肿瘤应答。基于这些发现,在患有转移性去势抵抗性前列腺癌(mcrpc)的患者中使用mvi
‑
816与派姆单抗组合进行了研究。在此试验中,患者在12至24周的疗程中一起或依次接受两种药剂。据观察,用派姆单抗的pd
‑
1阻断剂当与疫苗并行施用时,引发13名患者中的8名患者的psa下降(图1),并且在psa下降最大的两名患者中观察到了客观的肿瘤响应。psa响应与针对pap靶标抗原的免疫应答的发展有关,并引发cd8 肿瘤浸润淋巴细胞,这与疫苗作为t细胞活化疗法的作用一致。这些是令人鼓舞的发现,特别是因为在先前的i期试验中,已经证明单独的具有检查点抑制剂的pd
‑
1阻断剂对患有这一阶段前列腺癌的患者几乎没有单
药剂临床活性,并行接受恩杂鲁胺的患者可能除外[8,9,10]。此外,在疫苗疗法之后psa下降和客观的放射摄影响应很少见。
[0076]
雄激素剥夺是对患有转移性前列腺癌的患者的治疗的基石。它也常用于患有psa复发性前列腺癌的患者,并且在疾病的这一阶段已在间歇或连续的基础上使用。除了它针对靶标的直接抗肿瘤作用外,雄激素剥夺还具有免疫刺激作用。这些包括诱导胸腺再生和初始t细胞释放增加、免疫细胞浸润到前列腺中增加(髓细胞和淋巴细胞群两者)、调节性t细胞数量减少以及对前列腺抗原的抗体应答增加(11
‑
16)。临床前研究已经示出,雄激素剥夺可以增强各种免疫治疗方案的功效,包括检查点阻断(17)、放射肿瘤细胞疫苗(18)、t细胞过继转移(19)和抗原特异性疫苗(20、21)。
[0077]
最近发表的结果(22)示出,雄激素剥夺在体外和体内增加了人和小鼠前列腺肿瘤细胞中的ar表达。增加的表达随着时间持续。增加的ar表达与ar特异性t细胞的识别和细胞溶解活性有关。此外,adt与疫苗接种组合,特别是编码ar的配体结合结构域的dna疫苗(mvi
‑
118),导致改进的抗肿瘤应答,如通过两只小鼠前列腺癌模型(myc
‑
cap和前列腺特异性pten缺陷小鼠)中的肿瘤体积和延迟出现的去势抵抗性前列腺肿瘤所测量的。
[0078]
因此,在一些实施方案中,adt与针对ar的免疫疗法组合以靶向抗性的主要机制,ar的过表达。在一些实施方案中,恩杂鲁胺(雄激素受体拮抗剂)与抗肿瘤疫苗接种组合使用[21]。包括恩杂鲁胺或阿帕鲁胺的雄激素受体拮抗剂的优势是它们在不影响睾酮产生的情况下调节它们的作用。因此,它们可以间歇使用,与如所描述的免疫疗法组合[23],避免睾酮抑制对患有早期疾病的患者的潜在长期作用。在需要雄激素剥夺疗法之前,能够将psa驱动至不可检测的水平,可能地治愈或显著延迟前列腺癌的转移性复发,这是该疾病疗法中一个实质性且具有临床意义的“改变游戏规则”的进展。
[0079]
本文描述了示例性组合物和方法。
[0080]
i.dna疫苗
[0081]
本发明的实施方案包括针对癌症靶标(例如,pap和/或ar)的dna疫苗。
[0082]
pap
[0083]
前列腺酸性磷酸酶(pap)是前列腺癌中的肿瘤抗原,并且pap特异性cd8 ctl可以使前列腺癌细胞溶解。pap首先于1938年鉴定,并且最初用作检测前列腺癌的血清标志物。pap在正常和恶性前列腺细胞中的表达已被文献充分记载,并且仍然在免疫组织化学染色中用于确定转移性癌的前列腺来源。不同于可由或可不由特定肿瘤表达的特定致癌基因,pap在前列腺组织中的遍在性表达使得它成为作为免疫定向前列腺癌疗法的潜在“通用”靶标的有吸引力的抗原。此外,已证明一些前列腺癌患者具有针对pap的预先存在的抗体和t细胞应答,从而表明对这个“自身”蛋白质的耐受性可在体内被避免。特定来说,对pap具有特异性的th1样免疫应答指示即使不进行免疫,容许抗肿瘤应答的免疫环境也存在于患者中。此外,实验先前已证明对前列腺癌细胞具有细胞溶解活性的对pap具有特异性的cd8 t细胞存在于前列腺癌患者中,并且可以用疫苗接种来加强。
[0084]
pap基因是已知的,并且已经从人、小鼠和大鼠中克隆(分别参见例如seq id no:1、seq id no:2和seq id no:3)。如将易于由本领域普通技术人员所认识到,编码pap基因的任何dna序列都适于本发明,并且来自其他动物的任何其他pap基因在它们变得被鉴定、表征和克隆时也适于本发明。已知狗和非人灵长类具有pap基因。可易于认识到任何来源的
pap基因或它的任何衍生物、等效物、变体、突变体等都适于本技术,只要由基因或其衍生物、等效物、变体或突变体编码的蛋白质在宿主动物中诱导大致上与由自体抗原性或异种抗原性pap蛋白质在动物中诱导的免疫反应类似的免疫反应即可。pap在前列腺癌中的作用和靶向pap的示例性疫苗在wo 2017/139628中有所描述,其以引用的方式整体并入本文。
[0085]
ar
[0086]
在一些实施方案中,本文提供了靶向提供的雄激素受体的配体结合结构域的dna疫苗(参见例如美国专利no.9,433,668、8,962,590、8,513,210和7,910,565;所述美国专利的每一件以引用的方式整体并入本文)。此类疫苗利用任何来源的雄激素受体的配体结合结构域,或任何配体结合结构域的衍生物、等效物、变体、突变体等,它们都适于本发明,只要配体结合结构域或其衍生物、等效物、变体或突变体能够在宿主人或非人动物中诱导大致上与由自体抗原性或异种抗原性的雄激素受体的配体结合结构域在动物中诱导的免疫反应类似的免疫反应即可。类似地,编码受体的配体结合结构域的任何来源的雄激素受体基因的多核苷酸序列,或任何多核苷酸的衍生物、等效物、变体、突变体等都适于本发明,只要多核苷酸序列和由多核苷酸序列编码的多肽或蛋白质,或其衍生物、等效物、变体或突变体能够在宿主人或非人动物中诱导大致上与由自体抗原性或异种抗原性的雄激素受体的配体结合结构域在动物中诱导的免疫反应类似的免疫反应即可。
[0087]
雄激素受体基因是已知的,并且已经从许多物种中克隆。例如,人、小鼠、大鼠、狗、黑猩猩、猕猴和狐猴雄激素受体cdna连同氨基酸序列可以分别在genbank登录号nm_000044(cdna
‑
seq id no:5和氨基酸序列
‑
seq id no:6)、nm_013476(cdna
‑
seq id no:7和氨基酸序列
‑
seq id no:8)、nm_012502(cdna
‑
seq id no:9和氨基酸序列
‑
seq id no:10)、nm_001003053、nm_001009012、u94179和u94178中找到。来自其他物种的雄激素受体基因也是已知的。这些物种包括但不限于欧亚野猪(sus scrofa)、伯氏妊丽鱼(astatotilapia burtoni)、原鸡(gallus gallus)、红树林鱂鱼(kryptolebias marmoratus)、美国短吻鳄(alligator mississippiensis)、猬白鳐(leucoraja erinacea)、伯氏朴丽鱼(haplochromis burtoni)、黑头软口鲦(pimephales promelas)、舌齿鲈(dicentrarchus labrax)、食蚊鱼(gambusia affinis)、细须石首鱼(micropogonias undulates)、青鳉鱼(oryzias latipes)、黑棘鲷(acanthopagrus schlegelii)、牛蛙(rana catesbeiana)、斑鬣狗(crocuta crocuta)、褐领狐猴(eulemur fulvus collaris)和日本鳗(anguilla japonica)(分别参见genbank登录号nm_214314(或af161717)、ay082342、nm_001040090、dq339105、ab186356、dq382340、af121257、ay727529、ay647256、ab099303、ay701761、ab076399、ay219702、ay324231、ay128705、u94178和ab023960)。出于本发明的目的,人雄激素受体的配体结合结构域是指起始于氨基酸位651至681中的任何氨基酸并终止于氨基酸位900至920中的任何氨基酸的多肽。例如,包括氨基酸681
‑
900的人雄激素受体或人雄激素受体的片段以及包含编码上述的多核苷酸的dna疫苗是合适的疫苗。来自其他物种的雄激素受体的相应配体结合结构域可以通过序列比对(与人序列)(例如,通过下文关于序列同一性或同源性描述的方法)容易地确定。在优选的实施方案中,本发明中使用来自人雄激素受体的多肽,其起始于氨基酸位661至671中的任何氨基酸并终止于氨基酸位910至920中的任何氨基酸。在更优选的实施方案中,本发明中使用包含人雄激素受体的氨基酸661至920或664至920的多肽。为了帮助确定来自其他物种的雄激素受体的相应片段,这里指出与人
雄激素受体的氨基酸位661至920相对应的大鼠、狗、黑猩猩、猕猴和狐猴雄激素受体上的氨基酸位分别为640至899、643至902、648至907、652至910、636至895和625至884。需要注意的是,人、小鼠、大鼠、狗、黑猩猩、猕猴和狐猴雄激素受体的上述片段具有相同的氨基酸序列。其他物种的雄激素受体的配体结合结构域也是已知的或可以通过序列比对容易地鉴定。如将易于由本领域普通技术人员所认识到的,编码雄激素受体包括来自上述物种之一以及其他动物的全长受体的配体结合结构域或更大片段的任何dna序列都是适于本发明的。
[0088]
另外,雄激素受体的配体结合结构域的片段,诸如可以结合hla
‑
a2的那些,也是引发针对表达雄激素受体或其配体结合结构域的细胞的细胞毒性响应的有用抗原。编码这些片段的多核苷酸被认为是功能等效物。这些片段的实例在下文的实例中提供。特定来说,考虑使用以下四个片段:seq id no:11(seq id no:6的氨基酸811
‑
819)、seq id no:12(seq id no:6的氨基酸761
‑
770)、seq id no:13(seq id no:6的氨基酸805
‑
813)和seq id no:14(seq id no:6的氨基酸859
‑
867)。
[0089]
dna疫苗
[0090]
本发明提供了表达多肽抗原、哺乳动物雄激素受体的配体结合结构域或其某些片段和/或pap抗原的基于dna的疫苗,以及用于使用疫苗治疗人或非人动物中的前列腺癌的方法。在一些实施方案中,疫苗是质粒疫苗。质粒dna疫苗的优点是它们编码确定的、通常很少量的蛋白质。因此,可以重复地免疫动物或患者。此外,病毒可能会杀死细胞、整合至基因组中,或潜在地诱导其他不需要的免疫应答。所有这些都是dna质粒疫苗可能避免的缺点。
[0091]
在一些实施方案中,dna疫苗技术(例如,与组合物、方法等有关的)是如美国专利申请公开no.20040142890a1中所描述的,所述专利以引用的方式整体明确并入本文。
[0092]
如同基于肽的疫苗一样,dna疫苗在相对容易和廉价制造方面是有利的,并且不关于患者加以个体化,基于树突细胞的疫苗也是如此。不同于其中抗原由抗原递呈细胞摄取,并且主要在ii类mhc的情形下表达的重组蛋白疫苗,核酸疫苗中的dna直接由抗原递呈细胞摄取和表达,从而导致通过天然加工的i类mhc表位与ii类mhc表位两者来进行抗原递呈[38]。
[0093]
在一些实施方案中,pap多肽的衍生物、等效物、变体、片段或突变体在序列方面与人pap序列seq id no:1或ar序列seq id no:6至少85%同一。更优选地,同一性是至少88%,优选是至少90%,还更优选是至少95%,并且还更优选是至少95%。氨基酸序列之间或核苷酸序列之间的同一性可由本领域技术人员手动确定,或通过使用采用算法的基于计算机的序列比较和鉴定工具诸如blast(基本局部比对搜索工具;altschul et al.(1993)j.mol.biol.215:403
‑
410)来确定。
[0094]
在一些实施方案中,构建全长基因的编码全长pap或ar蛋白的部分的片段。这些片段肽引发针对蛋白质抗原的体液反应或细胞毒性反应或两者,并且被视为功能等效物。
[0095]
本技术提供了表达蛋白质抗原、前列腺酸性磷酸酶(pap)和/或ar抗原的基于dna的疫苗。在一些实施方案中,在相同核酸上提供pap和ar抗原。在一些实施方案中,pap和ar抗原以两种核酸提供。在一些实施方案中,pap和ar抗原在同一组合物中以两种核酸提供。在一些实施方案中,pap和ar抗原在分开的组合物中以两种核酸提供。
[0096]
在一些实施方案中,使pap和/或ar基因连接于已针对多核苷酸疫苗接种加以特定优化的表达载体。如本领域技术人员所熟知,适合表达载体的特征包括例如转录启动子、免
疫原性表位、免疫刺激性序列以及伴有它们自身的启动子的编码免疫增强性或免疫调节性基因的额外顺反子、转录终止子、细菌复制起点和抗生素抗性基因。任选地,在一些实施方案中,载体包含用于表达多顺反子mrna的内部核糖体进入位点(ires)。
[0097]
在本技术的一些实施方案中,使编码pap和/或ar蛋白的基因直接连接于转录启动子。在一些实施方案中,组织特异性启动子或增强子(例如肌肉肌酸激酶(mck)增强子元件)适用于将多核苷酸的表达限于特定组织类型。举例来说,肌细胞是不进行分裂的终末分化细胞。外来dna整合至染色体中似乎由细胞分裂与蛋白质合成两者促进。因此,将蛋白质表达限于非分裂细胞诸如肌细胞可为优选的。此外,在一些实施方案中,psa启动子用于将蛋白质的表达限于前列腺组织。在一些实施方案中,组织特异性或细胞特异性启动子用于使蛋白质的表达靶向抗原递呈细胞。举例来说,在一些实施方案中,α
‑
胎蛋白(afp)启动子(参见例如peyton et al.2000,proc.natl.acad.sci.,usa.97:10890
‑
10894)用于将表达限于肝组织。然而,使用cmv启动子足以实现在向其中引入质粒dna疫苗的许多组织中表达。
[0098]
在各种实施方案中,适合载体包括编码操作性地连接于真核启动子的pap和/或ar抗原或其功能性等效物或衍生物的任何质粒dna构建体。此类载体的实例包括可从stratagene(la jolla,calif.)商购获得的pcmv系列表达载体;或由invitrogen corporation(carlsbad,calif.)销售的pcdna或prep系列表达载体。
[0099]
存在本领域技术人员可从说明书了解的许多本发明实施方案。因此,在各种实施方案中,使用不同转录启动子、终止子和其他转录调控元件。其他真核转录启动子的实例包括劳斯肉瘤病毒(rous sarcoma virus,rsv)启动子、猿猴病毒40(sv40)启动子、人延伸因子
‑
1α(ef
‑
1α)启动子和人泛素c(ubc)启动子。
[0100]
在一些实施方案中,表达转基因的“裸”质粒dna是适用的,例如在一些实施方案中,裸质粒dna被直接真皮内或肌肉内注射、摄取并且表达(参见例如wolff et al.,1990,science 247:1465
‑
8)。这种途径的效率可为低下的,其中仅小百分比的肌细胞在体内被直接转化,并且仅在由这种定向递送靶向的肌肉组织的有限区域内。产生更高效率基因递送方法的各种替代途径是已知的(参见例如acsadi et al.,1991,new biol.3:71
‑
81;wolff et.al.,1991,biotechniques 11:474
‑
85;budker et.al.,1996,nat.biotechnol.14:760
‑
4;davis et al.,1993,hum.gene ther.4:151
‑
9;danko et al.,1994,gene ther.1:114
‑
21;manthorpe et al.,1993,hum.gene ther.4:419
‑
31)。
[0101]
在一些实施方案中,dna疫苗是ptvg
‑
hp(例如,包含人pap的cdna的ptvg4载体)。ptvg
‑
hp是在大肠杆菌(e.coli)中产生的质粒dna,其编码人前列腺酸性磷酸酶(pap)的cdna。特定来说,ptvg
‑
hp质粒由质粒载体pngvl3(例如如从在密歇根大学(university of michigan)的国立基因载体实验室(national gene vector laboratory)获得)构建。类似于pcdna3.1表达载体,这个载体由cmv启动子驱动转录,但也包括cmv内含子a序列以使蛋白质表达增强(lee et al.,1997,mol.cells 7:495
‑
501)。该载体也含有多克隆位点,并且不表达真核抗生素抗性基因,以致预期的在真核系统中进行的仅蛋白质表达是由cmv启动子驱动的表达,这不同于pcdna载体。已向这个载体中添加2个拷贝的36bp免疫刺激性(iss)片段,其含有先前(hartmann et al.,2000,j.immunol.164:1617
‑
24)鉴定的5'
‑
gtcgtt
‑
3'基序(例如,多核苷酸在5'末端包含tpc二核苷酸,继之以三个由tpt二核苷酸分隔的6聚体cpg基序(5'
‑
gtcgtt
‑
3')),以创建载体ptvg4。将人pap的编码序列克隆至这个载体中,并且通
过体外表达研究确认pap的表达。这个构建体命名为ptvg
‑
hp。因此,在一些实施方案中,dna疫苗包含cpg免疫刺激性序列。在一些实施方案中,免疫刺激性序列是tcg tcg ttt tgt cgt ttt gtc gtt(seq id no:4)。
[0102]
在一些实施方案中,疫苗包括gm
‑
csf。gm
‑
csf(沙格司亭(sargramostim))是一种疫苗佐剂。特定来说,gm
‑
csf是支持包括树突抗原递呈细胞的造血祖细胞的存活、克隆扩增和分化的生长因子。已显示gm
‑
csf是安全的,并且充当有效诱导针对免疫抗原的抗体和t细胞应答的佐剂[58,59]。使用gm
‑
csf伴有少许毒性[60,61,62]。gm
‑
csf是于250μg剂量小瓶中供应的无菌白色无防腐剂冻干粉末。重组人gm
‑
csf(rhgm
‑
csf)在静脉内或皮下施用时通常在50至500μg/m2/天的范围内的剂量下得以良好耐受。
[0103]
在本技术的特定实施方案中,使小瓶解冻,并且质粒dna疫苗用于使gm
‑
csf复原。举例来说,对于各次dna免疫,取出0.6ml的0.2mg/ml ptvg
‑
hp,并且用于使250μg gm
‑
csf复原。接着将0.25ml抽取至两个结核菌素注射器中的每一个中。这有效提供了100μg剂量的dna和208μggm
‑
csf。
[0104]
ii.pd
‑
1阻断剂
[0105]
肿瘤避免免疫检测所采用的主要机理是通过表达t细胞受体pd
‑
1的配体pd
‑
l1或pd
‑
l2。由pd
‑
l1或pd
‑
l2对pd
‑
1的活化使t细胞功能降低,并且使免疫耐受性增加。鉴于在临床试验中用pd/pd
‑
l(例如pd
‑
1和/或pd
‑
l1)抑制剂观察到的不利事件相对微少以及在早期临床试验中在一些情况下观察到长期疾病响应,当前对开发这些药剂存在极大热情。特定来说,靶向pd
‑
1应是一种通用疗法,因为它靶向t细胞区室,而非直接靶向肿瘤。然而,迄今为止,临床试验经验表明相比于具有其他组织结构(包括前列腺癌)的患者,具有一些实体肿瘤类型(特别是肾细胞癌、黑素瘤和非小细胞肺癌)的患者经历更大益处[18,19]。响应患者和非响应患者的t细胞差异可能是这个不一致的基础。特定来说,相比于前列腺癌,通常在患有肾细胞癌和黑素瘤的患者中观察到更高频率的肿瘤浸润性淋巴细胞(til)。另外,使用pd
‑
1或pd
‑
l1的早期临床试验已鉴定出根据活检体,pd
‑
1的至少一种配体(pd
‑
l1)在靶标肿瘤细胞上的表达与对疗法的临床响应相关联[18]。鉴于组织浸润性t细胞可以经由表达ifnγ来诱导pd
‑
l1表达,并且pd
‑
1与配体结合会导致t细胞效应物功能降低,这是所预期的。已证明前列腺癌可以表达pd
‑
l1,并且可以具有浸润性pd
‑
1表达性t细胞[20]。总之,这些结果指示通过使能够诸如通过疫苗接种来增加肿瘤特异性t细胞的数目的药剂组合,以及通过pd阻断剂和/或通过pd
‑
l阻断剂(例如pd
‑
1和/或pd
‑
l1阻断剂),例如通过pd抑制剂和/或通过pd
‑
l抑制剂(例如pd
‑
1抑制剂(例如抗pd
‑
1抗体)和/或pd
‑
l1抑制剂(例如抗pd
‑
l1抗体)),抗肿瘤免疫疗法对前列腺癌的功效将增加。
[0106]
鉴于在用靶向pd
‑
1或pd
‑
l1的抗体进行的早期临床试验中观察到的抗肿瘤应答,若干药物公司已正在开发相关药剂。当前,一种药剂已被核准作为疗法,即派姆单抗(keytruda,merck)。具体来说,基于在用易普利单抗(ipilimumab)治疗之后其疾病已进展的晚期(转移性)黑素瘤患者的i期试验的开放标签国际多中心扩展群组,派姆单抗在2014年9月被核准作为“突破”疗法用于治疗易普利单抗难治性晚期黑素瘤。在那个试验中,173名患者在3周间隔下以两种剂量(2mg/kg或10mg/kg)中的一种接受派姆单抗,直至疾病进展或出现不可耐受毒性。不管剂量如何,观察到26%的总体响应率。3级疲劳是超过1名患者中所报告的唯一药物相关3级或4级不利事件。鉴于这些研究结果,派姆单抗当前被fda核准用
于治疗患有易普利单抗难治性黑素瘤的患者,每3周在2mg/kg下静脉内给药,直至疾病进展或出现不可耐受不利作用。然而,值得注意的是,较早期临床试验已表明即使在中断治疗之后,治疗也可导致延长的响应。
[0107]
在一些实施方案中,pd
‑
1路径抑制剂是单克隆抗体。在一些实施方案中,单克隆抗体是派姆单抗(在商品名下销售)。派姆单抗是人程序化死亡受体
‑
1(pd
‑
1)阻断抗体,被指示用于治疗患有不可切除或转移性黑素瘤,以及在易普利单抗和braf抑制剂(如果呈braf v600突变阳性)之后疾病进展的患者。派姆单抗可以由100mg注射用冻干粉末组成的单次使用小瓶形式获得,并且优选在每三周200mg固定剂量下施用。它通过将4.0ml无菌注射用水(usp)添加至小瓶中以制备25mg/ml溶液来制备。在一些实施方案中,将两个小瓶的内容物转移至包含0.9%氯化钠注射液(usp)的iv袋中,使得稀释溶液的最终浓度在1mg/ml与10mg/ml之间。因此,在一些实施方案中,使用包含无菌无热原低蛋白质结合性0.2μm至5μm管线内过滤器或附加过滤器的iv管线,将它以静脉内输液形式例如历经30分钟施用。
[0108]
在一些实施方案中,单克隆抗体是尼鲁单抗(在商品名下销售)。尼鲁单抗是人igg4抗pd
‑
1单克隆抗体,其通过阻断配体对活化的t细胞上的程序化细胞死亡1(pd
‑
1)受体的活化来充当免疫调节剂。特定来说,尼鲁单抗通过阻断t细胞活化和应答的负性调控子,由此允许免疫系统攻击肿瘤来起作用。也就是说,尼鲁单抗阻断pd
‑
l1结合pd
‑
1,从而允许t细胞在肿瘤攻击方面起作用。
[0109]
本发明还预期在本发明的方法和试剂盒中使用其他pd
‑
1拮抗剂,包括但不限于:bms
‑
936559(bristol
‑
myers squibb);medi0680(medimmune/astrazeneca);medi4736(medimmune/astrazeneca);mpdl3280a(genentech/roche)、msb0010718c(emd serono);和匹迪珠单抗(pidilizumab)(curetech)。
[0110]
iii.雄激素剥夺疗法
[0111]
在一些实施方案中,前列腺癌疗法包括雄激素剥夺疗法(adt)。睾酮的合成是由从大脑开始的一系列过程介导的。当身体检测到低水平的睾酮时,下丘脑开始产生lhrh,其是一种一旦被脑垂体接收就会激活lh(黄体化激素)的合成的激素。lh进入睾丸,在那里诱导睾酮的形成。基于药物的雄激素剥夺疗法有两种方法。一种作用是阻止脑垂体释放lh,并且另一种是阻断身体使用雄激素的能力。
[0112]
存在两种不同的药物,lhrh激动剂和拮抗剂,它们两者都可以降低由睾丸制造的睾酮的量。它们的作用是抑制脑垂体中lh的形成。lhrh激动剂会引起睾酮水平突然增加,随后急剧下降,该过程称为爆发(flare),而lhrh拮抗剂直接降低睾酮的量。lhrh激动剂和拮抗剂活性物质的实例包括但不限于亮丙瑞林(leuprolide)、戈舍瑞林(goserelin)、曲普瑞林(triptorelin)、组氨瑞林(histrelin)和地加瑞克(degarelix)。在一些实施方案中,这些药物被注射到皮下,获得与手术去势相同的结果。
[0113]
在一些实施方案中,利用抗雄激素疗法(例如,雄激素受体拮抗剂)。肾上腺被发现是产生雄激素的另一个中心,即使是在去势过程之后。因此,开发了使用抗雄激素物质来阻断身体使用任何雄激素的能力的补充治疗。前列腺细胞包含雄激素受体(ar),当它受到雄激素如睾酮的刺激时,会促进生长并维持前列腺分化。然而,当这些促生长信号出现在癌细胞中时可能会导致问题。抗雄激素物质可以进入细胞并阻止睾酮结合于受体蛋白质,因为
它们对雄激素受体的亲和力更高。
[0114]
雄激素受体拮抗剂的实例包括但不限于醋酸环丙孕酮(cyproterone acetate)、氟他胺(flutamide)、尼鲁米特(nilutamide)、比卡鲁胺(bicalutamide)和恩杂鲁胺和阿帕鲁胺,它们都以口服丸剂的形式施用。额外的雄激素受体拮抗剂包括但不限于靶向睾酮合成的药剂(例如醋酸阿比特龙(abiraterone acetate)和seviteronel)或靶向ar核移位的药剂(例如恩杂鲁胺、阿帕鲁胺和达洛鲁胺(darolutamide)),以及组合的疗法(例如galeterone)。
[0115]
在一些实施方案中,雄激素受体拮抗剂是恩杂鲁胺或阿帕鲁胺。
[0116]
iv.治疗方法
[0117]
如上所述,本文提供了用于前列腺癌治疗的组合疗法。在一些实施方案中,疗法包括与pd
‑
1阻断剂和雄激素受体拮抗剂组合的一种或多种dna疫苗(例如,靶向pap和/或ar的dna疫苗)。
[0118]
在一些实施方案中,dna疫苗(例如靶向pap和/或ar的dna疫苗)与本文讨论的pd路径抑制剂和ar拮抗剂并行施用(参见,例如本文详细描述的给药时程)。在一些实施方案中,在用pd路径抑制剂治疗之前、并行或之后施用dna疫苗(例如,靶向pap和/或ar的dna疫苗)(参见,例如本文详细描述的给药时程)。
[0119]
在一些实施方案中,并行施用dna疫苗和pd
‑
1路径抑制剂持续1、2、3、4、5、6、7、8、9、10、11、12或更多周,随后是并行施用dna疫苗、pd
‑
1路径抑制剂和ar拮抗剂持续1、2、3、4、5、6、7、8、9、10、11、12或更多周的时期,随后是不施用dna疫苗、pd
‑
1路径抑制剂和ar拮抗剂(例如,1、4、6、8、10、12、14、16、18、24或更多周)的时期。
[0120]
在一些实施方案中,将ar拮抗剂以多周的间隔与dna疫苗和pd
‑
1路径抑制剂并行施用(例如,每日一次或多次,持续1、2、3、4、5、6、7、8、9、10、11、12或更多周),随后是不施用ar拮抗剂的时期(例如,1、4、6、10、12、16、18、24或更多周)。在一些实施方案中,在用dna疫苗和pd
‑
1路径抑制剂的长期治疗期间施用ar拮抗剂治疗时期。
[0121]
因此,本技术的一些实施方案涉及在癌症患者(例如患有非转移性、激素敏感性、生化复发性(psa
‑
复发性)前列腺癌的患者或者患有转移性、去势抵抗性前列腺癌的患者)中施用派姆单抗或尼鲁单抗与dna疫苗和ar拮抗剂的组合(例如,并行地或依序地)。
[0122]
在一些实施方案中,在施用dna疫苗之前和/或之后测试患者对组合疗法的响应。在一些实施方案中,在施用pd路径抑制剂(例如派姆单抗或尼鲁单抗)之前和/或之后测试患者。在一些实施方案中,测试包括例如成像方法(例如放射摄影方法、骨成像),测量抗肿瘤响应率(客观响应率和/或psa响应率,使用pcwg2准则),测量pap特异性t细胞应答或ar特异性t细胞应答的量值,测量循环t细胞上的pd
‑
1表达,测量循环上皮细胞(cec)上和/或肿瘤活检体上的pd
‑
l1表达,测量肿瘤生长速率,测量pap特异性抗体的量,测量前列腺相关抗原(例如psa和/或pap)的量。
[0123]
在一些实施方案中,监测生物标志物例如以追踪治疗过程和/或作为治疗功效的预测物。示例性生物标志物包括cec或肿瘤活检体上的pd
‑
l1表达,肿瘤特异性t细胞(例如tim3、btla和lag3)或肿瘤细胞(例如hvem、磷脂酰丝氨酸、pd
‑
l2),以及经pd
‑
1调控的抗原特异性t细胞(例如通过转移性体内dth测试鉴定的)上的其他调控分子的表达。
[0124]
通常预期dna疫苗、ar拮抗剂和pd
‑
1抑制剂被配制用于向哺乳动物施用,并且尤其
向患有对施用这类化合物有响应的病状的人(例如患有前列腺癌的人受试者)施用。因此,当预期的化合物以药理学组合物形式施用时,预期将预期的化合物与药学上可接受的载体一起掺混加以配制。举例来说,预期的化合物可以以药学上可接受的盐形式口服施用,或以生理盐水溶液(例如缓冲至约7.2至7.5的ph)形式静脉内施用。常规缓冲剂诸如磷酸盐、碳酸氢盐或柠檬酸盐可用于此目的。当然,本领域普通技术人员可在说明书的教义内改进制剂以提供用于特定施用途径的众多制剂。特定来说,可改进预期化合物以致使它们更可溶于水或其他媒介物中,此例如可易于以完全属于本领域普通技术的微小改变(盐配制、酯化等)来实现。也完全属于本领域普通技术的是改变特定化合物的施用途径和剂量方案来管理本化合物的药物动力学以在患者中达成最大有益作用。
[0125]
在某些药物剂型的情况下,可出于各种目的形成预期的化合物的前药形式,所述目的包括降低毒性,增加器官或靶标细胞特异性等。在各种前药形式之中,本化合物的酰化(乙酰化或其他)衍生物、吡啶酯和各种盐形式是优选的。本领域普通技术人员将认识到如何容易地使本化合物改性成前药形式以有助于将活性化合物递送至宿主生物体或患者内的靶标部位。当适用时,本领域普通技术人员也将在将本发明化合物递送至宿主生物体或患者内的所靶向部位时利用前药形式的有利药物动力学参数以使化合物的预定作用最大化。类似地,应了解预期的化合物也可被代谢成它们的生物活性形式,并且因此特定预期本文化合物的所有代谢物。另外,预期的化合物(及其组合)可与其他药剂组合施用。
[0126]
关于向受试者施用,预期化合物以药学上有效量施用。本领域普通技术人员认识到药学上有效量视所用治疗剂,受试者的年龄、状况和性别,以及受试者的疾病程度而变化。通常,剂量不应大到导致不利副作用,诸如血液问题、肺问题、结肠炎、肝炎、肾炎、下垂体炎、甲状腺功能受损等。剂量也可以由个别医师调整以实现所需治疗目标。因此,预期在患有低肿瘤负荷疾病的男性(例如,患有非转移性或微转移性激素敏感性、生物化学复发性前列腺癌的男性)中,可向他们给药1/2或1/3或1/4的标准剂量的pd
‑
1抑制剂,既能引发有效的抗肿瘤应答,并且又能降低通常归因于以标准剂量下用于晚期或转移性癌症的pd
‑
1抑制剂的毒性和副作用。
[0127]
如本文所用,由术语“药学上有效量”涵盖的实际量将取决于施用途径、所治疗受试者的类型、以及所考虑的特定受试者的身体特征。用以确定这个量的这些因素和它们的关系为医学领域、兽医学领域和其他相关领域中的熟练从业者所熟知。可以调适这个量和施用方法以使功效最大化,但将取决于诸如重量、膳食、并行药物的因素和本领域技术人员将认识到的其他因素。
[0128]
药物组合物优选包括本技术的与一种或多种药学上可接受的载体、稀释剂或赋形剂联合的一种或多种化合物。药学上可接受的载体在本领域中是已知的,诸如于例如出于所有目的以引用的方式明确并入本文的remingtons pharmaceutical sciences,mack publishing co.(a.r.gennaro编1985)中所述的那些。
[0129]
因此,在一些实施方案中,将免疫治疗剂配制成片剂、胶囊、定时释放片剂、定时释放胶囊;定时释放丸粒;缓慢释放片剂、缓慢释放胶囊;缓慢释放丸粒;快速释放片剂、快速释放胶囊;快速释放丸粒;舌下片剂;胶凝胶囊;微胶囊;经皮递送制剂;经皮凝胶剂;经皮贴片;经皮可溶解微针制剂(例如提供于贴片中);无菌溶液;制备来用作肌肉内、真皮内或皮下注射液,用作向所靶向部位中的直接注射液,或用于静脉内施用的无菌溶液;制备来用于
经直肠施用的溶液;制备来用于通过胃喂食管或十二指肠喂食管施用的溶液;用于经直肠施用的栓剂;制备成溶液或酏剂的用于口服消耗的液体;局部乳膏剂;凝胶剂;洗剂;酊剂;糖浆;乳液;或混悬液。
[0130]
在一些实施方案中,定时释放制剂是持续释放、持续作用、延长释放、控制释放、改进释放或连续释放机制,例如配制组合物以快速、缓慢或在化合物的任何适当释放速率下随时间而溶解。
[0131]
在一些实施方案中,配制组合物以使活性成分包埋在不溶性物质(例如各种丙烯酸系物、几丁质)的基质中,使得溶解中的化合物例如通过扩散来穿过基质中的孔找到它的出路。在一些实施方案中,将制剂封闭于在一侧具有激光钻孔,并且在另一侧具有多孔膜的基于聚合物的小片中。胃酸穿过多孔膜,由此将药物穿过激光钻孔而推出。按时地,整个药物剂量释放至系统中,而聚合物容器保持完整,以通过正常消化来稍后排泄。在一些持续释放制剂的情况下,化合物溶解至基质中,并且基质物理溶胀以形成凝胶,从而允许化合物穿过凝胶的外表面排出。在一些实施方案中,制剂呈微囊封形式,例如其在一些实施方案中用于产生复杂溶解概况。举例来说,通过围绕惰性核心涂覆化合物以及用不溶性物质对它层化以形成微球体,一些实施方案以适宜形式提供更一致和可重现溶解速率,所述适宜形式在特定实施方案中与其他控制(例如瞬时)释放药物成分组合,例如以提供多部分凝胶胶囊。
[0132]
在一些实施方案中,技术的药物制剂和/或配制剂以粒子形式提供。如本文所用的“粒子”意指可完全或部分由如本文所述的化合物组成的纳米粒子或微粒(或在一些情况下是更大粒子)。粒子可在由包括但不限于肠溶性包衣的包衣围绕的核心中包含制剂和/或配制剂。制剂和/或配制剂也可分散在整个粒子中。制剂和/或配制剂也可吸附至粒子中。粒子可具有任何级释放动力学,包括零级释放、一级释放、二级释放、延迟释放、持续释放、立即释放及其任何组合等。除制剂和/或配制剂之外,粒子也可包括常规用于制药和医学领域中的那些物质中的任一者,包括但不限于可蚀解、非可蚀解、生物可降解或非生物可降解物质或其组合。粒子可为包含呈溶液形式或处于半固体状态的制剂的微胶囊。粒子可具有实际上任何形状。
[0133]
非生物可降解聚合物质与生物可降解聚合物质两者均可以用于制造用于递送制剂和/或配制剂的粒子。所述聚合物可为天然或合成聚合物。基于释放需要历经的时期选择聚合物。特别关注的生物粘附性聚合物包括由h.s.sawhney,c.p.pathak和j.a.hubell在macromolecules,(1993)26:581
‑
587中描述的生物可蚀解水凝胶,所述文献的教义以引用的方式并入本文。这些包括聚透明质酸、酪蛋白、明胶、明胶蛋白、聚酐、聚丙烯酸、海藻酸盐、壳聚糖、聚(甲基丙烯酸甲酯)、聚(甲基丙烯酸乙酯)、聚(甲基丙烯酸丁酯)、聚(甲基丙烯酸异丁酯)、聚(甲基丙烯酸己酯)、聚(甲基丙烯酸异癸酯)、聚(甲基丙烯酸月桂酯)、聚(甲基丙烯酸苯酯)、聚(丙烯酸甲酯)、聚(丙烯酸异丙酯)、聚(丙烯酸酸异丁酯)和聚(丙烯酸十八基酯)。
[0134]
本技术也提供用于制备包含化合物或其盐的水溶液的稳定药物制剂以抑制降解产物形成的方法。提供包含化合物或其盐以及至少一种抑制剂的溶液。在将溶液终末装填在可密封容器中以形成稳定药物制剂之前和/或之后根据至少一种灭菌技术来处理溶液。本制剂可通过本领域中已知的各种方法制备,只要制剂是大致上均质的即可,例如药物大
致上均一分布在制剂内。所述均一分布有助于控制药物从制剂的释放。
[0135]
在一些实施方案中,将化合物与缓冲剂一起配制。缓冲剂可为任何药学上可接受的缓冲剂。缓冲体系包括柠檬酸盐缓冲剂、乙酸盐缓冲剂、硼酸盐缓冲剂和磷酸盐缓冲剂。缓冲剂的实例包括柠檬酸、柠檬酸钠、乙酸钠、乙酸、磷酸钠和磷酸、抗坏血酸钠、酒石酸、顺丁烯二酸、甘氨酸、乳酸钠、乳酸、抗坏血酸、咪唑、碳酸氢钠和碳酸、丁二酸钠和丁二酸、组氨酸、以及苯甲酸钠和苯甲酸。
[0136]
在一些实施方案中,将化合物与螯合剂一起配制。螯合剂可为任何药学上可接受的螯合剂。螯合剂包括乙二胺四乙酸(ethylenediaminetetraacetic acid)(也与edta、依地酸(edetic acid)、乙二胺四乙酸(versene acid)和乙二胺四乙酸(sequestrene)同义)和edta衍生物,诸如依地酸二钾、依地酸二钠、依地酸二钠钙、依地酸钠、依地酸三钠和依地酸钾。其他螯合剂包括柠檬酸及其衍生物。柠檬酸也称为柠檬酸单水化物。柠檬酸的衍生物包括无水柠檬酸和柠檬酸三钠二水合物。其他螯合剂包括烟酰胺及其衍生物以及脱氧胆酸钠及其衍生物。
[0137]
在一些实施方案中,将化合物与抗氧化剂一起配制。抗氧化剂可为任何药学上可接受的抗氧化剂。抗氧化剂为本领域普通技术人员所熟知,并且包括诸如以下的物质:抗坏血酸、抗坏血酸衍生物(例如,棕榈酸抗坏血酸酯、硬脂酸抗坏血酸酯、抗坏血酸钠、抗坏血酸钙等)、丁基化羟基茴香醚、丁基化羟基甲苯、没食子酸烷基酯、偏硫酸氢钠、硫酸氢钠、连二亚硫酸钠、巯基乙酸钠、甲醛次硫酸钠、生育酚及其衍生物(d
‑
α生育酚、乙酸d
‑
α生育酚、乙酸dl
‑
α生育酚、丁二酸d
‑
α生育酚、β生育酚、δ生育酚、γ生育酚和聚氧乙二醇1000丁二酸d
‑
α生育酚)、单硫代甘油和亚硫酸钠。所述物质通常在0.01至2.0%的范围内添加。
[0138]
在一些实施方案中,将化合物与低温保护剂一起配制。低温保护剂可为任何药学上可接受的低温保护剂。常见低温保护剂包括组氨酸、聚乙二醇、聚乙烯吡咯烷、乳糖、蔗糖、甘露糖醇和多元醇。
[0139]
在一些实施方案中,将化合物与等张剂一起配制。等张剂可以为任何药学上可接受的等张剂。此术语在本领域中可与等渗剂互换使用,并且作为添加至药物制剂中以增加渗透压的化合物而知晓,例如在一些实施方案中,向药物制剂中添加0.9%氯化钠溶液,其与人细胞外液诸如血浆等渗。优选的等张剂是氯化钠、甘露糖醇、山梨糖醇、乳糖、右旋糖和甘油。
[0140]
药物制剂可任选包括防腐剂。常见防腐剂包括选自由氯丁醇、对羟基苯甲酸酯、硫柳汞、苯甲醇和苯酚组成的组的那些。适合防腐剂包括但不限于:氯丁醇(0.3
–
0.9%w/v)、对羟基苯甲酸酯(0.01
–
5.0%)、硫柳汞(0.004
–
0.2%)、苯甲醇(0.5
–
5%)、苯酚(0.1
–
1.0%)等。
[0141]
在一些实施方案中,将化合物与保湿剂一起配制以在口服施加中提供合意口感。本领域中已知的保湿剂包括胆固醇、脂肪酸、甘油、月桂酸、硬脂酸镁、季戊四醇和丙二醇。
[0142]
在一些实施方案中,在制剂中包括乳化剂例如以确保所有赋形剂尤其是疏水性组分诸如苯甲醇都完全溶解。许多乳化剂在本领域中是已知的,例如聚山梨醇酯60。
[0143]
对于与口服施用相关的一些实施方案,可合乎需要的是添加药学上可接受的调味剂和/或甜味剂。诸如糖精、甘油、单糖浆和山梨糖醇的化合物适用作甜味剂。
[0144]
测量方法和测定
[0145]
在各种实施方案中,使用各种技术和可观察项收集数据,例如以测量受试者的基线和/或监测治疗的功效。举例来说,一些实施方案包括基于成像来评估受试者。在一些特定实施方案中,成像技术包括计算机断层摄影术(ct)。在一些特定实施方案中,成像技术包括磁共振成像(mri)。在一些实施方案中,ct和/或mri提供用于测量靶标病变的准确和可再现方法。在一些实施方案中,以在切片厚度方面是10mm或更小的连续切割进行ct和mri。在一些实施方案中,例如对于胸部、腹部和骨盆肿瘤,使用5mm连续重建算法进行螺旋ct。
[0146]
在一些实施方案中,测量肿瘤标志物。举例来说,在一些实施方案中,测量psa。在一些实施方案中,收集psa值以单独报告psa动力学。在一些实施方案中,受试者的下降至<0.2ng/ml的psa值指示完全psa响应。在一些实施方案中,测量血清pap和/或ar。在一些实施方案中,血清pap和/或psa浓度在疫苗接种之后稳定和/或在疫苗接种之后下降,并且提供对疫苗功效的量度。在一些实施方案中,计算血清psa与血清pap或ar的比率,并且提供疫苗功效的量度。在不受理论束缚下以及在了解对机理或理论的了解不为实施本技术所需下,在一些实施方案中,psa:pap比率随疗法而增加,因为相对于psa产生性细胞,疗法选择性消减pap产生性细胞,由此导致pap浓度比psa浓度更快下降。
[0147]
在一些实施方案中,对受试者进行临床检查。在一些实施方案中,当临床检测的病变是浅表性的(例如皮肤结节和可触知淋巴结)时,它被视为可测量。在一些实施方案中,通过彩色摄影术(包括用以估计病变尺寸的尺子)对皮肤病变进行文件记载。
[0148]
组织病理学评估
[0149]
在一些实施方案中,在治疗之前以及在治疗之后(例如在启动治疗之后1至20周,例如在第1、2、3、4、5、6、7、8、9、10、11、12、13、14、14、16、17、18、19、20、21、22、23或24周期间)从转移性病变(例如每名患者的同一病变)获得组织活检体。在一些实施方案中,进行测试以评估免疫如何影响肿瘤中的pd
‑
l1表达。在不受理论束缚以及了解对机理的理解不为实施本技术所需下,预期免疫通过引发分泌ifnγ的肿瘤抗原特异性t细胞来影响肿瘤中的pd
‑
l1表达。此外,进行测试以评估与抗pd
‑
1mab的并行治疗是否导致cd8 t细胞的浸润增加,以及治疗是否使t细胞上的其他t细胞调控配体(pd
‑
1、ctla
‑
4、tim
‑
3、btla、lag
‑
3)或肿瘤上的其他t细胞调控配体(例如hvem、磷脂酰丝氨酸、pd
‑
l2)的表达增加。因此,将治疗前以及在启动治疗之后获得的活检体试样用对cd3、cd4、cd8、foxp3、pd
‑
1、ctla
‑
4、tim3、btla、lag
‑
3、pd
‑
l1、pd
‑
l2、磷脂酰丝氨酸和/或hvem和/或其他标志物具有特异性的抗体染色。由对治疗组不知情的病理学家审查染色和定量以确定每个视野的cd8 t细胞、cd4 foxp3 (treg):cd8 t细胞比率、pd
‑
l1表达(例如,如由每个视野至少5个pd
‑
l1阳性细胞所指示),以及比较在治疗之前和之后测量的这些参数以鉴定由于治疗而变化的这些测量或计算参数中的任一者。
[0150]
循环肿瘤细胞(ctc)评估
[0151]
在一些实施方案中,对ctc计数和表征,例如在一些实施方案中,使用流式细胞计量术,在与免疫评估相同的时间点(例如治疗前,在1至6周之后(例如在1、2、3、4、5或6周之后),以及在各种间隔下持续直至1年(例如每月、每季度)。举例来说,在一些实施方案中,将在这些时间点获得的pbmc例如用对cd45、epcam、pd
‑
1、pd
‑
l1、ctla
‑
4和dapi中的至少一者或多者具有特异性的经荧光染料标记的抗体染色。ctc定义为cd45
‑
epcam dapi
–
细胞,并且测定在不同时间点下这些事件在所有活体细胞事件之中的百分比。也测定表达pd
‑
1、pd
‑
l1、ar或ctla
‑
4的ctc的百分比。报道来自不同时间点的结果,并且评估大体趋势。在一些实施方案中,结果是定量的,并且在一些实施方案中,结果是定性的(例如在一些实施方案中,获得多个重复结果以确定标准偏差是不可行的)。技术涵盖ctc捕集和计数的其他方法。
[0152]
受试者
[0153]
在一些实施方案中,向受试者施用组合疗法。举例来说,在一些实施方案中,受试者是癌症患者,例如前列腺癌患者,例如患有非转移性、激素敏感性、生化复发性前列腺癌的患者或者患有转移性、去势抵抗性前列腺癌的患者。在一些实施方案中,受试者是成人(例如年龄是18岁或更大)。在一些实施方案中,受试者患有已通过组织学确认的前列腺癌。在一些实施方案中,受试者患有转移性疾病,例如存在软组织和/或骨转移(例如如通过成像(ct(例如腹部/骨盆的ct)、骨闪烁照相术等)所检测)。在一些实施方案中,受试者患有去势抵抗性疾病,例如在一些实施方案中,受试者已接受雄激素剥夺治疗(例如手术去势、gnrh类似物或拮抗剂治疗)。在一些实施方案中,受试者在用本文所述的组合疗法(例如dna疫苗、ar拮抗剂和pd
‑
1抑制剂)治疗期间接受gnrh类似物或拮抗剂。在一些实施方案中,受试者先前已用非类固醇抗雄激素剂治疗;在一些实施方案中,受试者先前尚未用非类固醇抗雄激素剂治疗。在其中受试者先前已用抗雄激素剂治疗的一些实施方案中,受试者在用本文所述的组合疗法治疗之前已中断使用抗雄激素剂至少4周(对于氟他胺(flutamide))或6周(对于比卡鲁胺(bicalutamide)或尼鲁米特(nilutamide))。此外,在一些实施方案中,监测受试者中的psa,例如对于显示抗雄激素剂戒断应答(例如,在停止非类固醇抗雄激素剂的4
‑
6周内,psa下降>25%)的受试者,当受试者psa升高超过在抗雄激素剂戒断之后观察的最低水平时施用本文所述的组合疗法。在一些实施方案中,在开始治疗的6周内,去势睾酮水平是<50ng/dl。
[0154]
在一些实施方案中,受试者先前已用阿比特龙或恩杂鲁胺治疗,并且在一些实施方案中,受试者已中止(例如中断)先前皮质类固醇治疗至少3个月。在一些实施方案中,受试者具有是0、1或2的ecog表现状况。在一些实施方案中,受试者具有足够血液功能、肾功能和肝功能(例如wbc>2000/mm3;anc>1000/mm3;hgb>9.0gm/dl;血小板>100,000/mm3;肌酸酐<2.0mg/dl;和/或ast、alt<2.5
×
机构正常值上限)。在一些实施方案中,受试者不具有hiv 1和hiv 2、htlv
‑
1或活动性乙型肝炎或丙型肝炎的历史。在一些实施方案中,受试者已未进行其他治疗至少4周,并且已从归因于先前治疗的急性毒性恢复(达到<2级)。在一些实施方案中,受试者已进行活检。
[0155]
在一些实施方案中,测量受试者中pd
‑
1、pd
‑
l1和/或ar的水平以评估或修改治疗。在一些实施方案中,以任何顺序和频率,不限于例如,测量/施用、施用/测量、测量/施用/测量、施用/测量/施用、测量/施用/测量/施用、测量/施用/测量/施用/测量、测量/施用/测量/测量/施用/施用/施用/测量、施用/施用/测量/施用、测量/施用/施用/测量/施用/施用等,进行测量水平和施用dna疫苗。
[0156]
在一些实施方案中,治疗方案或剂量响应于测量而改变(例如,以获得pd
‑
1、pd
‑
l1和/或ar的目标水平)。
[0157]
施用、治疗、剂量和给药时程
[0158]
在一些实施方案中,本技术涉及向受试者施用dna疫苗和pd
‑
1抑制剂与ar拮抗剂组合的方法。在一些实施方案中,以与dna疫苗和pd
‑
1抑制剂不同的给药时程施用ar拮抗
剂。
[0159]
在一些实施方案中,本技术涉及向受试者施用dna疫苗和pd
‑
1抑制剂的方法。方法包括根据本技术向受试者施用dna疫苗和pd
‑
1抑制剂的一般步骤。在一些实施方案中,以药学上有效量施用dna疫苗和/或pd
‑
1抑制剂、其衍生物或其药学上可接受的盐。在一些实施方案中,以治疗有效剂量施用dna疫苗和/或pd
‑
1抑制剂、其衍生物或其药学上可接受的盐。
[0160]
选择剂量和频率以产生化合物的有效水平,而无实质上有害作用。当口服、真皮内、经皮或静脉内施用时,dna疫苗和/或pd
‑
1抑制剂的剂量将通常在0.001至10,000mg/kg/天或剂(例如0.01至1000mg/kg/天或剂;0.1至100mg/kg/天或剂)的范围内。
[0161]
施用药学上有效量的方法包括不限于以胃肠外、口服、腹膜内、鼻内、局部、舌下、经直肠和经阴道形式施用。胃肠外施用途径包括例如皮下、静脉内、肌肉内、胸骨内注射、静脉内、真皮内、经皮和输注途径。在一些实施方案中,口服施用化合物、其衍生物或其药学上可接受的盐。
[0162]
在一些实施方案中,向受试者施用单次剂量的化合物或相关化合物。在其他实施方案中,历经分隔数小时、数天、数周等的两个或更多个时间点施用多次剂量。在一些实施方案中,历经长久时期(例如长期),例如持续数周、数月或数年(例如1、2、3、4、5、6、7、8、9、10、11、12或更多周、月或年)的时期施用化合物。在所述实施方案中,可基于定期时程(例如每日、每周、每两周等)持续延长时期的持续时间摄取化合物。
[0163]
本技术也涉及用dna疫苗和pd
‑
1抑制剂治疗受试者的方法。根据本技术的另一方面,提供了一种用于治疗需要用有效量的dna疫苗和/或pd
‑
1抑制剂或其一种或多种盐进行所述治疗的受试者的方法。本方法涉及以以上描述、本文详述和/或权利要求中阐述的任一药物制剂形式向受试者施用有效量的dna疫苗和/或pd
‑
1抑制剂或其盐。受试者可以为需要所述治疗的任何受试者。在先前描述中,本技术与化合物或其盐相关联。所述盐包括但不限于溴化物盐、氯化物盐、碘化物盐、碳酸盐和硫酸盐。然而,应了解,化合物是一类化合物的成员,并且本技术旨在包括含有在这个类别内的相关衍生物的药物制剂、方法和试剂盒。本技术的另一方面于是包括先前概述,但在各个方面阅读起来就好像每当“化合物”出现时,用任何所述衍生物进行替代一样。
[0164]
在一些实施方案中,测试受试者以评估不适和/或病状诸如前列腺癌的存在、不存在或水平。例如通过测定或测量生物标志物、代谢物、身体症状、征象等来进行所述测试以确定不适或病状的风险或存在。在一些实施方案中,基于测试结果来用dna疫苗和/或pd
‑
1抑制剂治疗受试者。在一些实施方案中,用dna疫苗和/或pd
‑
1抑制剂治疗受试者,获得样品并测量可检测剂的水平,并接着基于测量的可检测剂的水平用dna疫苗和/或pd
‑
1抑制剂再次治疗所述受试者。在一些实施方案中,用dna疫苗和/或pd
‑
1抑制剂治疗受试者,获得样品并测量可检测剂的水平,基于测量的可检测剂的水平用dna疫苗和/或pd
‑
1抑制剂再次治疗所述受试者,并接着获得另一样品并测量可检测剂的水平。在一些实施方案中,其他测试(例如不基于测量可检测剂的水平)也在各个阶段例如在用dna疫苗和/或pd
‑
1抑制剂进行初始治疗之前用作初始剂量指导。在一些实施方案中,基于测试结果来调整用dna疫苗和/或pd
‑
1抑制剂进行的后续治疗,例如改变药物的剂量的量、剂量时程、成分(identity)等。
[0165]
在一些实施方案中,测试、治疗,并接着再次测试患者以监测对疗法的响应和/或改变疗法。在一些实施方案中,测试和治疗的循环可在不限于测试和治疗的样式、定期性、
或各个测试和治疗阶段之间的间隔的持续时间的情况下来进行。因此,本技术涵盖测试和治疗的各种组合,不限于例如测试/治疗、治疗/测试、测试/治疗/测试、治疗/测试/治疗、测试/治疗/测试/治疗、测试/治疗/测试/治疗/测试、测试/治疗/测试/测试/治疗/治疗/治疗/测试、治疗/治疗/测试/治疗、测试/治疗/治疗/测试/治疗/治疗等。
[0166]
本技术在用于施用dna疫苗和pd
‑
1抑制剂的给药和给药时程方面不受限制。举例来说,在一些实施方案中,在第1天开始,每两周真皮内施用dna疫苗(例如ptvg
‑
hp(例如100μg)与rhgm
‑
csf(例如208μg)或者ptvg
‑
hp(例如100ug)与gm
‑
csf(例如208ug)和ptvg
‑
ar(例如100ug)与rhgm
‑
csf(例如208ug))作为替代剂量施用,共6次,并且在第1天开始,每3周静脉内施用pd
‑
1抑制剂(例如派姆单抗或尼鲁单抗,在约200mg的固定剂量下),共4次。在一些实施方案中,在第1天开始,每两周真皮内施用dna疫苗(例如ptvg
‑
hp(例如100μg)与rhgm
‑
csf(例如208μg)),共6次,并且每两周、每三周或每4周静脉内施用pd
‑
1抑制剂(例如派姆单抗或尼鲁单抗,在约200mg的固定剂量下)(例如适当的共3至6次),其中第一剂在末次ptvg
‑
hp疫苗接种之后两周施用。
[0167]
因此,在一些实施方案中,以大约100μg(例如10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、300、400、500、600、700、800、900或1000μg或更多μg)的量施用dna疫苗(例如ptvg
‑
hp)。在一些实施方案中,dna疫苗与例如处于大约200μg(例如100至500μg,例如100、110、120、130、140、150、160、170、180、190、200(例如在一些实施方案中是208)、210、220、230、240、250、260、270、280、290、300、400、500、600、700、800、900或1000μg或更多μg)的量的佐剂例如gm
‑
csf(例如rhgm
‑
csf)组合施用。如上所指示,在一些实施方案中,在真皮内(例如在侧臂的三角肌区域上)施用dna疫苗。在一些实施方案中,以大约0.25ml(例如100至500μl,例如100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290、300、400、500、600、700、800、900或1000μl或更多)的体积施用dna疫苗。在一些实施方案中,在两个邻近部位各自处施用所述体积的dna疫苗。在一些实施方案中,每两周(例如大约每两周,例如大约每14天(例如14
±
3天(例如11至17天)))施用dna疫苗。在一些实施方案中,施用dna疫苗6次(例如3至9次,例如3、4、5、6、7、8或9次)。
[0168]
进一步的,在一些实施方案中,在2mg/kg(例如1至5mg/kg,例如1、1.5、2、2.5、3、3.5、4、4.5或5mg/kg)的剂量下以及最优选在约200mg的固定剂量下施用pd
‑
1路径抑制剂(例如派姆单抗或尼鲁单抗)。在一些实施方案中,静脉内施用pd
‑
1路径抑制剂。在一些实施方案中,历经30分钟(例如从15分钟至2小时,例如持续15、30、45、60、75、90、105或120分钟)施用(例如静脉内)pd
‑
1路径抑制剂。在一些实施方案中,每3周(例如每周、每1.5周、每2周、每2.5周、每3周(例如每21
±
3天(例如18至228天))、每3.5周、每4周或每5周)施用pd
‑
1路径抑制剂。在一些实施方案中,施用pd
‑
1路径抑制剂4次(例如2至9次,例如2、3、4、5、6、7、8或9次)。在一些实施方案中,与dna疫苗并行施用pd
‑
1路径抑制剂,例如在第1天,在用dna疫苗进行首次疫苗接种之前,与所述首次疫苗接种一起,或在所述首次疫苗接种之后。在其中与dna疫苗并行施用pd
‑
1路径抑制剂的一些实施方案中,pd
‑
1路径抑制剂于第一组合物中加以施用,并且dna疫苗于第二单独组合物中加以施用。在其中与dna疫苗并行施用pd
‑
1路径抑制剂的一些实施方案中,pd
‑
1路径抑制剂和dna疫苗于同一组合物中加以施用。在另一示例性实施方案中,pd
‑
1路径抑制剂在施用dna疫苗之后施用,例如在用dna疫苗进行最终疫
苗接种之后1、2、3、4周或更多周。
[0169]
在一些实施方案中,本技术包括根据时程施用dna疫苗和pd
‑
1路径抑制剂。举例来说,在一些实施方案中,在同一天向受试者施用dna疫苗(例如ptvg
‑
hp)和pd
‑
1路径抑制剂以启动治疗(例如“第1天”),例如在施用dna疫苗之后0至0.5至5小时以及直至24小时施用pd
‑
1路径抑制剂。接着,在一些实施方案中,在启动治疗之后的后续若干天施用dna疫苗和/或pd
‑
1抑制剂。举例来说,在一些实施方案中,在第15天(例如在第1天施用dna疫苗和pd
‑
1抑制剂之后15
±
3天(例如12至18天)),在第29天(例如在第15天施用dna疫苗之后14
±
3天(例如11至17天)),在第43天(例如在第29天施用dna疫苗之后14
±
3天(例如11至17天)),在第57天(例如在第43天施用dna疫苗之后14
±
3天(例如11至17天)),以及在第71天(例如在第57天施用dna疫苗之后14
±
3天(例如11至17天))施用dna疫苗;并且在第22天(例如在第15天施用dna疫苗之后7
±
3天(例如4至10天)),在第43天(例如在第43天施用dna疫苗之后0至0.5至5小时),以及在第64天(例如在第57天施用dna疫苗之后7
±
3天(例如4至10天))施用pd
‑
1抑制剂。
[0170]
在一些优选实施方案中,以重叠施用时程施用疫苗和pd
‑
1抑制剂多次。在一些实施方案中,首次并行施用疫苗和pd
‑
1抑制剂(即在治疗时程的第1天,在彼此的24小时内),并且此后,每10至20或21天,优选约每14天施用疫苗,并且每17至24天,优选约每21天施用pd
‑
1抑制剂,持续多达90天的时期。在一些实施方案中,方法进一步包括每10至20或21天,优选约每14天施用疫苗,并且每17至24天,优选约每21天施用pd
‑
1抑制剂,持续91天至365天的时期。在一些实施方案中,选择在90天之后展现psa降低或肿瘤消退的患者每10至20或21天施用疫苗,并且每17至24天施用pd
‑
1抑制剂,持续91天至365天的时期。在一些实施方案中,本方法进一步包括每10至20或21天,优选约每14天施用疫苗,并且每17至24天,优选约每21天施用pd
‑
1抑制剂,持续366天至730天的时期。在一些实施方案中,选择在365天之后展现psa降低或肿瘤消退的患者每10至20或21天施用疫苗,并且每17至24天施用pd
‑
1抑制剂,持续366天至730天的时期。在一些实施方案中,以重叠时程,每10至28天,优选每10至20或21或21天或10至24天,并且最优选约每14天或21天施用疫苗和pd
‑
1抑制剂,持续多达90天的时期。在一些实施方案中,本方法进一步包括以重叠时程,每10至28天,优选每10至20或21天或10至24天,并且最优选约每14天施用疫苗和pd
‑
1抑制剂,持续91天至365天的时期。在一些实施方案中,选择在90天之后展现psa降低或肿瘤消退的患者以重叠时程,每10至28天,优选每10至20或21天或10至24天,并且最优选约每14天施用疫苗和pd
‑
1抑制剂,持续91天至365天的时期。在一些实施方案中,本方法进一步包括以重叠时程,每10至28天,优选每10至20或21天或10至24天,并且最优选约每14天施用疫苗和pd
‑
1抑制剂,持续366天至730天的时期。在一些实施方案中,选择在365天之后展现psa降低或肿瘤消退的患者每10至28天,优选每10至20或21天或10至24天,并且最优选约每14天并行施用疫苗和pd
‑
1抑制剂,持续366天至730天的时期。在一些实施方案中,在重叠施用时程内并行施用疫苗和pd
‑
1抑制剂。并行施用涵盖于同一组合物(例如溶液)中施用疫苗和pd
‑
1抑制剂,或当分开施用药剂时,在同一天施用,并且优选在彼此的约1分钟至约5小时或24小时内或在彼此的约30分钟至约5小时或24小时内施用。
[0171]
在给药时程的其他实施方案中,向受试者施用dna疫苗(例如ptvg
‑
hp)以启动治疗(例如“第1天”),并且在第1天不施用pd
‑
1抑制剂。接着,在启动治疗之后的后续若干天施用
dna疫苗和/或pd
‑
1抑制剂。举例来说,在一些实施方案中,在第15天(例如在第1天施用dna疫苗之后15
±
3天(例如12至18天)),在第29天(例如在第15天施用dna疫苗之后14
±
3天(例如11至17天)),在第43天(例如在第29天施用dna疫苗之后14
±
3天(例如11至17天)),在第57天(例如在第43天施用dna疫苗之后14
±
3天(例如11至17天)),以及在第71天(例如在第57天施用dna疫苗之后14
±
3天(例如11至17天))施用dna疫苗;并且在一系列dna疫苗施用之后,例如在第85天(例如在第71天施用dna疫苗之后14
±
3天(例如11至17天)),在第106天(例如在第85天施用pd
‑
1抑制剂之后21
±
3天(例如18至24天)),在第127天(例如在第106天施用pd
‑
1抑制剂之后21
±
3天(例如18至24天)),以及在第148天(例如在第127天施用pd
‑
1抑制剂之后21
±
3天(例如18至24天))施用pd
‑
1抑制剂。参见例如图1。
[0172]
在一些实施方案中,在给药时程的任何时间期间,可对受试者或使用从受试者获得的样品进行一个或多个测试。示例性测试包括一种或多种例如用以测量化学物质、生物标志物、代谢物等(例如钠、钾、碳酸氢根、bun、肌酸酐、葡萄糖、alt、ast、胆红素、碱性磷酸酶、淀粉酶、甲状腺刺激激素(tsh)、ldh、血清前列腺特异性抗原(psa)、血清pap、血清睾酮)的水平的测试;血液测试(例如cbc,例如在一些实施方案中,包括分类计数和血小板计数);和其他测试,包括例如ct扫描;骨扫描;身体检查;白细胞单采术;抗体组套;ctc计数;组织活检;脉搏;血压;呼吸速率;体温;t细胞应答;pet扫描;问卷;等。
[0173]
在一些实施方案中,ar拮抗剂以间歇频率添加到上述给药时程中。例如,在一些实施方案中,施用ar拮抗剂,持续数周或数月的时期(例如,每天一次或多次,持续1、2、3、4、5、6、8、10、12、14、18、20周或更长时间),随后是给药中断(例如,中断1、2、3、4、5、6、8、10、12、14、18、20周或更长时间),其中在本文所描述的时程下施用dna疫苗和pd
‑
1抑制剂。例如,在一些实施方案中,在治疗持续期间(例如1个月、6个月、1年或更长),每90天施用ar拮抗剂持续90天的时期(例如,90天的每日给药,90天中断),尽管其他时程也特别考虑。
[0174]
对疗法的响应以及监测
[0175]
在一些实施方案中,对用本文所述的组合疗法达成的疗法的响应导致赘生性病变的尺寸降低,使受试者的生物肿瘤负荷降低等。举例来说,在一些实施方案中,在治疗之前、期间和之后鉴定和监测受试者的“可测量”病变。在一些实施方案中,评估在初始治疗之后受试者的肿瘤负荷以设置用于监测治疗过程的基线,例如以提供后续测量结果与其相比较的测量结果。在一些实施方案中,通过对受试者进行成像来确定“基线”肿瘤负荷。如本文所用,当受试者具有至少一个“可测量病变”时,所述受试者患有“可测量疾病”。如本文所用,“可测量病变”是可在至少一个维度(待记录的最长直径)上用常规技术准确测量为>20mm(2.0cm)或用螺旋ct扫描准确测量为>10mm(1.0cm)的病变。对于淋巴结转移,“可测量病变”根据螺旋ct或常规技术在最长直径方面是至少2.0cm。在一些实施方案中,位于先前照射区域中的肿瘤病变不被视为可测量。如本文所用,“非可测量”病变是不“可测量”的病变,例如所有其他病变,包括小病变(用常规技术得到的最长直径<20mm(2.0cm)或用螺旋ct扫描得到的最长直径<10mm(1.0cm)),<2.0cm的淋巴结,以及不能可靠地获得其测量结果的病变(例如骨病变、柔脑膜疾病、腹水、胸膜/心包积液、皮肤淋巴管炎/肺淋巴管炎、未由成像技术确认和追踪到的腹部团块、以及囊性病变)。
[0176]
在一些实施方案中,用正电子发射断层摄影术(pet)(例如
18
f naf pet)测量病变。
18
f naf pet适用于产生例如组织的3维测量结果,并且因此提供对病变体积的体积性定
量,并且因此提供总体肿瘤体积的测量结果。
[0177]
在一些实施方案中,通过监测代表所涉及器官的可测量病变的尺寸来监测对疗法的响应。在一些实施方案中,recist 1.1用于评估放射摄影数据。在一些实施方案中,基于who准则的免疫相关响应准则(irrc)用于评估免疫肿瘤学,例如基于recist 1.1、irrc和nishino(2013)“developing a common language for tumor response to immunotherapy:immune
‑
related response criteria using unidimensional measurements.”,clin cancer res.19(14):3936
‑
43(以引用的方式并入本文)的irrecist准则。
[0178]
在一些实施方案中,基于尺寸(例如具有最长直径的那些)和它们就准确重复测量来说的适合性来选择靶标病变。在一些实施方案中,通过计算所有靶标病变的最长直径的总和以提供最长直径总和来监测对疗法的响应。在一些实施方案中,最长直径总和用于表征肿瘤响应。对于可在2个或3个维度上测量的病变,使用在各次评估时的最长直径。进一步的,在一些实施方案中,例如根据recist 1.1和/或irrecist,使用短轴测量进行淋巴结测量。
[0179]
在一些实施方案中,基于受试者对治疗的响应,将所述受试者置于某一类别中。举例来说,基于所有靶标病变都消失,将受试者置于“完全响应(cr)”类别中。在一些实施方案中,为指定完全响应的状况,通过在首次满足响应准则之后进行重复评估不少于4周来确认肿瘤测量结果的变化。在一些实施方案中,psa是<0.2ng/ml。在一些实施方案中,收缩至小于1.0cm的淋巴结被视为是正常的。采用基线最长直径总和作为参照,基于靶标病变的最长直径的总和降低至少30%,将受试者置于“部分响应(pr)”类别中。在一些实施方案中,为指定部分响应的状况,必须通过在首次满足响应准则之后进行重复评估不少于4周来确认肿瘤测量结果的变化。在一些实施方案中,不存在新的病变。采用从基线测量以来记录的最小的最长直径总和作为参照,基于靶标病变的最长直径的总和增加至少20%以及绝对最小增加0.5cm,或出现一个或多个新的病变,将受试者置于“进行性疾病(pd)”类别中。基于既无足以定性为部分响应的收缩,也无足以定性为进行性疾病的增加,将受试者置于“稳定疾病(sd)”类别中。在一些实施方案中,为指定稳定疾病的状况,在进入研究之后,在12周的最小间隔下,测量结果满足稳定疾病准则至少一次。
[0180]
在一些实施方案中,监测对治疗的响应包括监测非靶标病变,例如不是靶标病变的所有疾病病变或部位。在一些实施方案中,例如通过骨闪烁照相术来监测非靶标病变。在一些实施方案中,基于对非靶标病变的监测,将受试者置于某一受试者类别中。举例来说,基于所有非靶标病变都消失以及psa肿瘤标志物水平不可检测,将受试者置于“完全响应(cr)”类别中。在一些实施方案中,为指定完全响应的状况,通过在首次满足响应准则之后进行重复评估不少于4周来确认肿瘤测量结果的变化。在一些实施方案中,基于一个或多个非靶标病变的持续性和/或可检测血清psa肿瘤标志物水平的持续性,将受试者置于“不完全响应/稳定疾病(sd)”类别中。在一些实施方案中,为指定稳定疾病的状况,在进入研究之后,在12周的最小间隔下,测量结果满足稳定疾病准则至少一次。在一些实施方案中,基于出现一个或多个新的病变和/或现有非靶标病变具有明确进展,将受试者置于“进行性疾病(pd)”类别中。在一些实施方案中,对于仅可通过骨扫描检测的病变,出现>2个新的病变并伴有症状构成疾病进展。在无症状的情况下,以及如果无其他疾病进展迹象(例如根据psa
或可测量疾病准则,无进行性疾病),那么在一些实施方案中,采用骨闪烁照相术,例如至少6周后显示>2个新的病变,对进展进行文件记载,以消除在骨扫描时所见的爆发响应的可能性。
[0181]
在一些实施方案中,监测psa进展(例如基于psa量和/或动力学)以监测受试者对治疗的响应。在一些实施方案中,基于psa降低至<0.2ng/ml,将受试者分类为“psa完全响应”。在一些实施方案中,以例如在最少4周后进行的稍后psa测量对置于“psa完全响应”类别中进行确认(经确认psa cr)。在一些实施方案中,置于“psa完全响应”中进一步基于无放射摄影进展迹象。在一些实施方案中,基于大于或等于50%基线psa降低,将受试者置于“psa部分响应”类别中。在一些实施方案中,置于“psa部分响应”类别中包括无放射摄影进展迹象。在一些实施方案中,达到psa进展的时间用于监测受试者对治疗的响应。如本文所用,psa进展是指psa超过最低水平psa增加50%,以及超过最低水平>2ng/ml,由3周或更多周后的第二值确认(例如经确认升高趋势)。如果尚未发生研究时的降低,那么最低水平是基线值(例如治疗前)。
[0182]
在一些实施方案中,例如通过评估pap特异性或ar特异性cd8 t细胞效应物免疫性,通过评估pap特异性或ar特异性记忆t细胞免疫性,通过评估pap特异性或ar特异性t细胞,通过评估抗原特异性抗体(例如pap特异性或ar特异性抗体),通过评估抗原特异性调控免疫应答,和/或通过评估对其他前列腺相关抗原的抗原传播来监测受试者的免疫系统。在一些实施方案中,通过对循环肿瘤细胞计数和表征来评估受试者。在一些实施方案中,使用组织学分析,例如通过检查组织活检体来评估受试者。在一些实施方案中,通过使用pet和/或ct(例如naf pet/ct)进行定量总体骨成像来评估受试者。
[0183]
在一些实施方案中,利用naf pet/ct,使用总体骨成像(例如定量总体骨成像,qtbi)评估受试者。举例来说,在一些实施方案中,使用qtbi对小体积骨转移性疾病和肿瘤生长速率进行评估。举例来说,在一些实施方案中,受试者患有未通过标准骨闪烁照相术检测到的骨疾病。在一些实施方案中,在各个时间点,例如在治疗之前1个月,在基线时,以及在治疗时的3个月评估患者。在一些实施方案中,基于功能性naf pet摄取,辅助以由ct扫描提供的解剖信息,对骨中的转移性前列腺癌病变进行定位和鉴定。在一些实施方案中,使用自动分段方法(例如使用固定suv阈值)进行分段,并且在医师指导下加以调整。在一些实施方案中,使用铰接配准技术,将来自不同时间点的扫描结果彼此配准,所述技术采用来自ct的对骨骼元件(例如骨)的刚性配准,随后通过与来自naf pet/ct的对骨和病变的可变形配准组合来进行配准优化。在一些实施方案中,在治疗前扫描与追踪扫描之间进行病变匹配以建立病变的纵向对应。对于各患者,在一些实施方案中,计算综合治疗响应量度,包括例如suv
总体
(总体疾病负荷)、suv
最大
(最大强度病变)、suv
平均
(平均强度)、病变的数目以及骨病变的总体积。另外,在一些实施方案中,计算各个别病变的成像响应量度。在一些实施方案中,这个方法用于通过评估随时间例如从治疗前至基线的变化,以及将此与从基线至第3个月获得的测量结果进行比较来评估骨转移性疾病的增长速率。
[0184]
试剂盒
[0185]
在一些实施方案中,本技术提供了用于治疗患有前列腺癌的受试者或处于前列腺癌的风险下的受试者的试剂盒。举例来说,一些实施方案提供了包括核酸(例如dna)疫苗(例如包括含有来自pap和/或ar基因的核苷酸序列的核酸)的第一组合物(例如第一药物组
合物)和包括pd
‑
1抑制剂的第二组合物(例如第二药物组合物)以及包括ar拮抗剂的第三组合物。另外,一些试剂盒实施方案进一步包括提供给药时程的产品插页,其包括关于施用核酸疫苗、pd
‑
1抑制剂和ar拮抗剂的说明。
[0186]
在一些实施方案中,核酸疫苗包括ptvg
‑
hp,并且pd
‑
1抑制剂是pd
‑
1的单克隆抗体抑制剂。在一些实施方案中,核酸疫苗包括ptvg
‑
hp,并且pd
‑
1抑制剂是派姆单抗。在一些实施方案中,核酸疫苗包括ptvg
‑
hp,并且pd
‑
1抑制剂是尼鲁单抗。在一些实施方案中,dna疫苗包括佐剂,例如gm
‑
csf。在一些实施方案中,ar拮抗剂是恩杂鲁胺或阿帕鲁胺。
[0187]
在一些实施方案中,dna疫苗、pd
‑
1抑制剂和ar拮抗剂以即用型药物组合物形式提供。在一些实施方案中,dna疫苗、pd
‑
1抑制剂和ar拮抗剂以干燥(例如冻干)状态提供,例如以在施用之前于药学上适当的溶液中溶解和/或再混悬。
[0188]
在一些实施方案中,试剂盒包括于容器诸如小瓶、安瓿、瓶等中的dna疫苗、pd
‑
1抑制剂和ar拮抗剂。在一些实施方案中,dna疫苗、pd
‑
1抑制剂和ar拮抗剂以单次剂量量提供于容器诸如小瓶、安瓿、瓶等中。举例来说,一些试剂盒实施方案包括:1)包括药物组合物的第一小瓶,所述药物组合物包括大约100μg的dna疫苗(例如ptvg
‑
hp)(例如靶向pap和ar的单一或多种dna疫苗)和大约208μg的gm
‑
csf;2)包括10mg至1000mg的pd
‑
1抑制剂的第二小瓶;和3)包括恩杂鲁胺或阿帕鲁胺的第三小瓶。在一些实施方案中,第一小瓶包括大约200至300μl的药物组合物。在一些实施方案中,试剂盒包括两小瓶的dna疫苗以提供两次剂量的dna疫苗。
[0189]
试剂盒的一些实施方案提供了多次剂量的dna疫苗、pd
‑
1抑制剂和ar拮抗剂,例如以提供足以完成如本文所述的给药时程的剂量数。举例来说,试剂盒的一些实施方案包括5至20小瓶的dna疫苗,并且试剂盒的一些实施方案包括2至10小瓶的pd
‑
1抑制剂和ar拮抗剂。
[0190]
实施例
[0191]
实施例1——临床试验方案
[0192]
此实施例描述了用于测试前列腺癌组合疗法的临床试验方案。本试验测试了以下假设:靶向一种或两种前列腺癌抗原的免疫,组合pd
‑
1阻断剂和阿帕鲁胺,导致有效的抗肿瘤免疫,如中断阿帕鲁胺后持续存在的psa完全响应所证明的。在需要雄激素剥夺疗法之前,将psa驱动至不可检测水平的能力,可能治愈或显著延迟前列腺癌的转移性复发,这是该疾病疗法中一个实质性且具有临床意义的“改变游戏规则”的进展。
[0193]
本试验是在该群体中进行的一项随机2阶段多机构研究。具体而言,本试验评估了使用靶向不同抗原(pap和ar)的一种或两种dna疫苗,与使用jnj
‑
63723283的pd
‑
1阻断剂并行递送,在包括阿帕鲁胺的12周疗程的方案中,总计6个月的时期。
[0194]
研究方案在图2中示出。本试验评估了mvi
‑
118dna疫苗 /
‑
mvi
‑
816dna疫苗和jnj
‑
63723283(janssen,raritan,nj)和阿帕鲁胺在患有d0/m0前列腺癌的患者中的安全性和耐受性。测量一年psa完全响应(psa<0.2ng/ml)率。
[0195]
本试验进一步评估了2年无转移存活率和中位放射摄影无进展存活期。额外的实验确定治疗是否会引发抗原特异性t细胞和/或igg响应,以及naf pet/ct是否可用于监测肿瘤响应。
[0196]
实施例2——对ar的免疫应答
cancer.bju int 2007;99:60
–
7.
[0218]
16.gannon po,poisson ao,delvoye n,lapointe r,mes
‑
masson am,saad f.characterization of the intra
‑
prostatic immune cell infiltration in androgen
‑
deprived prostate cancer patients.j immunol methods 2009;348:9
–
17.
[0219]
17.shen yc,kochel c,francica b,alme a,nirschl c,nirschl t,et al.combining androgen deprivation with immune checkpoint blockade delays the development of castration resistance in a murine model of prostate cancer.2015;philadelphia,pa.
[0220]
18.akins ej,moore ml,tang s,willingham mc,tooze ja,dubey p.in situ vaccination combined with androgen ablation and regulatory t
‑
cell depletion reduces castration
‑
resistant tumor burden in prostate
‑
specific pten knockout mice.cancer res 2010;70:3473
–
82.
[0221]
19.drake cg,doody ad,mihalyo ma,huang ct,kelleher e,ravi s,et al.androgen ablation mitigates tolerance to a prostate/prostate cancer
‑
restricted antigen.cancer cell 2005;7:239
–
49.
[0222]
20.koh yt,gray a,higgins sa,hubby b,kast wm.androgen ablation augments prostate cancer vaccine immunogenicity only when applied after immunization.prostate 2009;69:571
–
84.
[0223]
21.ardiani a,farsaci b,rogers cj,protter a,guo z,king th,et al.combination therapy with a second
‑
generation androgen receptor antagonist and a metastasis vaccine improves survival in a spontaneous prostate cancer model.clin cancer res 2013;19:6205
–
18.
[0224]
22.olson bm gamat m seliski j sawicki t jeffery j ellis l drake cg weichert j mcneel dg prostate cancer cells express more androgen receptor(ar)following androgen deprivation,improving recognition by ar
‑
specific t
‑
cells.cancer immunol res.2017dec;5(12):1074
‑
1085
[0225]
23.mcneel dg,smith ha,eickhoff jc,lang jm,staab mj,wilding g,liu g.phase i trial of tremelimumab in combination with short
‑
term androgen deprivation in patients with psa
‑
recurrent prostate cancer.cancer immunol immunother.2012jul;61(7):1137
‑
47
[0226]
以上说明书中提及的所有出版物和专利(包括但不限于以上章节中引用的那些)都出于所有目的以引用的方式整体并入本文。技术的所述组合物、方法和用途的各种修改和变化将在不脱离如所述技术的范围和精神下为本领域技术人员显而易知。尽管技术已与特定示例性实施方案关联加以描述,但应了解如所要求保护的本发明不应不当地限于所述特定实施方案。实际上,用于执行本发明的所述模式的为本领域技术人员显而易见的各种修改意图在以下权利要求的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。