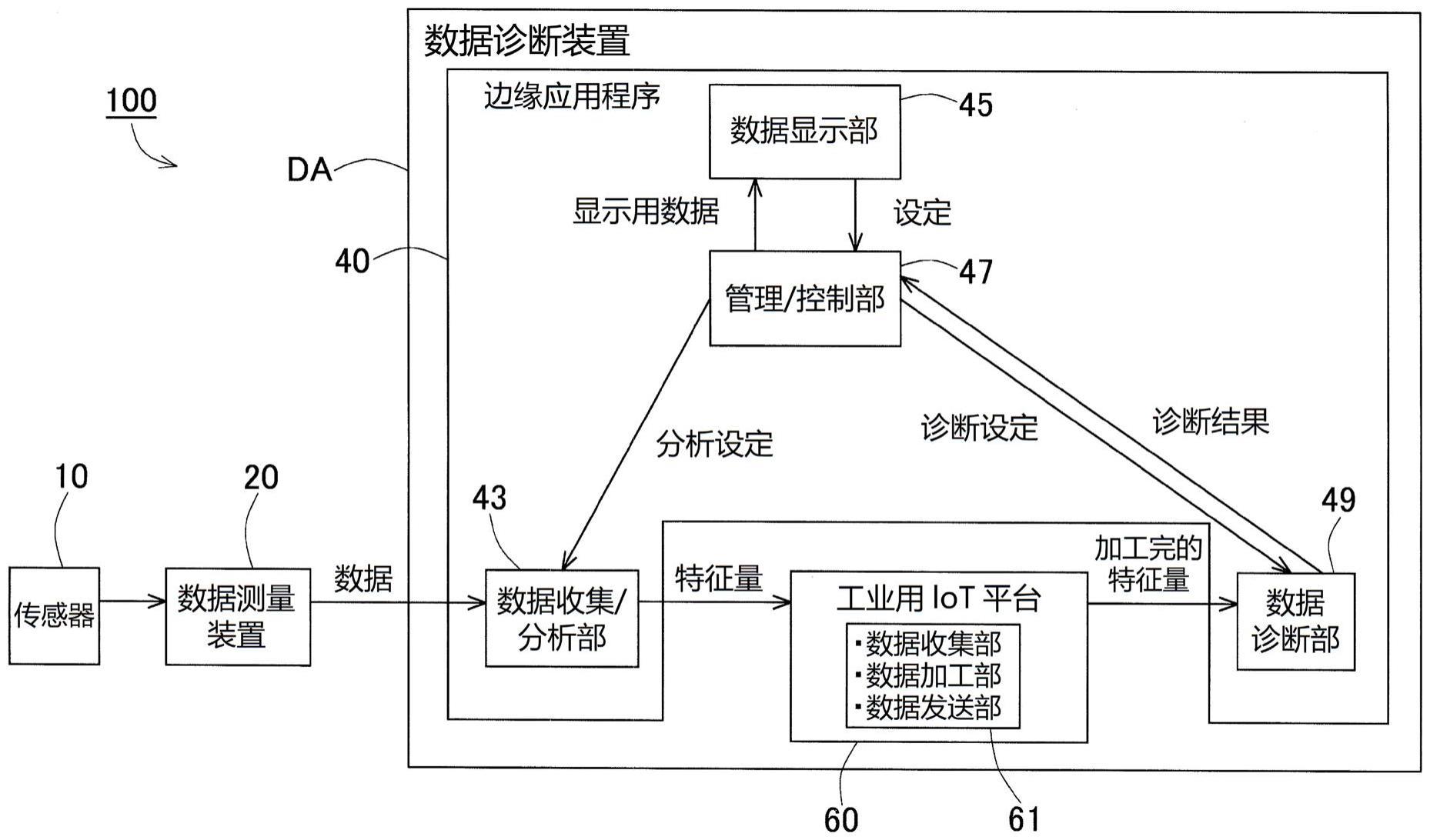
1.本发明涉及受试者肺癌的诊断。本发明提供了一种基于存在于外泌体中或表面上或为从液体活检或其他生物样品中获得的切割的外泌体表面多肽的一种或多种生物标志物的存在,以获得受试者中肺癌的存在的指示的诊断方法。本发明还提供了可以用于受试者肺癌诊断的装置,例如流动装置和微流体装置。
背景技术:
2.肺癌是最常被诊断出的癌症(fan等,2015),它仍然是全球男性和女性癌症相关死亡的主要原因(siegel等,2017)。尽管开发了新的治疗方法,但肺癌患者的总体预后较差,部分原因是大多数病例是在晚期发现的,此时转移已经扩散到淋巴结和身体其他部位。这些晚期肺癌难以手术切除,并且与术后肺癌复发率增加有关(kumarakulasinghe等,2015)。晚期肺癌患者的五年生存率仅为4%左右(国家肺筛查试验研究组等,2011),而早期诊断的具有仍可手术并局限于肺部的原发性肿瘤的患者的5年生存率为54%。
3.检测肺癌的标准诊断程序包括胸部x光、ct(计算机断层扫描)扫描和组织活检。这些都是非特异性的,并且有许多局限性,即将疾病的评估局限于早期阶段。非侵入性x射线方法只能检测大于1厘米的肿瘤;因此,肺肿瘤可能需要几年才能达到可以识别的大小。ct扫描提供了更多信息,并且与x射线相比可以检测出更小的肿瘤。然而,等待期通常较长,并且在此期间,侵袭性肺肿瘤通常会扩大一倍或开始转移。此外,这些医学成像技术怀疑的肿瘤需要进一步研究以确认肺癌的诊断。
4.由于肿瘤异质性,肺癌活检通常也不准确(levy等,2016)。此外,肿瘤活检的可及性代表了另一个问题,因为超过80%的晚期肺癌患者只有有限的或没有来自小活检或细胞学的有用组织以进行进一步的研究;此外,从患者获得组织活检是非常有创的、耗时且容易出错(wong等,2014)。
5.液体活检是组织活检的替代方法。液体活检最近被接受为癌症检测的新工具。该技术不仅对患者具有微创性,而且还提供了来自血流的新鲜肿瘤衍生物的宝贵来源,可以更好地反映原发肿瘤和任何转移部位的遗传和分子信息。通常,液体活检的样本只需要10毫升血液或其他体液;这使得能够捕获循环肿瘤细胞(ctc)、无细胞rna(cfrna)、无细胞dna(cfdna)、循环肿瘤dna(ctdna)和外泌体。
6.商业上可获得的测试的最高准确性允许在72%的ii-iv期肺癌患者中检测ctdna(cristiano等,2019),ctdna水平与肿瘤体积之间具有很强的相关性(newman等,2014)。然而,尽管这些细胞或核酸片段的检测为肺癌的诊断提供了一种有前途的工具,但它们的处理需要很长的程序,包括超速离心、提取、序列分析和从正常细胞cfdna中分离ctdna的灵敏方法。此外,肿瘤ctdna不稳定,并且只有2小时的半衰期;这意味着必须快速评估样本,这可能导致肺癌患者出现假阴性结果(diehl等,2008)。
7.最近对从液体活检中分离的外泌体越来越感兴趣,这是由于它们作为癌症检测的生物标志物和作为治疗药物递送系统的潜在临床应用。外泌体是细胞膜衍生的细胞外囊
泡,大小在30-150nm之间,具有脂质双层膜,由各种真核细胞分泌。20世纪80年代末,turbide的研究小组首次证实了它们的存在,它们最初被认为是细胞废物,没有明显的生物学作用(johnstone等,1987)。
8.然而,在过去的二十年中,外泌体因其在细胞间通讯和许多其他细胞过程中的独特作用而被广泛研究。外泌体的生物学功能取决于它们的生物活性货物;这些在分泌它们的亲本细胞之间差异很大。根据一个外泌体数据库,外泌体货物含有多达9769种不同的蛋白质、3408种不同的mrna、2838种不同的mirna和1116种不同的脂质(www.exocarta.org);这使得外泌体成为癌症诊断的潜在生物标志物。
9.癌症衍生的外泌体由肿瘤的组织分泌,并且可以从各种体液中分离出来,包括血液、唾液或尿液(van der pol等,2012);因此,它们提供了有关肿瘤的生物学概况、转移能力或生长速度的重要信息。脂质双层膜在血液循环过程中保护外泌体免受极端ph和核糖核酸酶降解,并且提供外泌体与无细胞rna相比更长的寿命和更高的稳定性(sourvinou等,2013)。
10.然而,尽管已经描述了不同的分离方法,但从临床样品中分离外泌体可能非常具有挑战性。标准技术包括离心和超速离心、密度梯度分离、色谱或基于特异性抗体包被的珠子的免疫沉淀的组合(vanni等,2017)。这些方法通常很耗时;此外,物理分离可能改变外泌体的结构。
11.来自液体活检的肿瘤外泌体生物标志物的靶向必须具有高度特异性以使其能够临床应用。最大的挑战是以最小的样品制备和成本检测外泌体的微小病理变化。
12.在过去的几年中,已经研究了来自液体活检(例如血液、唾液、尿液)的外泌体生物标志物用于肺癌诊断和筛查。外泌体microrna(cazzoli等,2013)、rna、长非编码rna malat-1(zhang等,2017)、mir-184(song等,2018)、脂质(fan等,2018)和外泌体蛋白(jakobsen等,2015)的评估已被提议用于肺癌的早期和晚期。此外,外泌体膜表面蛋白cd91、cd317和egfr已被认为是潜在的肿瘤标志物(yamashita等,2013);然而,它们还没有显示出对肺癌检测的精确特异性。最近对肺癌患者唾液中外泌体的lc-ms/ms分析最初确定了四种潜在的候选物,即bpifa1蛋白、crnn蛋白、muc5b蛋白和iqgap蛋白,用于肺癌的潜在检测;然而,进一步的分析显示肺癌患者和对照组患者的唾液没有显著差异(sun等,2018)。
13.非小细胞肺癌患者尿液中的蛋白质组学纳米-hplc-芯片-ms/ms分析显示lrg1蛋白表达水平较高,并提示了另一种用于nsclc诊断的潜在候选物(li等,2011)。
14.靶向来自液体活检的特定表面外泌体肿瘤生物标志物可以在肺肿瘤学中以最少的样品制备提供高诊断潜力。然而,目前对外泌体的生物发生知之甚少,特别是关于来自亲本细胞的蛋白质如何在外泌体内部或表面上加工。例如,细胞表面蛋白可以加工成外泌体,但不能在外泌体表面表达;另一方面,细胞细胞质蛋白可以插入外泌体膜中,在那里它们可以作为表面外泌体生物标志物起作用。另一个问题是,一些外泌体表面蛋白在许多不同类型的癌症外泌体中表达,不仅在肺癌中表达。
15.由于这些原因和其他原因,通过来自液体活检的特定表面外泌体生物标志物检测肺癌尚未在常规临床实践中得到转化;目前还并没有可用的外泌体生物标志物可以准确地区分某种类型的癌症。
技术实现要素:
16.因此,需要鉴定可以用于区分不同类型的癌症和/或检测患者的肺癌早期阶段的外泌体膜表面蛋白。现在已经鉴定出一组蛋白质对肺癌外泌体的表面具有特异性。这些生物标志物可以用于检测来自肺癌患者的液体样品中的肺癌。此外,针对这些生物标志物的抗体或其组合可用于检测肺癌的诊断装置中。
17.本发明的目的是提供一种获得受试者中肺癌和/或转移阶段的存在的指示的方法。本发明的另一个目的是提供一种装置,例如横向流动装置、垂直流动装置或微流体装置,其可用于提供生物样品中肺癌生物标志物存在的指示。
18.在一个实施方案中,本发明提供了一种获得受试者中肺癌的存在的指示的方法,该方法包括以下步骤:
19.(a)确定从所述受试者获得的生物样品中选自由pld3多肽、mage4a多肽、gage2d多肽、mtap多肽和uchl1多肽组成的组的一种或多种生物标志物的存在,其中所述生物样品包含从中获得的外泌体和/或多肽,
20.其中所述生物样品中一种或多种所述生物标志物的存在指示所述受试者中存在肺癌。
21.在另一个实施方案中,本发明提供了一种区分受试者早期肺癌(例如i期、ii期、iii期)和转移性肺病或确定受试者肺癌分期的方法,
22.该方法包括以下步骤:
23.(a)确定从所述受试者获得的生物样品中选自由pld3多肽、mage4a多肽、gage2d多肽、mtap多肽和uchl1多肽组成的组的一种或多种生物标志物的存在或水平,其中所述生物样品包含从中获得的外泌体和/或多肽,
24.其中
25.所述生物样品中pld3、mtap和/或uchl1的存在指示所述受试者中存在早期肺癌,以及
26.所述生物样品中mage4a和/或gage2d的存在指示所述受试者中存在转移性肺病。
27.通常,本发明的方法是在体外或离体进行的(除非上下文另有要求,例如,其中该方法包括给药步骤)。
28.肺癌,也称为肺恶性上皮肿瘤(lung carcinoma),是一种恶性肺肿瘤,其特征是肺组织中细胞生长不受控制。这种生长可以通过转移到附近组织或身体的其他部位的过程扩散到肺部以外。大多数始于肺部的癌症,即原发性肺癌,都是恶性上皮肿瘤(carcinoma)。
29.在一些实施方案中,肺癌是小细胞肺癌(small-cell lung carcinoma,sclc)。在其他实施方案中,肺癌是非小细胞肺癌(non-small-cell lung carcinoma,nsclc)。nsclc的三种主要亚型是腺癌、鳞状细胞癌和大细胞癌。罕见的亚型包括肺肠型腺癌。优选地,nsclc是腺癌(nslc)。
30.本发明的方法也可以用于获得受试者中源自肺癌的转移的存在的指示。肺癌可以是i期、1a期、1b期、ii期、iia期、iib期、iii期或iv期。
31.早期肺癌可能是非转移期。
32.如本文所用,术语“指示受试者患有肺癌”意味着存在或不同(例如增加)水平的一种或多种生物标志物与该受试者中肺癌的存在之间存在正相关。因此,来自受试者的外泌
体中一种或多种生物标志物的存在或不同/增加的水平意味着受试者患肺癌的可能性或统计学上显著的机会增加。显著性可以通过任何合适的技术检测,例如student’st检验(p《0.05)。
33.受试者优选为人类受试者。受试者可以是男性或女性。受试者可能是活着的或死去的(即该方法可以用于验尸诊断)。例如,人类可能是0岁-10岁、10岁-20岁、20岁-30岁、30岁-40岁、40岁-50岁、50岁-60岁、60岁-70岁、70岁-80岁、80岁-90岁、90岁-100岁或100岁以上。该人类可能有患某种特定疾病或紊乱(例如肺癌)的风险,也可能以前患有某种特定疾病或紊乱(例如肺癌)。
34.对照受试者可以定义为非患病受试者、无肺癌的受试者或健康的老年受试者。
35.优选地,生物样品是来自受试者的体液或液体活检。优选地,生物样品是受试者的血液、唾液、支气管灌洗液或尿液的样品。更优选地,生物样品是受试者的血液样品。最优选地,生物样品是血清或血浆。
36.在一些实施方案中,该方法另外包括在步骤(a)之前从受试者获得一个或多个生物样品的步骤。在一些实施方案中,直接在生物样品中检测一种或多种生物标志物,例如从受试者的血液、血清或血浆样品中检测。
37.在其他的实施方案中,在检测生物标志物之前,首先从生物样品中分离和/或纯化外泌体。因此,生物样品可以包含分离和/或纯化的外泌体。
38.可以通过任何合适的方法从生物样品中分离和/或纯化外泌体。这些方法包括离心或超速离心;这可能会也可能不会与尺寸排阻色谱相结合。可以使用尺寸排阻色谱柱,例如使用多孔凝胶柱。在这样的柱中,孔径优选为30nm-70nm,以允许外泌体通过,但不允许较大的囊泡通过。其他方法包括通过使用外泌体标志物(例如cd9/cd63)进行免疫沉淀。这可以例如通过市售试剂盒的直接免疫沉淀来实现。
39.在其他的实施方案中,外泌体在垂直流动装置、横向流动装置或微流体装置内分离和/或纯化。在一些实施方案中,直接在分离和/或纯化的外泌体中检测一种或多种生物标志物。
40.在其他的实施方案中,首先从分离和/或纯化的外泌体中分离和/或纯化外泌体多肽(优选外泌体表面多肽)。
41.多肽可以通过任何合适的方法从分离和/或纯化的外泌体中分离和/或纯化。优选地,从分离和/或纯化的外泌体中分离和/或纯化膜相关多肽。可以通过使用合适的去污剂(例如脱氧胆酸钠)分离膜相关多肽。
42.在一些实施方案中,处理外泌体以从外泌体的外表面释放多肽。如本文所用,术语“释放”意味着存在于外泌体外表面上的全部或部分多肽不再与外泌体表面结合,因此能够独立于外泌体移动。
43.外泌体可以用蛋白酶处理。优选地,蛋白酶是丝氨酸蛋白酶,更优选地,蛋白酶是胰蛋白酶。胰蛋白酶主要在氨基酸赖氨酸或精氨酸的羧基侧切割多肽链。使用的胰蛋白酶的浓度是从外泌体释放一些或大部分表面锚定的多肽而不引起这些多肽的过度降解。合适的浓度包括0.25%或0.5%,例如,在37℃下进行30分钟。
44.随后可以通过任何合适的方法(例如通过沉淀)纯化和/或浓缩从外泌体分离和/或纯化的多肽和/或从外泌体的外表面释放的多肽。合适的沉淀方法的例子包括使用三氯
乙酸(tca)或硫酸铵。多肽和/或表面多肽也可以是免疫沉淀的(例如用生物标志物特异性抗体)。优选地,使用tca沉淀多肽和/或表面多肽。特别优选的是,在确定uchl1或pld3的存在之前浓缩表面多肽。
45.在生物样品中检测选自由pld3、mage4a、gage2d、mtap和uchl1组成的组中的一种或多种生物标志物的存在。如本文所用,术语“生物样品”包括已分离和/或纯化的外泌体;以及从分离和/或纯化的外泌体中分离出的多肽和表面多肽。
46.mage1基因编码黑色素瘤相关抗原4。人类mage1基因在uniprotkb数据库中的登录号为p43358(maga4_human)。
47.gage2d基因编码g抗原2d。人类gage2d基因在uniprotkb数据库中的登录号为q9ueu5(gge2d_human)。
48.mtap基因编码s-甲基-5'-硫代腺苷磷酸化酶。人类mtap基因在uniprotkb数据库中的登录号为q13126(mtap_human)。
49.pld3基因编码5'-3'核酸外切酶。人类pld3基因在uniprotkb数据库中的登录号为q8iv08(pld3_human)。
50.uchl1基因编码泛素羧基末端水解酶同工酶l1。人类uchl1基因在uniprotkb数据库中的登录号为p09936(uchl1_human)。
51.tpgb在各种癌细胞类型的外泌体表面广泛表达;因此,它可以用作阳性对照。因此,本发明的方法可以额外包括确定生物样品中tpgb多肽的存在的步骤。tpgb基因编码滋养层糖蛋白。人类tpgb基因在uniprotkb数据库中的登录号为q13641(tpbg_human)。它也称为5t4癌胚抗原。
52.本发明的一种方法包括确定生物样品中一种或多种指定生物标志物的存在或升高的水平或浓度的步骤。在一些实施方案中,可以确定生物标志物的1种、2种、3种、4种或5种的存在。优选地,确定2-3种生物标志物的存在。
53.例如,可以使用5种生物标志物的任意组合来确定以下生物标志物组合的存在,包括:
54.mage4a、gage2d、mtap、pld3、uchl1;
55.mage4a、gage2d、mtap、pld3,
56.mage4a、gage2d、mtap、uchl1;
57.mage4a、gage2d、pld3、uchl1;
58.mage4a、mtap、pld3、uchl1;
59.gage2d、mtap、pld3、uchl1;
60.mage4a、gage2d、mtap,
61.mage4a、gage2d、pld3,
62.mage4a、gage2d、uchl1;
63.mage4a、mtap、pld3,
64.mage4a、mtap、uchl1;
65.mage4a、pld3、uchl1;
66.gage2d、mtap、pld3,
67.gage2d、mtap、uchl1;
68.mtap、pld3、uchl1;
69.mage4a、gage2d,
70.mage4a、mtap,
71.mage4a、pld3,
72.mage4a、uchl1;
73.gage2d、mtap,
74.gage2d、pld3,
75.gage2d、uchl1;
76.mtap、pld3,
77.mtap、uchl1;以及
78.pld3、uchl1;
79.pld3;
80.uchl1;
81.mtap;
82.mage4a;
83.gage2d;
84.在一些优选的实施方案中,生物标志物是(i)pld3、(ii)mtap或(iii)pld3和mtap。
85.tpgb(5t4)可以添加到上述任何组合中(作为阳性对照)。cd81、cd9或其他外泌体标志物也可用作通过微流体装置、横向或垂直流动装置分离的外泌体的标志物。
86.生物标志物的存在或水平可以通过任何合适的方法确定,优选通过使用标记的生物标志物特异性抗体的免疫检测,例如,通过蛋白质印迹、elisa或横向流动装置。
87.针对所有指定生物标志物的抗体是可以商购的,例如,
88.mage4a:目录号:12508-1-ap;美国proteintech;
89.gage2d;目录号:12532-1-ap,美国proteintech;
90.mtap,目录号:pa5-22000,美国invitrogen;
91.pld3,目录号:pa5-104016,美国invitrogen;
92.uchl1,目录号:cf504289,美origene;以及
93.5t4,目录号:ab-129058,美国abcam。
94.在另一个实施方案中,本发明提供了一种获得受试者肺癌预后的指示的方法,该方法包括以下步骤:
95.a)在第一时间点确定从所述受试者获得的生物样品中一种或多种生物标志物的存在或水平;以及
96.b)在第二(稍后)时间点确定从所述受试者获得的(相同类型的)生物样品中一种或多种相同生物标志物的存在或水平;
97.其中所述生物标志物选自由pld3多肽、mage4a多肽、gage2d多肽、mtap多肽和uchl1多肽组成的组,
98.其中所述生物样品均包含从中获得的外泌体和/或多肽,
99.其中与第一生物样品中相应的生物标志物水平相比,第二生物样品中一种或多种生物标志物水平的增加指示所述受试者的预后不良,以及
100.其中与第一生物样品中相应的生物标志物水平相比,第二生物样品中一种或多种生物标志物水平的降低指示所述受试者预后的改善。
101.第二时间点在第一时间点之后。例如,第一时间点可能处于肺癌的早期阶段(例如ia期、ib期、iia期或iib期)。第二时间点可能在肺癌的后期(iii期或iv期);或在受试者已经接受适合治疗肺癌的药物治疗后。第一时间点和第二时间点可以是任何合适的时间间隔,例如间隔至少一周,间隔1个月-12个月,或间隔至少1年、2年、3年、4年或5年。
102.在步骤(a)和(b)中获得的外泌体和/或多肽的样品必须是直接可比的,即比较相同的生物标志物,并且生物样品二者必须是相同类型的(例如,二者都是血液样品),并且以相同的方式处理。
103.人们认识到,肺癌不仅是一种疾病,而且是许多相关疾病的统称。因此,本发明可用于将受试者分为此类相关疾病或肺癌亚组,或用于鉴定肺癌分期。
104.因此,在另一个实施方案中,本发明提供了一种将受试者分类为肺癌亚组的方法,该方法包括以下步骤:
105.(a)确定从所述受试者获得的生物样品中选自由pld3多肽、mage4a多肽、gage2d多肽、mtap多肽和uchl1多肽组成的组的一种或多种生物标志物的存在或水平,其中所述生物样品包含从中获得的外泌体和/或多肽;以及
106.(b)根据所述生物样品中一种或多种所述生物标志物的存在或水平,将所述受试者分类为肺癌亚组。
107.步骤(b)中的分类可以使用来自先前被鉴定为属于特定亚组的其他受试者的相应生物标志物的存在或水平进行。例如,肺癌亚组可以是如上文所述的肺癌阶段。受试者的分类也可以用于选择临床试验的受试者。
108.生物样品中一种或多种生物标志物的存在或水平可以用于量化该受试者肺癌的严重程度。因此,该值可以用于确定特定药物是否对受试者的治疗具有有益效果。
109.因此,在另一个实施方案中,本发明提供了一种获得用于治疗受试者肺癌的药物的功效的指示的方法,该方法包括以下步骤:
110.a)在第一时间点确定从所述受试者获得的生物样品中一种或多种生物标志物的存在或水平;
111.b)在第二(稍后)时间点确定从所述受试者获得的(相同类型的)生物样品中一种或多种相同生物标志物的存在或水平,
112.其中所述生物标志物选自由pld3多肽、mage4a多肽、gage2d多肽、mtap多肽和uchl1多肽组成的组,
113.其中所述生物样品均包含从中获得的外泌体和/或多肽,
114.其中在第一时间点和第二时间点之间的间隔内给所述受试者施用了药物,
115.其中与第一生物样品中相应的生物标志物水平相比,第二生物样品中一种或多种所述生物标志物水平的增加指示药物缺乏功效,以及
116.其中与第一生物样品中相应的生物标志物水平相比,第二生物样品中一种或多种所述生物标志物水平的降低指示药物具有功效。
117.在步骤(a)和(b)中获得的生物样品必须是直接可比的,即生物样品二者必须是相同类型的(例如,二者都是血液样品),并且随后以相同的方式处理。例如,第一时间点可能
处于肺癌的早期阶段(例如ia期、ib期、iia期或iib期)。第二时间点可能在肺癌的晚期(iii期或iv期)。
118.在另一个实施方案中,本发明提供了一种治疗受试者肺癌的方法,该方法包括以下步骤:
119.(a)通过本发明的方法获得受试者中肺癌存在的指示;以及
120.(b)如果获得受试者中肺癌的存在的指示,则对所述受试者施用适合于治疗肺癌的治疗,从而治疗所述受试者中的肺癌。
121.在另一个实施方案中,本发明提供了一种治疗受试者肺癌的方法,该方法包括以下步骤:
122.(a)对所述受试者施用适合治疗肺癌的治疗,其中,在施用之前,已经通过本发明的方法获得了所述受试者中肺癌的存在的指示。
123.横向流动装置(lfd)通常用于测试液体样品(如唾液、血液或尿液)中是否存在分析物。横向流动装置的例子包括家庭怀孕测试、家庭排卵测试、其他激素测试、特定病原体测试和特定药物测试。例如,ep 0291194描述了用于进行妊娠试验的横向流动装置。
124.横向流动装置的特征在本领域是公知的。例如,可以参考以下,其描述了横向流动装置的一般特征,包括其生产方法,以及连接可检测标签和固定试剂的方法:ep2453242、us2015176050、wo 2020/049444、us2020/0023354 a1、jp 2019023647 a、ep 0291194 a1、wo 2020/033235a1、wo2019122816(a1)、wo 2019/023597、us2020132693 a1、wo 2020/041267a2、us2018/372733(a1)、us2018/133343(a1)、us2016017065(a1),其内容均通过引用具体并入本文。
125.横向流动装置通常包括一个或多个以下离散区(a)-(c),以及任选地(d)和(e),它们彼此流体连通,任选地按此顺序。
126.(a)样品接收区。该区接收包含待测试分析物(生物标志物)的测试样品。
127.样品接收区可以包含尺寸排阻区或可以在尺寸排阻区之前(即尺寸排阻区可以在样品接收区之前或是样品接收区的一部分)。在一些实施方案中,尺寸排阻区可以在检测区之前或是检测区的一部分。
128.尺寸排阻区包含一个区域,其中来自生物样品的外泌体基于外泌体大小与样品的其他组分(例如细胞)分离。尺寸排阻区允许基于外泌体大小的外泌体通过。
129.例如,尺寸排阻区可以是仅允许最大尺寸为30nm-150nm(例如30nm-70nm、70nm-100nm或100nm-150nm)的外泌体通过的区域。
130.例如,尺寸排阻区可以包含孔径为30nm-150nm(例如30nm-70nm、70nm-100nm或100nm-150nm)的多孔凝胶材料。
131.合适的多孔凝胶材料的实例包括多糖树脂、蔗糖、葡聚糖、二氧化硅基多孔材料、聚丙烯酰胺凝胶、琼脂糖、纤维素或其组合。优选地,这些材料的孔径为30nm-150nm。
132.在一些实施方案中,将样品直接施加到检测区上,并且可以将转移流体(无样品)施加到样品接收区。在这样的实施方案中,如上文所述,检测区可以包含尺寸排阻区或在其之前有尺寸排阻区。
133.(b)缀合区。该区包含分析物(生物标志物)的一种或多种第一特异性结合伴侣。每种第一特异性结合伴侣都与可检测的标签相连。第一特异性结合伴侣不固定在缀合区中;
它们能够被移动,即通过毛细管作用或活动的流体流动被输送到后续区。
134.标记的第一特异性结合伴侣在使用前保留(通常以干燥形式)在缀合区中,但可以随液体样品自由迁移(这导致它们的重构或活化)。例如,在基于多孔材料基板的lfd中,测试样品将被吸收在样品接收区,然后通过多孔材料被排出到缀合区。当缀合区的多孔材料湿润时,标记的第一特异性结合伴侣将自由结合分析物(如果存在),然后将它们运输到检测区。
135.因此,如果测试样品中存在任何分析物,则在缀合区中,第一特异性结合伴侣将与分析物结合。然后通过毛细管作用或活动的流体流动将液体样品排出到下一个区。
136.可以使用适当的转移流体(例如水溶液)将第一特异性结合伴侣转移到检测区,例如从样品接收区转移。
137.(c)检测区。该区可以包含分析物的一种或多种第二特异性结合伴侣。第二特异性结合伴侣是固定的,即它们不能通过液体测试样品的作用而被移动。通常,第二特异性结合伴侣不与可检测的标签相连。第二特异性结合伴侣可以包含与第一特异性结合伴侣相同或不同的分析物结合部分。
138.在一些实施方案中,检测区直接接收分析物(样品),并且分析物被固定在检测区中。在这样的实施方案中,不使用第二特异性结合伴侣。如上文所述,检测区可以包含尺寸排阻区。在这样的实施方案中,分析物(样品)中的外泌体在被固定在检测区之前通过尺寸排阻区。
139.第一结合伴侣和第二结合伴侣(当两者都存在时)可以参与“三明治”或“竞争”测定。
140.(d)任选地,横向流动装置可以包含对照区,其为结合反应提供阳性或阴性对照。例如,对照区可以包含固定的滋养层糖蛋白(tpgb)。
141.(e)任选地,横向流动装置可以包含吸收区。它充当液体样品和/或转移液的水槽。
142.液体样品通常通过毛细管作用(或“芯吸”)通过本发明的装置(例如横向流动装置、垂直流动装置或微流体装置)被排出,或主动输送(例如使用泵)到下一个区。
143.在本发明的所有实施方案中,可以使用适当的转移流体(例如水溶液)在区域之间转移部分(例如生物样品或第一特异性结合伴侣或第二特异性结合伴侣)。因此,本发明的方法还可以包含将转移流体施加到本文所述的任何区的步骤。
144.在一些实施方案中,样品通过活动的流体流动(转移流体,其可以包含生物样品或外泌体)从样品或液体接收区输送到随后的区,或从一个区输送到另一个区。
145.例如,可以使用泵(例如机械泵)以运输可能包含生物样品或外泌体的转移流体。这种泵可以用于增加转移流体的流速和/或外泌体分离的速度。该泵可以位于装置内的任何适当位置,例如装置末端(例如最后一个区或水槽之后)。
146.在一个实施方案中,横向流动装置包括离散区(a)-(c)和任选地(d)和(e),它们按此顺序彼此流体连通。在本实施方案中,将样品施加到样品接收区(a)。
147.在另一个实施方案中,横向流动装置包含区(a)、(b)、(c)以及任选地(d)和(e),它们按此顺序彼此流体连通。在本实施方案中,将样品直接施加到检测区(c),并将适当的转移流体施加到样品接收区(a)。
148.以这种方式,生物样品或转移流体从样品接收区(或转移流体接收区),通过缀合
区进入检测区,并任选地通过对照区和/或吸收区。在一个实施方案中,lfd可以包含多孔平面基板或固体载体,其包括如本文所定义的一个或多个离散区。
149.在一种简单形式中,lfd(或多孔平面基板或固体载体)包括多孔条或色谱条,其包括一个或多个离散区(如本文所定义),液体测试样品可以通过毛细管作用或主动运输沿着该区域排出。
150.例如,该条可以是纸、硝酸纤维素、聚偏二氟乙烯、尼龙或聚醚砜。这种条的使用在本领域是公知的。
151.在其他的实施方案中,lfd包括与一个或多个离散区(例如如上文所述的(a)-(e))和在它们之间进行流体连通的具有一个或多个流动路径或通道的装置。该装置可以是垂直流动装置或微流体装置。它还可以包括泵,即在区之间移动流体。
152.典型的lfd包括一个由防潮固体材料(可能是不透明或透明的,但通常在检测和对照区包括视觉可读部分)构成的空心外壳,该外壳包括一个干燥的多孔载体,该载体直接或间接与外壳外部连通,以便于液体测试样品可以施加在样品接收区多孔载体上,并运输到其他区。
153.垂直流动装置通常与横向流动装置具有一个或多个共同特征,其中流体转移通常是通过重力(与毛细管芯吸相反)。或者,垂直流动装置可以包括泵(例如在装置的末端)以帮助转移流体的流动。垂直流动装置可以包括以下一个或多个或所有区域:
154.(a)样品接收区。该区接收包含待测试分析物(例如液体样品)的测试样品。
155.然后通过重力将液体样品(例如血浆或原始外泌体样品)排出到下一个区。
156.(b)外泌体分离区。该区将外泌体与其他细胞囊泡分开,例如通过尺寸排阻色谱,例如通过30nm-70nm多孔材料,允许外泌体通过。
157.(c)检测区。该区可以包含分析物的一种或多种第二特异性结合伴侣。第二特异性结合伴侣是固定的,即它们不能通过液体测试样品的作用而被移动。通常,这些第二特异性结合伴侣不与可检测的标签相连。
158.检测区中外泌体的存在可以通过使用第一特异性结合伴侣来确定。第一特异性结合伴侣可能对生物标志物或外泌体具有特异性。或者,可以使用一般的检测手段,例如银染。
159.因此,在另一个实施方案中,本发明提供了一种获得受试者中肺癌的存在的指示的方法,该方法包括以下步骤:
160.(a)将从所述受试者获得的生物样品固定在固体载体上的检测区;
161.(b)将所述固体载体(优选所述检测区)与一种或多种第一特异性结合伴侣接触,其中每种第一特异性结合伴侣特异性结合选自由pld3多肽、mage4a多肽、gage2d多肽、mtap多肽和uchl1多肽组成的组的生物标志物,并且其中每种第一特异性结合伴侣与可检测标签连接;以及
162.(c)检测所述检测区中存在或不存在结合标签,
163.其中所述检测区中结合标签的存在指示受试者中存在肺癌。
164.在本文提到的固体载体和横向流动装置或垂直流动装置中,与第一特异性结合伴侣连接的可检测标签可以相同或不同。
165.因此,在另一个实施方案中,本发明提供了一种获得受试者中肺癌的存在的指示
的方法,该方法包括以下步骤:
166.(a)将从所述受试者获得的生物样品与固体载体接触,
167.其中所述固体载体包括检测区,该检测区包括针对选自由pld3多肽、mage4a多肽、gage2d多肽、mtap多肽和uchl1多肽组成的组的一种或多种生物标志物的一种或多种(例如1、2、3、4或5种)固定的特异性结合伴侣;以及
168.(b)检测所述检测区中存在或不存在结合的特异性结合伴侣,
169.其中所述检测区中结合的特异性结合伴侣的存在指示受试者中存在肺癌。
170.例如,固体载体可以包括与检测区流体连通的样品接收区。样品可以通过主动流体转移或被动流体转移(有或没有使用转移流体)从样品接收区移动到检测区。
171.特异性结合伴侣优选是对生物标志物之一具有独立特异性的抗体。检测区中结合的特异性结合伴侣的存在可以通过例如标记的二抗来检测。(如在该上下文中所用,术语“结合的特异性结合伴侣”是指与抗原(例如pld3多肽、mage4a多肽、gage2d多肽、mtap多肽或uchl1多肽)结合的特异性结合伴侣(例如抗体))。
172.本发明还提供了固定一种或多种(例如1、2、3、4或5种)第一特异性结合伴侣的固体载体,其中每种第一特异性结合伴侣特异性结合选自由pld3多肽、mage4a多肽、gage2d多肽、mtap多肽和uchl1多肽组成的组的生物标志物。在一些实施方案中,生物标志物选自由pld3和mtap组成的组。优选地,生物标志物处于其呈现在肺癌外泌体上的构型。
173.在另一个实施方案中,本发明提供了一种获得受试者中肺癌的存在的指示的方法,该方法包括以下步骤:
174.(a)将包括缀合区和检测区的横向流动装置、垂直流动装置或微流体装置与从所述受试者获得的生物样品接触,其中
175.(i)所述缀合区包含一种或多种第一特异性结合伴侣,其中每种第一特异性结合伴侣特异性结合选自由pld3多肽、mage4a多肽、gage2d多肽、mtap多肽和uchl1多肽组成的组的生物标志物,其中每种第一特异性结合伴侣与可检测的标签结合,并且其中所述第一特异性结合伴侣不固定在所述缀合区中;以及
176.(ii)将所述生物样品施加到所述检测区,
177.以及
178.(b)检测所述检测区中结合标签的存在或不存在,其中所述检测区中结合标签的存在指示所述受试者中存在肺癌。
179.生物样品固定在检测区。
180.检测区和缀合区是流体连通的。
181.样品可以通过主动流体转移或被动流体转移(有或没有转移流体)从缀合区移动到检测区。
182.本文公开的任意装置还可以包括尺寸排阻区以实现外泌体的分离和/或包括泵以帮助流体转移。
183.本发明还提供了一种包括缀合区和检测区的横向流动装置、垂直流动装置或微流体装置,其中
184.(i)缀合区包含一种或多种第一特异性结合伴侣,其中每种第一特异性结合伴侣特异性结合选自由pld3多肽、mage4a多肽、gage2d多肽、mtap多肽和uchl1多肽组成的组的
生物标志物,
185.其中每种第一特异性结合伴侣结合到可检测的标签上,和
186.其中所述第一特异性结合伴侣未固定在所述缀合区中;以及
187.(ii)检测区适于接收生物样品。
188.缀合区和检测区是流体连通的。
189.优选地,其中横向流动装置、垂直流动装置或微流体装置包括:
190.(a)转移流体接收区,向其施加水溶液或能够被施加水溶液;
191.(b)缀合区,如上文所定义;
192.(c)检测区,向其施加生物样品或能够被施加生物样品;
193.以及任选地以下一者或两者:
194.(d)对照区,和
195.(e)吸收区,
196.其中,当存在上述区时,以上述顺序(流体)连通连接。
197.该装置还可以包括(a)和(b)之间的尺寸排阻区。
198.横向流动装置、垂直流动装置或微流体装置还可以包括外泌体分离区,其与检测区(之前)连接(在流体连通中)。在该实施方案中,施加到流体接收区的转移流体被携带到缀合区;缀合区中的第一特异性结合伴侣被携带到检测区中,如果检测区中存在任何选定的生物标志物,则它们将在那里与生物样品结合。任选地,首先将生物样品施加到外泌体分离区,在那里分离外泌体,然后将其传递至检测区。
199.在另一个实施方案中,本发明提供了一种获得受试者中肺癌的存在的指示的方法,该方法包括以下步骤:
200.(a)将包括缀合区和检测区的横向流动装置、垂直流动装置或微流体装置与从所述受试者获得的生物样品接触,其中
201.(i)所述缀合区包含一种或多种第一特异性结合伴侣,其中每种第一特异性结合伴侣与可检测的标签结合,
202.其中所述第一特异性结合伴侣未固定在所述缀合区中;以及
203.(ii)所述检测区包含一种或多种第二特异性结合伴侣,其中每种第二特异性结合伴侣固定在所述检测区中,
204.其中所述第一特异性结合伴侣和/或所述第二特异性结合伴侣各自特异性结合选自由pld3多肽、mage4a多肽、gage2d多肽、mtap多肽和uchl1多肽组成的组的生物标志物,
205.并且其中不特异性结合所述生物标志物之一的第一特异性结合伴侣或第二特异性结合伴侣结合存在于外泌体中的配体;以及
206.(b)检测所述检测区中存在或不存在结合标签,
207.其中所述检测区中结合标签的存在指示受试者中存在肺癌。
208.缀合区和检测区是流体连通的。
209.本发明还提供了一种包括缀合区和检测区的横向流动装置、垂直流动装置或微流体装置,其中
210.(a)所述缀合区包含一种或多种第一特异性结合伴侣,
211.其中每种第一特异性结合伴侣与可检测的标签连接,并且其中所述第一特异性结
合伴
212.侣未固定在所述缀合区中;
213.(b)所述检测区包含一种或多种第二特异性结合伴侣,其中所述第二特异性结合伴侣固定在所述检测区中,
214.其特征在于,所述第一特异性结合伴侣和/或所述第二特异性结合伴侣各自特异性结合选自由pld3多肽、mage4a多肽、gage2d多肽、mtap多肽和uchl1多肽组成的组的生物标志物。
215.缀合区和检测区是流体连通的。
216.优选地,横向流动装置、垂直流动装置或微流体装置包括:
217.(a)样品接收区,向其施加样品或能够被施加生物样品;
218.(b)缀合区,其中每种第一特异性结合伴侣与可检测的标签连接,并且其中所述第一特异性结合伴侣未固定;
219.(c)检测区,其中所述第二特异性结合伴侣固定在所述检测区中;
220.以及任选地以下一者或两者:
221.(d)对照区,和
222.(e)吸收区,
223.其中上述区域(当存在时)以上述顺序(流体)连通连接。
224.横向流动装置,垂直流动装置或微流体装置还可以包括外泌体分离区,其与样品接收区(之前)或样品接收区和缀合区之间连接(在流体连通中)。
225.在该实施方案中,施加到样品接收区的生物样品被携带到缀合区(例如通过转移流体)。任选地,首先将生物样品施加到外泌体分离区,在那里分离外泌体,然后将其传递到样品接收区。一种或多种第一特异性结合伴侣可以与缀合区中生物样品中的生物标志物结合以形成样品/第一结合伴侣复合物。这些结合复合物被携带到检测区(例如通过转移流体)。在检测区,这些结合复合物可能与固定的第二特异性结合伴侣结合。这样,可检测标签在检测区域中结合,在那里可以检测到它。
226.转移流体可以包含生物样品。生物样品将为液体形式,优选为水溶液。转移流体和/或生物样品可以另外包含药学上可接受的稀释剂、载体或赋形剂。转移流体和/或生物样品还可以包含合适的量和浓度的缓冲液、盐、表面活性剂和/或封闭剂。这些可以用于增强本发明方法的灵敏度和/或特异性。
227.待测试的分析物(即生物样品)可以是包含或怀疑包含pld3多肽、mage4a多肽、gage2d多肽、mtap多肽和uchl1多肽中的一种或多种的分析物。
228.实际上,将从受试者获得生物样品,然后可以任选地以分离形式或通过本发明的装置分离从其获得的外泌体和/或多肽(作为分析物)进行测试。
229.每种第一特异性结合伴侣优选是与可检测标签连接的多肽结合部分。
230.多肽结合部分可以是特异性多肽结合部分或非特异性多肽结合部分。
231.在一些实施方案中,每种第一特异性结合伴侣是抗体或其抗原结合部分,其特异性结合本文所定义的生物标志物之一。
232.在一些实施方案中,每种第二特异性结合伴侣是抗体或其抗原结合部分,其特异性结合本文所定义的生物标志物之一。
233.在一些实施方案中,不特异性结合所述生物标志物之一的第一特异性结合伴侣或第二特异性结合伴侣可以结合通常存在于外泌体中的配体或一般的多肽。在这样的实施方案中,优选第一特异性结合伴侣特异性结合所述生物标志物之一。
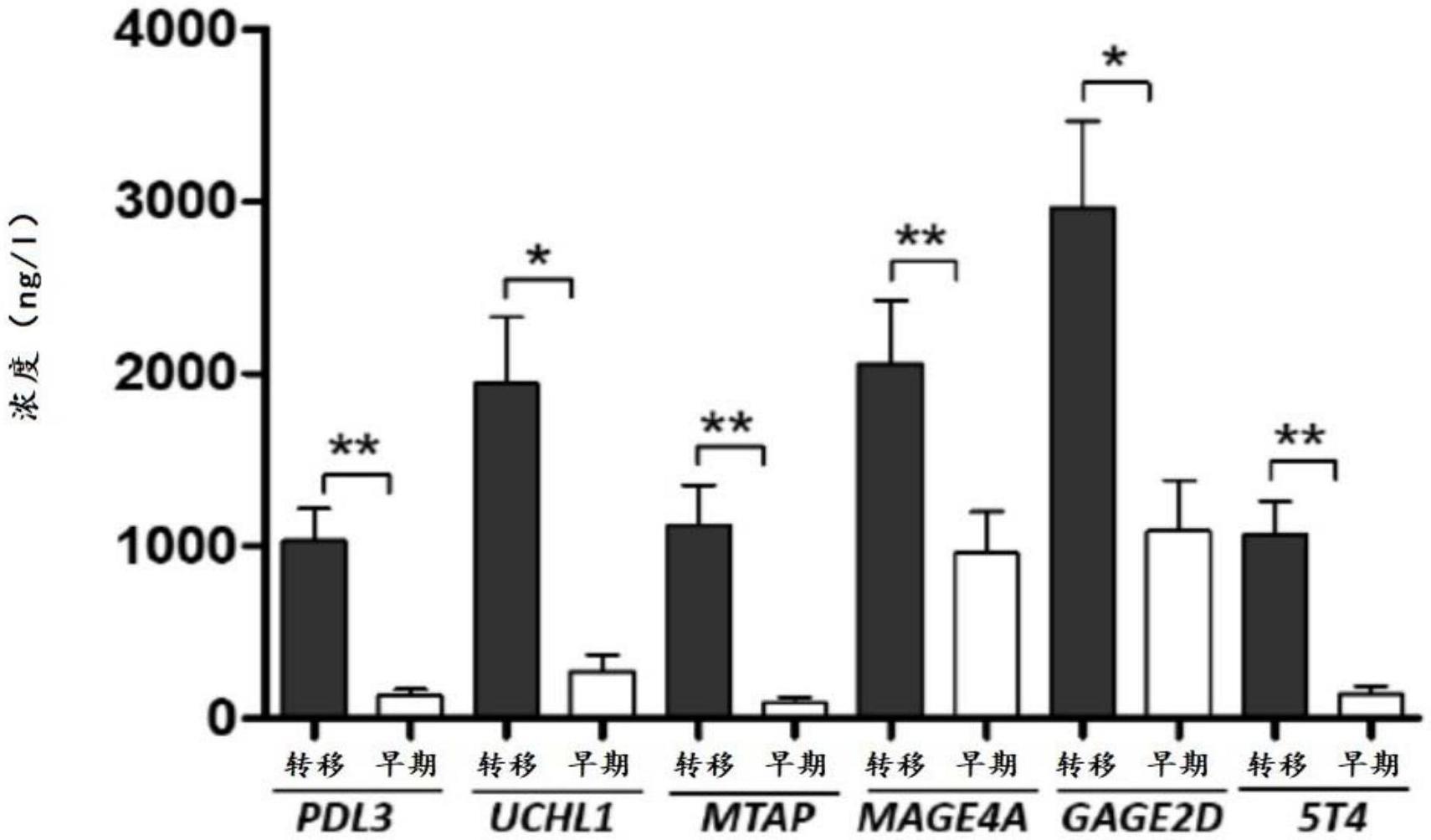
234.如果第一特异性结合伴侣或第二特异性结合伴侣/分析物复合物结合在检测区中,则标签有助于检测分析物(样品)。例如,标签可以选自由荧光标签、染料标签、酶报告基因、生物素、表位标签、金属纳米颗粒、碳、有色乳胶纳米颗粒、磁珠、荧光珠和有色聚苯乙烯珠组成的组。在一些实施方案中,可检测的标签是第一特异性结合伴侣或第二特异性结合伴侣的区域,例如抗体fc结构域,其可通过使用二抗来检测。优选地,标签是光学可检测的标记(即通过肉眼可检测)。在一些实施方案中,标签是磁珠。
235.在一些实施方案中,标签具有已知的密度值;这可以促进检测区中标志物的定量。
236.可检测的标签可以是多价支架。如本文所用,术语“多价支架”是指本文所公开的多个接头可以化学连接或锚定的载体。多价支架的实例包括纳米颗粒,超支化聚合物和环糊精。
237.优选地,方法步骤按照指定的顺序实施。
238.本文所述的每个参考文献的公开内容通过引用以其整体具体并入本文。
附图说明
239.图1:肺癌特异性表面外泌体抗原的横向流动(图1a)检测装置和垂直流动(图1b)检测装置的实例。
240.图2:
241.a、h1299细胞的纳米粒子追踪分析(nta)显示了从条件培养基中分离的外泌体的大小分布。
242.b、外泌体表面蛋白的蛋白质印迹分析。用胰蛋白酶处理外泌体以切割表面蛋白后,收集上清液并通过doc/tca暴露以沉淀切割的蛋白。
243.c、外泌体表面蛋白的免疫沉淀(ip)并通过蛋白质印迹技术进行分析。
244.d、肺癌外泌体的elisa分析。在晚期(iv和iii)具有转移性扩散(标记为“扩散”)和在早期(i,ii)没有转移性扩散(标记为“早期”)的肺癌患者血浆中分离外泌体后,外泌体表面蛋白的浓度。
245.e、肺癌外泌体的外泌体标志物cd9和cd81的elisa分析。加入纤连蛋白作为阳性对照。
具体实施方式
246.实施例
247.本发明通过以下实施例进一步说明,除非另有说明,其中的份数和百分比均以重量计,温度是摄氏度。应当理解,这些实施例虽然为本发明的优选实施方案,但仅以说明的方式给出。从以上讨论和这些实施例中,本领域技术人员可以确定本发明的基本特征,并且在不脱离其精神和范围的情况下,可以对本发明进行各种变化和修改以使其适应各种用途和条件。因此,根据前面的描述,除了本文所示和描述的那些之外,本发明的各种修改对于本领域技术人员来说将是显而易见的。这样的修改也旨在落入所附权利要求的范围内。
248.以下材料和方法用于以下一个或多个实施例。
249.材料和方法
250.外泌体的分离
251.h1299细胞(1x107个细胞/条件)在补充有0.1%(v/v)fbs(通过以100000xg过夜离心耗尽牛外泌体和细胞外囊泡)、2mm谷氨酰胺和100u/ml青霉素/链霉素的dmem中生长指定的时间,长达3天。收集条件培养基,并通过使用ultraclear thinwall管在optima xpn-80(beckman coulter)超速离心机中以2000xg40分钟、10000xg60分钟、100000xg1.5小时的连续超速离心来分离ev。将外泌体在1ml pbs中洗涤一次,并通过在optima max-xp超速离心机(beckman coulter)中以100000xg离心80分钟进行纯化。
252.将来自肺癌患者的临床样品的血浆以2500xg离心15分钟,然后通过0.8μm过滤器过滤,并以10000xg离心40分钟。将预先清洁的ev通过0.22μm过滤器过滤,并使用ultraclear thinwall管在optima xpn-80(beckman coulter)超速离心机中以100000xg离心1.5小时。通过使用izon柱(孔为35nm)并再次使用ultraclear thinwall管在optima xpn-80(beckman coulter)超速离心机中以100.000xg离心80分钟,通过尺寸排阻色谱法进一步分离外泌体。使用microbca测定法(thermo scientific并用于进一步分析)测量两种外泌体(来自细胞培养和临床样品)的蛋白质水平。
253.纳米粒子跟踪分析(nta)
254.在开始分析之前,通过在1ml pbs(gibco)中移液大力重悬总外泌体沉淀,并保存在冰上。
255.在开始任何测量之前,通过使用1ml注射器将蒸馏水加载到注射泵上并将液体压入nanosight的流通池顶板,将nanosight ns300(malvern panalytical)洗涤三次。pbs用于引发仪器并控制稀释剂的纯度(即溶液中不存在颗粒或存在浓度低于可检测水平的颗粒)。引发后,将1ml样品小心地加载到注射泵上。每次测量都是在注射泵的帮助下自动完成的,并且在nta 3.2软件上生成了数据采集脚本。一旦将每个样品加载到腔室中,就会自动进行三次60分钟的记录,并手动调整溶液中颗粒的焦点。
256.wb和ip的样品制备
257.h1299外泌体重悬于pbs中,并在37℃下用胰蛋白酶处理或不处理30分钟。处理后,将外泌体以100000xg超速离心80分钟以将外泌体与切割的表面蛋白分离。通过用脱氧胆酸钠/三氯乙酸(doc/tca)处理以沉淀蛋白质来暴露收集的上清液(含有裂解的表面外泌体蛋白)。(简而言之,将样品与2%脱氧胆酸钠在室温下孵育15分钟,然后用24%三氯乙酸处理。样品离心,沉淀用冷丙酮洗涤两次,并重悬于1xpbs中。)
258.将外泌体和沉淀的上清液重悬于pbs中,用于使用针对某些表面蛋白的特异性抗体的蛋白质印迹分析或免疫沉淀。
259.sds-page和蛋白质印迹
260.将外泌体和沉淀的上清液重悬于pbs中。然后将样品在100℃下煮沸10分钟。将样品用1x上样缓冲液(thermo scientific)标准化,以便每个实验达到相等的上样量。将蛋白质样品上样到凝胶上,并使用预制凝胶(10%或4%-12%)(thermo scientific)通过sds-page分离。将蛋白质转移到pvdf膜上,封闭并与一抗在含有稀释的3%脱脂牛奶的pbs-tween 20中孵育。将二抗在3%脱脂牛奶中孵育。膜被
thermoscientific,millipore或ge healthcare的ecl溶液覆盖,然后曝光膜(fujifilm)并在xograph显影剂中显影。
261.间接elisa
262.将分离的外泌体(1μg/ml)在ph 9.4的碳酸盐缓冲液中稀释,并在4℃下在微量滴定板上包被过夜。在室温下充分洗涤并封闭1小时后,将外泌体与一抗(1μg/ml)在室温下孵育2小时。洗涤后,将外泌体与二抗在室温下孵育1小时,然后洗涤并在室温下在黑暗中和tmb底物孵育30分钟。通过加入终止溶液终止hrp反应,并在酶标仪上在450nm处读取od。通过graphpad软件计算来自人肺癌血浆的外泌体中蛋白质的浓度。统计数据通过student’st检验计算,显著性p值≤0.05。
263.实施例1:肺癌外泌体生物标志物的鉴定
264.我们通过lc-ms/ms外泌体蛋白质分析鉴定了22种蛋白质,这些蛋白质对肺癌细胞系(h1299)具有特异性,而在其他类型的癌细胞系中未检测到。
265.为了表征我们鉴定的蛋白质是否定位于肺癌外泌体的表面,通过nta分析验证分离的外泌体以确认其大小(图2a),然后进行胰蛋白酶处理以从其表面切割蛋白质。
266.为了增加外泌体表面蛋白的浓度,胰蛋白酶处理后的上清液中的蛋白质通过doc/tca沉淀,并通过蛋白质印迹进行验证。在沉淀的样品中鉴定出五种肺癌特异性蛋白(图2b):mage4a、gage2d、mtap、pld3和uchl1。胰蛋白酶消化后,外泌体的所有这些蛋白质的表达都大大降低,证实这些蛋白质是从外泌体表面蛋白水解切割(释放)的。
267.有趣的是,蛋白质印迹分析未检测到对照外泌体(pbs)中uchl1和pld3蛋白的任何表达,表明它们的浓度低于该方法的检测限(图2b)。
268.这些结果清楚地表明,鉴定出的蛋白质位于外泌体表面,这些标志物可用于快速诊断测试,以精确准确地检测肺癌样品中甚至低浓度的蛋白质。
269.实施例2:生物标志物的免疫沉淀
270.为了进一步证实我们的结果,我们再次用或不用胰蛋白酶处理外泌体,然后用对鉴定的表面蛋白特异的抗体免疫沉淀切割的蛋白。与胰蛋白酶处理的外泌体相比,酶处理后并用doc/tca溶液沉淀的对照样品和上清液显示出所有表面标志物的表达(图2c)。有趣的是,pld3表达再次仅在doc/tca沉淀的上清液中可检测到,这表明doc/tca溶液对于增加一些低丰度蛋白质的浓度很重要。
271.这些结果清楚地表明,鉴定出的蛋白质位于外泌体表面。因此,这些蛋白质可以用作快速诊断测试中的标志物,以精确准确地检测肺癌样品中甚至低浓度的蛋白质。
272.实施例3:测定来自早期(i-ii)和晚期转移(iii-iv)阶段肺癌患者的外泌体中的外泌体肺癌特异性生物标志物。
273.为了研究体外鉴定的特异性肺癌生物标志物(图2b,2c)是否存在于肺癌患者液体活检的外泌体中,我们从i-iv期肺癌患者和分离的外泌体中收集了5ml血浆。结果清楚地表明,不仅来自肺癌患者外泌体中存在肺癌特异性生物标志物,而且早期和具有转移性扩散的晚期之间存在显著差异(图2d)。不同浓度的已鉴定的肺癌特异性蛋白证实了它们作为潜在的外泌体生物标志物的作用,其能够区分无转移患者的肺癌早期阶段和发展为肺癌转移性疾病的患者。通过一般外泌体标志物cd9、cd81和纤连蛋白作为阳性对照证实了从液体活检中分离的外泌体(图2e)。
274.参考文献
275.bebelman,m.p.,smit,m.j.,pegtel,d.m.,baglio,s.r.,2018.biogenesis and function of extracellular vesicles in cancer.pharmacol.ther.188,1
–
11.https://doi.org/10.1016/j.pharmthera.2018.02.013
276.cazzoli,r.,buttitta,f.,di nicola,m.,malatesta,s.,marchetti,a.,pass,h.i.,2013.micrornas derived from circulating exosomes as non-invasive biomarkers for screening and diagnose lung cancer.j.thorac.oncol.off.publ.int.assoc.study lung cancer 8,1156
–
1162.https://doi.org/10.1097/jto.0b013e318299ac32
277.cristiano,s.,leal,a.,phallen,j.,fiksel,j.,adleff,v.,bruhm,d.c.,jensen,s.medina,j.e.,hruban,c.,white,j.r.,palsgrove,d.n.,niknafs,n.,anagnostou,v.,forde,p.,naidoo,j.,marrone,k.,brahmer,j.,woodward,b.d.,husain,h.,van rooijen,k.l.,m.-b.w.,madsen,a.h.,van de velde,c.j.h.,verheij,m.,cats,a.,punt,c.j.a.,vink,g.r.,van grieken,n.c.t.,koopman,m.,fijneman,r.j.a.,johansen,j.s.,nielsen,h.j.,meijer,g.a.,andersen,c.l.,scharpf,r.b.,velculescu,v.e.,2019.genome-wide cell-free dna fragmentation in patients with cancer.nature 570,385
–
389.https://doi.org/10.1038/s41586-019-1272-6
278.devarakonda,s.,morgensztern,d.,govindan,r.,2015.genomic alterations in lung adenocarcinoma.lancet oncol.16,e342
–
e351.https://doi.org/10.1016/s1470-2045(15)00077-7
279.diehl,f.,schmidt,k.,choti,m.a.,romans,k.,goodman,s.,li,m.,thornton,k.,agrawal,n.,sokoll,l.,szabo,s.a.,kinzler,k.w.,vogelstein,b.,diaz,l.a.,2008.circulating mutant dna to assess tumor dynamics.nat.med.14,985
–
990.https://doi.org/10.1038/nm.1789
280.fan,h.,shao,z.-y.,xiao,y.-y.,xie,z.-h.,chen,w.,xie,h.,qin,g.-y.,zhao,n.-q.,2015.incidence and survival of non-small cell lung cancer in shanghai:a population-basedcohort study.bmj open 5,e009419.https://doi.org/10.1136/bmjopen-2015-009419
281.fan,t.w.m.,zhang,x.,wang,c.,yang,y.,kang,w.-y.,arnold,s.,higashi,r.m.,liu,j.,lane,a.n.,2018.exosomal lipids for classifying early and late stage non-small cell lungcancer.anal.chim.acta 1037,256
–
264.https://doi.org/10.1016/j.aca.2018.02.051
282.jakobsen,k.r.,paulsen,b.s.,r.,varming,k.,sorensen,b.s.,m.m.,2015.exosomal proteins as potential diagnostic markers in advanced non-small cell lungcarcinoma.j.extracell.vesicles 4.https://doi.org/10.3402/jev.v4.26659
283.johnstone,r.m.,adam,m.,hammond,j.r.,orr,l.,turbide,c.,1987.vesicle formationduring reticulocyte maturation.association of plasma membrane activities with released vesicles(exosomes).j.biol.chem.262,9412
–
9420.
vesicles.pharmacol.rev.64,676
–
705.https://doi.org/10.1124/pr.112.005983
295.vanni,i.,alama,a.,grossi,f.,dal bello,m.g.,coco,s.,2017.exosomes:a new horizonin lung cancer.drug discov.today 22,927
–
936.https://doi.org/10.1016/j.drudis.2017.03.004
296.wong,s.q.,li,j.,tan,a.y.-c.,vedururu,r.,pang,j.-m.b.,do,h.,ellul,j.,doig,k.,bell,a.,macarthur,g.a.,fox,s.b.,thomas,d.m.,fellowes,a.,parisot,j.p.,dobrovic,a.,2014.sequence artefacts in a prospective series of formalin-fixed tumours tested for mutationsin hotspot regions by massively parallel sequencing.bmc med.genomics 7,23.https://doi.org/10.1186/1755-8794-7-23
297.yamashita,t.,kamada,h.,kanasaki,s.,maeda,y.,nagano,k.,abe,y.,inoue,m.,yoshioka,y.,tsutsumi,y.,katayama,s.,inoue,m.,tsunoda,s.,2013.epidermal growthfactor receptor localized to exosome membranes as a possible biomarker for lung cancerdiagnosis.pharm.68,969
–
973.
298.zhang,r.,xia,y.,wang,z.,zheng,j.,chen,y.,li,x.,wang,y.,ming,h.,2017.serumlong non coding rna malat-1 protected by exosomes is up-regulated and promotes cellproliferation and migration in non-small cell lung cancer.biochem.biophys.res.commun.490,406
–
414.https://doi.org/10.1016/j.bbrc.2017.06.055
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。