1.本发明涉及细胞因子风暴抑制剂、细胞因子风暴抑制剂的使用方法和筛选方法。
背景技术:
2.《细胞因子风暴》
3.细胞因子是参与炎症反应和免疫应答的蛋白的总称,已知有数百种以上。细胞因子具有各种各样的活性,它们通过均衡协调地相互作用,维持或调节生物体功能。通常,通过对感染症等的免疫应答产生、释放细胞因子,但由于某些原因使得细胞因子的产生、释放变得无序,导致血液中的多种细胞因子浓度异常上升,结果有时会损伤生物体内的组织。将血液中的细胞因子浓度异常上升的状态称为细胞因子风暴(高细胞因子血症)。
4.作为细胞因子风暴的原因或产生细胞因子风暴的疾病,已知有感染症、给药、高度的手术侵袭、败血症、全身性炎症综合征(sirs)、弥漫性血管内凝血综合征(dic)、多脏器功能不全等。这些之中,第一原因是败血症,最近已知由于病毒血症、特别是covid-19而产生细胞因子风暴(非专利文献1;inflammation and regeneration(2020)40:14)。
5.在动物实验中,通过给予脂多糖(lps。内毒素)引起炎性细胞因子的浓度上升等败血症的症状,可诱导细胞因子风暴(非专利文献2:medical hypotheses(2020)144,109865)。
6.《现有的免疫抑制剂的问题》
7.作为抑制细胞因子风暴的方法,通过托珠单抗(tocilizumab,妥珠单抗)等抗白介素(il)-6抗体或类固醇等免疫抑制剂抑制炎性细胞因子等细胞因子量的方法广为人知。例如,非专利文献3(nature communications(2016)7:11498)中记载了:对给予了lps的小鼠给予抗il-6抗体时,在给予了对照的抗体的小鼠中从给予lps起96小时后小鼠全部死亡的条件下存活率为75%。
8.然而,使用抗il6抗体或类固醇等免疫抑制剂等抑制炎性细胞因子的方法不足以抑制细胞因子风暴,存在无法修复发生了细胞因子风暴的(附近的)组织的问题。因此,近年来人们认为即使利用免疫抑制剂治疗细胞因子风暴,也残留来自细胞因子风暴的后遗症。
9.现有技术文献
10.专利文献
11.专利文献1:日本专利第6327647号;
12.非专利文献
13.非专利文献1:inflammation and regeneration(2020)40:14;
14.非专利文献2:medical hypotheses(2020)144,109865;
15.非专利文献3:nature communications(2016)7:11498;
16.非专利文献4:stem cell rev and rep(2020)6:548-559);
17.非专利文献5:cell biosci(2020)10:22;
18.非专利文献6:antioxidants&redoxnsignaling(2020)33,2;
19.非专利文献7:stem cells and deveropment(2020),29,12,747-754;
20.非专利文献8:cytotheapy 00(may 2,2000)1-4;
21.非专利文献9:cells(2019)8,1605;
22.非专利文献10:front.bioeng.biotechnol.(2020),8:554;
23.非专利文献11:cells(2019)8,1240;
24.非专利文献12:j.neurochem.(2010)114,1569-1580;
25.非专利文献13:mol genet genomic med.(2019)7:e831。
技术实现要素:
26.发明所要解决的课题
27.需要说明的是,已知包含间充质干细胞的培养上清、即未分离的外来体等微小颗粒的组合物会抑制细胞因子相关的炎症。例如,专利文献1中记载了炎症性疾病的预防或治疗用组合物,其包含通过培养牙髓干细胞而得到的培养上清,所述炎症性疾病选自重症肝炎、急性肝炎、慢性肝炎、肝硬化、急性间质性肺炎、慢性间质性肺炎、肺纤维化、炎症性自身免疫疾病和缺血性心脏病。在专利文献1的[0033]中,作为炎症性疾病,记载了由对促炎性细胞因子应答的癌化学疗法诱发的休克(例如促炎性细胞因子相关休克)等全身性炎症。然而,在专利文献1中,对间充质干细胞的外来体未做探讨。
[0028]
本发明所要解决的课题在于:提供细胞因子风暴抑制剂,其可抑制与细胞因子风暴有关的多个细胞因子,并且可抑制由细胞因子风暴引起的组织损伤或者可修复在细胞因子风暴中损伤的组织。
[0029]
用于解决课题的手段
[0030]
《sod3与细胞因子风暴的关系》
[0031]
已知在ifnγ和tnf的存在下,细胞外超氧化物歧化酶(sod3)会减弱组织的损伤,减轻炎症(非专利文献4;stem cell rev and rep(2020)6:548-559)。
[0032]
已知msc分泌sod3,由msc分泌的sod3通过抗氧化作用和免疫调节可进行组织的修复(非专利文献5;cell biosci(2020)10:22),但对外来体没有记载。
33.在老年人的肺中形成sod3少的状态,暗示了这与来自细胞因子风暴的covid-19的重症化有关(非专利文献6;antioxidants&redox signaling(2020),33,2)。
[0034]
《msc外来体与细胞因子风暴的关系(没有sod3的暗示)》
[0035]
已知使用msc外来体来抑制细胞因子风暴,但并不知道sod3参与msc外来体的细胞因子抑制。
[0036]
例如,在非专利文献2(medical hypotheses(2020)144,109865)的摘要和第2页右栏中记载了:由脂肪、骨髓、脐带分离的间充质干细胞(msc)或由它们的培养上清分离的msc外来体会抑制炎性细胞因子、或修复在细胞因子风暴中损伤的组织的效果,但对sod3没有记载。
[0037]
在非专利文献1(inflammation and regeneration(2020)40:14)的第3页右栏~第4页左栏中记载了利用msc外来体进行的细胞因子风暴的抑制和治疗计划,但对sod3没有记载。
[0038]
在非专利文献7(stem cells and deveropment(2020),29,12,747-754)中记载了:来自骨髓的msc外来体对细胞因子风暴的下调,但对sod3没有描述。
[0039]
已知细胞因子风暴与covid-19肺炎有关、或者使用间充质干细胞(mesenchymal stem cell;msc)的细胞外小泡(外来体)的方法对covid-19感染症的治疗有效(非专利文献8;cytotheapy 00(may 2,2000)1-4),但对sod3没有记载。
[0040]
在非专利文献9(cells(2019)8,1605)中记载了:作为msc外来体抑制由给予lps而诱导的炎症的作用,通过递送mrna和mirna来激活自噬,抑制已损伤的组织的凋亡、坏死和氧化应激并促进再生,但对sod3没有记载。
[0041]
在非专利文献10(front.bioeng.biotechnol.(2020),8:554.)中记载了:细胞因子风暴状态的细胞或组织受到氧化应激,通过给予msc或外来体,除了可抑制炎症、抑制氧化应激,还可使肺再生,但对sod3没有记载。
[0042]
《利用msc外来体进行的组织修复(sod3和细胞因子风暴均未暗示)》
[0043]
在非专利文献11(cells(2019)8,1240)中,记载了msc外来体使损伤的肾脏再生,但对sod3或细胞因子风暴没有记载。
[0044]
《msc与sod3的关系(外来体和细胞因子风暴均未暗示)》
[0045]
在非专利文献12(j.neurochem.(2010)114,1569-1580)中记载了来自骨髓的msc所分泌的sod3保护神经细胞,但对外来体没有记载。
[0046]
在非专利文献13(mol genet genomic med.(2019)7:e831)中记载了通过高度表达sod3的msc抑制缺血性中风,但对外来体没有记载。
[0047]
《本发明中的新见解》
[0048]
本发明人发现了:来源于特定的间充质干细胞的培养上清的外来体等微小颗粒包含大量的细胞外超氧化物歧化酶(sod3),并且显示高的sod活性。
[0049]
而且,还发现了:不仅该微小颗粒本身会直接抑制通过给予lps而诱导的细胞因子风暴中的炎性细胞因子等,该微小颗粒中所含的sod3也会起到以下的协同效果:推进在细胞因子中在ifnγ和tnfα的存在下损伤的组织的修复,或者如果是在发生组织损伤之前则会抑制由细胞因子风暴导致的组织损伤。
[0050]
《作用机制的与现有的细胞因子风暴抑制剂不同、对老年人适用》
[0051]
迄今为止,已知在外来体中存在sod3蛋白。然而,本发明人首次发现的见解是:来源于特定的间充质干细胞的培养上清的外来体的sod3活性非常高,包括可修复因细胞因子风暴而损伤的组织的有效量以上。如果提出该见解,则无法想到可抑制与细胞因子风暴有关的细胞因子、并且可抑制由细胞因子风暴导致的组织损伤或者可修复在细胞因子风暴中损伤的组织的细胞因子风暴抑制剂,因此本发明的细胞因子风暴抑制剂的作用机制完全不同于现有的细胞因子风暴抑制剂。
[0052]
而且,预测到sod3少的老年人(非专利文献6;antioxidants&redox signaling(2020),33,2)因sod3少,故仅凭抑制细胞因子还无法进行组织的修复,但根据本发明,可显著地修复老年人在细胞因子风暴中损伤的组织,或者如果是在发生组织损伤之前,则可显著抑制由细胞因子风暴导致的组织损伤。
[0053]
为了解决上述课题进行了深入研究,其结果,本发明人发现了:来源于特定的间充质干细胞的培养上清的外来体等微小颗粒包含细胞外超氧化物歧化酶(sod3),并且显示高
sod活性。而且,本发明人发现了:通过使用该微小颗粒,可显著抑制与细胞因子风暴有关的多个细胞因子。
[0054]
具体而言,本发明和本发明的优选构成如下。
[0055]
[1]细胞因子风暴抑制剂,其是包含来源于来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞或它们的永生化干细胞的培养上清的微小颗粒的细胞因子风暴抑制剂,
[0056]
细胞因子风暴抑制剂不是培养上清,其不含来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞或它们的永生化干细胞,不含mcp-1,并且不含siglec-9,
[0057]
该细胞因子风暴抑制剂的用途为:对发生细胞因子风暴的人或人以外的动物在发生由上述细胞因子风暴导致的组织损伤之前给药,通过抑制细胞因子风暴来抑制上述细胞因子风暴导致的组织损伤;或者
[0058]
对发生由细胞因子风暴导致的组织损伤的人或人以外的动物给药,通过抑制细胞因子风暴来修复在细胞因子风暴中损伤的组织。
[0059]
[1-1]细胞因子风暴抑制剂,其包含来源于来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞或它们的永生化干细胞的培养上清的微小颗粒,
[0060]
微小颗粒包含可修复因细胞因子风暴而损伤的组织或细胞的有效量以上的细胞外超氧化物歧化酶(sod3),
[0061]
通过抑制细胞因子风暴来修复在细胞因子风暴中损伤的组织。
[0062]
[2][1]或[1-1]所述的细胞因子风暴抑制剂,其中,微小颗粒为外来体。
[0063]
[3][1]、[1-1]或[2]所述的细胞因子风暴抑制剂,其中,微小颗粒是由培养上清纯化的微小颗粒。
[0064]
[4][1]~[3]中任一项(包括[1-1]。下同)所述的细胞因子风暴抑制剂,其抑制细胞中或血液中的il-2、il-4、il-6、il-10、il-17、ifnγ和tnfα的任一种。
[0065]
[5][1]~[4]中任一项所述的细胞因子风暴抑制剂,其中,在对细胞因子风暴状态的人或人以外的动物给予细胞因子风暴抑制剂的情况下,与未给予细胞因子风暴抑制剂的情况相比提高存活率。
[0066]
[6][1]~[5]中任一项所述的细胞因子风暴抑制剂,其中,微小颗粒是每1mg微小颗粒包含1.0ng/mg以上的sod3。
[0067]
[7][1]~[6]中任一项所述的细胞因子风暴抑制剂,其中,sod3活性为0.3单位/μg以上。
[0068]
[8][1]~[7]中任一项所述的细胞因子风暴抑制剂,其包含0.01
×
108个/ml以上的微小颗粒。
[0069]
[9][1]~[7]中任一项所述的细胞因子风暴抑制剂,其包含2.0
×
109个/ml以上的微小颗粒。
[0070]
[10][1]~[9]中任一项所述的细胞因子风暴抑制剂,其中,来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞或来自脐带的干细胞是来自人牙髓的干细胞、来自人脂肪的干细胞、来自人骨髓的干细胞或来自人脐带的干细胞。
[0071]
[11][1]~[10]中任一项所述的细胞因子风暴抑制剂,其中,微小颗粒是来源于来
自牙髓的干细胞的培养上清的微小颗粒。
[0072]
[12][1]~[11]中任一项所述的细胞因子风暴抑制剂,其中,在细胞因子风暴中损伤的组织是肺组织。
[0073]
[13][1]~[12]中任一项所述的细胞因子风暴抑制剂,其中,来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞或来自脐带的干细胞以在微小颗粒中高度表达sod的方式被基因修饰。
[0074]
[14][1]~[13]中任一项所述的细胞因子风暴抑制剂,其包含抗il-6抗体和类固醇中的至少一者。
[0075]
[15][1]~[14]中任一项所述的细胞因子风暴抑制剂,其用途为:对于发生细胞因子风暴的人或人以外的动物,在发生由上述细胞因子风暴导致的组织损伤之前给药,通过抑制细胞因子风暴来抑制由上述细胞因子风暴导致的组织损伤,修复在细胞因子风暴中损伤的组织。
[0076]
[16][1]~[15]中任一项所述的细胞因子风暴抑制剂,其中,细胞因子风暴抑制剂为组织修复剂。
[0077]
[16-1][1]~[16]中任一项所述的细胞因子风暴抑制剂,其中,细胞因子风暴抑制剂不含从培养上清中去除了微小颗粒后的剩余物。
[0078]
[17]细胞因子风暴抑制剂的使用方法,其包括以下工序:
[0079]
对人或人以外的动物给予[1]~[16]和[16-1]中任一项所述的细胞因子风暴抑制剂,
[0080]
使人或人以外的动物的细胞中或血液中的细胞因子量减少,并且
[0081]
对于发生细胞因子风暴的人或人以外的动物,在发生由上述细胞因子风暴导致的组织损伤之前给药,通过抑制细胞因子风暴来抑制由上述细胞因子风暴导致的组织损伤的工序;或
[0082]
对发生了由细胞因子风暴导致的组织损伤的人或人以外的动物给药,通过抑制细胞因子风暴来修复在细胞因子风暴中损伤的组织的工序。
[0083]
[18][17]所述的细胞因子风暴抑制剂的使用方法,其中,将细胞因子风暴抑制剂与抗il-6抗体和类固醇中的至少一种并用。
[0084]
[19]对通过抑制细胞因子风暴来修复在细胞因子风暴中损伤的组织的组织修复有效的因子或其组合的筛选方法,具备以下工序:
[0085]
将通过培养来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞或它们的永生化干细胞而得到的培养上清中所含的1种或2种以上的成分供给至有关细胞外超氧化物歧化酶(sod3)的评价系统,评价有关sod3的特性。
[0086]
[20]细胞因子风暴抑制剂,其是包含通过[19]所述的筛选方法评价关于sod3的特性而获得的成分的细胞因子风暴抑制剂,
[0087]
该成分来源于来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞或它们的永生化干细胞的培养上清,
[0088]
该成分包含可修复因细胞因子风暴而损伤的组织或细胞的有效量以上的细胞外超氧化物歧化酶(sod3),
[0089]
细胞因子风暴抑制剂不是培养上清,其不含来自牙髓的干细胞、来自脂肪的干细
胞、来自骨髓的干细胞、来自脐带的干细胞或它们的永生化干细胞,不含mcp-1,并且不含siglec-9,
[0090]
该成分满足:每1mg的上述成分包含1.0ng/mg以上的sod3和sod3活性为0.3单位/μg以上中的至少一者,
[0091]
该细胞因子风暴抑制剂的用途为:对于发生细胞因子风暴的人或人以外的动物,在发生由上述细胞因子风暴导致的组织损伤之前给药,通过抑制细胞因子风暴来抑制由上述细胞因子风暴导致的组织损伤;或者
[0092]
对发生由细胞因子风暴导致的组织损伤的人或人以外的动物给药,通过抑制细胞因子风暴来修复在细胞因子风暴中损伤的组织。
[0093]
发明效果
[0094]
根据本发明,可提供细胞因子风暴抑制剂,其可抑制与细胞因子风暴有关的多个细胞因子,并且可抑制由细胞因子风暴导致的组织损伤或者可修复在细胞因子风暴中损伤的组织。
附图说明
[0095]
[图1]图1是显示各实施例的细胞因子风暴抑制剂或用作对照的dmem培养基的sod3的蛋白量的图。
[0096]
[图2]图2是显示对于给予了脂多糖(lps)的小鼠,在给予1次各实施例的细胞因子风暴抑制剂或用作对照的生理盐水(pbs对照)的情况下,lps给药后的经过时间与存活率的关系的曲线图。
[0097]
[图3]图3是显示对于给予了lps的小鼠,在给予2次各实施例的细胞因子风暴抑制剂或pbs对照的情况下,lps给药后的经过时间与存活率的关系的曲线图。
[0098]
[图4]图4是显示对于给予了lps的小鼠,在给予2次实施例1的细胞因子风暴抑制剂、来自牙髓的干细胞的培养上清或pbs对照的情况下,lps给药后的经过时间与存活率的关系的曲线图。
[0099]
[图5]图5是显示对于给予了lps的小鼠,在给予实施例1的细胞因子风暴抑制剂、来自牙髓的干细胞或pbs对照的情况下,lps给药后的经过时间与存活率的关系的曲线图。
[0100]
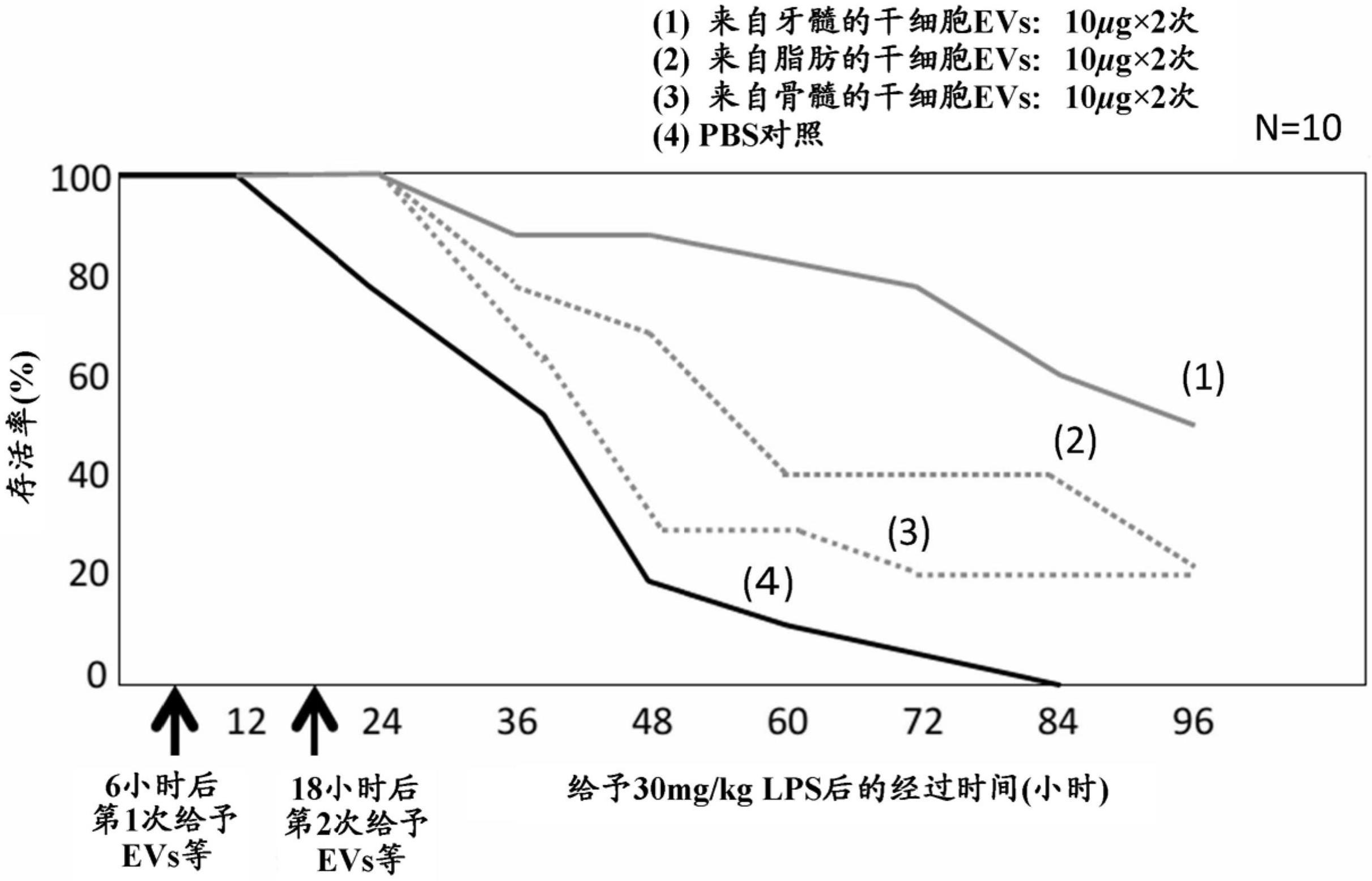
[图6]图6是显示对于给予了lps的小鼠,在lps给药起6小时后和18小时后2次给予实施例1的细胞因子风暴抑制剂、来自牙髓的干细胞的培养上清或pbs对照的情况下,lps给药后的经过时间与存活率的关系的曲线图。
[0101]
[图7]图7是显示对于给予了lps的小鼠,在0小时后和12小时后2次给予实施例1的细胞因子风暴抑制剂、来自牙髓的干细胞的培养上清或pbs对照的情况下,lps给药后的经过时间与存活率的关系的曲线图。
具体实施方式
[0102]
以下,对本发明进行详细说明。以下记载的构成要件的说明有时是基于代表性的实施方式或具体例子而进行的说明,但本发明并不限定于这样的实施方式。需要说明的是,本说明书中,用“~”表示的数值范围是指包括“~”前后所记载的数值作为下限值和上限值的范围。
[0103]
[细胞因子风暴抑制剂]
[0104]
本发明的细胞因子风暴抑制剂包含来源于来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞或它们的永生化干细胞的培养上清的微小颗粒,微小颗粒包含可修复因细胞因子风暴而损伤的组织或细胞的有效量以上的细胞外超氧化物歧化酶(sod3),该细胞因子风暴抑制剂的用途为:对于发生细胞因子风暴的人或人以外的动物,在发生由细胞因子风暴导致的组织损伤之前给药,通过抑制细胞因子风暴来抑制由细胞因子风暴导致的组织损伤;或者,对发生由细胞因子风暴导致的组织损伤的人或人以外的动物给药,通过抑制细胞因子风暴来修复在细胞因子风暴中损伤的组织。
[0105]
根据本发明的细胞因子风暴抑制剂,可抑制与细胞因子风暴有关的多个细胞因子,并且可抑制由细胞因子风暴导致的组织损伤、或者可修复在细胞因子风暴中损伤的组织。
[0106]
以下,对本发明的细胞因子风暴抑制剂的优选方案进行说明。
[0107]
本发明的细胞因子风暴抑制剂的用途为:对于发生细胞因子风暴的人或人以外的动物,在发生由细胞因子风暴导致的组织损伤之前给药,通过抑制细胞因子风暴来抑制由细胞因子风暴导致的组织损伤;或者,对发生由细胞因子风暴导致的组织损伤的人或人以外的动物给药,通过抑制细胞因子风暴来修复在细胞因子风暴中损伤的组织。
[0108]
本发明的细胞因子风暴抑制剂优选为组织损伤抑制剂,更优选为组织修复剂。
[0109]
损伤的组织的修复包括组织的再生、部分再生、残留有疤痕的修复、保护等。
[0110]
组织的再生是指损伤的组织在形态和功能上恢复到与原来的组织同等程度。这种情况下,优选损伤的组织通过与构成原来的组织的细胞相同的细胞来补充组织的缺损。
[0111]
组织的部分再生是指,损伤的组织虽然在形态和功能上与原来的组织不同等,但恢复至某种程度。这种情况下,也优选损伤的组织通过与构成原来的组织的细胞相同的细胞来补充组织的缺损。
[0112]
组织的残留有疤痕的修复是指损伤的组织残留疤痕(被肉芽细胞或胶原纤维置换的组织)而复原。这种情况下,损伤的组织可在形态和功能中的任一个方面恢复至与原来的组织同等程度。
[0113]
组织的保护是指抑制已损伤的组织的损伤程度进一步提高。
[0114]
这些之中,本发明的细胞因子风暴抑制剂优选可进行组织的损伤抑制、再生或部分再生。
[0115]
在本发明中,微小颗粒包含可修复因细胞因子风暴而损伤的组织或细胞的有效量以上的细胞外超氧化物歧化酶(sod3),因此本发明的细胞因子风暴抑制剂优选具有sod3活性。本发明的细胞因子风暴抑制剂优选包含1.0ng/mg以上的sod3、更优选包含3.0ng/mg以上、特别优选包含6.0ng/mg以上、更特别优选包含10.0ng/mg以上。本发明的细胞因子风暴抑制剂的优选方案是通过优选以高浓度包含sod3来进一步提高sod3活性。本发明的细胞因子风暴抑制剂的sod3活性优选为0.3单位/μg以上、进一步优选为0.4单位/μg以上、更优选为1.0单位/μg以上、特别优选为3.0单位/μg以上、更特别优选为4.0单位/μg以上。
[0116]
在微小颗粒不含可修复因细胞因子风暴而损伤的组织或细胞的有效量以上的细胞外超氧化物歧化酶(sod3)的情况下,难以提高sod3活性。本发明的细胞因子风暴抑制剂的优选方案是通过以高浓度包含充分地含有sod3的特定的微小颗粒,如此地进一步提高
sod3活性。
[0117]
《在细胞因子风暴中损伤的组织》
[0118]
对被细胞因子风暴损伤、且利用本发明的细胞因子风暴抑制剂可抑制或修复损伤的组织的种类没有特别限定,可列举:所有的组织。被细胞因子风暴损伤、且可利用本发明的细胞因子风暴抑制剂抑制或修复损伤的组织优选为所有的脏器、气管、神经和血管,更优选为肺组织、心脏组织、肝脏组织、胆囊组织、脾脏组织、肾脏组织、食道组织、胃组织、小肠组织、大肠组织、直肠组织、膀胱组织、气管组织、神经组织、甲状腺组织、血管组织,特别优选为肺组织、气管组织、血管组织,更特别优选为肺组织。
[0119]
《细胞因子风暴的抑制》
[0120]
(各种细胞因子的说明)
[0121]
本发明的细胞修复剂在通过抑制细胞因子风暴来抑制由细胞因子风暴导致的组织损伤或者修复在细胞因子风暴中损伤的组织时抑制细胞因子。对被抑制的细胞因子没有特别限定。作为被抑制的细胞因子的例子,可列举:il-2、il-4、il-6、il-10、il-17、ifnγ和tnfα等。除这些以外,作为其他被抑制的细胞因子,可列举:il-1、il-18、mig、mip-1α等。
[0122]
il-1是参与防御炎症或感染的炎性细胞因子。
[0123]
il-2是参与细胞免疫的细胞因子。il-2的过度表达导致t细胞的子集即控制性t细胞(treg)选择性地增加。treg通过抑制其他细胞的免疫应答而发挥维持末梢性耐受的作用。认为末梢性耐受的破绽会在人中引起自身免疫疾病。因此,认为treg的免疫抑制能力会防止自身免疫疾病的发病。另外,treg还与癌症有关,实体性肿瘤和血液恶性肿瘤伴有treg数的增加(参照日本特开2020-002154号公报的[0007])。
[0124]
il-4是参与从辅助t细胞向th2(辅助t2型)子集分化的非重复细胞因子,th2促进从未成熟b细胞向ige产生形质细胞的分化。在过敏性哮喘中ige水平上升。因此,il-4与过敏性哮喘的发病有关(参照日本特开2020-002154号公报的[0008])。
[0125]
il-6是b细胞分化因子、b细胞刺激因子-2、肝细胞刺激因子、杂交瘤增殖因子和形质细胞瘤增殖因子。il-6是代表性的炎性细胞因子,还是参与急性炎症应答的控制、包含b和t细胞分化的特定的免疫应答的调节、骨代谢、血小板生成、上皮增殖、月经、神经细胞分化、神经保护、年龄增加、癌、在阿尔茨海默病中发生的炎症反应等的多功能细胞因子。认为il-6在包括疲労、恶病质、自身免疫疾病、骨骼系疾病、癌症、心脏疾病、肥胖、糖尿病、哮喘、阿尔茨海默病和多发性硬化症在内的多种疾病和障碍的发展中起作用(参照日本特开2019-047787号公报的[0002]~[0005])。
[0126]
il-10是在t细胞、巨噬细胞、树状细胞中产生的160个氨基酸残基的同源二聚体的蛋白。已知il-10参与巨噬细胞功能抑制、b细胞激活等(参照日本再表2018/212237号公报的[0052])。另外,其是抗炎性细胞因子。
[0127]
il-17是由cd4记忆t细胞、th17细胞产生的132个氨基酸残基的蛋白。已知il-17参与由巨噬细胞、上皮细胞、内皮细胞、成纤维细胞产生炎性细胞因子等(参照日本再表2018/212237号公报的[0053])。
[0128]
若通过病毒感染或癌活性氧等对细胞施以强应激,则释放il-18。
[0129]
ifn(干扰素)具有阻止病毒复制、激活免疫细胞(例如自然杀伤细胞和巨噬细胞等)的功能等。ifn分为i型ifn、ii型ifn和iii型ifn。其中,作为ii型ifn的ifnγ是由活化的
免疫细胞产生的多种细胞因子,可诱发巨噬细胞活性的增加、mhc分子表达的增加和nk细胞活性的增加等细胞应答(参照日本特表2020-522254号公报的[0209])。
[0130]
tnf(tumor necrosis factor;肿瘤坏死因子)是代表性的炎性细胞因子。作为tnf,已知有tnfα、tnfβ和ltβ。其中,tnfα介导包括二次淋巴器官的结构和功能的组织化、细胞凋亡和抗肿瘤活性、阻碍病毒复复、免疫调节以及炎症在内的一些重要的生理功能。tnf在自身免疫疾病的病理发生、急性期反应、败血症性休克、发热和恶病质中也起到重要作用(参照日本特开2020-079306号公报的[0004])。
[0131]
mig是掌管1型免疫应答的细胞因子。由巨噬细胞或上皮细胞、血管内皮细胞等产生,使th1细胞或cd8t细胞、一部分巨噬细胞等游走到炎症部位。
[0132]
mip-1α是由巨噬细胞或成纤维细胞、上皮细胞、血管平滑肌细胞等根据炎症产生的细胞因子。
[0133]
在这些细胞因子中,ifnγ和tnfα较为重要。在细胞因子风暴的情况下存在的ifnγ和tnfα与外来体的sod3协调(参照stem cell rev and rep(2020)6:548-559),可修复由细胞因子风暴引起的组织损伤。从容易修复由细胞因子风暴引起的组织损伤的观点来看,优选ifnγ和tnfα没有被完全抑制、而有某种程度的残留。
[0134]
本发明的细胞因子风暴抑制剂优选抑制由细胞中或血液中的il(白介素)-2、il-4、il-6、il-10、il-17、ifnγ和tnfα构成的组中的至少2种细胞因子,更优选抑制这些组中的至少4种细胞因子。本发明的细胞因子风暴抑制剂特别优选抑制il-2、il-6、il-10、il-17、ifnγ和tnfα中的任一种,更特别优选抑制il-2、il-4、il-6、il-10、il-17、ifnγ和tnfα中的任一种。
[0135]
另外,本发明的细胞因子风暴抑制剂优选在对细胞因子风暴状态的人或人以外的动物给予细胞因子风暴抑制剂的情况下提高细胞外超氧化物歧化酶(sod3)活性。
[0136]
另外,本发明的细胞因子风暴抑制剂优选在对细胞因子风暴状态的人或人以外的动物给予细胞因子风暴抑制剂的情况下,与未给予细胞因子风暴抑制剂的情况相比提高存活率。
[0137]
《用途》
[0138]
本发明的细胞因子风暴抑制剂可用作与细胞因子风暴有关的疾病、例如感染症、给药、高度的手术侵袭、败血症、全身性炎症综合征(sirs)、弥漫性血管内凝血综合征(dic)、多脏器功能不全、其他炎症的治疗药或预防药、或者细胞因子风暴的后遗症的治疗药或预防药。本发明的细胞因子风暴抑制剂中所含的微小颗粒所包含的sod3可抑制与细胞因子风暴相关的多个细胞因子(下调),并且与ifnγ和tnfα协调,可修复由细胞因子风暴引起的组织损伤,因此可用作这些冠状病毒感染症(covid-19等)的治疗药或预防药。实际上,在老年人的肺中成为sod3少的状态,暗示这与covid-19的重症化有关(antioxidants&redox signaling(2020),33,2)。另外,细胞因子风暴状态的细胞暗示受到了氧化应激(front.bioeng.biotechnol.(2020),8:554),通过大量给予本发明的细胞因子风暴抑制剂中所含的微小颗粒所包含的高活性sod3,可提高抗氧化作用,抑制细胞因子风暴状态的细胞的氧化应激。
[0139]
本发明的细胞因子风暴抑制剂可如此地抑制细胞因子风暴,预防或治疗与细胞因子风暴有关的疾病,提高来自细胞因子风暴相关疾病的存活率,此外还通过修复由细胞因
子风暴引起的组织损伤而用作细胞因子风暴的后遗症的改善药。
[0140]
然而,本发明的细胞因子风暴抑制剂可在这些以外的用途中使用。在任一种情况下,本发明的细胞因子风暴抑制剂均优选为药物组合物。
[0141]
本发明的细胞因子风暴抑制剂即使在感染症或败血症中也可用作covid-19等病毒症的治疗药或预防药。这里,若人或人以外的动物感染sars-cov或作为covid-19的致病病毒的sars-cov-2等的一部分冠状病毒等,则成为细胞因子风暴状态。
[0142]
在申请本技术时,即使未显示作为covid-19的治疗药的药理试验结果,也可以说本发明的细胞因子风暴抑制剂可用作covid-19的治疗药(具有使用的可能性)。
[0143]
所谓covid-19(新型冠状病毒感染症)是指人或人以外的动物的生物体具有被sars-cov-2感染的细胞。感染症特别是可通过由呼吸系统样品进行检测或病毒滴定的方法、或检测血液循环sars-cov-2特异性抗体的方法等确认,此时采用使用了pcr的已知方法。
[0144]
所谓covid-19的预防是指阻止由sars-cov-2引起的人或人以外的动物的生物体中的感染、或者至少是减少其发生的可能性。
[0145]
本发明的细胞因子风暴抑制剂可用作covid-19的治疗药。所谓covid-19的治疗是指在人或人以外的动物的生物体中减轻、减弱与病毒感染相关的症状(呼吸系统综合征、发热等)、或缩短其症状的恢复期间。优选通过给予本发明的细胞因子风暴抑制剂,人或动物的生物体的病毒感染率(感染效价)减少,更优选病毒从生物体内完全消灭。
[0146]
而且,本发明的细胞因子风暴抑制剂可用作covid-19的后遗症的预防药或治疗药。本发明的细胞因子风暴抑制剂可通过抑制细胞因子风暴来修复由细胞因子风暴引起的组织损伤,因此可用作认为是由细胞因子风暴的后遗症引起的covid-19的后遗症的预防药或治疗药。
[0147]
与现有的可用作细胞因子风暴抑制剂或免疫抑制剂的组合物相比,本发明的细胞因子风暴抑制剂具有容易大量生产、可有效利用以往作为农业废弃物等废弃的干细胞的培养液、降低干细胞的培养液的废弃成本等优点。特别是在来自牙髓的干细胞等培养上清为来自人牙髓的干细胞、来自人脂肪的干细胞、来自人骨髓的干细胞或来自人脐带的干细胞的培养上清的情况下,对人适用本发明的细胞因子风暴抑制剂的情况下,还具有免疫学上等的观点上的安全性高、伦理性的问题也少的优点。在来自牙髓的干细胞等的培养上清为来自各种疾病患者(不孕症等)的来自牙髓的干细胞等的培养上清的情况下,对其患者适用本发明的细胞因子风暴抑制剂时安全性进一步提高,伦理性的问题也变少。
[0148]
本发明的细胞因子风暴抑制剂由于是来源于来自牙髓的干细胞等的培养上清,所以也用于修复医疗的用途。特别是包含来源于来自牙髓的干细胞等的培养上清的微小颗粒的组合物优选用于修复医疗的用途。这里,在以干细胞移植为前提的再生医疗中,已知干细胞不是再生的主角,干细胞产生的液性成分与自身的干细胞一起修复脏器。以往的干细胞移植所伴随的癌化、标准化、给药方法、保存性、培养方法等困难的问题得到解决,通过使用了来源于来自牙髓的干细胞等的培养上清的微小颗粒的组合物可进行修复医疗。若与干细胞移植相比,则在使用了本发明的细胞因子风暴抑制剂的修复中,由于不移植细胞,因此不易发生肿瘤化等,可谓更加安全。另外,来自牙髓的干细胞等的培养上清或本发明的细胞因子风暴抑制剂具有可使用一定标准化的品质的抑制剂的优点。由于可选择大量生成或有效
的给药方法,因此可低成本地利用。
[0149]
《微小颗粒》
[0150]
在本发明中,使用来源于来自牙髓的干细胞等的培养上清的微小颗粒,微小颗粒包含可修复由细胞因子风暴损伤的组织或细胞的有效量以上的细胞外超氧化物歧化酶(sod3)。微小颗粒例如通过从来自牙髓的干细胞等的分泌、出芽或分散等,由来自牙髓的干细胞等中导出,并浸出、释放或脱落到细胞培养的培养基中。因此,微小颗粒包含在来自牙髓的干细胞等的培养上清中。
[0151]
本发明的细胞因子风暴抑制剂可将来源于来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞或它们的永生化干细胞的培养上清的微小颗粒以由培养上清纯化的状态使用。即,微小颗粒优选为由培养上清纯化的微小颗粒。
[0152]
微小颗粒的来源可通过已知的方法判别。例如,微小颗粒可通过j stem cell res ther(2018)8:2中记载的方法判别是否来源于来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞的任一种。具体而言,可根据微小颗粒的mirna模式判别各微小颗粒的来源。
[0153]
在本发明中,微小颗粒包含细胞外超氧化物歧化酶(sod3)。这里,sod3是sod的1种。sod是将超氧化物阴离子自由基(o
2-)歧化成氧(o2)和过氧化氢(h2o2)的酶。sod在代谢氧的细胞中偏在,可保护细胞免受氧介导的自由基损伤。sod根据金属辅因子和局在的不同分为4种,sod3是与细胞外液或膜结合的sod。
[0154]
(微小颗粒的特性)
[0155]
微小颗粒优选为选自外来体(exosome)、微小泡、膜颗粒、膜小泡、核外颗粒体(ectosome)和外囊泡(exovesicle)或微囊泡(microvesicle)的至少1种,更优选为外来体。
[0156]
微小颗粒的直径优选为10~1000nm、更优选为30~500nm、特别优选为50~150nm。
[0157]
微小颗粒包含可修复由细胞因子风暴损伤的组织或细胞的有效量以上的sod3。微小颗粒优选每1mg微小颗粒包含1.0ng/mg以上的sod3,更优选包含3.0ng/mg以上,特别优选包含6.0ng/mg以上,更特别优选包含10.0ng/mg以上。本发明的细胞因子风暴抑制剂的优选方案是:优选通过以高浓度包含像这样充分地包含sod3的确定的微小颗粒来进一步提高sod3活性的方案。
[0158]
从容易抑制细胞因子风暴的观点来看,微小颗粒更优选sod3活性高。
[0159]
另外,希望在微小颗粒的表面存在cd9、cd63、cd81等称为四旋蛋白(tetraspanin)的分子,其可以是单独的cd9、单独的cd63、单独的cd81,或者可以是它们中的2种或3种的任意组合。
[0160]
以下,有时会说明使用外来体作为微小颗粒的情况下的优选方案,但本发明的微小颗粒并不限定于外来体。
[0161]
外来体优选为在多胞体与原形质膜融合时由细胞释放的细胞外小泡。
[0162]
外来体的表面优选包含来源于来自牙髓的干细胞等的细胞膜的脂质和蛋白。
[0163]
在外来体的内部优选包含核酸(微小rna、信使rna、dna等)和蛋白等来自牙髓的干细胞等的细胞内物质。
[0164]
已知外来体被用于通过从某个细胞向另一个细胞运输遗传信息而进行的细胞与细胞的通信。外来体可容易地追踪,且可靶向至特异性区域。
[0165]
(微小颗粒的含量)
[0166]
本发明的细胞因子风暴抑制剂对微小颗粒的含量没有特别限定。本发明的细胞因子风暴抑制剂优选包含0.5
×
108个以上的微小颗粒,更优选包含1.0
×
108个以上、特别优选包含2.0
×
108个以上、更特别优选包含1.0
×
109个以上、更进一步特别优选包含2.0
×
109个以上。
[0167]
另外,本发明的细胞因子风暴抑制剂对微小颗粒的含有浓度没有特别限定。本发明的细胞因子风暴抑制剂优选包含0.01
×
108个/ml以上的微小颗粒,更优选包含0.05
×
108个/ml以上、特别优选包含0.1
×
108个/ml以上、更特别优选包含1.0
×
109个/ml以上、更进一步特别优选包含2.0
×
109个/ml以上。本发明的细胞因子风暴抑制剂的优选方案是:通过像这样以高浓度包含充分地包含sod3的确定的微小颗粒来进一步通过sod3活性。
[0168]
(来自牙髓的干细胞等的培养上清)
[0169]
对来自牙髓的干细胞等的培养上清没有特别限定。
[0170]
来自牙髓的干细胞等的培养上清优选实质上不含血清。例如,来自牙髓的干细胞等的培养上清优选血清含量为1质量%以下、更优选为0.1质量%以下、特别优选为0.01质量%以下。
[0171]-来自牙髓的干细胞等-[0172]
来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞可来源于人、也可来源于人以外的动物。作为人以外的动物,可列举:与后述的给予本发明的细胞因子风暴抑制剂的对象动物(生物种)同样的动物,优选哺乳动物。
[0173]
对用于培养上清的来自牙髓的干细胞没有特别限定。可使用脱落乳牙牙髓干细胞(stem cells from exfoliated deciduous teeth)或通过其他方法获取的乳牙牙髓干细胞或恒齿牙髓干细胞(dental pulp stem cells;dpsc)。除人乳牙牙髓干细胞或人恒齿牙髓干细胞以外,还可使用猪乳牙牙髓干细胞等来源于人以外的动物的来自牙髓的干细胞。
[0174]
来自牙髓的干细胞(后述的来自脂肪的干细胞或来自骨髓的干细胞或来自脐带的干细胞也同样)除了可产生外来体还可产生血管内皮生长因子(vegf)、肝细胞生长因子(hgf)、胰岛素样生长因子(igf)、血小板衍生生长因子(pdgf)、转化生长因子-β(tgf-β)-1和-3、tgf-α、kgf、hbegf、sparc、其他生长因子、趋化因子等各种细胞因子。另外,还可产生其他的多种生理活性物质。
[0175]
本发明中,来自牙髓的干细胞的培养上清中使用的来自牙髓的干细胞特别优选为包含多种蛋白的来自牙髓的干细胞,优选使用乳牙牙髓干细胞。即,本发明中,优选使用乳牙牙髓干细胞的培养上清。
[0176]
对培养上清中使用的来自脂肪的干细胞没有特别限定。作为来自脂肪的干细胞,可使用任意的脂肪组织中所含的体干细胞。除来自人脂肪的干细胞以外,还可使用猪脂肪干细胞等来源于人以外的动物的来自脂肪的干细胞。作为来自脂肪的干细胞,例如可使用按照国际公开wo2018/038180号的[0023]~[0041]中记载的方法调制的来自脂肪的干细胞,该公报的内容作为参照纳入到本说明书中。另外,可使用通过日本特开2018-531979号公报的[0022]和[0172]~[0187]中记载的方法调制的来自脂肪的干细胞,该公报的内容作为参照纳入到本说明书中。
[0177]
对用于培养上清的来自骨髓的干细胞没有特别限定。除来自人骨髓的干细胞以
外,还可使用猪骨髓干细胞等来自人以外的动物的来自骨髓的干细胞。作为来自骨髓的干细胞,例如可使用通过日本特开2017-132744号公报的[0027]~[0028]和[0048]中记载的方法调制的来自骨髓的干细胞,该公报的内容作为参照纳入到本说明书中。
[0178]
对用于培养上清的来自脐带的干细胞没有特别限定。除来自人脐带的干细胞以外,还可使用猪脐带干细胞等来源于人以外的动物的来自脐带的干细胞。作为来自脐带的干细胞,例如可使用按照日本特开2017-119646号公报的[0023]~[0033]中记载的方法调制的来自脐带的干细胞,该公报的内容作为参照纳入到本说明书中。
[0179]
用于本发明的来自牙髓的干细胞等只要可实现目标处置即可,可以是天然干细胞,也可以是经基因修饰的干细胞。
[0180]
特别是,在本发明中,可使用来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞的永生化干细胞。通过使用实质上可无限增殖的永生化干细胞,可使干细胞的培养上清中所含的生物因子的量和组成长期稳定。对来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞的永生化干细胞没有特别限定。永生化干细胞优选为未癌化的永生化干细胞。来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞的永生化干细胞可通过在来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞中单独或组合添加以下的低分子化合物(抑制剂)进行培养来调制。
[0181]
作为tgfβ受体抑制剂,只要是具有抑制转化生长因子(tgf)β受体功能的作用的物质即可,没有特别限定,例如可列举:2-(5-苯并[1,3]二氧杂环戊烯-4-基-2-叔丁基-1h-咪唑-4-基)-6-甲基吡啶、3-(6-甲基吡啶-2-基)-4-(4-喹啉基)-1-苯硫基氨基甲酰基-1h-吡唑(a-83-01)、2-(5-氯-2-氟苯基)蝶啶-4-基)吡啶-4-基胺(sd-208)、3-(吡啶-2-基)-4-(4-醌基)]-1h-吡唑、2-(3-(6-甲基吡啶-2-基)-1h-吡唑-4-基)-1,5-萘啶(以上,merck公司)、sb431542(sigma-aldrich公司)等。可优选列举a-83-01。
[0182]
作为rock抑制剂,只要是具有抑制rho结合激酶的功能的作用的物质即可,没有特别限定。作为rock抑制剂,例如可列举:gsk269962a(axonmedchem公司)、fasudil hydrochloride(tocris bioscience公司)、y-27632、h-1152(以上,富士胶片和光纯药株式会社)等。可优选列举:y-27632。
[0183]
作为gsk3抑制剂,只要是抑制gsk-3(glycogen synthase kinase 3(糖原合酶激酶3)、糖原合成酶3)的物质即可,没有特别限定,可列举:a 1070722、bio、bio-丙酮肟(以上,tocris公司)等。
[0184]
作为mek抑制剂,只要是具有抑制mek(map激酶-erk激酶)的功能的作用的物质即可,没有特别限定,例如可列举:azd6244、ci-1040(pd184352)、pd0325901、rdea119(bay86-9766)、sl327、u0126-etoh(以上,selleck公司)、pd98059、u0124、u0125(以上,cosmo bio株式会社)等。
[0185]
从增强本发明的细胞因子风暴抑制剂所起到的效果的观点来看,优选用于本发明的来自牙髓的干细胞等是以在微小颗粒中高度表达sod3的方式进行基因修饰而得的干细胞。对在微小颗粒中高度表达sod的基因修饰技术没有特别限定,可采用已知的方法。例如,可采用mol genet genomic med.(2019)7:e831中记载的方法。
[0186]
在将本发明的细胞因子风暴抑制剂用于再生医疗的情况下,从再生医疗等安全性
确保法的要求出发,包含来源于来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞或它们的永生化干细胞(来自牙髓的干细胞等)的培养上清的微小颗粒的组合物为不含除来自牙髓的干细胞等以外的其他体干细胞的方案。本发明的细胞因子风暴抑制剂可含有除来自牙髓的干细胞等以外的间充质干细胞或其他体干细胞,但优选不含。
[0187]
作为除间充质干细胞以外的其他体干细胞的例子,包括来自真皮系、消化系、骨髓系、神经系等的干细胞,但并不限定于这些。作为真皮系体干细胞的例子,包括上皮干细胞、毛囊干细胞等。作为消化系体干细胞的例子,包括胰腺(整体的)干细胞、肝干细胞等。作为(除间充质干细胞以外的)骨髓系体干细胞的例子,包括造血干细胞等。作为神经系体干细胞的例子,包括神经干细胞、视网膜干细胞等。
[0188]
本发明的细胞因子风暴抑制剂可含有体干细胞以外的干细胞,但优选不含。作为体干细胞以外的干细胞,包括胚胎干细胞(es细胞)、诱导多能干细胞(ips细胞)、胚胎癌细胞(ec细胞)。
[0189]
对来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞或它们的永生化干细胞的培养上清的调制方法没有特别限定,可采用现有的方法。
[0190]
来自牙髓的干细胞等的培养上清是培养来自牙髓的干细胞等而得到的培养液,不包含细胞本身。例如通过在来自牙髓的干细胞等的培养后分离去除细胞成分,可得到可用于本发明的培养上清。可使用适当施行了各种处理(例如,离心处理、浓缩、溶剂的置换、透析、冷冻、干燥、冷冻干燥、稀释、脱盐、保存等)的培养上清。
[0191]
用于得到来自牙髓的干细胞等的培养上清的来自牙髓的干细胞等可通过常规方法筛选,可根据细胞的大小或形态、或作为粘附性细胞来筛选。在来自牙髓的干细胞的情况下,可从由脱落的乳牙或恒齿采集的牙髓细胞中作为粘附性细胞或其传代细胞来筛选。在来自脂肪的干细胞的情况下,可从由脂肪组织采集的脂肪细胞中作为粘附性细胞或其传代细胞来筛选。在来自脐带的干细胞的情况下,可从由脐带采集的细胞中作为粘附性细胞或其传代细胞来筛选。在来自牙髓的干细胞等的培养上清中,可使用培养所筛选的干细胞而得到的培养上清。
[0192]
需要说明的是,“来自牙髓的干细胞等的培养上清”优选为培养来自牙髓的干细胞等而得到的、不包含其细胞本身的培养液。本发明中使用的来自牙髓的干细胞等的培养上清优选在其一个方案中即使作为整体也不包含细胞(无论细胞的种类如何)。该方案的组合物通过该特征自然地使来自牙髓的干细胞等自身与包含来自牙髓的干细胞等的各种组合物明确地区别开来。该方案的典型例子是:不含来自牙髓的干细胞等、而仅由来自牙髓的干细胞等的培养上清构成的组合物。
[0193]
本发明中使用的来自牙髓的干细胞的培养上清可包含来自乳牙牙髓的干细胞和来自成人牙髓的干细胞两者的培养上清。本发明中使用的来自牙髓的干细胞的培养上清优选包含来自乳牙牙髓的干细胞的培养上清作为有效成分,更优选包含50质量%以上、优选包含90质量%以上。本发明中使用的来自牙髓的干细胞的培养上清更特别优选为仅由来自乳牙牙髓的干细胞的培养上清构成的组合物。
[0194]
在用于得到培养上清的来自牙髓的干细胞等的培养液中,可使用基础培养基、或在基础培养基中添加了血清等的培养基等。需要说明的是,作为基础培养基,除dulbecco改
良eagle培养基(dmem)以外,还可使用iscove改良dulbecco培养基(imdm)(gibco公司等)、ham f12培养基(hamf12)(sigma公司、gibco公司等)、rpmi1640培养基等。另外,作为可添加在培养基中的成分的例子,可列举:血清(胎牛血清、人血清、羊血清等)、血清替代品(knockout血清替代品(ksr)等)、牛血清白蛋白(bsa)、抗生素、各种维生素、各种矿物质。
[0195]
然而,为了调制不含血清的“来自牙髓的干细胞等的培养上清”,可在整个过程中或最后或从最后起的数次传代培养中使用无血清培养基。例如,通过用不含血清的培养基(无血清培养基)培养来自牙髓的干细胞等,可调制不含血清的来自牙髓的干细胞等的培养上清。进行1次或多次的传代培养,通过将最后或从最后起的多次传代培养用无血清培养基进行培养,也可得到不含血清的来自牙髓的干细胞等的培养上清。另一方面,通过利用透析或基于柱的溶剂置换等从回收的培养上清中去除血清,也可得到不含血清的来自牙髓的干细胞等的培养上清。
[0196]
在用于得到培养上清的来自牙髓的干细胞等的培养中,可直接适用通常所采用的条件。关于来自牙髓的干细胞等的培养上清的调制方法,除了根据干细胞的种类适当调整干细胞的分离和筛选工序以外,可与后述的细胞培养方法同样进行。根据来自牙髓的干细胞等的种类进行的来自牙髓的干细胞等的分离和筛选可由本领域技术人员适当进行。
[0197]
另外,在来自牙髓的干细胞等的培养中,为了大量生产有助于sod3表达和/或sod3活性的确定的外来体,可适用特别条件。作为特别条件,例如可列举:低温条件、低氧条件、微重力条件等与任何刺激物进行共培养的条件等。
[0198]-来自牙髓的干细胞等的培养上清中所含的其他成分-[0199]
本发明中用于调制外来体的来自牙髓的干细胞等的培养上清除包含来自牙髓的干细胞等的培养上清以外,还可包含其他成分,但优选实质上不含其他成分。
[0200]
然而,也可将用于调制外来体的各种添加剂添加至来自牙髓的干细胞等的培养上清中,然后进行保存。
[0201]
(微小颗粒的纯化)
[0202]
可由来自牙髓的干细胞等的培养上清纯化微小颗粒。
[0203]
微小颗粒的纯化优选为由来自牙髓的干细胞等的培养上清分离包含微小颗粒的组分,更优选为分离微小颗粒。
[0204]
微小颗粒可通过根据微小颗粒的特性从非缔合成分中分离而分离出来。例如,微小颗粒可根据分子量、大小、形态、组成或生物学活性进行分离。
[0205]
本发明中,通过分取对来自牙髓的干细胞等的培养上清进行离心处理而得到的、含有大量微小颗粒的确定组分(例如沉淀物),可纯化微小颗粒。可去除除规定组分以外的组分的不需要的成分(不溶成分)。从本发明的细胞因子风暴抑制剂中去除溶剂和分散介质、以及不需要的成分可以不是完全去除。可示例离心处理的条件如下:100~20000g、1~30分钟。
[0206]
本发明中,通过对来自牙髓的干细胞等的培养上清或其离心处理物进行过滤处理,可纯化微小颗粒。可通过过滤处理去除不需要的成分。另外,如果使用适当孔径的滤膜,则可同时进行不需要的成分的去除和灭菌处理。对用于过滤处理的滤膜的材质、孔径等没有特别限定。可按照已知方法用适当的分子量或尺寸截留的滤膜进行过滤。从容易分取外来体的观点来看,滤膜的孔径优选为10~1000nm、更优选为30~500nm、特别优选为50~
150nm。
[0207]
本发明中,可采用柱色谱等进一步的分离方法分离来自牙髓的干细胞等的培养上清或其离心处理物或者它们的过滤处理物。例如,可采用使用了各种柱的高效液相色谱(hplc)。柱可使用尺寸排阻柱或结合柱。
[0208]
在各处理阶段的各组分中,为了追踪微小颗粒(或其活性),可利用微小颗粒的1种以上的特性或生物学活性。例如,为了追踪微小颗粒,可采用光散射、折射率、动态光散射或uv-可见光检测器。或者,为了追踪各组分中的活性,可利用ace2的表达水平或ace2活性等。
[0209]
作为微小颗粒的纯化方法,可采用日本特表2019-524824号公报的[0034]~[0064]中记载的方法,该公报的内容作为参照纳入到本说明书中。
[0210]
《其他成分》
[0211]
本发明的细胞因子风暴抑制剂除了含有微小颗粒,还可根据给药的对象动物的种类或目的,在不损及本发明效果的范围内含有其他成分。作为其他成分,可列举:营养成分、抗生素、细胞因子、保护剂、载体、赋形剂、崩解剂、缓冲剂、乳化剂、悬浮剂、无痛化剂、稳定剂、保存剂、防腐剂等。
[0212]
作为营养成分,例如可列举:脂肪酸等、维生素等。
[0213]
作为抗生素,例如可列举:青霉素、链霉素、庆大霉素等。
[0214]
作为载体,可列举:作为药学上可接受的载体而已知的材料。
[0215]
本发明的细胞因子风暴抑制剂可以是微小颗粒本身,也可以是进一步包含药学上可接受的载体或赋形剂等的药物组合物。药物组合物的目的在于促进对给药对象给予微小颗粒。
[0216]
药学上可接受的载体优选为不会对给药对象引起显著的刺激性、不会抑制所给予的化合物的生物学活性和特性的载体(包含稀释剂)。载体的例子为:丙二醇;(生理)盐水;乳液;缓冲液;培养基、例如dmem或rpmi等;含有去除自由基的成分的低温保存培养基。
[0217]
本发明的细胞因子风暴抑制剂可包含以往已知的细胞因子风暴抑制剂和/或免疫抑制剂的有效成分。例如,从效果得到增强、兼顾和/或互补的观点来看,本发明的细胞因子风暴抑制剂优选包含抗il-6抗体或类固醇等机制不同于本发明的有效成分。本发明的细胞因子风暴抑制剂更优选包含抗il-6抗体和类固醇中的至少一者,特别优选包含抗il-6抗体。在本发明的细胞因子风暴抑制剂包含抗il-6抗体或类固醇等机制不同于本发明的有效成分的情况下,这样的有效成分的含量或含有浓度可与已知方法相同也可不同。这些可由本领域技术人员根据用途或给药对象等适当变更。
[0218]
另一方面,本发明的细胞因子风暴抑制剂优选不含规定的物质。
[0219]
例如,本发明的细胞因子风暴抑制剂优选不含来自牙髓的干细胞等。
[0220]
另外,本发明的细胞因子风暴抑制剂优选不含mcp-1。然而,可包含mcp-1以外的细胞因子。作为其他细胞因子,可列举:日本特开2018-023343号公报的[0014]~[0020]中记载的细胞因子等。
[0221]
另外,本发明的细胞因子风暴抑制剂优选不含siglec-9。然而,可包含除siglec-9以外的其他唾液酸结合免疫球蛋白样凝集素。
[0222]
需要说明的是,本发明的细胞因子风暴抑制剂优选实质上不含血清(胎牛血清、人血清、羊血清等)。另外,本发明的细胞因子风暴抑制剂优选实质上不含knockout血清替代
品(ksr)等现有的血清替代品。
[0223]
本发明的细胞因子风暴抑制剂优选上述的其他成分的含量(固体成分量)均为1质量%以下、更优选为0.1质量%以下、特别优选为0.01质量%以下。
[0224]
《细胞因子风暴抑制剂的制造方法》
[0225]
对本发明的细胞因子风暴抑制剂的制造方法没有特别限定。
[0226]
可利用上述方法调制来自牙髓的干细胞等的培养上清,然后由来自牙髓的干细胞等的培养上清纯化微小颗粒,调制本发明的细胞因子风暴抑制剂。或者,可由商业购入而获取的来自牙髓的干细胞等的培养上清纯化微小颗粒,调制本发明的细胞因子风暴抑制剂。也可接受包含废弃处理的来自牙髓的干细胞等的培养上清的组合物(或适当纯化其组合物),从中纯化微小颗粒,调制本发明的细胞因子风暴抑制剂。
[0227]
对本发明的细胞因子风暴抑制剂的最终形态没有特别限定。例如,本发明的细胞因子风暴抑制剂可列举:将微小颗粒与溶剂或分散介质一同填充至容器中而形成的形态;将微小颗粒与凝胶一同凝胶化且填充至容器中而形成的形态;将微小颗粒冷冻和/或干燥进行固态化制成制剂或填充至容器中而形成的形态等。作为容器,例如可列举:适于冷冻保存的管、离心管、袋等。冷冻温度例如可设为-20℃~-196℃。
[0228]
[细胞因子风暴抑制剂的使用方法]
[0229]
本发明的细胞因子风暴抑制剂的使用方法是对人或人以外的动物给予本发明的细胞因子风暴抑制剂,以减少人或人以外的动物的细胞中或血液中的细胞因子量,并且,通过抑制细胞因子风暴来修复在细胞因子风暴中损伤的组织。
[0230]
对人或人以外的动物给予本发明的细胞因子风暴抑制剂的工序没有特别限定。
[0231]
给药方法可列举:向口腔、鼻腔或气管喷雾或吸引、点滴、局部给药、滴鼻剂等,优选侵袭少。作为局部给药的方法,优选注射。另外,还优选电穿孔,其是通过对皮肤表面施加电压(电脉冲)使细胞膜短暂地产生微细的孔,使有效成分渗透至真皮层,这在常规护理中是无法达到的。在局部给药的情况下,可列举:静脉内给药、动脉内给药、门静脉内给药、皮内给药、皮下给药、肌肉内给药、腹腔内给药等,更优选为动脉内给药或静脉内给药,更优选为静脉内给药。
[0232]
本发明的细胞因子风暴抑制剂不限于适用于肺组织,还可适用于全身组织(全部脏器或血管等)。因此,从容易适用于全身组织的观点来看,与向口腔、鼻腔或气管喷雾或吸引相比,给药方法更优选为动脉内给药或静脉内给药、特别优选为静脉内给药。给予至动物的本发明的细胞因子风暴抑制剂在动物的体内循环,可到达规定的组织。
[0233]
对给药次数和给药间隔没有特别限定。给药次数可设为1~2次以上、优选设为1~5次、更优选设为1或2次、特别优选为2次。给药间隔优选为1~24小时、更优选为12小时以内。然而,可根据给药对象的症状适当调整。
[0234]
由于微小颗粒包含可修复由细胞因子风暴损伤的组织或细胞的有效量以上的细胞外超氧化物歧化酶(sod3),因此对给药量没有特别限定。在小鼠模型中,对每只小鼠(约25g)优选为1~50μg、更优选为3~25μg、特别优选为5~15μg。在对其他动物给药的情况下,优选为0.04~2mg/kg(重量/体重)、更优选为0.1~1mg/kg、特别优选为0.2~0.6mg/kg。然而,可根据给药对象的症状适当调整。
[0235]
对给药开始时期没有特别限定。对于发生细胞因子风暴的人或人以外的动物,给
药开始时期可以是发生由细胞因子风暴导致的组织损伤之前,也可以是发生由细胞因子风暴导致的组织损伤之后。在本发明中,从进一步提高存活率的观点来看,优选对发生细胞因子风暴的人或人以外的动物在发生由细胞因子风暴导致的组织损伤之前进行给药。即,本发明的细胞因子风暴抑制剂及其使用方法优选对发生细胞因子风暴的人或人以外的动物在发生由细胞因子风暴导致的组织损伤之前进行给药,通过抑制细胞因子风暴来抑制由细胞因子风暴导致的组织损伤的用途或修复在细胞因子风暴中损伤的组织的用途。本发明的细胞因子风暴抑制剂及其使用方法更优选为:对发生细胞因子风暴的人或人以外的动物,在发生由细胞因子风暴导致的组织损伤之前进行给药,通过抑制细胞因子风暴来抑制由细胞因子风暴导致的组织损伤的用途。
[0236]
另一方面,本发明的细胞因子风暴抑制剂及其使用方法还优选为:对发生由细胞因子风暴导致的组织损伤的人或人以外的动物给药,通过抑制细胞因子风暴来修复在细胞因子风暴中损伤的组织的用途。
[0237]
关于给药开始时期,在图6的给予lps起6小时后和18小时后的给药、即对发生由细胞因子风暴导致的组织损伤的人或人以外的动物给药的情况下显示存活率提高。与图6的情况相比,图7的给予lps起0小时后(发生细胞因子风暴的瞬间)和12小时后的给药、即对于发生细胞因子风暴的人或人以外的动物在发生由细胞因子风暴导致的组织损伤之前给药显示存活率进一步提高。需要说明的是,进行至使人或人以外的动物发生病毒感染、病毒增殖和免疫细胞的细胞因子风暴、并发生由细胞因子风暴导致的组织损伤之前的状态是给予lps 0小时后的状态。
[0238]
从提高存活率的观点来看,具体的给药开始时期优选为自细胞因子风暴发生起6小时以内、更优选为3小时以内、特别优选为1小时以内、更特别优选为在(认为是)细胞因子风暴的发生时期的同时。
[0239]
对给予本发明的细胞因子风暴抑制剂的对象动物(生物种)没有特别限定。给予本发明的细胞因子风暴抑制剂的对象动物优选为哺乳动物、鸟类(鸡、鹌鹑、鸭等)、鱼类(鲑鱼、鳟鱼、金枪鱼、鲣鱼等)。作为哺乳动物,可以是人,也可以是非人哺乳动物,但特别优选为人。作为非人哺乳动物,更优选为牛、猪、马、山羊、绵羊、猴、狗、猫、小鼠、大鼠、豚鼠、仓鼠。
[0240]
本发明的细胞因子风暴抑制剂可与以往已知的细胞因子风暴抑制剂和/或免疫抑制剂并用。例如,从效果得到增强、兼顾和/或互补的观点来看,优选将本发明的细胞因子风暴抑制剂与抗il-6抗体或类固醇等机制不同于本发明的药剂并用。在本发明的细胞因子风暴抑制剂的使用方法中,更优选将本发明的细胞因子风暴抑制剂与抗il-6抗体和类固醇中的至少一者并用、特别优选与抗il-6抗体并用。在并用本发明的细胞因子风暴抑制剂和抗il-6抗体或类固醇等机制不同于本发明的药剂的情况下,这样的药剂的给药量、给药次数、给药时期可与已知方法相同也可不同。另外,在并用本发明的细胞因子风暴抑制剂和抗il-6抗体或类固醇等机制不同于本发明的药剂的情况下,两者的给药次数或给药时期可相同也可不同。这些可由本领域技术人员根据用途或给药对象等适当变更。
[0241]
抗il-6抗体的机制是抑制边缘b细胞产生的il-6功能的机制,该il-6功能是使败血症(细胞因子风暴)恶化的因子(nature communications(2016)7:11498)。在该论文中显示:在给予lps后1小时后,由巨噬细胞产生大量的作为代表性的炎性细胞因子的il-6或tnf
α,而由边缘b细胞只产生微量,但在给予lps后的4小时后,边缘b细胞较巨噬细胞产生了更多的il-6。
[0242]
另外,已知类固醇的机制是:与细胞质的糖皮质激素(gr)结合形成活性型gr,在核的dna或转录调控因子中调节基因表达,抑制细胞因子合成(il-1、il-2、il-5、il-6、il-8、ifnγ)等,从而发挥抗炎作用、免疫抑制作用。
[0243]
[筛选方法]
[0244]
本发明的筛选方法是对通过抑制细胞因子风暴来修复在细胞因子风暴中损伤的组织的组织修复有效的因子或其组合的筛选方法,具备以下工序:将通过培养来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞或它们的永生化干细胞而得到的培养上清中所含的1种或2种以上的成分供给至与细胞外超氧化物歧化酶(sod3)有关的评价系统来评价sod3的相关特性。
[0245]
根据本发明的筛选方法,通过供给至与sod3有关的评价系统来评价sod3的相关特性,可筛选在来自牙髓的干细胞等的培养上清中所含的成分中是哪种成分对于通过抑制细胞因子风暴来修复在细胞因子风暴中损伤的组织的组织修复有效。在本发明的筛选方法中,评价该成分的与sod3相关的特性的结果,例如优选确定纯化后的sod3蛋白量优选为1.0ng/mg以上的成分而获取。另外,例如优选确定纯化后的sod3活性优选为0.3单位/μg以上的成分而获取。
[0246]
另外,根据本发明的筛选方法,可获取含有通过筛选确定的成分作为有效成分的细胞因子风暴抑制剂、或预防或治疗用组合物。通过筛选获取的细胞因子风暴抑制剂、或预防或治疗用组合物不是来源于来自牙髓的干细胞等的培养上清,而是可通过组合市售和/或纯化等的确定成分得到有效的细胞因子风暴抑制剂、或预防或治疗用组合物。即,本发明还涉及细胞因子风暴抑制剂,其是包含通过本发明的筛选方法评价sod3的相关特性而获取的成分的细胞因子风暴抑制剂,该成分来源于来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞或它们的永生化干细胞的培养上清,该成分包含可修复由细胞因子风暴损伤的组织或细胞的有效量以上的细胞外超氧化物歧化酶(sod3),该成分满足:每1mg上述成分包含1.0ng/mg以上的sod3、以及sod3活性为0.3单位/μg以上的至少一者,通过抑制细胞因子风暴来修复在细胞因子风暴中损伤的组织。
[0247]
该成分的sod3蛋白量和sod活性的更优选的范围与使用来源于来自牙髓的干细胞、来自脂肪的干细胞、来自骨髓的干细胞、来自脐带的干细胞或它们的永生化干细胞的培养上清的微小颗粒的细胞因子风暴抑制剂的情况下的sod3蛋白量和sod活性的更优选的范围相同。
[0248]
本发明的筛选方法中使用的关于sod3的评价系统可使用已知的评价系统。例如,除了可将本说明书中记载的sod3的定量方法或sod3活性的测定方法适用于各种细胞因子风暴相关疾病的模型小鼠,还可适当选择使用了相关细胞的评价系统进行利用。关于上述的各种评价系统,可由本领域技术人员适当选择,也可参照本说明书的实施例。
[0249]
如上所述,作为通过本发明的筛选方法对sod3的相关特性进行评价而获取的成分,可列举:来源于来自牙髓的干细胞等的培养上清的微小颗粒(优选外来体)。
[0250]
在本发明的筛选方法中,可评价其他的来源于来自牙髓的干细胞等的培养上清的成分的sod3的相关特性而获取。如上所述,来自牙髓的干细胞、来自脂肪的干细胞、来自骨
髓的干细胞、来自脐带的干细胞或它们的永生化干细胞的培养上清除了包含外来体等微小颗粒以外,还包含vegf、hgf、igf、pdgf)、tgf-β-1和-3、tgf-α、kgf、hbegf、sparc、其他的生长因子、趋化因子等各种细胞因子、其他的多种生理活性物质。
[0251]
实施例
[0252]
以下,列举实施例和比较例或参考例以进一步具体地说明本发明的特征。以下的实施例中所示的材料、使用量、比例、处理内容、处理步骤等只要不脱离本发明的宗旨则可适当变更。因此,本发明的范围不应由以下所示的具体例子限定性地解释。
[0253]
[实施例1]
[0254]
《来自牙髓的干细胞的培养上清的调制》
[0255]
使用dmem培养基代替dmem/ham f12混合培养基,其他则依据日本专利第6296622号的实施例6中记载的方法,调制了乳牙牙髓干细胞的培养上清。在原代培养中,添加胎牛血清(fbs)进行培养,在传代培养中分取使用原代培养液进行培养的传代培养液的上清使不含fbs,调制了乳牙牙髓干细胞的培养上清。需要说明的是,dmem是dulbecco改良eagle培养基,f12是ham f12培养基。
[0256]
《由来自牙髓的干细胞的培养上清调制外来体》
[0257]
按照以下的方法由得到的乳牙牙髓干细胞的培养上清纯化了来自牙髓的干细胞的外来体。
[0258]
用孔径为0.22微米的过滤器过滤乳牙牙髓干细胞的培养上清(100ml),之后将其溶液在4℃下以100000
×
g离心分离60分钟。倾析上清,将外来体浓缩颗粒重新悬浮于磷酸缓冲盐水(pbs)中。将重新悬浮的样品以100000
×
g离心分离60分钟。再次将颗粒作为浓缩样品从离心管的底部回收(约100μl)。蛋白浓度通过微小bsa蛋白测定试剂盒(pierce、rockford、il)来确定。包含外来体的组合物(浓缩溶液)在-80℃下保管。
[0259]
将所得到的包含外来体(来自牙髓的干细胞evs)的组合物作为实施例1的细胞因子风暴抑制剂。
[0260]
[实施例2]来自脂肪的干细胞evs(外来体)的调制
[0261]
除了使用来自脂肪的干细胞以外,与实施例1同样地操作,调制了来自脂肪的干细胞的培养上清。与实施例1同样地操作,由所得到的来自脂肪的干细胞的培养上清调制了包含外来体的组合物。将所得到的包含外来体(来自脂肪的干细胞evs)的组合物作为实施例2的细胞因子风暴抑制剂。
[0262]
[实施例3]来自骨髓的干细胞evs(外来体)的调制
[0263]
除了使用来自骨髓的干细胞以外,与实施例1同样地操作,调制了来自骨髓的干细胞的培养上清。与实施例1同样地操作,由所得到的来自骨髓的干细胞的培养上清调制了包含外来体的组合物。将所得到的包含外来体(来自骨髓的干细胞evs)的组合物作为实施例3的细胞因子风暴抑制剂。
[0264]
[实施例4]来自脐带的干细胞evs(外来体)的调制
[0265]
除了使用来自脐带的干细胞以外,与实施例1同样地操作,调制了来自脐带的干细胞的培养上清。与实施例1同样地操作,由所得到的来自脐带的干细胞的培养上清调制了包含外来体的组合物。将所得到的包含外来体(来自脐带的干细胞evs)的组合物作为实施例4的细胞因子风暴抑制剂。
[0266]
[评价]
[0267]
《外来体的特性》
[0268]
各实施例的细胞因子风暴抑制剂中所含的微小颗粒的平均粒径为50~150nm。
[0269]
各实施例的细胞因子风暴抑制剂是1.0
×
109个/ml以上的高浓度外来体溶液,特别是实施例1的细胞因子风暴抑制剂是2.0
×
109个/ml的高浓度外来体溶液。
[0270]
另外,按照已知方法分析了所得到的各实施例的细胞因子风暴抑制剂的成分。其结果可知:各实施例的细胞因子风暴抑制剂不含来自牙髓的干细胞等的干细胞,不含mcp-1,也不含siglec-9。因此,可知:与作为间充质干细胞的培养上清的有效成分的mcp-1和siglec-9以及它们的类似物不同的有效成分是各实施例的细胞因子风暴抑制剂的有效成分。
[0271]
《sod3的定量》
[0272]
使用sod3(人)elisa试剂盒(a-frontier co.,ltd.(lsr)制造、品号lfek0107),通过elisa夹层法测定了来自牙髓的干细胞evs(实施例1的细胞因子风暴抑制剂)、来自脂肪的干细胞evs(实施例2的细胞因子风暴抑制剂)、来自脐带的干细胞evs(实施例3的细胞因子风暴抑制剂)、来自骨髓的干细胞evs(实施例4的细胞因子风暴抑制剂)、用作对照的dmem培养基的sod3的蛋白量(n=2)。所得结果见图1。
[0273]
由图1可知:各实施例的细胞因子风暴抑制剂中所含的外来体包含大量的sod3。可知:特别是来自牙髓的干细胞evs(实施例1)的sod3蛋白量比来自脂肪的干细胞evs(实施例2)、来自骨髓的干细胞evs(实施例3)或来自脐带的干细胞evs(实施例4)的sod3蛋白量多。由这些结果可知:由于本发明的细胞因子风暴抑制剂以高浓度包含sod3,因此可调节细胞因子的表达。另外,sod3的蛋白量越多,则越容易进一步调节细胞因子的表达,越容易减少细胞因子风暴状态的各种细胞因子量。
[0274]
《sod3活性的测定》
[0275]
利用使用了stressxpress超氧化物歧化酶试剂盒(stressmarq biosciences inc制造)的黄嘌呤氧化酶方法,测定了来自牙髓的干细胞evs(实施例1的细胞因子风暴抑制剂)、来自脂肪的干细胞evs(实施例2的细胞因子风暴抑制剂)、来自脐带的干细胞evs(实施例3的细胞因子风暴抑制剂)、来自骨髓的干细胞evs(实施例4的细胞因子风暴抑制剂)的sod3(人)活性。
[0276]
测定时,使各实施例的细胞因子风暴抑制剂的外来体浓度和使用量相同,将外来体量设为等量。所得结果见下述表1。
[0277]
[表1]
[0278][0279]
由上述表1可知:各实施例的细胞因子风暴抑制剂的sod3活性高。可知:特别是来自牙髓的干细胞evs(实施例1)的sod3活性比来自脂肪的干细胞evs(实施例2)、来自骨髓的
干细胞evs(实施例3)或来自脐带的干细胞evs(实施例4)的sod3活性高。sod3活性的确认作为细胞因子量的调整容易度的确认方法比sod3蛋白量的确认更为准确。sod3活性越高,则越容易进一步调制细胞因子的表达,越容易减少细胞因子风暴状态的各种细胞因子量。
[0280]
《在体外的细胞因子风暴抑制的确认》
[0281]
使用人外周血单核细胞(peripheral-blood mononuclear cell;pbmc)进行细胞因子风暴的诱导,通过以下的方法在体外确认了包含外来体的各实施例的细胞因子风暴抑制剂的细胞因子风暴抑制效果。
[0282]
培养人pmbc,利用作为细胞因子风暴诱导剂的伴刀豆球蛋白a(con-a、富士胶片和光纯药(株)制造)进行刺激,诱导了细胞因子风暴。
[0283]
对该系统进行添加各实施例的细胞因子风暴抑制剂和作为对照的生理盐水中的1种的处理,利用细胞因子测定elisa试剂盒(r&d systems制造、商品名quantikine elisa kit)进行了人pmbc的培养上清中所含的细胞因子的定量。定量化的细胞因子为il-2、il-4、il-6、il-10、il-17、ifnγ和tnfα。
[0284]
当为pmbc的细胞时,添加包含外来体的实施例1~3的细胞因子风暴抑制剂使达到100个颗粒,进行处理。在使用包含外来体的各实施例的细胞因子风暴抑制剂进行处理后,测定了48小时后的细胞因子量(n=6)。
[0285]
所得结果见下述表2。
[0286]
[表2]
[0287][0288]
由上述表2可知:通过对于诱导细胞因子风暴而使各细胞因子量增多的细胞给予各实施例的细胞因子风暴抑制剂,与给予生理盐水的对照相比,可显著抑制细胞因子量。可知:特别是来自牙髓的干细胞evs(实施例1)可较来自脂肪的干细胞evs(实施例2)和来自骨髓的干细胞evs(实施例3)更显著地抑制细胞因子量。
[0289]
需要说明的是,虽然没有使用实施例4的来自脐带的干细胞evs,但具有实施例2的来自脂肪的干细胞evs与实施例3的来自骨髓的干细胞evs之间的sod3蛋白量和sod3活性,由此推断:可调整实施例2与3的中间程度的倾向的细胞因子量。
[0290]
《在体外确认细胞因子风暴的抑制》
[0291]
进行小鼠模型中的细胞因子风暴的诱导,利用以下的方法在体外确认了包含外来体的各实施例的细胞因子风暴抑制剂的细胞因子风暴抑制效果。
[0292]
每1组分别使用了6只c57bl/6j系统的8周龄小鼠。
[0293]
对于各小鼠,以20mg/kg体重向小鼠的腹腔内给予了作为细胞因子风暴诱导剂的脂多糖(lps)。
[0294]
在刚刚给予脂多糖后,立即自各小鼠的尾静脉分别给予了等量的10μg的各实施例的细胞因子风暴抑制剂(经超离心法纯化)和作为对照的生理盐水中的1种。
[0295]
在24小时后采集全血,分取了小鼠的细胞因子风暴中的血清。使用immune monitoring 48-plex mouse procartaplex(注册商标)panel(invitrogen公司制造)进行了小鼠的细胞因子风暴中的血清中所含的细胞因子的定量。同时,对给予脂多糖之前的正常小鼠也进行全血采集,同样地进行了血清中所含的细胞因子的定量。定量化的细胞因子为il-2、il-4、il-6、il-10、il-17、ifnγ和tnfα。
[0296]
所得结果见下述表3。
[0297]
[表3]
[0298][0299]
由上述表3可知:通过对于诱导细胞因子风暴而使各细胞因子量增多的动物(小鼠)给予各实施例的细胞因子风暴抑制剂,与给予了生理盐水的对照相比,可显著地抑制细胞因子量。可知:特别是来自牙髓的干细胞evs(实施例1)可较来自脂肪的干细胞evs(实施例2)和来自骨髓的干细胞evs(实施例3)更显著地抑制细胞因子量。
[0300]
需要说明的是,虽然没有使用实施例4的来自脐带的干细胞evs,但具有实施例2的来自脂肪的干细胞evs与实施例3的来自骨髓的干细胞evs之间的sod3蛋白量和sod3活性,由此推断:可调整实施例2与3的中间程度的倾向的细胞因子量。
[0301]
《因给予lps而致死的障碍小鼠模型的存活率的评价(1)》
[0302]
(1)1次给药的效果的确认
[0303]
进行小鼠模型中的细胞因子风暴的诱导,通过以下的方法在体内确认了包含外来体的各实施例的细胞因子风暴抑制剂的存活率改善效果。
[0304]
slc:每1组分别使用了10只icr系统的小鼠。
[0305]
对于各小鼠,分别以30mg/kg体重向小鼠的腹腔内给予了作为细胞因子风暴诱导剂的脂多糖(lps)。该条件是在96小时以内使小鼠全部死亡的严酷的条件。
[0306]
在从给予lps起6小时后,自各小鼠的尾静脉对每只小鼠分别给予了等量的10μg的各实施例的细胞因子风暴抑制剂(经超离心法纯化)和作为对照的生理盐水中的1种。
[0307]
从给予lps起12小时后开始,每12小时确认了各组小鼠的存活率。所得结果见图2。
[0308]
由图2可知:通过对于诱导了细胞因子风暴的动物(小鼠)给予各实施例的细胞因子风暴抑制剂,与给予了生理盐水的对照相比,可显著地改善存活率。可知:特别是来自牙髓的干细胞evs(实施例1)可较来自脂肪的干细胞evs(实施例2)和来自骨髓的干细胞evs(实施例3)更显著地改善存活率。
[0309]
该存活率的改善暗示了下述的可能性:各实施例的细胞因子风暴抑制剂也修复在细胞因子风暴中损伤的组织。
[0310]
《因给予lps而致死的障碍小鼠模型的存活率评价(2)》
[0311]
(2)2次给药的效果的确认
[0312]
进行小鼠模型中的细胞因子风暴的诱导,通过以下的方法在体内确认了包含外来体的各实施例的细胞因子风暴抑制剂的存活率改善效果。
[0313]
slc:每1组分别使用了10只icr系统的小鼠。
[0314]
对于各小鼠,分别以30mg/kg体重向小鼠的腹腔内给予了作为细胞因子风暴诱导剂的脂多糖(lps)。
[0315]
在从给予lps起6小时后,作为第1次给药,自各小鼠的尾静脉对每只小鼠分别给予了等量的10μg的各实施例的细胞因子风暴抑制剂(经超离心法纯化)和作为对照的生理盐水中的1种。
[0316]
在从给予lps起18小时后,作为第2次给药,自各小鼠的尾静脉对每只小鼠分别给予了等量的10μg的各实施例的细胞因子风暴抑制剂和作为对照的生理盐水中的1种。
[0317]
从给予lps起12小时后开始,每12小时确认了各组小鼠的存活率。所得结果见图3。
[0318]
由图3可知:通过对于诱导了细胞因子风暴的动物(小鼠)给予各实施例的细胞因子风暴抑制剂,与给予了生理盐水的对照相比,可显著地改善存活率。可知:特别是来自牙髓的干细胞evs(实施例1)可较来自脂肪的干细胞evs(实施例2)和来自骨髓的干细胞evs(实施例3)更显著地改善存活率。
[0319]
该存活率的改善暗示了下述的可能性:各实施例的细胞因子风暴抑制剂也修复在细胞因子风暴中损伤的组织。
[0320]
而且,由图2的结果与图3的结果的比较可知:通过第2次给予各实施例的细胞因子风暴抑制剂,与1次给药的情况相比可显著地改善存活率。
[0321]
需要说明的是,根据nature communications(2016)7:11498记载了:在对每只给予了600μg lps的c57bl/6系统的小鼠给予抗il-6抗体时,在给予了对照的抗体的小鼠中,
在从给予lps起96小时后小鼠全部死亡的条件下存活率为75%。由该论文的记载与图2和图3的结果的比较可知:虽然小鼠或实验系统存在差别,但各实施例的细胞因子风暴抑制剂(特别是实施例1的细胞因子风暴抑制剂)在存活率的评价中起到与抗il-6抗体几乎同等的效果。
[0322]
《因给予lps而致死的障碍小鼠模型的存活率的评价(3)》
[0323]
(3)纯化的微小颗粒与培养上清的比较
[0324]
进行小鼠模型中的细胞因子风暴的诱导,与直接使用来自牙髓的干细胞的培养上清的情况相比,通过以下的方法在体内确认了包含来自牙髓的干细胞外来体的实施例1的细胞因子风暴抑制剂的存活率的改善效果。
[0325]
slc:每1组分别使用了5只icr系统的小鼠。
[0326]
对于各小鼠,分别以30mg/kg体重向小鼠的腹腔内给予了作为细胞因子风暴诱导剂的脂多糖(lps)。
[0327]
在从给予lps起6小时后,作为第1次给药,自各小鼠的尾静脉对每只小鼠给予了10μg的实施例1的细胞因子风暴抑制剂(经超离心法纯化)、对每只小鼠给予了0.5ml的来自牙髓的干细胞的培养上清和对每只小鼠给予了10μg的作为对照的生理盐水。所使用的来自牙髓的干细胞的0.5ml的培养上清包含相当于10μg的实施例1的细胞因子风暴抑制剂的量的外来体。
[0328]
在从给予lps起18小时后,作为第2次给药,自各小鼠的尾静脉给予了与第1次给药等量的实施例1的细胞因子风暴抑制剂、来自牙髓的干细胞的培养上清和作为对照的生理盐水。
[0329]
从给予lps起12小时后开始,每12小时确认了各组小鼠的存活率。所得结果见图4。
[0330]
由图4可知:通过对于诱导了细胞因子风暴的动物(小鼠)给予包含来自牙髓的干细胞外来体的实施例1的细胞因子风暴抑制剂,与直接使用来自牙髓的干细胞的培养上清的情况和给予了生理盐水的对照相比,可显著地改善存活率。
[0331]
包含来自牙髓的干细胞外来体的实施例1的细胞因子风暴抑制剂的存活率的改善暗示了下述的可能性:与直接使用来自牙髓的干细胞的培养上清的情况相比,进一步修复在细胞因子风暴中损伤的组织。《因给予lps而致死的障碍小鼠模型的存活率的评价(4)》
[0332]
(4)纯化的微小颗粒与干细胞的比较
[0333]
进行小鼠模型中的细胞因子风暴的诱导,与直接使用来自牙髓的干细胞的情况相比,通过以下的方法在体内确认了包含来自牙髓的干细胞外来体的实施例1的细胞因子风暴抑制剂的存活率的改善效果。
[0334]
slc:每1组分别使用了5只icr系统的小鼠。
[0335]
对于各小鼠,以30mg/kg体重向小鼠的腹腔内给予了作为细胞因子风暴诱导剂的脂多糖(lps)。
[0336]
在从给予lps起6小时后,自各小鼠的尾静脉对每只小鼠给予了10μg的实施例1的细胞因子风暴抑制剂(经超离心法纯化)、对每只小鼠给予了2
×
106个细胞的来自牙髓的干细胞和对每只小鼠给予了10μg的作为对照的生理盐水。所使用的来自牙髓的干细胞的量(每只小鼠为2
×
106个细胞)是通常对动物进行细胞给药的最大数(不会致死的最大数),作为比较实验为适当的量。
[0337]
从给予lps起12小时后开始,每12小时确认了各组小鼠的存活率。所得结果见图5。
[0338]
由图5可知:通过对于诱导了细胞因子风暴的动物(小鼠)给予包含来自牙髓的干细胞外来体的实施例1的细胞因子风暴抑制剂,与直接使用来自牙髓的干细胞的情况和给予了生理盐水的对照相比,可显著地改善存活率。
[0339]
包含来自牙髓的干细胞外来体的实施例1的细胞因子风暴抑制剂的存活率的改善暗示了下述的可能性:与直接使用来自牙髓的干细胞的情况相比,进一步修复在细胞因子风暴中损伤的组织。
[0340]
《因给予lps而致死的障碍小鼠模型的存活率的评价(5)》
[0341]
(5)2次给药的时期的比较
[0342]
进行小鼠模型中的细胞因子风暴的诱导,为了将包含来自牙髓的干细胞外来体的实施例1的细胞因子风暴抑制剂的存活率的改善效果与直接使用来自牙髓的干细胞的培养上清的情况进行比较、同时将2次给药的时期的影响与存活率的评价(3)的情况进行比较,通过以下的方法在体内进行了确认。
[0343]
slc:每1组分别使用了5只icr系统的小鼠。
[0344]
首先,与存活率的评价(3)同样地,对于各小鼠给予lps,在从给予lps起6小时后和18小时后,对每只小鼠给予了10μg的实施例1的细胞因子风暴抑制剂(经超离心法纯化)、对每只小鼠给予了0.5ml的来自牙髓的干细胞的培养上清和对每只小鼠给予了10μg的作为对照的生理盐水。从给予lps起12小时后开始,每12小时确认了各组小鼠的存活率。所得结果见图6。
[0345]
接下来,对于各小鼠给予lps,在从给予lps起0小时后(与给予lps同时)和12小时后,对每只小鼠给予了10μg的实施例1的细胞因子风暴抑制剂(经超离心法纯化)、对每只小鼠给予了0.5ml的来自牙髓的干细胞的培养上清和对每只小鼠给予了10μg的作为对照的生理盐水。从给予lps起12小时后开始,每12小时确认了各组小鼠的存活率。所得结果见图7。
[0346]
由图6和图7可知:对于诱导了细胞因子风暴的动物(小鼠),通过如图7那样在与细胞因子风暴发生(lps给予)的同时(0小时后)和12小时后2次给予包含来自牙髓的干细胞外来体的实施例1的细胞因子风暴抑制剂,如图6那样在与从细胞因子风暴发生(给予lps)起6小时后和18小时后2次给予的情况相比,可进一步显著地改善存活率。
[0347]
包含来自牙髓的干细胞外来体的实施例1的细胞因子风暴抑制剂的存活率的改善暗示了下述的可能性:与直接使用来自牙髓的干细胞的培养上清的情况相比,进一步修复在细胞因子风暴中损伤的组织。
[0348]
《损伤的组织的修复》
[0349]
针对用于存活率的评价(1)~(5)的小鼠,根据各小鼠的肺、肝脏等所有脏器的组织的照片,确认了包含外来体的各实施例的细胞因子风暴抑制剂修复在细胞因子风暴中损伤的全身组织、特别是所有脏器的效果。
[0350]
其结果可知:通过对于诱导细胞因子风暴而使各细胞因子量增多的动物(小鼠)给予各实施例的细胞因子风暴抑制剂,与给予了生理盐水的对照相比,可修复在细胞因子风暴中损伤的各组织。可知:特别是来自牙髓的干细胞evs(实施例1)可较来自脂肪的干细胞evs(实施例2)和来自骨髓的干细胞evs(实施例3)更显著地修复在细胞因子风暴中损伤的肺组织或肝脏组织。
[0351]
该损伤组织的修复暗示了改善细胞因子风暴的后遗症。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
