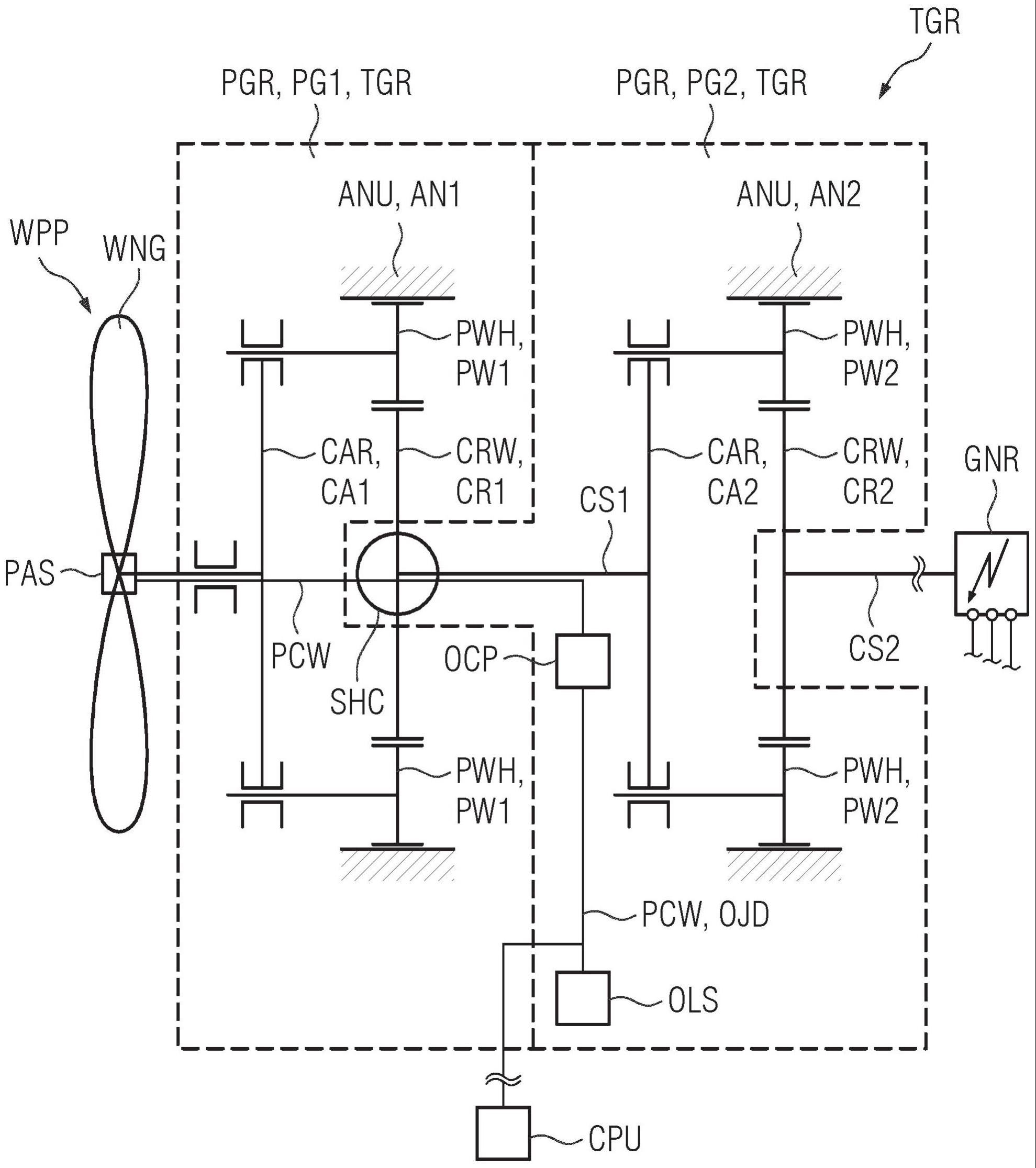
1.本发明涉及一种新型多奈哌齐醚棕榈酸酯(donepezil ether palmitate)或其药用盐,以及包含其作为主要成分的缓释药物组合物。具体地,本发明涉及多奈哌齐醚棕榈酸酯或其药用盐,以及包含其的可注射组合物,其在体内施用时能够维持活性成分多奈哌齐的恒定血药浓度,并且在无副作用风险的情况下在长时间内供应活性成分。
背景技术:
2.痴呆是指与复杂的认知损害相关的疾病,其表现为记忆丧失、智力衰退、人格改变、行为异常等。换句话说,痴呆是一种退行性颅神经疾病,其是由于引起中枢神经系统退行性疾病的慢神经细胞死亡而由神经网络中的不可逆功能障碍引起的,并且最终导致人体功能的永久性丧失。
3.痴呆的机制尚未被完全阐明,但是已知的是,与正常人相比,在痴呆患者的大脑中,合成乙酰胆碱(下文中称为ach)的胆碱乙酰转移酶(下文中称为chat)减少了约20%至30%,并且乙酰胆碱(一种神经递质)的浓度减少了约16%至30%。作为上述研究的结果,已经进行了使用抑制乙酰胆碱酯酶(下文中称为ache)的抑制剂作为间接治疗方法的研究,所述乙酰胆碱酯酶是一种水解乙酰胆碱(一种神经递质)的酶。
4.乙酰胆碱酯酶是这样的酶,该酶将乙酰胆碱(介导体内副交感神经的活动的神经递质之一)水解成胆碱和乙酸盐,并且其在内质网膜中形成并且移动到细胞膜以发挥其功能。该酶是一种重要的酶,其在胆碱能神经及其周围(尤其是在神经肌肉接头中)分布最多,并且在血浆、肝脏以及其他组织中均有发现。
5.目前使用的用于痴呆的大多数治疗剂是乙酰胆碱酯酶抑制剂,这包括多奈哌齐(donepezil)(商品名:aricept)、他克林(tacrine)(商品名:cognex)、利凡斯的明(rivastigmine)(商品名:exelon)、加兰他敏(galantamine)(商品名:reminyl)等。
6.第一代乙酰胆碱酯酶抑制剂包括他克林,其是首次被批准作为抗痴呆治疗剂的药物。然而,他克林因作用持续时间短而需要每天施用4次,并且具有引起肝毒性的问题。
7.第二代乙酰胆碱酯酶抑制剂包括多奈哌齐,其是由以下化学式表示的化合物。多奈哌齐于1996年在美国被批准用于治疗痴呆,并且已知为用于轻度和中度或更重度阿尔茨海默病(alzheimer's disease)的治疗剂,其大多数以片剂形式口服施用。
[0008][0009]
然而,已知的是,多奈哌齐片剂的口服施用在一些患者中引起胃肠副作用诸如腹泻、恶心、食欲不振、肌肉痉挛等。另外,目前可商购获得的盐酸多奈哌齐的口服制剂通常以
5mg的起始剂量在睡前每天施用一次,并且使用4至6周,然后将剂量增加至10mg,每天一次。然而,以这样的方式的治疗方法具有药物依从性低的缺点,因为制剂必须每天口服施用,特别是对于患有痴呆的患者。
[0010]
近年来,口服崩解片剂对于吞咽困难的患者是可商购获得的。此外,当难以进行口服施用时,已经提出了软膏制剂的透皮施用(日本公开(平)第11-315016号)。另外,已经提出了软膏剂、栓剂等以解决在其中痴呆症状显著进展的状态下难以口服服用药物的情形。然而,这些制剂也具有必须在长时间段内连续施用活性成分的问题。
[0011]
为了长时间段保持稳定的药物浓度,同时通过减少药物施用频率来改善患者便利性和依从性,存在配制缓释注射剂的方法。然而,当施用缓释注射剂时,很难确保药物在长时间段内持续且均匀地释放,同时在体内保持其生物活性。
[0012]
特别地,由于缓释注射剂具有高初始突释,其可引起包括毒性反应在内的副作用,所以需要消除或至少最小化高初始突释。
[0013]
因此,需要开发一种能够抑制多奈哌齐的高初始突释并且在长时间段内持续释放多奈哌齐的制剂。
[0014]
因此,本发明的发明人开发了多奈哌齐醚棕榈酸酯,其中在多奈哌齐中引入醚棕榈酸酯基团,以能够在体内持续且均匀地释放多奈哌齐,同时降低多奈哌齐的高初始突释,并且完成了本发明。
技术实现要素:
[0015]
技术问题
[0016]
本发明的一个目的是提供多奈哌齐醚棕榈酸酯或其药用盐,以及含有其的药物组合物,其在施用到体内时能够在低副作用风险的情况下改善痴呆患者的药物治疗依从性。
[0017]
具体地,本发明提供了多奈哌齐醚棕榈酸酯或含有其的缓释药物组合物,其能够降低多奈哌齐的初始突释以降低副作用(诸如药物毒性)的风险,并且允许多奈哌齐在长时间内在体内均匀释放以提高对于痴呆患者的药物治疗效果。
[0018]
技术方案
[0019]
本发明提供了一种由以下化学式1表示的化合物或其药用盐:
[0020]
[化学式1]
[0021][0022]
在以上化学式中,
[0023]
r1和r2各自独立地是氢、卤素、羟基、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基或芳基;并且
[0024]
r3是c
12-c
16
烷基。
[0025]
此外,本发明提供了一种用于预防或治疗痴呆的缓释药物组合物,其包含由化学式1表示的化合物或其药用盐。
[0026]
此外,本发明提供了由以下化学式2表示的2-(十四烷氧基)乙酸2-((1-苄基哌啶-4-基)甲基)-5,6-二甲氧基-1h-茚-3-基酯或其药用盐:
[0027]
[化学式2]
[0028][0029]
此外,本发明涉及一种用于预防或治疗痴呆的缓释药物组合物,其包含由化学式2表示的化合物或其药用盐。
[0030]
由化学式2表示的化合物的化学名称是“2-(十四烷氧基)乙酸2-((1-苄基哌啶-4-基)甲基)-5,6-二甲氧基-1h-茚-3-基酯”,并且在本发明中,将根据本发明的其中将醚棕榈酸酯基团引入到多奈哌齐中的化合物被称为多奈哌齐醚棕榈酸酯(dep)。
[0031]
本发明的多奈哌齐醚棕榈酸酯可以通过使多奈哌齐游离碱与2-(十四烷氧基)乙酰氯反应来制备。
[0032]
2-(十四烷氧基)乙酰氯可以通过包括以下步骤的方式制备:(i)混合1-十四烷醇、氯乙酸钠和氢氧化钾以获得2-(十四烷氧基)乙酸钠;(ii)使2-(十四烷氧基)乙酸钠与hcl水溶液反应以获得2-(十四烷氧基)乙酸;和(iii)使2-(十四烷氧基)乙酸与草酰氯反应。
[0033]
本发明的药物组合物可以被配制为用于肠胃外施用(例如肌内注射、静脉内注射、皮下注射、皮内注射或静脉内滴注的制剂,优选地被配制为用于肌内注射的制剂。
[0034]
本发明的药物组合物优选地每2至20周施用一次,更优选地每4至16周施用一次。
[0035]
有利效果
[0036]
本发明的多奈哌齐醚棕榈酸酯或其药用盐以及含有其作为主要成分的缓释药物组合物可以在施用到体内之后具有低的多奈哌齐的初始突释,由此最小化包括毒性反应在内的副作用的风险,并且可以在长时间内在血液中维持多奈哌齐的有效浓度以展现出治疗效果(即使是在单次施用的情况下),由此改善痴呆患者的药物治疗依从性。
附图说明
[0037]
图1示出了在向大鼠施用多奈哌齐(d)之后测量的血液中的多奈哌齐的浓度。
[0038]
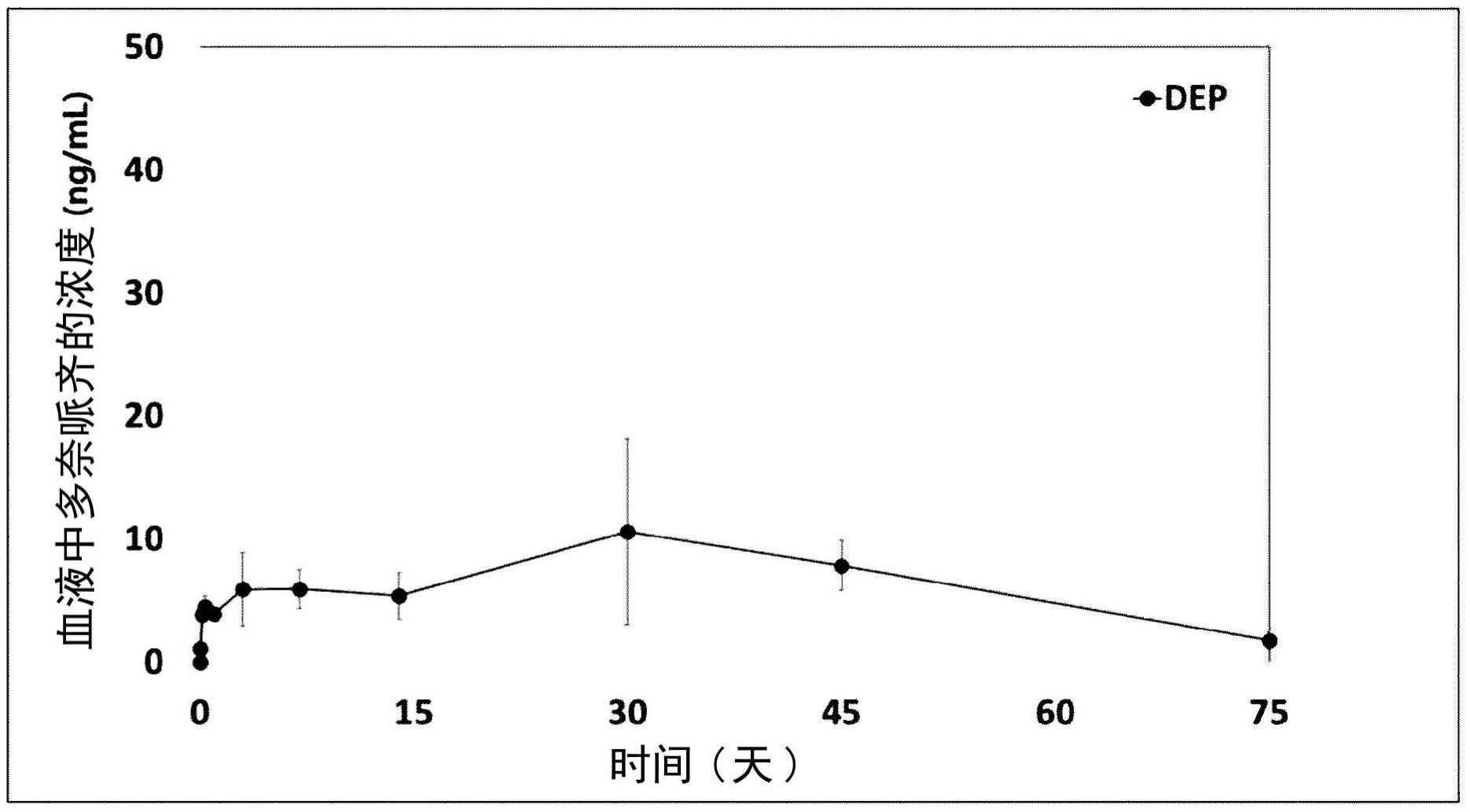
图2示出了在向大鼠施用多奈哌齐醚棕榈酸酯(dep)之后测量的血液中的多奈哌齐的浓度。
具体实施方式
[0039]
定义
[0040]
如本文中使用的,“烷基”是具有伯、仲、叔或季碳原子的烃,并且包括可以是直链、支链或环状或者其组合的饱和脂族基团。例如,烷基可以具有1至20个碳原子(即c
1-c
20
烷基)、1至10个碳原子(即c
1-c
10
烷基)或1至6个碳原子(即c
1-c6烷基)。合适的烷基的实例可以包括但不限于甲基(me,-ch3)、乙基(et,-ch2ch3)、1-丙基(n-pr,正丙基,-ch2ch2ch3)、2-丙基(i-pr,异丙基,-ch(ch3)2)、1-丁基(n-bu,正丁基,-ch2ch2ch2ch3)、2-甲基-1-丙基(i-bu,异丁基,-ch2ch(ch3)2)、2-丁基(s-bu,仲丁基,-ch(ch3)ch2ch3)、2-甲基-2-丙基(t-bu,叔丁基,-c(ch3)3)、1-戊基(正戊基,-ch2ch2ch2ch2ch3)、2-戊基(-ch(ch3)ch2ch2ch3)、3-戊基(-ch(ch2ch3)2)、2-甲基-2-丁基(-c(ch3)2ch2ch3)、3-甲基-2-丁基(-ch(ch3)ch(ch3)2)、3-甲基-1-丁基(-ch2ch2ch(ch3)2)、2-甲基-1-丁基(-ch2ch(ch3)ch2ch3)、1-己基(-ch2ch2ch2ch2ch2ch3)、2-己基(-ch(ch3)ch2ch2ch2ch3)、3-己基(-ch(ch2ch3)(ch2ch2ch3))、2-甲基-2-戊基(-c(ch3)2ch2ch2ch3)、3-甲基-2-戊基(-ch(ch3)ch(ch3)ch2ch3)、4-甲基-2-戊基(-ch(ch3)ch2ch(ch3)2)、3-甲基-3-戊基(-c(ch3)(ch2ch3)2)、2-甲基-3-戊基(-ch(ch2ch3)ch(ch3)2)、2,3-二甲基-2-丁基(-c(ch3)2ch(ch3)2)、3,3-二甲基-2-丁基(-ch(ch3)c(ch3)3)和辛基(-(ch2)7ch3)。
[0041]“烷氧基”是指具有-o-烷基部分的基团,其中如上所定义的烷基通过氧原子连接至母体化合物。烷氧基的烷基部分可以具有例如1至20个碳原子(即c
1-c
20
烷氧基)、1至12个碳原子(即c
1-c
12
烷氧基)、1至10个碳原子(即c
1-c
10
烷氧基)或1至6个碳原子(即c
1-c6烷氧基)。合适的烷氧基的实例可以包括但不限于甲氧基(-o-ch3或-ome)、乙氧基(-och2ch3或-oet)和叔丁氧基(-oc(ch3)3或-o-tbu)。
[0042]
如本文中使用的,术语“卤代”和“卤素”意指卤素并且包括氯代、氟代、溴代和碘代。
[0043]“卤代烷基”是其中如上所定义的烷基的氢原子中的至少一个被卤素原子替代的烷基。卤代烷基的烷基部分可以具有例如1至20个碳原子(即c
1-c
20
卤代烷基)、1至12个碳原子(即c
1-c
12
卤代烷基)、1至10个碳原子(即c
1-c
10
卤代烷基)或1至6个碳原子(即c
1-c6卤代烷基)。卤代烷基的实例可以包括但不限于-cf3、-chf2、-cfh2和-ch2cf3。
[0044]“芳基”包括单环、双环或多环的、取代或未取代的、一价或二价的芳族烃基,其中环的每个原子都是碳。优选地,芳环是6至20元环、6至14元环、6至10元环或更优选地6元环。芳基可以是具有两个或更多个环状环(其中两个相邻环共有两个或更多个碳)的多环环体系,其中这些环中的至少一个是芳族的并且其他环状环可以是例如环烷基、环烯基、环炔基、芳基、杂芳基和/或杂环烷基。芳基可以包括苯、萘、菲、蒽、茚、茚满、苯酚、苯胺等。
[0045]
当与诸如烷基、卤代烷基或烷氧基的化学部分一起使用时,术语“cx-y”或“cx-cy”意指包括在链中含有x至y个碳的基团。如果基团位于碳链末端,则c0烷基表示氢,或者如果其位于链内,则c0烷基表示键。例如,c
1-c
20
烷基在链中含有1至20个碳原子。
[0046]
在下文中,将通过以下实施例更详细地描述本发明。然而,提供这些实施例仅用于举例说明目的以有利于对本发明的理解,并且本发明的范围不受以下实施例限制。
[0047]
[实施例1]
[0048]
合成2-(十四烷氧基)乙酰氯(eps-cl)
[0049][0050]
1)制备2-(十四烷氧基)乙酸钠(eps-na)
[0051]
向反应容器中加入400g的1-十四烷醇并且在60℃溶解,然后加入108.7g的氯乙酸钠和108ml的正庚烷。向反应溶液中加入78.5g的氢氧化钾,并且将混合物加热至85℃并且搅拌3小时。向反应溶液中注入980ml的正庚烷和2.2l的乙醇,并且将反应溶液在60℃搅拌1小时,并且冷却至室温,接着过滤以获得263.3g的2-(十四烷氧基)乙酸钠化合物。
[0052]
(1h nmr(cd3od,400mhz)δ3.83(s,2h),3.48(t,j=6.9hz,2h),1.65~1.57(m,2h),1.37~1.29(m,22h),0.90(t,j=6.9hz,3h))。
[0053]
2)制备2-(十四烷氧基)乙酸(eps-酸)
[0054]
向反应容器中,将263.3g的在1)中制备的2-(十四烷氧基)乙酸钠加入到2.2l的乙酸乙酯中并且搅拌,然后注入1.45l的2m hcl水溶液并且在室温下搅拌2小时。使所得产物经历层分离以获得有机层,然后用1.45l的净化水洗涤两次。将所获得的有机层用1.45l的饱和氯化钠水溶液洗涤。在获得有机层之后,将其用无水硫酸钠干燥,过滤,并且在减压下浓缩。将浓缩的化合物溶解在1.63l的正己烷中,然后将混合物在0℃搅拌1小时。将沉淀的固体过滤以获得110.6g的2-(十四烷氧基)乙酸化合物。
[0055]
(1h nmr(cdcl3,400mhz)δ4.11(s,2h),3.56(t,j=6.7hz,2h),1.66~1.59(m,2h),1.36~1.25(m,22h),0.88(t,j=7.2hz,3h))。
[0056]
3)制备2-(十四烷氧基)乙酰氯(eps-cl)
[0057]
向反应容器中加入50.0g的在上述
‘
2)’中制备的2-(十四烷氧基)乙酸,并且通过注入500ml的二氯甲烷和0.5ml的二甲基甲酰胺来溶解。向反应溶液中注入16.5ml的草酰氯并且在室温下搅拌3小时。在反应完成后,通过在减压下蒸馏来移除溶剂以获得53.4g的2-(十四烷氧基)乙酰氯化合物。
[0058]
(1h nmr(cdcl3,400mhz)δ4.39(s,2h),3.56(t,j=6.6hz,2h),1.64~1.57(m,2h),1.36~1.25(m,22h),0.88(t,j=6.8hz,3h))。
[0059]
[实施例2]
[0060]
制备多奈哌齐醚棕榈酸酯(dep)[2-(十四烷氧基)乙酸2-((1-苄基哌啶-4-基)甲基)-5,6-二甲氧基-1h-茚-3-基酯]
[0061][0062]
向反应容器中加入63.3g的多奈哌齐游离碱(购自jinan chenghui-shuangda chemical co.,ltd),然后注入190ml的四氢呋喃和127ml的dmpu(1,3-二甲基-3,4,5,6-四氢-2(1h)-嘧啶酮),溶解,并且冷却至-20℃。在30分钟内向反应溶液中注入183.5ml的nahmds(1.0m四氢呋喃溶液),并且将混合物在-20℃搅拌1小时。在-20℃在40分钟内将反应
(十二烷氧基)乙酰氯化合物。
[0076]
(1h nmr(cdcl3,400mhz)δ4.39(s,2h),3.57(t,j=6.6hz,2h),1.64~1.57(m,2h),1.36~1.26(m,18h),0.88(t,j=6.8hz,3h))。
[0077]
[实施例4]
[0078]
制备多奈哌齐醚肉豆蔻酸酯(dem)[2-(十二烷氧基)乙酸2-((1-苄基哌啶-4-基)甲基)-5,6-二甲氧基-1h-茚-3-基酯]
[0079][0080]
向反应容器中加入50.0g的多奈哌齐游离碱(购自jinan chenghui-shuangda chemical co.,ltd),然后注入150ml的四氢呋喃和100ml的dmpu(1,3-二甲基-3,4,5,6-四氢-2(1h)-嘧啶酮),溶解,并且冷却至-20℃。在30分钟内向反应溶液中注入145ml的nahmds(1.0m四氢呋喃溶液),并且将混合物在-20℃搅拌1小时。在-20℃在30分钟内将反应溶液注入到其中38.1g的在上述
‘
实施例3-3)’中制备的2-(十二烷氧基)乙酰氯溶解在500ml的四氢呋喃中的溶液中,并且在相同温度下搅拌30分钟。
[0081]
向反应溶液中注入500ml的饱和氯化铵水溶液,加入100g的硅藻土,并且将混合物搅拌10分钟。将反应溶液过滤并且用500ml的乙酸乙酯洗涤并且过滤。使所得产物经历层分离以获得有机层,并且将水层用500ml的乙酸乙酯反萃取。将合并的有机层用500ml的5%氯化钠水溶液洗涤三次。将所获得的有机层用无水硫酸钠干燥,过滤,并且在减压下浓缩。向浓缩的溶液中注入500ml的正己烷,并且将浆液搅拌。将溶液过滤并且将所得滤液在减压下浓缩。将浓缩的溶液用二氧化硅柱纯化并且用750ml的正庚烷重结晶以获得26.7g的多奈哌齐醚肉豆蔻酸酯。
[0082]
(1h nmr(cdcl3,400mhz)δ7.32~7.21(m,5h),6.96(s,1h),6.59(s,1h),4.37(s,2h),3.87(s,3h),3.87(s,3h),3.64(t,j=6.7hz,2h),3.47(s,2h),3.25(s,2h),2.87~2.84(m,2h),2.27(d,j=7.1hz,2h),1.91(t,j=10.8hz,2h),1.71~1.63(m,4h),1.55~1.44(m,1h),1.41~1.25(m,20h),0.88(t,j=6.8hz,3h))。
[0083]
[实施例5]
[0084]
合成2-(十三烷氧基)乙酰氯(epds-cl)
[0085][0086]
1)制备2-(十三烷氧基)乙酸钠(epds-na)
[0087]
向反应容器中加入100.0g的1-十三烷醇并且在60℃溶解,然后加入29.1g的氯乙酸钠和30ml的正庚烷。向反应溶液中加入21.0g的氢氧化钾,并且将混合物加热至85℃并且搅拌3小时。向反应溶液中注入262ml的正庚烷和581ml的乙醇,冷却至室温,并且搅拌16小时。将溶液过滤以获得73.1g的2-(十三烷氧基)乙酸钠化合物。
[0088]
(1h nmr(cd3od,400mhz)δ3.83(s,2h),3.47(t,j=6.9hz,2h),1.64~1.57(m,2h),1.37~1.29(m,20h),0.90(t,j=6.8hz,3h))。
[0089]
2)制备2-(十三烷氧基)乙酸(epds-酸)
[0090]
向反应容器中,将72.2g的在上述
‘
1)’中制备的2-(十三烷氧基)乙酸钠加入到386ml的乙酸乙酯中并且搅拌,然后注入386ml的2m hcl水溶液并且在室温下搅拌1小时。向反应溶液中额外加入145ml的乙酸乙酯,并且将混合物在室温下搅拌2小时。使所得产物经历层分离以获得有机层,并且用386ml的净化水洗涤两次。将所获得的有机层用386ml的10%氯化钠水溶液洗涤。在获得有机层之后,将其用无水硫酸钠干燥,过滤,并且在减压下浓缩。在40℃将浓缩的产物溶解在290ml的正己烷中,并且将混合物在室温下搅拌1小时并且在0至5℃再搅拌1小时。将沉淀的固体过滤并且用60ml的冷正己烷洗涤以获得41.3g的2-(十三烷氧基)乙酸化合物。
[0091]
(1h nmr(cdcl3,400mhz)δ4.10(s,2h),3.56(t,j=6.7hz,2h),1.66~1.59(m,2h),1.37~1.26(m,20h),0.88(t,j=6.8hz,3h))。
[0092]
3)制备2-(十三烷氧基)乙酰氯(epds-cl)
[0093]
向反应容器中加入41.0g的在上述
‘
2)’中制备的2-(十三烷氧基)乙酸并且通过注入410ml的二氯甲烷和0.4ml的二甲基甲酰胺来溶解。向反应溶液中注入16.3ml的草酰氯并且在室温下搅拌2小时。在反应完成后,通过在减压下蒸馏来移除溶剂以获得43.9g的2-(十三烷氧基)乙酰氯化合物。
[0094]
(1h nmr(cdcl3,400mhz)δ4.39(s,2h),3.57(t,j=6.6hz,2h),1.64~1.57(m,2h),1.36~1.26(m,20h),0.88(t,j=6.8hz,3h))。
[0095]
[实施例6]
[0096]
制备多奈哌齐醚十五烷酸酯(depd)[2-(十三烷氧基)乙酸2-((1-苄基哌啶-4-基)甲基)-5,6-二甲氧基-1h-茚-3-基酯]
[0097][0098]
向反应容器中加入54.8g的多奈哌齐游离碱(购自jinan chenghui-shuangda chemical co.,ltd),然后注入164ml的四氢呋喃和110ml的dmpu(1,3-二甲基-3,4,5,6-四氢-2(1h)-嘧啶酮),溶解,并且冷却至-20℃。在30分钟内向反应溶液中注入159ml的nahmds(1.0m四氢呋喃溶液),并且将混合物在-20℃搅拌1小时。在-20℃在30分钟内将反应溶液注入到其中43.9g的在
‘
实施例5-3)’中制备的2-(十三烷氧基)乙酰氯溶解在548ml的四氢呋喃中的溶液中,并且在相同温度下搅拌30分钟。
[0099]
向反应溶液中注入548ml的饱和氯化铵水溶液,加入110g的硅藻土,并且将混合物搅拌10分钟。将反应溶液过滤并且用548ml的乙酸乙酯洗涤并且过滤。使所得产物经历层分离以获得有机层,并且将水层用548ml的乙酸乙酯反萃取。将合并的有机层用548ml的5%氯
化钠水溶液洗涤三次。将所获得的有机层用无水硫酸钠干燥,过滤,并且在减压下浓缩。向浓缩的溶液中注入548ml的正己烷,并且将浆液搅拌。将溶液过滤并且将所得滤液在减压下浓缩。将浓缩的溶液用二氧化硅柱纯化并且用1.37l的正庚烷重结晶以获得27.2g的多奈哌齐醚十五烷酸酯。
[0100]
(1h nmr(cdcl3,400mhz)δ7.32~7.21(m,5h),6.96(s,1h),6.59(s,1h),4.37(s,2h),3.87(s,3h),3.87(s,3h),3.64(t,j=6.7hz,2h),3.47(s,2h),3.25(s,2h),2.87~2.84(m,2h),2.27(d,j=7.1hz,2h),1.91(t,j=10.8hz,2h),1.71~1.63(m,4h),1.55~1.44(m,1h),1.43~1.25(m,22h),0.88(t,j=6.8hz,3h))。
[0101]
[实施例7]
[0102]
合成2-(十五烷氧基)乙酰氯(ehds-cl)
[0103][0104]
1)制备2-(十五烷氧基)乙酸钠(ehds-na)
[0105]
向反应容器中加入200g的1-十五烷醇并且在70℃至80℃溶解,并且注入51ml的正庚烷。向反应溶液中加入51.0g的氯乙酸钠和36.8g的氢氧化钾。将反应溶液加热至90℃并且搅拌4小时。向反应溶液中注入1l的乙醇和450ml的正庚烷,并且将混合物在60℃搅拌1小时。将反应溶液再次冷却至室温并且搅拌15小时。将反应溶液过滤并且用150ml的乙醇和75ml的正庚烷的混合物洗涤,以获得130.7g的2-(十五烷氧基)乙酸钠化合物。
[0106]
(1h nmr(cd3od,400mhz)δ3.83(s,2h),3.47(t,j=6.9hz,2h),1.64~1.57(m,2h),1.37~1.29(m,24h),0.90(t,j=6.9hz,3h))。
[0107]
2)制备2-(十五烷氧基)乙酸(ehds-酸)
[0108]
向反应容器中,将130.4g的在上述
‘
1)’中制备的2-(十五烷氧基)乙酸钠加入到678ml的乙酸乙酯中并且搅拌,然后注入678ml的2m hcl水溶液并且在室温下搅拌1小时。向反应溶液中额外加入255ml的乙酸乙酯,并且将混合物在室温下搅拌1小时。使所得产物经历层分离以获得有机层,并且用678ml的净化水洗涤两次。将所获得的有机层用678ml的饱和氯化钠水溶液洗涤。然后,将所获得的有机层用无水硫酸钠干燥,过滤,并且在减压下浓缩。在40℃将浓缩的化合物溶解在800ml的正己烷中,然后将混合物在室温下搅拌1小时。将反应溶液在0℃再搅拌1小时。将沉淀的固体过滤并且用150ml的冷正己烷洗涤,以获得72.6的2-(十五烷氧基)乙酸化合物。
[0109]
(1h nmr(cdcl3,400mhz)δ4.11(s,2h),3.56(t,j=6.7hz,2h),1.69~1.56(m,2h),1.37~1.25(m,24h),0.88(t,j=6.8hz,3h))。
[0110]
3)制备2-(十五烷氧基)乙酰氯(ehds-cl)
[0111]
向反应容器中加入72.0g的在上述
‘
2)’中制备的2-(十五烷氧基)乙酸并且通过注入720ml的二氯甲烷和0.7ml的二甲基甲酰胺来溶解。向反应溶液中注入25.9ml的草酰氯并且在室温下搅拌2小时。在反应完成后,通过在减压下蒸馏来移除溶剂以获得76.6g的2-(十二烷氧基)乙酰氯化合物。
[0112]
(1h nmr(cdcl3,400mhz)δ4.39(s,2h),3.57(t,j=6.6hz,2h),1.64~1.57(m,2h),1.39~1.25(m,24h),0.88(t,j=6.8hz,3h))。
[0113]
[实施例8]
[0114]
制备多奈哌齐醚十七烷酸酯(dehd)[2-(十五烷氧基)乙酸2-((1-苄基哌啶-4-基)甲基)-5,6-二甲氧基-1h-茚-3-基酯]
[0115][0116]
向反应容器中加入86.7g的多奈哌齐游离碱(购自jinan chenghui-shuangda chemical co.,ltd),然后注入260ml的四氢呋喃和173ml的dmpu(1,3-二甲基-3,4,5,6-四氢-2(1h)-嘧啶酮),溶解,并且冷却至-20℃。在30分钟内向反应溶液中注入251ml的nahmds(1.0m四氢呋喃溶液),并且将混合物在-20℃搅拌1小时并且加热至室温。在-20℃在30分钟内将反应溶液注入到其中76.6g的在上述
‘
实施例7-3)’中制备的2-(十五烷氧基)乙酰氯溶解在870ml的四氢呋喃中的溶液中,并且在相同温度下搅拌30分钟。
[0117]
向反应溶液中注入867ml的饱和氯化铵水溶液,通过硅藻土过滤,然后用867ml的乙酸乙酯洗涤,并且过滤。使所得产物经历层分离以获得有机层,并且将水层用867ml的乙酸乙酯反萃取。将合并的有机层用867ml的5%氯化钠水溶液洗涤三次。所获得的有机层用无水硫酸钠干燥,过滤,并且在减压下浓缩。向浓缩的溶液中注入867ml的正己烷并且在40℃搅拌,并且将温度降回到室温并且将浆液搅拌1小时。将溶液过滤并且将所得滤液在减压下浓缩。将浓缩的溶液用二氧化硅柱纯化并且用2.6l的正庚烷重结晶以获得55.2g的多奈哌齐醚十七烷酸酯.
[0118]
(1h nmr(cdcl3,400mhz)δ7.32~7.21(m,5h),6.96(s,1h),6.59(s,1h),4.37(s,2h),3.87(s,3h),3.87(s,3h),3.64(t,j=6.7hz,2h),3.47(s,2h),3.25(s,2h),2.87~2.84(m,2h),2.27(d,j=7.1hz,2h),1.91(t,j=10.8hz,2h),1.71~1.63(m,4h),1.53~1.45(m,1h),1.41~1.25(m,26h),0.88(t,j=6.8hz,3h))。
[0119]
[实施例9]
[0120]
合成2-(十六烷氧基)乙酰氯(ess-cl)
[0121][0122]
1)制备2-(十六烷氧基)乙酸钠(ess-na)
[0123]
向反应容器中加入104.1g的1-十六烷醇并且在60℃溶解,并且加入25.0g的氯乙酸钠。将反应溶液搅拌10分钟,并且加入25ml的正庚烷和19.0g的氢氧化钾。将反应溶液加热至80℃至90℃并且搅拌3小时。向反应溶液中注入333ml的乙醇和167ml的正庚烷,并且将混合物在60℃搅拌20分钟。将反应溶液冷却至室温,过滤,并且用167ml的乙醇和37ml的正庚烷的混合物洗涤,以获得70.9g的2-(十六烷氧基)乙酸钠化合物。
[0124]
(1h nmr(cd3od,400mhz)δ3.83(s,2h),3.47(t,j=6.8hz,2h),1.64~1.57(m,2h),
1.37~1.29(m,26h),0.90(t,j=6.8hz,3h))。
[0125]
2)制备2-(十六烷氧基)乙酸(ess-酸)
[0126]
向反应容器中,将70.0g的在上述
‘
1)’中制备的2-(十六烷氧基)乙酸钠加入到1.4l的乙酸乙酯并且搅拌,然后注入931ml的2m hcl水溶液并且在室温下搅拌1小时。使所得产物经历层分离以获得有机层,并且用931ml的净化水洗涤两次。将所获得的有机层用931ml的饱和氯化钠水溶液洗涤。然后,将所获得的有机层用无水硫酸钠干燥,过滤,并且在减压下浓缩。在40℃将浓缩的化合物溶解在900ml的正己烷中,然后将混合物在室温下搅拌1小时。将反应溶液在0℃再搅拌1小时。将沉淀的固体过滤并且用210ml的冷正己烷洗涤,以获得44.7g的2-(十六烷氧基)乙酸化合物。
[0127]
(1h nmr(cdcl3,400mhz)δ4.10(s,2h),3.57(t,j=6.7hz,2h),1.66~1.59(m,2h),1.37~1.26(m,26h),0.88(t,j=6.8hz,3h))。
[0128]
3)制备2-(十六烷氧基)乙酰氯(ess-cl)
[0129]
向反应容器中加入44.3g的在上述
‘
2)’中制备的2-(十六烷氧基)乙酸并且通过注入880ml的二氯甲烷和0.5ml的二甲基甲酰胺来溶解。向反应溶液中注入15.2ml的草酰氯并且在室温下搅拌2小时。在反应完成后,通过在减压下蒸馏来移除溶剂以获得47.0g的2-(十六烷氧基)乙酰氯化合物。
[0130]
(1h nmr(cdcl3,400mhz)δ4.39(s,2h),3.56(t,j=6.6hz,2h),1.64~1.57z(m,2h),1.36~1.25(m,26h),0.88(t,j=6.8hz,3h))。
[0131]
[实施例10]
[0132]
制备多奈哌齐醚硬脂酸酯(des)[2-(十六烷氧基)乙酸2-((1-苄基哌啶-4-基)甲基)-5,6-二甲氧基-1h-茚-3-基酯]
[0133][0134]
向反应容器中加入50.9g的多奈哌齐游离碱(购自jinan chenghui-shuangda chemical co.,ltd),然后注入152ml的四氢呋喃和102ml的dmpu(1,3-二甲基-3,4,5,6-四氢-2(1h)-嘧啶酮),溶解,并且冷却至-20℃。在30分钟内向反应溶液中注入147ml的nahmds(1.0m四氢呋喃溶液),并且将混合物在-20℃搅拌1小时并且加热至室温。在-20℃在30分钟内将反应溶液注入到其中47.0g的在上述
‘
实施例9-3)’中制备的2-(十六烷氧基)乙酰氯溶解在508ml的四氢呋喃中的溶液中,并且在相同温度下搅拌30分钟。
[0135]
向反应溶液中注入509ml的饱和氯化铵水溶液,通过硅藻土过滤,然后用500ml的乙酸乙酯洗涤,并且过滤。使所得产物经历层分离以获得有机层,并且将水层用500ml的乙酸乙酯反萃取。将合并的有机层用509ml的5%氯化钠水溶液洗涤三次。将所获得的有机层用无水硫酸钠干燥,过滤,并且在减压下浓缩。向浓缩的溶液中注入509ml的正己烷并且在40℃搅拌,并且将温度降回到室温并且将浆液搅拌1小时。将溶液过滤并且将所得滤液在减压下浓缩。将浓缩的溶液用二氧化硅柱纯化并且用1.5l的正庚烷重结晶以获得28.7g的多
奈哌齐醚硬脂酸酯。
[0136]
(1h nmr(cdcl3,400mhz)δ7.32~7.21(m,5h),6.96(s,1h),6.59(s,1h),4.38(s,2h),3.87(s,3h),3.87(s,3h),3.64(t,j=6.7hz,2h),3.47(s,2h),3.25(s,2h),2.87~2.84(m,2h),2.27(d,j=7.1hz,2h),1.91(t,j=10.9hz,2h),1.71~1.63(m,4h),1.52~1.45(m,1h),1.41~1.25(m,28h),0.88(t,j=6.7hz,3h))。
[0137]
[实施例11]
[0138]
制备多奈哌齐组合物
[0139]
使用各自具有下表1中的结构的多奈哌齐(d)、实施例2(dep)、实施例4(dem)、实施例6(depd)、实施例8(dehd)和实施例10(des)来制备溶液相组合物。
[0140]
[表1]
[0141]
[0142][0143]
将上表1的主要成分、蓖麻油和苯甲酸苄酯按照下表2的组分和用量进行混合,并且在室温下搅拌0.5至3小时,以制备溶液相组合物。
[0144]
[表2]
[0145]
[0146][0147]
*表示多奈哌齐并且对应于等效剂量
[0148]
[实验例1]
[0149]
药代动力学评价
[0150]
将平均体重为300g的四只雄性sd大鼠肌内注射在多奈哌齐(d)的制剂中的剂量为4mg/kg的多奈哌齐以及各自在dep、dem、depd、dehd和des制剂中的剂量为40mg/kg的多奈哌齐,并且利用lc-ms/ms对sd大鼠的血浆样品中的多奈哌齐的浓度进行分析。
[0151]
作为分析的结果,在dep、dem、depd、dehd和des制剂之中,当施用dep时的释放模式对于缓释组合物是最优选的,并且对于多奈哌齐和dep的结果显示在下表3以及图1和2中。
[0152]
[表3]
[0153] ddepcmax(ng/ml)27.57.9auc
最后
(ngh/ml)367.66290.0
[0154]
如表3和图1所示,确认了当施用多奈哌齐(d)组合物时,药物在施用后立即迅速释放,并且cmax高达27.5ngh/ml,表明引起副作用或毒性的可能性很高。此外,药物的释放在3天内终止,确认了多奈哌齐组合物不适合作为缓释组合物。
[0155]
另一方面,如表3和图2所示,确认了当施用实施例2(dep)的组合物时,即使以约10倍的量施用多奈哌齐,cmax也低至7.9ngh/ml,同时在施用后没有药物的迅速释放,并且在cmax和维持浓度之间的差异很小。此外,与其中施用多奈哌齐(d)组合物的情况不同,确认了即使是在单次施用的情况下,dep组合物也将有效血药浓度维持8周或更长的时间段。
[0156]
因此,可以理解的是,多奈哌齐醚棕榈酸酯(dep)表现出比多奈哌齐更好的释放模式。可以确认的是,当将dep施用到体内时,可以长时间段维持缓释,同时在施用后没有药物的迅速释放,因而具有优异的特性,诸如最小化包括毒性反应在内的副作用的风险,同时即使在单次施用的情况下也能长时间维持有效的治疗药物浓度。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。