治疗庞贝病的组合物和方法
1.相关申请的交叉引用
2.本技术要求2020年2月8日提交的美国临时专利申请号62/971,930和2020年11月19日提交的美国临时专利申请号63/115,975的优先权,将所述申请的内容通过引用以其整体并入本文。
技术领域
3.本技术涉及用于治疗庞贝病(如婴儿期发作的庞贝病(iopd))的组合物和方法。
背景技术:
4.庞贝病(也称为糖原贮积病ii型或gsd-ii)是基因遗传的溶酶体贮积病,其中糖原降解酶酸性α-葡糖苷酶(gaa)的缺乏引起糖原在溶酶体中的积累,从而导致肌无力和心脏扩大(chien,y.和hwu,w.biologics 2007 1:3;kishnani,p.s.等人,genetics in medicine 2006 8)。庞贝病的最严重形式是婴儿期发作的庞贝病(iopd),其中症状开始于生命早期,并且疾病进展极快:iopd症状开始的中值年龄为两个月,并且如果患者不进行治疗,则发生死亡的中值年龄为8.7个月(chien,y.,等人,the journal of pediatrics 2015 166:4;chien,y.和hwu,w.biologics 2007 1:3)。
5.已经开发出使用重组gaa的酶替代疗法(ert)来治疗iopd(例如,kishnani,p.s.等人neurology 2007 68:2)。但是,iopd是难以治疗的疾病,并且仍然存在对在患有iopd的患者中改善长期预后和缓解症状的需要(prater,s.n.等人,genet.med.2012 14:9;chien,y.,等人,the journal of pediatrics 2015 166:4)。因此,本领域中存在对用于治疗庞贝病,并且特别是用于治疗iopd的方法和组合物的需要。
技术实现要素:
6.本技术提供用于在有需要的个体中治疗庞贝病如iopd的方法和组合物。还提供用于治疗庞贝病如iopd的组合物和配制品以及组合物和配制品在制备用于治疗庞贝病如iopd的药物中的用途。
7.本技术的一方面提供一种治疗婴儿期发作的庞贝病(iopd)的方法,所述方法包括向有需要的人个体施用包含寡糖-蛋白质缀合物和药学上可接受的载体的药物组合物,其中所述寡糖-蛋白质缀合物具有式i的结构:
[0008][0009]
其中gaa是酸性α-葡糖苷酶,l是连接所述寡糖与所述gaa的化学接头,并且n是1至10,并且其中所述药物组合物是以约20mg/kg至约40mg/kg的剂量施用。在一些实施方案中,所述药物组合物是以约20mg/kg的剂量施用。在一些实施方案中,所述药物组合物是以约40mg/kg的剂量施用。在一些实施方案中,所述药物组合物是每两周一次施用至个体。在一些实施方案中,所述药物组合物是静脉内施用。在一些实施方案中,将所述药物组合物施用至所述个体持续至少约25周。
[0010]
在根据上述任一种方法的一些实施方案中,所述药物组合物是从包含所述寡糖-蛋白质缀合物的冻干配制品重构的。在一些实施方案中,所述药学上可接受的载体包含不被gaa降解的糖。在一些实施方案中,所述不被gaa降解的糖是甘露醇。在一些实施方案中,所述药学上可接受的载体还包含甘氨酸。在一些实施方案中,所述药学上可接受的载体包含组氨酸。在一些实施方案中,所述药物组合物的ph为约6.2。在一些实施方案中,所述药学上可接受的载体包含约10-50mm组氨酸、约0.25%-2%甘氨酸、约1%-4%甘露醇和约0.005%-0.05%聚山梨醇酯80。在一些实施方案中,所述药学上可接受的载体包含约10mm组氨酸、约2%甘氨酸、约2%甘露醇和约0.01%聚山梨醇酯80。
[0011]
在根据上述任一种方法的一些实施方案中,所述个体在生命第一年诊断时患有心肌病。在一些实施方案中,所述个体患有心律失常。在一些实施方案中,所述个体患有心脏扩大。在一些实施方案中,所述个体是18岁或更年轻。在一些实施方案中,所述个体是约6月龄或更年轻。
[0012]
在根据上述任一种方法的一些实施方案中,所述个体已经接受至少6个月的使用重组gaa的治疗。在一些实施方案中,所述个体在用所述重组gaa治疗后显示临床衰退,其中所述临床衰退是通过评估选自以下的一个或多个参数来确定:呼吸功能、运动技能和心脏参数。在一些实施方案中,所述个体对使用所述重组gaa的治疗具有次最佳临床反应,其中所述临床反应是通过评估选自以下的一个或多个参数来确定:呼吸功能、运动技能和心脏参数。在一些实施方案中,所述个体尚未接受过使用重组gaa的治疗。在一些实施方案中,所述重组gaa是阿葡糖苷酶α。
[0013]
在根据上述任一种方法的一些实施方案中,所述个体是交叉反应性免疫物质(crim)阴性的。在一些实施方案中,所述个体是crim阳性的。
[0014]
在根据上述任一种方法的一些实施方案中,所述方法还包括向所述个体施用有效量的甲氨蝶呤。在一些实施方案中,所述有效量的甲氨蝶呤是在单个周期中或在三个周期中施用。在一些实施方案中,所述甲氨蝶呤是在单个周期中施用。在一些实施方案中,所述甲氨蝶呤是在两个、三个、四个、五个或更多个周期中施用。在一些实施方案中,甲氨蝶呤的周期由1天甲氨蝶呤施用或连续2、3、4、5、6、7、8、9、10或11天甲氨蝶呤施用组成。在一些实施方案中,在选自以下的时间将甲氨蝶呤施用至所述个体:施用所述寡糖-蛋白质缀合物之前、期间和之后中的一个或多个。在一些实施方案中,在施用所述寡糖-蛋白质缀合物之前48小时与之后48小时之间,施用所述甲氨蝶呤。在一些实施方案中,与施用所述寡糖-蛋白质缀合物同时以及在施用所述寡糖-蛋白质缀合物后约24小时和约48小时,施用所述甲氨蝶呤。在一些实施方案中,以约0.1mg/kg至约5mg/kg施用所述甲氨蝶呤。在一些实施方案中,所述方法还包括向所述个体施用另外的免疫耐受诱导疗法。在一些实施方案中,所述另外的免疫耐受诱导疗法包括利妥昔单抗和静脉内免疫球蛋白(ivig)。
[0015]
在根据上述任一种方法的一些实施方案中,所述个体的针对所述寡糖-蛋白质缀合物的抗药抗体(ada)的水平随时间而递减。
[0016]
在根据上述任一种方法的一些实施方案中,当在治疗至少约25周后测量时,所述个体的肌酸激酶(ck)水平降低至少约100iu/l。
[0017]
在根据上述任一种方法的一些实施方案中,当在治疗至少约25周后测量时,所述个体的尿液己糖四糖(hex4)水平降低至少约10mmol/mol。
[0018]
在根据上述任一种方法的一些实施方案中,当在治疗至少约25周后测量时,所述个体的粗大运动功能测量(gmfm-88)得分增加至少5%。
[0019]
在根据上述任一种方法的一些实施方案中,所述个体显示选自以下的一个或多个参数的改善或稳定:呼吸功能、运动技能、心脏参数和眼睑位置。在一些实施方案中,所述改善或稳定是基于选自以下的一个或多个参数来评估:阿尔伯塔婴儿运动量表(alberta infant motor scale,aims)得分、庞贝-儿科残疾评估量表(pompe-pediatric evaluation of disability inventory,pedi)功能技能量表、超声心动图(echo)-左心室质量(lvm)z得分、echo lvmi得分、粗大运动功能分类系统-扩展修订版(gmfcs-e&r)得分、快速运动功能测试、6分钟步行测试(6mwt)、睑裂间距(ipfd)、边缘反射距离-1(mrd-1)、边缘瞳孔距离(mpd)、上睑下垂发作和呼吸支持的使用。在一些实施方案中,所述改善或稳定是基于庞贝-pedi功能技能量表来评估。在一些实施方案中,所述改善或稳定是基于echo-lvm z得分来评估。
[0020]
在根据上述任一种方法的一些实施方案中,所述寡糖-蛋白质缀合物具有式ii的结构:
[0021][0022]
其中gaa是酸性α-葡糖苷酶,l'是化学接头,并且n是1至10。
[0023]
在根据上述任一种方法的一些实施方案中,所述寡糖-蛋白质缀合物具有式iii的结构:
[0024][0025]
其中gaa是酸性α-葡糖苷酶,n是1至10,并且其中m和p独立地选自范围为1至10的整数。在一些实施方案中,m是3并且p是1。在一些实施方案中,n是5-7。
[0026]
在根据上述任一种方法的一些实施方案中,所述gaa是在中国仓鼠卵巢(cho)细胞中产生的人gaa。在一些实施方案中,所述人gaa具有糖型α。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α(avalglucosidase alfa)。
[0027]
本技术的另一方面提供一种配制品,所述配制品包含:(a)寡糖-蛋白质缀合物;以及(b)一种或多种冷冻保护剂,所述冷冻保护剂包含不被酸性α-葡糖苷酶降解的糖;其中所述寡糖-蛋白质缀合物具有式i的结构:
[0028][0029]
其中gaa是酸性α-葡糖苷酶,l'是化学接头,并且n是1至10。在一些实施方案中,所述糖是甘露醇。在一些实施方案中,所述配制品包含约1%-4%(w/w)甘露醇,如约2%甘露醇。
[0030]
在根据上述任一种配制品的一些实施方案中,所述一种或多种冷冻保护剂还包含氨基酸。在一些实施方案中,所述氨基酸是甘氨酸。在一些实施方案中,所述配制品包含约0.25%-2%(w/w)甘氨酸,如约2%甘氨酸。
[0031]
在根据上述任一种配制品的一些实施方案中,所述一种或多种冷冻保护剂还包含表面活性剂。在一些实施方案中,所述表面活性剂是聚山梨醇酯80。在一些实施方案中,所述配制品包含约0.005%-0.05%(w/w)聚山梨醇酯80,如约0.01%聚山梨醇酯80。
[0032]
在根据上述任一种配制品的一些实施方案中,所述配制品还包含缓冲剂。在一些实施方案中,所述缓冲剂是组氨酸。在一些实施方案中,所述配制品包含约10-50mm组氨酸,如约10mm组氨酸。
[0033]
在根据上述任一种配制品的一些实施方案中,所述配制品包含约10mm组氨酸、约2%甘氨酸、约2%甘露醇和约0.01%聚山梨醇酯80。
[0034]
在根据上述任一种配制品的一些实施方案中,所述配制品是冻干配制品。在一些实施方案中,所述配制品是冻干前(即,可冻干)配制品。在一些实施方案中,所述配制品是重构的液体配制品。在一些实施方案中,所述配制品的ph为约5.5至约6.5。在一些实施方案中,所述配制品的ph为约6.2。
[0035]
在根据上述任一种配制品的一些实施方案中,所述配制品包含约5-10mg/ml(例如,约5mg/ml)的所述寡糖-蛋白质缀合物。
[0036]
在根据上述任一种配制品的一些实施方案中,所述寡糖-蛋白质缀合物具有式ii的结构:
[0037][0038]
其中gaa是酸性α-葡糖苷酶,l'是化学接头,并且n是1至10。
[0039]
在根据上述任一种配制品的一些实施方案中,所述寡糖-蛋白质缀合物具有式iii的结构:
[0040][0041]
其中gaa是酸性α-葡糖苷酶,n是1至10,并且其中m和p独立地选自范围为1至10的整数。在一些实施方案中,m是3并且p是1。在一些实施方案中,n是5-7。
[0042]
在根据上述任一种配制品的一些实施方案中,所述gaa是在中国仓鼠卵巢(cho)细胞中产生的人gaa。在一些实施方案中,所述人gaa具有糖型α。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。
[0043]
本技术的另一方面提供一种制品,所述制品包含容器,所述容器包含根据上述任一种配制品的配制品。在一些实施方案中,所述容器是小瓶。在一些实施方案中,所述配制品是冻干配制品。
[0044]
还提供一种治疗庞贝病的方法,所述方法包括向有需要的人个体施用有效量的药物组合物,所述药物组合物包含根据上述任一种配制品的配制品。在一些实施方案中,所述庞贝病是iopd。
[0045]
还提供一种试剂盒,所述试剂盒包含根据上述任一种配制品的配制品。在一些实施方案中,所述试剂盒还包含用于治疗庞贝病(例如,iopd)的说明书。
附图说明
[0046]
图1提供研究设计的示意性总结。群组1以蓝色显示,群组2以橙色显示,并且群组3的两个组以粉色和绿色显示。自基线起的时间从左到右显示。
[0047]
图2a-图2b显示粗大运动功能测量-88(gmfm-88)总百分比得分相对于基线的变化。图2a显示在初步分析期期间,群组1(蓝色)和群组2(橙色)的gmfm-88得分。图2b显示在初步分析期期间,接受阿葡糖苷酶α且之后在第25周后接受艾瓦葡糖苷酶α(粉色)或接受阿葡糖苷酶α(绿色)的群组3的gmfm-88得分。在图2b中,*表示对于一名gmfcs v级患者,没有测量gmfm-88。在图2a-图2b中,x轴显示以周计的自基线起的时间的量,并且y轴显示自基线的变化(平均值
±
标准差)。
[0048]
图3显示按患者年龄随时间变化的庞贝儿科残疾评估量表(庞贝-pedi)功能技能量表:运动性领域量表得分(scaled score)。访视时的患者年龄显示于x轴上,并且量表得分显示于y轴上。群组1个体以蓝色显示,群组2个体以橙色显示,接受阿葡糖苷酶α且之后在第25周后接受艾瓦葡糖苷酶α的群组3个体以粉色显示,并且接受阿葡糖苷酶α的群组3个体以绿色显示。
[0049]
图4a-图4b显示肌酸激酶(ck)水平相对于基线的随时间的变化。图4a显示在初步分析期期间,群组1(蓝色)和群组2(橙色)的ck水平的变化。图4b显示在初步分析期期间,接受阿葡糖苷酶α且之后在第25周后接受艾瓦葡糖苷酶α(粉色)或接受阿葡糖苷酶α(绿色)的群组3的ck水平的变化。在图4a-图4b中,x轴显示以周计的自基线起的时间的量,并且y轴显示自基线的变化(中值)。不同群组在基线时以iu/l计的ck水平如下:群组1平均值:1102.17,标准差:932.43,中值:750,最小值:318.0,以及最大值:2607.0;群组2平均值:1444.80,标准差:164.17,中值:1472,最小值:1188.0,最大值:1645.0;接受艾瓦葡糖苷酶α的群组3平均值:1211.40,标准差:597.45,中值:1528,最小值:347.0,以及最大值:1704.0;以及接受阿葡糖苷酶α且之后在第25周后接受艾瓦葡糖苷酶α的群组3平均值:1136.17,标准差:672.61,中值:1179,最小值:273.0,以及最大值:1830.0。
[0050]
图5a-图5b显示hex4水平相对于基线的随时间的变化。图5a显示在初步分析期期间,群组1(蓝色)和群组2(橙色)的hex4水平的变化。图5b显示在初步分析期期间,接受阿葡糖苷酶α且之后在第25周后接受艾瓦葡糖苷酶α(粉色)或接受阿葡糖苷酶α(绿色)的群组3的hex4水平的变化。在图5a-图5b中,x轴显示以周计的自基线起的时间的量,并且y轴显示自基线的变化(中值)。不同群组在基线时以mmol/mol计的hex4水平如下:群组1平均值:80.25,标准差:48.38,中值:73.12,最小值:16.1,以及最大值:143.3;群组2平均值:63.43,标准差:30.71,中值:71.31,最小值:20.0,最大值:97.3;接受艾瓦葡糖苷酶α的群组3平均值:54.81,标准差:50.41,中值:42.54,最小值:11.9,以及最大值:141.0;以及接受阿葡糖苷酶α且之后在第25周后接受艾瓦葡糖苷酶α的群组3平均值:52.16,标准差:33.93,中值:69.17,最小值:4.2,以及最大值:80.6。
[0051]
图6a-图6d显示眼睑位置测量结果。
[0052]
图7a-图7f显示以下参数在第13周和第25周自基线的平均值
±
标准差(sd):睑裂间距(ipfd;图7a:右眼;图7b:左眼)、边缘反射距离-1(mrd-1;图7c:右眼;图7d:左眼)、边缘瞳孔距离(mpd;图7e:右眼;图7f:左眼)。
[0053]
图8a-图8d显示按群组(图8a)和基线值(图8b)排序的己糖四糖(hex4)自基线至第
25周的变化,以及按群组(图8c)和基线值(图8d)排序的肌酸激酶(ck)自基线至第25周的变化。1:群组1(艾瓦葡糖苷酶α,20mg/kg qow);2:群组2(艾瓦葡糖苷酶α,40mg/kg qow);3:群组3(艾瓦葡糖苷酶α,40mg/kg qow);以及4:群组3(阿葡糖苷酶α,20mg/kg qow至每周40mg/kg)。
[0054]
图9a-图9d显示按群组(图9a)和基线值(图9b)排序的生长运动功能测量-88项(gmfm-88)自基线至第25周的变化,以及按群组(图9c)和基线值(图9d)排序的快速运动功能测试(qmft)自基线至第25周的变化。1:群组1(艾瓦葡糖苷酶α,20mg/kg qow);2:群组2(艾瓦葡糖苷酶α,40mg/kg qow);3:群组3(艾瓦葡糖苷酶α,40mg/kg qow);以及4:群组3(阿葡糖苷酶α,20mg/kg qow至每周40mg/kg)。
[0055]
图10a-图10c显示对于三病例研究的单独参与者,如回顾性图表数据中所记录的以及在艾瓦葡糖苷酶α治疗开始后的粗大运动功能测量-88项(gmfm-88)表现。
[0056]
图11a-图11b显示在基线时年龄》6岁的可行走参与者中,在基线以及第13周和第25周时的6分钟步行测试(6mwt)距离。图11a显示群组2(艾瓦葡糖苷酶α,40mg/kg qow)和群组3(艾瓦葡糖苷酶α,40mg/kg qow)中的结果。图11b显示群组1(艾瓦葡糖苷酶α,20mg/kg qow)和群组3(阿葡糖苷酶α,20mg/kg qow和每周40mg/kg)中的结果。
[0057]
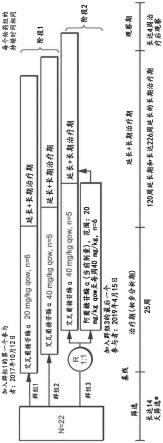
图12显示用于crim阴性患者的示例性剂量方案。在此剂量方案中,ert:酶替代疗法;iti:免疫耐受诱导疗法,即,甲氨蝶呤、利妥昔单抗和ivig。
具体实施方式
[0058]
本技术提供使用寡糖-酸性α-葡糖苷酶(gaa)缀合物治疗庞贝病的组合物和方法,所述庞贝病包括婴儿期发作的庞贝病(iopd),它是庞贝病的最严重形式。在一些实施方案中,本文所述组合物是寡糖-gaa缀合物的冻干配制品,其在储存后和/或在重构后具有高稳定性。在一些实施方案中,所述寡糖-gaa缀合物是艾瓦葡糖苷酶α。艾瓦葡糖苷酶α在人患者中的临床试验显示出本文所述组合物用于治疗庞贝病如iopd的功效,即使在用重组gaa治疗后展现临床衰退或次最佳临床反应的患者中。
[0059]
i.定义
[0060]
本文所用的术语与本领域通常所用的术语相同,除非下文另外定义。
[0061]
术语“酸性α-葡糖苷酶”与“gaa”在本文中可互换使用,是指蛋白质酸性α-葡糖苷酶。在一些实施方案中,所述gaa是重组gaa。在一些实施方案中,所述gaa是人gaa。
[0062]
如本文所用,“治疗(treatment)”或“治疗(treating)”是用于获得有益或所需结果(包括临床结果)的方法。出于本技术的目的,有益或所需临床结果包括但不限于以下中的一种或多种:减少所述疾病所致的一种或多种症状、减小所述疾病的范围、稳定所述疾病(例如,预防或延迟所述疾病的恶化)、预防或延迟所述疾病的扩散、预防或延迟所述疾病的发生或复发、延迟或减慢所述疾病的进展、改善所述疾病状态、提供所述疾病的缓解(部分或完全)、减小治疗所述疾病所需的一种或多种其他药物的剂量、延迟所述疾病的进展、提高生活质量和/或延长存活期。“治疗”还涵盖减少庞贝病(如iopd)的病理后果。本技术的方法考虑了这些治疗方面的任何一个或多个。
[0063]
术语“个体”、“受试者”与“患者”在本文中可互换使用以描述哺乳动物,包括人。在一些实施方案中,所述个体是人。在一些实施方案中,所述个体患有疾病,如iopd。在一些实
施方案中,所述个体需要治疗。
[0064]
如本领域中所理解,“有效量”是指治疗剂或组合物(例如包含艾瓦葡糖苷酶α的组合物)足以产生所需治疗结果(例如,降低iopd的一种或多种症状的严重程度或持续时间、使其稳定或将其消除)或足以实现所需预防结果(例如,诱导对所述治疗剂的免疫耐受)的量。本文中的有效量可以根据诸如以下的因素而变:疾病状态、患者的年龄、性别和体重,以及所述抗体在所述个体中引发所需反应的能力。有效量也是治疗有益效果超过治疗的任何毒性或有害影响的量。对于预防性使用,有益或所需结果包括诸如以下的结果:消除或降低风险、减轻严重程度或延迟所述疾病的发作,所述疾病包括所述疾病的生化、组织学和/或行为症状、其并发症和在所述疾病发展期间呈现出的中间病理表型。对于治疗性使用,有益或所需结果包括例如减少所述疾病导致的一种或多种症状(生化、组织学和/或行为的症状,包括其并发症和在疾病发展期间呈现出的中间病理表型)、提高患有所述疾病的那些患者的生活质量、减少治疗疾病所需的其他药物的剂量、增强另一种药物的效果、延迟所述疾病的进展和/或延长患者存活期。在一些实施方案中,所述治疗剂的有效量可以延长存活期(包括总存活期和无进展存活期);引起客观反应(包括完全反应或部分反应);在一定程度上缓解所述疾病或病症的一种或多种体征或症状;和/或提高所述受试者的生活质量。出于本技术的目的,药物、化合物或药物组合物的有效量是足以直接或间接实现预防性或治疗性治疗的量。
[0065]
如本文所用,“基线值”是指在治疗开始之前或治疗开始时个体的生物标记的值。
[0066]
术语“药物组合物”是指如下制剂:其所呈形式使得其中所含活性成分的生物活性有效,并且其不含对将被施用所述配制品的受试者具有不可接受的毒性的另外的组分。
[0067]“药学上可接受的载体”是指药物配制品中除了活性成分以外的对受试者无毒的一种或多种成分。药学上可接受的载体包括但不限于缓冲液、赋形剂、稳定剂、冷冻保护剂、张度剂、防腐剂及其组合。
[0068]
术语“冻干”、“冻干的”和“冷冻干燥的”是指如下过程,通过所述过程首先冷冻要干燥的材料,然后通过在真空环境中升华来去除冰或冷冻溶剂。冻干前配制品中可以包括赋形剂以增强冻干产物在储存时的稳定性。
[0069]
术语“冻干前配制品”与“可冻干配制品”在本文中可互换使用,是指经历冻干以制备冻干配制品的配制品。
[0070]
术语“包装说明书”用于指治疗产品的商业包装中通常包括的说明书,其含有关于涉及此类治疗产品的使用的适应症、用法、剂量、施用、组合疗法、禁忌证和/或警告的信息。
[0071]“制品”是任何制造物(例如,包装或容器)或试剂盒,其包含至少一种试剂(例如,用于治疗疾病或病症(例如,iopd)的药物)或者用于特异性检测本文所述生物标记的探针。在某些实施方案中,所述制造物或试剂盒是作为用于进行本文所述方法的单元来促销、分发或销售。
[0072]
本文中对“约”某个值或参数的提及包括(并且描述)针对该值或参数本身的变化。例如,提及“约x”的描述包括对“x”的描述。
[0073]
如本文所用,对“并非”某个值或参数的提及通常意指并描述“除了某个值或参数以外”。例如,方法并非用于治疗x型疾病意指所述方法用于治疗除了x以外的类型的疾病。
[0074]
本文所用术语“约x-y”具有与“约x至约y”相同的含义。
[0075]
如本文中以及在所附权利要求中所用,单数形式“一个/一种(a/an)”或“所述(the)”包括复数指代物,除非上下文明确指示其他情况。
[0076]
应理解,为了清晰起见,在单独实施方案的背景中描述的本发明的某些特征也可以在单个实施方案中组合提供。相反,为了简洁起见,在单个实施方案的背景中描述的本发明的多种特征也可以单独提供或以任何合适的子组合来提供。关于本文所述组合物和方法的实施方案的所有组合明确涵盖于本发明中并且公开于本文中,就如同单独且明确地公开每种和每个组合一样。另外,在描述此类变量的实施方案中,所述组合物和方法的特征和特性的所有子组合也明确涵盖于本发明中并且公开于本文中,就如同在本文中单独且明确地公开每种和每个这种子组合一样。
[0077]
ii.治疗方法
[0078]
本技术提供在有需要的个体中使用本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)治疗庞贝病(如婴儿期发作的庞贝病(iopd))的方法。
[0079]
在一些实施方案中,本公开文本提供一种治疗庞贝病的方法,所述方法包括向有需要的人个体施用有效量的药物组合物,所述药物组合物包含寡糖-蛋白质缀合物,其中所述寡糖蛋白质和药学上可接受的载体,其中所述寡糖-蛋白质缀合物具有式i的结构:
[0080][0081]
其中gaa是酸性α-葡糖苷酶,l是连接所述寡糖与所述gaa的化学接头,并且n是1至10。在一些实施方案中,所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述药学上可接受的载体包含组氨酸、甘氨酸、甘露醇和/或聚山梨醇酯80。在一些实施方案中,所述药学上可接受的载体包含约10-50mm(例如,约10mm)组氨酸、约0.25%-2%(例如,约2%)甘氨酸、约1%-4%(例如,约2%)甘露醇和约0.005%-0.05%(例如,约0.01%)聚山梨醇酯80。在一些实施方案中,所述药物组合物的ph为约5.5至约6.5,如约6.2。在一些实施方案中,所述庞贝病是iopd。在一些实施方案中,所述寡糖-蛋白质缀合物具有式(ii)的结构:
[0082][0083]
其中gaa是酸性α-葡糖苷酶,l'是化学接头,并且n是1至10。在一些实施方案中,所述寡糖-蛋白质缀合物具有式(iii)的结构:
[0084][0085]
其中gaa是酸性α-葡糖苷酶,n是1至10,并且m和p独立地选自范围为1至10的整数。在一些实施方案中,m是3并且p是1。在一些实施方案中,n是5-7。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。
[0086]
在一些实施方案中,提供治疗iopd的方法,所述方法包括向有需要的人个体施用包含寡糖-蛋白质缀合物和药学上可接受的载体的药物组合物,其中所述寡糖-蛋白质缀合物具有式i的结构:
[0087][0088]
其中gaa是酸性α-葡糖苷酶,l是连接所述寡糖与所述gaa的化学接头,并且n是1至10,并且其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述寡糖-蛋白质缀合物具有式ii的结构:
[0089]
其中gaa是酸性α-葡糖苷酶,l'是化学接头,并且n是1至10。在一些实施方案中,所述寡糖-蛋白质缀合物具有式iii的结构:
[0090][0091]
其中gaa是酸性α-葡糖苷酶,n是1至10,并且m和p独立地选自范围为1至10的整数。在一些实施方案中,m是3并且p是1。在一些实施方案中,n是5-7。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。
[0092]
在一些实施方案中,提供治疗iopd的方法,所述方法包括向有需要的人个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述个体是6个月大或更年轻。在一些实施方案中,提供治疗iopd的方法,所述方法包括向有需要的人个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述个体在6个月或更年轻时开始接受治疗。在一些实施方案中,所述个体在接所述受寡糖-gaa缀合物之前尚未接受过使用重组gaa的治疗。在一些实施方案中,所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。
[0093]
肌酸激酶(ck,也称为肌酸磷酸激酶)是庞贝病的血清酶生物标记,其指示肌肉损伤;ck水平在患有经典型iopd的患者体内升高(burton,b.k.等人pediatrics 2017 140:s1)。可以进行ck血液测试以测量个体血液中ck酶的量。
[0094]
因此,在本技术的一些实施方案中,提供治疗iopd的方法,所述方法包括向有需要的人个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用,并且其中当在治疗至少约25周后测量时,所述个体的肌酸激酶(ck)水平降低至少约100iu/l。在一些实施方案中,提供降低患有iopd的人个体中的肌酸激酶水平的方法,所述方法包括向所述个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,并且其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。
[0095]
在实施方案中,当在治疗特定持续时间后测量时,ck水平降低至少约以下值中的任一个:50iu/l、60iu/l、70iu/l、80、iu/l、90iu/l、100iu/l、110iu/l、120iu/l、130iu/l、140iu/l、150iu/l、160iu/l、170iu/l、180iu/l、190iu/l、200iu/l、250iu/l、300iu/l、400iu/l、500iu/l、600iu/l、700iu/l、800iu/l或更多。在一些实施方案中,当在治疗特定持
续时间后测量时,所述ck水平降低约以下值中的任一个:50iu/l、60iu/l、70iu/l、80、iu/l、90iu/l、100iu/l、110iu/l、120iu/l、130iu/l、140iu/l、150iu/l、160iu/l、170iu/l、180iu/l、190iu/l、200iu/l、250iu/l、300iu/l、400iu/l、500iu/l、600iu/l、700iu/l、800iu/l或更多,包括这些值之间的任何值或范围。在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述ck水平降低至少约以下值中的任一个:10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述ck水平降低不超过约以下值中的任一个:90%、80%、70%、60%、50%、40%、30%、20%或10%。在一些实施方案中,所述ck水平降低约以下值中的任一种:10%、20%、30%、40%、50%、60%、70%、80%、90%,包括这些值之间的任何值或范围。在一些实施方案中,在治疗约以下值中的任一时间后测量所述ck水平:1个月、3个月、6个月、25周、7个月、8个月、9个月、12个月、2年、5年、10年或更长时间,包括这些值之间的任何值或范围。
[0096]
iopd的另一生物标记是葡萄糖四糖,其在患有庞贝病的患者的尿液和血浆中升高(burton,b.k.等人pediatrics 2017 140:s1)。葡萄糖四糖可以作为尿液中的己糖四糖(hex4)水平来测量,因为hex4是糖原的分解产物。因此,尿液hex4用作糖原贮积的生物标记(burton,b.k.等人pediatrics 2017140:s1)。
[0097]
因此,在本文方法的一些实施方案中,提供治疗iopd的方法,所述方法包括向有需要的人个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用,并且其中当在治疗至少约25周后测量时,所述个体的尿液己糖四糖(hex4)水平降低至少约10mmol/mol。在一些实施方案中,提供降低患有iopd的人个体中的尿液hex4水平的方法,所述方法包括向所述个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,并且其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。
[0098]
在一些实施方案中,当在治疗特定持续时间后测量时,所述个体的尿液hex4水平降低至少约以下值中的任一个:5mmol/mol、6mmol/mol、7mmol/mol、8mmol/mol、9mmol/mol、10mmol/mol、11mmol/mol、12mmol/mol、13mmol/mol、14mmol/mol、15mmol/mol、20mmol/mol、25mmol/mol、30mmol/mol、35mmol/mol、40mmol/mol或50mmol/mol。在一些实施方案中,当在治疗特定持续时间后测量时,所述个体的尿液hex4水平降低约以下值中的任一个:5mmol/mol、6mmol/mol、7mmol/mol、8mmol/mol、9mmol/mol、10mmol/mol、11mmol/mol、12mmol/mol、13mmol/mol、14mmol/mol、15mmol/mol、20mmol/mol、25mmol/mol、30mmol/mol、35mmol/mol、40mmol/mol或50mmol/mol,包括这些值之间的任何值或范围。在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述尿液hex4水平降低至少约10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述尿液hex4水平降低不超过约90%、80%、70%、60%、50%、40%、30%、20%或10%。在一些实施方案中,所述hex4水平降低约以下值中的任一个:10%、20%、30%、40%、50%、60%、70%、80%、90%,包括这些值之间的任何值或范围。在一些实施方案中,在治疗约以下值中的任一时间后测量所述hex4水平:1个月、3个月、6个月、25周、7个月、8个月、9个月、12个月、2年、5年、10年或更长时间,包括这些值之间的任何值或范围。
[0099]
可以使用粗大运动功能测量-88(gmfm-88)得分来评估与iopd相关的肌无力。gmfm-88是88项测量,其考虑到以下五个维度的个体的粗大运动活动:(1)躺卧和翻滚,(2)坐,(3)爬行和跪,(4)站立,以及(5)步行、奔跑和跳跃。选择gmfm-88中的项目来表示截至5岁没有运动障碍的儿童通常进行的运动功能。每一项按4分李克特量表(即,0=无法做到;1=启动[任务的《10%];2=部分完成[任务的10%至《100%];3=任务完成)进行评分。每个维度的得分表示为该维度的最大得分的百分比。通过以下方式获得总得分:将每个维度的百分比得分相加,并将和除以维度总数。因此,每个维度对总得分的贡献相等。
[0100]
gmfm-88测试旨在用于儿童,并且可以用于一岁以下的幼儿。对于gmfm-88不存在截止年龄。在本领域中根据已出版手册(russell,d.j.,等人gross motor function measure(gmfm-66&gmfm-88)user’s manual,第2版2013)使用gmfm-88。尽管最初对于具有除了大脑性瘫痪以外的诊断的儿童没有进行验证,但是gmfm-88已经用于具有运动困难的其他儿童,包括患有成骨不全(russell,d.j.,等人gross motor function measure(gmfm-66&gmfm-88)user’s manual,第2版2013)和急性成淋巴细胞性白血病(wright,m.j.,等人med pediatr oncol.1998 31:2)的儿童。gmfm-88已经用于评价患有庞贝病的儿童和成人(winkel,l.p.等人,ann neurol.2004 55:4),并且可以用于测量继发于肌肉强度的改善或衰退的运动表现随时间的变化。
[0101]
因此,在本文方法的一些实施方案中,提供治疗iopd的方法,所述方法包括向有需要的人个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用,并且其中当在治疗至少约25周后测量时,所述个体的粗大运动功能测量-88(gmfm-88)得分增加至少5%。在一些实施方案中,提供在患有iopd的人个体中改善和/或增加gmfm-88得分的方法,所述方法包括向个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,并且其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。
[0102]
在一些实施方案中,所述gmfm-88得分增加至少约以下值中的任一个:3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%或更多,包括这些值之间的任何值或范围。在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述gmfm-88得分增加至少约以下值中的任一个:5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述gmfm-88得分增加不超过约以下值中的任一个:90%、80%、70%、60%、50%、40%、30%、20%或10%。在一些实施方案中,所述gmfm-88得分增加约以下值中的任一个:5%、10%、20%、30%、40%、50%、60%、70%、80%或90%,包括这些值之间的任何值或范围。在一些实施方案中,在治疗约以下值中的任一时间后测定所述gmfm-88得分:1个月、3个月、6个月、25周、7个月、8个月、9个月、12个月、2年、5年、10年或更长时间,包括这些值之间的任何值或范围。
[0103]
在一些实施方案中,所述个体显示改善或稳定,如通过粗大运动功能分类系统-扩展修订版(gmfcs-e&r)参数所评估。gmfcs-e&r强调世界卫生组织的功能、残疾和健康的国际分类(world health organization's international classification of functioning,disability and health)中的概念。重点是在家庭、工作和社区环境中的日
常表现,而不对运动质量或预后的改善进行评判。gmfcs-e&r是标准化的系统,最初开发用于对患有大脑性瘫痪的儿童的粗大运动功能进行分类(palisano,r.,等人dev.med.child neurol.1997 39:4)。还可以应用gmfcs-e&r来评估庞贝病(例如,spiridigliozzi,g.a.等人mol.genet.metab.2017 121:2)。gmfcs-e&r是用于特定年龄范围的5级分类系统,由基于自发运动的i至v级组成,重点在于坐、转移和运动性。级别之间的区别是基于功能限制、对辅助运动装置的需要以及(在非常低的程度上)运动质量,并且被设计为在日常生活中有意义(palisano r.j.,等人dev med child neurol.2008 50:10)。
[0104]
5个级别的总标题是:
[0105]
·
i级:不受限制的步行
[0106]
·
ii级:受限制的步行
[0107]
·
iii级:使用手持运动装置步行
[0108]
·
iv级:受限制的自身运动性;可能使用动力运动装置
[0109]
·
v级:用手动轮椅移动。
[0110]
因此,在本文方法的一些实施方案中,提供治疗iopd的方法,所述方法包括向有需要的人个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用,并且其中当在治疗至少约25周后测量时,所述个体的gmfcs-e&r得分增加。在一些实施方案中,提供在患有iopd的人个体中改善gmfcs-e&r得分的方法,所述方法包括向所述个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。
[0111]
在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述gmfcs-e&r得分增加至少约以下值中的任一个:10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述gmfcs-e&r得分增加不超过约以下值中的任一个:90%、80%、70%、60%、50%、40%、30%、20%或10%。在一些实施方案中,所述gmfcs-e&r得分增加约以下值中的任一个:10%、20%、30%、40%、50%、60%、70%、80%或90%,包括这些值之间的任何值或范围。在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述gmfcs-e&r得分增加1级、2级、3级或4级。在一些实施方案中,在治疗约以下值中的任一时间后测定gmfcs-e&r得分:1个月、3个月、6个月、25周、7个月、8个月、9个月、12个月、2年、5年、10年或更长时间,包括这些值之间的任何值或范围。
[0112]
在一些实施方案中,所述个体显示选自以下的一个或多个参数的改善或稳定:呼吸功能、运动技能、心脏参数和眼睑位置。示例性参数包括但不限于庞贝-儿科残疾评估量表(pedi)功能技能量表、超声心动图(echo)-左心室质量(lvm)z得分、echo lvmi得分、粗大运动功能分类系统-扩展修订版(gmfcs-e&r)得分、快速运动功能测试、6分钟步行测试(6mwt)、睑裂间距(ipfd)、边缘反射距离-1(mrd-1)、边缘瞳孔距离(mpd)、上睑下垂发作和呼吸支持的使用。在一些实施方案中,在治疗特定持续时间后,相对于基线,所述个体显示一个或多个参数的改善或稳定。治疗的持续时间可以是在以下时间之后:至少约10周、13
周、20周、25周、30周、40周、49周、61周、73周、97周、或100周、5个月、6个月、7个月、8个月、9个月、10个月、11个月、1年、2年、3年、4年、5年或更长时间。
[0113]
在一些实施方案中,所述个体显示一种或多种运动技能的改善或稳定,如通过庞贝儿科残疾评估量表(庞贝-pedi)功能技能量表:运动性领域所评估(haley,s.m.,等人pediatr rehabil 2003 6:2;haley,s.m.,等人pediatr.neurol.2004 31)。庞贝-pedi是专用于庞贝病的儿科残疾评估量表的修改版,并且包括自理和运动性两个项目(例如,头部控制、地面活动、坐、站立等(haley,s.m.,等人pediatr.neurol.2004 31))。原始庞贝-pedi得分是儿童能够从所述评估得到的项目得分之和。标准得分和量表得分以及相关的标准差是从统计学程序生成的,所述统计学程序是作为s.m.,等人pediatr.neurol.2004 31中描述的调查研究的一部分产生的;所述程序要求输入所述受试者的年龄和得分并产生相应的标准得分和量表得分数据。
[0114]
在一些实施方案中,提供在患有iopd的人个体中改善或稳定庞贝-pedi得分的方法,所述方法包括向所述个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。
[0115]
在一些实施方案中,庞贝-pedi功能技能量表:运动性领域量表得分增加至少约以下值中的任一个:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、25、30、40或50分。在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述庞贝-pedi功能技能量表:运动性领域量表得分增加至少约以下值中的任一个:5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述庞贝-pedi功能技能量表:运动性领域量表得分增加不超过约以下值中的任一个:90%、80%、70%、60%、50%、40%、30%、20%或10%。在一些实施方案中,庞贝-pedi功能技能量表:运动性领域量表得分增加约以下值中的任一个:10%、20%、30%、40%、50%、60%、70%、80%或90%,包括这些值之间的任何值或范围。在一些实施方案中,在治疗约以下值中的任一时间后确定庞贝-pedi功能技能量表:运动性领域量表得分:1个月、3个月、6个月、25周、7个月、8个月、9个月、12个月、2年、5年、10年或更长时间,包括这些值之间的任何值或范围。
[0116]
在一些实施方案中,提供在患有iopd的人个体中改善或稳定阿尔伯塔婴儿运动量表(aims)得分的方法,所述方法包括向所述个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。
[0117]
阿尔伯塔婴儿运动量表(aims)评估0-18月龄的婴儿粗大运动技能。其评价婴儿的负重、姿势和反重力(antigravity)运动。参见例如,piper mc等人construction and validation of the alberta infant motor scale(aims).can j public health.1992年7月-8月;83增刊2:s46-50。pmid:1468050。
[0118]
在一些实施方案中,所述个体显示一种或多种运动技能的改善或稳定,如通过快速运动功能测试(qmft)所评估(van capelle,c.i.,等人j inherit metab dis.2012 35:
2)。所述qmft是专用于庞贝病的功能运动量表,其中评价者观察患者的表现并按16个项目(例如,抬高躯干、屈颈、拾取物体等)对其进行评分,每个项目使用5分量表。
[0119]
在一些实施方案中,提供在患有iopd的人个体中改善或稳定qmft得分的方法,所述方法包括向所述个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。
[0120]
在一些实施方案中,所述个体显示qmft量表上的改善。例如,在治疗特定持续时间后,相对于基线,个体可以显示qmft量表上的改善,所述改善为约以下值中的任一个:2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或20%变化。在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述qmft得分增加至少约以下值中的任一个:5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述qmft得分增加不超过约以下值中的任一个:90%、80%、70%、60%、50%、40%、30%、20%或10%。在一些实施方案中,所述qmft得分增加约以下值中的任一个:10%、20%、30%、40%、50%、60%、70%、80%或90%,包括这些值之间的任何值或范围。在一些实施方案中,在治疗约以下值中的任一时间后测定所述qmft得分:1个月、3个月、6个月、25周、7个月、8个月、9个月、12个月、2年、5年、10年或更长时间,包括这些值之间的任何值或范围。
[0121]
在一些实施方案中,所述个体显示一个或多个心脏参数的改善或稳定,如通过超声心动图(echo)终点(如左心室质量指数(lvmi)和/或左心室质量(lvm)z得分)所评估(barker,p.a.c.,等人mol.genet.metab.2010101:4)。心力衰竭是庞贝病患者的主要死因,并且因此在本领域中使用超声心动描记术(也称为echo)来评价对ert的心脏反应(van capelle,c.i.,等人int.journal of cardiology 2018 269)。echo z得分描述给定测量值高于或低于特定体型或年龄的群体平均值的标准差(chubb,h.和j.m.simpson,ann.pediatr.cardiol.2012 5:2)。
[0122]
在一些实施方案中,提供减少患有iopd的人个体的lvmi的方法,所述方法包括向所述个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。
[0123]
在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述lvmi减少至少约以下值中的任一个:10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述lvmi减少不超过约以下值中的任一个:90%、80%、70%、60%、50%、40%、30%、20%或10%。在一些实施方案中,所述lvmi减少约以下值中的任一个:10%、20%、30%、40%、50%、60%、70%、80%、90%,包括这些值之间的任何值或范围。在一些实施方案中,在治疗约以下值中的任一时间后测定所述lvmi:1个月、3个月、6个月、25周、7个月、8个月、9个月、12个月、2年、5年、10年或更长时间,包括这些值之间的任何值或范围。
[0124]
在一些实施方案中,提供减少患有iopd的人个体的lvm z得分的方法,所述方法包
enzyme replacement therapy.j pediatr ophthalmol strabismus.2014;51(6):355-9,将所述文献通过引用并入本文。眼睑位置可以使用闪光摄影术或非闪光摄影术来测量。在一些实施方案中,眼睑位置(例如,ipdf和mpd)是用非闪光摄影术来测量的。在一些实施方案中,所述方法减小个体的ipfd、mrd-1和mpd中的一种或多种。在一些实施方案中,所述方法减小个体的ipfd、mrd-1和mpd。在一些实施方案中,所述减小是在两只眼睛中。在一些实施方案中,所述减小是在一只眼睛中。
[0129]
在一些实施方案中,提供减小患有iopd的人个体的睑裂间距(ipfd)的方法,所述方法包括向所述个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述药物组合物是以每隔一周或每周的频率施用。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。在一些实施方案中,所述减小是在两只眼睛中。在一些实施方案中,所述减小是在一只眼睛中。
[0130]
在一些实施方案中,提供减小患有iopd的人个体的边缘反射距离-1(mrd-1)的方法,所述方法包括向所述个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述药物组合物是以每隔一周或每周的频率施用。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。在一些实施方案中,所述减小是在两只眼睛中。在一些实施方案中,所述减小是在一只眼睛中。
[0131]
在一些实施方案中,提供减小患有iopd的人个体的边缘瞳孔距离(mpd)的方法,所述方法包括向所述个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述药物组合物是以每隔一周或每周的频率施用。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。在一些实施方案中,所述减小是在两只眼睛中。在一些实施方案中,所述减小是在一只眼睛中。
[0132]
在一些实施方案中,所述个体显示一种或多种呼吸功能的改善或稳定,如通过呼吸机使用所评估。iopd患者可能需要使用呼吸机。呼吸机可以是有创或无创的,仅在日间或夜间使用,或者既在日间也在夜间使用。在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述个体在日、周或月期间使用呼吸机的频率更低。在一些实施方案中,当在治疗特定持续时间后测量时,相对于基线,所述个体使用微创呼吸机,所述持续时间如约以下值中的任一个:1个月、3个月、6个月、25周、7个月、8个月、9个月、12个月、2年、5年、10年或更长时间,包括这些值之间的任何值或范围。
[0133]
在一些实施方案中,提供延迟患有iopd的人个体的呼吸机使用的方法,所述方法包括向所述个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。
[0134]
在一些实施方案中,提供延长患有iopd的个体的无有创呼吸机存活期和/或总存活期的方法,所述方法包括向所述个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。在一些实施方案中,无有创呼吸机存活期增加约以下值中的任一个:1年、2年、3年、4年、5年、10年、15年、20年、25年、30年、40年或更长时间,包括这些值之间的任何值或范围。在一些实施方案中,总存活期增加约以下值中的任一个:1年、2年、3年、4年、5年、10年、15年、20年、25年、30年、40年或更长时间,包括这些值之间的任何值或范围。
[0135]
本文所述方法与不良影响的低发生率也相关。在一些实施方案中,提供治疗iopd的方法,所述方法包括向有需要的人个体施用包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)和药学上可接受的载体的药物组合物,其中所述药物组合物是以约20mg/kg至约40mg/kg(例如,约20mg/kg或约40mg/kg)的剂量施用,并且其中所述个体针对所述寡糖-蛋白质缀合物的抗药抗体(ada)的水平随时间而降低。ada可以针对药物如寡糖-蛋白质缀合物而形成。ada具有中和药物作用的潜力,并且因此可以在ert中呈递激发。
[0136]
在一些实施方案中,本文所述方法还包括制备所述药物组合物。在一些实施方案中,所述药物组合物是从冻干配制品重构的。在一些实施方案中,所述药物组合物是从包含所述寡糖-蛋白质缀合物的冻干配制品重构的。
[0137]
在一些实施方案中,提供本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)在制造用于在有需要的人个体中治疗iopd的药物中的用途。在一些实施方案中,提供包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)的药物组合物,其用于在有需要的人个体中治疗iopd。
[0138]
可以将本文所述药物组合物静脉内或用另一种合适的施用途径施用至个体。所述药物组合物的合适的剂量为约20mg/kg至约40mg/kg,包括约以下值中的任一个:20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40mg/kg,包括这些值之间的任何值或范围。在一些实施方案中,所述药物组合物是以约20mg/kg的剂量施用。在一些实施方案中,所述药物组合物是以约40mg/kg的剂量施用。
[0139]
本文所述药物组合物可以以合适的频率来施用,所述频率包括例如每周两次、每周一次、每两周一次、每三周一次或每个月一次。在一些实施方案中,所述药物组合物是每两周一次施用至个体。
[0140]
将本技术的药物组合物施用至个体可以以单剂量或者以重复施用来进行。例如,本文所述药物组合物可以每两周在大约例如1、2、3、4、5、6、7、8、9或10小时内以约20mg/kg至约40mg/kg体重的剂量通过静脉内输注来施用。在一些实施方案中,施用速率可以以例如1mg/kg/h开始,然后在建立患者对所述输注速率的耐受性之后,每30分钟增加例如2mg/kg/h,直至例如7mg/kg/h的最大值。
[0141]
可以将本文所述药物组合物在延长时间段中施用至个体,所述延长时间段包括例如至少约以下值中的任一个:25周、6个月、7个月、8个月、9个月、10个月、11个月、12个月、2年、3年、4年、5年、6年、7年、8年、9年、10年、12年、15年、20年、25年、30年或更长时间,包括这
些值之间的任何值或范围。
[0142]
a.患者群体
[0143]
庞贝病(也称为酸性麦芽糖酶缺乏或糖原贮积病(gsd)ii型)是由溶酶体酸性α-葡糖苷酶(gaa)(一种降解糖原的酶)的缺乏引起的罕见常染色体隐性遗传病(参见omim 232300)。已将其分类为婴儿期发作的形式和迟发型形式。经典型婴儿期发作的庞贝病(iopd)的特征是在不治疗的情况下在一岁前致死。迟发型庞贝病(lopd)具有更易变的病程。
[0144]
特别地,iopd的特征在于快速进行性肥厚型心肌病、左侧室性流出道阻塞、肌张力低下和肌无力、呼吸窘迫以及独立通气的进行性丧失(kohler,l.等人,neurotherapeutics 2018 15:4)。呼吸困难、喂食问题和巨舌症是iopd的常见表现,并且运动发育通常显著延迟(kohler,l.等人,neurotherapeutics2018 15:4)。iopd可以通过新生儿筛查来诊断,如burton,b.k.等人pediatrics 2017 140:s1中所述。
[0145]
阿葡糖苷酶α含有活性成分重组人酸性α-葡糖苷酶(rhgaa),可以作为长期酶替代疗法(ert)用于治疗已证实诊断患有庞贝病的患者的庞贝病。基于阿葡糖苷酶α延长婴儿的无有创呼吸机存活期和总存活期的功效,以及其在患有所述疾病的儿童和成人中改善运动性和稳定呼吸功能的能力,阿葡糖苷酶α治疗已在全球被批准(商品名和)用于治疗庞贝病。尽管可使用rhgaa,但在庞贝病中,特别是对于虽然进行了早期治疗但仍频繁经历长期运动衰退的iopd患者,仍然存在未满足的需求。不希望受限于理论,这被认为至少部分是由于阿葡糖苷酶α上双-甘露糖-6-磷酸(双-m6p)的相对低水平所致。增加阿葡糖苷酶α上双-m6p的水平可以提供驱动摄取至骨骼肌中且由此改善在iopd和lopd方面的结果的机制。
[0146]
本文所述方法适合于治疗患有iopd的人个体。在一些实施方案中,所述个体在生命第一年诊断时患有心肌病。在一些实施方案中,所述个体在生命第一年诊断时患有肥厚型心肌病。在一些实施方案中,所述个体在生命第一年诊断时患有心律失常。在一些实施方案中,所述个体在生命第一年诊断时患有心脏扩大。在一些实施方案中,所述个体在生命第一年诊断时患有严重肌张力低下。在一些实施方案中,所述个体在生命第一年诊断时患有严重肌病。
[0147]
在一些实施方案中,所述个体是18岁或更年轻。在特定实施方案中,所述个体是17岁或更年轻、16岁或更年轻、15岁或更年轻、14岁或更年轻、13岁或更年轻、12岁或更年轻、11岁或更年轻、10岁或更年轻、9岁或更年轻、8岁或更年轻、7岁或更年轻、6岁或更年轻、5岁或更年轻、4岁或更年轻、3岁或更年轻、2岁或更年轻或者1岁或更年轻。在一些实施方案中,所述个体大于18岁。在一些实施方案中,所述个体是11月龄或更年轻、10月龄或更年轻、9月龄或更年轻、8月龄或更年轻、7月龄或更年轻、6月龄或更年轻、5月龄或更年轻、4月龄或更年轻、3月龄或更年轻、2月龄或更年轻或者小于1月龄。在一些实施方案中,所述个体是新生儿。在一些实施方案中,所述个体是约以下值中的任一个:0-1月龄、0-2月龄、0-3月龄、0-4月龄、0-5月龄、0-6月龄、1-6月龄、2-6月龄、3-6月龄、4-6月龄、5-6月龄、2-4月龄、3-6月龄或4-6月龄。在一些实施方案中,所述个体在生命的第一个月内首次被施用寡糖-gaa缀合物。在一些实施方案中,所述个体在生命的第一个月内被施用免疫诱导疗法(例如,甲氨蝶呤、利妥昔单抗和ivig)。
[0148]
在一些实施方案中,所述个体已经接受至少6个月的使用重组gaa的治疗。在一些实施方案中,所述个体已经接受至少约以下值中的任一时间的使用重组gaa的治疗:8个月、10个月、1年、2年、3年、4年、5年、10年或更长时间,包括这些值之间的任何值或范围。在其他实施方案中,所述个体尚未接受过使用重组gaa的治疗。示例性重组gaa包括但不限于阿葡糖苷酶α、拉维阿葡糖苷酶α(reveglucosidase alfa,biomarin)和atb200(amicus)。
[0149]
在一些实施方案中,所述个体在用所述重组gaa治疗后显示临床衰退,其中所述临床衰退是通过评估选自以下的一个或多个参数来确定:呼吸功能、运动技能和心脏参数。在一些实施方案中,所述个体对使用重组gaa的治疗具有次最佳临床反应。次最佳临床反应可以通过评估呼吸功能、运动技能或心脏参数来确定。呼吸功能、运动技能和/或心脏参数可以通过以下来评估:ck水平、尿液hex4水平、gmfm-88、阿尔伯塔婴儿运动量表(aims)得分、庞贝-儿科残疾评估量表(pedi)功能技能量表、超声心动图(echo)-左心室质量(lvm)z得分、echo lvmi得分、粗大运动功能分类系统-扩展修订版(gmfcs-e&r)得分、快速运动功能测试、6分钟步行测试(6mwt)、上睑下垂发作、睑裂间距(ipfd)、边缘反射距离-1(mrd-1)和边缘瞳孔距离(mpd)和/或呼吸支持的使用。
[0150]
在一些实施方案中,所述个体是交叉反应性免疫物质(crim)阴性的。crim阴性患者不产生任何gaa酶,并且因此可以产生高水平的针对gaa ert的中和抗体(dasouki,m.等人neurol clin.2014 32:3)。在其他实施方案中,所述个体是crim阳性的。crim阳性患者具有一定残留的gaa活性。crim状态可以通过蛋白质印迹分析从培养的皮肤成纤维细胞来确定,从gaa基因突变来预测,或者从血液测试来确定(burton,b.k.等人pediatrics2017 140:s1;bali,d.s.等人,am j med genet c semin med genet.2012 15:160c;wang,z.等人mol genet metab.2014 111:2)。
[0151]
b.寡糖-蛋白质缀合物
[0152]
本文所述方法使用寡糖-蛋白质缀合物(本文中也称为“寡糖gaa缀合物”),其包含寡糖、gaa(也称为酸性α-葡糖苷酶)以及连接所述寡糖与所述gaa(例如经由肟基团)的化学接头。在一些实施方案中,所述寡糖是多聚己糖。在一些实施方案中,所述寡糖具有两个甘露糖-6-磷酸(m6p)。在一些实施方案中,所述寡糖-蛋白质缀合物具有约以下值中的任一个:2、4、6、8、10、12、14、16、18、20或更多个m6p,包括这些值之间的任何值或范围。在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。
[0153]
在一些实施方案中,本文描述的是寡糖-蛋白质缀合物,其包含(1)gaa蛋白、(2)寡糖和(3)连接所述gaa蛋白与所述寡糖的肟基团。
[0154]
在一些实施方案中,所述寡糖-蛋白质缀合物具有式(i)的结构:
[0155][0156]
其中gaa是酸性α-葡糖苷酶,l是连接所述寡糖与所述gaa的化学接头,并且n是1至10。在一些实施方案中,n是1。在一些实施方案中,n是2。在一些实施方案中,n是3。在一些实施方案中,n是4。在一些实施方案中,n是5。在一些实施方案中,n是6。在一些实施方案中,n是7。在一些实施方案中,n是8。在一些实施方案中,n是9。在一些实施方案中,n是10。在一些实施方案中,n是至少1、2、3、4、5、6、7、8或9。在一些实施方案中,n不大于2、3、4、5、6、7、8、9或10。在一些实施方案中,n选自以下范围:1-2、2-3、3-4、4-5、5-6、6-7、7-8、8-9、9-10、1-3、3-5、5-7、7-9、1-4、4-7、7-10、1-5、5-10、2-10、3-9、4-8、2-9、3-8、4-7、5-8、5-9、5-10、4-7、3-7、2-7和1-7。在一些实施方案中,n是5-9。
[0157]
在一些实施方案中,所述寡糖-蛋白质缀合物具有式(ii)的结构:
[0158][0159]
其中gaa是酸性α-葡糖苷酶,l'是化学接头,并且n是1至10。在一些实施方案中,n
是1。在一些实施方案中,n是2。在一些实施方案中,n是3。在一些实施方案中,n是4。在一些实施方案中,n是5。在一些实施方案中,n是6。在一些实施方案中,n是7。在一些实施方案中,n是8。在一些实施方案中,n是9。在一些实施方案中,n是10。在一些实施方案中,n是至少1、2、3、4、5、6、7、8或9。在一些实施方案中,n不大于2、3、4、5、6、7、8、9或10。在一些实施方案中,n选自以下范围:1-2、2-3、3-4、4-5、5-6、6-7、7-8、8-9、9-10、1-3、3-5、5-7、7-9、1-4、4-7、7-10、1-5、5-10、2-10、3-9、4-8、2-9、3-8、4-7、5-8、5-9、5-10、4-7、3-7、2-7和1-7。在一些实施方案中,n是5-9。
[0160]
在一些实施方案中,所述寡糖-蛋白质缀合物具有式(iii)的结构:
[0161][0162]
其中gaa是酸性α-葡糖苷酶,n是1至10,并且m和p独立地选自范围为1至10的整数。在一些实施方案中,n是1。在一些实施方案中,n是2。在一些实施方案中,n是3。在一些实施方案中,n是4。在一些实施方案中,n是5。在一些实施方案中,n是6。在一些实施方案中,n是7。在一些实施方案中,n是8。在一些实施方案中,n是9。在一些实施方案中,n是10。在一些实施方案中,n是至少1、2、3、4、5、6、7、8或9。在一些实施方案中,n不大于2、3、4、5、6、7、8、9或10。在一些实施方案中,n选自以下范围:1-2、2-3、3-4、4-5、5-6、6-7、7-8、8-9、9-10、1-3、3-5、5-7、7-9、1-4、4-7、7-10、1-5、5-10、2-10、3-9、4-8、2-9、3-8、4-7、5-8、5-9、5-10、4-7、3-7、2-7和1-7。在一些实施方案中,n是5-9。在一些实施方案中,m是1、2、3、4、5、6、7、8或9或10。在一些实施方案中,p是1、2、3、4、5、6、7、8、9或10。在一些实施方案中,m和p独立地从选自以下范围的整数选择:1-4、4-8、8-10、2-4、2-6、2-8、2-10、1-3、3-6、6-9和4-10。在一些实施方案中,m和p独立地选自范围为1至5的整数。在一些实施方案中,m是1、2、3、4或5,并且p是1、2、3、4或5。在一些实施方案中,m是1、2或3,并且p是1、2或3。在一些实施方案中,m是5,并且p是1。在一些实施方案中,m是4,并且p是1。在一些实施方案中,m是3并且p是1。在一些实施方案中,m是2,并且p是1。在一些实施方案中,m是1,并且p是1。在一些实施方案中,m不大于5,并且p不大于3。在一些实施方案中,m不大于4,并且p不大于2。在一些实施方案中,m不大于3,并且p不大于1。在一些实施方案中,m是至少1,并且p是至少1。在一些实施方案中,m是至少2,并且p是至少1。在一些实施方案中,m是至少3,并且p是至少1。
[0163]
在一些实施方案中,每个寡糖-蛋白质缀合物(例如,式(i)、(ii)或(iii)的缀合物)中磷酸基团的数量为约2-20。在一些实施方案中,每个寡糖-蛋白质缀合物中磷酸基团的数量为2、4、6、8、10、12、14、16、18或20。在一些实施方案中,每个寡糖-蛋白质缀合物中磷
酸基团的数量为至少2、4、6、8、10、12、14、16、18或20。在一些实施方案中,每个寡糖-蛋白质缀合物中磷酸基团的数量不大于2、4、6、8、10、12、14、16、18或20。在一些实施方案中,每个寡糖-蛋白质缀合物中磷酸基团的数量是选自以下范围的偶数:2-4、4-6、6-8、8-10、10-12、12-14、14-16、16-18、18-20、2-6、6-10、10-14、14-18、2-8、8-14、14-20、2-10、10-20、4-20、6-18、8-16、4-18、6-16、8-14、10-16、10-18、10-20、8-14、6-14、4-14和2-14。
[0164]
在一些实施方案中,所述寡糖-蛋白质缀合物是艾瓦葡糖苷酶α。艾瓦葡糖苷酶α也称为neogaa或gz402666。艾瓦葡糖苷酶α是人gaa的寡糖修饰的形式,其包含多个六甘露糖结构,所述六甘露糖结构含有与所述gaa缀合的两个末端甘露糖-6-磷酸(m6p)部分。
[0165]
制备本文所述的寡糖-蛋白质缀合物的方法是本领域中已知的。参见例如,us 7723296、wo 2008/089403和wo 2010/075010,将所述申请通过引用以其整体并入本文。
[0166]
所述寡糖可以从天然来源分离,或者可以通过化学或酶合成来制备。从天然来源分离的寡糖可以是同质的或者可以是相关寡糖的异质性混合物。在一些实施方案中,可以通过对从天然来源分离的寡糖进行化学或酶修饰来制备寡糖(“半合成”)。在一些实施方案中,所述寡糖可以是具有天然存在的寡糖的化学结构的合成寡糖。
[0167]
gaa的序列是熟知的(参见例如,martiniuk等人,proc.natl.acad.sci.usa 83:9641-9644(1986);hoefsloot等人,biochem.j.272:493-497(1990);moreland等人,j.biol.chem.280:6780-6791(2005))。还参见genbank登录号nm_000152。所述gaa可以是野生型gaa或其序列变体。
[0168]
所述gaa可以从天然来源或以重组方式获得。在一些实施方案中,所述gaa是糖蛋白。在一些实施方案中,所述gaa是在中国仓鼠卵巢(cho)细胞中产生的人gaa。在一些实施方案中,所述人gaa具有糖型α。在一些实施方案中,所述gaa具有至少一个羰基基团。例如,具有至少一个羰基基团的gaa可以通过用本领域技术人员已知的任何手段氧化gaa来获得。在一些实施方案中,例如,具有至少一个羰基基团的gaa可以通过用高碘酸盐(例如,高碘酸钠)或半乳糖氧化酶氧化gaa来获得。在一些实施方案中,具有至少一个羰基基团的gaa可以与在还原端用羰基反应性基团(如例如,肼、酰肼、氨基氧基、氨基硫脲、氨基脲或胺基团)官能化的寡糖化学缀合,以产生寡糖-gaa缀合物。在一些实施方案中,将所述gaa用约1、2、3、4、5、7.5、10或22.5mm高碘酸盐氧化。在一些实施方案中,将所述gaa在足以氧化所述gaa的聚糖上的唾液酸残基并且使岩藻糖和甘露糖氧化降至最低的条件下进行氧化。在一些实施方案中,所用高碘酸盐浓度小于约2、3、4或5mm。在一些实施方案中,所述高碘酸盐是高碘酸钠。
[0169]
可以使用将所述寡糖与所述gaa蛋白缀合的其他方法。在一些实施方案中,所述寡糖-蛋白质缀合物是通过使包含第一反应性基团的寡糖与具有第二反应性基团的gaa蛋白反应来制备的。在一些实施方案中,所述寡糖-蛋白质缀合物是通过使包含氨基氧基的寡糖与具有至少一个羰基的gaa反应来制备的。
[0170]
在一些实施方案中,可以使所述寡糖与所述gaa蛋白的氨基酸(如半胱氨酸或赖氨酸)缀合。
[0171]
在一些实施方案中,可以使所述寡糖与所述gaa上的聚糖缀合。在一些实施方案中,可以使所述寡糖与聚糖上的唾液酸残基缀合。在其他实施方案中,可以使所述寡糖与聚糖上的甘露糖、岩藻糖、半乳糖和/或唾液酸残基缀合。对于经由半乳糖缀合,可以首先用唾
液酸酶处理糖蛋白以去除唾液酸残基,然后用半乳糖氧化酶处理,之后与所述寡糖反应。
[0172]
例如,所述寡糖-蛋白质缀合物可以通过可能存在于(包括例如,胺、硫醇、羧酸、羟基)和/或引入蛋白质中的任何官能团与寡糖上合适的第二官能团的反应来制备。用于引入官能团的方法是本领域中熟知的。例如,具有至少一个羰基的糖蛋白可以通过用例如高碘酸盐(例如,高碘酸钠)或用半乳糖氧化酶氧化该糖蛋白来获得。在另一个例子中,羰基基团可以通过使用具有扩展的遗传密码的表达系统来引入,如例如wang等人,proc.natl.acad.sci.usa 100:56-61(2003)中所述。还参见例如,美国专利申请公开号2006/0228348,其描述将反应性基团引入糖蛋白中。
[0173]
在某些实施方案中,所述方法还包括将还原剂添加至所述寡糖-蛋白质缀合物。所述还原剂可以是本领域技术人员已知的任何还原剂,如例如氰基硼氢化钠或三乙酰氧基硼氢化钠(stab)。
[0174]
在某些实施方案中,在缀合期间形成的蛋白质聚集物可以使用各种色谱法来去除。在一个实施方案中,可以采用疏水相互作用色谱法(hic)。hic柱的例子包括丁基650c和650m、己基650c、苯基6ff、capto辛基和capto苯基。在其他实施方案中,聚集物可以通过金属螯合色谱法(如铜、镍、钴或汞)来去除。在一个实施方案中,可以以结合与洗脱模式或以流通模式使用铜柱。
[0175]
在一些实施方案中,包含第一反应性基团的寡糖是包含氨基氧基的寡糖并且具有式(iv)的结构:
[0176][0177]
其中l'是化学接头。
[0178]
在一些实施方案中,式(iii)的寡糖是式(v)的寡糖:
[0179][0180]
其中m和p独立地选自范围为1至10的整数。在一些实施方案中,m是1、2、3、4、5、6、7、8、9或10。在一些实施方案中,p是1、2、3、4、5、6、7、8、9或10。在一些实施方案中,p是至少1、2、3、4、5、6、7、8、9或10。在一些实施方案中,m和p独立地从选自以下范围的整数选择:1-4、4-8、8-10、2-4、2-6、2-8、2-10、1-3、3-6、6-9和4-10。在一些实施方案中,m和p独立地选自范围为1至5的整数。在一些实施方案中,m是1、2、3、4或5,并且p是1、2、3、4或5。在一些实施方案中,m是1、2或3,并且p是1、2或3。在一些实施方案中,m是5,并且p是1。在一些实施方案中,m是4,并且p是1。在一些实施方案中,m是3并且p是1。在一些实施方案中,m是2,并且p是1。在一些实施方案中,m是1,并且p是1。在一些实施方案中,m不大于5,并且p不大于3。在一些实施方案中,m不大于4,并且p不大于2。在一些实施方案中,m不大于3,并且p不大于1。在一些实施方案中,m是至少1,并且p是至少1。在一些实施方案中,m是至少2,并且p是至少1。在一些实施方案中,m是至少3,并且p是至少1。
[0181]
c.免疫耐受诱导疗法
[0182]
本文所述的任一种方法还可以包括施用免疫耐受诱导疗法。在一些实施方案中,所述免疫耐受诱导疗法包括甲氨蝶呤。在一些实施方案中,所述免疫耐受诱导疗法包括甲氨蝶呤和另外的免疫耐受诱导疗法。在一些实施方案中,所述免疫耐受诱导疗法包括甲氨蝶呤、利妥昔单抗和ivig。在一些实施方案中,所述免疫耐受诱导疗法用于预防性用途。
[0183]
在一些实施方案中,所述方法还包括向个体施用有效量的甲氨蝶呤。在一些实施方案中,使用甲氨蝶呤在个体中诱导针对本文所述寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)的免疫耐受。可以使用任何可用给药方案来诱导免疫耐受,包括连续的每周重复的剂量方案(garman等人clin exp immunol,137(3):496-502(2004);joseph等人,clin exp immunol,152(1):138-46(2008);mendelsohn等人,n engl j med,360(2):194-5(2009)),以及短暂的低剂量方案(参见美国专利公开号20140135337)。在一些实施方案中,有效量的甲氨蝶呤是在三个周期中施用。在一些实施方案中,所述甲氨蝶呤是在单个周期中施用。在一些实施方案中,所述甲氨蝶呤是在一个、两个、三个、四个、五个或更多个周期中施用。
[0184]
如本文所用,单个周期是指连续或不连续的数天的治疗方案或治疗单元,并且优
选地在给药所述寡糖-gaa缀合物后不超过五天(例如,不超过三天)开始。甲氨蝶呤的单个周期可以由单剂量的甲氨蝶呤,或约2、3、4、5、6、7、8、9、10或11个连续每日剂量的甲氨蝶呤中的任一个组成。如果所述寡糖-gaa缀合物是在多个时间段中给药,则使用甲氨蝶呤治疗的单个周期优选地不延长超过所述寡糖-gaa缀合物给药的第一时间段。举例来说,在每周、每月或每年寡糖-gaa缀合物施用中,甲氨蝶呤的单个周期由连续三天的甲氨蝶呤摄入(例如,口服)组成,所述周期在第0天(即将所述寡糖-gaa缀合物首次给予患者的当天)开始。然后患者在第1天(约24小时后)和在第2天(约48小时后)接受单个剂量的甲氨蝶呤。在一些实施方案中,甲氨蝶呤的单个周期不会持续长于约8天。
[0185]
甲氨蝶呤和所述寡糖-gaa缀合物可以以被认为适当的任何顺序来施用。例如,可以在施用所述寡糖-gaa缀合物之前、期间和/或之后将所述甲氨蝶呤施用至受试者。在一些实施方案中,在施用所述寡糖-gaa缀合物之前约48小时与之后约48小时之间施用所述甲氨蝶呤。例如,可以在约以下值中的任一时间施用所述甲氨蝶呤:在施用所述寡糖-gaa缀合物治疗之前48小时、之前36小时、之前24小时、之前12小时、同时、之后12小时、之后24小时、之后36小时或之后48小时。在一些实施方案中,所述甲氨蝶呤与所述寡糖-gaa缀合物同时施用。在一些实施方案中,所述甲氨蝶呤是与寡糖-gaa缀合物的施用同时施用,以及在施用寡糖-gaa缀合物之后约24小时和约48小时施用。在一些实施方案中,所述寡糖-gaa缀合物是阿葡糖苷酶α,并且所述甲氨蝶呤是与所述寡糖-gaa缀合物的施用同时施用,以及在施用所述寡糖-gaa缀合物之后约24小时和约48小时施用。
[0186]
甲氨蝶呤可以以有效减少不需要的免疫应答(如抗体或细胞应答)的任何剂量来施用。甲氨蝶呤在人患者中的有效量可以在以下范围内:约0.05mg/kg至约10mg/kg,如不超过约以下值中的任一个:0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、1mg/kg、1.5mg/kg、2mg/kg、2.5mg/kg、3mg/kg、3.5mg/kg、4mg/kg、4.5mg/kg、5mg/kg、6mg/kg、7.5mg/kg或10mg/kg。在一些实施方案中,所述有效量是以下值中的任一个:约0.1mg/kg至约1.5mg/kg、约0.12mg/kg至约1.28mg/kg、约1mg/kg至约2.5mg/kg、或约2.5mg/kg至约5mg/kg、或约0.1mg/kg至约5mg/kg。在一些实施方案中,甲氨蝶呤的剂量可以造成最小安全风险,因为所述给药方案仅涉及如下剂量水平的甲氨蝶呤的短暂过程,所述剂量水平更类似于用于类风湿性关节炎的剂量而不是低肿瘤剂量。类风湿性关节炎患者可以每周接受高达25mg的甲氨蝶呤而没有严重毒性。甲氨蝶呤的低肿瘤剂量被认为是30mg/m2。
[0187]
在一些实施方案中,甲氨蝶呤是在多于一个周期中施用,但总剂量低。例如,所述甲氨蝶呤可以在两个或更多个(例如,3个、4个、5个、6个等)周期中施用,但是在患者中的总组合剂量不超过5mg/kg。
[0188]
在一些实施方案中,除了甲氨蝶呤外,在本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)施用的同时向受试者施用另外的免疫耐受诱导疗法。在一些实施方案中,在开始所述寡糖-gaa缀合物后将所述甲氨蝶呤和/或所述另外的免疫耐受诱导疗法施用至个体,与在使用所述寡糖-gaa缀合物的治疗的其他周期中施用的免疫耐受诱导疗法相反。在一些实施方案中,在开始所述寡糖-gaa缀合物后以及在使用所述寡糖-gaa缀合物的治疗的一个或多个其他周期中,将所述甲氨蝶呤和/或所述另外的免疫耐受诱导疗法施用至个体。在一些实施方案中,所述另外的免疫耐受诱导疗法是与甲氨蝶呤同时施用。在一些实施方案中,在施用甲氨蝶呤之后,如在施用甲氨蝶呤后1、2、3、4、5、6、7天或
更长时间中的任一时间之后,施用所述另外的免疫耐受诱导疗法。在一些实施方案中,在施用甲氨蝶呤之前,如在施用甲氨蝶呤之前1、2、3、4、5、6、7天或更长时间中的任一时间,施用所述另外的免疫耐受诱导疗法。在一些实施方案中,所述受试者患有crim阴性iopd。在一些实施方案中,所述受试者患有crim阳性iopd。在一些实施方案中,甲氨蝶呤是肠内施用。在一些实施方案中,甲氨蝶呤是以约0.5mg/kg的剂量施用。在一些实施方案中,甲氨蝶呤是每周施用。在一些实施方案中,甲氨蝶呤是皮下施用。在一些实施方案中,甲氨蝶呤是以约0.4mg/kg的剂量施用。在一些实施方案中,甲氨蝶呤是以每周三个剂量施用,持续三周。
[0189]
在一些实施方案中,所述另外的免疫耐受诱导疗法包括利妥昔单抗、静脉内免疫球蛋白(ivig)或其组合。在一些实施方案中,所述另外的免疫耐受诱导疗法包括施用利妥昔单抗。在一些实施方案中,利妥昔单抗是以约375mg/m2的剂量施用。在一些实施方案中,如在受试者的体表面积(bsa)小于0.5m2时,利妥昔单抗是以约12.5mg/kg的剂量施用。在一些实施方案中,利妥昔单抗是静脉内施用。在一些实施方案中,利妥昔单抗是每周施用。在一些实施方案中,所述另外的免疫耐受诱导疗法包括施用ivig。在一些实施方案中,ivig是以约0.5g/kg的剂量施用。在一些实施方案中,ivig是以约400-500mg/kg的剂量施用。在一些实施方案中,ivig是约每四周施用。在一些实施方案中,ivig是每月施用。在一些实施方案中,所述另外的免疫耐受诱导疗法包括施用利妥昔单抗和ivig二者。
[0190]
在一些实施方案中,所述方法包括:(a)向个体施用有效量的本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);以及(b)向个体施用有效量的甲氨蝶呤、有效量的利妥昔单抗和有效量的ivig。在一些实施方案中,所述寡糖-gaa缀合物是每隔一周以约20mg/kg施用。在一些实施方案中,所述甲氨蝶呤是皮下施用。在一些实施方案中,所述甲氨蝶呤是以约0.4mg/kg施用。在一些实施方案中,所述甲氨蝶呤是以每周三次剂量施用,持续三周。在一些实施方案中,所述利妥昔单抗是以约375mg/m2施用。在一些实施方案中,如在受试者的体表面积(bsa)小于0.5m2时,利妥昔单抗是以约12.5mg/kg的剂量施用。在一些实施方案中,利妥昔单抗是静脉内施用。在一些实施方案中,利妥昔单抗是每周施用。在一些实施方案中,ivig是以约400-500mg/kg的剂量施用。在一些实施方案中,ivig是约每四周施用。在一些实施方案中,所述寡糖-gaa缀合物、甲氨蝶呤、利妥昔单抗和ivig的剂量方案如图12中所示。
[0191]
甲氨蝶呤和所述另外的免疫耐受诱导疗法对管理患者中的不需要的抗体反应的作用可以通过熟知的方法来监测,所述方法包括对患者的临床检查、症状、测定抗药抗体滴度的血液测试以及免疫组织化学测定(例如,c4沉积测定和其他固相抗体检测方法,如酶联免疫吸附测定(elisa)和基于珠的荧光测定)。所述作用还可以通过测量以下项来监测:生物标记(如mcp-1、il-13、il-6和il-12)的水平,已显示其水平通过甲氨蝶呤治疗而降低;以及移行2b细胞、移行3b细胞、滤泡b细胞、边缘区b细胞、b10 b细胞和b1 b细胞,已显示其数量通过甲氨蝶呤治疗而增加。另外,可以根据需要使用tgf-β、foxp3、il-5、il-10、il-15和gm-csf作为生物标记来监测甲氨蝶呤对不需要的免疫应答的作用。还可以使用生物标记的水平来监测甲氨蝶呤对t细胞针对所述寡糖-gaa缀合物的反应性的影响。还可以监测用于t细胞激活的生物标记(如il-2、干扰素-γ和tnf-α)作为甲氨蝶呤对t细胞应答的影响的读出。在一些实施方案中,还检测cd19的水平以监测不需要的免疫应答。在一些实施方案中,在整个治疗中监测个体的抗药抗体水平(如抗rhgaa igg抗体水平)、cd19水平和疾病进展
中的一项或多项。
[0192]
iii.配制品和药物组合物
[0193]
还提供配制品和药物组合物,其包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)。在一些实施方案中,所述配制品是冻干配制品。在一些实施方案中,所述配制品是可冻干配制品。在一些实施方案中,所述药物组合物是从所述冻干配制品重构的。还提供本文所述配制品和药物组合物用于治疗庞贝病如iopd的方法和用途。
[0194]
当在延长时间段中储存时,本文所述寡糖-gaa缀合物在液体配制品中不稳定。不受任何理论或假设的束缚,所述寡糖部分与所述gaa蛋白之间的化学连接可能在液体配制品中发生降解。开发冻干配制品以允许储存呈干粉形式的所述寡糖-gaa缀合物,并且在施用至患者之前将其重构为液体配制品。先前将重组gaa配制为冻干配制品的尝试是不成功的,并且在重构后导致聚集,因为gaa是可以分解常用作冻干或可冻干配制品中的冷冻保护剂的糖部分的酶。本文所述冻干配制品包含不经历gaa的降解的一种或多种冷冻保护剂,如甘露醇。
[0195]
在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);以及(b)不被gaa降解的糖。在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);(b)不被gaa降解的糖;以及(c)缓冲剂。在一些实施方案中,所述糖是甘露醇。在一些实施方案中,所述缓冲剂是组氨酸。在一些实施方案中,所述配制品还包含一种或多种稳定剂,如甘氨酸或精氨酸。在一些实施方案中,所述配制品还包含表面活性剂,如聚山梨醇酯,例如,聚山梨醇酯80。在一些实施方案中,所述配制品是冻干配制品。在一些实施方案中,所述配制品是可冻干配制品。在一些实施方案中,提供一种从所述冻干配制品重构的药物组合物。
[0196]
在一些实施方案中,提供一种冻干或可冻干配制品,所述冻干或可冻干配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);以及(b)包含不被gaa降解的糖的一种或多种冷冻保护剂。在一些实施方案中,提供一种冻干或可冻干配制品,所述冻干或可冻干配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);(b)(b)包含不被gaa降解的糖的一种或多种冷冻保护剂;以及(c)缓冲剂。在一些实施方案中,所述一种或多种冷冻保护剂包含甘露醇。在一些实施方案中,所述一种或多种冷冻保护剂包含甘氨酸和甘露醇。在一些实施方案中,所述一种或多种冷冻保护剂包含精氨酸和甘露醇。在一些实施方案中,所述一种或多种冷冻保护剂还包含表面活性剂,如聚山梨醇酯,例如,聚山梨醇酯80。在一些实施方案中,所述缓冲剂是组氨酸。在一些实施方案中,所述配制品是冻干配制品。在一些实施方案中,所述配制品是可冻干配制品。在一些实施方案中,提供一种从所述冻干配制品重构的药物组合物。
[0197]
在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);(b)甘露醇;以及(c)缓冲剂,如组氨酸。在一些实施方案中,所述配制品还包含表面活性剂,如聚山梨醇酯,例如,聚山梨醇酯80。在一些实施方案中,所述配制品是冻干配制品。在一些实施方案中,所述配制品是可冻干配制品。在一些实施方案中,提供一种从所述冻干配制品重构的药物组合物。
[0198]
在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡
糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);(b)甘露醇;以及(c)缓冲剂,如组氨酸。在一些实施方案中,所述配制品还包含表面活性剂,如聚山梨醇酯,例如,聚山梨醇酯80。在一些实施方案中,所述配制品是冻干配制品。在一些实施方案中,所述配制品是可冻干配制品。在一些实施方案中,提供一种从所述冻干配制品重构的药物组合物。
[0199]
在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);(b)甘露醇;(c)甘氨酸;以及(d)缓冲剂,如组氨酸。在一些实施方案中,所述配制品还包含表面活性剂,如聚山梨醇酯,例如,聚山梨醇酯80。在一些实施方案中,所述配制品是冻干配制品。在一些实施方案中,所述配制品是可冻干配制品。在一些实施方案中,提供一种从所述冻干配制品重构的药物组合物。
[0200]
在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);(b)甘露醇;(c)精氨酸;以及(d)缓冲剂,如组氨酸。在一些实施方案中,所述配制品还包含表面活性剂,如聚山梨醇酯,例如,聚山梨醇酯80。在一些实施方案中,所述配制品是冻干配制品。在一些实施方案中,所述配制品是可冻干配制品。在一些实施方案中,提供一种从所述冻干配制品重构的药物组合物。
[0201]
在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);(b)甘露醇;(c)甘氨酸;以及(d)组氨酸。在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);(b)甘露醇;(c)甘氨酸;(d)组氨酸;以及(e)聚山梨醇酯(例如,聚山梨醇酯80)。在一些实施方案中,所述配制品是冻干配制品。在一些实施方案中,所述配制品是可冻干配制品。在一些实施方案中,提供一种从所述冻干配制品重构的药物组合物。
[0202]
除非另有指示,否则本文所述的百分比浓度是重量百分比。在提及寡糖-gaa缀合物或各种赋形剂在冻干配制品中的浓度时,所述浓度是在冻干之前(即,在可冻干配制品中)或在重构所述冻干配制品之后在组合物中确定。冻干配制品的ph也是指在冻干之前(即,在可冻干配制品中)或在重构冻干配制品之后组合物的ph。
[0203]
在一些实施方案中,所述配制品包含约1%至约5%的不被gaa降解的糖,包括例如约以下值中的任一个:1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%或5%的糖,包括这些值之间的任何值或范围。在一些实施方案中,所述配制品包含约以下值中的任一个:1%-2%、2%-3%、3%-4%、4%-5%、1%-3%、2%-4%、1%-4%或1%-5%的糖。在一些实施方案中,所述配制品包含约2%的糖。
[0204]
在一些实施方案中,所述配制品包含约1%至约5%的甘露醇,包括例如约以下值中的任一个:1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%或5%的甘露醇,包括这些值之间的任何值或范围。在一些实施方案中,所述配制品包含约以下值中的任一个:1%-2%、2%-3%、3%-4%、4%-5%、1%-3%、2%-4%、1%-4%或1%-5%的甘露醇。在一些实施方案中,所述配制品包含约1%-4%甘露醇。在一些实施方案中,所述配制品包含约2%甘露醇。
[0205]
在一些实施方案中,所述配制品包含约0.5%至约4%的氨基酸(例如,精氨酸),包括例如约以下值中的任一个:0.5%、1%、1.5%、2%、2.5%、3%、3.5%或4%的氨基酸,包括这些值之间的任何值或范围。在一些实施方案中,所述配制品包含约以下值中的任一个:
0.5%-1%、1%-2%、2%-3%、3%-4%、1%-3%、2%-4%或1%-4%的氨基酸。
[0206]
在一些实施方案中,所述配制品包含约0.25%至约4%的甘氨酸,包括例如约以下值中的任一个:0.25%、0.5%、1%、1.5%、2%、2.5%、3%、3.5%或4%的糖,包括这些值之间的任何值或范围。在一些实施方案中,所述配制品包含约以下值中的任一个:0.25%-0.5%、0.5%-1%、1%-2%、2%-3%、3%-4%、1%-3%、2%-4%、0.25%-1%、0.25%-1.5%或0.25%-2%的甘氨酸。在一些实施方案中,所述配制品包含约0.25%-2%甘氨酸。在一些实施方案中,所述配制品包含约2%甘氨酸。
[0207]
在一些实施方案中,所述配制品以约以下值中的任一个的重量比包含甘露醇和氨基酸(例如,精氨酸或甘氨酸):16:1、8:1、4:1、2:1、1:1、1:2、1:3、1:4或1:5,包括这些值之间的任何值或范围。在一些实施方案中,所述配制品以约1:1的重量比包含甘露醇和甘氨酸。
[0208]
在一些实施方案中,所述配制品包含约5mm至约50mm缓冲剂,包括例如约以下值中的任一个:5mm、10mm、15mm、20mm、25mm、30mm、35mm、40mm、45mm或50mm,包括这些值之间的任何值或范围。在一些实施方案中,所述配制品包含约以下值中的任一个:5-10mm、10-20mm、20-30mm、30-40mm、40-50mm、5-20mm、10-40mm、10-50mm、5-25mm或25-50mm的所述缓冲剂。
[0209]
在一些实施方案中,所述配制品包含约5mm至约50mm组氨酸,包括例如约以下值中的任一个:5mm、10mm、15mm、20mm、25mm、30mm、35mm、40mm、45mm或50mm,包括这些值之间的任何值或范围。在一些实施方案中,所述配制品包含约以下值中的任一个:5-10mm、10-20mm、20-30mm、30-40mm、40-50mm、5-20mm、10-40mm、10-50mm、5-25mm或25-50mm的组氨酸。在一些实施方案中,所述配制品包含约10-50mm组氨酸。在一些实施方案中,所述配制品包含约10mm组氨酸。
[0210]
在一些实施方案中,所述配制品的ph为约5.5至约6.5,包括例如约以下值中的任一个:5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4或6.5,包括这些值之间的任何值或范围。在一些实施方案中,所述配制品的ph为约以下值中的任一个:5.5-6、6-6.5、5.5-5.75、5.75-6、6-6.25、5.75-6.25或6.25-6.5。在一些实施方案中,所述配制品的ph为约6.2。
[0211]
在一些实施方案中,所述配制品包含约0.005%-0.05%的表面活性剂(例如,聚山梨醇酯),包括例如约以下值中的任一个:0.005%、0.0075%、0.01%、0.015%、0.02%、0.025%、0.03%、0.035%、0.04%、0.045%或0.05%,包括这些值之间的任何值或范围。在一些实施方案中,所述配制品包含约以下值中的任一个:0.005%-0.01%、0.01%-0.02%、0.02%-0.03%、0.03%-0.04%、0.04%-0.05%、0.005%-0.02%、0.01%-0.04%或0.005%-0.05%的表面活性剂(例如,聚山梨醇酯)。
[0212]
在一些实施方案中,所述配制品包含约0.005%-0.05%的聚山梨醇酯80,包括例如约以下值中的任一个:0.005%、0.0075%、0.01%、0.015%、0.02%、0.025%、0.03%、0.035%、0.04%、0.045%或0.05%,包括这些值之间的任何值或范围。在一些实施方案中,所述配制品包含约以下值中的任一个:0.005%-0.01%、0.01%-0.02%、0.02%-0.03%、0.03%-0.04%、0.04%-0.05%、0.005%-0.02%、0.01%-0.04%或0.005%-0.05%的聚山梨醇酯80。在一些实施方案中,所述配制品包含约0.01%聚山梨醇酯80。
[0213]
在一些实施方案中,所述配制品包含约1-10mg/ml的寡糖-gaa缀合物,包括例如约以下值中的任一个:1、2、3、4、5、6、7、8、9或10mg/ml的所述寡糖-gaa缀合物。在一些实施方
案中,所述配制品包含约以下值中的任一个:1-5、2-8、3-7、4-6、1-2.5、2.5-5、5-7.5、7.5-10或5-10mg/ml的所述寡糖-gaa缀合物。在一些实施方案中,所述配制品包含约5-10mg/ml的所述寡糖-gaa缀合物。在一些实施方案中,所述配制品包含约5mg/ml的所述寡糖-gaa缀合物。
[0214]
在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);以及(b)约1%-4%甘露醇。在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);(b)约1%-4%甘露醇;以及(c)约0.25%-2%甘氨酸。在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);(b)约1%-4%甘露醇;(c)约0.25%-2%甘氨酸;以及(d)约10-50mm组氨酸。在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);(b)约1%-4%甘露醇;(c)约0.25%-2%甘氨酸;(d)约10-50mm组氨酸;以及(e)约0.005%-0.05%聚山梨醇酯(例如,聚山梨醇酯80)。在一些实施方案中,所述配制品是冻干配制品。在一些实施方案中,所述配制品是可冻干配制品。在一些实施方案中,提供一种从所述冻干配制品重构的药物组合物。在一些实施方案中,所述配制品包含约5mg/ml至约10mg/ml的所述寡糖-gaa缀合物。在一些实施方案中,所述配制品的ph为约5.5至约6.5。
[0215]
在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);以及(b)约2%甘露醇。在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);(b)约2%甘露醇;以及(c)约2%甘氨酸。在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);(b)约2%甘露醇;(c)约2%甘氨酸;以及(d)约10mm组氨酸。在一些实施方案中,提供一种配制品,所述配制品包含:(a)本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α);(b)约2%甘露醇;(c)约2%甘氨酸;(d)约10mm组氨酸;以及(e)约0.01%聚山梨醇酯80。在一些实施方案中,所述配制品是冻干配制品。在一些实施方案中,所述配制品是可冻干配制品。在一些实施方案中,提供一种从所述冻干配制品重构的药物组合物。在一些实施方案中,所述配制品包含约5mg/ml的所述寡糖-gaa缀合物。在一些实施方案中,所述配制品的ph为约6.2。
[0216]
在一些实施方案中,提供一种冻干或可冻干配制品,所述冻干或可冻干配制品包含:(a)艾瓦葡糖苷酶α;(b)约1%-4%甘露醇;(c)约0.25%-2%甘氨酸;(d)约10-50mm组氨酸;以及(e)约0.005%-0.05%聚山梨醇酯80。在一些实施方案中,所述配制品是冻干配制品。在一些实施方案中,所述配制品是可冻干配制品。在一些实施方案中,提供一种从所述冻干配制品重构的药物组合物。在一些实施方案中,所述配制品包含约5mg/ml的艾瓦葡糖苷酶α。在一些实施方案中,所述配制品的ph为约6.2。
[0217]
在一些实施方案中,提供一种冻干或可冻干配制品,所述冻干或可冻干配制品包含:(a)艾瓦葡糖苷酶α;(b)约2%甘露醇;(c)约2%甘氨酸;(d)约10mm组氨酸;以及(e)约0.01%聚山梨醇酯80。在一些实施方案中,所述配制品是冻干配制品。在一些实施方案中,所述配制品是可冻干配制品。在一些实施方案中,提供一种从所述冻干配制品重构的药物
组合物。在一些实施方案中,所述配制品包含约5mg/ml的艾瓦葡糖苷酶α。在一些实施方案中,所述配制品的ph为约6.2。
[0218]
术语“缓冲液”涵盖在冻干前将溶液ph维持在可接受范围内的那些药剂,并且可以包括琥珀酸盐(琥珀酸钠或琥珀酸钾)、组氨酸、磷酸盐(磷酸钠或磷酸钾)、tris(三(羟甲基)氨基甲烷)、二乙醇胺、柠檬酸盐(柠檬酸钠)等。将ph控制在该范围内的缓冲液的例子包括琥珀酸盐(如琥珀酸钠)、葡糖酸盐、组氨酸、柠檬酸盐和其他有机酸缓冲液。
[0219]
术语“冷冻保护剂”通常包括如下药剂:其可能通过优先从蛋白质表面被排除来向蛋白质提供抵抗冷冻诱导的应力的稳定性。它们还可以在初级和次级干燥期间以及在长期产物储存期间提供保护。例子是聚合物,如葡聚糖和聚乙二醇;糖,如甘露醇;表面活性剂,如聚山梨醇酯;以及氨基酸,如甘氨酸、精氨酸和丝氨酸。
[0220]
本文所述配制品还可以包含一种或多种药学上可接受的赋形剂,如膨胀剂、张力调节剂、抗氧化剂和防腐剂。本文所述冷冻保护剂(如甘露醇和甘氨酸)可以起多种作用,包括作为膨胀剂和/或张力调节剂。术语“膨胀剂”包含提供冷冻干燥的产物的结构的药剂。除了提供药学上精致的饼状物以外,膨胀剂还可以赋予关于修改塌陷温度、提供冷冻-解冻保护和增强长期储存中的蛋白质稳定性的有用性质。术语“张力调节剂”包括用作张力调节剂以控制渗透压的盐(nacl、kcl、mgc12、cac
12
等)。
[0221]
在一些实施方案中,本文所述配制品包含抗氧化剂,如甲硫氨酸。在一些实施方案中,本文所述配制品不含抗氧化剂。在一些实施方案中,所述配制品包含约1-20mm的抗氧化剂(例如,甲硫氨酸),包括例如约以下值中的任一个:1、2、5、10、15或20mm的所述抗氧化剂,包括这些值之间的任何值或范围。
[0222]
本文所述配制品是稳定的。“稳定的”配制品是如下配制品:其中的蛋白质在储存时基本上保持其物理稳定性和/或化学稳定性和/或生物学稳定性。用于测量蛋白质稳定性的各种分析技术是本领域中可用的并且综述于以下文献中:peptide and protein drug delivery,247-301,vincent lee编辑,marcel dekker,inc.,纽约,纽约州,pubs.(1991);和jones,a.adv.drug delivery rev.10:29-90(1993)。可以在所选温度下在所选时间段中测量稳定性。
[0223]“稳定的”冻干配制品是如下冻干配制品:在冷冻温度(2℃-8℃)下至少12个月、优选地2年、且更优选地3年;或者在室温(23-27℃)下至少3个月、优选地6个月、且更优选地1年,未观察到其有显著变化。稳定性的标准如下:不超过10%,优选地5%、3%、2%、1%或更少的所述寡糖-gaa缀合物单体被降解,如通过尺寸排阻色谱法(sec)所测量。通过视觉分析,再水化的溶液是无色的,或者是透明至微乳白色的。所述配制品的浓度、ph和同渗重摩的变化不超过 /-10%。效力(potency)在对照的70%-130%内,优选地在80%-120%内。观察到不超过10%,优选地5%、3%、2%、1%或更少的裁剪(clipping)。形成不超过10%,优选地5%、3%、2%、1%或更少的聚集。
[0224]
在开发稳定的冻干配制品时考虑以下标准。在冻干期间的蛋白质解折叠应最小化。各种降解途径应最小化,包括gaa与寡糖之间的化学连接的降解和gaa蛋白的降解。玻璃化转变温度(tg)应高于产物储存温度。残留水分应低(以质量计《1%)。应获得坚固且精致的饼状物结构。在室温(22℃至28℃)下,优选的保质期应为至少3个月,优选地6个月,更优选地1年。重构时间应短,例如,小于5分钟,优选地小于2分钟,并且更优选地小于1分钟。在
重构冻干产物时,重构的样品应在2℃-8℃下稳定至少48小时。
[0225]
本文所述配制品使包含所述寡糖-gaa缀合物的药物组合物中聚集物和微粒的形成最小化,并且确保在从冻干配制品重构之后所述寡糖-gaa缀合物维持其活性。本文所述药物组合物可以包含从水性冻干前(即,可冻干)配制品制备的无菌的药学上可接受的冻干配制品。
[0226]
冻干是冷冻干燥过程,其通常用于制备药物产品以保留其生物学活性。制备液体组合物,然后将其冻干以形成干燥饼状产物。所述过程通常涉及在真空中干燥先前冷冻的样品以去除冰,使无水组分以粉状或饼状物质的形式保持完整。所述冻干产物可以储存延长的时间段,并且在升高的温度下储存,而不损失生物学活性,并且可以通过添加适当的稀释剂将其容易地重构为无颗粒溶液。适当的稀释剂可以是如下任何液体:其是生物上可接受的并且冻干粉末可以完全溶于其中。水、特别是无菌的无热原水是优选的稀释剂,因为它不包括可能影响所述寡糖-gaa缀合物的稳定性的盐或其他化合物。冻干的优点在于含水量降低至一定水平,所述水平显著减少导致产物在长期储存时不稳定的各种分子事件。所述冻干产物还能够更容易地耐受运输的物理应力。所述重构的产物不含颗粒,因此它可以在不进行预先过滤的情况下施用。
[0227]
液体冻干前(即,可冻干)配制品可以使用适当的干燥参数来冻干。例如,可以使用以下干燥参数:约-20℃至-50℃的初级干燥期温度和在约80mtorr至约120mtorr之间的压力;以及在环境温度和在约80mtorr至120mtorr之间的压力下的次级干燥期。
[0228]
在稀释剂(例如,无菌水或盐水)中使用时将冻干配制品再水化,以产生无颗粒药物组合物。即使在冻干饼状物在环境温度下的延长储存后,重构的药物组合物是无颗粒的。将重构的药物组合物肠胃外(优选地静脉内或皮下)施用至受试者。
[0229]
所述冻干配制品的重要特征是重构时间或将干粉再水化所耗时间。为了使得能够极快且完全地再水化,重要的是使饼状物具有多孔结构。饼状物结构随多个参数而变,所述参数包括所述寡糖-gaa缀合物的浓度、赋形剂类型和浓度以及冻干周期的过程参数。通常,重构时间随浓度增加而增加,并且因此在开发寡糖-gaa缀合物的高浓度冻干配制品时,短重构时间是重要目标。
[0230]
还提供本文所述任一种配制品或药物组合物用于制备治疗庞贝病(如iopd)的药物中的用途。还提供用于治疗庞贝病(如iopd)的本文所述任一种配制品或药物组合物。
[0231]
iv.试剂盒和制品
[0232]
本技术还提供用于本文所述治疗方法的任何实施方案中的试剂盒和制品。所述试剂盒和制品可以包含本文所述的任一种配制品和药物组合物。例如,提供包含艾瓦葡糖苷酶α的冻干配制品的试剂盒。
[0233]
在一些实施方案中,本文提供一种包含配制品的试剂盒,所述配制品包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)、一种或多种冷冻保护剂、一种或多种缓冲剂(例如,组氨酸)和包含不被所述gaa降解的糖(例如,甘露醇)的一种或多种冷冻保护剂。在一些实施方案中,所述一种或多种冷冻保护剂包含甘露醇和甘氨酸。在一些实施方案中,所述一种或多种冷冻保护剂还包含表面活性剂(例如,聚山梨醇酯80)。在一些实施方案中,所述试剂盒包含配制品,所述配制品包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)、组氨酸、甘氨酸、甘露醇和聚山梨醇酯80。在
一些实施方案中,所述配制品包含约10-50mm(例如,约10mm)组氨酸、约0.25%-2%(例如,约2%)甘氨酸、约1%-4%(例如,约2%)甘露醇和约0.005%-0.05%(例如,约0.01%)聚山梨醇酯80。在一些实施方案中,所述配制品是冻干配制品、可冻干配制品或重构的液体配制品。在一些实施方案中,所述配制品的ph为约5.5至约6.5(例如,约6.2)。在一些实施方案中,所述配制品包含约5mg/ml至约10mg/ml的所述寡糖-gaa缀合物。在一些实施方案中,所述配制品包含艾瓦葡糖苷酶α。
[0234]
在一个实施方案中,本文提供包含含有配制品的容器的制品,所述配制品包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)、一种或多种冷冻保护剂一种或多种缓冲剂(例如,组氨酸)和包含不被gaa降解的糖(例如,甘露醇)的一种或多种冷冻保护剂。在一些实施方案中,所述一种或多种冷冻保护剂包含甘露醇和甘氨酸。在一些实施方案中,所述一种或多种冷冻保护剂还包含表面活性剂(例如,聚山梨醇酯80)。在一些实施方案中,所述制品包含含有配制品的容器,所述配制品包含本文所述的任一种寡糖-gaa缀合物(例如,式i-式iii,或艾瓦葡糖苷酶α)、约10-50mm(例如,约10mm)组氨酸、约0.25%-2%(例如,约2%)甘氨酸、约1%-4%(例如,约2%)甘露醇和约0.005%-0.05%(例如,约0.01%)聚山梨醇酯80。在一些实施方案中,所述配制品是冻干配制品、可冻干配制品或重构的液体配制品。在一些实施方案中,所述配制品的ph为约5.5至约6.5(例如,约6.2)。在一些实施方案中,所述配制品包含约5mg/ml至约10mg/ml的所述寡糖-gaa缀合物。在一些实施方案中,所述配制品包含艾瓦葡糖苷酶α。在一些实施方案中,所述容器是小瓶。在一些实施方案中,所述容器是20cc小瓶。
[0235]
本技术的试剂盒和制品在合适的包装中。合适的包装包括但不限于小瓶、瓶子、广口瓶、软包装(例如,麦拉(mylar)袋或塑料袋)等。试剂盒可以任选地提供另外的组分,如缓冲液和解释性信息。本技术因此还提供制品,所述制品包括小瓶(如密封小瓶)、瓶子、广口瓶、软包装等。
[0236]
试剂盒还包含使用所述寡糖-gaa缀合物治疗庞贝病(如iopd)的说明书。在一些实施方案中,所述试剂盒还包含指导手册,如描述本文所述治疗方法的任何实施方案的方案的手册。所述说明书可以包括关于以下的信息:寡糖-gaa缀合物(例如,艾瓦葡糖苷酶α)的剂量、给药时间表和施用途径。在一些实施方案中,所述试剂盒还包含针对治疗方法选择个体的说明书。在一些实施方案中,所述试剂盒还包含在接受治疗后监测个体的说明书。
[0237]
所述容器可以是单位剂量、散装包装(例如,多剂量包装)或亚单位剂量。例如,可以提供如下试剂盒:其含有足够的如本文所公开的寡糖-gaa缀合物(例如,艾瓦葡糖苷酶α),以在诸如以下的延长时间段内提供对个体的有效治疗:3周、6周、9周、3个月、4个月、5个月、6个月、8个月、9个月、1年或更长时间中的任一时间。
[0238]
本说明书中公开的所有特征可以以任何组合进行组合。本说明书中公开的每个特征可以由用于相同、等同或类似目的的替代性特征来替代。因此,除非另外明确陈述,否则所公开的每个特征只是等同或类似特征的一般系列的例子。
[0239]
实施例
[0240]
下文的实施例意图仅是本发明的示例,并且因此不应视为以任何方式限制本发明。以下实施例和详细描述是以说明方式而不是限制方式来提供的。
[0241]
实施例1.婴儿期发作的庞贝病临床试验中的艾瓦葡糖苷酶α
[0242]
以下实施例描述开放标签的递增剂量群组研究,其评估艾瓦葡糖苷酶α在用阿葡糖苷酶α治疗且显示临床衰退或次最佳临床反应的患有婴儿期发作的庞贝病的患者中的安全性、药代动力学和初步功效。
[0243]
a.研究设计
[0244]
目标
[0245]
研究的主要目标是评价艾瓦葡糖苷酶α在先前用阿葡糖苷酶α治疗的患有婴儿期发作的庞贝病(iopd)的患者中的安全性概况。次要目标是与阿葡糖苷酶α相比,表征艾瓦葡糖苷酶α的药代动力学概况和评价艾瓦葡糖苷酶α初步功效。
[0246]
方法学
[0247]
进行多阶段2期开放标签、多中心、多国递增剂量群组研究,其包括艾瓦葡糖苷酶α在患有iopd的儿科患者中的重复静脉内输注研究,所述儿科患者先前已经用阿葡糖苷酶α治疗,并显示在指定的呼吸功能、运动技能、心脏参数和/或上睑下垂新发作(包括眼睑位置测量,如睑裂间距(ipfd)、边缘反射距离-1(mrd-1)和边缘瞳孔距离(mpd))方面的临床衰退(阶段1)或次最佳临床反应(阶段2)。研究设计的示意性总结提供于图1中。
[0248]
群组1和2中的患者具有已记录的与庞贝病相关的至少一个以下参数方面的临床衰退的证据:呼吸功能、运动技能和/或心脏参数。群组3中的患者具有已记录的接受阿葡糖苷酶α时至少一个与庞贝病相关的以下参数方面的次最佳临床反应的证据:呼吸功能、运动技能和/或上睑下垂新发作(通过至少2次连续评估来证实)。
[0249]
在阶段1中,群组1中的患者在整个研究中接受20mg/kg艾瓦葡糖苷酶α,并且群组2中的患者在整个研究中接受40mg/kg艾瓦葡糖苷酶α(图1)。在阶段2中,将加入群组3的患者随机化为接受来自群组1和2的最大耐受剂量的艾瓦葡糖苷酶α(即,40mg/kg),或在研究的前6个月内接受阿葡糖苷酶α(在加入研究之前至少6个月内以稳定剂量、以标记剂量或高于标记剂量),之后转换为40mg/kg艾瓦葡糖苷酶α。所有患者在研究的剩余时间中接受艾瓦葡糖苷酶α。
[0250]
诊断以及入选和排除的标准
[0251]
入选的患者具有已记录的gaa缺乏,年龄《18岁,在庞贝病诊断时患有心脏受累,在即将进入研究之前最少6个月内一直定期接受稳定剂量的阿葡糖苷酶α,并且具有已记录的临床衰退(阶段1患者)或次最佳临床反应(阶段2患者)的证据。
[0252]
研究的入选标准如下:
[0253]
·
患者患有已证实的任何组织来源(例如,血液、皮肤或肌肉组织)的酸性α-葡糖苷酶(gaa)酶缺乏。
[0254]
·
在进行任何研究相关程序之前根据当地法规所定义已达到法定成年年龄的患者或患者的一名或多名法定监护人提供已签署的知情同意书。如果根据当地法规患者在法律上未成年,在适用的情况下取得患者的同意。
[0255]
·
患者(和患者的法定监护人,如果根据当地法规的定义患者在法律上未成年的话)必须有能力依从临床方案。
[0256]
·
患者《18岁。
[0257]
·
患者(如果是女性并且有生育能力)的血清妊娠测试(β-人绒毛膜促性腺激素)必须呈阴性,并且在筛查/基线时不得正在进行母乳喂养。
[0258]
·
患者在生命第一年诊断时患有心肌病:即,左心室质量指数(lvmi)等同于平均年龄特定的lvmi加2个标准差。
[0259]
·
患者在即将进入研究之前最少6个月内一直定期接受稳定剂量的阿葡糖苷酶α。
[0260]
·
对于阶段1中的参与者:患者具有已记录的至少一个与庞贝病相关且与并发疾病无关的以下参数方面的临床衰退的证据:呼吸功能、运动技能和/或心脏参数。
[0261]
·
对于阶段2中的参与者:患者具有已记录的至少一个与庞贝病相关且与并发疾病无关的以下参数方面的次最佳临床反应的证据:呼吸功能、运动技能和/或上睑下垂新发作。
[0262]
排除的患者具有高抗体滴度(即,在相隔》1个月的2个连续时间点,抗阿葡糖苷酶α抗体滴度≥1:25,600);临床上显著的器质性疾病(除了庞贝病),其可能已经导致异常实验室参数或潜在降低的存活期;或者对艾瓦葡糖苷酶α的严重过敏反应的高风险(即,先前中度/严重过敏性反应、ige抗体或针对阿葡糖苷酶α的高igg抗体史)。
[0263]
研究的排除标准如下:
[0264]
·
患者具有针对阿葡糖苷酶α的高抗体滴度。
[0265]
·
患者具有对艾瓦葡糖苷酶α的严重过敏反应的高风险。
[0266]
·
患者在研究的持续时间中需要任何禁止的合并用药(例如,免疫调节治疗)。
[0267]
·
患者先前已经参与过任何act14132研究群组。
[0268]
·
有生育能力的女性患者未通过高效的节育避孕方法进行保护和/或其不愿或不能进行妊娠测试。
[0269]
主要关键终点和主要的次要关键终点
[0270]
主要安全性终点包括:(1)不良事件/治疗期间出现的不良事件(teae),包括输注相关反应(iar)(表5);(2)作为描述性总结的临床实验室分析,包括标准生物化学、血液学和尿分析;以及(3)作为描述性总结的免疫原性评估。
[0271]
次要药代动力学终点包括血浆参数,包括c
max
、t
max
、曲线下面积(auc
0-最后
)、终末半衰期(t
1/2z
)、清除率(cl)和分布容积(vd)。
[0272]
次要功效终点包括在6个月时以下参数的变化:粗大运动功能测量-88(gmfm-88,参见图2a-图2b)和粗大运动功能分类系统-扩展修订版(gmfcs-e&r);庞贝儿科残疾评估量表(庞贝-pedi)功能技能量表:运动性领域(图3);快速运动功能测试(qmft);超声心动描记术(echo)终点(表6):左心室质量指数(lvmi)和左心室质量(lvm)z得分;以及肌酸激酶水平(图4a-图4b)。
[0273]
其他次要终点包括6分钟步行测试(6mwt),其测量能够在不停止和不使用辅助装置的情况下行走至少40米(大约130英尺)的患者步行的距离;呼吸机使用和尿液hex-4水平(图5a-图5b)。
[0274]
另一次要终点是眼睑位置测量。所述评估是在筛查/基线时、第1天以及从第3周至第25周(包含端值)每2周进行。如作为次最佳改善的入选标准所定义的对上睑下垂的诊断是基于治疗主要研究者的评估;另外,中心读取器基于在基线时和在每次访视(包括第25周)时拍摄的照片来检查所评价的上睑下垂的存在。在参与者佩戴新型测量装置时拍摄所述参与者眼睛的图像,所述新型测量装置由一对空眼镜框和作为标准化测量工具连接的尺子组成(图6a)。通过遮蔽治疗组和剂量的独立中心读取器进行以下眼睑位置测量:(1)睑裂
间距(ipfd):上睑缘与下睑缘之间的垂直距离(图6b);(2)边缘反射距离-1(mrd-1):角膜光反射与上睑缘之间的距离(图6c);(3)边缘瞳孔距离(mpd):瞳孔中心与上睑缘之间的距离(图6d)。
[0275]
统计学方法
[0276]
基于安全性群体提供安全性结果的描述性总结,所述安全性群体被定义为在研究中接受至少一次输注(部分或完全)的所有患者。总结关于不良事件、实验室安全性变量和免疫原性的数据。
[0277]
提供所有群组的功效终点、药代动力学和药效动力学终点的描述性总结和/或图表。
[0278]
艾瓦葡糖苷酶α配制品
[0279]
将艾瓦葡糖苷酶α配制于小瓶中,每个小瓶在10mm组氨酸、2%甘氨酸、2%甘露醇、0.01%聚山梨醇酯80(ph 6.2)中含有大约105mg艾瓦葡糖苷酶α。在施用前将其用注射用无菌水重构。
[0280]
b.结果
[0281]
群体特征
[0282]
六名患者加入群组1,5名加入群组2,并且11名加入群组3(表1)。患者在法国的两个地点、日本的两个地点、英国的两个地点、美国的3个地点和中国台湾的一个地点加入。在群组3患者中,六名随机化为阿葡糖苷酶α且五名随机化为艾瓦葡糖苷酶α。患者年龄在1岁与12岁之间。
[0283]
患者在基线时的人口统计学和特征在三个群组和治疗组之间相当,但年龄除外:随机化为阿葡糖苷酶α的群组3患者更年轻(表1)。表2提供加入研究之前,从诊断时起的患者病史的总结。基线功能水平在所有患者之间是异质性的,且群组3中运动功能障碍不太严重(表3)。有两名交叉反应性免疫物质(crim)阴性患者和20名crim阳性患者(表3)。
[0284]
群组3阿葡糖苷酶α治疗组参与者在基线时比其他群组更年轻,并且接受范围为20mg/kg qow至高达每周40mg/kg的剂量方案。群组1参与者主要是男性。总之,参与者的生长参数基本上在正常范围内。
[0285]
表1.在基线时患者人口统计学的总结
[0286]
[0287][0288]
*仅可获得年龄在0与35个月(包含端值)之间的患者(n=4)的头围z得分,who头围z得分表。
[0289]
表2.从诊断时起/加入研究之前的患者病史的总结
[0290]
[0291][0292]
*在其病史中患有肺炎的所有患者中,除了一名患者以外都在加入之前一年期间具有《5次发病;群组3阿葡糖苷酶α组中的一名患者在加入之前一年中具有5次与10次之间的发病。
[0293]
表3.在基线时庞贝病史、crim和功能状态的总结
[0294]
[0295][0296]
*2名crim(历史的)阴性患者加入(一名患者在群组2中,并且一名患者在群组3阿葡糖苷酶α中[在诊断时用免疫耐受诱导预治疗])
[0297]
在初步分析期(25周治疗期)中,或者在初步分析期的最后一名患者的最后一次访视(lplv)之后,直至2019年9月30日的数据截止日,没有患者中断。所有患者都具有至少6个月的可用数据。
[0298]
初步分析期期间的研究药物暴露
[0299]
没有遗漏输注或剂量降低,并且加入的所有22名患者都完成了初步分析期(直至第25周;表4)。总体治疗依从性良好;没有参与者遗漏输注或降低其剂量。
[0300]
在群组3阿葡糖苷酶α治疗组中,每名患者具有基于范围为每2周20mg/kg直至每周40mg/kg的先前稳定剂量的其自身方案。群组1中的两名患者在初步分析期后根据方案增加剂量。
[0301]
表4.初步分析期期间的研究药物暴露
[0302][0303]
安全性结果
[0304]
治疗期间出现的不良事件(teae)的发生率在所有群组之间以及在群组3的两个治疗组之间是类似的(表5)。安全性与在严重影响的先前治疗的iopd患者中测试的两种剂量水平(20mg/kg qow和40mg/kg qow)下产物和潜在疾病二者的已知安全性概况一致。最常见的teae是呕吐和发烧(各6名患者)、上呼吸道感染(5名患者)、咳嗽和皮疹(各4名患者)。
[0305]
表5.安全性结果的总结
[0306][0307]
没有治疗相关的严重不良事件。在任何群组中没有由于不良事件引起的死亡或退出。
[0308]
四名患者在初步分析期内经历至少一次输注相关反应(iar),并且四名患者在延长治疗期(etp)内经历至少一次iar(表5)。
[0309]
没有实验室或超声心动图的潜在临床上显著异常的相关不良事件。
[0310]
在施用研究药物后(在首次药物施用之后的任何时间),6名患者产生针对艾瓦葡糖苷酶α的抗药抗体(ada)且中值峰值滴度为6400,包括具有加强的ada的1名患者,即,预先存在的ada从基线被加强至少2个滴度台阶(step)(即,滴度增加4倍)。除了一名患者以外所有患者的ada都随时间而下降;该患者在最后一个可用时间点的峰值滴度为6400。
[0311]
值得注意的是,crim阴性患者极少。经历阿葡糖苷酶α治疗的患者被包括在内,并且先前具有高抗体滴度(抗阿葡糖苷酶α抗体滴度≥1:25600)的患者被排除。
[0312]
功效结果
[0313]
大多数患者(14/16名用艾瓦葡糖苷酶α治疗的患者、6/6名用阿葡糖苷酶α治疗的患者)经历合格症状(即,临床衰退/次最佳反应的进入标准)的稳定或改善。在初步分析期之后,两名恶化的患者根据方案将艾瓦葡糖苷酶α剂量从20mg/kg增加至40mg/kg。
[0314]
使用艾瓦葡糖苷酶α治疗时,运动量表gmfm-88(图2a-图2b)、庞贝-pedi(图3)和超声心动图评估(例如,超声心动图左心室质量(lvm)z得分)(表6)存在正趋势(稳定或改善)。在所有群组之间,关于庞贝-pedi功能技能量表,单独患者显示改善或稳定(图3)。在初步分析期期间,没有观察到echo-lvm z得分从基线衰退,并且在基线时具有异常lvm z得分的唯一患者在第25周改善为正常范围(crim阴性群组2患者)(表6)。
[0315]
表6.超声心动图(echo)-lvm z得分m模式*结果
[0316][0317]
在组的水平上,在第25周时在群组3中的艾瓦葡糖苷酶α(每隔一周40mg/kg)与阿葡糖苷酶α(在先前稳定剂量下;范围为每隔一周/每周20-40mg/kg)之间没有观察到明显差异,但在治疗组之间关于患者年龄存在不平衡(即,阿葡糖苷酶α组中的患者更年轻)。
[0318]
药效动力学结果
[0319]
在所有剂量水平下,肌酸激酶(图4a-图4b)和尿液hex4(图5a-图5b)参数存在高个体间变异性,且在40mg/kg艾瓦葡糖苷酶α组中存在更显著下降的趋势。与使用阿葡糖苷酶α的稳定性相比,使用艾瓦葡糖苷酶α时,肌肉损伤(肌酸激酶[ck])和糖原负荷(己糖四糖[hex4])的药效动力学疾病生物标记的水平也有所下降。
[0320]
上睑下垂
[0321]
眼睑位置测量的结果显示于下表7中。在基线时,加入mini-comet的22名参与者中有7名具有上睑下垂的临床诊断,包括3名双侧和4名单侧。在第25周,7名参与者患有上睑下垂,包括3名双侧和4名单侧。在群组1(艾瓦葡糖苷酶α,20mg/kg qow)中,1名参与者患有消退的左眼上睑下垂,并且另外2名参与者截至第25周发生双侧上睑下垂。在群组2(艾瓦葡糖苷酶α,40mg/kg qow)中,1名参与者在基线时患有右眼上睑下垂,并且截至第25周没有参与者患有任一只眼睛的上睑下垂。在群组3(艾瓦葡糖苷酶α,40mg/kg qow)中,另外1名参与者截至第25周发生右眼上睑下垂,而在基线时患有双侧上睑下垂的1名参与者截至第25周没有上睑下垂。在群组3(阿葡糖苷酶α,20mg/kg qow至每周40mg/kg)中,2名参与者在基线时患有右眼上睑下垂,截至第25周,所述上睑下垂在1名参与者中仍然存在并且在1名参与者中消退,而在基线时患有左眼上睑下垂的1名参与者中,所述上睑下垂在第25周仍然存在。
[0322]
表7.对上睑下垂在参与者中的存在进行临床评估(数据是参与者的数量)
[0323][0324][0325]
图7a-图7f比较不同群组之间各个眼睑位置测量的结果。在40mg/kg qow艾瓦葡糖苷酶α组(群组2和群组3艾瓦葡糖苷酶α组)中,存在从基线至第25周对于眼睑位置测量的改善趋势。相比之下,20mg/kg qow艾瓦葡糖苷酶α组(群组1)和阿葡糖苷酶α组(群组3阿葡糖苷酶α组)在这些测量中显示稳定或恶化。睑裂间距(两只眼睛,使用和不使用闪光)在治疗组之间的差异比边缘反射距离-1(两只眼睛)或边缘瞳孔距离(两只眼睛)的差异更显著。值得注意的是,非闪光图像、特别是测量睑裂间距和边缘瞳孔距离的那些可以允许更精确的测量,因为不存在由于闪光摄影术所致的眼斜视。
[0326]
单独参与者反应
[0327]
已经通过在细面图中标绘基线和第25周数据来分析mini-comet研究中的单独参与者反应。
[0328]
图8a-图8d显示不同群组中的个体反应,如通过以下庞贝病负荷生物标记所测量:(1)己糖四糖(hex4)水平和(2)肌酸激酶(ck)水平。hex4从基线至第25周的下降在用艾瓦葡糖苷酶α40mg/kg qow治疗的参与者中最大,其基线值》40mmol/mol,而对于用阿葡糖苷酶α和艾瓦葡糖苷酶α20mg/kg qow治疗的那些参与者,变化是更多变的(图8a-图8b)。ck从基线至第25周的下降显现出主要在基线水平》900iu/l的参与者中被观察到,并且在用艾瓦葡糖苷酶α治疗的参与者中倾向于下降,且在用阿葡糖苷酶α治疗的那些参与者中保持稳定(图8c-图8d)。
[0329]
图9a-图9d显示不同群组中的个体反应,如通过运动功能参数(包括gmfm-88和qmft)所测量。gmfm-88和快速运动功能测试(qmft)显现出分别对于基线得分在20%-70%之间(按0-100%范围)和在10-45之间(按0-64范围)的情况下具有最大改善。功能更低或更高的参与者保持稳定或倾向于下降(图9a-图9d)。
[0330]
在开始艾瓦葡糖苷酶α治疗之前可获得gmfm-88得分的那些参与者中,在从每周高阿葡糖苷酶α治疗转换为艾瓦葡糖苷酶α40mg/kg qow之后,显示运动功能的一致性改善。三项个体病例研究显示于图10a-图10c和下表8中。
[0331]
表8.病例研究
[0332][0333]
对于群组2和3中接受艾瓦葡糖苷酶α40mg/kg qow的所有那些参与者,在基线时年龄》6岁的可行走参与者的6分钟步行测试(6mwt)距离有所改善(图11a),而接受较低剂量的艾瓦葡糖苷酶α(20mg/kg qow)的群组1中和群组3阿葡糖苷酶α组(剂量范围,20mg/kg qow至每周40mg/kg)中的参与者在治疗的前25周期间稳定或衰退(图11b)。
[0334]
基于可靠地进行测试的能力的与年龄相关的限制,可获得关于肺功能测试的有限数据。5名参与者在基线时正在接受通气,并且观察到极少变化,没有呼吸衰退。
[0335]
结论
[0336]
患者在基线时的人口统计学和特征在三个群组和治疗组之间是相当的,年龄除外(随机化为阿葡糖苷酶α的群组3患者的平均年龄更年轻)。在所有患者之间,在基线时的功能水平具有异质性,且群组3中的运动功能障碍不太严重。
[0337]
在初步分析期内或直至截止日,没有患者中断。此外,没有死亡,且没有治疗相关
的严重不良事件。
[0338]
存在有利的安全性和免疫原性概况。在先前以范围为每2周20mg/kg至每周40mg/kg的剂量方案治疗的对阿葡糖苷酶α具有不完全治疗反应的严重受影响的iopd患者中,艾瓦葡糖苷酶α在每2周20mg/kg和40mg/kg下总体上是安全的且耐受良好。疾病生物标记和探索性功效评估显示大多数研究参与者的改善的趋势。
[0339]
在接受40mg/kg艾瓦葡糖苷酶α的患者中,肌酸激酶(和hex4)下降的趋势更显著。存在高个体间变异性。
[0340]
与接受艾瓦葡糖苷酶α20mg/kg qow或剂量范围为20mg/kg qow至每周40mg/kg的阿葡糖苷酶α的参与者中的稳定或衰退相比,在接受艾瓦葡糖苷酶α40mg/kg qow的参与者中还观察到眼睑位置的改善的趋势。该作用对于睑裂间距比对于边缘反射距离-1或边缘瞳孔距离更显著。这些数据进一步支持,在患有iopd的长期存活者中,艾瓦葡糖苷酶α40mg/kg qow对临床上有意义的结果量度(即,预防上睑下垂恶化,最终转化为降低弱视的风险或对手术干预的需求)的作用更强。
[0341]
大多数患者(14/16名用艾瓦葡糖苷酶α治疗的患者、6/6名用阿葡糖苷酶α治疗的患者)经历临床衰退/次最佳反应的进入标准的稳定或改善。
[0342]
由于患者群组的异质性基线功能水平,患者水平分析阐明艾瓦葡糖苷酶α的作用。进行分析以解释在三个群组和治疗组中的患者之间基线时的异质性功能水平,以及在诊断和进入研究时的年龄、先前阿葡糖苷酶α治疗和性别平衡方面的差异。
[0343]
参与者水平分析证实,关于药效动力学疾病生物标记、运动结果、呼吸参数和眼睑量度,与阿葡糖苷酶α(20mg/kg qow至每周40mg/kg)相比,20mg/kg和40mg/kg qow的艾瓦葡糖苷酶α显现出改善或更好地稳定庞贝病的症状。所测试艾瓦葡糖苷酶α的最高剂量40mg/kg qow显现出在有意义的结果量度方面提供另外的益处,同时维持有利的安全性概况和可接受的免疫原性。
[0344]
这些数据支持使用艾瓦葡糖苷酶α在患有iopd的患者(受影响最严重的庞贝病患者群体)中的积极临床影响。
[0345]
实施例2.未经治疗的婴儿期发作的庞贝病临床试验中的艾瓦葡糖苷酶α
[0346]
以下实施例描述对艾瓦葡糖苷酶α在年龄小于或等于6个月的未经治疗的婴儿期发作的庞贝病儿科患者中的功效、安全性、药代动力学和药效动力学的3期、开放标签、多国、多中心、静脉内输注研究。
[0347]
a.研究设计
[0348]
目标
[0349]
研究的主要目标是确定在治疗的52周后,艾瓦葡糖苷酶α治疗对年龄小于或等于6个月的婴儿期发作的庞贝病(iopd)患者的存活期和无有创呼吸机存活期的影响。研究的次要目标是确定艾瓦葡糖苷酶α治疗对以下的影响:12月龄和18月龄时的存活期和无有创呼吸机存活期,以及在研究的第52周时左心室质量z得分(lvm z得分)、阿尔伯塔婴儿运动量表(aims)得分、身长、体重和头围百分位数以及尿液hex4水平的变化。研究的其他次要目标是确定艾瓦葡糖苷酶α的安全性、耐受性和免疫原性,以及确定在第12周和第52周时药代动力学(pk)概况。
[0350]
方法学
[0351]
患者包括在单一实验组中,其每两周接受艾瓦葡糖苷酶α静脉内(iv)输注。在研究完成之前,在52周收集主要终点数据。
[0352]
诊断以及入选和排除的标准
[0353]
入选的患者必须具有证实的婴儿期发作的庞贝病的诊断,并且年龄小于或等于6个月。
[0354]
研究的入选标准如下:
[0355]
·
患者具有证实的婴儿期发作的庞贝病的诊断,所述婴儿期发作的庞贝病定义为:(1)两种溶酶体酸性α-葡糖苷酶(gaa)致病变体的存在和已记录的血液、皮肤或肌肉组织的gaa缺乏,或者(2)两种单独样品(来自两种不同组织或来自相同组织但在两个不同的取样日期)中一种gaa致病变体的存在和已记录的血液、皮肤和肌肉组织的gaa缺乏。
[0356]
·
患者具有在加入之前可获得的已确立的交叉反应性免疫物质(crim)状态。这可以由以下来提供:历史crim测试结果、基于基因型分析的crim的预测或者通过临床实验室改进修正案(clinical laboratory improvement amendments,clia)或其他适当认证的实验室在筛查时进行的测试。
[0357]
·
患者在诊断时患有心肌病;即,左心室质量指数(lvmi)等同于平均年龄特定的lvmi加1个标准差(对于通过新生儿筛查或同胞筛查(sibling screening)诊断的参与者)或加2个标准差(对于通过临床评价诊断的参与者)。
[0358]
·
患者的父母或一名或多名法定授权代表能够提供已签署的知情同意书。
[0359]
研究的排除标准如下:
[0360]
·
患者在加入时具有呼吸功能不全的症状,或任何通气使用(有创或无创)。
[0361]
·
患者患有严重先天性异常。
[0362]
·
患者患有临床上显著的器质性疾病(与庞贝病相关的症状除外)。
[0363]
·
患者已经接受过使用来自任何来源的重组人酸性α葡糖苷酶(rhgaa)的酶替代疗法(ert)。
[0364]
·
患者先前在艾瓦葡糖苷酶α的任何临床试验中进行过治疗。
[0365]
·
研究者不论出于任何原因(包括医疗或临床状况)判断患者不适合参与,或者患者可能具有不依从研究程序的风险。
[0366]
主要关键终点和主要的次要关键终点
[0367]
研究的主要终点是在第52周时存活并且不使用有创通气的患者的比例。
[0368]
研究的次要终点包括在第52周的以下评价:在12月龄和18月年龄时存活并且不使用有创通气的患者的比例;在第52周时存活的参与者的比例;在12月龄和18月龄时存活的患者的比例;以及在第52周时没有使用呼吸机且没有使用补充供氧的患者的比例。
[0369]
次要终点还包括在第52周的以下评价:治疗期间出现的不良事件(teae,包括输注相关反应)的评估;身体检查;临床实验室评价;生命体征测量;12导联心电图(ecg);以及免疫原性评估。
[0370]
其他次要终点包括以下参数从基线至第52周的变化:左心室质量(lmv)z得分、阿尔伯塔婴儿运动量表(aims)得分、身体生长z得分、尿液hex4、以及身长、体重和头围百分位数。
[0371]
另外,在第1天、第12周和第52周时评估酸性α葡糖苷酶(gaa)的血浆浓度。
[0372]
研究期的持续时间
[0373]
患者在初步分析期内被治疗52周,并且在随后的52周研究延长治疗期内继续接受治疗。在此之后进行长达104周的延长的长期治疗期加上4周随访期,研究总持续时间长达4.08年。该持续时间可随国家而变,但持续直至艾瓦葡糖苷酶α在患者所在国家被批准为止或长达4.08年,以先发生者为准。
[0374]
艾瓦葡糖苷酶α配制品
[0375]
将艾瓦葡糖苷酶α配制为无菌冻干粉末。在通过iv输注施用之前将其重构。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。