1.本发明涉及指引刮取操作有关,尤其涉及一种用于检体玻片的刮取指引系统及其方法。
背景技术:
2.于现有的刮取检体的方法中,多是由专业临床人员阅览检体的实体玻片后,以人工判断需要刮取的区域,再进行刮取操作。
3.前述人工判断刮取区域的方法,其正确性与效率完全仰赖临床人员的专业度,但如此作法并无法确保不同临床人员的判读标准或圈选做法一致,进而导致检体品质参差不齐。
4.是以,现有刮取检体存在上述问题,而亟待更有效的方案被提出。
技术实现要素:
5.本发明的主要目的,在于提供一种指引检体玻片的刮取系统与刮取方法,可产生并输出用来辅助刮取检体的刮取指引。
6.于一实施例中,一种用于检体玻片的刮取指引方法,包括:一显示步骤,包括于一互动界面显示一检体的一电子图像,其中该电子图像上标记一第一参数值的一第一分析结果;一变更步骤,包括于接受参数值变更操作时,显示使用所变更的一第二参数值的一第二分析结果进行标记的该电子图像,其中该第一分析结果与该第二分析结果是以不同平滑度来表示目标细胞的分布;一分割步骤,包括将该电子图像与一区域分割图进行叠合,以将该电子图像分割为多个子区域,其中该区域分割图的一输出尺寸是对应该检体的一实体玻片的尺寸;一选择步骤,包括基于分析结果选择至少一部分的该子区域;及,一指引步骤,包括于该区域分割中对所选择的该子区域进行标记以产生一刮取指引,并基于该输出尺寸对该刮取指引进行输出,其中于输出的该刮取指引与该实体玻片迭合后,该刮取指引中的标记对该实体玻片起到标记效果。
7.于一实施例中,一种用于检体玻片的刮取指引系统,包括:一图像库,用以存储一检体的一电子图像;及,一平台端,连接所述图像库,该平台端用以经由网络与一用户端建立网络连线,并提供一互动界面至该用户端,该平台端被配置来于该互动界面显示使用一第一参数值的一第一分析结果进行标记的该电子图像,并于经由该互动界面接受一参数值变更操作时,于该互动界面显示使用所变更的一第二参数值的一第二分析结果进行标记的该电子图像,该平台端被配置来于该互动界面叠合该电子图像与一区域分割图,以将该电子图像分割为多个子区域,该区域分割图的一输出尺寸是对应该检体的一实体玻片的尺寸,该平台端被配置来基于分析结果选择至少一部分的该子区域,于该区域分割图中对所选择的该子区域进行标记以产生一刮取指引,并基于该输出尺寸对该刮取指引进行输出,其中于输出的该刮取指引与该实体玻片叠合后,该刮取指引中的标记对该实体玻片起到标记效果。
8.通过叠合本发明所输出的刮取指引与实体玻片,可对实体玻片起到标记效果,可以辅助用户有效率地执行检体刮取,并提升检体刮取标准的一致性。
附图说明
9.图1为目前的检体的刮取与检验程序;
10.图2为本发明的一实施例的刮取指引系统的架构图;
11.图3为本发明的一实施例的平台端的处理模块的架构图;
12.图4为本发明的一实施例的刮取指引方法的流程图;
13.图5为本发明的一实施例的变更参数值的流程图;
14.图6为本发明的一实施例的选择子区域的流程图;
15.图7为本发明的一实施例的校准输出尺寸的流程图;
16.图8为本发明的一实施例的产生分析结果的流程图;
17.图9为本发明的一实施例的目标识别与分析的流程图;
18.图10为本发明的一实施例的细胞识别与分析的流程图;
19.图11为本发明的一实施例的生成参数值的分析结果的流程图;
20.图12为本发明的一实施例的选择子区域的界面示意图;
21.图13为本发明的一实施例的标记子区域的界面示意图;
22.图14为本发明的一实施例的刮取指引的使用示意图;
23.图15为本发明的一实施例的基于第一参数值标记电子图像的示意图;
24.图16为本发明的一实施例的基于第二参数值标记电子图像的示意图;
25.图17为本发明的一实施例的刻度量测的示意图;
26.图18为基于图17的校准输出尺寸的示意图;
27.图19为基于图18所产生的刮取指引的示意图。
28.附图标号说明
29.1:平台端
30.10:处理模块
31.100:web模块
32.101:互动控制模块
33.102:输出控制模块
34.11:存储模块
35.110:存储阵列
36.12:通讯模块
37.13:人机界面
38.2:用户端
39.20:处理器
40.21:输入装置
41.22:显示器
42.220:电子刮取指引
43.23:网络装置
44.24:打印装置
45.25:存储装置
46.3:识别与分析模块
47.30:学习模型
48.31:算法模块
49.4:数据库
50.40:图像库
51.41:结果库
52.50:实体刮取指引
53.51:实体玻片
54.60:参数值变换模块
55.61:分割模块
56.62:手动选择模块
57.63:自动选择模块
58.630:纯度计算模块
59.631:外接计算模块
60.632:推荐区域决策模块
61.633:区域限缩模块
62.64:渲染模块
63.65:指引产生模块
64.66:图像调整模块
65.70-71、80-81:群集
66.72、82:网格区域
67.s10-s15:产生刮取指引步骤
68.s20-s24:变更参数值步骤
69.s30-s32:手动选择步骤
70.s40-s47:自动选择步骤
71.s50-s54:校准输出尺寸步骤
72.s60-s64:产生分析结果步骤
73.s70-s72:目标识别与分析步骤
74.s80-s73:细胞识别与分析步骤
75.s90-93:分析与滤波步骤
具体实施方式
76.兹就本发明的一较佳实施方式,配合附图,详细说明如后。
77.请参阅图1,为目前的检体的刮取与检验程序。目前有一种电脑辅助的检体刮取的方法,可以辅助临床人员识别需要刮取的检体位置。
78.具体而言,取得检体(如手术切下的病变组织或其他待检测组织)后,检体被切割为多个薄切片,并以多个实体玻片作为载体。这些实体玻片上的检体的薄切片,由于是取自
相同组织位置,通常具有相同或相似的外观与细胞组成。
79.并且,这些实体玻片的其中之一会被用来扫描成电子图像,即检体的薄切片的电子图像。通过电脑对电子图像执行特征分析,可以产生分析结果,如病变组织于电子图像中的位置。
80.接着,临床人员可看着电脑屏幕显示的分析结果,在剩余的实体玻片上对目标细胞(如肿瘤细胞或其他病变细胞)进行人工标记,以标记要刮取的位置。
81.最后,临床人员对人工标记的位置进行刮取,并将刮取取下来的组织送交专门的检验单位进行检验分析,如次世代定序(next generation sequencing,ngs)。
82.然而,当临床人员看着电脑屏幕来对实体玻片进行人工标记,由于虚实之间的落差,临床人员很难准确地圈选出正确的位置,而容易造成标记误差。
83.此外,上述电脑辅助的检体刮取的方法只能显示一组预设标准(扩增固定肿瘤边界)的分析结果,并无法提供不同预设标准的分析结果供临床人员比较或选择,而无法符合临床的变化需求。
84.此外,由于实体玻片制作容易受到切割或捞片影响(刀痕、组织龟裂或位置偏移等),即便是两片位置相邻的组织玻片在形状与特征上也未必相同,这使得电脑屏幕显示的分析结果可能无法与实体玻片完全对应,而无法准确进行比对,即特征分析用的实体玻片的检体与刮取用的实体玻片的检体可能存在型态差异。
85.为解决上述问题,本发明提出一种检体玻片的刮取指引系统与刮取指引方法,可以自动建议刮取区域,并产生刮取指引。并且,当用户(如临床人员)将输出的刮取指引与实体玻片叠合后,刮取指引可以明确地标示出适合刮取的位置。
86.此外,本发明的刮取指引系统与刮取指引方法,还可供临床人员快速切换不同严谨度(参数值)的不同分析结果,藉以选择适合目前分析结果的刮取区域。
87.请一并参阅图2,为本发明的一实施例的刮取指引系统的架构图。本发明的刮取指引系统主要包括通过网络(如网际网络或区域网络)连接的平台端1与用户端2。
88.平台端1(如伺服器或云端服务平台等可提供网络服务的电脑设备)用来架设网站(web服务),并通过网站提供电子图像与其刮取指引的服务。
89.用户端2(如台式电脑、笔记本电脑、平板电脑等,可由用户操作的电脑设备)用来通过网络连接平台端1,以供用户可通过操作网页来对指定的检体的电子图像执行刮取指引(电子刮取指引220)的生成与编辑。
90.并且,用户可操作用户端2来输出电子刮取指引220以获得实体刮取指引50(如纸本),将实体刮取指引50与检体的实体玻片51进行叠合。
91.藉此,实体刮取指引50可对实体玻片51起到标记作用,而使用户可依据标记来对实体玻片51进行检体的刮取。
92.值得一提的是,前述电子刮取指引220与实体刮取指引50是虚实对应,即实体刮取指引50是实体化的电子刮取指引220。本发明通过将实体化刮取指引,可以排除虚实之间的落差,而提升标记的效率与正确性。
93.于一实施例中,平台端1可包括存储模块11、通讯模块12、人机界面13与电性连接上述元件的处理模块10。
94.存储模块11(如ram、eeprom、固态硬盘、磁盘硬盘、快闪存储器等存储装置或其任
意组合)用以存储数据。通讯模块12(如网络界面卡,nic)用以连接网络(如网际网络),并通过网络与外部设备(如用户端2、数据库4和/或识别与分析模块3)通讯。人机界面13(包括输入界面与输出界面,如鼠标、键盘、各式按键、触控板、显示器、触控屏幕、投影模块等)用以供平台端1的操作者(如网管人员)进行互动。处理模块10(可为cpu、gpu、tpu、mcu等处理器或其任意组合),用以控制平台端1并实现本发明所提出的功能。
95.于一实施例中,处理模块10可包括web模块100、互动控制模块101和/或输出控制模块102。
96.web模块100(如网站伺服器端模块)被设定来提供网页服务,以通过网页协定(如http或https)与用户端2连接。
97.于一实施例中,web模块100可对用户端2进行验证(如帐号密码验证,一次性密码验证、绑定硬件验证等),并于用户端2通过验证后才允许使用服务。
98.互动控制模块101,被设定来产生于用户端2中所显示的网页中的互动界面(可为图形使用者界面(gui),如图12至图19所示界面),并通过此互动界面接收用户端2的操作与显示信息给用户。
99.输出控制模块102,被设定来传送所产生(编辑完成)的刮取指引至用户端2。
100.于一实施例中,用户端2可包括输入装置21、显示器22、网络装置23、打印装置24、存储装置25与电性连接上述装置的处理器20。
101.输入装置21(如鼠标、键盘、触控板等)用以供用户输入数据或操作。显示器22(如液晶显示器、投影机、触控屏幕等)用以显示信息(如显示网页与所产生的电子刮取指引220)。网络装置23(如网络界面卡,nic)用以连接网络(如网际网络),并通过网络与外部设备(如平台端1)通讯。打印装置24(如印表机)用以打印电子刮取指引220为实体刮取指引50,如打印于纸本或薄透明板,或直接打印于实体玻片51上等,不加以限定。存储装置25(如ram、eeprom、固态硬盘、磁盘硬盘、快闪存储器等存储装置或其任意组合)用以存储数据。处理器20(如cpu、gpu、tpu、mcu等处理器或其任意组合),用以控制用户端2。
102.于一实施例中,平台端1可信息连接(如通过网络连接或通过本机线路连接)识别与分析模块3。识别与分析模块3可建置于伺服器或云端服务平台(如amazon web service、google cloud platform或microsoft azure等),并用来对电子图像进行目标识别与分析(容后详述)。
103.于一实施例中,识别与分析模块3可直接内建于平台端1。
104.于一实施例中,识别与分析模块3可基于人工智能(ai,artificial intelligence)执行图像自动识别与分析,并包括学习模型30与算法模块31。
105.学习模型30(如分类器)可被设定来基于机器学习执行图像分类(如细胞的图像分类)。
106.算法模块31被设定来使用学习模型30识别细胞(如非目标细胞与目标细胞),并可计算各目标细胞所在位置的细胞数量。
107.于一实施例中,平台端1可信息连接(如通过网络)用以存储大量数据的数据库4(例如是网络数据库、本地数据库、关联式数据库等数据库或其组合)。
108.于一实施例中,平台端1可包括图像库40,图像库40可存储多个检体的多个电子图像。
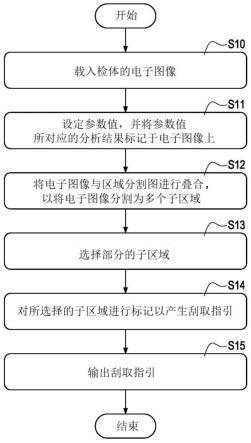
109.一实施例中,平台端1可包括结果库41。结果库41可存储各检体的电子图像的分析结果(如后述的结果存储阵列110)。
110.请一并参阅图3,为本发明的一实施例的平台端的处理模块的架构图。处理模块10可包括模块60-66,自动选择模块63可包括模块630-633。
111.这些模块60-66、630-633、图2的模块100-102、与识别与分析模块3分别被设定来执行不同的功能(容后详述)。
112.前述模块是相互连接(可为电性连接与信息连接),并可为硬件模块(例如是电子电路模块、集成电路模块、soc等等)、软件模块(例如是固件、作业系统或应用程序)或软硬件模块混搭,不加以限定。
113.值得一提的是,当前述模块为软件模块(例如是固件、作业系统或应用程序)时,平台端1的存储模块11可包括非暂态电脑可读取记录媒体,前述非暂态电脑可读取记录媒体存储有电脑程序,电脑程序记录有电脑可执行的程序码,当处理模块10执行前述程序码后,可实现对应模块的功能。
114.请一并参阅图4,为本发明的一实施例的刮取指引方法的流程图。本发明各实施例的刮取指引方法可通过图2-图3所示的刮取指引系统来加以实现。
115.于本实施例的刮取指引方法中,平台端1可通过网络与web模块100提供web服务给用户端2。用户端2可向平台端1发出服务使用请求并进行身分验证,并于通过验证后登入网页(亦可不验证),并显示平台端1通过互动控制模块101提供的互动界面。
116.步骤s10:平台端1可于互动界面上显示检体的电子图像。于一实施例中,用户端2可通过互动界面选择指定的检体的电子图像,平台端1则自图像库40载入所指定的电子图像(如苏木精与伊红(h&e)染色玻片图像)。
117.步骤s11:平台端1可设定参数值(可为系统预设或由用户端2设定),取得参数值的分析结果,并通过渲染模块64将分析结果标记在电子图像上。
118.于一实施例中,结果库41可预先存储同一电子图像(同一检体)使用不同参数值的不同分析结果,并依据当前设定的参数值读取对应的分析结果。
119.于一实施例中,不同参数值表示不同的严谨度或平滑度(容后详述),不同参数值的不同分析结果是以不同平滑度来表示目标细胞的分布状态。
120.于一实施例中,不同参数值的不同分析结果是分别对应不同严谨度的标记。
121.于一实施例中,平台端1可于载入电子图像后即时产生不同参数值的不同分析结果,并依据用户所设定的参数值,呈现对应的分析结果于电子图像。
122.于一实施例中,用户端2可即时切换不同的参数值(如自第一参数值切换至第二参数值),来使平台端2即时于电子图像上呈现不同的分析结果(如自第一分析结果变换至第二分析结果)。
123.步骤s12:平台端1可通过分割模块61叠合电子图像与区域分割图,来将电子图像分割为多个子区域。前述区域分割图的输出尺寸是对应检体的实体玻片的尺寸(如相同或固定比例)。
124.步骤s13:平台端1可通过自动选择模块63来基于分析结果自动选择至少一部分的子区域(如选择一部分或选择全部,不加以限定),如目标细胞所在或容易刮取的子区域。
125.于一实施例中,平台端1可通过手动选择模块62来供用户端2手动选择子区域。
126.于一实施例中,平台端1可通过渲染模块64来即时于互动界面中呈现被选择的子区域。
127.步骤s14:平台端1可通过指引产生模块65于区域分割图中对所选择的子区域进行标记来产生刮取指引(电子刮取指引220)。
128.于一实施例中,平台端1可通过渲染模块64来即时于互动界面中呈现所产生的电子刮取指引220。
129.步骤s15:平台端1通过输出控制模块102输出具有指定输出尺寸的刮取指引至用户端2。
130.于一实施例中,平台端1可要求用户端2允许控制打印装置24来打印所产生的刮取指引为纸本。
131.于一实施例中,用户端2可主动打印出具有指定输出尺寸的刮取指引(实体刮取指引50)。并且,所印出的刮取指引与实体玻片51叠合后,刮取指引中的标记对实体玻片51的建议刮取位置起到标记效果。
132.藉此,通过叠合本发明所输出的刮取指引与实体玻片,可对实体玻片起到标记效果,而可以辅助用户有效率地执行检体刮取。
133.请一并参阅图12至图14,图12为本发明的一实施例的选择子区域的界面示意图。图13为本发明的一实施例的标记子区域的界面示意图,图14为本发明的一实施例的刮取指引的使用示意图。图12至图14用以示例性说明本发明的一种具体实施方式。
134.于本例子中,如图12、13所示,区域分割图包括多条格线,重叠电子图像的多条格线将电子图像的检体图像分割为多个网格区域,以作为多个子区域。
135.平台端1可于互动界面中,将目前的参数值的分析结果呈现在电子图像上,以于电子图像上显示目标细胞的圈选标记(如对目标细胞所在位置进行圈选)。前述圈选标记的平滑度是随参数值改变。
136.此外,平台端1可于互动界面中显示分为多个子区域的电子图像,并自动选择建议刮取(如目标细胞的纯度较高)的子区域,如多个网格区域的群集70、71。
137.于一实施例中,平台端1还可依据各网格区域的目标细胞的纯度(如肿瘤细胞纯度,tumor cell purity,tcp)执行不同颜色或图案的标记,如纯度越高的网格区域颜色越深。
138.于一实施例中,平台端1还可于互动界面显示不建议刮取(如目标细胞的纯度过低)的子区域,如网格区域72。
139.此外,用户端2可手动对网格区域进行选择或取消选择,来改变群集70、71的范围
140.如图13所示,于选择完成后,用户端2可请求产生电子刮取指引。本例子的刮取指引是以线条标记(或如图19所示,以色块标记)要对检体进行刮取的位置。
141.接着,如图14所示,电子刮取指引经过打印为实体刮取指引后,可用来与实体玻片叠合,而使得实体刮取指引上的标记(如群集70、71的范围标记与网格区域72的范围标记)可以明确对实体玻片中的检体切片起到标记效果,而使用户可以正确且有效率的进行刮取操作。
142.请一并参阅图5,为本发明的一实施例的变更参数值的流程图。相较于图4的刮取指引方法,本实施例的刮取指引方法进一步提供由步骤s20-s24所实现的参数值变更功能。
143.步骤s20:平台端1切换至参数值设定模式。于一实施例中,平台端1可于载入电子图像(步骤s10)后即切换至参数值设定模式,以供用户端2设定适合的参数值。
144.步骤s21:平台端1通过参数值变换模块60识别目前设定的参数值(如第一参数值),并获取目前的参数值的的分析结果(如第一分析结果)。
145.于一实施例中,平台端1可取得电子图像的检体图像的各图像位置的目标细胞(如肿瘤细胞等病变细胞)的数量或纯度,前述信息可预先分析完成并存储于结果库41(如通过后述的步骤s60-s64)。接着,平台端1依据所有参数值,计算不同严谨度的目标细胞分布位置,并将这些计算后的位置加入至对应参数值的分析结果,以供后续用户选择时呈现。
146.更进一步地,前述不同参数值分别对应不同严谨度。本发明主要是基于不同参数值计算出具有不同的平滑度的目标细胞的分布标记。当平滑度越高,表示目标细胞认定范围越广,即认定目标细胞的严谨程度越低;当平滑度越低,表示目标细胞认定范围越窄,即认定目标细胞的严谨程度越高。藉此,本发明可提供用户取得不同严谨程度下所辨识的目标细胞的分布。
147.步骤s22:平台端1通过渲染模块64将目前的参数值的分析结果标记于电子图像上,如于电子图像中呈现分析结果,以使用具有对应的平滑度的标记来圈出目标细胞分布位置的图像位置(如图12所示的目标细胞的图像位置)。
148.步骤s23:平台端1通过参数值变换模块60检测是否通过互动界面接受用户端2的参数值变更操作。
149.若用户端2变更参数值,则识别变换后的新的参数值(如第二参数值),再次执行步骤s21-s22,以获取新的参数值的分析结果(如第二分析结果),并使用新的分析结果对电子图像进行标记。
150.若用户端2未变更参数值或已决定最终参数值则执行步骤s24:平台端1判断是否离开参数值设定模式,如用户是否确定不再变更参数值。
151.若不离开参数值设定模式,则再次执行步骤s23以再次检测。否则,继续执行方法的其他步骤。
152.藉此,本发明可提供不同严谨度的分析结果,即具有不同平滑度的标记,而可满足临床上的不同严谨度需求。
153.请一并参阅图11,为生成参数值的分析结果的流程图。相较于图4与图5的刮取指引方法,本实施例的刮取指引方法进一步提供由步骤s90-s93所实现的不同严谨度的目标细胞的分析结果。
154.于本实施例中,是以不同参数值表示不同严谨度,并依据不同参数值控制滤波保留的图像细节程度。
155.步骤s90:平台端1读取所有可能的参数值。如事先指定多个严谨度等级,并将多个严谨度等级分别对应至多个参数值)。举例来说,参数值50对应到较低的严谨度;参数值70对应到较高的严谨度。
156.步骤s91:平台端1依据不同参数值计算对应的滤波遮罩。不同参数值所对应的不同滤波遮罩是分别具有不同的滤波能力,如用来滤除不同频率范围的信号。
157.步骤s92:平台端1使用不同参数值的不同滤波遮罩来分别对图像频域执行滤波处理,以获得不同滤波遮罩的不同滤波结果。
158.于一实施例中,平台端1是先将电子图像自空间域转换至频域(如通过傅立叶转换、快速傅立叶转换等),再执行前述滤波处理。
159.于一实施例中,前述滤波遮罩是低通滤波遮罩,各滤波遮罩是用来于滤波处理中过滤不同频率范围的高频信号。如较广的低通滤波遮罩会过滤较多的高频信号(严谨度较低),较窄的低通滤波遮罩会保留较多的高频信号(严谨度较高)。
160.步骤s93:经过滤波处理,平台端1可获得不同参数值(不同滤波遮罩)下的目标细胞的图像位置,来作为此参数值的分析结果,并存储至数据库4。
161.藉此,本发明可产生不同的严谨度的分析结果。
162.请一并参阅图15至图16,图15为本发明的一实施例的基于第一参数值标记电子图像的示意图,图16为本发明的一实施例的基于第二参数值标记电子图像的示意图。
163.本例子中,目标细胞为活体肿瘤细胞(variable cancer cell,vcc)。于本例子中,参数值表示呈现vcc的严谨度,且参数值是与严谨度成正比。即参数值越高,严谨度越高(标记边界越精细,而不易圈选);参数值越低,严谨度越低(标记边界越平滑,而容易圈选),但不以此限定。
164.于另一例子中,参数值可被设定为与严谨度成反比。即参数值越高,严谨度越低;参数值越低,严谨度越高。
165.值得一提的是,本发明可基于不同参数值来控制滤波处理(如图11所示步骤)中标记细节的保留程度,以提供不同的严谨度。
166.图15中,参数值为70,即设定较高的严谨度。于此设定下,滤波处理会保留较多的高频信号(即细节部分),产生较细致的vcc的图像位置的标示,进而提供严谨度较高的vcc位置的检测结果。
167.图16中,参数值为50,即设定较低的严谨度。于此设定下,滤波处理会保留较少的高频信号,产生较粗略的vcc的图像位置的标示,进而提供严谨度较低的vcc位置的检测结果。
168.藉此,本发明可供用户依据不同严谨度需求设定不同的参数值,并即时阅览对应的分析结果,而可以提供不同标准的分析结果供临床人员比较或选择,以避免无法符合临床的变化需求。
169.图6为本发明的一实施例的选择子区域的流程图。相较于图4的刮取指引方法,本实施例的刮取指引方法于步骤s13中,进一步提供由步骤s30-s32所实现的手动选择模式与步骤s40-s47所实现的自动选择模式。
170.手动选择模式包括以下步骤:
171.步骤s30:平台端1通过手动选择模块62与互动界面接受用户端2的子区域选择操作,前述子区域选择操作是选择或取消选择至少一子区域。
172.步骤s31:平台端1通过手动选择模块62将步骤s30中所选择的子区域的状态变更为已选择、未选择或不刮取。
173.于一实施例中,当子区域被第一次选择时,其状态自未选择变更为已选择;当子区域被第二次选择时,其状态自已选择变更为未选择。
174.于一实施例中,用户端2可直接设定部分子区域的状态为不刮取(如目标细胞的纯度较低的区域或不容易刮取的区域),以避免后续误刮取此区域。
175.步骤s32:平台端1通过渲染模块64即时于互动界面呈现所有子区域的变更后的状态。
176.自动选择模式包括以下步骤。
177.步骤s40:平台端1通过纯度计算模块630取得电子图像的各子区域的纯度,并挑选出纯度大于预设纯度(如30%、50%或70%)的子区域。
178.步骤s41:平台端1通过外接计算模块631于所选择的多个子区域中,将相邻的多个子区域群集设定为范围较广的候选区域。
179.于一实施例中,平台端1可产生多个子区域的最小外接矩形区域当作候选区域。
180.值得一提的是,由于单一子区域的面积过小,不容易刮取。本发明通过群集多个相邻且适合刮取的子区域为较大的建议范围,可有效提升刮取操作的正确性与效率。
181.步骤s42:平台端1通过推荐区域决策模块632逐一判断各候选区域是否符合预设条件。
182.于一实施例中,前述预设条件可包括候选区域的纯度不小于预设纯度(如30%、50%或70%等)。
183.于一实施例中,前述预设条件可包括候选区域的目标细胞的数量不小于预设数量(如5000、10000、15000、20000等)。
184.若有任一候选区域符合预设条件,则对此符合的候选区域执行步骤s43:平台端1通过推荐区域决策模块632将符合的候选区域设定为推荐区域。
185.若有任一候选区域不符合预设条件,则对此不符合的候选区域执行步骤s44:平台端1通过区域限缩模块633缩减候选区域的范围(如排除一或多个子区域),以使缩减后的候选区域符合预设条件并被设定为推荐区域。
186.于一实施例中,平台端1可通过区域限缩模块633计算对此不符合的候选区域的每一边的目标细胞的纯度,并排除纯度最低的一边的子区域,藉以提升缩减后的候选区域的整体纯度。
187.于一实施例中,平台端1可直接将不符合的候选区域设定为非推荐区域,或者于不符合的候选区域已缩减为空白区域后,将其设定为非推荐区域。
188.步骤s45:平台端1判断是否有任一推荐区域产生。
189.若有任一推荐区域产生,则执行步骤s46:平台端1通过渲染模块64于互动界面的电子图像中呈现推荐区域。
190.若没有任一推荐区域产生,则可直接发出无推荐区域的警示,或执行步骤s47:平台端1通过渲染模块64于互动界面的电子图像中呈现涵盖目标细胞的子区域,以作为用户端2手动选择的参考。
191.于一实施例中,平台端1可进一步通过渲染模块64于互动界面的电子图像中呈现所有子区域,并提供各子区域的目标细胞数量与非目标细胞数量。
192.请一并参阅图7、图17-图19,图7为本发明的一实施例的校准输出尺寸的流程图,图17为本发明的一实施例的刻度量测的示意图,图18为基于图17的校准输出尺寸的示意图,图19为基于图18所产生的刮取指引的示意图。
193.相较于图4的刮取指引方法,本实施例的刮取指引方法于输出刮取指引前,进一步提供由步骤s50-s54所实现的校准输出尺寸。
194.步骤s50:用户可先将实体玻片中的检体对准实体的区域分割图(于图17中为实体网格纸),并确认应对刻度(于图17中为(12,8)的长宽刻度)。
195.前述实体的区域分割图与前述用来分割电子图像的区域分割图具有相对应的尺寸。
196.步骤s51:平台端1通过图像调整模块66通过互动界面接受刻度输入操作,以取得输入刻度。
197.如图18上图所示,用户端2可将当前刻度(x,y)=(12,9)修改为步骤s51所量测的实际刻度(x,y)=(12,8),即输入刻度。
198.步骤s52:平台端1通过图像调整模块66调整电子图像的输出尺寸,以使电子图像的当前刻度符合输入刻度。
199.于一实施例中,平台端1是对电子图像与刮取指引进行等比例缩放,以使缩放后的电子图像与刮取指引的输出尺寸符合输入刻度。
200.如图18下图所示,由于电子图像被缩放,刮取指引的群集70-71与网格区域72的范围与位置也会随之缩放与移动,而变更为群集80-81与网格区域82。
201.步骤s53:平台端1通过指引产生模块65输出调整后的刮取指引,此刮取指引的输出尺寸已于步骤s52中被一并调整。
202.接着,用户端2可基于调整后的输出尺寸打印调整后的刮取指引。藉此,所印出的刮取指引可以符合实体玻片的检体的尺寸。
203.如图19所示,由于等比例缩放,调整后的刮取指引(带有色块标记的实体网格纸)的群集80-81与网格区域82将可能不会对齐格线,但却更符合实体玻片的尺寸。
204.步骤s54:平台端1可将所印出的带有标记的刮取指引与实体玻片与待刮取的实体玻片对齐,并依标示进行刮取。
205.藉此,本发明可弥补特征分析用的实体玻片的检体与刮取用的实体玻片的检体之间的型态差异,而提升刮取操作的正确性。
206.请一并参阅图8,为本发明的一实施例的产生分析结果的流程图。相较于图4的刮取指引方法,本实施例的刮取指引方法进一步提供由步骤s60-s64所实现的分析结果计算功能。前述分析结果计算功能可计算指定的电子图像的详细分析结果,以供作为选择子区域,提供步骤s21的数据获取来源。
207.步骤s60:平台端1通过识别与分析模块3于存储模块11中建立目前选择的电子图像的结果存储阵列110。
208.步骤s61:平台端1通过识别与分析模块3逐一读取电子图像的各子图像(区域图像),并对各子图像执行步骤s62-63,直到对整张电子图像完成处理。
209.值得一提的是由于电子图像的解析度相当高,必须要极高规格的硬件设备才能同时对整张电子图像执行识别与分析处理,本发明通过对子图像分批执行处理,可有效降低对于硬件规格的需求。
210.步骤s62:平台端1通过识别与分析模块3对各子图像执行目标识别与分析,以识别各子图像中目标细胞的数量,作为子图像的分析结果。
211.于一实施例中,识别与分析模块3可使用基于机器学习(如基于目标细胞的图像特征训练而成)的分类器(如学习模型30)于子图像中识别各目标细胞。
212.于一实施例中,识别与分析模块3可使用学习模型30执行模型预测,来计算每个位置的目标细胞数量,并可搭配算法模块31的预测算法(如卷积网络)所预测目标细胞位置与frst算法所产生的细胞核位置,藉以计算每个子区域中的目标细胞数值。
213.步骤s63:平台端1将各子图像的分析结果存储至结果存储阵列110的对应存储器位置。当所有子图像完成分析后,即可获得此电子图像的结果存储阵列110,结果存储阵列110记录有各图像位置的目标细胞相关信息。
214.于一实施例中,完成的结果存储阵列110可被存储于结果库41中。
215.步骤s64:平台端1基于结果存储阵列110取得所有电子图像中目标细胞的位置,并进行存储,如存储于结果库41。
216.藉此,本发明可产生电子图像的详尽分析信息,而可作为后续选择刮取区域的参考。
217.请一并参阅图9,为本发明的一实施例的目标识别与分析的流程图。相较于前述的刮取指引方法,本实施例的刮取指引方法进一步提供由步骤s70-s72所实现的目标细胞的分析功能。
218.步骤s70:平台端1通过识别与分析模块3取得所有细胞的位置,并取得所有目标细胞的位置,如通过ai自动识别。
219.步骤s71:平台端1通过识别与分析模块3计算各目标细胞所在位置的细胞数量,以计算各图像位置的纯度。
220.步骤s72:平台端1计算各子区域的目标细胞与非目标细胞的数量。
221.藉此,本发明可计算各图像位置的目标细胞纯度与数量。
222.请一并参阅图10,为本发明的一实施例的细胞识别与分析的流程图。相较于前述的刮取指引方法,本实施例的刮取指引方法进一步提供由步骤s80-s83所实现的目标细胞的定位功能。
223.步骤s80:平台端1读取颜色转换矩阵。前述颜色转换矩阵是基于所要识别的目标细胞的类型与所采用的染色法来加以决定,如对于肿瘤细胞可采用苏木精与伊红(h&e)染色转换矩阵。
224.步骤s81:平台端1使用颜色转换矩阵拆解各子图像为不同色的多个染色图像通道。
225.于一实施例中,当目标细胞为肿瘤细胞,电子图像为苏木精-伊红染色的病理图像时,可使用颜色转换矩阵拆解rgb图像(电子图像)为苏木精染色通道图像与伊红染色通道图像。
226.步骤s82:平台端1对各染色图像通道图像执行识别处理,以识别各染色图像通道图像所对应的细胞类型的细胞位置图像。
227.于一实施例中,平台端1可在苏木精染色通道图像用frst算法检测细胞位置图像。
228.值得一提的是,染料苏木精可以将嗜碱性结构染成蓝紫色,嗜碱性结构通常包括含有核酸的部分,染色主要将细胞核染色成蓝紫色;而伊红可以将嗜酸性结构染成粉红色,嗜酸性结构则通常由细胞内及细胞间的蛋白质构成。
229.步骤s83:平台端1转换各细胞位置图像为细胞坐标(如图像坐标),并存储细胞坐标并存于前述结果存储阵列110中。
230.藉此,本发明可有效识别各细胞的具体位置。
231.以上所述仅为本发明的较佳具体实例,非因此即局限本发明的权利要求范围,故举凡运用本发明内容所为的等效变化,均同理皆包含于本发明的范围内,合予陈明。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
