通过施用pd-1抑制剂抗体西米普利单抗来治疗宫颈癌的方法
技术领域
1.本公开内容一般地涉及治疗或抑制肿瘤生长或提高宫颈癌患者的总存活的方法,包括选择有此需要的患有宫颈癌的患者并向所述患者施用治疗有效量的程序性死亡1(programmed death 1,pd-1)抑制剂。
背景技术:
2.宫颈癌是全世界女性第四大最常诊断的癌症和第四大癌症死亡原因,每年约有570,000例病例,并且2018年约有311,000例相关死亡。(bray et al.,ca cancer j clin,68(2018)394-424)。大约95%的宫颈癌源于具有人乳头状瘤病毒(hpv)的慢性感染。(burk et al.,nature 543(2017)378-384)。大约80%的宫颈癌被归类为鳞状细胞癌(来自宫颈底部的细胞),而其余大部分是腺癌(来自宫颈上部的腺细胞)。虽然针对hpv高危株的疫苗接种预计将在未来15年内逐渐降低宫颈癌的全球发病率,但这种疾病的负担仍然很重(bray et al.,lancet oncol,2012;13:790-801)。
3.宫颈癌在早期检测到和有效管理时通常是可以治愈的,但在晚期阶段治疗选择更为有限。在美国,大约三分之一的患有宫颈癌的患者会经历复发性或转移性疾病,并接受化学治疗作为一线治疗。然而,这些患者中至少有三分之二最终会因疾病进展、毒性或死亡而停止一线化学治疗。
4.对于患有局部晚期疾病的患者,治愈意图的治疗是同时使用顺铂的根治性放射治疗。患有有复发性或转移性疾病的患者在需要时通过与贝伐单抗组合的化学治疗进行治疗。(marth et al.,ann oncol,28(2017)iv72-iv83)。接受顺铂、紫杉醇和贝伐单抗的组合的这些患者的一线治疗与接受仅顺铂和紫杉醇的组合相比,总存活提高(os,17.0个月与13.3个月)且响应率更高(48%与36%)(tewari et al.,n engl j med,370(2014)734-743)。然而,在针对复发性或转移性疾病接受基于铂-紫杉烷的一线化学治疗之后进展后,尚无标准护理。因此,一旦患者在这些方案中出现肿瘤进展,治疗选择就会受到限制,并且在二线或更高的设定(higher setting)中,中位生存期仅为约7个月。(marth et al.,ann oncol 28(2017)iv72-iv83;lorusso et al.,ann oncol 21(2010)61-66;miller et al.,gynecol oncol 110(2008)65-70)。派姆单抗(pembrolizumab)获得了食品药品监督管理局(food and drug administration)的加速批准,用于治疗患有在化学治疗时或化学治疗之后有疾病进展的复发性或转移性宫颈癌的患者(其肿瘤根据客观响应率和响应持久性表达程序性死亡配体1。(lorusso et al.,ann oncol 21(2010)61-66)。然而,尚无药剂显示提高转移性宫颈癌一线化学治疗之后的总存活。在使用或不使用贝伐单抗的标准一线基于铂-紫杉烷的化学治疗时宫颈癌进展之后,需要为患有复发性或转移性宫颈癌的患者开发治疗选择。
5.免疫检查点程序性死亡配体-1(pd-l1)的表达是在肿瘤细胞和病毒感染细胞二者中观察到的免疫逃逸策略。使用肿瘤细胞和周围基质的免疫组织化学分析,已在大多数宫颈鳞状细胞癌中检测到pd-l1表达(heeren et al.,cancer immunol res 3(2015)48-58)。
然而,仍然需要安全有效的宫颈癌治疗。
技术实现要素:
6.在一方面中,所公开的技术涉及治疗或抑制肿瘤生长或提高宫颈癌患者总存活的方法,其包括:选择患有宫颈癌的患者;并向所述患者施用治疗有效量的程序性死亡1(pd-1)抑制剂。在一些实施方案中,宫颈癌选自鳞状细胞癌、腺癌和腺鳞癌。在一些实施方案中,宫颈癌是宫颈鳞状细胞癌。在一些实施方案中,宫颈癌是晚期的、复发性的、持续性的和/或转移性的。在一些实施方案中,宫颈癌是复发性的或转移性的。在一些实施方案中,患者在化学治疗时或化学治疗之后有疾病进展。在一些实施方案中,患者患有在化学治疗时或化学治疗之后有疾病进展的复发性或转移性宫颈癌。在某些实施方案中,患者患有宫颈癌伴鳞状细胞癌组织学。在某些实施方案中,患者患有这样的宫颈癌,对所述宫颈癌没有治愈意图的选择(例如,手术或放射治疗伴随或不伴随化学治疗)。在一些这样的实施方案中,患者不是治愈性手术或治愈性放射的候选者。在一些实施方案中,患者已经接受过先前的治疗,例如化学治疗(例如,紫杉醇)或抗vegf治疗(例如,贝伐单抗)。在一些这样的实施方案中,患者对先前的治疗具有抗性或难治性。在一些实施方案中,患者接受过先前的抗癌治疗,但由于疾病进展和/或毒性而中断。在一些实施方案中,先前的抗癌治疗(例如化学治疗或贝伐单抗)不适用于患有宫颈癌的患者。
7.在一些实施方案中,患者已经接受过先前的抗癌治疗。在一些实施方案中,患者对用抗癌治疗进行的先前的治疗有抗性,或宫颈癌在所述治疗之后进展。在一些实施方案中,先前的抗癌治疗包括化学治疗、手术、放射治疗和/或抗vegf治疗中的一种或更多种。在一些实施方案中,先前的抗癌治疗包括选自培美曲塞、拓扑替康、伊立替康、吉西他滨和长春瑞滨的基于铂的化学治疗。在一些实施方案中,宫颈癌表现出升高的pd-l1表达。在一些实施方案中,宫颈癌表现出升高的pd-l1蛋白表达。在一些实施方案中,宫颈癌表现出升高的pd-l1 mrna表达。在一些实施方案中,患者的人乳头状瘤病毒(hpv)测试呈阳性。在一些实施例中,患者的人乳头状瘤病毒(hpv)测试呈阴性。
8.在某些实施方案中,pd-1抑制剂作为单一治疗施用。在某些实施方案中,pd-1抑制剂的施用在患者中促进肿瘤消退、降低肿瘤细胞负荷、降低肿瘤负荷和/或预防肿瘤复发。在一些实施方案中,与用化学治疗进行治疗的患者相比,pd-1抑制剂的施用导致选自以下的至少一种改善:提高总存活、无进展存活、总响应率、完全响应、部分响应和稳定性疾病。在一些实施方案中,与用化学治疗进行治疗的患者相比,pd-1抑制剂的施用导致总存活提高。在一些实施方案中,无论肿瘤中的pd-l1表达如何,都会发生上述任何改善。
9.在某些实施方案中,pd-1抑制剂与第二治疗剂或治疗组合施用。在某些实施方案中,pd-1抑制剂选自:抗pd-1抗体或其抗原结合片段、抗pd-l1抗体或其抗原结合片段和抗pd-l2抗体或其抗原结合片段。在某些实施方案中,pd-1抑制剂选自抗pd-1抗体或其抗原结合片段。
10.在一些实施方案中,所述pd-1抑制剂是抗pd-1抗体或其抗原结合片段,其包含重链可变区(heavy chain variable region,hcvr)和轻链可变区(light chain variable region,lcvr),所述重链可变区包含三个重链互补决定区(complementarity determining region,cdr)(hcdr1、hcdr2和hcdr3),所述轻链可变区(lcvr)包含三个轻链cdr(lcdr1、
lcdr2和lcdr3),其中:hcdr1具有seq id no:3的氨基酸序列;hcdr2具有seq id no:4的氨基酸序列;hcdr3具有seq id no:5的氨基酸序列;lcdr1具有seq id no:6的氨基酸序列;lcdr2具有seq id no:7的氨基酸序列;并且lcdr3具有seq id no:8的氨基酸序列。在一些实施方案中,所述hcvr包含seq id no:1的氨基酸序列。在一些实施方案中,所述lcvr包含seq id no:2的氨基酸序列。在一些实施方案中,所述抗pd-1抗体或其抗原结合片段包含seq id no:1/2的hcvr/lcvr氨基酸序列对。在一些实施方案中,所述抗pd-1抗体包含重链和轻链,其中所述重链具有seq id no:9的氨基酸序列。在一些实施方案中,所述抗pd-1抗体包含重链和轻链,其中所述轻链具有seq idno:10的氨基酸序列。在一些实施方案中,所述抗pd-1抗体包含重链和轻链,其中所述重链具有seq id no:9的氨基酸序列并且所述轻链具有seq id no:10的氨基酸序列。在一些实施方案中,所述pd-1抑制剂是包含与seq id no:1具有90%、95%、97%或98%序列同一性的hcvr的抗pd-1抗体或其抗原结合片段。在一些实施方案中,所述pd-1抑制剂是包含与seq id no:2具有90%、95%、97%或98%序列同一性的lcvr的抗pd-1抗体或其抗原结合片段。在一些实施方案中,所述pd-1抑制剂是包含与seq id no:1具有90%、95%、97%或98%序列同一性的hcvr和与seq id no:2具有90%、95%、97%或98%序列同一性的lcvr的抗pd-1抗体或其抗原结合片段。在一些实施方案中,所述pd-1抑制剂是西米普利单抗(cemiplimab)或其生物等同物(bioequivalent)。
11.在一些实施方案中,pd-1抑制剂是选自以下的抗pd-1抗体:西米普利单抗、纳武单抗(nivolumab)、派姆单抗、匹地利珠单抗(pidilizumab)、medi0608、bi 754091、pf-06801591、斯巴达珠单抗(spartalizumab)、卡瑞利珠单抗(camrelizumab)、jnj-63723283和mcla-134。在另一些实施方案中,pd-1抑制剂是选自以下的抗pd-l1抗体:regn3504、阿维单抗(avelumab)、阿特珠单抗(atezolizumab)、德瓦鲁单抗(durvalumab)、mdx-1105、ly3300054、faz053、sti-1014、cx-072、kn035和ck-301。在一些实施方案中,pd-1抑制剂以5mg至1500mg的剂量施用。在一些实施方案中,所述pd-1抑制剂以200mg、250mg、350mg、400mg、500mg、600mg、700mg、750mg、800mg、1000mg、1050mg或1200mg的剂量施用。在一些实施方案中,所述pd-1抑制剂以1mg/kg患者体重至20mg/kg患者体重的剂量施用。在一些实施方案中,所述pd-1抑制剂以1mg/kg患者体重、3mg/kg患者体重或10mg/kg患者体重的剂量施用。在一些实施方案中,所述pd-1抑制剂以一个或更多个剂量施用,其中每个剂量每周、每两周、每三周、每四周、每五周或每六周施用。在一些实施方案中,所述pd-1抑制剂静脉内、皮下或腹膜内施用。
12.在另一方面中,所公开的技术涉及程序性死亡1(pd-1)抑制剂,其用于治疗或抑制肿瘤生长或提高宫颈癌患者总存活的方法中,所述方法包括:(a)选择患有宫颈癌的患者;以及(b)向所述患者施用治疗有效量的pd-1抑制剂。在一些实施方案中,所述宫颈癌是在化学治疗时或化学治疗之后有疾病进展的复发性或转移性宫颈癌或不适合化学治疗。
13.在另一方面中,所公开的技术涉及药盒,其包含与治疗有效量的pd-1抑制剂的书面使用说明书组合的程序性死亡(pd-1)抑制剂,其用于治疗或抑制肿瘤生长或提高患有宫颈癌的患者的总存活。
附图说明
14.图1是癌症基因组图谱(tcga)通过组织学确定的宫颈癌中pd-l1mrna表达的箱线
图,如实施例1中所述。
15.图2是实施例2所述研究的示意图。
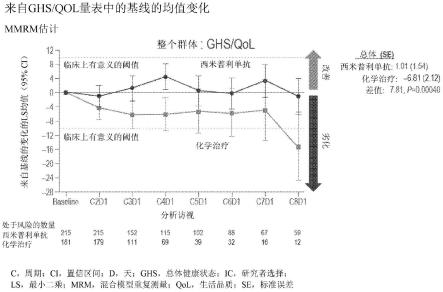
16.图3是示出在实施例4中描述的患者总体群中混合模型重复测量估计,相对于全球健康状况/生命质量(global health status/quality of life)量表的基线的平均变化的图。
17.图4是在实施例4中描述的研究中患有鳞状细胞癌(squamous cell carcinoma,scc)和非scc组织学的患者的总体群(全分析集)中总存活的kaplan-meier曲线。
18.图5是在实施例4描述的研究中患有scc组织学的患者的scc患者(全分析集)中总存活的kaplan-meier曲线。
19.图6是实施例4中描述的研究中患有腺癌/腺鳞组织学的患者的腺癌患者(全分析集)中总存活的kaplan-meier曲线。
20.图7是实施例4中描述的研究中患有鳞状细胞癌(scc)和非scc组织学的患者的总体群(全分析集)中无进展存活的kaplan-meier曲线。
21.图8是在实施例4中描述的研究中患有scc组织学的患者的scc患者(全分析集)中无进展存活的kaplan-meier曲线。
22.图9是在实施例4中描述的研究中患有腺癌/腺鳞组织学的患者的腺癌患者(全分析集)中无进展存活的kaplan-meier曲线。
具体实施方式
23.应当理解,本公开内容不限于所述的特定方法和实验条件,因为这样的方法和条件可变化。还应理解,本文中使用的术语仅出于描述特定实施方案的目的,而非旨在限制,并且本公开内容的范围将仅由所附权利要求书限制。除非另有定义,否则本文中使用的所有技术术语和科学术语具有与本公开内容所属领域的普通技术人员通常理解的相同的含义。尽管类似于或等同于本文描述的那些方法和材料的任何方法和材料都可以用于本公开内容的实践或测试中,但是现在描述的是优选的方法和材料。除非另有说明,本文提及的所有出版物均通过引用整体并入本文。
24.治疗或抑制宫颈癌生长的方法
25.本公开内容包括用于治疗或抑制肿瘤生长或提高宫颈癌患者的总存活的方法,所述方法包括选择患有宫颈癌的患者并向有此需要的患者施用特异性结合pd-1、pd-l1和/或pd-l2或本文所述的任何其他“pd-1抑制剂”的抗体或其抗原结合片段。在本公开内容中,提供对特定抗pd-1抗体的引用以说明代表性pd-1抑制剂,并不限制本公开内容的范围。
26.在一些实施方案中,所公开的方法提供了惊人有效的免疫治疗,与用化学治疗进行治疗的宫颈癌患者相比,所述免疫治疗提高了宫颈癌患者的总存活。在一些实施方案中,与用化学治疗或另一些抗pd-1抗体(例如,派姆单抗或纳武单抗)进行治疗的宫颈癌患者相比,向宫颈癌患者施用治疗有效剂量的抗pd-1抗体(例如,西米普利单抗或其生物等同物)导致提高的总存活。在一些实施方案中,与用化学治疗进行治疗的宫颈癌患者相比,向宫颈癌患者施用治疗有效量的抗pd-1抗体(例如,西米普利单抗或其生物等同物)提供了改善的安全特性并导致较低的不良事件发生率。在一些实施方案中,与用化学治疗进行治疗的宫颈癌患者相比,向宫颈癌患者施用治疗有效量的抗pd-1抗体(例如,西米普利单抗或其生物
等同物)导致相比于患者生活质量基线的改进的总体平均变化。
27.无论肿瘤中的pd-l1表达如何,本公开内容的方法在宫颈癌患者群体(包括患有鳞状细胞癌、腺癌和腺鳞癌的患者)中提供了意想不到的有效治疗。因此,所公开的方法在有效针对鳞状形式的宫颈癌以及特别难以治疗的腺癌方面提供了显著优势。本公开内容的方法还提供了出乎意料地有效的二线治疗,作为对先前接受过化学治疗(例如基于铂的化学治疗,例如培美曲塞、拓扑替康、伊立替康、吉西他滨或长春瑞滨)和/或其宫颈癌在化学治疗时有进展,或不适合于化学治疗的宫颈癌患者的治疗。
28.在一些实施方案中,本公开内容的方法不需要宫颈癌患者在用pd-1抑制剂(如抗pd-1抗体或其抗原结合片段(例如,西米普利单抗或其生物等同物))治疗之前进行pd-l1测试。在这方面中,所公开的方法包括向没有并且不需要表现出pd-l1阈值表达的宫颈癌患者施用治疗有效量的pd-1抑制剂。在另一些实施方案中,宫颈癌患者在癌组织和/或肿瘤浸润免疫细胞中表达约1%、约2%、约5%、约10%、约20%、约30%、约40%、约50%或更高的pd-l1表达。
29.如本文所使用的,术语“治疗”及其变型等意指缓和或减轻至少一种症状或适应症的严重性,以暂时或永久消除症状的起因,以延迟或抑制肿瘤生长,以减少肿瘤细胞负荷或肿瘤负荷,以促进肿瘤消退,以引起肿瘤收缩、坏死和/或消失,以防止肿瘤复发,以防止或抑制转移,以抑制转移性肿瘤生长,以消除对放射或手术的需要,和/或以延长对象的存活时间。在许多实施方案中,术语“肿瘤”、“病变”、“肿瘤病变”、“癌症”和“恶性肿瘤”可互换使用并且指一种或更多种癌生长物。
30.在一些实施方案中,宫颈癌是复发性、持续性和/或转移性宫颈癌。在一些实施方案中,宫颈癌是晚期宫颈癌。在一些实施方案中,宫颈癌是子宫颈的鳞状细胞癌(scc)。在一些实施方案中,宫颈癌是腺癌。在一些实施方案中,宫颈癌是腺鳞癌。在一些实施方案中,患者患有这样的宫颈癌,对所述宫颈癌没有治愈意图的选择(例如,手术或放射治疗伴随或不伴随化学治疗)。在一些实施方案中,患有宫颈癌的患者在肿瘤组织中表现出升高的pd-l1表达水平,其中肿瘤组织包含肿瘤细胞和肿瘤浸润性免疫细胞。
31.如本文所使用的,术语“复发”是指患者中宫颈癌的频繁或重复诊断或者个别肿瘤的频繁或重复出现,例如原发性肿瘤和/或可以代表先前肿瘤的复发的新肿瘤。在某些实施方案中,pd-1抑制剂的施用抑制了患者中宫颈癌肿瘤的复发。
32.如本文所使用的,表述“有此需要的对象”意指表现出宫颈癌的一种或更多种症状或适应症的人或非人哺乳动物,和/或已被诊断患有宫颈癌的人或非人哺乳动物,以及需要宫颈癌的治疗的人或非人哺乳动物。在许多实施方案中,术语“对象”和“患者”可互换使用。该表述包括患有原发性肿瘤、已建立的肿瘤、复发性肿瘤或转移性肿瘤(晚期恶性肿瘤)的对象。在具体实施方案中,该表述包括患有复发性和/或转移性宫颈癌和/或需要复发性和/或转移性宫颈癌的治疗的人类对象。该表述还包括患有持续性宫颈癌疾病(放化疗后未完全消退的疾病)的对象。在某些实施方案中,该表述包括患有对先前治疗(例如,手术或化学治疗例如卡铂或多西他赛)具有抗性、或其具有难治性或由其无法充分控制的宫颈癌的患者。在某些实施方案中,该表述包括患有宫颈癌的对象,所述对象不是治愈性手术或治愈性放射的候选者,或者常规抗癌治疗对其而言是不可取的,例如,由于毒副作用。在某些实施方案中,该表述包括已经接受过先前的化学治疗或任何其他抗癌治疗、在这样的治疗中进
展或不适合(或不适宜)这样的治疗的患有宫颈癌的患者(例如,已经接受过先前的紫杉醇和/或先前的贝伐珠单抗或者被认为不适合这样的治疗的患者)。在某些实施方案中,该表述包括已经用铂、紫杉醇和/或贝伐珠单抗治疗并且具有疾病进展的患有宫颈癌的患者。在一个实施方案中,该表述包括患有铂难治性宫颈癌的患者。
33.在某些实施方案中,本公开内容的方法可以用于治疗患有宫颈癌的患者,所述患者显示出升高水平的一种或更多种癌症相关生物标志物-例如程序性死亡配体1(pd-l1)、hpv致癌基因e6或e7。在一个实施方案中,本公开内容的方法包括向在肿瘤组织中具有升高水平的pd-l1的患者施用治疗有效量的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段)。在另一个实施方案中,所述方法用于基于癌组织中的pd-l1表达选择的患有宫颈癌的患者。在某些实施方案中,本公开内容的方法用于治疗患有宫颈癌的患者,其中所述患者基于癌组织和/或肿瘤浸润性免疫细胞中至少1%、至少2%、至少5%、至少10%、至少20%、至少30%、至少40%或至少50%pd-l1表达来选择。确定癌组织和/或免疫细胞中pd-l1表达的方法是本领域已知的。在某些实施方案中,pd-l1在肿瘤组织中的表达通过本领域已知的任何测定来确定,例如通过如例如在wo 2016124558、wo 2016191751或us 20160305947中描述的elisa测定或免疫组织化学(ihc)测定来确定。在某些实施方案中,pd-l1的表达通过定量rna表达来确定,例如通过原位杂交或通过rt-pcr来确定。在某些实施方案中,pd-l1的表达通过用标记的抗pd-l1抗体成像来确定,例如通过免疫正电子发射断层扫描或ipet来确定。参见,例如,the oncologist,12:1379(2007);journal of nuclear medicine,52(8):1171(2011);us 20180161464。
34.在一些实施方案中,本公开内容的方法可以用于治疗对hpv检测呈阳性的患有宫颈癌的患者。在另一些实施方案中,本公开内容的方法可以用于治疗对hpv检测呈阴性的患有宫颈癌的患者。
35.在某些实施方案中,所公开的方法包括与抗肿瘤治疗联合施用治疗有效量的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段)。抗肿瘤治疗包括但不限于常规抗肿瘤治疗,例如化学治疗、放射、手术,或者如本文在其他地方所述的抗肿瘤治疗。
36.根据某些实施方案,本公开内容的方法包括与第二治疗剂或治疗联合向对象施用治疗有效量的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段)。可以施用第二治疗剂或治疗以提高抗肿瘤功效、降低一种或更多种治疗的毒性作用和/或降低一种或更多种治疗的剂量。在各种实施方案中,第二治疗剂或治疗可以包括以下中的一者或更多者:放射;手术;癌症疫苗;咪喹莫特;抗病毒剂(例如西多福韦);光动力治疗;程序性死亡配体1(pd-l1)抑制剂(例如抗pd-l1抗体);淋巴细胞活化基因3(lag3)抑制剂(例如抗lag3抗体);细胞毒性t淋巴细胞相关蛋白4(ctla-4)抑制剂(例如伊匹单抗(ipilimumab));糖皮质激素诱导的肿瘤坏死因子受体(gitr)激动剂(例如抗gitr抗体);含t细胞免疫球蛋白和黏蛋白-3(tim3)的抑制剂;b和t淋巴细胞弱化子(btla)抑制剂;具有ig和itim结构域的t细胞免疫受体(tigit)抑制剂;cd38抑制剂;cd47抑制剂;吲哚胺-2,3-双加氧酶(ido)抑制剂;cd28激活剂;血管内皮生长因子(vegf)拮抗剂[例如,“vegf-trap”,例如阿柏西普,或抗vegf抗体或其抗原结合片段(例如,贝伐珠单抗、或雷珠单抗)或vegf受体的小分子激酶抑制剂(例如,舒尼替尼、索拉非尼或帕唑帕尼)]、血管生成素2(ang2)抑制剂;转化生长因子β(tgfβ)抑制剂;表皮生长因子受体(egfr)抑制剂;针对肿瘤特异性抗原的抗体[例如,ca9、ca125、黑色
素瘤相关抗原3(mage3)、癌胚抗原(cea)、波形蛋白、肿瘤-m2-pk、前列腺特异性抗原(psa)、黏蛋白-1、mart-1、和ca19-9];疫苗(例如卡介苗(bacillus calmette-guerin));粒细胞-巨噬细胞集落刺激因子;溶瘤病毒;细胞毒素;化学治疗剂(例如,培美曲塞、达卡巴嗪、替莫唑胺、环磷酰胺、多西他赛、多柔比星、柔红霉素、顺铂、卡铂、吉西他滨、甲氨蝶呤、米托蒽醌、奥沙利铂、紫杉醇、拓扑替康、伊立替康、长春瑞滨和长春新碱);il-6r抑制剂;il-4r抑制剂;il-10抑制剂;细胞因子,例如il-2、il-7、il-12、il-21和il-15;抗体药物偶联物;抗炎药例如皮质类固醇;非甾体抗炎药(nsaid);冷冻治疗;抗hpv治疗;激光治疗;hpv细胞的电外科切除;以及膳食补充剂例如抗氧化剂。
[0037]
在某些实施方案中,向患有宫颈癌的对象施用治疗有效量的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段)引起对肿瘤生长的抑制提高—例如,在经治疗的对象中更大的肿瘤消退。在某些实施方案中,向患有宫颈癌的对象施用治疗有效量的pd-1抑制剂(例如抗pd-1抗体或其抗原结合片段)引起提高的肿瘤消退、肿瘤收缩和/或消失。在某些实施方案中,与未经治疗的对象或者用基于铂的化学治疗或其他soc治疗(例如本文公开的那些)治疗的对象相比,pd-1抑制剂的施用引起肿瘤生长和进展延迟,例如,肿瘤生长在经治疗的对象中可以延迟约3天、多于3天、约7天、多于7天、多于15天、多于1个月、多于3个月、多于6个月、多于1年、多于2年、或多于3年。在一个实施方案中,无论肿瘤中pd-l1表达如何,都发生对肿瘤生长的提高的抑制。
[0038]
在某些实施方案中,与未经治疗的对象或者用基于铂的化学治疗或其他“标准护理(standard-of-care)”(soc)治疗(例如本文公开的那些)治疗的对象相比,向患有宫颈癌的对象施用治疗有效量的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段)预防肿瘤复发和/或延长对象的存活时间,例如,延长存活时间多于15天、多于1个月、多于3个月、多于6个月、多于12个月、多于18个月、多于24个月、多于36个月、或多于48个月。在一个实施方案中,无论肿瘤中pd-l1表达如何,都发生肿瘤复发的预防和存活时间的延长。
[0039]
在某些实施方案中,与施用soc治疗的对象相比,向患有宫颈癌的对象施用治疗有效量的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段)引起所述对象的总存活(os)或无进展存活(pfs)提高。标准护理治疗的非限制性实例包括基于铂的化学治疗(例如,基于铂-紫杉烷的化学治疗)、抗叶酸剂(例如,培美曲塞)、拓扑异构酶1抑制剂(例如,拓扑替康或伊立替康)、核苷类似物(例如,吉西他滨)、长春花生物碱(例如,长春瑞滨)、手术、放射及其组合。在某些实施方案中,与施用任一种或更多种soc治疗的对象相比,pfs延长至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月、至少1年、至少2年、或至少3年。在某些实施方案中,与施用任一种或更多种soc治疗(例如基于铂的化学治疗)的对象相比,os延长至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月、至少1年、至少2年、或至少3年。
[0040]
pd-1抑制剂
[0041]
本文公开的方法包括施用治疗有效量的pd-1抑制剂。如本文所使用的,“pd-1抑制剂”是指任何能够抑制、阻断、废除或干扰pd-1的活性或表达的分子。在一些实施方案中,pd-1抑制剂可以是抗体、小分子化合物、核酸、多肽或其功能片段或变体。合适的pd-1抑制剂抗体的非限制性实例包括抗pd-1抗体及其抗原结合片段、抗pd-l1抗体及其抗原结合片
段、以及抗pd-l2抗体及其抗原结合片段。合适的pd-1抑制剂的其他非限制性实例包括rnai分子,例如抗pd-1rnai分子、抗pd-l1 rnai和抗pd-l2 rnai;反义分子,例如抗pd-1反义rna、抗pd-l1反义rna和抗pd-l2反义rna;以及显性失活蛋白,例如显性失活pd-1蛋白、显性失活pd-l1蛋白和显性失活pd-l2蛋白。前述pd-1抑制剂的一些实例在例如us 9308236、us 10011656和us 20170290808中描述,其中确定pd-1抑制剂的部分在此通过引用并入。
[0042]
如本文所使用的,术语“抗体”旨在指包括四条多肽链(通过二硫键相互连接的两条重(h)链和两条轻(l)链)的免疫球蛋白分子(即,“完整抗体分子”)以及其多聚体(例如igm)或其抗原结合片段。每条重链包括重链可变区(“hcvr”或“vh”)和重链恒定区(包括结构域ch1、ch2和ch3)。每条轻链包括轻链可变区(“lcvr”或“vl”)和轻链恒定区(cl)。vh和vl区可以进一步细分为高变区(称为互补决定区(cdr)),夹杂着更保守的区域(称为框架区(fr))。每个vh和vl包括从氨基端到羧基端按以下顺序排列的三个cdr和四个fr:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。在某些实施方案中,抗体(或其抗原结合片段)的fr可以与人种系序列相同或者可以是天然或人工修饰的。氨基酸共有序列可以基于两个或更多个cdr的并行分析来限定。如本文所使用的,术语“抗体”还包括完整抗体分子的抗原结合片段。
[0043]
如本文所使用的,术语抗体的“抗原结合片段”、抗体的“抗原结合部分”等包括特异性结合抗原以形成复合物的任何天然存在的、酶法可获得的、合成的或基因工程的多肽或糖蛋白。使用涉及编码抗体可变结构域和任选恒定结构域的dna的操作和表达的任何合适的标准技术例如蛋白水解消化或重组基因工程技术,抗体的抗原结合片段可以源自例如完整抗体分子。这样的dna是已知的和/或容易从例如商业来源、dna文库(包括例如噬菌体-抗体文库)获得,或者可以被合成。dna可以以化学方法或通过使用分子生物学技术进行测序和操作,例如,以将一个或更多个可变和/或恒定结构域排列成合适的构型,或引入密码子,产生半胱氨酸残基,修饰、添加或删除氨基酸等。
[0044]
抗原结合片段的非限制性实例包括:(i)fab片段;(ii)f(ab')2片段;(iii)fd片段;(iv)fv片段;(v)单链fv(scfv)分子;(vi)dab片段;以及(vii)由模拟抗体高变区(例如,分离的互补决定区(cdr),例如cdr3肽)的氨基酸残基或限制性fr3-cdr3-fr4肽组成的最小识别单位。其他工程分子例如结构域特异性抗体、单结构域抗体、结构域缺失抗体、嵌合抗体、cdr移植抗体、双抗体、三抗体、四抗体、微型抗体、纳米抗体(例如单价纳米抗体、二价纳米抗体等)、小型模块化免疫药物(small modular immunopharmaceutical,smip)和鲨鱼可变ignar结构域也包括在如本文所使用的表述“抗原结合片段”中。
[0045]
抗体的抗原结合片段通常包含至少一个可变结构域。可变结构域可以具有任何大小或氨基酸组成,并且通常将包含至少一个与一个或更多个构架序列相邻或与其同框的cdr。在具有与v
l
结构域相关的vh结构域的抗原结合片段中,vh和v
l
结构域可以以任何合适的排列相对于彼此定位。例如,可变区可以为二聚的并且包含v
h-vh、v
h-v
l
或v
l-v
l
二聚体。或者,抗体的抗原结合片段可以包含单体vh或v
l
结构域。
[0046]
在某些实施方案中,抗体的抗原结合片段可以包含至少一个与至少一个恒定结构域共价连接的可变结构域。可以在本公开内容的抗体的抗原结合片段内发现的可变结构域和恒定结构域的非限制性示例性构型包括:(i)v
h-ch1;(ii)v
h-ch2;(iii)v
h-ch3;(iv)v
h-ch1-ch2;(v)v
h-ch1-ch2-ch3;(vi)v
h-ch2-ch3;(vii)v
h-c
l
;(viii)v
l-ch1;(ix)v
l-ch2;(x)v
l-ch3;(xi)v
l-ch1-ch2;(xii)v
l-ch1-ch2-ch3;(xiii)v
l-ch2-ch3;和(xiv)v
l-c
l
。在可变结构域
和恒定结构域的任何构型中,包括任何以上所列的示例性构型,可变结构域和恒定结构域可以彼此直接连接或者可以通过完整或部分铰链区或接头区连接。铰链区可以由至少2个(例如,5个、10个、15个、20个、40个、60个或更多个)氨基酸组成,所述氨基酸引起单个多肽分子中相邻可变结构域和/或恒定结构域之间的柔性或半柔性连接。此外,本公开内容的抗体的抗原结合片段可以包含彼此非共价缔合和/或与一个或更多个单体vh或v
l
结构域(例如,通过二硫键)非共价缔合的任何以上所列的可变结构域和恒定结构域构型的同源二聚体或异源二聚体(或其他多聚体)。
[0047]
本文公开的方法中使用的抗体可以是人抗体。如本文所使用的,术语“人抗体”是指具有源自人种系免疫球蛋白序列的可变区和恒定区的抗体。尽管如此,本公开内容的人抗体可以包含不是由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机诱变或位点专一诱变或通过体内体细胞突变引入的突变),例如在cdr,特别是cdr3中。然而,如本文所使用的,术语“人抗体”不旨在包括其中源自另一哺乳动物物种(例如小鼠)的种系的cdr序列已被移植到人构架序列上的抗体。
[0048]
本文公开的方法中使用的抗体可以是重组人抗体。如本文所使用的,术语“重组人抗体”包括通过重组方式制备、表达、产生或分离的所有人抗体,例如使用转染到宿主细胞中的重组表达载体表达的抗体(下文进一步描述)、从重组、组合人抗体文库中分离的抗体(下文进一步描述)、从针对人免疫球蛋白基因转基因的动物(例如,小鼠)中分离的抗体(参见例如taylor等(1992)nucl.acids res.20:6287-6295)或者通过涉及将人免疫球蛋白基因序列剪接至其他dna序列的任何其他方式制备、表达、产生或分离的抗体。这样的重组人抗体具有源自人种系免疫球蛋白序列的可变区和恒定区。然而,在某些实施方案中,使这样的重组人抗体经受体外诱变(或者,当使用针对人ig序列转基因的动物时,体内体细胞诱变),因此重组抗体的vh和v
l
区的氨基酸序列是这样的序列:虽然源自人种系vh和v
l
序列并与之相关,但在体内可能不天然存在于人抗体种系库中。
[0049]
抗pd-1抗体及其抗原结合片段
[0050]
在一些实施方案中,本文公开的方法中使用的pd-1抑制剂是特异性结合pd-1的抗体或其抗原结合片段。术语“特异性结合”等意指抗体或其抗原结合片段与在生理条件下相对稳定的抗原形成复合物。确定抗体是否特异性结合抗原的方法是本领域公知的并且包括例如平衡透析、表面等离子体共振等。例如,如在本公开内容的上下文中使用的“特异性结合”pd-1的抗体包括这样的结合pd-1或其一部分的抗体:如在表面等离子体共振测定中测量的,具有小于约500nm、小于约300nm、小于约200nm、小于约100nm、小于约90nm、小于约80nm、小于约70nm、小于约60nm、小于约50nm、小于约40nm、小于约30nm、小于约20nm、小于约10nm、小于约5nm、小于约4nm、小于约3nm、小于约2nm、小于约1nm或小于约0.5nm的kd。然而,特异性结合人pd-1的经分离的抗体可能与其他抗原例如来自其他(非人)物种的pd-1分子具有交叉反应性。
[0051]
根据某些示例性实施方案,抗pd-1抗体或其抗原结合片段包含含有us 9987500(其在此通过引用整体并入)中所陈述的任何抗pd-1抗体的氨基酸序列的重链可变区(hcvr)、轻链可变区(lcvr)和/或互补决定区(cdr)。在某些示例性实施方案中,可以用于本公开内容的上下文中的抗pd-1抗体或其抗原结合片段包含含有seq id no:1的氨基酸序列的重链可变区(hcvr)的重链互补决定区(hcdr)和含有seq id no:2的氨基酸序列的轻链可
变区(lcvr)的轻链互补决定区(lcdr)。根据某些实施方案,抗pd-1抗体或其抗原结合片段包含三个hcdr(hcdr1、hcdr2和hcdr3)和三个lcdr(lcdr1、lcdr2和lcdr3),其中hcdr1包含seq id no:3的氨基酸序列;hcdr2包含seq id no:4的氨基酸序列;hcdr3包含seq id no:5的氨基酸序列;lcdr1包含seq id no:6的氨基酸序列;lcdr2包含seq id no:7的氨基酸序列;以及lcdr3包含seq id no:8的氨基酸序列。在另一些实施方案中,抗pd-1抗体或其抗原结合片段包含含有seq id no:1的hcvr和含有seq idno:2的lcvr。在某些实施方案中,本公开内容的方法包括使用抗pd-1抗体,其中所述抗体包含含有seq id no:9的氨基酸序列的重链。在一些实施方案中,抗pd-1抗体包含含有seq id no:10的氨基酸序列的轻链。包含含有seq id no:1的氨基酸序列的重链可变区和含有seq id no:2的氨基酸序列的轻链可变区的示例性抗体是称为西米普利单抗(也称为regn2810;)的完整人抗pd-1抗体。
[0052]
根据某些示例性实施方案,本公开内容的方法包括使用西米普利单抗或其生物等同物。如本文所使用的,术语“生物等同物”是指这样的为药物等效物或药物替代物的抗pd-1抗体或pd-1结合蛋白或其片段:当在类似的实验条件下以相同的摩尔剂量(单剂量或多剂量)施用时,其吸收率和/或吸收程度不显示出与参考抗体(例如,西米普利单抗)的吸收率和/或吸收程度的显著差异。在本公开内容的上下文中,术语“生物等同物”包括与pd-1结合并且在安全性、纯度和/或效力方面与西米普利单抗没有临床意义上的差异的抗原结合蛋白。
[0053]
根据本公开内容的某些实施方案,抗人pd-1或其抗原结合片段包含与seq id no:1具有90%、95%、97%或98%序列同一性的hcvr。
[0054]
根据本公开内容的某些实施方案,抗人pd-1或其抗原结合片段包含与seq id no:2具有90%、95%、97%或98%序列同一性的lcvr。
[0055]
根据本公开内容的某些实施方案,抗人pd-1或其抗原结合片段包含含有具有不多于5个氨基酸替换的seq id no:1的氨基酸序列的hcvr。根据本公开内容的某些实施方案,抗人pd-1或其抗原结合片段包含含有具有不多于2个氨基酸替换的seq id no:2的氨基酸序列的lcvr。
[0056]
可以通过本领域已知的方法(例如,gap、bestfit和blast)测量序列同一性。
[0057]
本公开内容还包括抗pd-1抗体或其抗原结合片段在治疗宫颈癌的方法中的用途,其中抗pd-1抗体或其抗原结合片段包含本文公开的具有一个或更多个保守氨基酸替换的任何hcvr、lcvr和/或cdr氨基酸序列的变体。例如,本公开内容包括使用相对于本文公开的任何hcvr、lcvr和/或cdr氨基酸序列,具有拥有例如10个或更少、8个或更少、6个或更少、4个或更少等的保守氨基酸替换的hcvr、lcvr和/或cdr氨基酸序列的抗pd-1抗体或其抗原结合片段。
[0058]
可以在本公开内容的方法的上下文中使用的其他抗pd-1抗体或其抗原结合片段包括例如在本领域中被称为和已知为纳武单抗、派姆单抗、medi0608、匹地利珠单抗、bi 754091、斯巴达珠单抗(也称为pdr001)、卡瑞利珠单抗(也称为shr-1210)、jnj-63723283、mcla-134的抗体,或者在美国专利号6808710、7488802、8008449、8168757、8354509、8609089、8686119、8779105、8900587、和9987500以及专利公开wo 2006/121168、wo 2009/114335中所陈述的任何抗pd-1抗体。所有上述出版物中确定抗pd-1抗体的部分均在此通过
引用并入。
[0059]
在本公开内容的方法的上下文中使用的抗pd-1抗体可以具有ph依赖性结合特性。例如,与中性ph相比,用于本公开内容的方法中的抗pd-1抗体在酸性ph下可以表现出与pd-1的结合减少。或者,与中性ph相比,本发明的抗pd-1抗体在酸性ph下可以表现出增强的与其抗原的结合。表述“酸性ph”包括小于约6.2,例如为约6.0、5.95、5.9、5.85、5.8、5.75、5.7、5.65、5.6、5.55、5.5、5.45、5.4、5.35、5.3、5.25、5.2、5.15、5.1、5.05、5.0或更小的ph值。如本文所使用的,表述“中性ph”意指约7.0至约7.4的ph。表述“中性ph”包括约7.0、7.05、7.1、7.15、7.2、7.25、7.3、7.35和7.4的ph值。
[0060]
在某些情况下,“与中性ph相比,在酸性ph下与pd-1的结合减少”根据在酸性ph下与pd-1结合的抗体的kd值与在中性ph下与pd-1结合的抗体的kd值的比率(反之亦然)来表示。例如,如果抗体或其抗原结合片段表现出约3.0或更大的酸性/中性kd比,则出于本公开内容的目的,抗体或其抗原结合片段可以被视为表现出“与中性ph相比,在酸性ph下与pd-1的结合减少”。在某些示例性实施方案中,本公开内容的抗体或抗原结合片段的酸性/中性kd比可以为约3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12.0、12.5、13.0、13.5、14.0、14.5、15.0、20.0、25.0、30.0、40.0、50.0、60.0、70.0、100.0或更大。
[0061]
可以例如通过筛选与中性ph相比在酸性ph下与特定抗原的结合减少(或增强)的抗体群体来获得具有ph依赖性结合特性的抗体。此外,在氨基酸水平上对抗原结合结构域进行修饰可以产生具有ph依赖性特性的抗体。例如,通过用组氨酸残基替换抗原结合结构域(例如,cdr内)的一个或更多个氨基酸,可以获得相对于中性ph在酸性ph下具有减少的抗原结合的抗体。如本文所使用的,表述“酸性ph”意指6.0或更低的ph。
[0062]
抗pd-l1抗体及其抗原结合片段
[0063]
在一些实施方案中,在本文公开的方法中使用的pd-1抑制剂是特异性结合pd-l1的抗体或其抗原结合片段。例如,如在本公开内容的上下文中使用的“特异性结合”pd-l1的抗体包括以约1
×
10-8
m或更小的kd(例如,较小的kd表示更紧密的结合)结合pd-l1或其一部分的抗体。“高亲和力”抗pd-l1抗体是指如通过表面等离子体共振例如biacore
tm
或溶液亲和elisa测量的,表示为kd的对pd-l1的结合亲和力为至少10-8
m(例如10-9
m、10-10
m、10-11
m、或10-12
m)的那些mab。然而,特异性结合人pd-l1的经分离的抗体可能与其他抗原例如来自其他(非人)物种的pd-l1分子具有交叉反应性。
[0064]
根据某些示例性实施方案,抗pd-ll抗体或其抗原结合片段包含含有us 9938345(其在此通过引用整体并入)中所陈述的任何抗pd-l1抗体的氨基酸序列的重链可变区(hcvr)、轻链可变区(lcvr)和/或互补决定区(cdr)。在某些示例性实施方案中,可以在本公开内容的上下文中使用的抗pd-l1抗体或其抗原结合片段包含含有seq id no:11的重链可变区(hcvr)的重链互补决定区(hcdr)和含有seq id no:12的轻链可变区(lcvr)的轻链互补决定区(lcdr)。包含seq id no:11的hcvr和seq id no:12的lcvr的示例性抗pd-l1抗体是regn3504。
[0065]
根据本公开内容的某些实施方案,抗人pd-l1抗体或其抗原结合片段包含与seq id no:11具有90%、95%、97%或98%序列同一性的hcvr。根据本公开内容的某些实施方案,抗人pd-l1抗体或其抗原结合片段包含与seq id no:12具有90%、95%、97%或98%序
列同一性的lcvr。
[0066]
根据本公开内容的某些实施方案,抗人pd-l1抗体或其抗原结合片段包含含有具有不多于5个氨基酸替换的seq id no:11的氨基酸序列的hcvr。根据本公开内容的某些实施方案,抗人pd-l1抗体或其抗原结合片段包含含有具有不多于2个氨基酸替换的seq id no:12的氨基酸序列的lcvr。
[0067]
可以通过本领域已知的方法(例如,gap、bestfit和blast)测量序列同一性。
[0068]
本公开内容还包括抗pd-ll抗体在治疗宫颈癌的方法中的用途,其中所述抗pd-ll抗体包含本文公开的具有一个或更多个保守氨基酸替换的任何hcvr、lcvr和/或cdr氨基酸序列的变体。例如,本公开内容包括使用相对于本文公开的任何hcvr、lcvr和/或cdr氨基酸序列,具有拥有例如10个或更少、8个或更少、6个或更少、4个或更少等的保守氨基酸替换的hcvr、lcvr和/或cdr氨基酸序列的抗pd-l1抗体。
[0069]
可以在本公开内容的方法的上下文中使用的其他抗pd-ll抗体包括例如在本领域中被称为和已知为mdx-1105、阿替利珠单抗(tecentriq
tm
)、德瓦鲁单抗(imfinzi
tm
)、阿维单抗(bavencio
tm
)、ly3300054、faz053、sti-1014、cx-072、kn035(zhang等,cell discovery,3,170004(2017年3月))、ck-301(gorelik等,american association for cancer research annual meeting(aacr),2016-04-04摘要4606)的抗体,或者在专利公开us 7943743、us 8217149、us 9402899、us 9624298、us 9938345、wo 2007/005874、wo 2010/077634、wo 2013/181452、wo 2013/181634、wo 2016/149201、wo 2017/034916、或ep3177649中所陈述的任何其他抗pd-l1抗体。所有上述出版物中确定抗pd-l1抗体的部分均在此通过引用并入。
[0070]
药物组合物和施用
[0071]
本公开内容提供了包含本文公开的pd-1抑制剂的治疗性药物组合物。这样的药物组合物可以用合适的可药用载体、赋形剂、缓冲剂和提供合适的转移、递送、耐受性等的其他试剂配制。许多合适的制剂可以在所有药物化学家已知的处方集:remington's pharmaceutical sciences,mack publishing company,easton,pa中找到。这些制剂包括例如散剂、糊剂、软膏剂、凝胶剂、蜡、油、脂质、包含囊泡的脂质(阳离子或阴离子)(例如lipofectin
tm
)、dna缀合物、无水吸收糊剂、水包油和油包水乳剂、乳液聚乙二醇(各种分子量的聚乙二醇)、半固体凝胶和含有聚乙二醇的半固体混合物。还参见powell等,"compendium of excipients for parenteral formulations"pda,j pharm sci technol 52:238-311(1998)。
[0072]
pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段)的剂量可以根据待施用的对象的年龄和体型、目标疾病、病症、施用途径等而变化。当将本公开内容的pd-1抑制剂用于治疗或抑制宫颈癌的生长或改善宫颈癌患者的总存活时,以约0.1mg/kg体重至约100mg/kg体重的单剂量施用pd-1抑制剂可以是有利的。根据病症的严重性,可以调整治疗的频率和持续时间。在某些实施方案中,本公开内容的pd-1抑制剂可以作为至少约0.1mg至约1500mg、约1mg至约1000mg、约3mg至约800mg、约5mg至约500mg、或约10mg至约400mg的初始剂量施用。在某些实施方案中,初始剂量之后可以是以可以近似与初始剂量的量相等或小于初始剂量的量的量施用第二或多个后续剂量的pd-1抑制剂,其中后续剂量相隔至少1天至3天、至少1周、至少2周、至少3周、至少4周、至少5周、至少6周、至少7周、至少8周、至少9周、至少
10周、至少12周、或至少14周。
[0073]
各种递送体系是已知的并且可以用于施用本公开内容的药物组合物,例如,包被在脂质体、微粒、微囊中,能够表达突变病毒的重组细胞,受体介导的内吞作用(参见,例如,wu等(1987)j.biol.chem.262:4429-4432)。引入方法包括但不限于皮内、经皮、肌内、腹膜内、静脉内、皮下、鼻内、硬膜外和经口途径。所述组合物可以通过任何方便的途径施用,例如通过输注或推注(bolus injection)施用,通过经由上皮或黏膜皮肤内层(例如,口腔黏膜、直肠和肠黏膜等)吸收施用,并且可以与其他生物活性剂一起施用。药物组合物也可以以囊泡,特别是脂质体(参见,例如,langer(1990)science 249:1527-1533)递送。
[0074]
本文还考虑了使用纳米颗粒来递送本公开内容的pd-1抑制剂。抗体偶联的纳米颗粒可以用于治疗应用和诊断应用二者。arruebo等,2009,“antibody-conjugated nanoparticles for biomedical applications,”j.nanomat.,2009卷,文章编号439389,24页详细描述了抗体偶联的纳米颗粒以及制备方法和用途。可以开发纳米颗粒并将其偶联至药物组合物中包含的抗体以靶向细胞。用于药物递送的纳米颗粒也已在例如us 8257740或us 8246995中描述。
[0075]
在某些情况下,药物组合物可以以控制释放体系递送。在一个实施方案中,可以使用泵。在另一个实施方案中,可以使用聚合物材料。在又一个实施方案中,可以将控制释放体系放置在组合物的目标附近,因此仅需要全身剂量的一部分。
[0076]
可注射的制剂可以包括用于静脉内、皮下、颅内、腹膜内和肌内注射、滴注等的剂型。这些可注射的制剂可以通过公知的方法制备。
[0077]
本公开内容的药物组合物可以用标准针和注射器皮下或静脉内递送。此外,关于皮下递送,笔式递送装置容易应用于递送本公开内容的药物组合物。这样的笔式递送装置可以为可重复使用的或一次性的。可重复使用的笔式递送装置通常使用包含药物组合物的可更换药筒。一旦药筒内的所有药物组合物都已被施用并且药筒是空的,就可以容易地丢弃空药筒并用包含药物组合物的新药筒替换。然后可以重复使用笔式递送装置。在一次性笔式递送装置中,没有可更换的药筒。相反,一次性笔式递送装置预填充有保存在装置内的储存器中的药物组合物。一旦储存器没有药物组合物,整个装置就被丢弃。
[0078]
有利地,将上述用于经口或肠胃外使用的药物组合物制备成适合于适合活性成分的剂量的单位剂量的剂型。这样的单位剂量的剂型包括例如片剂、丸剂、胶囊剂、注射剂(安瓿)、栓剂等。所含抗体的量通常为每单位剂量的剂型约5mg至约1500mg。
[0079]
在某些实施方案中,本公开内容提供了包含治疗量的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段)和可药用载体的药物组合物或制剂。us 2019/0040137中公开了可以用于本公开内容的上下文中的包含抗pd-1抗体的药物组合物的非限制性实例。
[0080]
本公开内容还提供了包含如本文所述的用于治疗用途的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段)的药盒。药盒通常包括指示药盒内容物的预期用途的标签和使用说明。如本文所使用的,术语“标签”包括在药盒上、药盒中或与药盒一起提供的或者以其他方式随药盒提供的任何书写或记录的材料。因此,本公开内容提供了用于治疗患有宫颈癌的患者的药盒,所述药盒包括:(a)治疗有效剂量的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段);以及(b)用于在本文公开的任何方法中使用pd-1抑制剂的说明。
[0081]
施用方案
[0082]
在某些实施方案中,本文公开的方法包括以多剂量向有此需要的对象的肿瘤施用治疗有效量的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段),例如作为特定治疗性给药方案的一部分。例如,治疗性给药方案可包括以以下频率向对象施用一个或更多个剂量的pd-1抑制剂:约每天一次、每两天一次、每三天一次、每四天一次、每五天一次、每六天一次、每周一次、每两周一次、每三周一次、每四周一次、每五周一次、每六周一次、每八周一次、每十二周一次、每月一次、每两个月一次、每三个月一次、每四个月一次、每天两次、每两天两次、每三天两次、每四天两次、每五天两次、每六天两次、每周两次、每两周两次、每三周两次、每四周两次、每五周两次、每六周两次、每八周两次、每十二周两次、每月两次、每两个月两次、每三个月两次、每四个月两次、每天三次、每两天三次、每三天三次、每四天三次、每五天三次、每六天三次、每周三次、每两周三次、每三周三次、每四周三次、每五周三次、每六周三次、每八周三次、每十二周三次、每月三次、每两个月三次、每三个月三次、每四个月三次或更低频率地,或者根据需要,只要实现治疗性响应即可。在一个实施方案中,每三周施用一次如本文所述的一个或更多个剂量的pd-1抑制剂。在一个实施方案中,每六周施用一次如本文所述的一个或更多个剂量的pd-1抑制剂。在一个实施方案中,每三周施用一次如本文所述的一个或更多个剂量的pd-1抑制剂,然后每六周施用一次一个或更多个剂量。
[0083]
在一些实施方案中,每三周以350mg的剂量施用一次如本文所述的一个或更多个剂量的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段,例如西米普利单抗或其生物等同物)。在一些实施方案中,每四周以600mg的剂量施用一次如本文所述的一个或更多个剂量的pd-1抑制剂。在一些实施方案中,每六周以600mg的剂量施用一次如本文所述的一个或更多个剂量的pd-1抑制剂。在一些实施方案中,每六周以700mg的剂量施用一次如本文所述的一个或更多个剂量的pd-1抑制剂。在一些实施方案中,每六周以1050mg的剂量施用一次如本文所述的一个或更多个剂量的pd-1抑制剂。
[0084]
在某些实施方案中,在至少一个治疗周期中施用一个或更多个剂量。根据该方面,所述方法包括向有此需要的对象施用包括施用1、2、3、4、5、6、7、8、9、10或更多个剂量的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段)的至少一个治疗周期。在一个实施方案中,治疗周期包含12个剂量的pd-1抑制剂。在一个实施方案中,治疗周期包含24个剂量的pd-1抑制剂。
[0085]
剂量
[0086]
根据本文公开的方法施用至对象的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段)的量通常是治疗有效量。如本文所使用的,术语“治疗有效量”意指导致以下中的一项或更多项的pd-1抑制剂的量:(a)宫颈癌(例如,肿瘤病变)的症状或适应证的严重性或持续时间降低;(b)抑制肿瘤生长,或提高肿瘤坏死、肿瘤收缩和/或肿瘤消失;(c)肿瘤生长和发育延迟;(d)抑制肿瘤转移;(e)防止肿瘤生长复发;(f)患有癌症的对象的存活提高;和/或(g)与未经治疗对象或用基于铂的化学治疗或其他soc治疗(例如本文所公开的那些)进行治疗的对象相比,常规抗癌治疗的使用或需求降低(例如,消除对手术的需求或者对化学治疗剂或细胞毒性剂的使用降低或消除)。
[0087]
在某些实施方案中,治疗有效量的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段,例如西米普利单抗或其生物等同物)可为抗体的约0.05mg至约1500mg、约1mg至约800mg、约5mg至约600mg、约10mg至约550mg、约50mg至约400mg、约75mg至约350mg、或约
100mg至约300mg。例如,在不同的实施方案中,pd-1抑制剂的量为约0.05mg、约0.1mg、约1.0mg、约1.5mg、约2.0mg、约5mg、约10mg、约15mg、约20mg、约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg、约600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、约700mg、约710mg、约720mg、约730mg、约740mg、约750mg、约760mg、约770mg、约780mg、约790mg、约800mg、约810mg、约820mg、约830mg、约840mg、约850mg、约860mg、约870mg、约880mg、约890mg、约900mg、约910mg、约920mg、约930mg、约940mg、约950mg、约960mg、约970mg、约980mg、约990mg、约1000mg、约1010mg、约1020mg、约1030mg、约1040mg、约1050mg、约1060mg、约1070mg、约1080mg、约1090mg、约1200mg、约1210mg、约1220mg、约1230mg、约1240mg、约1250mg、约1260mg、约1270mg、约1280mg、约1290mg、约1300mg、约1310mg、约1320mg、约1330mg、约1340mg、约1350mg、约1360mg、约1370mg、约1380mg、约1390mg、约1400mg、约1410mg、约1420mg、约1430mg、约1440mg、约1450mg、约1460mg、约1470mg、约1480mg、约1490mg或约1500mg。
[0088]
单个剂量内所含pd-1抑制剂的量可表示为每千克对象体重抗体的毫克数(即,mg/kg)。在某些实施方案中,本文公开的方法中使用的pd-1抑制剂可以约0.0001mg/kg至约100mg/kg对象体重的剂量施用于对象。在某些实施方案中,抗pd-1抗体可以约0.1mg/kg至约20mg/kg患者体重的剂量施用。在某些实施方案中,本公开内容的方法包括以约1mg/kg至3mg/kg、1mg/kg至5mg/kg、1mg/kg至10mg/kg、1mg/kg、3mg/kg、5mg/kg或10mg/kg患者体重的剂量施用pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段)。
[0089]
在某些实施方案中,向患者施用的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段)的单个剂量量可小于治疗有效量,即亚治疗剂量。例如,如果pd-1抑制剂的治疗有效量包含3mg/kg,则亚治疗剂量包含小于3mg/kg,例如2mg/kg、1.5mg/kg、1mg/kg、0.5mg/kg或0.3mg/kg的量。如本文所定义,“亚治疗剂量”是指通过自身不会导致治疗效果的pd-1抑制剂的量。然而,在某些实施方案中,施用pd-1抑制剂的多个亚治疗剂量以在对象中共同实现治疗效果。
[0090]
在某些实施方案中,每个剂量包含0.1mg/kg至10mg/kg对象体重(例如,0.3mg/kg、1mg/kg、3mg/kg或10mg/kg)。在某些另外的实施方案中,每个剂量包含5mg至1500mg的pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段),例如5mg、10mg、15mg、20mg、25mg、30mg、40mg、45mg、50mg、100mg、150mg、200mg、250mg、300mg、350mg、400mg、450mg、500mg、550mg、600mg、650mg、700mg、750mg、800mg、850mg、900mg、950mg、1000mg、1050mg、1100mg、1150mg、1200mg、1550mg、1300mg、1350mg、1400mg、1450mg或1500mg的pd-1抑制剂。
[0091]
在某些实施方案中,pd-1抑制剂(例如,抗pd-1抗体或其抗原结合片段)与以2格雷(gy)至100格雷(gy)的一个或更多个剂量提供的放射治疗组合施用。在某些实施方案中,放射治疗包含2gy、3gy、4gy、5gy、6gy、7gy、8gy、9gy、10gy、11gy、12gy、15gy、20gy、23gy、25gy、
27gy、30gy、35gy、40gy或45gy。在某些另外的实施方案中,放射治疗包含50gy至100gy、60gy至90gy、或70gy至80gy。在某些实施方案中,放射治疗以分次施用(高分次放射治疗)。高分次放射治疗(hfrt)是指放射剂量包含2个或更多个分次的放射治疗。在不同的实施方案中,每个分次包含2gy至20gy。例如,50gy的放射剂量可分成10个分次,每个分次包含5gy。在某些实施方案中,2个或更多个分次在连续或顺序的日子里施用。在某些另外的实施方案中,2个或更多个分次在一段时期内施用,包括2天一次、3天一次、4天一次、5天一次、6天一次、7天一次、3天两次、一周两次、一周三次、或其组合。
[0092]
实施例
[0093]
提出以下实施例是为了向本领域普通技术人员提供如何制造和使用本公开内容的方法和组合物的完整公开内容和描述,并且不旨在限制发明人视为其发明的范围。同样,本公开内容不限于本文描述的任何特定的优选实施方案。实际上,在阅读本说明书时,本实施方案的修改和变化对本领域技术人员而言可以是明显的,并且可以在不脱离其精神和范围的情况下进行修改和变化。已经努力确保关于所使用的数字(例如,量、温度等)的准确性,但应当考虑一些实验误差和偏差。除非另有说明,否则份数为按重量计份数,分子量为平均分子量,温度以摄氏度计,室温为约25℃,并且压力为大气压或接近大气压。
[0094]
实施例1:抗pd-1抗体在宫颈癌患者中的临床试验
[0095]
该研究是针对晚期实体瘤患者的抗pd-1抗体(西米普利单抗)的i期、开放标签、多中心研究。西米普利单抗是一种针对pd-1受体高亲和力的、人类的、铰链稳定的igg4单克隆抗体,能有效阻断pd-1与pd-l1和pd-l2的相互作用。西米普利单抗包括具有seq id no:9氨基酸序列的重链和具有seq id no:10氨基酸序列的轻链;包含seq id nos:1/2的hcvr/lcvr氨基酸序列对;以及包含seq id nos:3-8的重链和轻链cdr序列,如本文所述。另参见us 9987500。该研究包括年龄≥18岁的组织学或细胞学证实的复发性或转移性宫颈癌患者,他们对铂和紫杉烷双重化学治疗耐药或不耐受。
[0096]
一组患者[单一治疗组群,不计划进行高分次放射治疗(hfrt)]接受西米普利单抗3mg/kg静脉注射(iv),每2周一次(q2w),持续48周。第二组患者(组合治疗组群,计划进行姑息性放射治疗)接受西米普利单抗3mg/kg iv q2w持续48周加上hfrt(对单一病变在1周内9gy
×
3次,在14天周期的第8天至第12天的西米普利单抗的第1天后的1周之后开始)。组合治疗组群登记的是计划对引起一些症状或体征的病变进行姑息性hfrt的患者。放射病变不作为反应评估的目标病变被跟踪。西米普利单抗以25mg/ml或50mg/ml的浓度供应。西米普利单抗输注进行30分钟,窗口期为
±
10分钟。
[0097]
额外的资格标准包括东部合作肿瘤学组(eastern cooperative oncology group)表现状况评分为0或1,以及足够的器官功能。根据实体瘤反应评估标准(response evaluation criteria in solid tumors,recist)1.1版,患者需要具有至少一个可测量的病变(eisenhauer等,eur j cancer45(2009)228-47)。在组合治疗组群中,可测量的病变在辐照病变之外。
[0098]
主要的排除标准包括正在进行或最近(5年内)需要全身免疫抑制的自身免疫性疾病、之前用阻断pd-1/pd-l1通路的药物治疗、实体器官移植史、同时患有癌症(除非是温和的或不危及生命的)、或血液学癌症。
[0099]
研究目的:本研究的一个目的是表征西米普利单抗在复发性或转移性宫颈癌患者
diagnostics;az)进行pd-l1免疫组织化学染色。pd-l1评分报告为任何膜染色高于背景的肿瘤细胞的百分比(tc%)或任何强度的染色高于背景的肿瘤相关免疫细胞的百分比(ic%)。在计算肿瘤相关免疫细胞所占肿瘤面积的百分比(免疫细胞存在,icp)时,将任何处于混合炎症环境且不属于坏死的肿瘤相关免疫细胞包括在内。为了便于分析和解释,通过将分布组织成离散单元来确定组pd-l1表达的截止值和免疫细胞存在。
[0107]
在癌症基因组图谱(the cancer genome atlas,tcga)中绘制鳞状和非鳞状宫颈癌肿瘤的pd-l1 mrna表达。使用omicsoft arraystudio软件10.0.1.50版绘制宫颈癌肿瘤的每百万转录物(transcripts per million,tpm)。pd-l1 mrna表达结果整体基于tcga研究网(tcga research network)(https://www.cancer.gov/tcga)产生的数据。
[0108]
结果
[0109]
患者——每个扩展组群中登记十名患者。单一治疗组群和组合治疗组群的中位数年龄分别为55.0岁(范围,31.0-76.0)和51.5岁(范围,29.0-65.0)。两个组群的基线特征相似,汇总于表2中。十名患者有鳞状组织学,八名患者有腺癌,一名患者有腺鳞组织学,一名患者有粘液癌组织学。在数据截止时,在接受西米普利单抗单一治疗的患者中,一名患者完成了计划的治疗(48周),九名患者中断了治疗,主要是由于疾病进展或复发(n=8)。在接受西米普利单抗 hfrt的患者中,所有10名患者都中断了治疗,主要是由于疾病进展或复发(n=8)。
[0110]
表2.患者人口统计和基线特征
[0111][0112]a其他组织学为一名患者的腺鳞细胞癌和一名患者的粘液癌。
[0113]b化学/药理/治疗亚组规则对于接受西米普利单抗 hfrt的一名患者不可用。
[0114]
ecog,东部合作肿瘤学组;hfrt,高分次放射治疗。
[0115]
对于接受西米普利单抗单一治疗的患者,西米普利单抗施用剂量的中位数为4(范围,2.0-23.0),暴露的中位持续时间为8.1周(范围,4.0-48.4),随访的中位持续时间为5.6个月(范围,0.8-16.2)。对于接受西米普利单抗 hfrt的患者,西米普利单抗施用剂量的中位数为8(范围,1.0-17.0),暴露的中位持续时间为16.0周(范围,2.0-34.1),随访的中位持续时间为3.76个月(范围,0.7-8.1)。
[0116]
效力——每个组群中有一名患者(10%)经历部分响应,单一治疗组群响应者的持续时间为11.2个月,组合治疗组群响应者的持续时间为6.4个月。两位响应者均为鳞状组织学。辐照病变不包括在响应评估中。八名患者实现了稳定性疾病(sd)的最佳响应:单一治疗组群中有三名患者(30%),组合治疗组群中有五名患者(50%)(表3)。在这八名最佳响应为sd的患者中,有四名为鳞状组织学。持久性疾病控制(定义为≥105天无进展性疾病的患者比例)在接受西米普利单抗单一治疗的患者中为20.0%(95%ci:2.5-55.6),在接收西米普利单抗 hfrt的患者中为30.0%(95%ci:6.7-65.2)。关于肿瘤响应状况的其他临床活性结果总结于表3中。如果目标病变和新病变的测量值为基线的≤30%,则确定为部分响应(pr)。如果目标病变和新病变的测量值为最低测量值的≥20%,则确定为进展性疾病(pd)。
[0117]
表3.根据研究者评估的肿瘤响应
[0118][0119]
a ne响应包括缺失和未知的肿瘤响应。
[0120]b定义为有客观响应或稳定性疾病的患者比例。
[0121]c定义为有客观响应或稳定性疾病而至少16周没有进展的患者比例,至少测量105天以考虑方案中的时间表窗口(scheduling window)。
[0122]d基于每组有一名患者经历客观肿瘤响应。
[0123]
ci,置信区间;dor,响应持续时间;iqr,四分位数范围;ne,不可评估;orr,客观响应率。
[0124]
中位pfs的kaplan-meier估计在接受西米普利单抗单一治疗的患者中为1.9(95%ci:1.0-9.0)个月,在接受西米普利单抗 hfrt的患者中为3.6(95%ci:0.6-5.7)个月。中位os的kaplan-meier估计在接受西米普利单抗单一治疗的患者中为10.3(95%ci:2.1-不可评估[ne])个月,在接受西米普利单抗 hfrt的患者中为8.0(95%ci:1.7-ne)个月。
[0125]
安全性——在单一治疗组群和组合治疗组群中,分别有9名和10名患者报告了任何等级的teae,与治疗属性无关。最常见的teae为:组合起来在两个组群登记的患者中35%(7/20)腹泻,25%(5/20)疲劳,25%(5/20)低血钾。在接受西米普利单抗单一治疗的患者中,有四名(40.0%)患者经历等级≥3的teae。在接受西米普利单抗 hfrt的患者中,有四名(40.0%)患者经历等级≥3的teae。两个组群中都没有患者因teae而中断治疗。
[0126]
在接受西米普利单抗 hfrt的患者中报告了一例因肺炎的死亡,认为与治疗有关。然而,对患者结局有潜在影响的其他共病包括可能的弥漫性恶性肺部受累、可能影响舒张充盈血压的心包肿瘤、一般状况的下降,以及诸如烟草使用和慢性阻塞性肺病的病史因素。这名患者中被选择进行姑息性放射治疗(rt)的病变在心包上。在死于肺炎时,该患者的总体肿瘤响应是部分响应。另一名患者也经历了3级肺炎,这在包括类固醇和经验性抗生素的治疗下得到了缓解。一位有疲劳基线的患者经历了3级免疫相关的肌痛和2级免疫相关的甲状腺功能减退,并伴有间歇性2级和3级疲劳。肌痛用类固醇治疗得到缓解。表4总结了单一治疗组群中10%(1/10)的患者和组合治疗组群中30%(3/10)的患者发生的与治疗有关的teae(≥3级)。
[0127]
表4.与治疗有关的不良事件摘要
[0128][0129]a发生在任一组群的两个或更多个患者中的任何等级,或者在任何患者中≥3级;按西米普利单抗单一治疗组群中的总频率排序。
[0130]
宫颈癌中的蛋白质和pd-l1 mrna表达——鳞状组织学的患者发生响应的观察结果促使探索pd-l1表达与宫颈癌组织学之间的潜在联系。来自研究患者的样品不足,因此对其他来源的宫颈癌档案标本进行了询问。如表5中所示,在通过免疫组织化学分析的155个肿瘤样品中,69.8%(30/43)的腺癌和40%(45/112)的鳞状细胞癌样品中检测不到肿瘤pd-l1表达(《1%)。pd-l1在免疫细胞中的表达在30.2%(13/43)的腺癌中检测不到(《1%),而在鳞状细胞癌中则是4.5%(5/112)。综合富集分析表明,免疫细胞的存在以及肿瘤细胞和免疫细胞中pd-l1的表达均在鳞状细胞癌中比在腺癌肿瘤中更常见。
[0131]
表5.宫颈scc和腺癌中免疫细胞的存在以及肿瘤和免疫细胞中pd-l1的表达频率
[0132][0133]
pd-l1,程序化死亡配体-1;scc,鳞状细胞癌
[0134]
还在tcga样品中在mrna水平上探讨了宫颈癌中pd-l1表达与肿瘤组织学之间的潜在联系。pd-l1 mrna表达在鳞状宫颈癌样品比在非鳞状宫颈癌样品中更多。鳞状宫颈癌肿瘤(n=253)的pd-l1 mrna的tpm中位数和平均值分别为4.5和5.0。非鳞状宫颈肿瘤(n=53)的中位数和平均值分别为1.3和1.2(图1)。对选择的基因(pd-1、pd-l1、cd8a)表达的另外的tcga分析显示,宫颈癌与其他实体肿瘤类型聚类,抗pd-1治疗提高了总存活(os),例如黑素
瘤、非小细胞肺癌、肾透明细胞癌和头颈部鳞状细胞癌。
[0135]
讨论
[0136]
这些扩展组群的临床活性结果表明,西米普利单抗治疗在复发性或转移性宫颈癌患者中引起响应和临床益处。这支持了在西米普利单抗首次人体研究的剂量递增组群中观察到的临床活性信号,其中三名宫颈癌患者中有两名有持久性响应(papadopoulos等,clin cancer res(dec 2019)epub)。总数相当于i期研究登记的宫颈癌患者中17%的客观响应率(合并4/23;剂量递增组群中2/3的响应患者加上扩展组群中的2/20)。所有响应者均为鳞状组织学。这里观察到的安全性结果与西米普利单抗和其他pd-1/pd-l1轴抑制剂的其他研究中观察到的结果一致。在开始西米普利单抗治疗后加入hfrt,客观响应率(orr)没有明显改善。事实上,在后续剂量递增中对西米普利单抗 hfrt有客观响应的宫颈鳞状患者中,有一人在完成计划的治疗之后出现了疾病复发,并对西米普利单抗单一治疗的再治疗经历了完全响应。
[0137]
在我们对独立于i期试验的宫颈癌标本的分析中,高的pd-l1蛋白表达和免疫细胞存在两者的组合相对于腺癌在鳞状中富集。这些结果证实并扩展了先前的报告,其使用不同的抗pd-l1抗体并发现在鳞状宫颈癌样品中比在腺癌宫颈癌样品中更高的表达(heeren等,cancer immunol res 3(2015)48-58)。本实施例的研究通过报告在tcga宫颈癌样品中pd-l1mrna表达在鳞状样品中多于非鳞状样品而支持这些观察。在鳞状肿瘤中在蛋白质和mrna水平二者上的提高的pd-l1表达表明,鳞状宫颈癌和非鳞状宫颈癌的免疫逃避机制可能不同,并可能影响对免疫治疗的临床响应。鳞状组织学与非鳞状组织学中的pd-l1 mrna表达水平以前没有描述过。
[0138]
pd-1/pd-l1轴在鳞状宫颈癌中的重要性也得到用其他pd-1抑制剂的研究支持。在多组群研究keynote-158中,用派姆单抗的宫颈癌组群的orr为12.2%(12/98),观察到的12个响应中有11个是在鳞状组织学的患者中(papadopoulos等,clin cancer res(2019年12月)epub)。在checkmate 358,一项仅针对鳞状组织学患者的i/ii期研究中,用纳武单抗的宫颈癌中的客观响应率为26.3%(5/19)(naumann等,j clin oncol 37(2019)2825-2834)。另一项研究,其患者群体中60%为鳞状组织学,也报告了对纳武单抗的4%响应率(santin等,gynecol oncol 157(2020)161-166)。尽管这些观察结果在方向上与pd-1阻断在宫颈癌中的效力可能随鳞状组织学而分区的假设一致,但不可能从小的跨研究比较中得出结论。本数据以及在此综述的其他研究并不排除一些非鳞状宫颈癌患者也可能从免疫治疗中获益的可能性。
[0139]
尽管大多数复发性或转移性宫颈癌患者用pd-1阻断没有经历客观响应,但潜在的持久性响应(或持久的稳定性疾病)可能会导致有意义的存活益处。目前的研究太小,无法提供有力的os估计。
[0140]
在tcga中对选择的基因(pd-1、pd-l1、cd8a)的基因表达数据的分析表明,宫颈癌与其他实体肿瘤类型聚类,抗pd-1治疗提高了总存活,例如黑素瘤、非小细胞肺癌、肾透明细胞癌和头颈部鳞状细胞癌(trivedi等,clin adv hematol oncol 13(2015)858-868;ferris等,n engl j med 375(2016)1856-1867;lee等,cancer j 22(2016)92-95;chamoto等,int j clin oncol(2020);gellrich等,j clin med 9(2020)223;chae等,j immunother cancer 6(2018)39)。此外,对21种肿瘤类型的36个变量的tcga分析发现,cd8
t细胞丰度、pd-1基因表达和肿瘤突变负担是抗pd-1/pd-l1治疗的客观响应最有预测性的三个变量(lee等,jama oncol 5(2019)1614-1618)。这些变量中的两个(cd8 t细胞丰度、pd-1基因表达)与将宫颈癌与其他免疫治疗响应性肿瘤聚类的目前报告中的tcga分析一致。第三个变量(肿瘤突变负担)也可促成pd-1阻断对一些宫颈癌患者的效力。在对派姆单抗ii期研究的扩展组群的探索性分析中(keynote-158),宫颈鳞状细胞癌是其中高组织肿瘤突变负担(定义为》10个突变/兆碱基)与提高的效力有关的肿瘤类型之一(marabelle等,annals of oncology 30(2019)v477-v478)。因此,在此提出的tcga分析进一步支持将宫颈癌确定为西米普利单抗治疗应当是有益的肿瘤类型。
[0141]
一项针对二线或更大的转移性宫颈癌患者的随机iii期试验正在进行,比较西米普利单抗与研究者选择的化学治疗(nct03257267)。os的主要分析是分层次的,首先是鳞状组织学的患者,然后是所有患者(鳞状、腺癌或腺鳞组织学)。探讨了pd-l1表达、效力和组织学之间的关联。
[0142]
结论
[0143]
在对铂和紫杉烷双重化学治疗耐药或不耐受的复发性或转移性宫颈癌患者中,西米普利单抗表明与用其他pd-1抑制剂观察到的类似的临床益处和安全特性。西米普利单抗试验的结果与其他抗pd-1剂的数据相结合,表明效力与宫颈癌的组织学有关。此外,其他来源的宫颈癌标本的分析也间接支持了组织学与pd-1抑制效力之间的潜在联系,其中pd-l1蛋白和mrna表达在鳞状组织学中比在非鳞状组织学中更多。一项西米普利单抗与研究者选择的化学治疗的iii期随机试验正在进行,主要的总存活分层次分析首先在鳞状组织学的患者中进行。
[0144]
实施例2:西米普利单抗相对于化学治疗在复发性或转移性宫颈癌中的临床试验
[0145]
本研究是西米普利单抗相对于研究者选择(ic)化学治疗在患有含铂化学治疗之后进展的复发性或转移性宫颈癌的患者中的开放标签的随机化3期试验。
[0146]
研究目的
[0147]
本研究的主要目的是对于具有鳞状细胞癌(scc)组织学和具有任何符合条件的组织学的复发性或转移性宫颈癌患者,比较用西米普利单抗或研究者选择(ic)化学治疗进行治疗的os。在scc患者中以及在所有符合条件的组织学(scc、腺癌或腺鳞癌)中进行的研究的次要目的包括:(1)比较西米普利单抗相对于ic化学治疗的无进展存活(pfs);(2)按照实体瘤响应评价标准(recist)1.1比较西米普利单抗相对于ic化学治疗的客观响应率(orr)(部分响应[pr] cr);(3)比较西米普利单抗相对于ic化学治疗的响应持续时间(dor);(4)通过描述不良事件(ae)比较西米普利单抗相对于ic化学治疗的安全性谱;以及(5)使用欧洲癌症生活质量研究与治疗组织问卷核心30(eortc qlq-c30)比较经西米普利单抗相对于经ic化学治疗进行治疗的患者的生活质量(qol)。
[0148]
研究群体
[0149]
本研究正在招募患有在提供含铂化学治疗以治疗复发性或转移性宫颈癌之后进展的复发性、顽固性和/或转移性宫颈癌的≥18岁的女性。仅接受过先前基于铂的治疗并同时接受过针对局部疾病的放射治疗的患者不符合条件。
[0150]
患者群体的基本理由:本研究中的患者患有在含铂化学治疗之后进展的复发性或转移性宫颈癌。先前的研究确定了用铂 紫杉醇 贝伐单抗的方案对复发性或转移性宫颈癌
进行一线治疗的效力。(tewari等,n engl jmed,370(2014)734-743)。不存在二线环境中的标准护理方案。在这种环境中可以考虑的药剂为本研究中的ic选项:培美曲塞、拓扑替康、伊立替康、吉西他滨和长春瑞滨。尽管可使用多种化学治疗选项,但经这些药剂治疗宫颈癌的患者具有约7个月的中位存活时间。
[0151]
宫颈癌文献中已描述了“铂难治性”疾病的概念,它与先前铂治疗之后的时间有关。(nishino等,clin cancer res.,2016年8月;mclachlan等,clinical oncology 2016;tanioka等,cancer chemother pharmacol(2011)68:337
–
342)。然而,如果宫颈癌患者在复发性或转移性疾病的情况下已接受基于铂的化学治疗,则用基于铂的化学治疗对其进行重新治疗并不是典型的临床实践。本研究对照组中的化学治疗方案代表了在复发性或转移性疾病的情况下接受过先前铂的宫颈癌患者的目前治疗选项。无论先前铂治疗(用于复发性或转移性宫颈癌)与随后进展之间的时间间隔如何,这样的患者都具有尚未得到满足的医疗需求,并且适合考虑临床研究。在其他情况下提供的铂治疗(例如,作为治愈意图的治疗的一部分与放射治疗同时进行,在放射[或化学放射]之后作为具有无疾病证据的患者中的辅助治疗)不满足本研究中关于先前铂治疗的资格要求。
[0152]
术语“顽固性疾病”有时被用于指化学治疗之后从未有文件证明完全解决的疾病。对于这样的患者,一线治疗与患有复发性或转移性疾病的患者的一线治疗相同(即铂 紫杉醇
±
贝伐单抗)。作为本研究中的惯例,在本文中使用“顽固性疾病”这一术语的任何时候,患有顽固性疾病的患者都被认为包括在“复发性或转移性”疾病的类别中。
[0153]
研究群体将接受过先前紫杉醇和先前贝伐单抗,拒绝这样的治疗,或不适合这样的治疗(或者,在贝伐单抗的情况下,不起作用)。对于接受过先前紫杉醇和/或先前贝伐单抗的患者,在先前紫杉醇和/或贝伐单抗之后的任何时候的疾病进展都是停止紫杉醇和/或贝伐单抗的可接受原因。
[0154]
研究设计是西米普利单抗相对于ic化学治疗的随机化比较,以os为终点。对于其中没有广泛接受的护理标准以及其中随机化到安慰剂或最佳支持性护理组的患者群体被认为是不道德或不可行的,卫生当局已接受ic作为已导致基于os终点的监管批准的研究中的比较者(donoghue等,clin canc res,2012;18:1496-1505;ferris等,new engl j med,2016年10月epub)。在目前的研究中,由于西米普利单抗与ic选项之间方案的差异以及ae谱的差异(即,西米普利单抗的免疫相关不良事件[irae]和化学治疗的白细胞计数抑制),因此盲法是不实用的。
[0155]
总存活直接衡量临床益处,不存在偏差,并且不是替代终点。因此,选择os作为主要终点,并且这项开放标签的研究在患有在复发性或转移性疾病的情况下提供用含铂方案进行的先前治疗之后进展的宫颈癌的患者中比较了西米普利单抗相对于ic化学治疗。
[0156]
纳入标准:患者必须满足以下标准才有资格纳入本研究:(1)具有鳞状细胞组织学的复发性、顽固性和/或转移性宫颈癌,没有治愈意图的选项(在具有或不具有化学治疗的情况下手术或放射治疗)(注:根据原方案,具有腺癌和腺鳞癌组织学的患者也被招募);(2)用铂治疗进行治疗(必须用于治疗转移性、顽固性或复发性宫颈癌)之后的肿瘤进展或复发;(3)患者必须患有如recist 1.1所定义的可测量疾病。可测量疾病被定义为至少一个病变可以在至少一维(要记录的最长维度)上被准确测量。各个病变在通过计算机断层扫描(ct)、磁共振成像(mri)或临床检查的卡尺测量进行测量时,必须≥10mm,或者在通过胸部x
射线进行测量时必须≥20mm。在通过ct或mri进行测量时,淋巴结的短轴必须》15mm;(4)东部肿瘤合作组(eastern cooperative oncology group,ecog)表现状态≤1;(5)≥18岁;(6)肝功能:总胆红素≤1.5
×
正常上限(uln;如果肝转移则≤3
×
uln);转氨酶≤3
×
uln(或≤5.0
×
uln,如果肝转移的话);碱性磷酸酶≤2.5
×
uln(或≤5.0
×
uln,如果肝或骨转移的话);(7)肾功能:血清肌酐≤1.5
×
uln或估计的肌酐清除率》45ml/分钟;(8)骨髓功能:血红蛋白≥9.0g/dl;绝对中性粒细胞计数(anc)≥1.5
×
109/l;血小板计数≥75
×
109/l;(9)预期寿命期望》12周;(10)愿意并能够遵守门诊访视和研究相关程序;(11)提供签署的知情同意书;(12)能够理解并完成研究相关问卷;(13)患者必须满足以下关于先前贝伐单抗治疗的至少一个标准:(a)先前接受过含贝伐单抗的治疗,由于疾病进展而停止;(b)先前接受过含贝伐单抗的治疗,由于毒性而停止;(c)由于以下原因之一被认为不适合先前贝伐单抗治疗:(i)不可接受的瘘管形成风险;(ii)高血压控制不佳;(iii)根据moore标准的“低风险”疾病(tewari等,clin cancer res 2015;21(24));(d)拒绝先前贝伐单抗治疗;(e)由于后勤原因无法获得贝伐单抗治疗(例如,居住在患有宫颈癌的患者无法商购贝伐单抗的地区,或者没有贝伐单抗的保险覆盖;(14)患者必须满足以下关于先前紫杉醇治疗的至少一个标准:(a)先前接受过含紫杉醇的治疗,由于疾病进展而停止;(b)先前接受过含紫杉醇的治疗,由于毒性而停止;(c)由于以下原因之一被认为不适合先前紫杉醇治疗:(i)神经病变(ii)对紫杉醇或其组分过敏;(d)拒绝先前紫杉醇治疗。
[0157]
排除标准:满足任意以下标准的患者被排除在本研究之外:(1)需要用系统性免疫抑制性治疗进行治疗的显著自身免疫病的进行中或近期(5年内)的证据,这可能表明严重的irae的较高风险。以下不被排除在外:白癜风、已消退的儿童哮喘、1型糖尿病、仅需激素替代的残留甲状腺功能减退症,或不需要系统性治疗的银屑病;(2)用阻断pd-1/pd-l1通路的药剂进行的先前治疗;(3)用其他系统性免疫调节剂进行的先前治疗,其(a)在招募日期之前少于4周(28天)之内,或(b)与招募之前90天内任何等级的irae相关,或(c)与导致停止免疫调节剂的毒性相关。免疫调节的一些实例包括治疗性疫苗、细胞因子治疗(粒细胞集落刺激因子或促红细胞生成素除外)或靶向细胞毒性t淋巴细胞抗原4(ctla-4)、4-1bb(cd137)、pi 3-k-δ、lag3或ox-40的药剂;(4)可被认为是活跃的已知脑转移史(除非临床怀疑存在脑转移,否则不需要脑部筛查影像)。具有经先前治疗的脑转移的患者可以参与,前提是病变是稳定的(筛选期期间获得的影像持续至少6周没有进展的证据),没有新的脑转移或扩大的脑转移的证据,并且在研究药物(西米普利单抗或ic化学治疗)的第一剂量的4周内,患者不需要任何免疫抑制性系统性皮质类固醇的剂量来管理脑转移;(5)在研究药物(西米普利单抗或ic化学治疗)的第一剂量之前4周内的免疫抑制性皮质类固醇剂量(每日》10mg泼尼松或当量);(6)需要治疗的活动性细菌、病毒、真菌或霉菌感染,包括已知的人免疫缺陷病毒感染(hiv)、或者乙型肝炎病毒(hbv)或丙型肝炎病毒(hcv)的活动性感染;(7)过去5年内的肺炎史;(8)初始施用研究药物(西米普利单抗或ic化学治疗)的30天内或计划在研究期期间进行的任何抗癌治疗(化学治疗、靶向系统性治疗、光动力学治疗)、研究性或标准护理(接受双膦酸盐/酯类或地诺单抗的患者不被排除在外);(9)抗体治疗引起的有记录的变态反应或急性超敏反应史;(10)在研究药物(西米普利单抗或ic化学治疗)的第一计划剂量之日的3年内,除宫颈癌之外的并发性恶性肿瘤和/或除宫颈癌之外的恶性肿瘤史,转移或死亡风险可忽略的肿瘤除外,例如经充分治疗的皮肤鳞状细胞癌或皮肤基底细胞癌
或原位乳腺导管癌。患有恶性血液病(例如,慢性淋巴细胞白血病)的患者被排除在外;(11)研究者认为使患者无资格参与的任何急性或慢性精神病问题;(12)有实体器官移植史的患者(有先前角膜移植的患者可在与医学监测者讨论并获得其批准之后允许被招募);(13)研究者认为的由于高安全性风险和/或影响研究结果的解释的可能性而使患者不适合参与临床试验的任何医学共病、体检发现或代谢功能障碍或临床实验室异常;(14)怀孕或哺乳期女性;(15)在初始研究药物治疗之前、研究期间以及最后一个剂量之后至少6个月不愿意实施高效避孕的有生育潜力的女性。高效避孕措施包括:筛选之前稳定使用与开始2个或更多个月经周期的排卵抑制相关的组合的(含雌激素和孕激素)激素避孕(经口、阴道内、经皮)或仅孕激素的激素避孕(经口、可注射、可植入);宫内节育器;宫内激素释放系统;双侧输卵管结扎术;切除输精管的伴侣;和或性禁戒;(16)根据司法或行政当局发布的命令而致力于机构的患者排除在本研究之外;(17)用艾代拉利司进行的先前治疗;(18)初始施用研究药物(西米普利单抗或ic化学治疗)的30天内用活疫苗进行的先前治疗。在研究期间和研究药物的最后一个剂量之后的至少5个半衰期内,患者不能用活疫苗进行治疗;(19)初始施用研究药物的30天内对任何临床试验进行先前治疗的患者。非干预性试验和观察性试验是可接受的。
[0158]
研究变量
[0159]
本研究的主要终点为os,os被定义为从随机化到死亡日期的时间。未死亡的患者在最后已知的接触日期被删失。
[0160]
次要终点包括无进展存活(pfs)和总响应率(orr)。pfs被定义为从随机化到使用recist 1.1首次记录的肿瘤进展日期或由于任何原因的死亡日期的时间。orr被定义为具有确认的完全响应(cr)或部分响应(pr)的最佳总响应的患者数除以效力分析集中的患者数。最佳总响应被定义为随机化日期与首次客观记录的进展日期或随后抗癌治疗日期(以先到者为准)之间的最佳总响应。
[0161]
以下定义适用于目标病变:完全响应(cr)被定义为所有目标病变的消失;任何病理性淋巴结(无论是靶标还是非靶标)的短轴都必须减小至《10mm(《1cm)。部分响应(pr)被定义为目标病变的直径总和至少减小30%,以基线总和直径作为参照。进展性疾病(pd)被定义为目标病变的直径总和至少增大20%,以研究时的最小总和(这包括基线总和,如果其在研究时是最小的话)作为参照。除了20%的相对增大之外,所述总和还必须显示出至少5mm(0.5cm)的绝对增大。稳定疾病被定义为既没有足够的缩小而不符合pr也没有足够的增大而不符合pd,以研究时的最小总和直径作为参照。
[0162]
本研究的其他次要终点包括响应持续时间(dor)和生活质量(qol)。dor被定义为从首次响应(cr或pr)日期到首次记录的肿瘤进展(按照recist 1.1)日期或由于任何原因的死亡日期之间的时间。qol通过eortc qlq c30测量。另外的次要终点包括西米普利单抗的安全性和耐受性。为了评价西米普利单抗、ic化学治疗的安全性和耐受性,评估了ae、严重不良事件(sae)、死亡和实验室异常的发生率。
[0163]
研究设计
[0164]
在本研究中,约534名患者(其中436名具有鳞状细胞癌(scc)组织学)被随机化到实验性西米普利单抗治疗组或ic化学治疗对照治疗组。436名scc患者按1:1随机化(每个治疗组218名)。在实验组中,以350mg q3w的平剂量施用西米普利单抗。在对照组中,ic化学治
疗选项有4类:(1)抗叶酸剂培美曲塞;(2)拓扑异构酶1抑制剂-拓扑替康或伊立替康;(3)核苷类似物-吉西他滨;以及(4)长春花生物碱-长春瑞滨。对照组中允许的化学治疗处理仅为被列为ic选项的5种药物中的任意者。本研究中不允许这些类别中的其他药剂。图2提供了本研究设计的示意图。
[0165]
本研究包括3个时期:筛选、治疗和随访。筛选期从签署知情同意书(icf)开始。筛选期在患者被确认完全符合本研究并被随机化时结束,或者在确认患者不符合且筛查失败时结束。治疗期从随机化到其中一个治疗组的5天内开始。周期长度为6周,计划在第1至4个、第6个、第8个、第10个、第12个、第14个和第16个周期的第42天(
±
7天)进行肿瘤成像。计划的治疗长达96周。治疗期在患者停止研究治疗时结束。本研究中没有交叉。治疗期完成之后,患者进入随访期。随访期之后,对患者进行存活随访。在鳞状细胞患者中报告了第331次os事件之后,实施研究结束程序。
[0166]
根据表6中所示的方案向本研究中的患者提供治疗。
[0167]
表6:治疗
[0168][0169]
术语“研究产品”(研究药物)包括实验性治疗西米普利单抗处理和ic化学治疗处理。在本研究中,研究产品为:西米普利单抗(实验组);抗叶酸剂:培美曲塞(对照组中的ic选项);拓扑异构酶抑制剂:拓扑替康或伊立替康(对照组中的ic选项);核苷类似物:吉西他滨(对照组中的ic选项);以及长春花生物碱:长春瑞滨(对照组中的ic选项)。对照组中允许的化学治疗处理仅为以上被列为ic选项的5种药物中的任意者。本研究中不允许这些类别中的其他药剂。
[0170]
实验组治疗(西米普利单抗):将开放标签的西米普利单抗以液体供应在无菌的一次性小瓶中。每个小瓶包含浓度为50mg/ml的西米普利单抗。西米普利单抗在门诊环境中以30分钟iv输注施用。每位患者的剂量以350mg q3w的平剂量施用。准备好的输注袋应在室温下保存不超过6小时,或在2℃至8℃下保存不超过24小时。
[0171]
对照组治疗(研究者的选择):分配到对照组的患者接受研究者选择化学治疗选项之一,如下:抗叶酸剂:培美曲塞,每21天500mg/m
2 iv,治疗长达96周。根据培美曲塞的标准护理提供维生素b
12
和叶酸支持;拓扑异构酶1抑制剂:拓扑替康,每21天1mg/m2/天iv持续5天,治疗长达96周;或伊立替康,每周4次100mg/m
2 iv,然后休息10至14天,治疗长达96周;核苷类似物:吉西他滨,每21天在第1天和第8天1000mg/m
2 iv,治疗长达96周;长春花生物碱:长春瑞滨,每21天在第1天和第8天30mg/m
2 iv,治疗长达96周。对于ic选项,剂量是基于体重的。对于第1个周期/第1天,研究者应使用筛选时的身高和体重来计算剂量,但也允许使用第1个周期/第1天的体重,由研究者决定。在每个周期开始时测量体重。如果体重存在≥10%的变化,则应重新计算ic化学治疗剂量。
[0172]
程序和评估
[0173]
进行肿瘤成像(计算机断层扫描[ct]或磁共振成像[mri])以测量肿瘤负荷,并使用响应标准来表征研究治疗的效力谱。尽一切努力收集所有患者的存活数据,包括因任何原因从研究中撤出但未撤回同意收集存活信息的患者。
[0174]
进行体格检查、实验室测试、生命体征、心电图(ecg)、有生育潜力的女性的妊娠测试、以及ae和伴随药物的记录,以确保患者安全并表征研究治疗的安全性谱。
[0175]
其他评估包括:药代动力学(pk)的血液样品;评估抗西米普利单抗抗体的血液样品;生物标志物(血清、血浆、肿瘤组织);外周血单个核细胞;和生活质量评估。
[0176]
筛选访视时执行的程序:执行以下程序仅为了确定研究资格或表征基线群体:血清β-hcg(结果必须是在第一剂量之前≤72小时的);hbv、hcv和hiv筛查:乙型肝炎表面抗原、丙型肝炎阳性rna(丙型肝炎抗体测试呈阳性将需要进行丙型肝炎rna测试以排除活动性感染)、hiv-1或hiv-2血清抗体;宫颈癌(仅鳞状细胞组织学)的病理证实记录;以及病理材料(福尔马林固定、石蜡包埋[ffpe]块或来自提交的病理报告中的样品的20个载片)。
[0177]
效力程序:对于所有患者,根据recist 1.1标准对疾病进行放射学测量。在筛选时、治疗期间和随访期间进行用于肿瘤评估的ct或mri。在治疗期期间,在第1至4个、第6个、第8个、第10个、第12个、第14个和第16个周期结束时进行肿瘤响应评估。在随访期间,在第1次和第2次随访访视时进行肿瘤响应评估。选择通过ct还是mri成像是研究者的决定。一旦选择了ct扫描或mri,后续评估就应尽可能使用相同的方式进行。全身(胸部/腹部/骨盆)成像在基线评估时进行,并且强烈建议在每次响应评估时进行。在颈部有转移的患者中应进行颈部ct或mri。至少应在每次响应评估时对所有放射学上可测量的目标病灶(recist1.1)进行成像。每次响应评估时应使用相同的放射学成像方式。对于有脑转移史的患者或临床怀疑有脑转移的患者,在筛选期进行脑成像-使用钆的脑mri(如果mri不可行,则进行使用造影剂的脑ct)。本研究中招募的具有“不活跃”的脑转移的患者应在每次响应评估时进行脑成像,或者如果临床怀疑治疗期间脑转移恶化,则应更早进行。
[0178]
生活质量问卷:患者报告的结果是使用有效的患者自我管理的eortc qlq c30问卷来测量的。在给定的研究访视中(在研究期/治疗期和随访期期间)进行任何研究程序之
前,要求患者完成这些问卷。
[0179]
伴随用药和程序
[0180]
从知情同意的时间到最后一次研究治疗之后90天,除抗癌治疗之外所施用的任何治疗都被认为是伴随治疗。这包括在研究之前开始施用并在研究期间继续的用药和其他治疗,以及在随访期开始以处理与研究药物有关的ae的任何治疗。
[0181]
禁止的用药和程序:在参与本研究时,患者不得接受除随机化分配的治疗(西米普利单抗或ic化学治疗)之外的任何抗癌治疗。在研究期间和研究药物的最后一个剂量之后的5个半衰期内,患者不得接受活疫苗。研究者可决定可以给予任何其他被认为对患者幸福有必要且预期不干扰分配的治疗(西米普利单抗或ic化学治疗)的评价的药物。使用系统性皮质类固醇(皮质类固醇替代物除外)的免疫抑制性剂量(》10mg/天泼尼松或当量)的患者不符合本研究的资格。对于西米普利单抗组的患者,建议患者在整个研究的任何时候都不要接受系统性皮质类固醇,例如氢化可的松、泼尼松、泼尼松龙或地塞米松除非在危及生命的紧急情况时和/或用于治疗irae。
[0182]
允许的用药和程序。系统性皮质类固醇的生理学替代剂量是允许的,即使》10mg/天的泼尼松当量也是如此。皮质类固醇的短期疗程用于预防(例如,造影剂变态反应)或用于治疗非自身免疫性病症(例如,由接触性过敏原引起的迟发型超敏反应)是允许的。
[0183]
在实验组或对照组中,放射治疗都不是研究方案的一部分。计划进行放射治疗的患者不符合条件。如果在研究过程期间,患者发展了症状性病变,研究者认为针对该症状性病变,姑息性放射治疗是适当的,则该症状性病变被视为pd,并且通常该患者将从研究中去除。在某些情况下,在至少进行了24周研究的患者中可允许姑息性放射治疗。本研究中仅允许对非目标病变进行姑息性放射。
[0184]
结果
[0185]
预期施用西米普利单抗会导致患有具有scc组织学的宫颈癌的患者中的肿瘤消退增强。预期这样的患者表现出更大的部分响应和完全响应,以及显著提高的总存活和总响应率。还预期,与在具有腺癌组织学的宫颈癌患者中观察到的情况相比,在具有scc组织学的宫颈癌患者中将在甚至更大的程度上实现这样的益处。
[0186]
实施例3:西米普利单抗相对于化学治疗在≥二线(2l)宫颈癌中的3期研究结果
[0187]
本实施例提供了从实施例2中描述的临床试验中获得的结果。本实施例中描述的研究包括总共608名对基于铂的化学治疗具有抗性的转移性宫颈癌患者(477名患有鳞状细胞癌(scc);131名患有腺癌(ac)),其中东部肿瘤合作组(ecog)表现状态为0或1。本研究的主要终点为总存活(os)。次要终点包括无进展存活(pfs)、总响应率(orr)/响应持续时间(dor)、安全性和生活质量。
[0188]
用以下中的任一者对患者进行治疗:(i)西米普利单抗,350mg iv q3w或(ii)选自培美曲塞、吉西他滨、拓扑替康(或伊立替康)、或长春瑞滨的研究者选择(ic)化学治疗。这是90%功效研究。用西米普利单抗进行治疗的患者的中位os为12个月,以及用化学治疗进行治疗的患者的中位os为8.5个月。每个统计学设计的风险比(hr)为0.70。最终分析的统计学显著性的最小hr为0.80。第二中期(85%事件)中的统计学显著性的最小hr为0.77。
[0189]
如表7所汇总的,人口统计对于总群体来说是平衡的,表7提供了具有scc和非scc
组织学的患者的人口统计和基线特征(全分析集)。本研究的总患者群体的中位年龄51.0代表了现实世界的宫颈癌患者年龄。无论pd-l1表达状态如何,患者都允许被招募。
[0190]
表7:患者人口统计
[0191]
[0192]
所有患者的治疗暴露持续时间都为约20周。结果显示,与化学治疗相比,西米普利单抗提供了显著优势(表8至表10),特别是在宫颈癌患者(包括具有scc和非scc组织学的患者)的总存活方面(表8)。
[0193]
表8:总存活(os)结果
[0194][0195]
表9:无进展存活(pfs)结果
[0196][0197]
表10:总响应率(orr)结果
[0198][0199]
如表11和表12(针对具有scc和非scc组织学的患者的安全性分析集)所汇总的,治疗伴发不良事件(teae)与西米普利单抗的已知安全性谱一致,并且优于化学治疗安全性谱。未观察到新的安全性体征。
[0200]
表11:teae汇总
[0201][0202]
表12:teae-总群体(西米普利单抗中的所有等级≥10%),没有新的安全性体征
[0203]
按优选术语和nci等级划分的所有治疗伴发不良事件
[0204]
(安全性分析集)
[0205]
具有scc和非scc组织学的患者
[0206][0207]
上述结果显示,与化学治疗相比,西米普利单抗显著降低了患有二线复发性或转移性宫颈癌的患者的死亡风险。这是在晚期宫颈癌中进行的最大的随机化3期临床试验。西米普利单抗是首个在3期试验中证明在患有基于铂的化学治疗进展之后的复发性或转移性宫颈癌的女性中的总存活益处的药物。
[0208]
与化学治疗相比,西米普利单抗将死亡风险降低了31%(hr=0.69;ci:0.56至0.84,p=0.003)。接受西米普利单抗的患者(n=304)的中位存活为12个月,相比之下,接受化学治疗的患者(n=304)的中位存活为8.5个月。未观察到新的西米普利单抗安全性体征。
[0209]
复发性或转移性宫颈癌众所周知难以治疗,并且没有一线化学治疗之后的护理标准。该试验显示,西米普利单抗帮助患有复发性或转移性宫颈癌的患者在化学治疗失败之后活得更久,无论其pd-l1状态如何。
[0210]
实施例4:西米普利单抗相对于化学治疗在复发性或转移性宫颈癌中的3期研究结果
[0211]
本实施例提供了相对于实施例3中所示的结果更新的结果,并且从实施例2中描述的临床试验中获得。本实施例中描述的研究包括总共608名患有在一线基于铂的化学治疗之后进展的复发性或转移性宫颈癌的女性。无论pd-l1表达状态如何,患者都被招募,并且每3周接受西米普利单抗350mg静脉注射或研究者选择(ic)化学治疗,长达96周。ic化学治疗选项为培美曲塞、长春瑞滨、吉西他滨、伊立替康或拓扑替康。患者按组织学(鳞状细胞癌(scc)/腺癌或腺鳞癌(ac))分层。患者人口统计示于表13中。
[0212]
表13:总群体中的患者人口统计和基线特征的汇总(全分析集)
[0213]
[0214][0215]
本研究的主要目的是比较西米普利单抗与ic化学治疗对具有鳞状细胞癌(scc)组织学的患者群体和再者具有任何符合条件的组织学(scc或腺癌/腺鳞癌[ac])的总群体的总存活(os)。在scc患者和总群体(scc和ac)中进行的研究的次要目的是比较西米普利单抗与ic化学治疗的scc的无进展存活(pfs)、生活质量(qol)、scc的客观响应率(orr)、总群体的pfs和orr、以及安全性谱。当大约85%的事件发生在scc患者中时,安排中期分析。
[0216]
结果:608名患者是随机化的:中位年龄:51岁[范围22至87];组织学:477名scc,131名ac;ecog表现评分:0[46.5%],1[53.5%]。中位西米普利单抗暴露为15周(范围:1.4至100.7)。在中期分析时,总群体中西米普利单抗(n=304)相对于ic化学治疗(n=304)的中位os分别为12.0个月相对于8.5个月;死亡风险比(hr)为0.69;95%置信区间(ci)为0.56至0.84;p《0.001。
[0217]
在scc群体中,西米普利单抗组中的os显著长于化学治疗组。具体地,西米普利单抗(n=239)相对于ic化学治疗(n=238)的中位os为11.1个月相对于8.8个月;死亡hr为0.73;95%ci为0.58至0.91;p=0.003。在scc群体中,西米普利单抗组中的pfs显著优于化学治疗组:风险比=0.71(95%ci:0.58,0.86);单侧p=0.00026。西米普利单抗组中的估计
的中位pfs为2.8个月,相比之下,化学治疗组为2.9个月。scc中全球健康状况/生活质量(ghs/qol)从基线的总平均变化:从基线的平均变化的估计的差异(西米普利单抗-化学治疗)为8.49(95%ci:3.77,13.21);单侧p=0.00025;西米普利单抗比化学治疗更具统计学显著性并且更有利。图3中示出了总群体中ghs/qol从基线的平均变化。在总群体中,西米普利单抗相对于化学治疗具有更有利的令人满意的显著性差异。接受西米普利单抗的患者的ghs/qol从基线得到改善或保持。接受化学治疗的患者通常显示出这些评分的劣化。
[0218]
scc中身体机能从基线的总平均变化:从基线的平均变化的估计的差异(西米普利单抗-化学治疗)为8.35(95%ci:4.08,12.62);单侧p=0.00008;西米普利单抗比化学治疗更具统计学显著性并且更有利。scc中的orr:西米普利单抗组中的orr显著高于化学治疗组:17.6%(95%ci:13.0至23.0)相对于6.7%(95%ci:3.9至10.7),单侧p=0.00014。
[0219]
在ac群体中,西米普利单抗(n=65)相对于ic化学治疗(n=66)的中位os为13.3个月相对于7.0个月;hr为0.56;95%ci为0.36至0.85;p《0.005(标称p值)。总群体和scc群体中的pfs和orr,以及scc群体中从基线qol的平均变化都是西米普利单抗更有利。ac中的pfs:hr=0.91(95%ci:0.62,1.34)。西米普利单抗组中的中位pfs为2.7个月,相比之下,化学治疗组为2.8个月。ac中的orr:西米普利单抗组中的orr为12.3%(95%ci:5.5至22.8),相比之下,化学治疗组为4.5%(95%ci:0.9至12.7)。
[0220]
西米普利单抗相对于ic化学治疗最常见的任意等级的治疗伴发不良事件(ae)为贫血(25%相对于45%)、恶心(18%相对于33%)和呕吐(16%相对于23%)。8%的西米普利单抗患者和5%的ic化学治疗患者中发生因ae而停止。表14至15中提供了安全性汇总。
[0221]
表14
[0222][0223]
安全性在接受任意研究治疗的所有随机患者中进行分析。ae,不良事件。
[0224]
表15
[0225][0226]
pd-1/pd-l1抑制剂类不存在未充分描述的免疫相关ae。
[0227]
在总群体中,关于os,在两个治疗组中效力分析都包括304名患者。西米普利单抗组的中位随访(从随机化到数据截止日)为17.9个月,相比之下化学治疗组为18.3个月。西米普利单抗组中的os显著长于化学治疗组:风险比=0.69(95%ci:0.56,0.84);单侧p=0.00011。西米普利单抗组中的估计的中位os为12.0个月,相比之下化学治疗组为8.5个月。总群体中的pfs:西米普利单抗组中的pfs显著优于化学治疗组:风险比=0.75(95%ci:0.63,0.89);单侧p=0.00048。西米普利单抗组中的估计的中位pfs为2.8个月,相比之下化学治疗组为2.9个月。总群体中的orr:西米普利单抗组中的orr显著高于化学治疗组:16.4%相对于6.3%,单侧p=0.00004。
[0228]
统计学方法:使用kaplan-meier存活曲线对os这一主要终点进行汇总,并通过在scc和ac中按地理区域(北美相对于亚洲相对于row)的随机化分层因素,以及在总群体中按组织学(scc相对于ac)和地理区域的随机化分层因素进行分层,使用对数秩检验在两个治疗组之间进行比较。具有双侧95%置信区间的风险比由分层cox比例风险模型得出,其中在
分层对数秩检验中使用相同的分层因素。使用与关于scc、腺癌和总群体的os的主要分析所描述的相同的统计学方法来分析pfs。按与关于scc、ac和总群体的os分析中使用的相同分层因素进行分层使用cochran-mantel-haenszel检验来分析orr。通过clopper-pearson法计算每个治疗组的orr和对应的95%确切ci。
[0229]
qol:使用重复测量的混合模型(mmrm)分析每次pro评估时ghs/qol和pf量表从基线的纵向变化。这些量表的评分越高表示健康状况/机能越好。给予每次访视相同的权重,对西米普利单抗与ic化学治疗的经总体调整的平均估计值、以及第2个周期时的经调整的平均估计值进行了成对比较。该模型针对每个pro评估产生了从基线的平均变化的最小二乘(ls)平均估计值、标准误差、95%ci和p值(在适用的情况下)。
[0230]
os结果示于表16至表19和图4至图6中。
[0231]
表16:总群体中的总存活,亚组分析
[0232][0233]
*按地理区域(北美相对于亚洲相对于row/iwrs)和组织学(scc相对于ac/iwrs)而不是地理区域、组织学亚组(西米普利单抗相对于化学治疗)分层。地理区域按组织学(scc
相对于ac/iwrs)分层。组织学按地理区域(北美相对于亚洲相对于row/iwrs)(西米普利单抗相对于化学治疗)分层。ac,腺癌或腺鳞癌;ci,置信区间;ecog,东部合作肿瘤组;iwrs,交互网络响应系统;row,世界其他地区;r/m,复发性或转移性;scc,鳞状细胞癌。
[0234]
表17:总群体中的总存活(os)(全分析集)
[0235][0236]
表18:scc群体中的总存活(os)(全分析集)
[0237][0238]
表19:腺癌患者中的总存活(全分析集)
[0239][0240]
pfs结果示于表20至表22和图7至图9中。
[0241]
表20:总群体中的无进展存活(全分析集)
[0242]
[0243][0244]
表21:scc患者中的无进展存活(全分析集)
[0245][0246]
表22:腺癌患者中的无进展存活(全分析集)
[0247][0248]
orr结果在表23至25中示出。
[0249]
表23:整个群体中的客观响应率(全分析集)
[0250][0251]
表24:scc患者中的客观响应率(全分析集)
[0252][0253]
表25:腺癌患者中的客观响应率(全分析集)
[0254][0255]
qol和身体机能结果在表26至29中示出
[0256]
表26:来自scc患者中的eortc qlq-c30 ghs/qol基线的变化的最小二乘均值估计(全分析集)
[0257][0258]
表27:来自ssc患者中的eortc qlq-c30身体机能基线的变化的最小二乘均值估计-fas
[0259][0260]
表28:来自整个群体中的eortc qlq-c30ghs/qol基线的变化的最小二乘均值估计-fas
[0261][0262][0263]
表29:来自整个群体中的eortc qlq-c30身体机能基线的变化的最小二乘均值估计-fas
[0264]
[0265][0266]
在每个治疗周期(最多16个)的基线和第1天时,向患者施用eortc qlq-c30。混合效应重复测量模型估计了来自所有量表中基线的最小二乘(ls)均值变化。响应者分析根据qlq-c30确定了的临床上有意义(使用10分阈值)的改善或劣化或稳定性的比例。根据统计层级对scc和整个群体报道结果;对ac组给出了事后分析。
[0267]
基线评分显示,整个治疗组中具有极小差异的中度至高度机能和轻度至中度症状负担。ls中的显著差异意味着有利于观察西米普利单抗的qlq-c30 ghs/qol、身体机能量表和其他功能和症状量表(表30)。对角色功能、疼痛和食欲减退的估计治疗效果超过了临床上有意义的阈值。更多接受西米普利单抗的患者在ghs/qol、功能和大多数症状量表中经历了临床上有意义的改善/维持。在患有复发性或转移性宫颈癌的患者中,西米普利单抗相对于化学治疗在维持/改善ghs/qol、身体机能和大多数症状方面提供了显著的益处。
[0268]
表30:在来自基线的变化的ls均值中的总体差异(95%ci)a[0269][0270]
在整个群体中,用西米普利单抗治疗的那些(n=304)与化学治疗(n=304)相比在os、pfs和orr方面经历了显著改善,包括:(i)死亡风险降低31%([hr:0.69;95%ci:0.56至0.84;单侧p=0.0011);(ii)疾病进展风险降低25%(hr=0.75;95%ci:0.63至0.89;单侧p=0.00048);和(iii)16%orr(50名患者;95%ci:13%至21%;单侧p=0.00004),相比之下
化学治疗(19名患者)为6%,其中响应的中位持续时间根据kaplan-meier估计,西米普利单抗为16个月(95%ci:12个月至尚不可评价)和化学治疗为7个月(95%ci:5至8个月)。
[0271]
在这项研究中,78%的患者患有归类为scc的晚期宫颈癌。在这个亚群中,在西米普利单抗(n=239)的情况下与化学治疗(n=238)相比也发现了显著改善,包括:(i)死亡风险降低27%(hr:0.73;95%ci:0.58至0.91;单侧p=0.00306);(ii)疾病进展风险降低29%(hr=0.71;95%ci:0.58至0.86;单侧p=0.00026);和(iii)18%orr(42名患者;95%ci:13%至23%),相比之下化学治疗(16名患者;95%ci:6%至23%)为7%。
[0272]
尽管腺癌的评估不是预指定的终点,但事后分析表明了经西米普利单抗治疗的患者(n=65)与化学治疗(n=66)相比的结果,包括:(i)死亡风险降低44%(hr:0.56;95%ci:0.36至0.85;标称单侧p<0.005);(ii)疾病进展风险降低9%(hr=0.91;95%ci:0.62至1.34);和(iii)12%orr(8名患者;95%ci:6%至23%),相比之下化学治疗(3名患者;95%ci:1%至13%)为5%。
[0273]
另外,经西米普利单抗治疗的患者通常能够改善或维持其基线ghs/qol,然而用化学治疗的那些经历了在第8个周期前劣化变成临床上有意义的,根据eortc qlq-c30(总体估计的结果[标准误差]:西米普利单抗1.01[1.54]的改善,化学治疗-6.81[2.12]的恶化;差值:7.81;单侧标称p=0.00040)。
[0274]
没有新的西米普利单抗安全性信号观察到。对接受至少1剂的研究治疗的患者进行安全性评估:300名患者在西米普利单抗组(暴露的中位持续时间:15周;范围:1至101周)中和290名患者在化学治疗组(暴露的中位持续时间:10周;范围:1至82周)中。ae在88%的西米普利单抗患者和91%的化学治疗患者中观察到,在15%或更多西米普利单抗患者中出现的ae是贫血(25%西米普利单抗,45%化学治疗)、恶心(18%西米普利单抗,33%化学治疗)、疲劳(17%西米普利单抗,16%化学治疗)、呕吐(16%西米普利单抗,23%化学治疗)、食欲降低(15%西米普利单抗,16%化学治疗)和便秘(15%西米普利单抗,20%化学治疗)。3级或更高的ae在45%的西米普利单抗患者和53%的化学治疗患者中出现。在15%或更多患者中的ae中,在西米普利单抗组中更通常出现的3级或更高的ae包括无力(2%西米普利单抗,1%化学治疗)和发热(小于1%西米普利单抗,0%化学治疗)。免疫相关的ae在16%的西米普利单抗患者和少于1%的化学治疗患者中观察到,分别为6%和少于1%是3级或更高。因ae在9%的西米普利单抗患者和5%的化学治疗患者中出现时则中止。
[0275]
结论:西米普利单抗单一治疗比研究者选择化学治疗在整个群体以及患有在≥2l设置的含铂的化学治疗之后已进展的复发性或转移性宫颈癌的患者scc和ac亚群二者中的os、pfs和orr方面产生了统计学上显著的改善。在患有鳞状细胞癌组织学的患者中,在来自总体健康状态/生活品质和身体机能中的基线的总体均值变化中的统计学上显著的差异,与研究者选择化学治疗相比,有利于西米普利单抗。另外,来自基线ghs/qol的总体均值变化有利于整个群体(标称p《0.001)和scc患者(p《0.001)中的西米普利单抗。西米普利单抗的毒性谱比化学治疗的毒性谱更有利(更少的任何级别并且≥3级的teae),并且与已知的西米普利单抗的安全性谱一致。
[0276]
总之,这项登记无论pd-l1表达状态如何的患者的研究,表明了西米普利单抗是对患有二线晚期宫颈癌的女性高度有效的治疗,这些女性面临预后较差并且治疗选择有限。在整个群体中西米普利单抗与化学治疗相比表明了患有在经化学治疗进展之后的晚期宫
worldwide for 36 cancers in 185countries,ca cancer j clin 68(2018)394-424.
[0283]
[2]r.burk,z.chen,c.saller,t.c.g.a.r.network,integrated genomic and molecular characterization of cervical cancer,nature 543(2017)378-384.
[0284]
[3]c.marth,f.landoni,s.mahner,m.mccormack,a.gonzalez-martin,n.colombo,e.g.committee,cervical cancer:esmo clinical practice guidelines for diagnosis,treatment and follow-up,ann oncol 28(2017)iv72-iv83.
[0285]
[4]k.s.tewari,m.w.sill,h.j.long iii,r.t.penson,h.huang,l.m.ramondetta,l.m.landrum,a.oaknin,t.j.reid,m.m.leitao,improved survival with bevacizumab in advanced cervical cancer,n engl j med 370(2014)734-743.
[0286]
[5]d.lorusso,g.ferrandina,s.pignata,m.ludovisi,r.vigano,s.scalone,p.scollo,e.breda,a.peitragalla,g.scambia,evaluation of pemetrexed(alimta,ly231514)as second-line chemotherapy in persistent or recurrent carcinoma of the cervix:the cervix 1 study of the mito(multicentre italian trials in ovarian cancer and gynecologic malignancies)group,ann oncol 21(2010)61-66.
[0287]
[6]d.s.miller,j.a.blessing,d.c.bodurka,a.j.bonebrake,j.o.schorge,evaluation of pemetrexed(alimta,ly231514)as second line chemotherapy in persistent or recurrent carcinoma of the cervix:a phase ii study of the gynecologic oncology group,gynecol oncol 110(2008)65-70.
[0288]
[7]a.m.heeren,b.d.koster,s.samuels,d.m.ferns,d.chondronasiou,g.g.kenter,e.s.jordanova,t.d.de gruijl,high and interrelated rates of pd-l1 cd14 antigen-presenting cells and regulatory t cells mark the microenvironment of metastatic lymph nodes from patients with cervical cancer,cancer immunol res 3(2015)48-58.
[0289]
[8]l.deng,h.liang,b.burnette,m.beckett,t.darga,r.r.weichselbaum,y.x.fu,irradiation and anti-pd-l1 treatment synergistically promote antitumor immunity in mice,j clin invest 124(2014)687-695.
[0290]
[9]k.p.papadopoulos,m.l.johnson,a.c.lockhart,k.moore,g.s.falchook,s.c.formenti,a.naing,r.d.carvajal,l.s.rosen,g.j.weiss,r.s.leidner,j.li,a.paccaly,m.feng,e.stankevich,i.lowy,m.g.fury,m.r.crittenden,first-in-human study of cemiplimab alone or in combination with radiotherapy and/or low-dose cyclophosphamide in patients with advanced malignancies,clin cancer res 26(2020)1025-1033.
[0291]
[10]r.w.naumann,a.hollebecque,t.meyer,m.-j.devlin,a.oaknin,j.kerger,j.m.lopez-picazo,j.-p.machiels,j.-p.delord,t.r.j.evans,v.boni,e.calvo,s.l.topalian,t.chen,i.soumaoro,b.lin,j.gu,r.zwirtes,k.n.moore,safety and efficacy of nivolumab monotherapy in recurrent or metastatic cervical,vaginal,or vulvar carcinoma:results from the phase i/ii checkmate 358 trial,j clin oncol 37(2019)2825-2834.
[0292]
[11]a.d.santin,w.deng,m.frumovitz,n.buza,s.bellone,w.huh,s.khleif,
h.a.lankes,e.s.ratner,r.e.o
′
cearbhaill,a.a.jazaeri,m.birrer,phase ii evaluation of nivolumab in the treatment of persistent or recurrent cervical cancer(ncto2257528/nrg-gy002),gynecol oncol 157(2020)161-166.
[0293]
[12]m.trivedi,b.hoffner,j.winkelmann,m.abbott,o.hamid,r.d.carvajal,programmed death 1 immune checkpoint inhibitors,clin adv hematol oncol 13(2015)858-868.
[0294]
[13]r.l.ferris,g.blumenschein jr,j.fayette,j.guigay,a.d.colevas,l.licitra,k.harrington,s.kasper,e.e.vokes,c.even,nivolumab for recurrent squamous-cell carcinoma of the head and neck,n engl j med 375(2016)1856-1867.
[0295]
[14]c.h.lee,r.j.motzer,immune checkpoint therapy in renal cell carcinoma,cancer j 22(2016)92-95.
[0296]
[15]k.chamoto,r.hatae,t.honjo,current issues and perspectives in pd-1 blockade cancer immunotherapy,int j clin oncol(2020).
[0297]
[16]f.f.gellrich,m.schmitz,s.beissert,f.meier,anti-pd-1and novel combinations in the treatment of melanoma
‑‑
an update,j clin med 9(2020)223.
[0298]
[17]y.k.chae,a.arya,w.lams,m.r.cruz,s.chandra,j.choi,f.giles,current landscape and future of dual anti-ctla4 and pd-1/pd-l1 blockade immunotherapy in cancer;lessons learned from clinical trials with melanoma and non-small cell lung cancer(nsclc),j immunother cancer 6(2018)39.
[0299]
[18]j.s.lee,e.ruppin,multiomics prediction of response rates to therapies to inhibit programmed cell death 1 and programmed cell death 1 ligand 1,jama oncol 5(2019)1614-1618.
[0300]
[19]a.marabelle,m.g.fakih,j.lopez,m.shah,r.shapira-frommer,k.nakagawa,h.c.chung,h.l.kindler,j.a.lopez-martin,w.miller,a.italiano,s.kao,s.a.piha-paul,j.p.delord,r.r.mcwilliams,d.aurora-garg,m.chen,f.jin,k.norwood,y.j.bang,1192o-association of tumour mutational burden with outcomes in patients with select advanced solid tumours treated with pembrolizumab in keynote-158,annals of oncology 30(2019)v477-v478.
[0301]
[20]h.kim,j.-h.chung,pd-l1 testing in non-small cell lung cancer:past,present,and future,j pathol transl med 53(2019)199-206.
[0302]
本公开内容的范围不受本文中描述的特定实施方案的限制。实际上,通过前面的描述和附图,除本文中描述的那些之外的本发明的多种修改对于本领域技术人员来说将变得明显。这样的修改旨在落入所附的权利要求书的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。