一种可操作切断的dna编码苗头化合物的鉴定方法
技术领域
1.本发明属于药物筛选领域,具体涉及一种基于液质联用的可操作切断的dna编码苗头化合物的鉴定方法。
背景技术:
2.dna编码化合物库(dnaencoded library,del)作为新型药物先导化合物发现的重要手段,正逐步发展为药物发现的重要推动力。del的优势在于短时、高效地完成上亿甚至十亿百亿级别的分子库构建和筛选,在新药发现中展现出时间优势和成本优势(wo2005058479、wo2018166532、cn103882532)。
3.传统确定dna编码苗头化合物是基于测序数据以生物信息学计算筛选富集值,然后参照合成历史并对应至相应的分子砌块的组合信息,从而确定高可信度的靶点结合dna编码苗头化合物。然而,该筛选过程可能存在以下不足:(1)由于dna片段比较长,在一定程度上会影响小分子与靶点蛋白之间的作用,因此重合成的苗头化合物与目标靶点之间不一定具有相互作用;(2)del的合成是通过组合化学的方式在短时内获得大量的分子,过程中中间产物的残留与副产物的生成无法在每一步的合成后完全被纯化去除,因此del的最终产品包含了合成路线所生成的所有分子。这些分子在于靶点蛋白孵育的过程中,均有同样几率与靶点蛋白发生结合。因此,del合成中的中间产物与副产物,其dna端仍可以通过连接获得完整的dna链信息,从而导致针对合成路线中的某一del分子,其最终产物、中间产物与副产物都被标记了同一条dna序列的信息,在筛选,测序直至数据分析结束后,不能精确定位与靶点蛋白结合的化合物结构。
技术实现要素:
4.针对上述存在的问题,本发明提供了一种可操作切断的dna编码苗头化合物鉴定方法,能够精确鉴定出与靶点蛋白结合的小分子苗头化合物,避免dna的存在影响最终检测结果的可靠与真实性。
5.一种可操作切断的dna编码苗头化合物的鉴定方法,该方法包括以下步骤:
6.(1)带有可切断基团的dna编码苗头化合物的合成:针对靶点蛋白dna编码化合物库筛选数据信号,按照其富集度由高到低进行排序,确定潜在的dna编码苗头化合物的分子序列信息及合成路径,并以所述合成路径在带有可切断基团的dna上对所有潜在的dna编码苗头化合物进行合成;
7.(2)苗头化合物的释放:将上述带有可切断基团的dna编码苗头化合物进行切断操作,然后分离dna与苗头化合物,得到不含dna的苗头化合物;
8.(3)将不含dna的苗头化合物样本进行亲和力筛选:
9.筛选样本的准备:使用筛选缓冲溶液配制所述不含dna的苗头化合物的筛选前样本;实验组将筛选前样本与靶点蛋白、固定蛋白所用磁珠进行共同孵育;参照组将筛选前样本与固定蛋白所用磁珠进行孵育;再使用洗脱缓冲液对实验组与参照组进行洗涤,洗脱,分
别收集洗脱液作为实验组洗脱样本和参照组洗脱样本;
10.(4)通过质谱进行结构鉴定:采用高效液相色谱质谱联用系统对测试样本进行分子量的测定,测试样本包括步骤(3)中的筛选前样本、实验组洗脱样本和参照组洗脱样本,实验组洗脱样本和参照组洗脱样本中需要加入内标;筛选前样本中发现所有产物的分子量,都在实验组洗脱样本和参照组洗脱样本的质谱中进行分别提取并对比,若提取的某个分子量的亲和力值大于3,则判断该分子为与靶点蛋白结合的苗头化合物;其中,亲和力值的计算公式为:
[0011][0012]
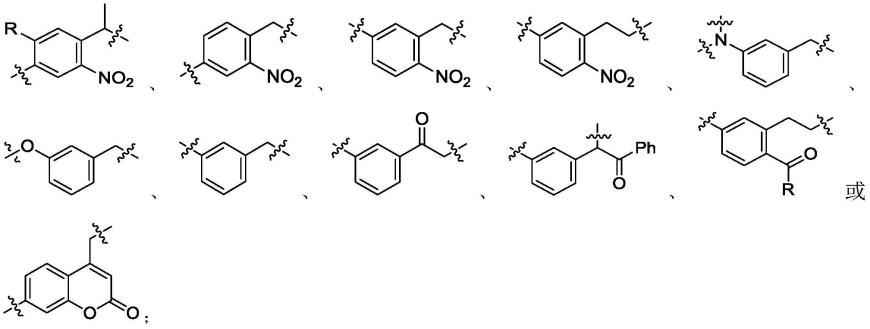
进一步地,所述带有可操作切断基团的dna编码苗头化合物的结构为:
[0013]
dna-l-a-m
[0014]
其中,
[0015]
结构式中dna包含由人工修饰的和/或未修饰的核苷酸单体聚合得到的单链或双链的核苷酸链,该核苷酸链通过一个或多个化学键或基团与l相连;
[0016]
l为连接链或无;
[0017]
a为可操作切断基团;
[0018]
m为苗头化合物部分。
[0019]
更进一步地,所述可操作切断的基团为:
[0020]020][0021]
所述r选自氢、苯基、c
1-c
10
烷氧基或者c
1-c
10
烷基。
[0022]
更进一步具体地,所述带有可切断基团的dna编码苗头化合物的结构为:
[0023][0024]
所述r选自c
1-c6烷氧基或者c
1-c6烷基。
[0025]
进一步具体地,所述步骤(2)的切断操作是通过光照将可操作切断基团进行切断。优选地,所述光照波长为250~400nm,优选为300~400nm。
[0026]
进一步地,步骤(1)中所述在带有可切断基团的dna编码苗头化合物进行合成的具体步骤包括:根据该苗头化合物在库合成时所遵循的合成路线、后处理操作和纯化方式依次将各个维度的反应砌块和dna进行化学反应组装;其中每一维度反应结束后进行醇沉操作,然后将所有反应产物投入下一个维度的循环反应中。
[0027]
更进一步地,所述醇沉操作是依次加入10%体积比的5.0mol/l的氯化钠溶液和3倍体积的无水乙醇,然后在-20℃以下冷冻40分钟,再进行离心、去除上清操作。
[0028]
更进一步具体地,将步骤(1)中带有可切断基团的dna编码苗头化合物合成完毕后进行醇沉操作,然后通过过滤器过滤并进行冻干。
[0029]
进一步地,在步骤(1)中还包括:得到带有可切断基团的dna编码苗头化合物后,通过液相色谱质谱联用解析在dna上合成的目标产物的收率情况,以及副产物情况,计算得到的带有可切断基团的dna编码苗头化合物浓度和纯度。根据在带有可切断基团的dna上对所有潜在的dna编码苗头化合物进行合成的质谱检测验证报告,确定该反应路线所包含的所有中间产物,副产物与目标产物的分子量与纯度信息。
[0030]
进一步地,在步骤(2)中还包括:切断操作后,通过液相色谱质谱联用解析得到切断步骤的转化率。
[0031]
更进一步地,步骤(2)中不含dna的苗头化合物的浓度通过切断前带有可切断基团的dna编码苗头化合物浓度和纯度、切断转化率计算得到。即苗头化合物的浓度为切断前dna的浓度乘以带有可切断基团的苗头化合物在切断前样本中的纯度,再乘以切断转化率。
[0032]
进一步地,在步骤(2)中分离dna与苗头化合物的方法包括:通过过滤器分离dna与苗头化合物;或者通过固相载体分离dna与苗头化合物。
[0033]
步骤(2)中通过过滤器操作后可以将苗头化合物进行冻干,复溶,通过此操作步骤得到苗头化合物的浓度可以通过复溶后苗头化合物的浓度和切断转化率计算得到。
[0034]
步骤(2)中通过固相载体处理后的苗头化合物的浓度是通过切断前dna编码苗头化合物的浓度和纯度、切断转化率计算得到,即苗头化合物的浓度=(切断前dna的浓度)*(dna-可切断基团-苗头化合物在切断前样本中的纯度)*(切断转化率)。
[0035]
进一步地,步骤(3)实验组中靶点蛋白量为70~140pmol,筛选前样本中不含dna的苗头化合物量为500-5000pmol,优选为2000pmol。
[0036]
进一步地,步骤(3)中所述筛选缓冲溶液的成分为:40mm tris,20mm mgcl2,10mm imidazole,0.05mm dtt,0.1%tween-20,ph 7.5。
[0037]
进一步地,步骤(3)中具体包括:实验组中以筛选缓冲液溶解靶点蛋白与筛选前样本,靶点蛋白终浓度为0.7~2.8μm;室温旋转孵育1-2小时后加入固定蛋白所用磁珠中进行蛋白固定,室温下固定30分钟。
[0038]
进一步地,步骤(3)中具体包括:参照组中以筛选缓冲液溶解筛选前样本,然后加入固定蛋白所用磁珠,室温下固定30分钟。
[0039]
进一步地,步骤(3)中所述洗脱缓冲液每组需用50μl。
[0040]
进一步地,步骤(3)中所述洗脱缓冲液的成分为:1)50mm hepes,300mm nacl,ph7.5;2)40mm tris,300mm nacl,ph 8.0;3)甲醇;4)200mm nh4oac ph 7.5;
[0041]
进一步地,步骤(3)中所述洗脱操作为:除去上清后,用洗脱缓冲液孵育1分钟,取掉上清,再加入洗脱缓冲液在95摄氏度条件下解离10分钟。
[0042]
进一步地,步骤(4)中所述的内标为酰胺类化合物;具体的,所述的酰胺类化合物选自n-甲基-1-萘甲酰胺、n-甲基-2-萘甲酰胺、n-甲基苯甲酰胺或6-溴-n-甲基-2-萘甲酰胺。
[0043]
进一步地,步骤(4)中所述高效液相色谱质谱联用系统具体包括:设定液相色谱的进样体积为10μl,检测时长10分钟,质谱设定全扫描模式;按照筛选前样本、实验组洗脱样本和参照组洗脱样本的顺序进行进样设置。
[0044]
更进一步地,步骤(4)中具体包括:判断某分子量分子的结构归属是通过带有可切断基团的dna编码苗头化合物的合成中的主、副产物分析的对比得到的。
[0045]
本发明方法具体包括以下步骤:
[0046]
(1)带有可切断基团的dna编码苗头化合物的合成:针对靶点蛋白dna编码化合物库筛选数据信号,按照其富集度由高到低进行排序,确定潜在的dna编码苗头化合物的分子序列信息及合成路径,并以所述合成路径在带有可切断基团的dna上对所有潜在的dna编码苗头化合物进行合成;
[0047]
(2)苗头化合物的释放:将上述带有可切断基团的dna编码苗头化合物进行切断操作,通过过滤器或者固相载体除掉相应的dna,得到不含dna的苗头化合物;
[0048]
(3)将不含dna的苗头化合物样本进行亲和力筛选:
[0049]
筛选样本的准备:使用筛选缓冲溶液(筛选缓冲溶液成分为40mm tris,20mm mgcl2,10mm imidaole,0.05mm dtt,0.1%tween-20,ph 7.5)配制上述不含dna的苗头化合物的筛选前样本;
[0050]
实验组:在1.5ml离心管中将2nmol上述筛选前样本和70pmol的靶点蛋白配置于总体积为50μl的筛选缓冲溶液中,将离心管置于旋转混合器上,20rpm,25℃孵育60min;然后将用筛选缓冲溶液洗涤3次后的20μl磁珠投入到上述溶液中,将离心管置于旋转混合器上,
20rpm,25℃孵育30min,通过靶点蛋白标签与特异性磁珠的亲和作用,用磁力架将靶点蛋白及靶点蛋白结合的不含dna的苗头化合物的复合体从溶液中分离出来,并收集保留上清。用50μl洗脱缓冲溶液(200mm nh4oac ph 7.5)重悬分离后的磁珠,于旋转混合器上,20rpm,25℃洗涤1min,洗掉非特异性结合的小分子复合物,用磁力架分离磁珠和上清液;用50μl洗脱缓冲溶液(200mm nh4oac ph 7.5)重悬洗涤后的磁珠,在金属浴中加热到95℃洗脱10min,让靶点蛋白变性使结合在蛋白上的苗头化合物洗脱,用磁力架分离磁珠,得到实验组洗脱样本。
[0051]
参照组中是以筛选缓冲液溶解筛选前样本,不加靶点蛋白,其他步骤同实验组,按照上述操作后得到参照组的上清样本和洗脱样本。
[0052]
(4)通过质谱进行结构鉴定:采用高效液相色谱质谱联用系统对测试品进行分子量的测定,测试品包括步骤(3)中的筛选前样本、实验组洗脱样本和参照组洗脱样本,实验组洗脱样本和参照组洗脱样本中需要加入内标;筛选前样本中发现的所有产物分子量,都在实验组洗脱样本和参照组洗脱样本的质谱中进行分别提取并对比,若提取的某个分子量的亲和力值大于3,则判断该分子为与靶点蛋白结合的苗头化合物;其中,亲和力值的计算公式为:
[0053][0054]
作为优选:一种可操作切断的dna编码苗头化合物的鉴定方法,还包括步骤(a):
[0055]
所述步骤(a)通过功能性筛选找出具有活性的苗头化合物样本:
[0056]
筛选样本的准备:使用筛选缓冲溶液配制所述不含dna的苗头化合物的筛选前样本;
[0057]
实验组将筛选前样本与靶点蛋白进行孵育;参照组将筛选缓冲溶液与靶点蛋白进行孵育;空白组只加入筛选缓冲溶液;然后向实验组、参照组、空白组中分别加入蛋白活性检测试剂,对靶点蛋白的活性进行检测;
[0058]
筛选样本蛋白活性抑制率=1-(实验组荧光信号-空白组荧光信号)/(参照组荧光信号-空白组荧光信号);上述实验重复做3次,若三组数据的平均蛋白活性抑制率》10%,且三组数据之间的显著性差异值(p)小于0.05,则判定该筛选样本中含有对蛋白起抑制作用的苗头化合物。
[0059]
进一步地,步骤(a)实验组中靶点蛋白的含量为0.001-0.2pmol,筛选前样本中不含dna的苗头化合物的浓度为0.1-10mm。
[0060]
进一步地,步骤(a)中使用的筛选缓冲溶液为40mm tris,20mm mgcl2,0.05mm dtt,0.1%bsa,ph 7.5。
[0061]
进一步地,步骤(a)中具体包括:实验组将靶点蛋白与不含有dna的苗头化合物的筛选前样本共孵育,25℃预孵育10-90min后对蛋白活性进行检测。
[0062]
进一步地,步骤(a)中参照组将筛选溶液与靶点蛋白共孵育,25℃预孵育10-90min后对蛋白活性进行检测。
[0063]
进一步地,步骤(a)中空白组只加入筛选缓冲溶液;25℃预孵育10-90min后对蛋白活性进行检测。
[0064]
进一步地,步骤(a)中所述蛋白活性检测试剂选自adp-glo
tm kinase试剂或
cathepsin-d。
[0065]
更进一步地,本发明还提供一种可操作切断的dna编码苗头化合物的鉴定方法,先进行步骤(1)和步骤(2),再进行步骤(a)和步骤(3)、(4):根据dna编码化合物库筛选分析得到dna苗头化合物,按照dna编码化合物库合成策略在带有可切断基团的dna上进行潜在的苗头化合物的重合成,在特定条件下将dna与苗头化合物进行分离,将苗头化合物与靶点蛋白进行功能性筛选,找到有活性的苗头化合物样本;然后将有活性的苗头化合物样本与靶点蛋白进行亲和力筛选,利用质谱对洗脱物进行分子鉴定,从而精确鉴定苗头化合物。
[0066]
本发明方法具体包括以下步骤:
[0067]
(1)带有可切断基团的dna编码苗头化合物的合成:针对靶点蛋白dna编码化合物库筛选数据信号,按照其富集度由高到低进行排序,确定潜在的dna编码苗头化合物的分子序列信息及合成路径,并以所述合成路径在带有可切断基团的dna上对所有潜在的dna编码苗头化合物进行合成;
[0068]
(2)苗头化合物的释放:将上述带有可切断基团的dna编码苗头化合物进行切断操作,通过过滤器或者固相载体除掉相应的dna,得到不含dna的苗头化合物;
[0069]
(3)通过功能性筛选找出具有活性的苗头化合物样本
[0070]
筛选样本的准备:使用筛选缓冲溶液(筛选缓冲溶液的成分为40mm tris,20mm mgcl2,0.05mm dtt,0.1%bsa,ph 7.5)配置不含dna的苗头化合物的筛选前样本;
[0071]
实验组:在1.5ml的离心管中将上述的筛选前样本和0.01pmol的靶点蛋白配置于总体积为15ul的筛选缓冲溶液中,将离心管置于旋转混合器上,280rpm,25℃孵育10min,然后加入5ul含60ug/ml s6k和20um atp的缓冲体系配置的溶液,于旋转混合器上,280rpm,25℃孵育40min,取10ul上述反应液转移到新的离心管中,加入10ul adp-glo
tm
试剂,将离心管置于旋转混合器上,280rpm,25℃孵育40min,加入等体积20ul kinase检测试剂,于旋转混合器上,280rpm,25℃孵育40min后利用酶标仪收集荧光素酶/荧光素荧光信号。
[0072]
参照组将筛选缓冲溶液与靶点蛋白共孵育,不加筛选前样本,其他步骤和实验组相同;
[0073]
空白组中只加入缓冲溶液,不加入苗头化合物与靶点蛋白,其他步骤和实验组相同;
[0074]
筛选样本蛋白活性抑制率=1-(实验组荧光信号-空白组荧光信号)/(参照组荧光信号-空白组荧光信号);上述实验重复做3次,若三组数据的平均蛋白活性抑制率》10%,且三组数据之间的显著性差异值(p)小于0.05,则判定该筛选样本中含有对蛋白起抑制作用的苗头化合物。
[0075]
(4)测亲和力筛选
[0076]
筛选样本的准备:使用筛选缓冲溶液(筛选缓冲溶液成分为40mm tris,20mm mgcl2,10mm imidaole,0.05mm dtt,0.1%tween-20,ph 7.5)配制上述不含dna的苗头化合物的筛选前样本;
[0077]
实验组:在1.5ml离心管中将2nmol上述筛选前样本和70pmol的靶点蛋白配置于总体积为50μl的筛选缓冲溶液中,将离心管置于旋转混合器上,20rpm,25℃孵育60min,然后将用筛选缓冲溶液洗涤3次后的20μl磁珠投入到小分子和靶点蛋白孵育后的溶液中,将离心管置于旋转混合器上,20rpm,25℃孵育30min,通过靶点蛋白标签与特异性磁珠的亲和作
用,用磁力架将靶点蛋白及靶点蛋白结合的不含dna的苗头化合物的复合体从溶液中分离出来,并收集保留上清,用50μl洗脱缓冲液(200mm nh4oac ph 7.5)重悬分离后的磁珠,于旋转混合器上,20rpm,25℃洗涤1min,洗掉非特异性结合的小分子复合物,用磁力架分离磁珠和上清液;用50μl洗脱缓冲液(200mm nh4oac ph 7.5)重悬洗涤后的磁珠,在金属浴中加热到95℃洗脱10min,让靶点蛋白变性使结合在蛋白上的苗头化合物洗脱,用磁力架分离磁珠,得到实验组洗脱样本。
[0078]
参照组中是以筛选缓冲液溶解筛选前样本,不加靶点蛋白,其他步骤同实验组,按照上述操作后得到参照组的上清样本和洗脱样本。
[0079]
(5)通过质谱进行结构鉴定:采用高效液相色谱质谱联用系统对测试品进行分子量的测定,测试品包括步骤(4)中的筛选前样本、实验组洗脱样本和参照组洗脱样本,实验组洗脱样本和参照组洗脱样本中需要加入内标;筛选前样本中发现的所有产物分子量,都在实验组洗脱样本和参照组洗脱样本的质谱中进行分别提取并对比,若提取的某个分子量的亲和力值大于3,则判断该分子为与靶点蛋白结合的苗头化合物;其中,亲和力值的计算公式为:
[0080][0081]
进一步地:本发明还提供一种可操作切断的dna编码苗头化合物的鉴定方法,先进行步骤(1)和步骤(2),再进行步骤(3)、(4)和步骤(a),通过功能性筛选和亲和力筛选的结果相互结合,缩小了后续苗头化合物纯合成的范围,避免资源浪费,提高了dna编码化合物库中苗头化合物鉴定的准确性。
[0082]
综上所述,本发明将潜在的不含dna的苗头化合物样本与靶点蛋白进行亲和力筛选,找到结合的苗头化合物样本,或者将不含dna的苗头化合物与靶点蛋白进行功能性筛选,找到有活性的苗头化合物样本;通过功能性筛选和亲和力筛选的结果相互结合,最后利用质谱对洗脱物进行分子鉴定,从而精确鉴定苗头化合物。本发明可以实现dna编码苗头化合物的精确、快速发现,并且通过可切断基团来分离dna与苗头化合物,避免dna对筛选造成影响,提高dna编码化合物库中苗头化合物鉴定的准确性。
附图说明
[0083]
图1:本发明实施例2的流程图;
[0084]
图2:本发明实施例1中筛选前样本的高效液相色谱图;
[0085]
图3:本发明实施例1中实验组洗脱样本和参照组洗脱样本中提取的目标分子量的离子流强度对比。
[0086]
图4:本发明实施例2中筛选前样本的高效液相色谱图;
[0087]
图5:本发明实施例2中实验组洗脱样本和参照组洗脱样本中提取的目标分子量的离子流强度对比。
具体实施方式
[0088]
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明,但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容
所实现的技术均属于本发明的范围。
[0089]
实施例1、对靶点蛋白进行亲和力筛选以确定潜在的苗头化合物
[0090]
1)遵循dna编码化合物库的合成策略,在带有可切断基团的dna上进行潜在苗头化合物的逐步合成,将合成的样本通过过滤器过滤,得到纯化后的样本,将纯化后的样本溶于h2o/dmso(体积比97:3)中配成1.3毫摩尔每升的溶液,然后置于0摄氏度的365纳米,光照强度600j的光照条件下光照40分钟,取样反应液用于质谱监测,确定反应的转化率(80%)。然后将上述溶液加入到固相载体中,震荡1h后离心,上清液为苗头化合物样本,苗头化合物3的浓度=(切断前dna的浓度)*(切断效率)*(带有可切断基团的苗头化合物在切断前样本中的纯度)。
[0091][0092]
2)筛选样本的准备:使用筛选缓冲溶液(筛选缓冲溶液成分为40mm tris,20mm mgcl2,10mm imidaole,0.05mm dtt,0.1%tween-20,ph 7.5)配制所述不含dna的苗头化合物3的筛选前样本。
[0093]
3)实验组:在1.5ml离心管中将2nmol上述筛选前样本和70pmol的靶点蛋白配置于总体积为50μl的缓冲缓冲溶液中,将离心管置于旋转混合器上,20rpm,25℃孵育60min。然后将用筛选缓冲溶液洗涤3次后的20μl磁珠投入到苗头化合物和靶点蛋白孵育后的溶液中,将离心管置于旋转混合器上,20rpm,25℃孵育30min,通过靶点蛋白标签与特异性磁珠的亲和作用,用磁力架将靶点蛋白及靶点蛋白结合的不含dna的苗头化合物的复合体从溶液中分离出来,并收集保留上清。用50μl洗脱缓冲溶液(200mm nh4oac,ph 7.5)重悬分离后的磁珠,于旋转混合器上,20rpm,25℃洗涤1min,洗掉非特异性结合的小分子复合物,用磁力架分离磁珠和上清液。用50μl洗脱缓冲溶液(200mm nh4oac,ph 7.5)重悬洗涤后的磁珠,在金属浴中加热到95℃洗脱10min,让靶点蛋白变性使结合在蛋白上的苗头化合物洗脱,用磁力架分离磁珠,得到实验组洗脱样本。
[0094]
参照组中是以筛选缓冲溶液溶解筛选前样本,不加靶点蛋白,其他步骤同实验组,按照上述操作后得到参照组的上清样本和洗脱样本。
[0095]
4)采用通过water uplc-ms xevo g2-xs q-tof(waters美国)高效液相质谱联用对测试样本进行分子量的测定,实验组洗脱样本和参照组洗脱样本加入20pmol的n-甲基-1-萘甲酰胺作为内标,测试品包括筛选前样本(图2)、实验组洗脱样本和参照组洗脱样本。对筛选前样本的液相质谱数据进行分析,提取到分子量为426.1915的目标信号;然后在实验组洗脱样本和参照组洗脱样本中进行提取分子量为426.1915,得到提取离子强度(图3);然后提取186.1324(内标的分子量)在实验组洗脱样本和参照组洗脱样本中的离子强度;然后根据亲和力值的计算公式得到分子量为426.1915的亲和力值为115,该比值大于3,即确定该分子量对应的化合物结构为与靶点蛋白结合的小分子化合物。
[0096]
其中,亲和力值的计算公式为:
[0097][0098]
实施例2:对靶点蛋白进行功能性筛选和亲和力筛选以确定潜在的苗头化合物
[0099]
(1)在带有可切断基团的dna上对潜在的dna编码苗头化合物进行合成;
[0100][0101]
首先将dna与可切断基团相连,然后遵循dna编码化合物库的合成策略,在dna-可切断基团上对潜在苗头化合物的进行逐步合成。将合成的样本通过过滤器过滤,得到纯化后的dna-可切断基团-苗头化合物样本。
[0102]
(2)苗头化合物的释放
[0103][0104]
将dna-可切断基团-苗头化合物样本溶于h2o/dmso(体积比97:3)中配成1.3mm的溶液,然后置于0摄氏度的紫外光照条件下(365nm,600j)反应40分钟,反应结束后取样用于质谱监测,确定反应的转化率(80%),然后将上述溶液加入到固相载体中,震荡1h后离心,上清液为苗头化合物样本,苗头化合物6的浓度=(切断前dna的浓度)*(切断效率)*(带有可切断基团的苗头化合物在切断前样本中的纯度)。
[0105]
(3)对靶点蛋白进行功能性筛选以确定潜在的苗头化合物样本
[0106]
筛选样本的准备:使用筛选缓冲溶液(筛选缓冲溶液的成分为40mm tris,20mm mgcl2,0.05mm dtt,0.1%bsa,ph 7.5)配置不含dna的苗头化合物的筛选前样本。
[0107]
实验组:在离心管中将上述筛选前样本与0.01pmol的靶点蛋白配置于总体积为15ul筛选缓冲溶液中,将离心管置于旋转混合器上,280rpm,25℃孵育10min,然后加入5ul含60ug/ml s6k和20um atp的缓冲体系配置的溶液,于旋转混合器上,280rpm,25℃孵育40min,取10ul上述反应液转移到新的离心管中,加入10ul adp-glo
tm
试剂,将离心管置于旋转混合器上,280rpm,25℃孵育40min。加入20ul kinase检测试剂,于旋转混合器上,280rpm,25℃孵育40min后利用酶标仪收集荧光素酶/荧光素荧光信号。
[0108]
参照组将筛选缓冲溶液与靶点蛋白共孵育,不加筛选前样本,其他步骤和实验组相同;
[0109]
空白组中只加入筛选缓冲溶液,不加入苗头化合物和靶点蛋白,其他步骤和实验组相同;
[0110]
按照上述操作后得到参照组和空白组荧光信号。
[0111]
上述实验重复三次。
[0112]
该筛选样本平均蛋白活性的抑制率为69%,该比值大于10%,且三组数据之间的显著性差异值(p)为0.00041,小于0.05,判断该筛选样本中含有对蛋白起抑制作用的苗头
化合物。
[0113]
(4)将上述具有活性的苗头化合物样本进行亲和力筛选
[0114]
筛选样本的准备:使用筛选缓冲溶液(筛选缓冲溶液成分为40mm tris,20mm mgcl2,10mm imidaole,0.05mm dtt,0.1%tween-20,ph 7.5)配制上述苗头化合物的筛选前样本;
[0115]
实验组:在1.5ml离心管中将2nmol上述具有活性的苗头化合物的筛选前样本和70pmol的靶点蛋白配置为总体积为50μl体系,将离心管置于旋转混合器上,20rpm,25℃孵育60min。然后将用筛选缓冲溶液洗涤3次后的20μl磁珠投入到苗头化合物和靶点蛋白孵育后的溶液中,将离心管置于旋转混合器上,20rpm,25℃孵育30min,通过靶点蛋白标签与特异性磁珠的亲和作用,用磁力架将靶点蛋白及靶点蛋白结合的不含dna的苗头化合物的复合体从溶液中分离出来,并收集保留上清。用50μl洗脱缓冲液(200mm nh4oac ph 7.5)重悬分离后的磁珠,于旋转混合器上,20rpm,25℃洗涤1min,洗掉非特异性结合的小分子复合物,用磁力架分离磁珠和上清液。用50μl洗脱缓冲液(200mm nh4oac ph 7.5)重悬洗涤后的磁珠,在金属浴中加热到95℃洗脱10min,让靶点蛋白变性使结合在蛋白上的苗头化合物洗脱,用磁力架分离磁珠,得到实验组洗脱样本。
[0116]
参照组中是以筛选缓冲液溶解筛选前样本,不加靶点蛋白,其他步骤同实验组,按照上述操作后得到参照组的上清样本和洗脱样本。
[0117]
(5)通过质谱进行结构鉴定:采用高效液相色谱质谱联用系统对测试品进行分子量的测定,实验组洗脱样本和参照组洗脱样本加入20pmol的n-甲基-1-萘甲酰胺作为内标,测试品包括步骤(4)中的筛选前样本、实验组洗脱样本和参照组洗脱样本;对筛选前样本的液相质谱数据(图4)进行分析,提取到分子量为308.17目标信号;然后在实验组洗脱样本和参照组洗脱样本中进行提取分子量为308.17,得到提取离子强度(图5);然后提取186.13(内标的分子量)在实验组洗脱样本和参照组洗脱样本中的离子强度;然后根据亲和力值的计算公式得到分子量为308.17的亲和力值为11,该比值大于3,即确定该分子量对应的化合物结构为与靶点蛋白结合的小分子化合物。
[0118]
其中,亲和力值的计算公式为:
[0119][0120]
综上所述,上述各实施例仅为本发明的较佳实施例而已,并不用以限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,皆应包含在本发明的保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
