1.本发明属于医药化学及材料技术领域,具体涉及一种负载有机砷剂的介孔聚多巴胺纳米抗菌剂的制备方法和应用。
背景技术:
2.有机砷杀菌剂是化学结构中含砷(as)的有机合成杀菌剂,含砷药物广泛用于农业和牲畜养殖业中,比如最常见的洛克沙胂(rox,as
5
)。然而由于化学抗菌剂的滥用导致其耐药菌广泛出现,使得包括有机砷杀菌剂在内的传统抗菌剂效果大大减弱,对农业和牲畜养殖业造成了严重的影响。
3.为了提高抗菌效果,通常会采用加大有机砷杀菌剂使用量的方式,然而该方法不仅会对生态环境以及生命体造成毒性污染,还可能进一步提高了耐药菌的耐药性,如此往复,陷入恶性循环。此外,研究人员也在致力于开发新的应用于农业和牲畜养殖业的抗菌药物,然而开发新药投入的周期和成本较高,且实际应用效果无法保证,无法解决燃眉之急。
4.鉴于此,探究一种提升抗菌效率并降低耐药菌产生的策略迫在眉睫。
技术实现要素:
5.本发明的目的在于解决目前有机砷杀菌剂因细菌耐药性已无法发挥其最好抗菌效果的不足之处,而提供一种负载有机砷剂的介孔聚多巴胺纳米抗菌剂的制备方法和应用。
6.本发明的构思:
7.考虑到目前新药的研发难度,为了解决燃眉之急,本发明研究团队拟采用“旧药新用”的方式,充分利用现有的有机砷杀菌剂。
8.如何提升目前有机砷杀菌剂对耐药菌的抗菌效果,研发人员考虑首先需要提升耐药菌对有机砷杀菌剂的敏感度,在此,研发人员利用了一氧化氮,一氧化氮(no)是一种生命体内的气体信号分子,可以提高耐药菌对抗菌药物的敏感性,从而加强抗菌剂的药效;但是如何将no供体基团与有机砷杀菌剂进行结合,又是研发人员在改进过程中遇到的另外一个问题,在此,研发人员创造性地借助了中间载体来整合并传输药物;纳米药物载体不仅递送方便且可以延长药物作用时间。综上,本发明着手利用纳米药物传输系统的协同增效作用以及光热控释作用,来实现有机砷杀菌剂的高效和高利用率。
9.介孔聚多巴胺纳米颗粒(mpda)作为一种光热剂不仅可以有效地将近红外光(nir)转化为局部高温,破坏细菌结构以杀死病原体,同时其介孔和表面可以用来吸附运载药物。因此,利用介孔聚多巴胺纳米颗粒作为中间载体,将no供体和有机砷杀菌剂进行整合,来制备光热和no增效的有机砷纳米抗菌剂是一种可行的方案。同时,光热转换还可以促进no和药物的释放,从而对药物作用时间和部位进行控制,具有显著的效果。
10.为实现上述目的,本发明所提供的技术解决方案是:
11.一种负载有机砷剂的介孔聚多巴胺纳米抗菌剂,其特殊之处在于:所述纳米抗菌剂的真实粒径为20~200nm,其以一氧化氮供体基团表面改性的介孔聚多巴胺纳米颗粒为载体,且该载体的介孔中和表面上吸附有有机砷杀菌剂;
12.所述一氧化氮供体基团通过亚硝化反应负载在介孔聚多巴胺纳米颗粒的仲胺活性位点上,对介孔聚多巴胺纳米颗粒进行改性;
13.对所述纳米抗菌剂施加近红外光照射,介孔聚多巴胺纳米颗粒光热抗菌的同时能够促进一氧化氮no与有机砷杀菌剂的释放,即纳米颗粒能光热抗菌的同时实现一氧化氮no与有机砷杀菌剂的释放,实现了协同化学-光热疗法对耐药菌精确可控的杀灭作用。
14.进一步地,所述有机砷杀菌剂为洛克沙胂rox。
15.本发明还提供了上述负载有机砷剂的介孔聚多巴胺纳米抗菌剂的制备方法,其特征在于,包括以下步骤:
16.1)制备改性介孔聚多巴胺纳米颗粒(mpda@no纳米颗粒)
17.在粒径为20-200nm的介孔聚多巴胺纳米颗粒(mpda纳米颗粒)的仲胺活性位点上通过亚硝化反应负载一氧化氮供体基团,得到具有一氧化氮释放功能的改性介孔聚多巴胺纳米颗粒,即mpda@no纳米颗粒;纳米颗粒在200nm以下能够确保抗菌剂被细胞胞吞生效;
18.2)制备纳米抗菌剂
19.在步骤1)得到的改性介孔聚多巴胺纳米颗粒介孔中和表面上吸附大量的有机砷杀菌剂,得到在近红外光照射下可以同时释放一氧化氮与有机砷杀菌剂的纳米抗菌剂。
20.进一步地,步骤1)具体为:
21.1.1)将粒径为20-200nm的介孔聚多巴胺纳米颗粒超声分散于亚硝酸钠的水溶液中,得到混合物;
22.1.2)将步骤1.1)得到的混合物逐滴滴加至冰浴的硫酸中(手动缓慢滴加即可),搅拌均匀后,置于密封容器中进行反应,反应完成后,离心分离,得到产物;
23.1.3)采用水和丙酮清洗步骤1.2)得到的产物,确保nano2被完全去除 (检测nano2是否被完全去除,可取离心后的上清液,使用griess法检测,若在540nm处没有吸收峰,即完全去除),得到具有一氧化氮释放功能的改性介孔聚多巴胺纳米颗粒。
24.进一步地,步骤2)具体为:
25.将步骤1)得到的改性介孔聚多巴胺纳米颗粒分散于有机砷杀菌剂溶液中,均匀搅拌使有机砷杀菌剂吸附于纳米颗粒的介孔中和表面上,离心得到负载有机砷剂的介孔聚多巴胺纳米抗菌剂。
26.进一步地,步骤1)中粒径为20-200nm的介孔聚多巴胺纳米颗粒的制备方法如下:
27.s1.将乳化剂三嵌段共聚物f127(聚(乙二醇)-block-聚(丙二醇)
‑ꢀ
block-聚(乙二醇))和1,3,5-三甲基苯tmb溶解于水和乙醇的混合溶液中,搅拌至乳化剂分散均匀,加入三羟甲基氨基甲烷tris溶液调节混合溶液的 ph至7-8,即弱碱性;
28.s2向s1得到的混合溶液中加入盐酸多巴胺,搅拌反应,反应完成后,离心,收集纳米颗粒产物;
29.s3以乙醇和丙酮的混合物作为萃取剂,对s2得到的纳米颗粒产物进行超声处理,去除残余的三嵌段共聚物f127和tmb;重复该洗涤过程多次,离心收集得到介孔聚多巴胺纳米颗粒(mpda)。
30.上述制备粒径为20-200nm的介孔聚多巴胺纳米颗粒就是通过有机-有机自组装以及π-π堆积的相互作用,在水/1,3,5-三甲基苯tmb界面上形成乳液液滴进而定向共组装。
31.进一步地,介孔聚多巴胺纳米颗粒的粒径大小受到反应时间的影响,孔径受到乳化剂f127和tmb浓度的影响,为了获得尺寸均一,孔径合适的纳米颗粒,s1中,f127与tmb的质量比为1∶1,用水和乙醇调节成0.64% (w/v)的浓度,水和乙醇体积比为13∶12;搅拌半小时乳化剂分散均匀;
32.s2中,盐酸多巴胺与f127和tmb的总重量之比为1∶13.3;搅拌反应 24小时,离心速度为9000转/分,离心时间为15分钟;
33.s3中,乙醇和丙酮的体积比为2∶1;重复洗涤过程3次。
34.进一步地,步骤1.1)中,亚硝酸钠的水溶液的质量浓度为2.4% (w/v);
35.介孔聚多巴胺纳米颗粒与亚硝酸钠的质量比为1∶5~10;
36.步骤1.2)中,硫酸与1.1)混合物的体积比为6∶1~5∶1,硫酸的摩尔浓度为3m;
37.反应7-10小时(优选8小时),离心速度为11000转/分,离心时间为 25-35分钟(优选30分钟)。
38.进一步地,步骤2)中,有机砷杀菌剂溶液为洛克沙胂溶液,其质量浓度为0.1-0.8mg/ml;
39.改性介孔聚多巴胺纳米颗粒与洛克沙胂溶液的质量比为1∶0.5~4,可达到130~580μg/mg的吸附标准;
40.均匀搅拌22~24h,优选24h。
41.本发明还提供了上述负载有机砷剂的介孔聚多巴胺纳米抗菌剂在杀灭耐药菌中的应用。
42.本发明的机理:
43.为了得到高效可控的灭耐药菌抗菌剂,首先利用no供体受热后释放抗菌no的特点,将通过亚硝化反应将其负载于具有光热转换功能的介孔聚多巴胺纳米颗粒的仲胺活性位点上,获得改性后的mpda@no纳米颗粒;然后以改性的mpda@no纳米颗粒为载体,将大量有机砷杀菌剂(比如rox)吸附于纳米载体的介孔中和表面上,制成负载no和有机砷杀菌剂的介孔聚多巴胺纳米抗菌剂。在到达特定位置(比如细菌感染部位)后在近红外光(nir)照射下,纳米颗粒不仅被快速加热起到抗菌作用,同时还会促进有机砷杀菌剂和no的释放,在光热抗菌和no-抗菌、药物化学抗菌的协同作用下,对耐药菌实现药物精准控释和协同高效杀灭的效果。即以no供体改性的介孔聚多巴胺纳米颗粒作为药物传递载体,来实现有机砷杀菌剂 (比如:rox)的高利用率,在需要抗菌的位置,pda在受到nir照射时,pda把光转换成热杀菌(光热抗菌)的同时促进no和有机砷药物的释放杀菌(化学抗菌),实现精准可控的光热-化学协同高效杀菌。
44.本发明的优点是:
45.1.本发明针对旧药新用,设计并合成了一种负载有机砷剂的介孔聚多巴胺纳米抗菌剂,制备方法简便,易操作,研发周期大大缩短且杀菌效果有所保障。通过对mpda纳米颗粒表面改性处理,制备负载no供体的 mpda@no纳米颗粒,并以此为药物载体,吸附有机砷杀菌剂,得到纳米颗粒抗菌剂。整个纳米颗粒抗菌剂经过微观形貌分析,确定所制备纳米颗粒具有均匀分布的真实粒径(20~200nm),该粒径符合细胞胞吞范围。此外,通过光热控释测
试发现在nir照射下,no和有机砷杀菌剂的释放量和释放速度明显提高,因此具有显著的光热转换控释的效果,颗粒到达感染部位时被nir照射才能大量释放药物和气体高效杀菌,因此精确可控。该发明可以应用于抗耐药菌感染相关领域的纳米药物递送系统中。
46.2.本发明制备的纳米颗粒粒径分布均一,形貌可控,具有良好的光热转换性能。本发明研究了修饰的mpda纳米颗粒的光热转换控制释放的性能与效果,并对比了不同负载修饰的mpda纳米颗粒的抗菌性能和溶血率。通过实验证实,制备的mpda@no-rox纳米颗粒在光照后利用其协同化学-光热疗热功能,表现出最优的对耐药菌的抗菌效果,因此可以通过将抗菌药物输送到感染部位后,再利用nir来实现杀菌作用的精准可控。此外在使用浓度低于1mg/ml时,可保证mpda@no-rox纳米颗粒具有良好的血液相容性。因此,开发负载有机砷剂的介孔聚多巴胺纳米药物递送系统在对抗耐药菌感染相关领域有着潜在的应用前景。
附图说明
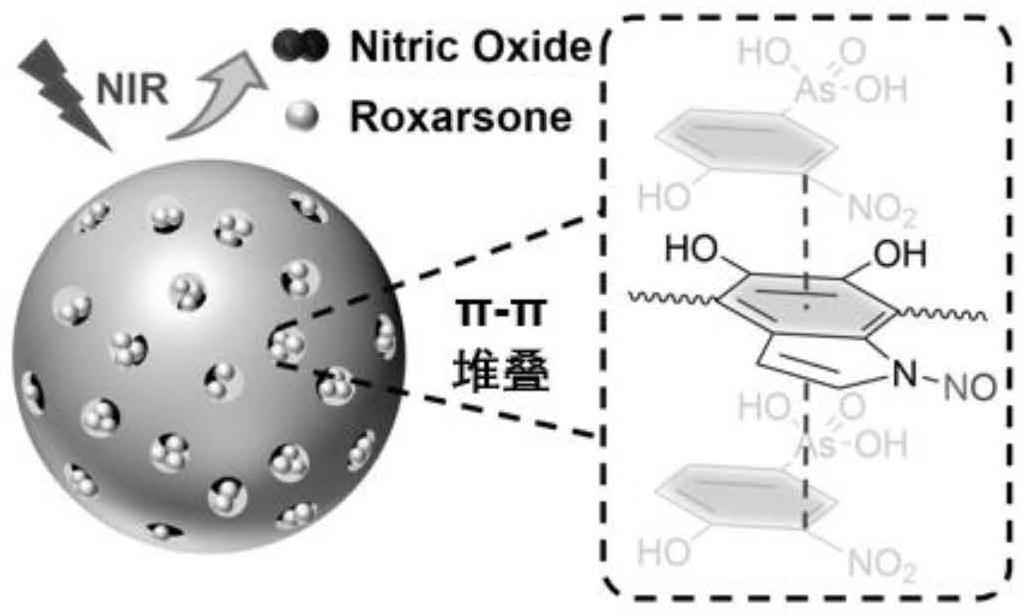
47.图1为mpda@no-rox纳米颗粒的制备及光热控释的机理示意图;
48.图2为修饰前mpda纳米颗粒和修饰后mpda@no-rox纳米颗粒的扫描电子显微镜(sem)图像;
49.图3为mpda纳米颗粒的氮气吸附-脱附曲线;
50.图4为水合粒径分布图;
51.图5为mpda、mpda@no以及mpda@no-rox纳米颗粒的x射线光电子能谱图(xps);
52.图6为rox、mpda、mpda@no、以及mpda@no-rox纳米颗粒紫外吸收光谱(uv-vis);
53.图7为mpda和rox重量比例对rox的吸附量和负载效率的影响;
54.图8为mpda-rox纳米颗粒的光热释放rox效率;
55.图9为mpda@no纳米颗粒的光热转换控制no释放的性能;
56.图10为不同质量浓度的mpda、mpda@no、以及mpda@no-rox 纳米颗粒的溶血率(a)以及与triton x-100一起孵育的红细胞悬浮液的照片 (b);
57.图11为不同修饰的mpda纳米颗粒在有无nir情况下对耐药大肠杆菌 (a)和耐药金黄色葡萄球菌(b)的抗菌性能。
具体实施方式
58.以下结合附图和具体实施例对本发明的内容作进一步的详细描述:
59.实施例1
60.一种负载有机砷剂的介孔聚多巴胺纳米抗菌剂的制备方法,包括如下步骤:
61.1)制备mpda纳米颗粒
62.1.1)将0.4g f127和0.4g tmb溶于水(65ml)和乙醇(60ml)的混合溶液中,经过半小时的搅拌后乳化剂分散均匀,加入tris缓冲溶液(90毫克的tris溶解在10毫升水中)调节溶液为弱碱性ph 7-8;
63.1.2)向步骤1.1)得到的混合溶液中60mg加入盐酸多巴胺。在搅拌24 小时后,以9000转/分离心15分钟,分离纳米颗粒产物;
64.1.3)以乙醇和丙酮(体积比为2∶1)的混合物作为萃取剂,采用萃取剂对步骤1.2)得到的纳米颗粒产物进行超声处理30min,以去除残余的f127和tmb;重复该洗涤过程三次,
离心收集得到介孔聚多巴胺纳米颗粒 (mpda nps);
65.2)采用亚硝化法制备mpda@no纳米颗粒
66.2.1)将50mg步骤1)得到的mpda纳米颗粒超声分散于亚硝酸钠的水溶液中(2.4%w/v),得到混合物;
67.2.2)将步骤2.1)得到的混合物滴加至60ml冰浴的硫酸(摩尔浓度为 3m)中,搅拌均匀后置于密封容器中反应8小时,反应完成后,以11000转/分离心30分钟,分离得到产物;
68.2.3)采用水和丙酮清洗步骤2.2)得到的产物,确保nano2被完全去除 (检测nano2是否被完全去除,可取离心后的上清液,使用griess法检测,若在540nm处没有吸收峰,即完全去除),得到具有一氧化氮释放功能的改性介孔聚多巴胺纳米颗粒,即mpda@no纳米颗粒。
69.3)制备mpda@no-rox纳米抗菌剂
70.将步骤2)得到的mpda@no纳米颗粒分散于质量浓度为0.4mg/ml的 rox溶液(mpda@no纳米颗粒和rox质量比为1∶4)中;搅拌24h 后,将混合物离心分离纳米颗粒产物,得到mpda@no-rox纳米抗菌剂。
71.验证例1
72.步骤1)与实施例1相同;
73.步骤2)制备mpda-rox纳米颗粒
74.将2mg mpda纳米颗粒分散于10ml rox溶液(采用不同浓度的rox 溶液形成多组样品,浓度分别为0.1,0.2,0.4,0.6,0.8mg/ml)中。搅拌 24h后,将混合物离心分离得到纳米颗粒产物mpda-rox纳米颗粒。
75.为了验证纳米抗菌剂的性能,本发明还对实施例1制备的mpda@no
‑ꢀ
rox纳米抗菌剂进行以下试验:
76.从图1可以看出:实施例1中,一氧化氮(no)供体基团被修饰在多巴胺分子上,制备的mpda@no-rox表面在受到nir照射后会释放no,同时rox分子通过与聚多巴胺之间的π-π堆叠作用被吸附在聚多巴胺颗粒的介孔中。
77.从图2的扫描电子显微镜(sem)图像可以看出:实施例1中修饰前的 mpda颗粒的呈现介孔均匀分布的表面形貌,负载no供体和rox后,聚多巴胺纳米颗粒粒径大小未发生明显变化,但其表面形态发生了变化,未观察到类似负载前的孔洞结构,说明纳米颗粒的孔洞被no供体和rox填充。
78.从图3的实施例1中修饰前的mpda介孔材料的氮气吸附-脱附曲线可以显示出介孔材料的iv型等温曲线,其比表面积为35.2978m2/g。孔径分布范围在3-32nm之间,平均孔径约为30nm,进一步证实其具有大的孔径通道,有利于药物的高效负载。
79.从图4可以看出:实施例1中随着对mpda纳米颗粒进行no供体表面改性以及进一步的rox吸附处理,纳米颗粒的水合粒径明显增大,这表明 mpda纳米颗粒表面和介孔中负载了no供体和rox。
80.对图5的x射线光电子能谱图(xps)进行分析,表明实施例1中 mpda@no-rox纳米粒子具有砷as(3d)元素的特征峰,说明rox成功吸附到表面介孔中。同时mpda@no纳米颗粒表面的xps能谱中在406.1ev处新出现了一个特征峰,来源于n=o,这说明no供体基团成功负载在mpda 纳米颗粒的表面。
81.对图6的紫外吸收光谱(uv-vis)进行对比,实施例1中mpda@no
‑ꢀ
rox纳米颗粒在
337nm处有相较于其他具有明显的rox特征吸收峰,表明成功地将rox吸附到mpda纳米颗粒的孔洞内部。
82.由图7所示,验证例1中rox的吸收量随着其与mpda比例的提高而提高,但比例达到3以后,由于空洞吸附rox接近饱和,因此吸收量变化不大,而负载效率的整体也因此下降。
83.由图8所示,验证例1中选取mpda-rox(mpda∶rox重量比为1∶ 4)进行nir控释测试,随着时间的推移,释放量逐渐增大。在近红外光 (nir)照射下,药物释放量的速率明显提升,说明负载有rox药物的 mpda-rox纳米颗粒具有明显的光热控制释放性能,在nir刺激下可以在短时间内快速释放更多的杀菌药物。
84.由图9所示,在没有nir照射的情况下no的释放量几乎为0,而在 nir照射的情况下,供体基团的no释放量随着照射时间的延长逐渐增加,在15min后增加减缓;这说明mpda@no纳米颗粒具有十分明显的光热转换控制no释放的性能。
85.由图10所示,以triton x-100处理的红细胞悬液作为对照,实验结果表明,mpda@no-rox纳米颗粒的溶血率在质量浓度高达4mg/ml时溶血率最高为9.5%,在1mg/ml以下时低于5%,因此在该浓度下具有良好的血液相容性。
86.由图11所示,正常情况下所有杀菌效果区分不大,而在nir照射的情况下,不同修饰的mpda纳米颗粒(浓度均为1mg/ml)都表现出更好的杀菌效果,同时mpda@no-rox纳米颗粒表现出比负载no供体或吸附rox 的mpda纳米颗粒更显著的抗菌效果,这说明同时负载no供体和rox能更好地起到对耐药菌的杀灭作用,并且通过协同化学-光热疗法实现了精准可控的杀灭耐药菌的功能。
87.由此可见,本发明采用旧药新用这种构思设计的纳米抗菌剂在对抗耐药菌感染相关领域有着潜在的应用前景。
88.以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明公开的技术范围内,可轻易想到各种等效的修改或替换,这些修改或替换都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。