基于均相时间分辨荧光技术的体外rig-i激活检测的方法
技术领域
1.本发明属于rig-i激活检测技术领域,尤其涉及一种基于均相时间分辨荧光技术的体外rig-i激活检测的方法。
背景技术:
2.蛋白rig-i(视黄酸诱导基因i,retinoic acid-inducible gene i)是天然免疫系统中的重要分子,为基因ddx58(dexd/h-box helicase 58)所编码。rig-i蛋白的主要功能是结合并识别细胞质中的rna,当识别到非自身的rna时激活,触发干扰素产生通路。
3.rig-i蛋白可分为三个结构域,从氨基端到羰基端依次为card结构域(caspase蛋白招募结构域,caspase recruitment domain),解旋酶结构域和rna结合结构域。在静息状态下,rig-i蛋白的card结构域与解旋酶结构域相互作用,即使其rna结合结构域与自身rna结合,也不会引起card结构域的解离和活性位点暴露。rig-i蛋白一旦识别到非自身的rna,便会引起蛋白质构象变化,解旋酶结构域、rna结合结构域和非自身rna形成较为牢固的复合体,并导致card结构域的解离和活性位点暴露。
4.根据该原理,stephen cusack等人在文章(文献1:kowalinski e, lunardi t, mccarthy aa, lou ber j, brunel j, grigorov b, gerlier d, cusack s. structural basis for the activation of innate immune pattern
‑ꢀ
recognition receptor rig-i by viral rna. cell. 2011 oct 14; 147(2): 423-35.)中,使用纯化的仅含card结构域的蛋白和仅含解旋酶结构域的蛋白,通过体外的蛋白质沉降实验,验证了两者在没有rna作用下处于未激活的结合状态(附图1,泳道6对比泳道4,drig-i-hel位置条带)。而当向该体系中加入rig-i激活配体双链短rna时,仅含card结构域的蛋白和仅含解旋酶结构域的蛋白会解离(附图1,泳道8对比泳道6,drig-i-hel位置条带),重现了rig-i蛋白激活时的构象变化。该方法可以通过两个蛋白是否解离,判断所添加物是否能激活rig-i。
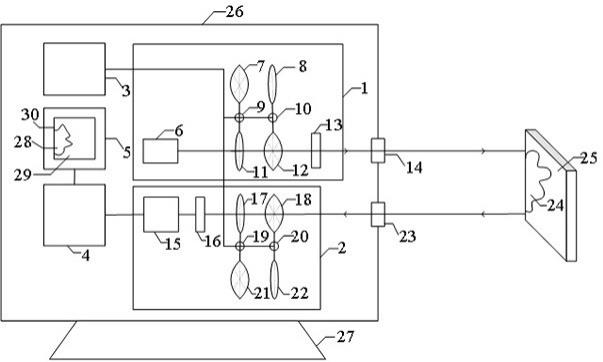
5.附图1,为蛋白drig-i-hel(解旋酶结构域)单独或与带his标签的蛋白hiscards(card结构域)、蛋白hiscards和双链短rna、带his标签的蛋白hisctd(rna结合结构域)共孵育,然后用镍柱填料将带his标签的蛋白纯化分离制得样品,通过变性聚丙烯酰胺凝胶电泳(sds-page)和全蛋白染色对样品中蛋白进行分析,所得的实验结果。
6.由上可知,该方法应用于大规模rig-i激活剂的筛选略显不足。主要缺陷为:1.文中所使用rig-i序列的是来源于禽类,与人类的序列有所差异;2.文中主要的鉴定方法采用镍柱填料纯化,再加上变性聚丙烯酰胺凝胶电泳(sds-page)和全蛋白染色分析,通量小且结果不能准确量化;3.文中使用的蛋白浓度在4-5um,单个反应蛋白质需求量较大,成本较高;4.文中使用的反应体系不能体现生理条件下的环境影响,特别是溶液中atp和镁离子作为rig-i的辅助因子的作用。
7.另外,依据同样的原理,t. h. dickey(文献2:dickey th, song b, pyle am. rna binding activates rig-i by releasing an autorepressed signaling domain. sci adv. 2019 oct 2;5(10):eaax3641.)开发了基于荧光能量共振转移的测定rig-i体外
激活的方法。作者在rig-i蛋白紧挨card结构域的c端,插入了含有四半胱氨酸的片段,以标记荧光素flash;同时,通过氨基酸密码子置换将位于解旋酶结构域的494位谷氨酸残基替换为叠氮基苯丙氨酸,再经由化学反应标记上荧光素alexa fluor 594。改造后的蛋白在静息状态下,能够发生能量转移产生较高的信号。再通过不同rna处理后,rig-i激动剂组中信号有不同程度降低,表示rig-i的体外激活。
8.参见图2,示出了荧光标记的rig-i与不同rna共孵育后信号的改变。u55,长度为55个碱基的多聚尿嘧啶;slr,5
’‑
三磷酸修饰的茎环结构rna,数字代表双链rna的长度;pppns,5
’‑
三磷酸修饰的线性rna;oh-slr14,5
’‑
未修饰的茎环结构rna,双链长度为14个碱基;p(i:c),聚肌胞苷酸。
9.然而,该方法仍旧存有以下不足。主要为:1.文中所使用的氨基酸替换需要使用trna改造的大肠杆菌进行蛋白表达,而该菌株尚未商业化应用,因此技术实现有一定难度;同时,局限于该方法,所表达的蛋白缺乏真核生物的蛋白修饰;2.文中rig-i蛋白表达后要进行两步的荧光素标记,反应时间较长,对蛋白的活性会有潜在不利影响;3.文中给出的rig-i激活的信号变化不超过60%,信号窗口较小。
技术实现要素:
10.本发明提供基于均相时间分辨荧光技术的体外rig-i激活检测的方法,其具有快速高通量的测定潜力、良好的信号检测窗口及显著的激动剂对rig-i活性的影响。
11.为了实现上述目的,本发明采用以下的技术方案:基于均相时间分辨荧光技术的体外rig-i激活检测的方法,其特征在于,所述方法通过将rig-i蛋白分为card结构域片段和解旋酶结构域片段,并以二者片段的结合程度反应rig-i的活性,同时采用均相时间分辨荧光技术对rig-i的活性进行量化。
12.一些实施方案中,所述方法包括以下步骤:s10:将纯化的仅含card结构域的蛋白片段与仅含解旋酶结构域的蛋白片段共稀释于溶解有rig-i激动剂或待检测物的缓冲液中;s20:对card结构域片段和解旋酶结构域片段进行荧光抗体标记;s30:读取反应体系激发后的荧光信号并经计算转换成rig-i的活性值。
13.一些实施方案中,在步骤s10中,所述缓冲液包括用于稳定反应体系酸碱度的酸溶液、用于模拟生理环境盐度的金属盐溶液、用于模拟细胞内低氧分压环境的还原剂、用于模拟细胞内高浓度蛋白环境的牛血清白蛋白及用作rig-i辅助因子的atp与镁盐溶液。
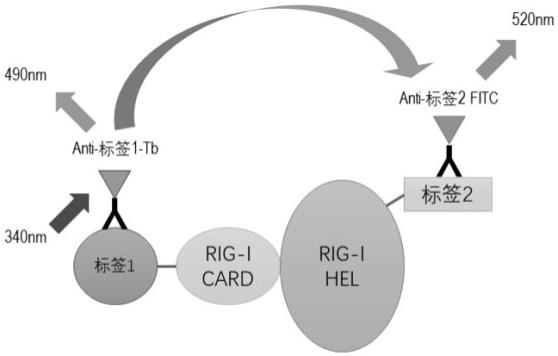
14.一些实施方案中,所述atp溶液的添加浓度位于2~5mm之间。
15.一些实施方案中,在步骤s20中,所述card结构域片段和解旋酶结构域片段预先融合用于蛋白纯化和后续抗体标记的标签,所述用于蛋白纯化的标签不能干扰后续抗体的识别或者利用蛋白酶纯化后进行切除;所述card结构域片段和解旋酶结构域片段需要各自融合不同的标签用于抗体的识别,各识别标签的抗体之间不存在交叉反应,且均不与rig-i存在交叉反应;以及
选择的抗体均含有荧光素标记,且荧光素对可产生能量共振转移现象。
16.一些实施方案中,用于纯化目的的融合标签选自gst、多聚组氨酸、sumo及mbp中的至少一种;和/或,用于抗体识别的融合标签选自gst、flag、myc、v5及ha中的至少一种;和/或,所标记的荧光素组合可以为铽(tb)与异硫氰基荧光素(fitc)、dylight 488、alexa flour 488中的一种;也可以为铕(eu)和apc进行组合。
17.一些实施方案中,在步骤s30中,利用酶标仪读取反应体系激发前后的荧光信号rnλ1/λ2,其中,所述λ1为标记解旋酶结构域片段荧光素的发射波长,所述λ2为标记card结构域片段荧光素的发射波长。
18.一些实施方案中,依据公式a=(1-d/d0)*100%计算出rig-i的活性值,其中,d来源于rig-i激活检测条件下rigi-card和rigi-hel共孵育组读数rnλ1/λ2_card和rigi-hel单独组读数rnλ1/λ2_back,其计算方法具体为:d =rnλ1/λ2_card
ꢀ‑ꢀ
rnλ1/λ2_back;d0来源于对照阴性样品未激活条件下rigi-card和rigi-hel共孵育组读数rnλ1/λ2_card0和rigi-hel单独组读数rnλ1/λ2_back0,其计算方法具体为:d
0 = rnλ1/λ2_card0ꢀ‑ꢀ
rnλ1/λ2_back0。
19.一些实施方案中,所述rig-i蛋白来源于人源,并通过昆虫表达系统或哺乳动物表达系统进行表达制备。
20.一些实施方案中,所述card结构域片段与解旋酶结构域片段共稀释于缓冲液后的物质的量浓度比值为1:4。
21.本发明采用以上技术方案至少具有如下的有益效果:1.通过将rig-i蛋白分为rigi-card和rigi-hel,利用二者蛋白的结合程度反应rig-i的活性,并以均相时间分辨荧光技术对rig-i的活性进行量化,方案中采用荧光信号读数准确量化激动剂或待检测物对rig-i的激活程度,从配置反应体系到读数之间仅需6h,而且检测信噪比约为4.357,检测显著性(z
’‑
factor)约为0.5328,满足研发要求的前提下,极大的提升了检测效率;同时,htrf技术由于极大降低了激发光带来的本底信号,可提高信号窗口;2.使用基于人源rig-i蛋白的氨基酸序列,可以最大限度反应人源rig-i的蛋白活性;更进一步的,使用贴近生理环境条件的缓冲液,使反应体系有稳定ph的成分、生理的盐度,镁盐和atp为蛋白rig-i提供协同分子,牛血清白蛋白模拟细胞内高浓度蛋白环境,以及还原性物质模拟细胞内低氧分压环境,其反应结果,更能真实反应rig-i的活性水平;3.本技术蛋白的表达制备比较简便,考虑到潜在的修饰,可采用目前普遍使用的昆虫表达系统或哺乳动物表达系统进行表达制备,若条件不足也可使用商业化的原核表达系统尝试,蛋白表达后仅需纯化即可使用,并不需要在反应前进行荧光素标记;4.本技术测定蛋白rig-i的激活,采用的是非细胞体外测定系统,能改善待测物无法穿过细胞膜而不能接触到蛋白的问题,同时能避免待测物通过其他通路或途径间接调节rig-i活性,以及直接激活下游信号通路导致激活的假象。
附图说明
22.为了更清楚的说明本发明实施例中的技术方案,下面将对实施例中所需要使用的附图及其标记作简单的介绍,显而易见地,下面描述的附图仅仅是本发明的一些实施例,对于本领域的普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
23.图1为文献1中rig-i不同结构域间相互作用的实验结果;图2为文献2中荧光标记的rig-i与不同rna共孵育后信号改变的实验结果;图3为本发明的反应原理图;图4为rig-i活性随聚肌胞苷酸浓度变化曲线图;图5为atp浓度与rn490读数的线性关系图;图6为atp浓度与rn520读数的线性关系图;图7为atp浓度与d0数值的线性关系图;图8为rigi-card终浓度与rn520/490的线性关系图;图9为蛋白rigi-card和rigi-hel组与蛋白gst和rigi-hel组的读数rn520/490比较图;图10为添加聚肌胞苷酸组与未处理组的读数差d比较图。
具体实施方式
24.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。实施例中所用到的各种常用试剂,均为市售产品。
25.htrf 均相时间分辨荧光,homogeneous time-resolved fluorescence;rig-i 视黄酸诱导基因i,retinoic acid-inducible gene i;rna 核糖核酸;sds-page 变性聚丙烯酰胺凝胶电泳以分子量分离变形蛋白样品手段;atp 腺嘌呤核苷三磷酸;gst 谷胱氨肽转移酶;poly(i:c) 聚肌胞苷酸,双链rna类似物,可用于rig-i的激活。
26.一些实施例中,提出一种基于均相时间分辨荧光技术的体外rig-i激活检测的方法,通过将rig-i蛋白分为card结构域片段和解旋酶结构域片段,并以二者片段的结合程度反应rig-i的活性,同时采用均相时间分辨荧光技术对rig-i的活性进行量化,参见图3。
27.该实施方式中采用荧光信号读数准确量化激动剂或待检测物对rig-i的激活程度,极大的提升了检测效率;同时,htrf技术由于极大降低了激发光带来的本底信号,可提高信号窗口。
28.该方法包括步骤:s10:将纯化的仅含card结构域的蛋白片段与仅含解旋酶结构域的蛋白片段共稀释于溶解有rig-i激动剂或待检测物的缓冲液中。
29.该缓冲液包括用于稳定反应体系酸碱度的酸溶液、用于模拟生理环境盐度的金属
盐溶液、用于模拟细胞内低氧分压环境的还原剂、用于模拟细胞内高浓度蛋白环境的牛血清白蛋白及用作rig-i辅助因子的atp与镁盐溶液。
30.一些具体实施方式中,缓冲液主要由tris-hcl (ph 7.5)、 nacl、 kcl、mgcl2、牛血清白蛋白、 tcep和 atp组成,反应体系中的tcep可用同类还原剂dtt代替,为了防止空气氧化和自降解,tcep和atp每次均新鲜配制和添加。
31.该实施方式中使用贴近生理环境条件的缓冲液,其反应结果,更能真实反应rig-i的活性水平。
32.s20:对card结构域片段和解旋酶结构域片段进行荧光抗体标记。
33.一些具体实施方式中,card结构域片段和解旋酶结构域片段预先融合用于蛋白纯化和后续抗体标记的标签,其中,用于蛋白纯化的标签不能干扰后续抗体的识别或者利用蛋白酶纯化后进行切除;后续抗体识别需要求rigi-card和rigi-hel在检测过程中各自融合不同的标签,各识别标签的抗体之间不存在交叉反应,且均不与rig-i存在交叉反应。
34.一些优选方式中,用于纯化目的的融合标签选自gst、多聚组氨酸、sumo及mbp中的至少一种; 用于抗体识别的融合标签选自gst、flag、myc、v5及ha中的至少一种。
35.一些具体实施方式中,选择的抗体均含有荧光素标记,荧光素对可产生能量共振转移现象,并且,抗体荧光素的信号观测需满足酶标仪的设置。
36.抗体依照蛋白rigi-card和rigi-hel的标签设计,可采用不同的抗标签抗体组合,使得抗体分别只结合单一蛋白;也可采用仅抗蛋白rigi-card和仅抗蛋白rigi-hel的抗体,配对使用。
37.一些优选方式中, 所标记的荧光素组合可以为铽(tb)与异硫氰基荧光素(fitc)、dylight 488、alexa flour 488中的一种;也可以为铕(eu)和apc进行组合,其读数波长相应调整为615nm和665nm。
38.s30:读取反应体系激发后的荧光信号并经计算转换成rig-i的活性值。
39.一些具体实施方式中,利用酶标仪读取反应体系激发后的荧光信号rnλ1/λ2,其中,λ1为标记解旋酶结构域片段荧光素的发射波长,λ2为标记card结构域片段荧光素的发射波长;为了平衡rig-i激动剂或待检测物本身对读数的影响,需要进行对照阴性样品的读数测定;依据公式a=(1-d/d0)*100%计算出rig-i的活性值,其中,d来源于rig-i激活检测条件下rigi-card和rigi-hel共孵育组读数rnλ1/λ2_card和rigi-hel单独组读数rnλ1/λ2_back,其计算方法具体为:d =rnλ1/λ2_card
ꢀ‑ꢀ
rnλ1/λ2_back;d0来源于对照阴性样品未激活条件下rigi-card和rigi-hel共孵育组读数rnλ1/λ2_card0和rigi-hel单独组读数rnλ1/λ2_back0,其计算方法具体为:d
0 = rnλ1/λ2_card0ꢀ‑ꢀ
rnλ1/λ2_back0。
40.若反应体系中不存在处理,则d = d0,rig-i活性为0%,表示蛋白rigi-card和rigi-hel处于结合平衡状态;而当d = 0时,则定义为100%活性,表示蛋白rigi-card和rigi-hel完全解离。解离程度越高,rig-i的活性越大。
41.一些实施例中,通过测定不同浓度下的rig-i激动剂聚肌胞苷酸(poly(i:c))激活
rig-i的水平制作出rig-i活性标准曲线。
42.步骤1:基于人源rig-i蛋白的氨基酸序列,将rig-i分为两个蛋白片段:rigi-card;其中,rigi-card的n端添加了标签1,用于蛋白纯化和抗体标记;rigi-hel的n端添加了标签2和标签3,分别用于抗体标记和纯化。
43.步骤2:配置反应体系所用缓冲液。取以下物质于烧杯内混合: 12.5ml 1m tris-hcl (ph7.5)(invitrogen,15567-027)、2.1915g nacl(vetec,v900058)、2.7956g kcl(general-reagent,g80636b)、0.2380g mgcl2(sigma-aldrich,m8266)及0.0500g牛血清白蛋白(sigma-aldrich,b2064),添加纯水并搅拌混匀,定容至500ml,溶液于4℃保存。
44.步骤3:以纯水配置母液1 m tcep(sigma-aldrich,c4706)和100mm atp(energy-chemical,e120475),配置完成后于-20℃保存。
45.步骤4:反应前,向缓冲液中添加tcep和atp,使终浓度分别为0.3mm和3 mm。
46.步骤5:将聚肌胞苷酸粉末(invivogen,tlrl-pic-5)溶解于生理盐水中,配制成10 mg/ml母液,于-80℃保存。反应前用缓冲液稀释成2.0 mg/ml样品,并以1:9梯度稀释成8个浓度。
47.步骤6:将蛋白gst(近岸蛋白novoprotein,cg20)和蛋白rigi-card分别稀释于两管缓冲液中,使其终浓度达到100 nm。再向管中加入蛋白rigi-hel至终浓度为400 nm。吹打混匀。
48.步骤7:将两组蛋白稀释液分别和聚肌胞苷酸等体积混合于1.5ml带盖微量离心管(泰坦,ep0150-b-lb-a-zx)中,吹打混匀。于4℃静置60分钟。
49.步骤8:将铽结合抗标签1抗体和异硫氰基荧光素结合抗标签2抗体共稀释于缓冲液中,其终浓度分别为350 nm和1.40 um。抗体稀释液随后与蛋白/聚肌胞苷酸混合液以1:5比例混合,吹打混匀。
50.步骤9:将混合好的样品转移至384孔板(greiner bio-one,784075)中,每孔约10ul样品,每个样品3个重复。500 x g离心15秒。于4℃静置30分钟。
51.步骤10:采用spectramax id5(molecular devices)进行读板。读板参数为350nm波长激发,读取490nm和520nm波长信号,滞后0.1毫秒后收集,曝光时间为0.4毫秒,闪烁频数为20。该孔的读数分别为520nm与490nm波长信号值,记作rn520和rn490。两者之比为最终读值,记为rn520/490。对于相同处理,蛋白gst和rigi-hel组读数记为rn520/490_back,蛋白rigi-card和rigi-hel组读数记为rn520/490_card,两者的差值用d表示。其中,没有经过聚肌胞苷酸共孵育组的差值定义为d0。
52.步骤11:采用以下公式计算指定聚肌胞苷酸浓度下rig-i的活性:a=(1-d/d0)*100%以聚肌胞苷酸浓度为横坐标,rig-i活性为纵坐标作图,可得到rig-i活性随聚肌胞苷酸浓度变化曲线,参见图4。
53.采用以下公式对曲线进行非线性回归:y = bottom ( x ^ hillslope ) *( top
ꢀ–ꢀ
bottom ) / (x ^ hillslope ec50 ^ hillslope)最终可求得ec50为1.92 ug/ml,emax为76.6%。
54.一些实施例中,通过测定不同浓度atp水平下rig-i静息状态信号强度用于在使用不同蛋白反应时优化缓冲液中组分浓度。
55.步骤a:重复步骤1-3。
56.步骤b:反应前,向缓冲液中添加tcep,使终浓度为0.3 mm。向缓冲液中加入不同量的atp母液,使反应体系中atp终浓度分别为0 mm,1.8mm,3 mm和5 mm。
57.步骤c:在两管1.5ml带盖微量离心管中,将蛋白gst和蛋白rigi-card分别稀释于反应体系中,使其终浓度达到50 nm。再向管中加入蛋白rigi-hel,使其终浓度为200 nm。吹打混匀,并于4℃静置60分钟。
58.步骤d:重复步骤8-10。
59.步骤e:以atp浓度为横坐标,rn490或rn520为纵坐标作图,如图5-6所示(虚线和空心点为蛋白gst和rigi-hel组,实线和实心点为蛋白rigi-card和rigi-hel组)。由图可知,atp最佳浓度应低于5mm,使得rn490和rn520的数值不出现明显的下降。
60.步骤f:以atp浓度为横坐标,d0为纵坐标作图,如图7所示(虚线和空心点为蛋白gst和rigi-hel组,实线和实心点为蛋白rigi-card和rigi-hel组)。atp最佳浓度位于2~5mm,使得d0取得极大值。进一步可得atp最佳浓度为3mm。
61.一些实施例中,通过测定不同浓度蛋白水平下rig-i静息状态信号强度用于在使用不同蛋白反应时优化蛋白浓度。
62.步骤一:重复示例一中的步骤1-4。
63.步骤二:将蛋白rigi-card稀释于缓冲液中至终浓度为400nm,并以1:1梯度稀释成7个浓度。将蛋白rigi-hel稀释于缓冲液中至终浓度为400nm。将两者等体积混合于1.5ml带盖微量离心管中,吹打混匀。
64.步骤三:重复步骤8-10。
65.步骤四:以rigi-card终浓度为横坐标,rn520/490为纵坐标作图,如图8所示。由图可知,rigi-card最佳浓度应为50nm,使得rn520/490取得极大值,也即card结构域片段与解旋酶结构域片段共稀释于缓冲液后的浓度比值为1:4最优。
66.本技术具有快速高通量测定的潜力,当蛋白准备好后,整个测定过程不超过6小时,且有比较好的信号窗口。如图9所示,12次实验的结果分析可见,实线/实心点所示的蛋白rigi-card和rigi-hel组与虚线/空心点所示的蛋白gst和rigi-hel组的读数rn520/490比较,检测信噪比约为4.357,检测显著性(z
’‑
factor)约为0.5328,满足一般研发的要求。
67.本技术可以显著检测到rig-i激动剂对活性的影响。若在反应体系中添加聚肌胞苷酸(poly(i:c))至终浓度1.0 mg/ml,即可检测到rig-i激活信号。如图10所示,10次实验的结果分析可见,实线/实心点所示的添加聚肌胞苷酸组与虚线/空心点所示的未处理组的读数差d比较,检测信噪比约为5.319,检测显著性(z
’‑
factor)约为0.5574,满足一般研发的要求。
68.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明的保护范围应以所附权利要求为准。
69.本领域技术人员应当理解,虽然本发明是按照多个实施例的方式进行描述的,但是并非每个实施例仅包含一个独立的技术方案。说明书中如此叙述仅仅是为了清楚起见,本领域技术人员应当将说明书作为一个整体加以理解,并将各实施例中所涉及的技术方案
看作是可以相互组合成不同实施例的方式来理解本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。