一种伊达比星微球制剂
发明领域
1.本发明属于药物制剂领域,具体而言,涉及一种伊达比星微球制剂和提高伊达比星微球的载药性能的方法。
2.发明背景
3.蒽环类化合物是一类广泛应用于治疗血液系统恶性肿瘤和实体肿瘤的物质,其中(7s,9s)-9-乙酰基-7,8,9,10-四氢-6,7,9,11-四羟-7-o-(2,3,6-三脱氧-3-氨基-α-l-来苏-已-吡喃糖)-5,12-骈四苯盐酸盐,即4-脱甲氧柔红霉素(下文称为伊达比星),结构如下:
[0004][0005]
伊达比星是治疗复发性和难治性的成人急性髓细胞白血病(aml)的一线用药,由法玛西亚普强公司开发生产,1990年09月27日经fda批准上市,2004年由cfda批准上市。上市的剂型有2种:胶囊和注射剂。
[0006]
传统的注射制剂仍然存在一些缺陷,如1)给药不方便,耗费较多时间和精力;2)经济性差;3)带来更多的痛苦;4)有潜在的风险如感染、静脉炎、渗漏、血栓等并发症,甚至有空气栓塞的致命危险。因此亟需结合新型制剂技术对传统的伊达比星注射剂进行改造。
[0007]
新型注射制剂中进展最快的有微球和脂质体,其中微球与传统注射制剂相比具有如下优势:可调节的药物释放控制并最大限度地减少体内药物浓度的波动;平稳释药以减少药物暴露引起的副作用;由于注射频率减少,患者顺应性良好。目前,我国微球的国产品种较少,如亮丙瑞林、曲普瑞林和奥曲肽。将微球技术应用到伊达比星注射剂时如何提高载药和释药性能也是本发明需要解决的问题。
技术实现要素:
[0008]
本发明的目的在于提供一种伊达比星的微球,从而延长其血液循环时间,降低毒副作用并提高其被动靶向性能。
[0009]
本发明的目的还在于提供一种提高伊达比星微球的载药性能的方法。
[0010]
一方面,本发明提供了一种伊达比星微球,所述微球选自或
[0011]
另一方面,本发明还提供了一种提高伊达比星微球的载药性能的方法,所述方法通过控制微球类型、投料量、载药介质、载药方式和载药浓度等因素实现。
[0012]
在一些实施方案中,所述微球选自callispheres微球或hepasphere微球。
[0013]
在一些典型的实施方案中,所述微球的粒径为50~500μm。
[0014]
在一些实施方案中,所述微球选自100~300μm callispheres微球、300~500μm callispheres微球、干态粒径为50~100μm的hepasphere微球。
[0015]
在一些实施方案中,载药介质选自注射用水和5%葡萄糖注射液。
[0016]
在一些实施方案中,所述方法还包括载药方式,载药方式选自提高载药温度和超声载药,其中所述载药温度优选37℃。
[0017]
在一些实施方案中,所述方法的载药浓度,选自0.25-2mg/ml,优选1-2mg/ml,更优选1.5mg/ml。
[0018]
在一些具体的实施方案中,本发明提供了一种提高伊达比星微球的载药性能的方法,该方法包括控制:
[0019]
(1)微球类型选自100~300μm callispheres微球、300~500μm callispheres微球或50~100μmhepasphere微球;
[0020]
(2)载药介质为注射用水或5%葡萄糖注射液;
[0021]
(3)载药方式为37℃孵育或超声载药;
[0022]
(4)载药浓度为1-2mg/ml。
[0023]
在一些实施方案中,本发明提供了测定载药效率的方法,该方法包括将前处理的微球加入工作液。
[0024]
在一些具体的实施方案中,本发明提供了测定载药效率的方法,具体有:
[0025]
(1)微球前处理;
[0026]
(2)配置工作液;
[0027]
(3)取前处理后的微球加入工作液,混匀,以一定载药方式载药;
[0028]
所述步骤(1)使用载药介质前处理;
[0029]
所述步骤(2)使用注射用水稀释伊达比星粉针剂;
[0030]
所述步骤(3)的微球为100~300μm callispheres微球、300~500μm callispheres微球和hepasphere微球;所述载药方式包括室温孵育、37℃孵育和超声载药。
[0031]
所述方法还包括取适量步骤(3)的上清,用流动相稀释后进样测定,计算载药效率。
[0032]
本领域技术人员可以根据需求调整步骤(1)和(2)的顺序。
[0033]
本发明中,如无特殊规定,以下术语具有如下含义:
[0034]
或“callispheres微球”均为微球的商品名;
[0035]
或“hepasphere微球”均为微球的商品名;
[0036]“pbs”是指磷酸盐缓冲溶液;
[0037]“fbs”是指胎牛血清;
[0038]“nacl”是指氯化钠;
[0039]“glu”是指葡萄糖;
[0040]“生理盐水”是指浓度为0.9%的氯化钠水溶液;
[0041]“干态粒径”是指微球为干态粉末时的粒径。
附图说明
[0042]
图1为实施例1的不同投药量下的100~300μm callispheres微球载药曲线图
[0043]
图2为实施例1的不同投药量下的300~500μm callispheres微球载药曲线图
[0044]
图3为实施例1的不同投药量下的hepasphere微球载药曲线图
[0045]
图4为实施例2的不同载药介质下的100~300μm callispheres微球载药曲线图
[0046]
图5为实施例2的不同载药介质下的300~500μm callispheres微球载药曲线图
[0047]
图6为实施例2的不同载药介质下的hepasphere微球载药曲线图
[0048]
图7为实施例3的三种载药方式下的300~500μm callispheres微球载药曲线图
[0049]
图8为实施例4的不同载药浓度下的300~500μm callispheres微球载药曲线图
[0050]
图9为实施例5的最终伊达比星载药条件下的载药曲线图
[0051]
图10为实施例5的载药微球与碘帕醇混合后的稳定性图
[0052]
图11为实施例6的微球极限载药时间曲线图
[0053]
图12为实施例7的三种微球在pbs中的释放曲线
[0054]
图13为实施例7的三种微球在pbs 10%fbs中的释放曲线
[0055]
图14为实施例8的不同微球载药前后的水化粒径分布图
[0056]
图15为实施例8的三种微球载药、释放前后在光学显微镜下的照片(
×
40)
[0057]
图16为实施例8的三种微球载药前后的扫描电镜图(
×
1000)
具体实施方式
[0058]
本发明具体实施方式中使用的原料设备均为已知产品,通过购买市售产品获得。
[0059]
实验方法
[0060]
(1)伊达比星含量测定的高效液相色谱法:
[0061]
色谱柱:agilent eclipse plus c18(4.6
×
150mm,5μm);
[0062]
流动相:甲醇-0.1%磷酸(体积比)=70:30;
[0063]
流速:1ml/min;
[0064]
柱温:25℃;
[0065]
检测波长254nm,进样量10μl。
[0066]
将伊达比星对照品用dmso溶解得储备液,再用流动相稀释得到一系列浓度梯度的伊达比星溶液进样,开展系统适应性、线性和回收率等方法学验证
[0067]
(2)微球前处理
[0068]
将1支总体积约为8ml的100~300μm callispheres微球充分摇匀后,吸取一定体积的混悬液,静置待微球沉淀,小心吸弃上清。用相应载药介质(注射用水、0.9%nacl或5%glu)润洗3遍,小心吸弃上清,备用。
[0069]
300~500μm callispheres微球的前处理方法同上。hepasphere微球为干态粉末,先加入8ml生理盐水重建10min,而后的前处理方法同上。
[0070]
载药效率(%)=(初始上清液药物浓度
–
载药后上清液药物浓度)/初始上清液药物浓度
×
100%
[0071]
粒径测定或计算:使用激光粒径仪进行测定,取测定结果的d[4,3]数值作为平均粒径。
[0072]
实施例1投药量对伊达比星载药效率的影响
[0073]
将1支注射用盐酸伊达比星粉针剂用5.0ml注射用水溶解,得浓度为2mg/ml的母
液。将母液进一步用注射用水稀释至500μg/ml,作为工作液。
[0074]
取用注射用水前处理的100~300μm callispheres微球若干份,加入相应体积的上述工作液,使得投药量分别相当于每支微球5mg、10mg、15mg、20mg、40mg,混匀后室温孵育,于0min、5min、10min、15min、30min、45min、60min、90min取适量上清,用流动相稀释后进样测定,计算载药效率。
[0075]
300~500μm callispheres微球和hepasphere微球同法测定。
[0076]
三种微球在不同投药量下对伊达比星载药效率的实验结果见表1~3,载药曲线如图1~3。
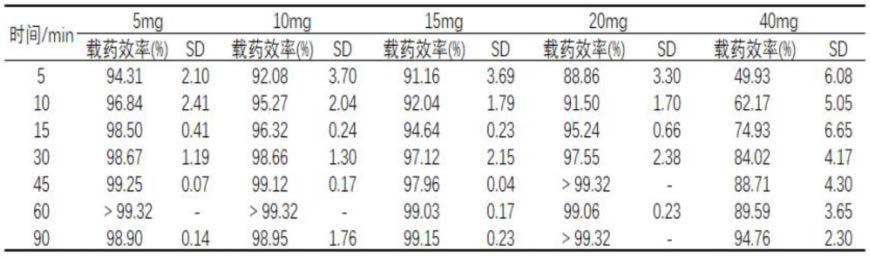
[0077]
表1不同投药量下100~300μm callispheres微球载药结果(n=3)
[0078][0079]
表2不同投药量下300~500μm callispheres微球载药结果
[0080][0081]
表3不同投药量下hepasphere微球载药结果(n=3)
[0082][0083]
从结果可以看出,在较高投药量40mg时,对于callispheres栓塞微球,小粒径栓塞微球的载药效率高于大粒径栓塞微球,呈现一定的径效关系。与callispheres栓塞微球相比,在20mg及以下的投药量时hepasphere栓塞微球的载药速率和载药能力基本相同,但在较高投药量40mg时,其表现出比callispheres更高的载药速率和载药能力。
[0084]
总的来看,三种栓塞微球均可以作为伊达比星良好的载药平台,具有载药量高、载
药速率快的特性。
[0085]
实施例2载药介质对伊达比星载药效率的影响
[0086]
取3支注射用盐酸伊达比星粉针剂,分别用5.0ml注射用水、5.00ml 0.9%nacl和5.00ml 5%glu溶解,得2mg/ml母液。将上述母液分别用相应溶剂稀释至500ug/ml,作为三种溶剂对应的工作液。
[0087]
分别取用注射用水、0.9%nacl和5%glu前处理的100~300μm callispheres微球,分别加入对应工作液,使得投药量相当于每支微球20mg,混匀后室温孵育,于0min、5min、10min、15min、30min、45min、60min、90min取适量上清,用流动相稀释后进样测定,计算载药效率。
[0088]
300~500μm callispheres微球、hepasphere微球同法测定。
[0089]
三种微球在不同载药介质下对伊达比星载药效率的实验结果见表4~6,载药曲线如图4~6。
[0090]
表4载药介质对100~300μm callispheres微球载药效率的影响(n=3)
[0091][0092]
表5载药介质对300~500μm callispheres微球载药效率的影响(n=3)
[0093][0094]
表6载药介质对hepasphere微球载药效率的影响(n=3)
[0095][0096]
不同载药介质对三种栓塞微球载药能力影响的结果可以看出,采用注射用水和5%葡萄糖注射液作为载药介质对伊达比星具有更高的载药能力,而以生理盐水作为介质时,对伊达比星的载药能力明显下降。
[0097]
实施例3载药方法对伊达比星载药效率的影响
[0098]
实验所用工作液同实施例1。
[0099]
取注射用水前处理的300~500μm callispheres微球若干份,加入工作液使得投药量相当于每支微球20mg,混匀后分别与室温孵育、37℃孵育、超声三种条件下载药,于0min、5min、10min、15min、30min、45min、60min、90min取适量上清,用流动相稀释后进样测定,计算载药效率。
[0100]
300~500μm callispheres微球在不同载药介质下对伊达比星载药效率的实验结果见表7,载药曲线如图7。
[0101]
表7载药方式对300~500μm callispheres微球载药效率的影响(n=3)
[0102][0103]
结果显示,采用提高载药温度(37℃孵育)和超声载药的方式,均可明显提高伊达比星的载药速率。
[0104]
实施例4药物浓度对伊达比星载药效率的影响
[0105]
将1支注射用盐酸伊达比星粉针剂用5.0ml注射用水溶解,得浓度为2mg/ml的母液。将母液进一步用注射用水分别稀释至250ug/ml、500ug/ml、1mg/ml、1.5mg/ml作为工作液,2mg/ml的工作液直接取用母液。取注射用水前处理的300~500μm callispheres微球若干份,分别加入相应体积不同浓度的工作液,使得投药量均相当于每支微球20mg,混匀后室温孵育,于0min、5min、10min、15min、30min、45min、60min、90min取适量上清,用流动相稀释后进样测定,计算载药效率。
[0106]
300~500μm callispheres微球在不同载药浓度下对伊达比星载药效率的实验结果见表8,载药曲线如图8。
[0107]
表8载药浓度对300~500μm callispheres微球载药效率的影响(n=3)
[0108][0109]
药物浓度对栓塞微球载药效率的影响结果表明,药物浓度对栓塞微球的载药效率具有显著性的影响,随着药物浓度的提高,载药效率随之提高。
[0110]
实施例5最终伊达比星载药条件与碘帕醇稳定性
[0111]
将1支注射用盐酸伊达比星粉针剂用5.0ml注射用水溶解,得浓度为2mg/ml的母液,直接作为工作液。分别取注射用水前处理的100~300μm callispheres微球、300~500μm callispheres微球、hepasphere微球,分别加入工作液使使得投药量均相当于每支微球20mg,混匀后室温孵育,于0min、5min、10min、15min、30min、45min、60min、90min取适量上清,用流动相稀释后进样测定,计算载药效率。同法制备载药微球,但不取上清测定,载药30min后加入等体积的碘帕醇注射液,混匀后室温放置,于0min、10min、20min、30min、45min、60min、90min、120min、240min取适量上清,用流动相稀释后测定,计算药物泄漏率。
[0112]
三种微球在最终确定的载药条件下对伊达比星载药效率的实验结果见表9,载药曲线如图9。载药微球加入碘帕醇后的稳定性结果见表10,泄漏率如图10。
[0113]
表9最终伊达比星载药条件下的载药数据(n=3)
[0114][0115]
表10载药微球与碘帕醇混合后的稳定性(n=3)
[0116]
[0117]
三种载药栓塞微球载药后与造影剂碘帕醇混合后的溶液稳定性结果表明,载药栓塞微球与造影剂混合后在4小时内的药物泄漏率小于1%,对于calllispheres,栓塞微球粒径越小,药物越容易泄露;与两种粒径的callispheres栓塞微球相比,heasphere载药微球的药物泄漏率更低,稳定性更佳。
[0118]
实施例6极限载药测试
[0119]
将1支注射用盐酸伊达比星粉针剂用5.0ml注射用水溶解,得浓度为2mg/ml的母液,直接作为工作液。分别取注射用水前处理的100~300μm callispheres微球、300~500μm callispheres微球和hepasphere微球,分别加入工作液使使得投药量均相当于每支微球40mg,混匀后室温孵育,于0min、5min、10min、15min、30min、45min、60min和90min取适量上清,用流动相稀释后进样测定,计算载药效率。
[0120]
三种微球极限载药测试时对伊达比星载药效率的实验结果见表11,载药曲线如图11。
[0121]
表11微球极限载药结果(n=3)
[0122][0123]
实施例7载药微球的体外释放研究
[0124]
按最终确定的伊达比星载药条件制备3种载药微球,使用流通池法(usp 4)溶出仪测定其体外释放度,释放介质分别选用pbs(ph=7.2~7.4)和加入10%胎牛血清后的pbs,温度为37
±
0.5℃。取样时间点:10min、20min、30min、45min、60min、90min、2h、3h、4h、6h、8h、12h。取样后先10000rpm离心3min使微球沉淀,取上清液按1:1(v/v)加入甲醇、10000rpm离心5min除去蛋白,取上清进样测定。另取游离药物水溶液同法测定,以校正伊达比星的降解。
[0125]
三种微球在pbs中的释放曲线如图12,在含10%fbs的pbs中释放曲线如图13。图中虚线为校正伊达比星降解前的释放曲线。
[0126]
载药微球释放曲线的研究结果表明,载药微球在8h时药物释放量大于75%,微球的粒径对药物的释放具有较为明显的影响,对于callispheres载药栓塞微球,粒径越小,释放速率越快。与两种粒径的callispheres载药栓塞微球相比,hepasphere载药微球的释药速度明显低于calispheres载药微球,表现出良好的缓释特征。当释放介质中加入fbs后,三种载药栓塞微球中伊达比星的释放度呈现明显增加的趋势,表明血清可以明显增加药物的释放速度。
[0127]
实施例8微球载药前后的表征
[0128]
取载药前的3种微球,和按最终确定的伊达比星载药条件制备3种载药微球,分别用激光粒径仪测定粒径分布、用扫描电子显微镜观察形态。另取原始微球、注射用水前处理后的微球、载药后微球、释放72h后的微球,于普通光学显微镜下观察形态。
[0129]
三种微球载药前后的水化粒径及其分布结果如图14所示。
[0130]
三种微球载药前后及释放后在光学显微镜下的照片如图15所示。
[0131]
三种微球载药前后的扫描电子显微镜图如图16所示。
[0132]
三种载药栓塞微球的颗粒表征结果显示,hepaspheres水化重建后的微球粒径约在300μm左右,呈现出良好的接触面可铺展特性,而callispheres微球表现出良好的弹性特征。三种微球载药前后的粒径变化不明显,呈现一定程度的粒径变小趋势。扫描电镜的结果进一步显示出hepasphere微球与接触面具有良好的可舒展性,呈现圆形的平面,干燥后会出明显的干裂现象,而callispheres微球呈现立体球型,反映出该类微球具有良好的弹性特征;三种微球载药后,球体表现出更为光滑的表面特征,提示药物经与微球离子交换作用,可有效的包裹在微球表面。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。