1.本发明涉及纳米医学技术领域,具体涉及一种靶向树突状细胞促进抗原溶酶体逃逸激活免疫系统的抗原递送载体其制备方法与应用。
背景技术:
2.树突状细胞(dendritic cell,dc)是目前所知的功能最强的抗原提呈细胞,处于启动、调控、并维持免疫应答的中心环节,可有效的激活免疫反应。基于dc的免疫疗法是最具前景的免疫治疗策略之一。目前,dc免疫疗法在各大癌症治疗中取得重大突破。aivita biomedical公司公布的ilixadencel dc疫苗在针对转移性肾细胞癌、胶质母细胞瘤、黑色素瘤等恶性肿瘤的治疗中表现优异,大大提高患者的无进展生存率、患者的总生存率和完全缓解率,并且更加安全。基于dc的免疫治疗在提高肿瘤患者治疗效果方面有着振奋人心的成绩,加速高效dc细胞疗法的研究,将推动癌症治疗进入新的时代。
3.然而,dc治疗仍存在一些局限因素。首先,从治疗流程来看,dc治疗通过采用病人自体的单核细胞在体外培养诱导生成dc,然后负载相应的肿瘤抗原,制成负载肿瘤抗原的dc,再将这些dc注入体内后刺激体内的肿瘤杀伤性淋巴细胞增殖,达到消灭肿瘤的目的。整个过程工艺复杂,耗时长,且体外培养存在感染风险,回输人体之后易遭到患者自身免疫细胞的排斥。其次,从抗原负载能力来看,由于抗原本身并不具备靶向性,dc对抗原的负载能力并不高。再次,dc通过内吞小泡摄取外源性抗原,经由溶酶体途径导向mhc ii类复合物,激活辅助性cd4
t细胞而无法高效的直接激活杀伤性cd8
t细胞。以上三点,限制dc免疫治疗效果。发展直接在体内靶向dc、增加dc对抗原的摄取、促使抗原在dc内交叉递呈、增强dc对 cd8
t细胞激活的抗原递送系统,可全面增强dc诱导的免疫应答,成为提高dc 免疫疗效的关键途径。
技术实现要素:
4.针对dc细胞疗法目前存在的问题:1.治疗流程复杂、耗时长;2.dc对抗原摄取提呈效率低;3.无法高效激活cd8
t细胞的问题。本发明提供一种以金属骨架材料为主体,通过靶向配体和质子化修饰,制备具有特异性的靶向dc、提高dc抗原摄取、促进抗原溶酶体逃逸激活cd8
t细胞功能的体内抗原递送载体(金属骨架复合物)的制备方法及应用。该载体在制备过程中直接包覆抗原(ovalbumin,ova,包括但不限于)和免疫佐剂(cpg-odn,包括但不限于),与载体形成体内抗原递送系统,诱导强效的免疫反应,杀伤癌细胞。
5.第一方面,本发明要求保护一种用于向体内递送抗原的载体。
6.本发明要求保护的用于向体内递送抗原的载体为利用聚乙烯亚胺和甘露糖对金属骨架材料进行功能化修饰所得的金属骨架复合物。金属骨架材料为本领域公知的由锌离子和2-甲基咪唑配体组成。
7.其中,所述金属骨架复合物的形状为规则的多边形立方体,粒径可为100-120nm。
在本发明的具体实施方式中,所述金属骨架复合物的粒径为118nm。
8.在一些案例中,所述载体可按照包括如下步骤的方法制备得到:
9.(a1)将锌离子(如六水合硝酸锌zn(no3)2·
6h2o)与聚乙烯亚胺(pei mw 600) 溶解于水中,得到溶液1;
10.(a2)将2-甲基咪唑(2meim)溶于水中,得到溶液2;
11.(a3)将所述溶液1进行磁力搅拌,在磁力搅拌下向所述溶液1中倒入所述溶液2,保持磁力搅拌反应10-15min(如15min)后将混合液在10000-11000rpm(如 10000rpm)转速下离心15min,吸出上清后留沉淀部分,然后向沉淀中加水,得到溶液3;
12.(a4)将d-( )-甘露糖溶于水得到溶液4;
13.(a5)将所述溶液3进行磁力搅拌,在磁力搅拌下向所述溶液3中倒入所述溶液4,保持磁力搅拌反应25-30min(如30min)后将混合液在10000-11000rpm(如 10000rpm)转速下离心15min,沉淀经40-45℃(如45℃)下真空干燥,即为所述载体;
14.其中,所述溶液1中的六水合硝酸锌、聚乙烯亚胺、所述溶液2中的2-甲基咪唑和所述溶液4中的d-( )-甘露糖的配比为0.17mmol:0.0833mmol:11.8mmol:2.77 mmol。
15.第二方面,本发明要求保护一种用于向体内递送抗原的载体的制备方法。
16.本发明要求保护的用于向体内递送抗原的载体的制备方法,可包括前文的步骤 (a1)-(a5)。
17.第三方面,本发明要求保护一种负载有抗原和/或免疫佐剂的体内抗原递送系统。
18.本发明要求保护的负载有抗原和/或免疫佐剂的体内抗原递送系统,可按照包括如下步骤的方法制备得到:
19.(b1)将锌离子(如六水合硝酸锌zn(no3)2·
6h2o)与聚乙烯亚胺(pei mw 600) 溶解于水中,得到溶液1;
20.(b2)将如下1)和2)溶于水中,得到溶液2;
21.1)2-甲基咪唑;
22.2)抗原和/或佐剂;
23.(b3)将所述溶液1进行磁力搅拌,在磁力搅拌下向所述溶液1中倒入所述溶液2,保持磁力搅拌反应10-15min(如15min)后将混合液在10000-11000rpm(如 10000rpm)转速下离心15min,吸出上清后留沉淀部分,然后向沉淀中加水,得到溶液3;
24.(b4)将d-( )-甘露糖溶于水得到溶液4;
25.(b5)将所述溶液3进行磁力搅拌,在磁力搅拌下向所述溶液3中倒入所述溶液 4,保持磁力搅拌反应25-30min(如30min)后将混合液在10000-11000rpm(如10000 rpm)转速下离心15min,吸出上清后留沉淀部分,沉淀经40-45℃(如45℃)下真空干燥,即为所述负载有抗原和/或免疫佐剂的体内递送系统;
26.其中,所述溶液1中的锌离子、聚乙烯亚胺、所述溶液2中的2-甲基咪唑、所述抗原和/或佐剂,以及所述溶液4中的d-( )-甘露糖,配比为0.17mmol的锌离子: 0.0833mmol的聚乙烯亚胺:11.8mmol的2-甲基咪唑:0.0052mmol的抗原: 0.0000248mmol的佐剂:2.77mmol的d-( )-甘露糖。
27.在一些案例中,抗原递送系统为真空干燥粉末。
28.在一些案例中,抗原递送系统粉末溶解于生理盐水/细胞培养基。
29.第四方面,本发明要求保护一种负载有抗原和/或免疫佐剂的体内抗原递送系统的制备方法。
30.本发明要求保护的负载有抗原和/或免疫佐剂的体内抗原递送系统的制备方法,可包括前文步骤(b1)-(b5)。
31.第五方面,本发明要求保护如下任一中的应用:
32.(c1)前文第一方面所述载体或前文第三方面所述系统在向体内递送抗原和/或免疫佐剂中的应用;
33.(c2)前文第一方面所述载体在制备前文第三方面所述递送系统中的应用;
34.(c3)前文第一方面所述载体或前文第三方面所述递送系统在制备树突状细胞疫苗中的应用;
35.(c4)前文第一方面所述载体或前文第三方面所述递送系统在制备免疫刺激剂中的应用;
36.(c5)前文第一方面所述载体或前文第三方面所述递送系统在制备用于杀伤癌细胞的产品中的应用。
37.在上述各方面中,所述抗原可选自如下任意一种或多种:ova、肿瘤特异性抗原、肿瘤干细胞抗原、肿瘤细胞裂解物(肿瘤全细胞抗原)等。
38.在上述各方面中,所述免疫佐剂可选自如下任意一种或多种:细胞-巨噬细胞集落刺激因子、白细胞介素-l、白细胞介素-2、干扰素-γ、toll样受体激动剂、细菌或其产物、无机佐剂等。
39.进一步地,所述toll样受体激动剂可为肽聚糖、cpg-odn、咪喹莫特或瑞喹莫特等;所述细菌或其产物为分枝杆菌(如结核杆菌、卡介苗)、短小棒状杆菌、百日咳杆菌或革兰阴性杆菌内毒素等;所述无机佐剂为氢氧化铝、明矾或磷酸铝等;
40.第六方面,本发明要求保护如下任一产品:
41.(d1)树突状细胞疫苗,为将前文第三方面所述抗原递送系统靶向树突状细胞后所得;
42.(d2)免疫刺激剂,为将前文第三方面所述抗原递送系统与树突状细胞共孵育后所得;
43.(d3)用于杀伤癌细胞的产品,为将前文第三方面所述抗原递送系统与树突状细胞共孵育后,再将所述树突状细胞与t细胞共培养后所得。
44.在上述各方面中,所述癌细胞可为广泛癌症类型细胞,如肺癌、乳腺癌、胃癌、肝癌、宫颈癌、食管癌、结直肠癌、淋巴癌等常见的癌症类型。
45.在上述各方面中,抗原递送系统作为免疫刺激剂的用途,所述免疫刺激包括细胞免疫激活、体液免疫激活和/或肿瘤免疫调控。特别是,本发明的抗原递送系统能促抗原溶酶体逃逸激活cd8
t细胞。
46.本发明提供的抗原递送载体粒径均一、分散性好、生物安全性高、对抗原负载量大,展现出对树突状细胞的的高靶向性,增加树突状细胞对抗原的摄取,促进树突状细胞成熟,并促使抗原在树突状细胞内的交叉递呈,能够高效的激活cd4
和cd8
t 细胞,引起强烈的免疫反应,杀伤癌细胞。该载体应用广泛,可实现对单种、多种抗原的包覆,对广泛癌细胞均具有杀伤能力。本发明解决树突状细胞疫苗抗原摄取提呈效率低、无法高效激活cd8
t细
胞等难点问题,为制备安全、高效的抗肿瘤树突状疫苗提供一种新的纳米级抗原递送载体。
附图说明
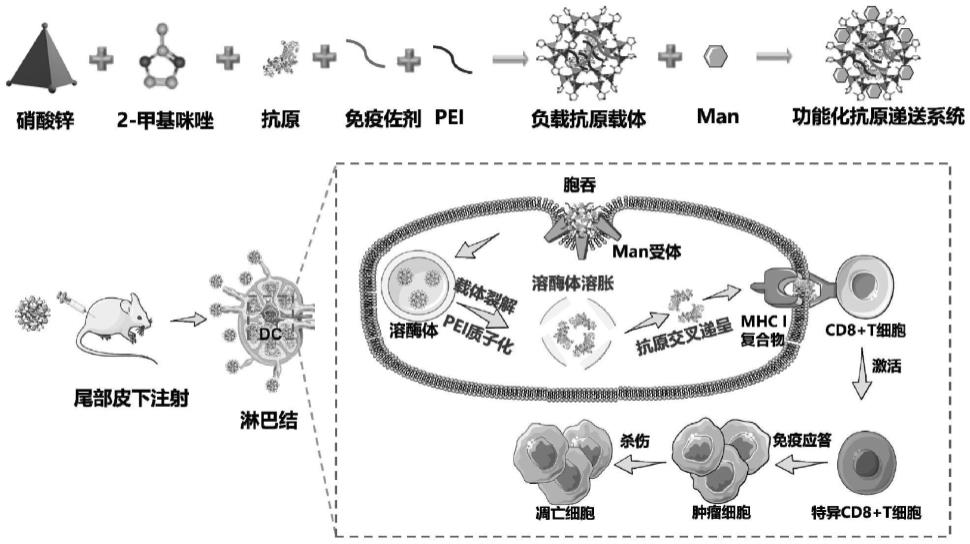
47.图1为体内抗原递送系统制备流程及作用示意图。
48.图2为制备的金属骨架材料(命名为zn-2meim)、抗原递送载体 zn-2meim@pei@man(简写为zpm)的形貌、粒径及表面电势表征。
49.图3为zn-2meim、zpm稳定性及分散性表征。a:真空干燥的zpm呈白色粉末状;b:zn-2meim、zpm在水中分散状态;c:zn-2meim在水中7天的紫外吸收光谱;d:zpm在水中7天的紫外吸收光谱。
50.图4为zn-2meim、zpm载体表面基团及晶型表征。a:红外光谱表征表面基团; b:x射线衍射光谱表征晶型结构。
51.图5为负载抗原和免疫佐剂的功能化抗原递送系统(命名为ova-cpg-zpm)表征。a:透射电镜观察平面形貌;b:扫描电镜观察立体形貌;c:粒径统计;d:水合粒径及表面电势统计。
52.图6为zpm对抗原ova的负载及酸响应释放效率。a:zpm对不同浓度ova 的最高包封效率;b:ova-cpg-zpm不同ph下随时间的抗原释放效率。
53.图7为从人外周血单核细胞(pbmc)中分离dc进行体外诱导培养。
54.图8为从pbmc中分离t细胞进行体外培养。
55.图9为zn-2meim、zpm载体及递送系统ova-cpg-zpm的细胞毒性表征。
56.图10为dc对ova及递送系统ova-cpg-zpm的摄取、抗原的细胞内定位及溶酶体逃逸。白色箭头:dc,紫色箭头:抗原溶酶体逃逸。
57.图11为抗原递送系统ova-cpg-zpm刺激t细胞激活释放细胞因子研究。各实验组与dc共孵育24h后与t细胞共培养24h后检测上清中释放的相关细胞因子浓度。a:inf-γ浓度;b:il-4浓度;c:tnf-α浓度。*p《0.05,**p《0.01,与空白组相比;#p《0.05,##p《0.01,与ova组相比。
58.图12为ldh法检测抗原递送系统ova-cpg-zpm激活t细胞后对癌细胞的杀伤能力。各实验组与dc共孵育12h后与t细胞共培养24h,随后与人肺腺癌细胞 a549和h1975共培养24h,利用ldh检测试剂盒,检测癌细胞的凋亡。a:a549; b:h1975。*p《0.05,**p《0.01,与空白组相比;#p《0.05,##p《0.01,与ova 组相比。
59.图13为抗原递送系统ova-cpg-zpm对小鼠生理指标的影响。a-d:血生化指标变化,其中a为谷丙转氨酶、b为谷草转氨酶、c为尿肌酐、d为乳酸脱氢酶;e:体重变化;f:脏器指数变化。*p《0.05,与空白组相比。
60.图14为抗原递送系统刺激小鼠抗体产生的研究。c57bl/6小鼠尾部皮下注射3 次不同剂量的各组分后,血清中产生的ova特异性免疫球蛋白igg的含量。a:注射剂量10μg;b:注射剂量25μg;c:注射剂量50μg。*p《0.05,**p《0.01,与空白组相比;#p《0.05,与ova组相比。&p《0.05,&&p《0.01,与ova-cpg组相比。
61.图15为活体成像观察抗原递送系统体内的聚集及离体脏器的荧光成像。
具体实施方式
62.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
63.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
64.实施例1、本发明体内抗原递送载体/系统制备流程及作用过程
65.如图1所示,展现了体内抗原递送系统制备流程及作用示意图。
66.一、制备流程
67.1、粒径均一、形貌规则、分散性、稳定性良好的金属骨架材料zn-2meim制备工艺
68.0.05g zn(no3)2·
6h2o(相当于0.17mmol锌离子,sigma-aldrich 228737-100g) 溶解于3ml去离子水中形成溶液1,0.97g 2-甲基咪唑(sigma-aldrich m50850-100g) 溶解于2ml去离子水形成溶液2,将溶液1转移至25ml圆底烧瓶中,500rpm磁力搅拌下,倒入溶液2,加入溶液2后形成的混合溶液立马从澄清变为白色浑浊液体,保持磁力搅拌,反应15min;反应结束后将混合液转移至50ml离心管中,10000rpm (离心半径12cm)离心15min,结束后吸出上清,保留底部沉淀,随后向离心管中加入5ml去离子水,超声下将沉淀重新分散至均匀液体状态,重复离心一遍(10000 rpm(离心半径12cm)离心15min),结束后吸出上清,底部的白色沉淀在45℃下真空干燥至白色粉末保存。得到粒径均一、形貌规则的zn-2meim载体。
69.2、zn-2meim载体进行功能质子化修饰和靶向配体修饰制备抗原递送载体zpm 工艺
70.0.05g zn(no3)2·
6h2o(相当于0.17mmol锌离子)和0.05g(相当于0.0833mmol) 聚乙烯亚胺(pei mw 600,aladding e107077-100g)混合溶解于3ml去离子水中形成溶液1,0.97g(相当于11.8mmol)2-甲基咪唑溶解于2ml去离子水形成溶液2,将溶液1转移至25ml圆底烧瓶中,500rpm磁力搅拌下,倒入溶液2,保持磁力搅拌,反应15min;反应结束后将混合液转移至50ml离心管中,10000rpm(离心半径12cm)离心15min,结束后吸出上清,保留底部沉淀,随后向离心管中加入3ml 去离子水,超声下将沉淀重新分散至均匀液体状态,形成溶液3,将0.5g(相当于 2.77mmol)d-( )-甘露糖(sigma-aldrich m2069-25g)溶解于2ml去离子水中形成溶液4,将溶液3转移至25ml圆底烧瓶中,500rpm磁力搅拌下,倒入溶液4,保持磁力搅拌反应30min;反应结束后将混合液转移至50ml离心管中,10000rpm(离心半径12cm)离心15min,结束后吸出上清,底部的白色沉淀在45℃下真空干燥至白色粉末保存。得到靶向配体man和质子化pei修饰的功能化抗原递送载体,命名为zpm。
71.3、包覆抗原和免疫佐剂的体内抗原递送系统制备工艺(以模式抗原ova和免疫佐剂cpg-odn为例说明)
72.0.05g zn(no3)2·
6h2o(相当于0.17mmol锌离子)和0.05g(相当于0.0833mmol) 聚乙烯亚胺(pei mw 600)混合溶解于2.5ml去离子水中形成溶液1,0.97g(相当于11.8mmol)2-甲基咪唑、0.005g(相当于0.0052mmol)ova(浓度相当于2mg/ml, sigma-aldrich a5503-5g)、150μg(相当于0.0000248mmol)cpg-odn(广州艾基生物技术有限公司)溶解于2.5ml去离子水形成溶液2,将溶液1转移至25ml圆底烧瓶中,500rpm磁力搅拌下,倒入溶液2,保持磁
力搅拌,反应15min;反应结束后将混合液转移至50ml离心管中,10000rpm离心15min,结束后吸出上清,保留底部沉淀,随后向离心管中加入3ml去离子水,超声下将沉淀重新分散至均匀液体状态,形成溶液3,将0.5g(相当于2.77mmol)d-( )-甘露糖溶解于2ml去离子水中形成溶液4,将溶液3转移至25ml圆底烧瓶中,500rpm磁力搅拌下,倒入溶液4,保持磁力搅拌反应30min;反应结束后将混合液转移至50ml离心管中,10000 rpm(离心半径12cm)离心15min,结束后吸出上清,底部的白色沉淀在45℃下真空干燥至白色粉末保存。得到包覆抗原和免疫佐剂的体内抗原递送系统,命名为 ova-cpg-zpm。
73.二、作用过程
74.1、利用树突状细胞(dc)表面大量表达的甘露糖(man)受体与递送系统表面修饰的man的特异性结合,实现递送系统在体内精准靶向dc,通过受体介导内吞作用进入dc内部,经过内吞小泡、内涵体、最后进入溶酶体。
75.2、利用金属骨架载体zn-2meim酸响应裂解性质,释放内部的抗原的免疫佐剂。
76.3、利用聚乙烯亚胺(pei)的质子化效应,造成溶酶体的渗透性溶胀,促使抗原和佐剂的溶酶体逃逸。
77.4、抗原在dc内部交叉递呈,通过mhc i复合物呈递,激活cd8
t细胞;cd8
t细胞诱导强烈的免疫应答,杀死表达肿瘤抗原的癌细胞。
78.实施例2、对制备的zn-2meim及zpm进行形貌观察、粒径和表面电势统计
79.分别对制备的zn-2meim及zpm进行形貌观察、粒径和表面电势统计。如图2 所示,透射电镜观察到制备的zn-2meim载体呈规则的多边形立方体结构,尺寸较均一、分散性良好,平均粒径在105nm,表面电势呈正电,为24.55
±
1.31mv。对 zn-2meim进行pei和man的修饰后,并未改变zn-2meim金属骨架材料的形态,仍然呈规则立体结构,但是水合粒径有所增大,zpm因为pei及man的修饰后,水合粒径增大为118nm。表面电势也相应改变,电位降低至1.23
±
1.04mv。粒径与电势的改变表明本发明对zn-2meim载体的每一步修饰是有效的。
80.实施例3、对zn-2meim、zpm稳定性及分散性表征
81.对zn-2meim、zpm稳定性及分散性表征,具体操作如下:分别称取真空干燥的粉末状zn-2meim、zpm各1g,分散在水中,连续7天,每天用紫外分光光度计检测两种载体的紫外吸收峰值变化。如图3中a所示,真空干燥后的zpm呈白色的粉末状,便于长期保存。将zn-2meim与zpm粉末分散在水中,如图3中b所示,载体可均匀分散在水中,具有良好的分散性。表征其稳定性,zn-2meim和zpm水溶液保存7天,每天利用紫外分光光度计对其吸收峰进行表征,如图3中c、d所示, 2-6天吸收峰的强度保持稳定,第7天吸收峰强度有轻微降低,此结果表明zn-2meim 及zpm具有较高的稳定性。
82.实施例4、对zn-2meim、zpm载体表面基团及晶型表征
83.对zn-2meim、zpm载体表面基团及晶型表征。如图4中a所示,通过红外光谱仪对各个载体的表面基团进行表征,从红外光谱可以看出两种载体均具有明显的 zn-n键、c-n键、c=c键和c-n键,表明zn离子与2-甲基咪唑配位自组装结构的生成,而pei与man并未与zn-2meim形成共价键。图4中b的x衍射图谱可看出,两种载体的衍射峰高尖锐且对称,表明载体的结晶度较高,内部原子质点排列规则。以上表征数据表明,对zn-2meim的修饰不会影响其骨架结构,但是会改变水合粒径及表面电势。
84.实施例5、负载抗原和免疫佐剂的功能化递送系统ova-cpg-zpm表征
85.对负载抗原的功能化递送系统ova-cpg-zpm表征。分别用透射电镜及扫描电镜对ova-cpg-zpm进行观察,如图5中a透射电镜图显示,相比zpm载体, ova-cpg-zpm周边显示粗糙,显示了抗原ova的包覆,图5中b扫描电镜更加直观立体的显示出ova-cpg-zpm内部及表面被ova包覆,但仍然保持较为均一的尺寸及形态。图5中c显示ova-cpg-zpm的粒径分布较为集中。图5中d显示包覆 ova后的水合粒径增加至143nm,由于ova表现为负电荷,因此ova-cpg-zpm的表面电势变为-22.09
±
1.35mv。该图显示了zpm对ova和免疫佐剂的有效负载。
86.实施例6、功能化载体zpm对抗原ova的负载及酸响应释放效率研究
87.对功能化递送载体zpm对抗原ova的负载及酸响应释放效率进行研究。按照实施例1(一、制备流程-3)中的制备流程,将ova投入浓度依次换成0.3mg/ml、0.5 mg/ml、1mg/ml、1.5mg/ml、2mg/ml、2.5mg/ml,其他步骤保持一致。制备完成后,离心收集上清,利用bca检测上清中未被包覆的ova含量,利用“包覆率%= (总量-上清游离量)/总量
×
100%”公式计算zpm对抗原的最大负载量。如图6中a 所示,在ova的浓度较低为0.3mg/ml时,zpm对ova的负载效率很低,但随着 ova投入剂量的增加,zpm对ova的负载效率逐渐提高,当ova投入浓度达到 1mg/ml之后,负载效率趋于平稳,在2mg/ml达到最高75%的包覆率,随后包覆率又开始下降,该结果表明当ova投入剂量达到2mg/ml时zpm对ova具有最高的负载效率。
88.随后,本发明对功能化递送系统ova-cpg-zpm的酸响应释放抗原效率进行探究。用ph计调节制备ph分别为7.4(正常外液ph值)、6.5(内涵体ph值)和5 (溶酶体ph值)的pbs溶液。称取6mg ova-cpg-zpm粉末,分别至于3ml ph 为7.4、6.5和5的pbs溶液中,不同时间后,进行离心,利用bca法测定溶液中释放的抗原效率。如图6中b所示,ova-cpg-zpm在ph 7.4下,释放ova的效率较低,随着溶液酸性增加,ova的释放率增加,在ph为5下,ova的释放率最高达到约92%。该结果表明ova-cpg-zpm具有酸响应特性,在内涵体和溶酶体酸性条件下具有酸响应释放特性。
89.实施例7、从pbmc中分离dc进行体外诱导培养
90.从pbmc中分离dc进行体外诱导培养。具体操作如下:1)复苏pbmc;2) aim-v培养基重悬调整细胞浓度为3-5
×
106/孔(24孔板,培养基体积800μl/孔);3) 37℃培养箱培养2h后,小心晃动孔板,使底层絮状薄层浮起,吸出上清后,留下底部贴壁的细胞,重新在24孔板加培养液(800μl/孔培养液:aim-v 200ng/mlgm-csf 100ng/ml il-4);4)2-3天半量换液,并补足细胞因子;5)培养至第4 天,加tnf-a诱导细胞成熟(换培养液:aim-v 200ng/ml tnf-a);6)培养至第6 天,收获细胞。如图7所示,0天的dc呈圆形,3天时如图箭头所示,dc开始成团生长,并且细胞周围已经开始出现树突状的分支,与文献指出的dc生长情况吻合, 6天时,dc成团生长更加的明显,呈现半悬浮状态,细胞周围明显看到树突状分支,成团半悬浮生长也是dc成熟的标志,表明成功在体外诱导培养成熟dc。
91.实施例8、从pbmc中分离t细胞进行体外培养
92.从pbmc中分离t细胞进行体外培养。具体操作如下:1.复苏pbmc,2.aim-v 培养基重悬调整细胞浓度为3-5
×
106/孔(24孔板,培养基体积800ul/孔),3.37℃培养箱培养2h后,小心晃动孔板收集上层絮状薄层为t细胞,4.t细胞在24孔板中培养(800μl/孔培养液:含20ng/ml il-2的x-vivo培养基)。如图8所示,0天的t细胞,呈圆形悬浮状态,第7天的t细胞,仍呈圆形悬浮状态,并未有太大的变化,符合t细胞生长特性。以上结果表明,成功收集及体外培养t细胞。
93.实施例9、对载体及递送系统的细胞毒性表征
94.利用cck-8试剂盒(beyotime biotechnology c0037)对载体及递送系统的细胞毒性进行表征。具体操作如下:2
×
104个dc接种于96孔板中,dc诱导成熟后,将不同浓度的zn-2meim、zpm、ova-cpg-zpm分别加入dc中,37℃下在细胞培养箱中培养过夜,24h后检测细胞存活率。如图9所示,各组分在150mg/l浓度(以 zn-2meim、zpm、ova-cpg-zpm质量浓度计算)下与dc共培养24h之后,细胞存活率依然在85%以上,表明抗原递送系统具有较低的细胞毒性,为临床转化应用提供良好基础。
95.实施例10、dc对ova及ova-cpg-zpm的摄取、抗原的细胞内定位及溶酶体逃逸研究
96.dc对ova及ova-zpm的摄取、抗原的细胞内定位及溶酶体逃逸进行研究。具体操作如下:根据实施例7中的方案诱导成熟dc,随后向dc(1
×
105细胞/孔)中加入100mg/l的fitc-ova(西安昊然生物科技有限公司产品)、100mg/lfitc-ova-cpg-zpm(按照实施例1(一、制备流程-3)中的制备流程,将ova换成 fitc-ova,其他步骤保持不变),与dc细胞在37℃培养箱中共孵育12h,然后离心(3000rpm,离心半径10cm,5min)收集dc,去除未被摄取的fitc-ova或 fitc-ova-cpg-zpm,收集的dc用200μl的aim-v培养基重悬,并加入2μllyso-tracker red染液(beyotime biotechnology c1046)标记溶酶体,随后将细胞转移至共聚焦小皿,利用激光共聚焦显微镜观察。如图10,白色箭头标记的是dc,从图中看出,单独ova组,标记的三个dc,只有一个dc对ova有摄取,且摄取量少,有的dc细胞几乎不摄取ova,表明单独ova对dc缺乏靶向性,dc有效摄取ova效率低。而ova-cpg-zpm组,标记出的四个dc,均摄取ova,且ova的摄取量相较单独ova组明显更多,表明ova-cpg-zpm对dc具有良好的靶向性,且显著增加dc对抗原的摄取。利用lyso-tracker red标记溶酶体,观察溶酶体与ova 的共定位,图中最后一列紫色箭头标出ova在dc中的定位与红色未重叠,表明 ova-cpg-zpm可有效促进ova的溶酶体逃逸。
97.实施例11、抗原递送系统ova-cpg-zpm刺激t细胞激活释放细胞因子情况
98.对抗原递送系统ova-cpg-zpm刺激t细胞激活释放细胞因子情况进行研究。实验组分为空白对照组、单独孵育ova组和孵育ova-cpg-zpm组。根据实施例7 中的方案诱导成熟dc,随后向dc(1
×
105细胞/孔)中加入20、50、100mg/l各个实验组,与dc细胞在37℃培养箱中共孵育24h,然后离心(3000rpm,离心半径 10cm,5min)收集dc,并计数,收集的dc用200μl的aim-v培养基重悬备用。根据实施例8中方案分离培养t细胞。将上述dc与t细胞以细胞数比例1:10混合,在37℃培养箱共培养24h,随后利用elisa试剂检测t细胞激活释放的相关细胞因子含量(酶联生物:人肿瘤坏死因子α(tnf-α)、人γ干扰素(ifn-γ)、人白细胞介素4(il-4)elisa kit)。如图11所示,ova组可促进ifn-γ、il-4细胞因子的分泌,但对tnf-α的分泌无影响,ova-cpg-zpm各浓度组均可显著的增加ifn-γ、il-4和 tnf-α的分泌,且ova-cpg-zpm组与ova组相比,均具有显著性差异。该结果表明,ova-cpg-zpm具有更显著的激活t细胞能力,促使t细胞分泌更多的免疫细胞因子。
99.实施例12、检测抗原递送系统ova-cpg-zpm激活t细胞后对癌细胞的杀伤能力
100.检测抗原递送系统ova-cpg-zpm激活t细胞后对癌细胞的杀伤能力。实验组分为空白对照组、单独孵育ova组和孵育ova-cpg-zpm组。根据实施例7中的方案诱导成熟dc,随后向dc(1
×
105细胞/孔)中加入25、50、75mg/l各个实验组,与dc细胞在37℃培养箱中共孵育12h,然后离心(3000rpm,5min)收集dc,并计数,收集的dc用200μl的aim-v培养基重悬备用。
根据实施例8中方案分离培养t细胞。将上述dc与t细胞以细胞数比例1:10混合,在37℃培养箱共培养24 h备用。人肺腺癌细胞a549(5
×
103细胞/孔)和h1975(5
×
103细胞/孔)培养在96 孔板中,上述t细胞(5
×
104细胞/孔)分别加入a549与h1975中,在37℃培养箱共培养24h,利用ldh检测试剂盒(elabscience,e-bc-k046-m),检测癌细胞的凋亡。如图12,ova-cpg-zpm组相对单独ova组,检测到溶液中释放的ldh显著提高,表明ova-zpm组对癌细胞的杀伤能力明显增强。
101.实施例13、检测抗原递送系统ova-cpg-zpm对小鼠生理指标的影响
102.选雌性6周龄c57bl/6小鼠(珠海百试通生物科技有限公司)为实验鼠,实验组分为:空白组、zn-2meim、zpm、ova、ova-cpg(制备方法如下:0.00485g(相当于0.005044mmol)ova、150μg(相当于0.0000248mmol)cpg-odn溶解于10ml 去离子水中,制备成浓度为500μg/ml的注射液)、ova-zpm(按照将实施例1(一、制备流程-3)中的制备流程,在制备过程中不加入150μg(相当于0.0000248mmol) cpg-odn,其他步骤保持不变)和ova-cpg-zpm组。称取各实验组5mg,溶解于 10ml去离子水中,制备成浓度为500μg/ml的注射液,向每只c57bl/6小鼠尾部皮下注射100μl注射液,间隔7天注射一次,共注射3次,在第21天,称量每组小鼠体重,通过摘眼球取血,离心收集血清备用,解剖收集小鼠的脏器,称重并计算脏器指数。收集的血清通过试剂盒(elabscience:e-bc-k046-m、e-bc-k236-m、 e-bc-k235-m;酶联生物:小鼠尿肌酐elisa kit)检测血生化指标谷丙转氨酶、谷草转氨酶、尿肌酐、乳酸脱氢酶变化。如图13,只有ova注射组导致了小鼠谷草转氨酶的升高(图13中b),其余各个注射组对小鼠的生理指标(体重变化见图13中e;脏器指数见图13中f;血生化见图13中a、c和d)均未产生显著影响。该结果表明 ova-cpg-zpm具有良好的生物安全性。
103.实施例14、抗原递送系统ova-cpg-zpm刺激小鼠抗体产生的研究
104.选雌性6周龄c57bl/6小鼠(珠海百试通生物科技有限公司)为实验鼠,实验组分为:空白组、zn-2 meim、zpm、ova、ova-cpg、ova-zpm和ova-cpg-zpm 组。分别称取各实验组1mg、2.5mg、5mg,溶解于10ml去离子水中,制备成浓度为100、250、500μg/ml的注射液,向c57bl/6小鼠尾部皮下注射100μl(质量为10、25、50μg)各个实验组,间隔7天注射一次,共注射3次,在第21天,通过摘眼球取血,离心收集血清,用elisa试剂盒(酶联生物,mouse ova-sigg elisa kit) 检测小鼠体内产生的ova特异性抗体免疫球蛋白igg的含量。如图14,10μg、25μgova组未能显著的刺激ova-igg的产生,只有高剂量50μg注射组对ova-igg的产生有促进作用;而低浓度10μg ova-cpg-zpm注射组即可显著的刺激小鼠体内ova-igg抗体的生成。该结果表明,抗原递送系统ova-cpg-zpm具有更有效的免疫激活效果。
105.实施例15、抗原递送系统ova-cpg-zpm在小鼠体内的聚集
106.向c57bl/6小鼠皮下注射100μl 50μg的fitc-ova和fitc-ova-cpg-zpm,不同时间点后用小动物活体成像仪观察体内的聚集情况。如图15,注射0.5h后,小鼠体内均可观察到ova、ova-cpg-zpm,注射6h后,ova-cpg-zpm在小鼠体内的聚集明显多于ova组,注射24h后,ova在小鼠体内几乎观察不到,但是在 ova-cpg-zpm组小鼠体内仍能明显观察到,且大部分ova-cpg-zpm聚集在小鼠腹股沟淋巴结处。该结果表明,抗原递送系统ova-cpg-zpm可有效的靶向至小鼠体内淋巴结,且增长抗原在体内的滞留时间。离体脏器的活体成像未见明显的荧光信号,表明ova/ova-cpg-zpm不在主要的脏器聚集。
107.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和
范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。