一种适用于fama法的vzv感染细胞固定抗原片及其制备方法和应用
技术领域
1.本发明属于血液制品技术领域,具体涉及一种适用于抗膜抗原荧光抗体法(fama法)的vzv感染细胞固定抗原片及其制备方法和应用,特别是该vzv感染细胞固定抗原片在筛选水痘-带状疱疹人免疫球蛋白高效价原料血浆(即含高效价抗vzv中和抗体的原料血浆)以及检测抗vzv中和抗体效价水平中的应用。
背景技术:
2.水痘-带状疱疹病毒(varicella-zoster virus,vzv)属于疱疹病毒科,主要通过呼吸道分泌物和密切接触传播,高危易感人群(孕妇、婴幼儿、免疫抑制/缺陷的成人)感染vzv后可引起极高的致病率甚至死亡。水痘-带状疱疹人免疫球蛋白(varicella-zoster immune globulin,vzig)作为vzv暴露后的紧急预防用药,特别是对于孕妇和新生儿群体来说,具有不可替代的重要作用。
3.vzig是将通过一定的筛选方法及其相应的筛选标准筛选获得的含高效价抗vzv中和抗体的健康人血浆进行混合后,以cohn低温乙醇法及病毒灭活等工艺制备而成的免疫球蛋白制剂。对于vzig的制备,最重要的是筛选含高效价抗vzv中和抗体的原料血浆。目前vzig的原料血浆筛选方法主要是经典的免疫学方法,包括酶联免疫法(enzyme linked immunosorbent assay,elisa)、补体结合试验(complement fixation test,cf)、抗原抗体中和试验(neutralization test,nt)和抗膜抗原荧光抗体法(fluorescent antibody to membrane antigen,fama)等。
4.elisa作为规模化原料血浆的筛选方法,优点是稳定性好、易获得、操作简单、快速,一次可检测大量样品;但vzv的糖蛋白与人疱疹病毒家族其它成员(特别是巨细胞病毒和单纯疱疹病毒hsv)的某些中和抗原具有一定的同源性,可能存在交叉反应并且该方法中的抗原抗体反应并不能直接反映特异性抗体的中和作用,因此对于大规模随机筛选使用具有一定的缺陷。cf和nt试验能够准确反映血浆中水痘特异性抗体的中和效价,但是对于实验材料和操作者的要求较高,没有商品化检测试剂的统一性和便捷性。
5.fama法为who指定的vzv中和抗体效价鉴定方法之一,其主要以vzv毒株感染的二倍体细胞作为检测抗原(即vzv感染细胞抗原),通过荧光标记二抗的作用,在荧光显微镜下可观察到感染细胞表面呈现典型的黄绿色光环,该黄绿色光环为vzv感染细胞特有,具有高灵敏性和特异性,常被用作检测vzv中和抗体的金标准。
6.然而,传统的fama法(例如专利文献cn108181467a,以下称文献1;袁萍等,水痘-带状疱疹病毒膜抗原荧光抗体试验的建立与评价,国际生物制品学杂志,2018年6月第41卷第3期,128-130,以下称文献2)使用的二倍体细胞系(例如人胚肺二倍体成纤维细胞)有严格的生长接触抑制、细胞寿命有限、营养要求高、增殖速度较慢等限制,难以达到短时间内迅速放大培养病毒的试验要求,限制了其在大规模筛选含高效价抗vzv中和抗体的原料血浆中的应用。虽然现有技术(庞宇,水痘-带状疱疹病毒疫苗株在vero细胞中传代适应及elisa
检测血清igg研究,硕士论文,2006,以下称文献3)使用繁殖快、营养要求低和易于大规模培养的vero细胞建立了对vzv减毒疫苗株(vzv北京减毒疫苗株)的大规模培养方法,克服了传统fama法中使用二倍体细胞系作为基质细胞的不足,并且证明了vzv减毒疫苗株(vzv北京减毒疫苗株)可以在vero细胞上稳定传代培养。但是,上述文献3公开的是基于elisa的检测原理对经vzv北京减毒疫苗株感染的vero病变细胞进行破碎裂解提取vzv抗原制成vzv全病毒elisa抗原或vzv糖蛋白elisa抗原,其未能克服上述elisa法在检测抗vzv中和抗体效价方面的缺陷,并且对于由vzv北京减毒疫苗株感染的vero细胞是否能够用于制备适用于fama法的vzv感染细胞固定抗原片并没有任何教导。
技术实现要素:
7.针对现有技术中存在的问题的一个或多个,本发明一个方面提供一种适用于fama法的vzv感染细胞固定抗原片,其包括在经多聚赖氨酸处理的组织原位载玻片上由冷丙酮固定的由vzv-oka病毒液感染72h以上,且病变为50%~75%的vero e6细胞,其中所述vzv-oka病毒液的滴度为2.0
×
105pfu/ml以上,感染复数moi为0.25~0.50,优选为0.30~0.40。
8.上述vzv-oka病毒液由vzv-oka适应毒株病毒液稀释获得,所述vzv-oka适应毒株为vzv-oka减毒疫苗株在vero e6细胞上经适应性传代培养至稳定传代的病毒,优选所述vzv-oka适应毒株病毒液的滴度为3.5
×
106pfu/ml以上。
9.上述vzv感染细胞固定抗原片中,所述vzv-oka减毒疫苗株的滴度为8.0
×
103~1.0
×
104pfu/ml。
10.上述vzv感染细胞固定抗原片中,所述由vzv-oka病毒液感染的时间为72~80h,在经多聚赖氨酸处理的组织原位载玻片上由冷丙酮固定的病变为50%~75%的vero e6细胞的密度为2.5~3.5
×
105个/ml。
11.本发明另一方面提供一种适用于fama法的vzv感染细胞固定抗原片的制备方法,其包括以下步骤:
12.s1:使用滴度为2.0
×
105pfu/ml以上的vzv-oka病毒液感染生长至单层的vero e6细胞,感染复数moi为0.25~0.50,当感染时间达到72h以上,且细胞病变达到50%~75%时,弃掉培养液,用胰酶消化后收集感染细胞,并离心洗涤;
13.s2:将洗涤后的感染细胞的密度调整至2.5~3.5
×
105个/ml,获得感染细胞悬液;
14.s3:将步骤s2获得的感染细胞悬液加至经多聚赖氨酸处理的组织原位载玻片,晾干后用冷丙酮固定,获得所述vzv感染细胞固定抗原片。
15.上述制备方法中,步骤s1中所述vzv-oka病毒液由vzv-oka适应毒株病毒液稀释获得,所述vzv-oka适应毒株病毒液的具体获得操作为:将vzv-oka减毒疫苗株在vero e6细胞上经适应性传代培养至稳定传代,其中所述vzv-oka减毒疫苗株的滴度为8.0
×
103~1.0
×
104pfu/ml,所述适应性传代培养的传代次数为5次以上。
16.上述制备方法中,步骤s3中向经多聚赖氨酸处理的组织原位载玻片(如12孔载玻片)的孔中添加的感染细胞悬液的量为10~15μl/孔,添加的冷丙酮的量为15~20μl/孔。
17.本发明再一方面还提供一种含高效价抗vzv中和抗体原料血浆的筛选方法,其包括以下步骤:
18.t1:按照含高效价抗vzv中和抗体原料血浆的效价筛选标准确定待筛选原料血浆
的稀释倍数,并按照该稀释倍数稀释原料血浆,获得待检原料血浆样品;
19.t2:将步骤t1获得的待检原料血浆样品添加至以上提及的适用于fama法的vzv感染细胞固定抗原片的孔中,添加量为10μl/孔;
20.t3:将步骤t2的vzv感染细胞固定抗原片置于湿盒中37℃孵育1小时后用pbs洗板,随后加入1:100稀释的fitc标记的羊抗人igg,添加量为10μl/孔,再次将vzv感染细胞固定抗原片置于湿盒中37℃孵育30分钟后,用pbs洗板;
21.t4:向步骤t3的vzv感染细胞固定抗原片的孔中添加90%甘油缓冲液1滴,在荧光显微镜下观察是否出现荧光环,出现荧光环的孔对应的待检原料血浆样品即为含高效价抗vzv中和抗体的原料血浆。
22.本发明再一方面还提供一种样品中抗vzv中和抗体效价的检测方法,其包括以下步骤:
23.m1:按照系列梯度稀释样品,获得系列梯度稀释的待测样品;
24.m2:将步骤m1获得的系列梯度稀释待测样品分别添加至以上提及的适用于fama法的vzv感染细胞固定抗原片的孔中,添加量为10μl/孔;
25.m3:将步骤m2的vzv感染细胞固定抗原片置于湿盒中37℃孵育1小时后用pbs洗板,随后加入1:100稀释的fitc标记的羊抗人igg,添加量为10μl/孔,再次将vzv感染细胞固定抗原片置于湿盒中37℃孵育30分钟后,用pbs洗板;
26.m4:向步骤m3的vzv感染细胞固定抗原片的孔中添加90%甘油缓冲液1滴,在荧光显微镜下观察vzv感染细胞固定抗原片上出现荧光环的样品孔,确定该待测样品出现荧光环的最高稀释倍数,根据该最高稀释倍数和抗原片的检测下限计算所述样品中抗vzv中和抗体的效价水平。
27.本发明又一方面还提供一种vzv-oka适应毒株,其能在vero e6细胞上稳定传代且具有高病毒滴度(滴度为3.5
×
106pfu/ml以上),其获得方式为:将病毒滴度为8.0
×
103~1.0
×
104pfu/ml的vzv-oka减毒疫苗株在vero e6细胞进行适应性传代培养;
28.优选地,所述适应性传代培养的代次为5代次以上;
29.更优选地,适应性传代培养6~8代次,获得的适应毒株稳定且病毒滴度达1.0
×
107pfu/ml。
30.基于以上技术方案,本发明首次提供一种快速建立vzv-oka减毒疫苗株在vero e6细胞上的适应毒株的方法,并获得一种可稳定传代且具有较高滴度(3.5
×
106pfu/ml以上)的适应于vero e6细胞培养的vzv-oka适应毒株。基于该vzv-oka适应毒株,本发明提供的适用于抗膜抗原荧光抗体法(fama法)的vzv感染细胞固定抗原片是利用获自该vzv-oka适应毒株的vzv-oka病毒液感染的vero e6细胞制成,经试验验证,提供的vzv感染细胞固定抗原片在检测vzv中和抗体上表现出高灵敏度特性(对who vzv免疫球蛋白国际标准品的检出灵敏度下限为31.25miu/ml),可以有效用于筛选含高效价抗vzv中和抗体的原料血浆或检测样品(例如血液制品、原料血浆)中抗vzv中和抗体的效价。
31.与现有技术相比,本发明具有以下有益效果:
32.1)本发明首次提供一种快速建立vzv-oka减毒疫苗株在vero e6细胞上的适应毒株的方法,并且获得了具有较高的滴度(3.5
×
106pfu/ml以上)的适应毒株,该适应毒株为利用病毒滴度为8.0
×
103pfu/ml以上(8.0
×
103~1.0
×
104pfu/ml)的vzv-oka减毒疫苗株
在vero e6细胞上经适应性传代培养至稳定传代后获得。经验证,将病毒滴度为8.0
×
103pfu/ml以上的vzv-oka减毒疫苗株在vero e6细胞上经适应性传代培养3代次便可以导致vero e6细胞发生明显病变,经适应性传代培养5代次以上便可以获得病毒滴度为3.5
×
106pfu/ml以上的适应毒株,经适应性传代培养6~8代次,更是稳定获得病毒滴度高达约1.0
×
107pfu/ml的适应毒株。而上述文献3使用vzv北京减毒疫苗株(病毒滴度约为1
×
10
4.5
pfu/ml)在vero细胞上需要适应性传代培养10代以上才能获得病毒滴度最高仅为1
×
10
4.7
pfu/ml的适应毒株,并且其获得的适应毒株的滴度相对于vzv北京减毒疫苗株的滴度来说并没有明显变化。因此,相对于上述文献3,本发明可以快速获得具有更高病毒滴度的能在vero e6细胞上稳定传代培养的vzv-oka适应毒株。
33.2)本发明提供的适用于fama法的vzv感染细胞固定抗原片对who vzv免疫球蛋白国际标准品的检测下限能达到31.25miu/ml,明显低于上述文献3中利用其公开的2bs var elisa、vero var elisa和gp elisa对who vzv免疫球蛋白国际标准品的检测下限(分别为781miu/ml、781miu/ml和195miu/ml),因此本发明提供的适用于fama法的vzv感染细胞固定抗原片具有更高的检测敏感性。
34.3)本发明制备适用于fama法的vzv感染细胞固定抗原片所使用的基质细胞为vero e6细胞,其相对于上述文献1和文献2使用的二倍体细胞系具有无可比拟的优点:可以无限增殖,便于建立稳定、特征明确的细胞库;繁殖快,营养要求低,易于大规模培养;因此本发明提供的vzv感染细胞固定抗原片及其制备方法更加适合用于大规模生产和应用,并且相较于上述文献2提供的利用oka疫苗株感染二倍体细胞系制备的vzv感染细胞固定抗原片对who vzv免疫球蛋白国际标准品的检测下限(0.04iu/ml),本发明提供的vzv感染细胞固定抗原片的检测下限更低(31.25miu/ml)。
35.4)本发明制备适用于fama法的vzv感染细胞固定抗原片所使用的病毒株为oka疫苗株,为常用的用于制备水痘减毒活疫苗的病毒株(who the immunological basis for immunization series module 10:varicella-zoster virus),因此本发明利用vzv-oka毒株制备的感染细胞固定抗原片可适用于大规模筛选含高效价抗vzv中和抗体的原料血浆或检测样品(例如血液制品、原料血浆)中抗vzv中和抗体的效价。
附图说明
36.图1为vzv-oka适应毒株感染vero e6细胞的显微镜观察照片,其中a幅表示vzv-oka适应毒株感染vero e6细胞,b幅表示空白对照vero e6细胞;
37.图2为vzv-oka减毒疫苗株在vero e6细胞上连续传代培养8代次后无致密核酸的病毒粒子的透射电子显微镜照片;
38.图3为vzv-oka减毒疫苗株在vero e6细胞上连续传代培养8代次后裸露核衣壳的透射电子显微镜照片;
39.图4为vzv-oka减毒疫苗株在vero e6细胞上连续传代培养的各代次病毒的全长糖蛋白e的pcr鉴定胶图;
40.图5为vzv-oka减毒疫苗株在vero e6细胞上连续传代培养的各代次病毒的ps片段的pcr鉴定胶图;
41.图6为vzv-oka-e6-8代病毒多种糖蛋白的western blot鉴定胶图;
42.图7为vzv-oka-e6-8代病毒的糖蛋白e的western blot鉴定胶图;
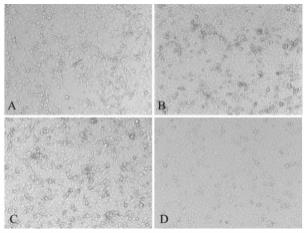
43.图8为不同感染剂量的获自vzv-oka适应毒株的vzv-oka病毒液感染vero e6细胞的显微镜观察照片;
44.图9为本发明的一个实施例制备的vzv感染细胞固定抗原片对不同稀释度的who vzv免疫球蛋白国际标准品检测时的荧光显微镜观察照片;
45.图10为本发明的一个实施例制备的vzv感染细胞固定抗原片对不同稀释度的原料血浆检测时的荧光显微镜观察照片。
具体实施方式
46.本发明利用vzv-oka减毒疫苗株快速建立一种能在vero e6细胞上稳定传代培养,且能够获得高滴度的vzv-oka适应毒株,并基于获自该vzv-oka适应毒株的vzv-oka病毒液感染的vero e6细胞成功制备一种适用于fama法的vzv感染细胞固定抗原片。经验证,本发明制备得到的vzv感染细胞固定抗原片对who vzv免疫球蛋白国际标准品(即上述文献3中使用的who抗vzv国际标准参考血清)的检测下限为31.25miu/ml,明显低于上述文献3中利用其公开的2bs var elisa(利用2bs细胞培养vzv北京减毒疫苗株后破碎感染细胞提取vzv抗原制备的vzv全病毒elisa抗原)、vero var elisa(利用vero细胞培养vzv北京减毒疫苗株后破碎感染细胞提取vzv抗原制备的vzv全病毒elisa抗原)和gp elisa(利用vero细胞培养vzv北京减毒疫苗株后破碎感染细胞提取vzv糖蛋白制备的vzv糖蛋白elisa抗原)对who抗vzv国际标准参考血清的检测下限(分别为781miu/ml、781miu/ml和195miu/ml)。
47.以下结合具体实施例和附图详细说明本发明的内容。
48.在下文中,仅简单地描述了某些示例性实施例。正如本领域技术人员可认识到的那样,在不脱离本发明的精神或范围的情况下,可通过各种不同方式修改所描述的实施例。因此,附图和描述被认为本质上是示例性的而非限制性的。
49.下述实施例中所用方法如无特别说明均为常规方法,具体步骤可参见:《分子克隆实验指南》(《molecular cloning:a laboratory manual》sambrook j.,russell,david w.,molecular cloning:a laboratory manual,3rd edition,2001,ny,cold spring harbor)。
50.实施例中描述到的各种生物材料的取得途径仅是提供一种试验获取的途径以达到具体公开的目的,不应成为对本发明生物材料来源的限制。事实上,所用到的生物材料的来源是广泛的,任何不违反法律和道德伦理能够获取的生物材料都可以按照实施例中的提示替换使用。
51.以下实施例中涉及的引物序列均用已有技术合成。
52.实施例1:vzv-oka减毒疫苗株在vero e6细胞上的适应性传代培养及鉴定
53.该实施例利用vzv-oka减毒疫苗株(北京绿竹生物技术有限责任公司惠赠)在vero e6细胞(北京协和细胞资源中心)上进行适应性传代培养,以获得该疫苗株在vero e6细胞上传代稳定的vzv-oka适应毒株,并对获得的vzv-oka适应毒株进行鉴定,具体包括以下操作步骤。
54.1.1、vzv-oka减毒疫苗株在vero e6细胞上的适应性传代培养
55.1)将vero e6细胞在细胞生长液(含5%新生牛血清与1%双抗的dmem培养液)中以
1:3的传代比例传代24~48h,至细胞汇合度为75%左右的单层;
56.2)弃细胞生长液,用生理盐水洗涤单层的vero e6细胞2次;
57.3)将vzv-oka减毒疫苗株(病毒滴度为8.80
×
103pfu/ml)按照1/10培养液(不含血清的dmem培养液)体积接种至步骤2)的vero e6细胞中,置于37℃、5%co2培养箱感作1h,期间晃动培养瓶3次,同时设立对照;
58.4)按照培养瓶的体积添加维持液(含1%新生牛血清与1%双抗的dmem培养液),在37℃、5%co2培养箱中培养;
59.5)每日观察细胞病变情况,接毒96h后如果无细胞病变效应(cytopathic effect,cpe)产生,采用同步接种的方法将其消化,即留取1/4于原瓶中,再添加同样数量的正常vero e6细胞的消化重悬液,常规培养,同时设立对照;
60.6)当传代后至96h出现明显病变时,按照感染复数moi为0.01进行单层细胞接种,添加维持液至正常培养体积,于37℃、5%co2培养箱中培养,同时设立对照;并重复以上操作至稳定传代3次,每代次于75%细胞病变时收毒,将其置于-70℃
→
4℃条件下反复冻融3次,混匀,添加10%新生牛血清(v/v),分装,于-70℃长期保存。各代次病毒液分别分装并保存,用于各代次病毒滴度的测定(蚀斑法(参见上述文献3中公开的方法))和病毒鉴定。
61.结果表明:接种vzv-oka减毒疫苗株的vero e6细胞,在第3代开始出现明显的细胞病变(细胞呈脱落状病变,细胞病变cpe为25%),测定其病毒滴度达到3.3
×
103pfu/ml,继续传代后,第4代病毒滴度达到2.4
×
105pfu/ml,第5代病毒滴度为3.5
×
106pfu/ml,第6代、7代、8代病毒滴度相当,约为1.0
×
107pfu/ml。
62.从以上结果可见使用vzv-oka减毒疫苗株(病毒滴度为8.80
×
103pfu/ml)在vero e6细胞上进行适应性传代培养时,第5代次以后便可以达到3.5
×
106pfu/ml以上的病毒滴度,并且第6代、7代、8代病毒滴度甚至可以达到约1.0
×
107pfu/ml,因此本发明中将从第5代开始获得的oka毒株称为vzv-oka减毒疫苗株在vero e6细胞上的适应毒株vzv-oka-e6(对应第5代至第8代适应毒株分别命名为vzv-oka-e6-5、vzv-oka-e6-6、vzv-oka-e6-7、vzv-oka-e6-8)。此外,发明人还利用病毒滴度分别为8.0
×
103pfu/ml、1.0
×
104pfu/ml的vzv-oka减毒疫苗株病毒液接种于vero e6细胞上进行适应性传代培养,均获得了与vzv-oka减毒疫苗株(病毒滴度为8.80
×
103pfu/ml)在vero e6细胞上进行适应性传代培养类似的结果。
63.如图1所示,示出了vzv-oka适应毒株vzv-oka-e6感染vero e6细胞的病变情况(a幅),相对于b幅所示的对照细胞,a幅vero e6细胞被vzv-oka适应毒株vzv-oka-e6感染后可见典型的细胞病变情况,cpe的表现形式为聚团明显的带状或桑葚状。
64.1.2、vzv-oka适应毒株的鉴定
65.1.2.1、透射电子显微镜观察病毒粒子
66.将上述步骤1.1中vzv-oka适应毒株vzv-oka-e6-8的病毒培养细胞达到75%左右病变时,反复冻融3次后取均质状态的培养液200μl,12000g离心15min去除细胞碎片;取10μl上清液滴加至400目聚乙烯醇缩甲醛覆盖的铜网上,沉淀1min后滤纸蘸干表面液体;再使用3%磷钨酸固定5min,蘸干后利用透射电子显微镜进行观察;先在40000
×
放大倍数视野下观察,确定为病毒粒子后120000
×
放大倍数拍照。
67.由于vzv属于严格的细胞-细胞生长的病毒,在细胞上清液中鲜见完整的游离病毒
粒子,因此在此试验中我们观察到的多为包膜结构或无包膜裸露的核衣壳结构。完整的vzv病毒粒子直径为150~200nm,不含包膜的核衣壳直径大概为70~100nm,且二十面体的核衣壳外成管束状结构。图2和图3表示为透射电子显微镜观察的无致密核酸的vzv-oka-e6-8代病毒粒子和无包膜结构的vzv-oka-e6-8代病毒的裸露核衣壳的照片,验证了本试验获得的适应毒株符合vzv的一般形态学特征。
68.1.2.2、vzv-oka适应毒株的基因组特定保守区的dna序列鉴定
69.1)使用商品化试剂盒分别提取上述1.1中vzv-oka减毒疫苗株病毒液在vero e6细胞上适应性传代培养8代次的病毒dna;并同步提取正常vero e6细胞基因组作为阴性对照;
70.2)根据ncbi中公布的vzv基因组全序列human herpesvirus 3completment genome(ncbi索引号:nc_001348.1)中的目标基因区域的碱基序列,设计两对引物(表1),分别扩增位于orf32区域的基因片段(ps)和orf68区域内的编码糖蛋白e的全长基因序列(ge),判断各代次病毒特定保守区核苷酸的变异情况;
71.表1:vzv-oka适应毒株保守区核苷酸鉴定用扩增引物
[0072][0073]
注:*与**标注的条件必需同时满足。
[0074]
3)pcr扩增和琼脂糖凝胶电泳鉴定。pcr反应在50μl体系中进行,取5μl病毒/正常细胞基因组dna作为模板,依次加入10
×
reaction buffer 5μl,10mmol/l dntps 8μl,上、下游引物各50pmol,kod dna聚合酶1u,加无菌去离子水至50μl,于pcr仪上进行反应。
[0075]
扩增程序为:94℃预变性5min,94℃ 1min
→
54℃ 45s(扩增ps时选用)/58℃(扩增ge时选用)45s
→
72℃ 1min(扩增ps时选用)/2min(扩增ge时选用),30个循环,72℃延伸5min。扩增产物经1%琼脂糖凝胶电泳分离鉴定。
[0076]
结果如图4和图5所示,其中图4示出的是vzv-oka减毒疫苗株在vero e6细胞上适应性传代培养各代次病毒的全长糖蛋白e(ge)的pcr鉴定结果,图5示出的是vzv-oka减毒疫苗株在vero e6细胞上适应性传代培养各代次病毒的ps片段的pcr鉴定结果,在图4和图5中,m:dl2000 marker;b:空白对照;n:正常vero e6细胞基因组对照(阴性对照);a~k:分别以vzv-oka减毒疫苗株在vero e6细胞上适应性传代培养的第1代~第8代次病毒基因组dna为模板的扩增产物。可见vzv-oka减毒疫苗株在vero e6细胞上适应性传代培养的第1代~第8代次病毒在pcr扩增ge和ps片段上均获得了目的大小的扩增产物,经过对各代次病毒的pcr扩增产物进行测序,并与vzv-oka减毒疫苗株的这两个片段的序列进行比对后发现,所有代次病毒的ge和ps片段序列均一致,并与vzv-oka减毒疫苗株的序列也一致,表明vzv-oka减毒疫苗株在vero e6细胞上适应性培养传代8代次后没有发生序列变异,证明该vzv-oka减毒疫苗株在vero e6细胞上的传代稳定,获得的vzv-oka适应毒株在vero e6细胞上也传代稳定。
[0077]
1.2.3、western blot鉴定vzv-oka适应毒株(vzv-oka-e6-8)糖蛋白的表达
[0078]
参照上述文献3中第三章公开的方法,将vzv-oka-e6-8病毒感染vero e6细胞后,提取病毒糖蛋白。随后进行sds-page对不同分子量的蛋白进行分离,方法参照《分子克隆》进行。蛋白样品进行sds-page分离之后,将其转移至硝酸纤维素膜上,进行western blot鉴定,其中一抗为who vzv免疫球蛋白国际标准品(50iu/ml)(购自英国nibsc公司,货号w1044)或羊抗vzv-ge多抗(购自santa cruz公司),分别按照1:200倍和1:500倍稀释,二抗分别为hrp标记羊抗人igg(h l)、hrp标记兔抗羊igg(h l)(均购自北京中衫金桥生物技术有限公司),按照1:3000稀释。
[0079]
vzv-oka-e6-8病毒糖蛋白的表达鉴定结果如图6和图7所示,其中图6示出的是vzv-oka-e6-8病毒的多种糖蛋白(gb、gh、ge和gi)的表达情况,图7示出的是vzv-oka-e6-8病毒的ge的表达情况,在图6和图7中,a:正常vero e6细胞纯化糖蛋白;b:vzv-oka-e6-8代病毒纯化糖蛋白,可见纯化的感染细胞膜中的病毒糖蛋白可被vzv免疫球蛋白国际标准品识别,四种表达量相对较高的主要糖蛋白ge、gh、gb和gi分子大小符合预期;图7说明通过抗ge多抗作为一抗时,仅能识别其中一种蛋白,相应蛋白分子大小与图6和文献报道均相符。以上结果说明,适应株病毒中和抗原表达符合vzv表达中和抗原的一般特性,因此可用于客观反映样品(例如血液制品、原料血浆或其组合)中的抗vzv中和抗体水平。
[0080]
实施例2:适用于fama法的vzv感染细胞固定抗原片的制备
[0081]
该实施例利用上述实施例1获得的vzv-oka适应毒株vzv-oka-e6,测得其滴度为2.48
×
107pfu/ml。将该滴度的vzv-oka-e6适应毒株病毒液进行稀释,作为感染病毒液感染vero e6细胞来制备适用于fama法的vzv感染细胞固定抗原片,具体包括以下操作步骤。
[0082]
2.1、vzv-oka-e6病毒感染剂量的优化
[0083]
选择处于对数生长期生长状态良好的vero e6细胞接种于6孔细胞培养板中,每孔的细胞接种量为4
×
105个,于37℃、5%co2培养箱中孵育24h。使用滴度为2.48
×
107pfu/ml的vzv-oka适应毒株病毒液分别稀释成6.20
×
104pfu/ml、1.24
×
105pfu/ml和2.48
×
105pfu/ml的vzv-oka-e6病毒液,每个滴度分别取500μl的病毒感染量感染生长至单层的vero e6细胞(约4
×
105个细胞/孔),即感染剂量分别为3.1
×
104pfu/孔(moi为0.0775)、6.2
×
104pfu/孔(moi为0.155)和1.24
×
105pfu/孔(moi为0.31),72h后观察细胞病变。病变程度达“ ~ ”(其中“ ”表示50%的细胞出现病变,“ ”表示75%的细胞出现病变)时最为适宜。
[0084]
结果如图8所示,其中a幅、b幅、c幅分别表示使用3.1
×
104pfu/孔、6.2
×
104pfu/孔、1.24
×
105pfu/孔病毒感染剂量感染的vero e6细胞病变情况,d幅表示对照vero e6细胞,明显可见3.1
×
104pfu/孔和6.2
×
104pfu/孔的病毒感染剂量在72h后未能达到细胞病变标准,而1.24
×
105pfu/孔病毒感染剂量在72h后达到细胞病变标准,细胞病变程度大约为50%~60%,因此该试验选择大约1.24
×
105pfu/孔病毒感染剂量用于感染vero e6细胞,此时病毒的感染复数moi约为0.31。根据本条件的优化过程,感染复数是影响细胞病变程度的重要因素,当感染复数moi较低(如0.155)时,感染的vero e6细胞在72h后病变程度不能达到50%~75%;但是当感染复数moi(如0.51)较高时,感染的vero e6细胞在72h后病变程度可能会超过75%。因此本发明在制备适用于fama法的vzv感染细胞固定抗原片时,感染复数控制为0.25~0.50,优选为0.30~0.40,以保证感染的vero e6细胞在72h后的病变程度维持在50%~75%范围内。且根据本条件的优化过程以及图8中c幅所示的细胞病变程度,
在同等病毒感染量(500μl/孔)的情况下,使用更高滴度的病毒液进行感染也是可以的。而如果用于感染vero e6细胞的病毒液的滴度较低时,例如为1.0
×
104pfu/ml时,为了达到0.25~0.50的moi,其病毒感染量就需要为至少10ml,即使用于感染vero e6细胞的病毒液滴度达到1.0
×
105pfu/ml时,为了达到0.25~0.50的moi,其病毒感染量也需要至少1.0ml,显然这在制备vzv感染细胞固定抗原片中是不现实的,因此在使用vzv-oka病毒液感染的vero e6细胞制备适用于fama法的vzv感染细胞固定抗原片时,需要保证vzv-oka病毒液具有较高的病毒滴度,应为2.0
×
105pfu/ml以上。
[0085]
2.2、感染细胞抗原片固定液的优化
[0086]
2.2.1、选择30%乙醇、4%多聚甲醛、-20℃预冷的丙酮为固定液制备vzv感染细胞固定抗原片。利用上述实施例1获得的vzv-oka适应毒株vzv-oka-e6病毒液(滴度为2.48
×
107pfu/ml)的稀释液感染(1.24
×
105pfu/孔的病毒感染剂量)生长至单层的vero e6细胞,72h后待病变达“ ~ ”时,弃掉培养液(dmem),用胰酶消化后收集感染细胞,1200r/min离心5min洗涤,重复洗涤3次后用pbs将细胞密度调整为2.5~3.5
×
105个/ml。将感染细胞加至12孔组织原位载玻片,每孔10μl细胞悬液,晾干后选择-20℃预冷的丙酮、30%乙醇、4%多聚甲醛为固定液,每孔15μl,重复2次。待固定液挥发后,加入pbs洗板,重复3次。
[0087]
2.2.2、将who vzv免疫球蛋白国际标准品50倍稀释后进行1:2、1:4、1:8、1:16、1:32、1:64稀释,对应的vzv免疫球蛋白国际标准品浓度为500miu/ml、250miu/ml、125miu/ml、62.5miu/ml、31.25miu/ml、15.625miu/ml,加至上述步骤2.2.1制备的vzv感染细胞固定抗原片,每孔10μl,置于湿盒中37℃孵育1小时;用pbs洗板,重复3次;加入1:100稀释的fitc标记的羊抗人igg(beyotime公司),每孔10μl,置于湿盒中37℃孵育30分钟;用pbs洗板,重复3次;每孔加90%甘油缓冲液1滴。于荧光显微镜下观察结果,感染细胞表面出现荧光环(黄绿色)者判为阳性,未出现者判为阴性。
[0088]
结果如下表2所示,可见使用-20℃预冷的丙酮为固定液制备的感染细胞固定抗原片,可检测的vzv免疫球蛋白国际标准品最低浓度为31.25miu/ml;而使用30%乙醇、4%多聚甲醛为固定液制备的感染细胞固定抗原片,可检测的vzv免疫球蛋白国际标准品最低浓度仅为62.5miu/ml。因此本发明中制备vzv感染细胞固定抗原片时选择使用-20℃预冷的丙酮为固定液,可以最大程度上保留感染细胞膜上的抗原,提高vzv感染细胞固定抗原片的检测灵敏度。
[0089]
表2:不同固定液的感染细胞固定抗原片灵敏度检测结果
[0090][0091]
注:“ ”代表检测结果为阳性;“-”代表检测结果为阴性。
[0092]
2.3、vzv感染细胞固定抗原片的制备
[0093]
基于以上步骤2.1和2.2的优化结果,该步骤制备vzv感染细胞固定抗原片的具体
操作为:选择处于对数生长期生长状态良好的vero e6细胞接种于6孔细胞培养板中,每孔的细胞接种量为4
×
105个,于37℃、5%co2培养箱中孵育24h。用vzv-oka-e6病毒液感染(1.24
×
105pfu/孔病毒感染剂量)生长至单层的vero e6细胞,72h后待病变达“ ~ ”时,弃掉培养液,用胰酶消化后收集感染细胞,1200r/min离心5min洗涤,重复洗涤3次后将细胞密度调整至2.5~3.5
×
105个/ml。将感染细胞加至经多聚赖氨酸处理的12孔组织原位载玻片,每孔10μl细胞悬液,晾干后加入-20℃预冷的丙酮,每孔15μl,重复2次。待丙酮挥发后,加入pbs洗板,重复3次,制备得到vzv感染细胞固定抗原片。
[0094]
利用制备的vzv感染细胞固定抗原片对不同浓度的who vzv免疫球蛋白国际标准品进行检测,以确定上述制备的vzv感染细胞固定抗原片的检测灵敏度,具体包括以下操作:将vzv免疫球蛋白国际标准品50倍稀释后进行1:2、1:4、1:8、1:16、1:32、1:64稀释,对应的vzv免疫球蛋白国际标准品浓度为500miu/ml、250miu/ml、125miu/ml、62.5miu/ml、31.25miu/ml、15.625miu/ml,加至vzv感染细胞固定抗原片,每孔10μl,置于湿盒中37℃孵育1小时;用pbs洗板,重复3次;加入1:100稀释的fitc标记的羊抗人igg,每孔10μl,置于湿盒中37℃孵育30分钟;用pbs洗板,重复3次;每孔加90%甘油缓冲液1滴。于荧光显微镜下观察结果,感染细胞表面出现荧光环者判为阳性,未出现者判为阴性。
[0095]
检测结果如图9所示,其中a幅~f幅分别表示vzv免疫球蛋白国际标准品浓度为500miu/ml~15.625miu/ml的观察结果,g幅表示pbs缓冲液对照的观察结果,可见本发明制备的vzv感染细胞固定抗原片的检测下限能够达到浓度为31.25miu/ml的who vzv免疫球蛋白国际标准品,具有较低的检测下限,并且明显低于上述文献3中利用其公开的2bs var elisa、vero var elisa和gp elisa对who抗vzv国际标准参考血清的检测下限(分别为781m iu/ml、781m iu/ml和195m iu/ml),也明显低于市场上已有的用于检测vzv抗体的elisa试剂盒(例如vzv var elisa igg kit(检测下限为250m iu/ml)和vzv elisa igg kit(检测下限为1.01iu/ml))的检测下限。因此本发明提供的适用于fama法的vzv感染细胞固定抗原片克服了现有技术中普遍认为的在检测血清抗vzv igg的方法中,敏感性方面存在gpelisa≈ent>var elisa≈fama(请参见上述文献3中第四章讨论部分)的技术偏见,本发明反而利用vzv-oka病毒液感染的vero e6细胞制备得到一种具有更高的检测敏感性的适用于fama法的vzv感染细胞固定抗原片。
[0096]
实施例3:利用vzv感染细胞固定抗原片筛选含高效价抗vzv中和抗体的原料血浆和检测抗vzv中和抗体的效价水平
[0097]
该实施例利用上述实施例2制备的vzv感染细胞固定抗原片对原料血浆中的抗vzv中和抗体效价水平进行检测,具体包括以下步骤:将原料血浆(深圳卫光生物制品股份有限公司提供,单采血浆)56℃补体灭活30min。用pbs缓冲液将灭活后的原料血浆稀释10倍后,再进行倍比稀释,得到1:160、1:320、1:640、1:1280、1:2560共5个稀释度,将各稀释度样品加至实施例2制备的vzv感染细胞固定抗原片,每孔10μl,置于湿盒中37℃孵育1小时;用pbs洗板,重复3次;加入1:100稀释的fitc标记的羊抗人igg,每孔10μl,置于湿盒中37℃孵育30分钟;用pbs洗板,重复3次;每孔加90%甘油缓冲液1滴。于荧光显微镜下观察结果,感染细胞表面出现荧光环(黄绿色)者判为阳性,未出现者判为阴性。
[0098]
结果如图10所示,其中a幅~e幅分别表示1:160、1:320、1:640、1:1280、1:2560的血浆观察结果,f幅表示pbs缓冲液对照的观察结果,可见利用上述实施例2制备的vzv感染
细胞固定抗原片能够检测至稀释度为1:1280的原料血浆,由于vzv感染细胞固定抗原片的检测下限为31.25miu/ml,因此可以确定该实施例中检测的原料血浆样品中抗vzv中和抗体的效价为40iu/ml,证明本发明提供的vzv感染细胞固定抗原片确实可以检测原料血浆样品中的抗vzv中和抗体效价,因此可以用于筛选含高效价抗vzv中和抗体的原料血浆。例如当利用本发明提供的vzv感染细胞固定抗原片筛选含效价为40iu/ml以上的抗vzv中和抗体的原料血浆时,可以统一将原料血浆按照1:1280进行稀释,然后利用本发明提供的vzv感染细胞固定抗原片对稀释后的原料血浆样品分别进行检测,如果在荧光显微镜下能够观察到感染细胞表面出现荧光环,则证明该原料血浆中含有效价为40iu/ml以上的抗vzv中和抗体。
[0099]
最后应说明的是:以上所述仅为本发明的优选实施例,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。