1.本发明涉及肿瘤诊断领域,具体涉及一种非小细胞肺癌的多重荧光免疫组化分析试剂盒及其使用方法。
背景技术:
2.最新癌症负担数据显示,肺癌的发病率与病死率非常高。非小细胞肺癌(non-small cell carcinoma,nsclc)约占所有肺癌的85%。在肺癌患者中大多数都属于非小细胞肺癌。非小细胞是由于吸烟、长期接触化学物质、受到了大气的污染或者肺部受到了慢性感染引起的一种疾病。目前,手术、化疗(基于铂类药物的治疗方案)、放疗、放化联合治疗以及靶向疗法(单独或组合)仍是肺癌的常规疗法。首先,手术切除肿瘤和附近淋巴结是早期疾病最一致和最有效的治疗方法。之后,当手术不是理想解决方案时,会推荐放疗和/或化疗。近年来,随着晚期治疗方案的进步,踊跃出大量的免疫治疗方案以及表观遗传活性药物。
3.过去十年来,越来越多的实体肿瘤治疗引入了靶向t细胞的免疫调节剂来阻断免疫检查点ctla-4(ipilimumab)和pd-1或pdl-1,并且取得了显著的疗效。目前我国已有8大免疫检查点抑制剂获批上市,用于多种癌症类型的治疗。在以pd-1/l1抑制剂为代表的肿瘤免疫治疗中,pd-l1阳性表达与治疗缓解密切相关,但其预测作用相对有限。为了提高疗效预测能力,筛选能够获益更多的患者群体,有研究人员提出在pd-l1基础上增加cd8,分析高密度的cd8 和pd-l1 细胞与durvalumab(德瓦鲁单抗)治疗下非小细胞肺癌患者生存改善之间的联系。然而,现有技术的检测手段及试剂,不能高灵敏、高特异性地预测免疫检查点抑制剂的有效性,限制了对这些免疫检查点抑制剂疗效的预测能力。
技术实现要素:
4.(一)要解决的技术问题
5.鉴于现有技术的上述缺点、不足,本发明提供一种非小细胞肺癌的多重荧光免疫组化分析试剂盒,使用该试剂盒可以有效地预测免疫检查点抑制剂的有效性,且具有极高的特应性和灵敏度。本发明还涉及该分析试剂盒的使用方法。
6.(二)技术方案
7.为了达到上述目的,本发明采用的主要技术方案包括:
8.第一方面,本发明提供一种非小细胞肺癌的多重荧光免疫组化分析试剂盒,其包括:内源性过氧化物酶阻断剂、单克隆抗体组、抗原修复缓冲液、hrp酶标免疫显色试剂、酪胺荧光染色液试剂盒;所述单克隆抗体组包括cd8单克隆抗体、pd-l1单克隆抗体和ck-pan单克隆抗体;所述酪胺荧光染色液试剂盒包含至少三种不同激发波长的tsa荧光染色液。
9.根据本发明的较佳实施例,所述酪胺荧光染色液试剂盒包含tsa488、tsa555、tsa640染色液及信号放大剂。
10.根据本发明的较佳实施例,所述试剂盒还包括(即用型)抗荧光淬灭封片剂。
11.优选地,以上各个试剂可根据检测片量选择产品规格,进行单片检测时加液量一般为100μl/片;单克隆抗体组为即用型试剂。
12.第二方面,本发明提供上述非小细胞肺癌的多重荧光免疫组化分析试剂盒的使用方法,其包括对组织石蜡切片脱蜡及水化后,进行连续三次抗体孵育、免疫显色和荧光染色及信号放大的处理;具体地,
13.分别采用cd8单克隆抗体、pd-l1单克隆抗体和ck-pan单克隆抗体与经过抗原修复液微波法修复及内源性过氧化物酶阻断剂处理的组织进行共孵育,每次孵育后使用hrp酶标免疫显色试剂进行hrp酶标免疫显色,然后对应使用所述酪胺荧光染色液试剂盒中的其中一种tsa荧光染色液进行染色处理,之后进行荧光检测;其中,每种抗体孵育后对应使用一种tsa荧光染色液,不同抗体不共用同一种染色液;
14.通过前述处理,检测出样品中cd8单阳性、pd-l1单阳性、ck-pan单阳性、镜下总细胞数、cd8 pd-l1双阳性以及ck-pan pd-l1双阳性细胞数。
15.根据本发明的较佳实施例,使用抗原修复液进行抗原修复的方法为:将抗原修复液倒入修复杯中,微波炉700-800w高火加热3min,将脱蜡后的玻片放置于修复杯中,再100-150w低火继续加热15min后冷却至室温。进行该步骤前建议先不放样品进行一次预实验,检测15min后液面是否高于样品,避免干片。抗原修复液不能重复使用。
16.根据本发明的较佳实施例,将pd-l1单克隆抗体与经过抗原修复液修复及内源性过氧化物酶灭活的组织进行共孵育后,使用hrp酶标免疫显色试剂进行免疫显色,并用酪胺荧光染色液试剂盒中的tsa555染色液及信号放大剂进行荧光染色及信号放大处理;
17.将cd8单克隆抗体与经过抗原修复液修复及内源性过氧化物酶灭活的组织进行共孵育后,使用hrp酶标免疫显色试剂进行免疫显色,并用酪胺荧光染色液试剂盒中的tsa488染色液及信号放大剂进行荧光染色及信号放大处理;
18.将ck-pan单克隆抗体与经过抗原修复液修复及内源性过氧化物酶灭活的组织进行共孵育后,使用hrp酶标免疫显色试剂进行免疫显色,并用酪胺荧光染色液试剂盒中的tsa640染色液及信号放大剂进行荧光染色及信号放大处理。
19.需要说明的是,在本发明的试剂盒使用过程中,抗体孵育顺序、显色顺序、抗体对应的荧光染料颜色(染色液种类)等均可随意互换,并不仅限于上述顺序和对应关系。
20.根据本发明的较佳实施例,完成所述连续三次抗体孵育、免疫显色和荧光染色及信号放大的处理后,进行封片保存。所述封片方法为:滴加抗荧光淬灭封片剂,用盖玻片封片,避免气泡,长期保存请用透明指甲油对盖玻片边缘进行密封。
21.第三方面,本发明还提供了上述非小细胞肺癌的多重荧光免疫组化分析试剂盒在预测/评估免疫检查点抑制剂对非小细胞肺癌治疗有效性中的应用。
22.优选地,所述预测/评估方法包括:
23.(1)利用分析软件计算检测样品中cd8单阳性、pd-l1单阳性、ck-pan单阳性及镜下总细胞数;
24.(2)利用分析软件计算检测样品中cd8 pd-l1双阳性、ck-pan pd-l1双阳性细胞数;
25.(3)当cd8 pd-l1双阳性>2.14时,判断免疫检查点抑制剂对该待测样品来源的患者治疗有效性高,反之,则有效性低。
26.(三)有益效果
27.本发明的有益效果是:本发明主要基于多重免疫荧光技术,其原理是tsa技术(全称为tvramide sianal amolification)利用辣根过氧化酶(hrp)对靶蛋白进行高密度原位标记,提高检测的灵敏度,大幅提高信噪比。tsa信号不受微波法影响,并能在抗体去除后保留信号,由于tsa是共价键结合,非常稳定。在mwt微波法处理后,可以进行下一轮染色检测,而不必担心会受到上一轮染色中抗体的干扰。因此,即使使用同一种属来源的一抗也就可以实现多色标记(tsa结合方式稳定,通过微波修复后,上一个染色结果不会丢失,即使下一个一抗种属相同,也不会因修复洗脱不充分,而出现与上一个靶点染色结果串色的情况)。每一轮染色换用不同荧光标记的tsa,可对石蜡切片样本多重染色。
附图说明
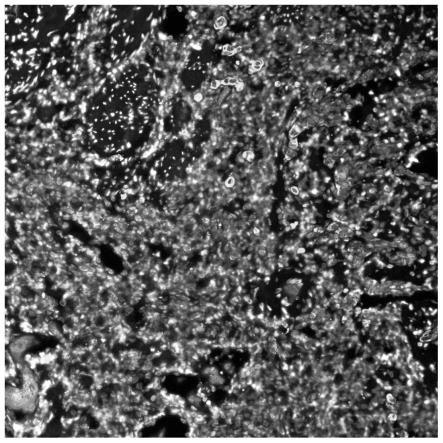
28.图1采用本发明提供的分析试剂盒检测样品中pd-l1(染色液为tsa555)的表达情况。
29.图2为采用本发明提供的分析试剂盒检测样品中cd8(染色液为tsa488)表达情况。
30.图3为采用本发明提供的分析试剂盒检测样品中ck-pan(染色液为tsa640)表达情况。
31.图4为将采用分析软件将三次荧光染色显示的pd-l1(染色液为tsa555)、cd8(染色液为tsa488)和ck-pan(染色液为tsa640)表达进行叠加得到的pd-l1 cd8 ck-pan共表达情况。
32.图5为采用分析软件对图4显示的pd-l1 cd8 ck-pan共表达情况进行抽象化处理的得到的pd-l1 cd8 ck-pan共表达概况。
具体实施方式
33.为了更好的解释本发明,以便于理解,下面结合附图,通过具体实施方式,对本发明作详细描述。
34.本发明提供一种非小细胞肺癌的多重荧光免疫组化分析试剂盒,其包括:内源性过氧化物酶阻断剂、单克隆抗体组、抗原修复缓冲液、hrp酶标免疫显色试剂、酪胺荧光染色液试剂盒;所述单克隆抗体组包括cd8单克隆抗体、pd-l1单克隆抗体和ck-pan单克隆抗体;所述酪胺荧光染色液试剂盒包含至少三种不同激发波长的tsa荧光染色液。
35.优选地,所述酪胺荧光染色液试剂盒包含tsa488、tsa555、tsa640染色液及信号放大剂。
36.优选地,所述试剂盒还包括(即用型)抗荧光淬灭封片剂。
37.优选地,以上各个试剂可根据检测片量选择产品规格,进行单片检测时加液量一般为100μl/片;单克隆抗体组为即用型试剂。
38.以下为本发明较佳实施例的多重荧光免疫组化分析试剂盒的使用方法,所述方法包括:
39.1.样本准备:将石蜡切片于60℃恒温箱中烤片2小时,室温保存备用。
40.2.脱蜡与水化:
41.a.石蜡切片置于新鲜二甲苯中,浸泡15min。处理2次。
42.b.石蜡切片依次置于梯度酒精中(100%,95%,85%,70%),每次3min。
43.c.蒸馏水冲洗1次,pbs冲洗2次,每次3min。
44.3.抗原修复:把1x抗原修复液倒入修复杯中,微波炉高火700-800w加热3min。将脱蜡后的玻片放置于修复杯中,低火100-150w继续加热15min后冷却至室温。(注:进行该步骤前建议先不放样品进行一次预实验,检测15min后液面是否高于样品,避免干片。抗原修复液不能重复使用。)
45.4.内源性过氧化物酶灭活:甩掉多余液体,用免疫组化笔将组织圈住,加入1-3滴即用型内源性过氧化物酶阻断剂完全覆盖组织,室温孵育15min,pbs冲洗2次,每次3min。
46.5.pd-l1单克隆抗体孵育:加入1-3滴即用型pd-l1单克隆抗体完全覆盖组织,37℃湿盒孵育60min,pbs冲洗3次,每次2min。
47.6.二抗孵育:加入1-3滴即用型hrp酶标免疫显色试剂,完全覆盖组织,37℃湿盒孵育30min,pbs冲洗3次,每次2min。
48.7.荧光染色及信号放大:去除玻片上的洗液,在配制管中加入信号放大液0.2ml及200x的tsa 555染色液1μl,混匀后滴加配制好的tsa555工作液,浸没样本区域。室温孵育10min,pbs冲洗3次,每次2min。
49.如图1所示,为采用本发明提供的分析试剂盒检测样品中pd-l1阳性表达情况的荧光染色结果。
50.8.抗原修复:把1x抗原修复液倒入修复杯中,微波炉高火(700-800w)加热3min。将脱蜡后的玻片放置于修复杯中,低火(100-150w)继续加热15min后冷却至室温。(注:进行该步骤前建议先不放样品进行一次预实验,检测15min后液面是否高于样品,避免干片。抗原修复液不能重复使用。)
51.9.内源性过氧化物酶灭活:甩掉多余液体,用免疫组化笔将组织圈住,加入1-3即用型滴内源性过氧化物酶阻断剂完全覆盖组织,室温孵育15min,pbs冲洗2次,每次3min。
52.10.cd8单克隆抗体孵育:加入1-3滴即用型cd8单克隆抗体完全覆盖组织,37℃湿盒孵育60min,pbs冲洗3次,每次2min。
53.11.二抗孵育:加入1-3滴即用型hrp酶标免疫显色试剂完全覆盖组织,37℃湿盒孵育30min,pbs冲洗3次,每次2min。
54.12.荧光染色及信号放大:去除玻片上的洗液,在配制管中加入信号放大液0.2ml及200x的tsa 488染色液1μl,混匀后滴加配制好的tsa488工作液,浸没样本区域。室温孵育10min,pbs冲洗3次,每次2min。
55.如图2所示,为采用本发明提供的分析试剂盒检测样品中cd8阳性表达情况的荧光染色结果。
56.13.抗原修复:把1x抗原修复液倒入修复杯中,微波炉高火(700-800w)加热3min。将脱蜡后的玻片放置于修复杯中,低火(100-150w)继续加热15min后冷却至室温。(注:进行该步骤前建议先不放样品进行一次预实验,检测15min后液面是否高于样品,避免干片。抗原修复液不能重复使用。)
57.14.内源性过氧化物酶灭活:甩掉多余液体,用免疫组化笔将组织圈住,加入1-3滴即用型内源性过氧化物酶阻断剂完全覆盖组织,室温孵育15min,pbs冲洗2次,每次3min。
58.15.ck-pan单克隆抗体孵育:加入1-3滴即用型ck-pan单克隆抗体完全覆盖组织,
37℃湿盒孵育60min,pbs冲洗3次,每次2min。
59.16.二抗孵育:加入1-3滴即用型hrp酶标免疫显色试剂完全覆盖组织,37℃湿盒孵育30min,pbs冲洗3次,每次2min。
60.17.荧光染色及信号放大:去除玻片上的洗液,在配制管中加入信号放大液0.2ml及200x的tsa 640染色液1μl,混匀后滴加配制好的tsa640工作液,浸没样本区域。室温孵育10min,pbs冲洗3次,每次2min。
61.如图3所示,为采用本发明提供的分析试剂盒检测样品中ck-pan阳性表达情况的荧光染色结果。
62.18.封片:滴加抗荧光淬灭封片剂,用盖玻片封片,避免气泡,长期保存请用透明指甲油对盖玻片边缘进行密封。
63.采用计算机软件将图1、图2和图3三次荧光染色显示的pd-l1阳性表达、cd8阳性表达和ck-pan阳性表达进行叠加得到如图4所示的pd-l1 cd8 ck-pan共表达荧光染色情况。图5为对图4抽象化处理的得到的pd-l1 cd8 ck-pan共表达荧光染色概况。
64.然后利用分析软件计算检测样品中cd8单阳性、pd-l1单阳性、ck-pan单阳性、镜下总细胞数、cd8 pd-l1双阳性、ck-pan pd-l1双阳性细胞数等。当cd8 pd-l1双阳性>2.14时,即判断免疫检查点抑制剂对该待测样品来源的患者治疗有效性高;反之,则表示免疫检查点抑制剂对患者治疗有效性低。计算方法如下:
65.①
cd8 单阳性=肿瘤浸润边缘组织cd8单阳性细胞数;
66.②
pd-l1 单阳性=肿瘤浸润边缘组织pd-l1 单阳性细胞数;
67.③
ck-pan 单阳性=肿瘤浸润边缘组织ck-pan 单阳性细胞数;
68.④
cd8 pd-l1 双阳性=肿瘤相关区域cd8 pd-l1 双阳性细胞数;
69.⑤
ck-pan pd-l1 双阳性=肿瘤相关区域ck-pan pd-l1 双阳性细胞数
70.⑥
cd8 占比=(cd8单阳性细胞数
÷
肿瘤浸润边缘组织总细胞数)
×
100%;
71.⑦
pd-l1 占比=(pd-l1单阳性细胞数
÷
肿瘤浸润边缘组织总细胞数)
×
100%;
72.⑧
cd8 pd-l1 占比=(cd8 pd-l1 双阳性细胞数
÷
肿瘤浸润边缘组织总细胞数)
×
100%;
73.⑨
ck-pan 占比=(ck-pan单阳性细胞数
÷
肿瘤浸润边缘组织总细胞数)
×
100%;
74.按照上述方法,利用分析软件计算图4-5中多重免疫荧光检测显示的cd8、pd-l1及ck-pan表达情况,汇总如下表(表1):
75.表1
[0076][0077]
注:*评分的肿瘤相关区域指肿瘤细胞占据的区域以及他们相关的肿瘤内和临近
的肿瘤周围结缔组织肿瘤基质。
[0078]
*其中pd-l1 单阳性细胞数中既包含了圈定的全部肿瘤区域内pd-l1阳性的肿瘤细(tc )也包含了圈定的全部肿瘤区域内pd-l1阳性的浸润免疫细胞(ic )。
[0079]
*其中pd-l1和cd8 双阳性表达肿瘤,显示明显激活的抗原表达和t细胞信号传导增强。
[0080]
利用本发明的多重荧光免疫组化分析试剂盒对免疫检查点抑制剂有效性预测的特异性强、灵敏度高,为实现精确用药提供条件。下面结合具体的应用例进行说明。
[0081]
应用例
[0082]
研究选取120例非小细胞肺癌活检样本,采用多重荧光免疫组化对同一样本进行cd8、pd-l1及ck-pan表达检测,通过分析软件检测cd8、pd-l1的共表达情况。pd-l1高表达定义为任何染色强度下≥25%的肿瘤细胞有表达。
[0083]
表2. 120例非小细胞肺癌患者生存期
[0084][0085]
从表中数据得出,cd8 和pd-l1 联合与经durvalumab治疗的非小细胞肺癌患者预后有密切的相关性。
[0086]
本应用例中使用的一抗、免疫显色试剂、tsa荧光染料、抗荧光淬灭封片剂等试剂信息如下表(表3):
[0087]
表3一抗、免疫显色试剂及荧光染料等试剂信息
[0088][0089]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依
然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
