腺相关病毒载体变体
1.相关申请的引用
2.本技术要求2019年11月22日提交的美国临时申请序列号62/939,315和2020年9月29日提交的美国临时申请序列号63/084,709的优先权,这两个申请的全部内容均在此以引用方式整体并入。
3.对序列表的引用
4.本技术包含序列表,该序列表已经由efs-web以ascii格式提交,并在此以引用方式整体并入。创建于2020年11月19目的所述ascii副本名为chopp0038wo_st25.txt并且大小为63.8千字节。
技术领域
5.本发明大体上涉及医学、病毒学和神经学领域。更特定地说,本发明涉及靶向肽,所述靶向肽将病毒载体靶向递送到脑中的独特结构。
背景技术:
6.已经开发了不同的策略来生成aav载体变体,包括合理设计和定向进化。合理设计方法利用aav衣壳的知识对衣壳进行靶向变化,以改变转导效率或特异性,诸如衣壳表面上用于增加转导效率的酪氨酸突变。定向进化方法不需要任何衣壳结构知识,而是通过随机诱变、衣壳改组或随机肽插入来完成。这些策略通常使用体外系统或小鼠,这对于基于细胞或小鼠的研究是理想的,但并不暗示着向临床的转化。实际上,没有任何aav变体专门或有效地靶向独特脑结构。因此,需要能够靶向独特灵长类脑结构的aav变体。
技术实现要素:
7.本文提供各自包含经修饰的衣壳的病毒载体,其中经修饰的衣壳包含至少一个将病毒载体靶向独特脑结构的氨基酸序列。
8.在一个实施方案中,提供经修饰的腺相关病毒(aav)衣壳蛋白,其包含靶向肽,所述靶向肽将包含经修饰的aav衣壳蛋白的病毒载体靶向独特的器官或脑结构,并且靶向肽的长度为3到10个氨基酸。在一些方面,经修饰的aav衣壳蛋白是经修饰的aav1衣壳蛋白、经修饰的aav2衣壳蛋白或经修饰的aav9衣壳蛋白。
9.在一些方面,经修饰的aav衣壳蛋白衍生自aav1衣壳蛋白(参见seq id no:138),并且靶向肽插入aav1衣壳蛋白的残基590之后。在一些方面,靶向肽的侧翼为接头序列,并且靶向肽的每侧上的接头序列均为两个或三个氨基酸长。在一些方面,接头序列是靶向肽的n末端侧上的ssa和靶向肽的c末端侧上的as。在一些方面,经修饰的aav1衣壳蛋白具有与seq id no:141至少95%相同的序列。
10.在一些方面,经修饰的aav衣壳蛋白衍生自aav2衣壳蛋白(参见seq id no:139),并且靶向肽插入aav2衣壳蛋白的残基587之后。在一些方面,靶向肽的侧翼为接头序列,并且靶向肽的每侧上的接头序列均为两个或三个氨基酸长。在一些方面,接头序列是靶向肽
的n末端侧上的aaa和靶向肽的c末端侧上的aa。在一些方面,经修饰的aav2衣壳蛋白具有与seq id no:142至少95%相同的序列。
11.在一些方面,经修饰的aav衣壳蛋白衍生自aav9衣壳蛋白(参见seq id no:140),并且靶向肽插入aav9衣壳蛋白的残基588之后。在一些方面,靶向肽的侧翼为接头序列,并且靶向肽的每侧上的接头序列均为两个或三个氨基酸长。在一些方面,接头序列是靶向肽的n末端侧上的aaa和靶向肽的c末端侧上的as。在一些方面,经修饰的aav9衣壳蛋白具有与seq id no:143至少95%相同的序列。
12.在一些方面,靶肽包含长度最多达10个氨基酸的序列,其中具有选自由seq id no:1-137和144组成的组的氨基酸序列。在一些方面,靶向肽的长度为7个氨基酸。
13.在一些方面,独特脑结构是脑干、尾核、小脑皮质、大脑皮质、室管膜、苍白球、海马、脑脊膜、视神经、壳核、脊髓、黑质、底丘脑核或丘脑。在某些方面,经修饰的aav衣壳蛋白是经修饰的aav1衣壳蛋白,并且靶向肽选自表1中列出的那些以靶向对应的脑结构。在某些方面,经修饰的aav衣壳蛋白是经修饰的aav2衣壳蛋白,并且靶向肽选自表2中列出的那些以靶向对应的脑结构。在某些方面,经修饰的aav衣壳蛋白是经修饰的aav9衣壳蛋白,并且靶向肽选自表3中列出的那些以靶向对应的脑结构。
14.在一些方面,独特器官是脑、肾脏、心脏、肝脏、生殖腺、脾或肝脏。在某些方面,经修饰的aav衣壳蛋白是经修饰的aav1衣壳蛋白,并且靶向肽选自表4中列出的那些以靶向对应的器官。在某些方面,经修饰的aav衣壳蛋白是经修饰的aav2衣壳蛋白,并且靶向肽选自表5中列出的那些以靶向对应的器官。在某些方面,经修饰的aav衣壳蛋白是经修饰的aav9衣壳蛋白,并且靶向肽选自表6中列出的那些以靶向对应的器官。
15.在一个实施方案中,本文提供包含编码本实施方案中任一项的经修饰的衣壳蛋白的序列的核酸。
16.在一个实施方案中,本文提供了包含本实施方案中任一项的经修饰的衣壳蛋白的重组腺相关病毒(raav)。在一些方面,提供raav的组合。例如,提供具有经修饰的aav1衣壳蛋白和seq id no:21的靶向肽的raav、具有经修饰的aav2衣壳蛋白和seq id no:53的靶向肽的raav、具有经修饰的aav2的raav衣壳蛋白和seq id no:80的靶向肽以及具有经修饰的aav9衣壳蛋白和seq id no:113的靶向肽的raav的组合。
17.在一个实施方案中,本文提供包含编码本实施方案中任一项的经修饰的衣壳蛋白的核酸的病毒载体。在一些方面,病毒载体进一步包含编码目的核酸的核酸序列。在一些方面,目的核酸是治疗剂。在一些方面,治疗剂是酶或rnai分子。
18.在一个实施方案中,本文提供包含本实施方案中任一项的病毒载体的细胞。在一些方面,细胞是哺乳动物细胞,诸如人细胞。在一些方面,细胞在体外或体内。
19.在一个实施方案中,本文提供包含本实施方案的病毒载体和药学上可接受的载剂的药物组合物。
20.在一个实施方案中,本文提供向受试者的独特脑结构递送药剂的方法,其包括向受试者施用本实施方案的病毒。在一些方面,独特脑结构是脑干、尾核、小脑皮质、大脑皮质、室管膜、苍白球、海马、脑脊膜、视神经、壳核、脊髓、黑质、底丘脑核或丘脑。在某些方面,使用具有经修饰的aav1衣壳蛋白的raav,并且靶向肽选自表1中列出的那些以靶向对应的脑结构。在某些方面,使用具有经修饰的aav2衣壳蛋白的raav,并且靶向肽选自表2中列出
的那些以靶向对应的脑结构。在某些方面,使用具有经修饰的aav9衣壳蛋白的raav,并且靶向肽选自表3中列出的那些以靶向对应的脑结构。在各个方面,使用任何raav的组合。例如,使用具有经修饰的aav1衣壳蛋白和seq id no:21的靶向肽的raav、具有经修饰的aav2衣壳蛋白和seq id no:53的靶向肽的raav、具有经修饰的aav2的raav衣壳蛋白和seq id no:80的靶向肽以及具有经修饰的aav9衣壳蛋白和seq id no:113的靶向肽的raav的组合。
21.在一个实施方案中,本文提供将药剂递送到受试者的独特器官的方法,其包括向受试者施用本实施方案的病毒。在一些方面,器官是脑、肾脏、心脏、肝脏、生殖腺、脾或肝脏。在某些方面,使用具有经修饰的aav1衣壳蛋白的raav,并且靶向肽选自表4中列出的那些以靶向对应的器官。在某些方面,使用具有经修饰的aav2衣壳蛋白的raav,并且靶向肽选自表5中列出的那些以靶向对应的器官。在某些方面,使用具有经修饰的aav9衣壳蛋白的raav,并且靶向肽选自表6中列出的那些以靶向对应的器官。在各个方面,使用任何raav的组合。
22.在一些方面,药剂是sirna、shrna、mirna、非编码rna、lncrna、治疗性蛋白或crispr系统。在一些方面,施用是针对中枢神经系统。在一些方面,施用针对小脑延髓池、脑室内空间、室管膜、脑室、蛛网膜下腔和/或鞘内空间。在一些方面,脑室是前侧脑室、和/或后侧脑室、和/或右侧脑室、和/或左侧脑室、和/或右前侧脑室、和/或左前侧脑室、和/或右后侧脑室、和/或左后侧脑室。
23.在一些方面,施用多个病毒颗粒。在一些方面,以约1
×
106到约1
×
10
18
个载体基因组每千克(vg/kg)的剂量施用病毒。在一些方面,以约1
×
10
7-1
×
10
17
、约1
×
10
8-1
×
10
16
、约1
×
10
9-1
×
10
15
、约1
×
10
10-1
×
10
14
、约1
×
10
10-1
×
10
13
、约1
×
10
10-1
×
10
13
、约1
×
10
10-1
×
10
11
、约1
×
10
11-1
×
10
12
、约1
×
10
12-1
×
10
13
或约1
×
10
13-1
×
10
14
vg/kg患者的剂量施用病毒。在一些方面,受试者是人。
24.在一个实施方案中,本文提供治疗哺乳动物的疾病的方法,其包括向哺乳动物施用本实施方案的病毒。在一些方面,疾病是神经退行性疾病。在一些方面,神经退行性疾病是亨延顿病(huntington's disease)、als、遗传性痉挛性偏瘫、原发性侧索硬化、脊髓性肌萎缩、肯尼迪病(kennedy’s disease)、阿尔茨海默病(alzheimer's disease)、聚谷氨酰胺重复病或帕金森病(parkinson's disease)。在一些方面,哺乳动物是人。
25.如本文所用,就指定组分来说,“基本上不含”在本文中用于意指没有任何指定组分被有目的地配制到组合物中和/或仅作为污染物或以痕量存在。因此由组合物的任何意外污染产生的指定组分的总量远低于0.05%,优选低于0.01%。最优选用标准分析方法不能检测到任何量的指定组分的组合物。
26.如本文说明书中所用,“一(a或an)”可意指一或多。如本文权利要求书中所用,当结合词语“包含”使用时,词语“一(a或an)”可意指一或多于一。
27.在权利要求书中,除非明确指示是指仅二选一或两种选择相互排斥,否则术语“或”的使用用于意指“和/或”,但本公开支持指仅二选一及“和/或”的定义。如本文所用的“另一”可意指至少第二或更多。
28.在本技术通篇内,术语“约”用于指示值包括用于确定所述值的装置、方法的固有误差变化、研究对象之间存在的变化或在所述值的10%内的值。
29.根据下文详细描述将明了本发明的其他目标、特征和优点。然而,应当理解,尽管
具体实施方式和具体实施例显示了本发明的优选实施方案,但其仅以举例方式给出,因为本领域技术人员根据此详细描述将明了属于本发明精神和范围内的各种变化和修改。
附图说明
30.附图形成本说明书的一部分并且被包括以进一步证实本发明的某些方面。可通过与本文所呈现的具体实施方案的详细说明组合参考这些附图中的一个或多个来更好地理解本发明。
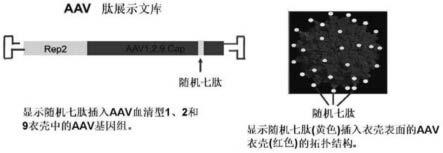
31.图1.aav肽展示文库示意图。
32.图2体内筛选策略示意图。
33.图3.输入文库多样性的图形表示。在第1轮icv注射之前,从aav1、aav2和aav9病毒载体的等分试样测量输入病毒文库的多样性。
34.图4.逐轮(round-over-round)条形码富集的图形表示。所收集的每个组织在恒河猕猴中在第1轮和第2轮富集后恢复的唯一条形码的总数。显示了dna和rna的第2轮值。
35.图5.小脑皮质的aav1、aav2和aav9血清型中条形码的逐轮富集图示。
36.图6.aav9 1999的富集图示。来自aav9的条形码富集的热图描绘图,通过从所指示的组织检测到的条形码的百分比对细胞进行着色。从dna中恢复的条形码显示在左侧,而从rna恢复的条形码在右侧。
37.图7a-c.来自aav1(图7a)、aav2(图7b)和aav9(图7c)的opool条形码富集的热图描绘图。
38.图8.aav9 1999体内恒河猕猴验证。将egfp表达构建体包装到由cag启动子驱动的aav9 1999中。通过icv注射将1.5e13 vg的aav9 1999递送到5岁龄的雌性恒河猕猴。显示了描绘aav9 1999的转导模式的h&e染色小脑的代表性图像。
39.图9a-d.aav9 1999体内小鼠验证。将egfp表达构建体包装到由cag启动子驱动的aav9 1999中。通过以1e10 vg的icv注射将含有egfp构建体的aav9-1999和aav9衣壳递送到c57bl/6 p0小鼠幼崽。egfp荧光信号的代表性图像是全脑(图9a)、全脑矢状切面(图9b)、s1皮质切面(图9c,左)、海马切面(图9c,中)、小脑矢状切面(图9c,右)和腰脊髓冠状切面(图9d)。
40.图10a-c.体内恒河猕猴侧脑室(a)、第四脑室(b)和脑脊膜(c)中aav混合物的荧光图像。
41.图11a-c.在将含有egfp构建体的aav9 1999衣壳施用于小鼠耳蜗后,耳蜗转(turn)(a)、内毛细胞(b)、皮质器官(c)和远端蜗轴(c)的荧光图像。
具体实施方式
42.本文提供各自包含经修饰的衣壳的病毒载体,其中经修饰的衣壳包含至少一个将病毒载体靶向独特脑结构的氨基酸序列。在某些实施方案中,脑结构是脑干、尾核、小脑皮质、大脑皮质、室管膜、苍白球、海马、脑脊膜、视神经、壳核、脊髓、黑质、底丘脑核或丘脑。表1-3中提供用于每种脑结构的靶向肽。
43.在某些实施方案中,病毒载体是腺相关病毒载体(aav)。在某些实施方案中,aav是aav1、aav2或aav9。示例性的野生型参考aav1衣壳蛋白序列提供于seq id no:138中。示例
性的野生型参考aav2衣壳蛋白序列提供于seq id no:139中。示例性的野生型参考aav9衣壳蛋白序列提供于seq id no:140中。在某些方面,将靶向肽插入aav1衣壳的590位、aav2衣壳的587位或aav9衣壳的588位。示例性的经修饰的aav1衣壳蛋白序列提供于seq id no:141中,其显示作为ssax7as在位置590之后的靶向肽插入,其中前导ssa和尾随as是接头序列并且x7代表靶向肽。示例性的经修饰的aav2衣壳蛋白序列提供于seq id no:142中,其显示作为aaax7aa在位置587之后的靶向肽插入,其中前导aaa和尾随aa是接头序列并且x7代表靶向肽。示例性的经修饰的aav9衣壳蛋白序列提供于seq id no:143中,其显示作为aaax7as在位置588之后的靶向肽插入,其中前导aaa和尾随as是接头序列并且x7代表靶向肽。
44.表1.用于每种脑结构的aav1靶向肽.
45.46.47.48.49.50.51.[0052][0053][0054]
表2.用于每种脑结构的aav2靶向肽.
[0055]
[0056]
[0057]
[0058]
[0059]
[0060]
[0061]
[0062]
[0063][0064]
表3.用于每种脑结构的aav9靶向肽.
[0065]
[0066]
[0067]
[0068]
[0069]
[0070]
[0071]
[0072]
[0073][0074]
表4.用于各种器官的aav1靶向肽.
[0075][0076]
表5.用于各种器官的aav2靶向肽.
[0077]
[0078][0079]
表6.用于各种器官的aav9靶向肽.
[0080]
[0081][0082]
i.腺相关病毒(aav)载体
[0083]
腺相关病毒(aav)是细小病毒科(parvoviridae)的非病原性小病毒。迄今为止,已鉴别出许多血清学上独特的aav,并且已从人或灵长类动物中分离出超过一打aav。aav区别于该科的其他成员,因为它依赖于辅助病毒进行复制。
[0084]
aav基因组可以染色体外状态存在而不整合到宿主细胞基因组中;具有宽宿主范围;在体外和体内转导分裂细胞和非分裂细胞两者,并维持受转导基因的高水平表达。aav病毒颗粒是热稳定的;耐溶剂、洗涤剂、ph值和温度变化;并且可在cscl梯度上或通过其他手段进行柱纯化和/或浓缩。aav基因组包含正义或负义的单链脱氧核糖核酸(ssdna)。aav的大约4.7kb基因组由一段正极性或负极性的单链dna组成。基因组的末端是短的反向末端重复(itr),其可折叠成发夹结构并用作病毒dna复制的起点。
[0085]
aav“基因组”是指最终被包装或封装以形成aav颗粒的重组核酸序列。aav颗粒经常包含用aav衣壳蛋白包装的aav基因组。在使用重组质粒构建或制造重组载体的情况下,aav载体基因组不包含不对应于重组质粒的载体基因组序列的“质粒”部分。重组质粒的该非载体基因组部分被称为“质粒骨架”,其对于质粒的克隆和扩增(质粒繁殖和产生所需的过程)是重要的,但其本身不被包装或封装到病毒颗粒中。因此,aav载体“基因组”是指由aav衣壳蛋白包装或封装的核酸。
[0086]
aav病毒体(颗粒)是直径为大约25nm的包含aav衣壳的无包膜二十面体颗粒。aav颗粒包括二十面体对称性,其包含三种相关的衣壳蛋白vp1、vp2和vp3,所述衣壳蛋白一起相互作用以形成衣壳。大多数天然aav的基因组经常含有两个开放阅读框(orf),有时被称为左侧orf和右侧orf。右侧orf经常编码衣壳蛋白vp1、vp2和vp3。这些蛋白经常分别以1∶1∶10的比率被发现,但可能比率有变化,并且全部来自右手orf。vp1、vp2和vp3衣壳蛋白的不同之处在于使用了选择性剪接和不寻常的起始密码子。缺失分析已证明,从选择性剪接的信息翻译的vp1的去除或改变会导致感染性颗粒的产率降低。vp3编码区内的突变导致不能产生任何单链子代dna或感染性颗粒。在某些实施方案中,aav颗粒的基因组编码一种、两种或所有三种vp1、vp2和vp3多肽。
[0087]
左侧orf经常编码非结构性rep蛋白(rep 40、rep 52、rep 68和rep 78),它们除了参与单链子代基因组的产生之外,还参与复制和转录的调控。已将rep蛋白中的两种与aav基因组优先整合到人19号染色体q臂区域相关联。已证明rep68/78具有ntp结合活性以及dna和rna解旋酶活性。一些rep蛋白具有核定位信号以及若干潜在的磷酸化位点。在某些实施方案中,aav(例如,raav)的基因组编码一些或所有rep蛋白。在某些实施方案中,aav(例如,raav)的基因组不编码rep蛋白。在某些实施方案中,一种或多种rep蛋白可以反式递送,因此不包括在包含编码多肽的核酸的aav颗粒中。
[0088]
aav基因组的末端包含短的反向末端重复(itr),其具有折叠成用作病毒dna复制起点的t形发夹结构的潜力。因此,aav的基因组包含一个或多个(例如,一对)位于单链病毒dna基因组两侧的itr序列。itr序列经常各自具有约145个碱基的长度。在itr区域内,已描述两个元件,它们被认为是itr功能的核心,即gagc重复基序和末端解链位点(trs)。已证明当itr处于线性或发夹构象时,重复基序结合rep。该结合被认为将rep68/78定位为在trs处以位点和链特异性方式发生的切割。除了在复制中的作用之外,这两个元件似乎还是病毒整合的核心。在染色体19整合基因座内含有具有相邻trs的rep结合位点。已证明这些元件是功能性的,并且对于基因座特异性整合是必需的。
[0089]
术语“重组”,作为载体的修饰语(诸如重组病毒载体,例如,慢病毒或细小病毒(例如,aav)载体),以及序列的修饰语(诸如重组核酸序列和多肽),意指组合物已经以自然界中通常不发生的方式被操作(即工程改造)。重组载体(诸如aav病毒载体、逆转录病毒载体或慢病毒载体)的特定示例将是在病毒基因组内插入野生型病毒基因组中通常不存在的核酸序列。重组核酸序列的示例将是核酸(例如,基因)编码克隆到载体中的抑制性rna的情形,该载体具有或不具有该基因的通常在病毒基因组内缔合的5
′
、3
′
和/或内含子区。尽管术语“重组”在本文中并不始终参考载体(诸如病毒载体)以及序列(诸如多核苷酸)来使用,但包括核酸序列、多核苷酸、转基因等的“重组”形式被明确包括在内,尽管有任何此类省略。
[0090]
重组病毒“载体”通过以下方式而来源于病毒的野生型基因组:使用分子方法从病毒中去除部分野生型基因组,并用非天然核酸(诸如核酸序列)替代。通常,例如,对于aav,aav基因组的一个或两个反向末端重复(itr)序列保留在重组aav载体中。“重组”病毒载体(例如,raav)区别于病毒(例如,aav)基因组,因为病毒基因组的一部分已相对于病毒基因组核酸(诸如编码反式激活子的核酸或编码抑制性rna的核酸或编码治疗性蛋白的核酸)用非天然序列替代。因此,此类非天然核酸序列的掺入将病毒载体定义为“重组”载体,所述载
体在aav的情况下可称为“raav载体”。
[0091]
在某些实施方案中,aav(例如,raav)包含两个itr。在某些实施方案中,aav(例如,raav)包含一对itr。在某些实施方案中,aav(例如,raav)包含一对itr,所述itr位于至少编码具有功能或活性的多肽的核酸序列的侧翼(即,在所述核酸序列的每个5
′
和3
′
端)。
[0092]
aav载体(例如,raav载体)可被包装并且在本文中被称为“aav颗粒”,用于细胞的随后离体、体外或体内感染(转导)。在将重组aav载体封装或包装到aav颗粒中的情况下,该颗粒还可被称为“raav颗粒”。在某些实施方案中,aav颗粒是raav粒子。raav颗粒经常包含raav载体或其一部分。raav颗粒可以是一个或多个raav颗粒(例如,多个aav颗粒)。raav颗粒通常包含封装或包装raav载体基因组的蛋白(例如,衣壳蛋白)。值得注意的是,对raav载体的提及也可用于提及raav颗粒。
[0093]
任何适合的aav颗粒(例如,raav颗粒)均可用于本文的方法或用途。raav颗粒和/或其中所包含的基因组可来源于任何适合的aav血清型或毒株。raav颗粒和/或其中所包含的基因组可来源于两种或更多种aav血清型或毒株。因此,raav可包含aav的任何血清型或毒株的蛋白和/或核酸或其部分,其中aav颗粒适于哺乳动物细胞的感染和/或转导。aav血清型的非限制性示例包括aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、aav-rh74、aav-rn10和aav-2i8。
[0094]
在某些实施方案中,多个raav颗粒包括相同毒株或血清型(或亚型或变体)的颗粒,或来源于相同菌株或血清型的颗粒。在某些实施方案中,多个raav颗粒包括两种或更多种不同raav颗粒(例如,不同血清型和/或毒株)的混合物。
[0095]
如本文所用,术语“血清型”是用于指代具有在血清学上区别于其他aav血清型的衣壳的aav的区别。血清学区别性是基于针对一种aav的抗体与另一种aav之间缺乏交叉反应性来确定的。此类交叉反应性差异通常归因于衣壳蛋白序列/抗原决定簇的差异(例如,归因于aav血清型的vp1、vp2和/或vp3序列差异)。尽管有包括衣壳变体在内的aav变体可能在血清学上并不区别于参考aav或其他aav血清型的可能性,但它们与参考aav血清型或其他aav血清型相比相差至少一个核苷酸或氨基酸残基。
[0096]
在某些实施方案中,基于第一血清型基因组的raav载体对应于包装该载体的一种或多种衣壳蛋白的血清型。例如,包含aav载体基因组的一种或多种aav核酸(例如,itr)的血清型对应于包含raav颗粒的衣壳的血清型。
[0097]
在某些实施方案中,raav载体基因组可基于区别于包装载体的一种或多种aav衣壳蛋白的血清型的aav(例如,aav2)血清型基因组。例如,raav载体基因组可包含aav2来源的核酸(例如,itr),而三种衣壳蛋白中的至少一种或多种来源于不同的血清型,例如,aav1、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、rh10、rh74或aav-2i8血清型或其变体。
[0098]
在某些实施方案中,与参考血清型有关的raav颗粒或其载体基因组的多核苷酸、多肽或亚序列包含与aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、rh10、rh74或aav-2i8颗粒的多核苷酸、多肽或子序列至少60%或更高(例如,65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%等)相同的序列或由该序列组成。在特定实施方案中,与参考血清型有关的raav颗粒或其载体基因组的衣壳或itr序列包含与aav1、aav2、aav3、aav4、aav5、aav6、
aav7、aav8、aav9、aav10、aav11、aav12、rh10、rh74或aav-2i8血清型的衣壳或itr序列至少60%或更高(例如,65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%等)相同的序列或由该序列组成。
[0099]
在某些实施方案中,本文的方法包括使用、施用或递送raav1、raav2、raav3、raav4、raav5、raav6、raav7、raav8、raav9、raav10、raav11、raav12、rrh10、rrh74或raav-2i8颗粒。
[0100]
在某些实施方案中,本文的方法包括使用、施用或递送raav2颗粒。在某些实施方案中,raav2颗粒包含aav2衣壳。在某些实施方案中,raav2颗粒包含与天然或野生型aav2颗粒的对应衣壳蛋白至少60%、65%、70%、75%或更高相同(例如,80%、85%、85%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%等,最高达100%相同)的一种或多种衣壳蛋白(例如,vp1、vp2和/或vp3)。在某些实施方案中,raav2颗粒包含与天然或野生型aav2颗粒的对应衣壳蛋白至少75%或更高相同(例如,80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%等,最高达100%相同)的vp1、vp2和vp3衣壳蛋白。在某些实施方案中,raav2颗粒是天然或野生型aav2颗粒的变体。在一些方面,aav2变体的一种或多种衣壳蛋白与天然或野生型aav2颗粒的衣壳蛋白相比具有1、2、3、4、5、5-10、10-15、15-20或更多个氨基酸取代。
[0101]
在某些实施方案中,raav9颗粒包含aav9衣壳。在某些实施方案中,raav9颗粒包含与天然或野生型aav9颗粒的对应衣壳蛋白至少60%、65%、70%、75%或更高相同(例如,80%、85%、85%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%等,最高达100%相同)的一种或多种衣壳蛋白(例如,vp1、vp2和/或vp3)。在某些实施方案中,raav9颗粒包含与天然或野生型aav9颗粒的对应衣壳蛋白至少75%或更高相同(例如,80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%等,最高达100%相同)的vp1、vp2和vp3衣壳蛋白。在某些实施方案中,raav9颗粒是天然或野生型aav9颗粒的变体。在一些方面,aav9变体的一种或多种衣壳蛋白与天然或野生型aav9颗粒的衣壳蛋白相比具有1、2、3、4、5、5-10、10-15、15-20或更多个氨基酸取代。
[0102]
在某些实施方案中,raav颗粒包含与天然或野生型aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、aav-rh74、aav-rh10或aav-2i8的对应itr至少75%或更高相同(例如,80%、85%、85%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%等,最高达100%相同)的一个或两个itr(例如,一对itr),只要它们保留一种或多种期望的itr功能(例如,形成允许dna复制的发夹的能力;将aav dna整合到宿主细胞基因组中;和/或如果期望,包装)即可。
[0103]
在某些实施方案中,raav2颗粒包含与天然或野生型aav2颗粒的对应itr至少75%或更高相同(例如,80%、85%、85%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%等,最高达100%相同)的一个或两个itr(例如,一对itr),只要它们保留一种或多种期望的itr功能(例如,形成允许dna复制的发夹的能力;将aav dna整合到宿主细胞基因组中;和/或如果期望,包装)即可。
[0104]
在某些实施方案中,raav9颗粒包含与天然或野生型aav2颗粒的对应itr至少75%或更高相同(例如,80%、85%、85%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.1%、99.2%、99.3%、99.4%、99.5%等,最高达100%相同)的一个或两个itr(例如,一对itr),只要它们保留一种或多种期望的itr功能(例如,形成允许dna复制的发夹的能力;将aav dna整合到宿主细胞基因组中;和/或如果期望,包装)即可。
[0105]
raav颗粒可包含具有任何适合数目的“gagc”重复的itr。在某些实施方案中,aav2颗粒的itr包含1、2、3、4、5、6、7、8、9或10个或更多个“gagc”重复。在某些实施方案中,raav2颗粒包含包括三个“gagc”重复的itr。在某些实施方案中,raav2颗粒包含具有少于四个“gagc”重复的itr。在某些实施方案中,raav2颗粒包含具有多于四个“gagc”重复的itr。在某些实施方案中,raav2颗粒的itr包含rep结合位点,其中前两个“gagc”重复中的第四个核苷酸是c而不是t。
[0106]
可掺入raav载体中用于包装/衣壳化到raav颗粒中的dna的示例性适合长度可为约5千碱基(kb)或更小。在特定实施方案中,dna的长度小于约5kb、小于约4.5kb、小于约4kb、小于约3.5kb、小于约3kb或小于约2.5kb。
[0107]
可使用本领域已知的适合的重组技术生成包含指导rnai或多肽表达的核酸序列的raav载体(例如,参见sambrook等,1989)。重组aav载体通常被包装成具有转导能力的aav颗粒,并使用aav病毒包装系统进行繁殖。具有转导能力的aav颗粒能够结合到哺乳动物细胞并进入其中,并随后将核酸货物(例如,异源基因)递送到细胞核。因此,具有转导能力的完整raav颗粒被配置为转导哺乳动物细胞。配置为转导哺乳动物细胞的raav颗粒经常不具备复制能力,并且需要额外的蛋白机器来自我复制。因此,配置为转导哺乳动物细胞的raav颗粒被工程改造为结合哺乳动物细胞并进入其中并且将核酸递送到该细胞,其中用于递送的核酸经常位于raav基因组中的一对aav itr之间。
[0108]
用于产生具有转导能力的aav颗粒的适合宿主细胞包括但不限于可以或已经用作异源raav载体的受体的微生物、酵母细胞、昆虫细胞和哺乳动物细胞。可使用来自稳定的人细胞系hek293(可通过例如美国典型培养物保藏中心(american type culture collection)以保藏号atcc crl1573容易地获得)的细胞。在某些实施方案中,使用用腺病毒5型dna片段转化并表达腺病毒e1a和e1b基因的经修饰的人胚肾细胞系(例如,hek293)来生成重组aav颗粒。经修饰的hek293细胞系易于被转染,并提供了产生raav颗粒的特别方便的平台。生成能够转导哺乳动物细胞的高效价aav颗粒的方法是本领域已知的。例如,aav颗粒可如wright,2008和wright,2009中所述制得。
[0109]
在某些实施方案中,通过在转染aav表达载体之前或同时用aav辅助构建体转染宿主细胞,将aav辅助功能引入宿主细胞中。因此,aav辅助构建体有时用于提供aav rep和/或cap基因的至少瞬时表达,以补充生产性aav转导所需的缺失aav功能。aav辅助构建体经常缺少aav itr,并且既不能自我复制也不能自我包装。这些构建体可以是质粒、噬菌体、转座子、粘粒、病毒或病毒体的形式。已经描述了许多aav辅助构建体,诸如编码rep和cap表达产物两者的常用质粒paav/ad和pim29 45。已知许多编码rep和/或cap表达产物的其他载体。
[0110]“表达载体”是含有基因或核酸序列的特化载体,该基因或核酸序列具有在宿主细胞中表达所需的必要调控区。表达载体可含有至少用于在细胞中繁殖的复制起点和任选地额外的元件,诸如异源核酸序列、表达控制元件(例如,启动子、增强子)、内含子、一个或多
个itr和多聚腺苷酸化信号。
[0111]
ii.治疗剂
[0112]
在一些实施方案中,可使用病毒基因转移方法在哺乳动物细胞或靶组织中引入核酸。此类方法可用于将编码抑制性rna、非编码rna和/或治疗性蛋白的核酸施用于培养中或宿主生物体中的细胞。
[0113]
a.抑制性rna
[0114]“rna干扰(rnai)”是由sirna起始的序列特异性转录后基因沉默过程。在rnai期间,sirna诱导靶mrna的降解,从而导致基因表达的序列特异性抑制。
[0115]“抑制性rna”、“rnai”、“小干扰rna”或“短干扰rna”或“sirna”分子、“短发夹rna”或“shrna”分子或“mirna”是核苷酸的靶向目的核酸序列的rna双链体。如本文所用,术语“sirna”是涵盖shrna和mirna的子集的通用术语。“rna双链体”是指由rna分子的两个区域之间的互补配对形成的结构。sirna被“靶向”基因,因为sirna的双链体部分的核苷酸序列与靶向基因的核苷酸序列互补。在某些实施方案中,sirna靶向编码亨延顿蛋白(huntingtin)的序列。在一些实施方案中,sirna双链体的长度小于30个碱基对。在一些实施方案中,双链体的长度可为29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11或10个碱基对。在一些实施方案中,双链体的长度为19到25个碱基对长。在某些实施方案中,双链体的长度为19或21个碱基对长。sirna的rna双链体部分可以是发夹结构的一部分。除了双链体部分之外,发夹结构还可含有位于形成双链体的两个序列之间的环部分。环的长度可以变化。在一些实施方案中,环的长度为5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个核苷酸。在某些实施方案中,环的长度为18个核苷酸。发夹结构还可含有3
′
和/或5
′
突出端部分。在一些实施方案中,突出端是长度为0、1、2、3、4或5个核苷酸的3
′
和/或5
′
突出端。
[0116]
shrna包含茎环结构,所述茎-环结构被设计成含有5
′
侧翼区、sirna区区段、环区、3
′
sirna区和3
′
侧翼区。大多数rnai表达策略利用了由基于poliii的强启动子驱动的短发夹rna(shrna)。许多shrna在体外以及体内均表现出对靶序列的有效敲低,然而,还发现一些表现出对靶基因有效敲低的shrna在体内具有毒性。
[0117]
mirna是由前体茎环转录物加工而成的小细胞rna(约22nt)。已知的mirna茎环可经修饰以含有对目的基因特异的rnai序列。mirna分子可能优于shrna分子,因为mirna是内源性表达的。因此,mirna分子不太可能诱导dsrna应答性干扰素途径,它们比shrna更有效地被加工,并且它们已被证明沉默效率高80%。
[0118]
最近发现的替代方法是使用人工mirna(穿梭sirna序列的原始-mirna支架)作为rnai载体。人工mirna更自然地类似于内源性rnai底物,并且更适于pol-ii转录(例如,允许rnai的组织特异性表达)和多顺反子策略(例如,允许递送多个sirna序列)。参见美国专利号10,093,927,其以引用方式并入。
[0119]“shrna”的转录单位包含由未配对核苷酸的环连接的有义序列和反义序列。shrna通过输出蛋白-5从细胞核中输出,且一旦进入细胞质中,就被dicer加工以生成功能性sirna。“mirna”茎-环包含由未配对的核苷酸环连接的有义序列和反义序列,通常作为较大原始转录物(原始-mirna)的一部分表达,所述原始-mirna由drosha-dgcr8复合物切除,生成称为前体mirna的中间体,所述中间体随后由输出蛋白-5从细胞核中输出,且一旦进入细
胞质中,就由dicer加工以生成功能性sirna。如本文可互换使用的“人工mirna”或“人工mirna穿梭载体”是指原始mirna转录物,其具有经由drosha和dicer加工切除的双链体茎环的区域(至少约9-20个核苷酸),该区域被针对靶基因的sirna序列替代,同时保留茎环内对于有效drosha加工所需的结构元件。术语“人工”源于如下事实,即侧翼序列(上游约35个核苷酸和下游约40个核苷酸)产生于sirna的多克隆位点内的限制酶位点。如本文所用,术语“mirna”涵盖天然存在的mirna序列以及人工生成的mirna穿梭载体两者。
[0120]
sirna可由核酸序列编码,并且所述核酸序列还可包含启动子。核酸序列还可包含多聚腺苷酸化信号。在一些实施方案中,多聚腺苷酸化信号是合成的最小多聚腺苷酸化信号或六个t的序列。
[0121]
在设计rnai时,有若干需要考虑的因素,诸如sirna的性质、沉默效应的耐久性以及传递系统的选择。为了产生rnai效应,引入生物体中的sirna通常将含有外显子序列。此外,rnai过程依赖于同源性,因此必须仔细选择序列以最大限度地提高基因特异性,同时最大限度地降低同源但不是基因特异性的序列之间的交叉干扰可能性。优选地,sirna在sirna序列和待抑制基因之间展现出大于80%、85%、90%、95%、98%或甚至100%的同一性。与靶基因小于约80%相同的序列基本上不太有效。因此,sirna与待抑制基因之间的同源性越大,不相关基因的表达受到影响的可能性就越小。
[0122]
另外,sirna的大小是重要的考虑因素。在一些实施方案中,本发明涉及sirna分子,其包含至少约19-25个核苷酸并且能够调节基因表达。在本发明的上下文中,sirna的长度优选地小于500、200、100、50或25个核苷酸。更优选地,sirna的长度为约19个核苷酸到约25个核苷酸。
[0123]
sirna靶标通常意指包含编码多肽的区域的多核苷酸,或调控复制、转录或翻译或对多肽表达重要的其他过程的多核苷酸区域,或包含编码多肽的区域和与其可操作地连接的调控表达的区域的多核苷酸。可靶向在细胞中表达的任何基因。优选地,靶基因是参与对疾病重要或作为研究对象特别感令人兴趣的细胞活动的进展或与其相关的基因。
[0124]
b.非编码rna
[0125]
如通过cdna克隆计划和基因组嵌合阵列所证明的那样,超过90%的人基因组经历了转录但不编码蛋白。这些转录产物被称为非蛋白编码rna(ncrna)。多种ncrna转录物(诸如核糖体rna、转移rna、竞争性内源性rna(cerna)、小核rna(snrna)和小核仁rna(snorna))对细胞功能至关重要。类似地,还已知大量的短ncrna,诸如微小rna(mirna)、内源性短干扰rna(sirna)、piwi相互作用rna(pirna)和小核仁rna(snorna)在真核细胞中发挥重要的调控作用。最近的研究已证实展现出细胞类型特异性表达并定位到特定亚细胞区室中的一组长ncrna(lncrna)转录物。还已知lncrna在细胞发育和分化期间发挥重要作用,支持它们在进化过程期间被选择的观点。
[0126]
lncrna似乎具有许多不同的功能。在许多情况下,它们似乎在调控蛋白的活性或定位方面发挥作用,或者充当用于亚细胞结构的组织框架。在其他情况下,lncrna被加工以产生多个小rna,或者它们可调节其他rna被加工的方式。由公共研究联盟(public research consortium)gencode(版本号27)产生的最新版本的数据对人类基因组中略低16,000个的lncrna进行了编目,产生了近28,000个转录物;当包括其他数据库时,已知超过40,000个lncrna。
[0127]
有趣的是,lncrna可影响特定基因组基因座处特定靶蛋白的表达,调节蛋白结合配偶体的活性,将染色质修饰复合物引导到其作用位点,并经过转录后加工以产生大量5
′
加帽的小rna。表观遗传途径也可调控lncrna的差异表达。
[0128]
越来越多的证据也表明,异常表达的lncrna在正常生理过程以及多种疾病状态中发挥着重要作用。lncrna在各种疾病中被误调控,包括缺血、心脏病、阿尔茨海默病、银屑病和脊髓小脑性共济失调8型。这种误调控也表现在各种类型的癌症(诸如乳腺癌、结肠癌、前列腺癌、肝细胞癌和白血病)中。若干lncrna(例如gadd74和lncrna-ror5)调节细胞周期调控物,诸如细胞周期蛋白、细胞周期蛋白依赖性激酶(cdk)、cdk抑制剂和p53,因此为细胞周期进程提供一层额外的灵活性和稳健性。另外,一些lncrna与有丝分裂过程关联,诸如着丝粒卫星rna,它是动粒形成必不可少的,因此对于人和果蝇有丝分裂期间的染色体分离至关重要。另一种核lncrna(ma-lincl)通过顺式发挥作用来调控m期退出,以阻抑其邻近基因pura的表达,pura是细胞增殖的调控物。
[0129]
lncrna是通常被定义为缺乏延伸开放阅读框(orf)的超过200个核苷酸(例如约200到约1200nt、约2500nt或更多)的转录物的群组。术语“非编码rna”(ncrna)包括lncrna以及例如小于约200nt(诸如约30到200nt)的更短转录物。
[0130]
因此,在一些实施方案中,将ncrna递送到诸如目的特定脑结构纠正了异常rna表达水平或调节致病性lncrna的水平。因此,在一些实施方案中,本发明提供raav,其中病毒基因组被工程改造为编码治疗性非编码rna(ncrna)。在一些实施方案中,ncrna是长度为约200个核苷酸(nt)或更大的长非编码rna(lncrna)。在一些实施方案中,治疗剂是长度为约25nt或约30nt到约200nt的ncrna。在一些实施方案中,lncrna的长度为约200nt到约1,200nt。在一些实施方案中,lncrna的长度为约200nt至约1,100nt、约1,000nt、约900nt、约800nt、约700nt、约600nt、约500nt、约400nt或约300nt。
[0131]
c.crispr系统
[0132]
基因编辑是允许在活细胞内修饰靶基因的技术。最近,利用crispr的细菌免疫系统进行按需基因编辑彻底改变了科学工作者处理基因组编辑的方式。crispr系统的cas9蛋白(其为rna引导的dna内切核酸酶)可通过改变其引导rna序列进行工程改造以相对容易地靶向新位点。这一发现使序列特异性基因编辑在功能上有效。
[0133]
通常,“crispr系统”统指参与crispr相关(“cas”)基因活性表达或引导其活性的转录物和其他元件,包括编码cas基因的序列、tracr(反式激活crispr)序列(例如tracrrna或活性部分tracrrna)、tracr-伴侣(mate)序列(在内源crispr系统的背景下涵盖“同向重复”和tracrrna加工的部分同向重复)、引导序列(在内源性crispr系统的背景下也被称为“间隔物”)和/或来自crispr基因座的其他序列和转录物。
[0134]
crispr/cas核酸酶或crispr/cas核酸酶系统可包含序列特异性结合到dna的非编码rna分子(引导)rna和具有核酸酶功能性(例如,两个核酸酶结构域)的cas蛋白(例如,cas9)。crispr系统的一个或多个元件可来源于i型、ii型或iii型crispr系统,例如,来源于包含内源性crispr系统的特定生物体,诸如酿脓链球菌(streptococcus pyogenes)。
[0135]
crispr系统可在靶位点诱导双链断裂(dsb),之后是如本文所讨论的碎裂。在其他实施方案中,使用被认为是“切口酶”的cas9变体在靶位点切割单链。可使用配对的切口酶,例如,以改善特异性,每种切口酶由一对不同的grna靶向序列指导,使得在同时引入切口
后,引入5
′
突出端。在其他实施方案中,催化无活性的cas9与异源效应物结构域(诸如转录阻遏物(例如,krab)或激活物)融合,以影响基因表达。或者,具有催化无活性的cas9的crispr系统进一步包含与核糖体结合蛋白融合的转录阻遏物或激活物。
[0136]
在一些方面,将cas核酸酶和grna(包括对靶序列特异的crrna和固定的tracrrna的融合物)引入细胞中。一般来说,grna的5
′
端处的靶位点使用互补碱基配对将cas核酸酶靶向靶位点,例如基因。靶位点可基于其紧邻原型间隔物(protospacer)相邻基序(pam)序列(诸如通常为ngg或nag)的5
′
位置来选择。在这方面,通过修饰引导rna的前20、19、18、17、16、15、14、14、12、11或10个核苷酸以对应于靶dna序列,将grna靶向期望序列。通常,crispr系统的特征在于促进在靶序列位点形成crispr复合物的元件。通常,“靶序列”一般是指引导序列被设计成具有互补性的序列,其中靶序列和引导序列之间的杂交促进了crispr复合物的形成。不一定需要完全互补性,条件是存在足够的互补性以引起杂交并促进crispr复合物的形成。
[0137]
靶序列可包含任何多核苷酸,诸如dna或rna多核苷酸。靶序列可定位于细胞的细胞核或细胞质中,诸如细胞的细胞器内。通常,可用于重组到包含靶序列的靶向基因座中的序列或模板被称为“编辑模板”或“编辑多核苷酸”或“编辑序列”。在一些方面,外源模板多核苷酸可被称为编辑模板。在一些方面,重组是同源重组。
[0138]
通常,在内源性crispr系统的背景下,crispr复合物(包含与靶序列杂交并与一种或多种cas蛋白复合的引导序列)的形成导致靶序列中或附近(例如1、2、3、4、5、6、7、8、9、10、20、50或更多个碱基对内)的一条或两条链的切割。tracr序列(其可包含野生型tracr序列的全部或部分(例如野生型tracr序列的约或超过约20、26、32、45、48、54、63、67、85或更多个核苷酸)或由其组成)也可诸如通过沿着tracr序列的至少一部分与可操作地连接到引导序列的tracr伴侣序列的全部或部分杂交来形成crispr复合物的一部分。tracr序列与trac伴侣序列具有足够的互补性以杂交并参与crispr复合物的形成,诸如当最佳比对时,沿着tracr伴侣序列的长度具有至少50%、60%、70%、80%、90%、95%或99%的序列互补性。
[0139]
可将驱动crispr系统的一个或多个元件的表达的一个或多个载体引入细胞中,使得crispr系统的元件的表达在一个或多个靶位点处直接形成crispr复合物。组分还可作为蛋白和/或rna递送到细胞。例如,cas酶、连接到tracr-伴侣序列的引导序列和tracr序列可各自可操作地连接到单独载体上的单独调控元件。cas酶可以是如本文所公开的处于受调控的选择性剪接事件控制之下的靶基因,其作为嵌合靶基因小基因或作为用于嵌合小基因反式激活子的靶基因。grna可能处于组成型启动子的控制之下。
[0140]
或者,从相同或不同调控元件表达的元件中的两个或更多个可在单个载体中组合,其中一个或多个额外的载体提供不包括在第一载体中的crispr系统的任何组分。载体可包含一个或多个插入位点,诸如限制性内切核酸酶识别序列(也被称为“克隆位点”)。在一些实施方案中,一个或多个插入位点定位于一个或多个载体的一个或多个序列元件的上游和/或下游。当使用多个不同的引导序列时,可使用单个表达构建体将crispr活性靶向细胞内的多个不同的对应靶序列。
[0141]
载体可包含可操作地连接到编码crispr酶(诸如cas蛋白)的酶编码序列的调控元件,。cas蛋白的非限制性示例包括cas1、cas1b、cas2、cas3、cas4、cas5、cas6、cas7、cas8、
cas9(也被称为csn1和csx12)、cas10、csy1、csy2、csy3、cse1、cse2、csc1、csc2、csa5、csn2、csm2、csm3、csm4、csm5、csm6、cmr1、cmr3、cmr4、cmr5、cmr6、csb1、csb2、csb3、csx17、csx14、csx10、csx16、csax、csx3、csx1、csx15、csfl、csf2、csf3、csf4、它们的同源物或它们的修饰形式。这些酶是已知的;例如,酿脓链球菌cas9蛋白的氨基酸序列可在swissprot数据库中以保藏号q99zw2找到。
[0142]
crispr酶可以是cas9(例如,来自酿脓链球菌或肺炎链球菌(s.pneumonia))。crispr酶可在靶序列的位置(诸如在靶序列内和/或在靶序列的互补序列内)指导一条或两条链的切割。载体可编码相对于对应的野生型酶突变的crispr酶,使得突变的crispr酶缺乏切割含有靶序列的靶多核苷酸的一条或两条链的能力。例如,来自酿脓链球菌cas9的ruvc i催化结构域中的天冬氨酸到丙氨酸的取代(d10a)将cas9从切割两条链的核酸酶转化为切口酶(切割单链)。在一些实施方案中,cas9切口酶可与一个或多个引导序列(例如,两个引导序列,其分别靶向dna靶标的有义链和反义链)组合使用。该组合允许两条链都带切口并用于诱导nhej或hdr。
[0143]
在一些实施方案中,编码crispr酶的酶编码序列经密码子优化以用于在特定细胞(诸如真核细胞)中表达。真核细胞可以是特定生物体的那些或来源于特定生物体,所述特定生物体诸如哺乳动物,包括但不限于人、小鼠、大鼠、兔、狗或非人灵长类动物。通常,密码子优化是指通过以下方式修饰核酸序列以增强在目的宿主细胞中表达的过程:用该宿主细胞的基因中更频繁或最频繁使用的密码子替代天然序列的至少一个密码子,同时维持天然氨基酸序列。各种物种对特定氨基酸的某些密码子展现出特定的偏好。密码子偏倚(生物体之间密码子使用的差异)经常与信使rna(mrna)的翻译效率相关,所述翻译效率进而认为取决于被翻译密码子的性质和特定转移rna(trna)分子的可用性等因素。所选trna在细胞中的优势通常反映了肽合成中最频繁使用的密码子。因此,可基于密码子优化为给定生物体中的最佳基因表达定制基因。
[0144]
通常,引导序列是与靶多核苷酸序列具有足够互补性以与靶序列杂交并指导crispr复合物与靶序列的序列特异性结合的任何多核苷酸序列。在一些实施方案中,当使用适合的比对算法进行最佳比对时,引导序列与其对应的靶序列之间的互补程度为约或大于约50%、60%、75%、80%、85%、90%、95%、97.5%、99%或更高。
[0145]
可使用用于比对序列的任何适合算法来确定最佳比对,所述算法的非限制性示例包括smith-waterman算法、needleman-wunsch算法、基于burrows-wheeler变换的算法(例如burrows wheeler aligner)、clustal w、clustal x、blat、novoalign(novocraft technologies,eland(illumina,san diego,calif.)、soap(可在soap.genomics.org.cn获得)和maq(可在maq.sourceforge.net获得)。
[0146]
crispr酶可以是包含一个或多个异源蛋白结构域的融合蛋白的一部分。crispr酶融合蛋白可包含任何额外的蛋白序列,以及任选地任两个结构域之间的接头序列。可与crispr酶融合的蛋白结构域的示例包括但不限于表位标签、报告基因序列和具有以下一种或多种活性的蛋白结构域:甲基化酶活性、脱甲基酶活性、转录激活活性、转录抑制活性、转录释放因子活性、组蛋白修饰活性、rna切割活性和核酸结合活性。表位标签的非限制性示例包括组氨酸(his)标签、v5标签、flag标签、流感血凝素(ha)标签、myc标签、vsv-g标签和硫氧还蛋白(trx)标签。报告基因的示例包括但不限于谷胱甘肽-5-转移酶(gst)、辣根过氧
化物酶(hrp)、氯霉素乙酰基转移酶(cat)、β半乳糖苷酶、β-葡糖醛酸糖苷酶、荧光素酶、绿色荧光蛋白(gfp)、hcred、dsred、青色荧光蛋白(cfp)、黄色荧光蛋白(yfp)和自发荧光蛋白,包括蓝色荧光蛋白(bfp)。crispr酶可与编码结合dna分子或结合其他细胞分子的蛋白或蛋白片段的基因序列融合,所述其他细胞分子包括但不限于麦芽糖结合蛋白(mbp)、s-tag、lex a dna结合结构域(dbd)融合物、gal4a dna结合结构域融合物和单纯疱疹病毒(hsv)bp16蛋白融合物。可形成包含crispr酶的融合蛋白的一部分的额外结构域描述于us 20110059502(其以引用方式并入本文)中。
[0147]
d.治疗性蛋白
[0148]
一些实施方案涉及重组蛋白和多肽的表达。在一些方面,可修饰蛋白或多肽以增加血清稳定性。因此,当本技术提到“经修饰的蛋白”或“经修饰的多肽”的功能或活性时,本领域普通技术人员将理解,这包括例如具有优于未修饰的蛋白或多肽的额外优点的蛋白或多肽。特别预期关于“经修饰的蛋白”的实施方案可相对于“经修饰的多肽”来实施,反之亦然。
[0149]
重组蛋白可具有氨基酸的缺失和/或取代;因此,具有缺失的蛋白、具有取代的蛋白以及具有缺失和取代的蛋白是经修饰的蛋白。在一些实施方案中,这些蛋白可进一步包含插入或添加的氨基酸,诸如例如融合蛋白或具有接头的蛋白。“经修饰的缺失蛋白”缺少天然蛋白的一个或多个残基,但可能具有天然蛋白的特异性和/或活性。“经修饰的缺失蛋白”还可具有降低的免疫原性或抗原性。经修饰的缺失蛋白的示例是具有从至少一个抗原区(即确定在特定生物体(诸如正在施用修饰蛋白的生物体)中具有抗原性的蛋白区)缺失的氨基酸残基的蛋白。
[0150]
取代或替代变体通常蛋白内一个或多个位点处的一个氨基酸交换为另一个氨基酸,并且可被设计为调节多肽的一种或多种性质,特别是其效应子功能和/或生物利用度。取代可能是保守的,也可能不是保守的,也就是说,一个氨基酸被具有相似形状和电荷的氨基酸替代。保守取代在本领域中是众所周知的,并且包括例如以下变化:丙氨酸到丝氨酸;精氨酸到赖氨酸;天冬酰胺到谷氨酰胺或组氨酸;天冬氨酸到谷氨酸;半胱氨酸到丝氨酸;谷氨酰胺到天冬酰胺;谷氨酸到天冬氨酸;甘氨酸到脯氨酸;组氨酸到天冬酰胺或谷氨酰胺;异亮氨酸到亮氨酸或缬氨酸;亮氨酸到缬氨酸或异亮氨酸;赖氨酸到精氨酸;蛋氨酸到亮氨酸或异亮氨酸;苯丙氨酸到酪氨酸、亮氨酸或甲硫氨酸;丝氨酸到苏氨酸;苏氨酸到丝氨酸;色氨酸到酪氨酸;酪氨酸到色氨酸或苯丙氨酸;和缬氨酸到异亮氨酸或亮氨酸。
[0151]
除了缺失或取代之外,经修饰的蛋白还可具有残基的插入,这通常涉及在多肽中添加至少一个残基。这可包括靶向肽或多肽或仅单个残基的插入。下文讨论称为融合蛋白的末端添加。
[0152]
术语“生物功能等同物”在本领域中是众所周知的并且在本文中进一步被详细定义。因此,包括约70%到约80%、或约81%到约90%、或甚至约91%到约99%的氨基酸与对照多肽的氨基酸相同或功能等同的序列,条件是维持蛋白的生物活性。在某些方面,重组蛋白可在生物学功能上等同于其天然对应物。
[0153]
还应当理解,氨基酸和核酸序列可包含额外的残基,诸如额外的n-或c末端氨基酸或5
′
或3
′
序列,但仍然基本上如本文所公开的序列之一中所示,只要序列满足上述准则,包括在涉及蛋白表达的情况下维持生物蛋白活性。末端序列的添加特别适用于如下核酸序
列:可例如包括位于编码区5
′
或3
′
部分侧翼的各种非编码序列,或者可包括已知发生在基因内的各种内部序列,即内含子。
[0154]
如本文所用,蛋白或肽通常是指但不限于大于约200个氨基酸、最多达从基因翻译的全长序列的蛋白;大于约100个氨基酸的多肽;和/或约3到约100个氨基酸的肽。为方便起见,术语“蛋白”、“多肽”和“肽”在本文中可互换使用。
[0155]
如本文所用,“氨基酸残基”是指本领域已知的任何天然存在的氨基酸、任何氨基酸衍生物或任何氨基酸模拟物。在某些实施方案中,蛋白或肽的残基是连续的,没有任何非氨基酸中断氨基酸残基的序列。在其他实施方案中,该序列可包含一个或多个非氨基酸部分。在特定实施方案中,蛋白或肽的残基序列可被一个或多个非氨基酸部分中断。
[0156]
因此,术语“蛋白或肽”涵盖氨基酸序列,所述氨基酸序列包含在天然存在的蛋白中发现的20种常见氨基酸中的至少一种,或至少一种经修饰或不寻常的氨基酸。
[0157]
本发明的某些实施方案涉及融合蛋白。这些分子可能具有在n末端或c末端连接到异源结构域的治疗性蛋白。例如,融合还可采用来自其他物种的前导序列以允许蛋白在异源宿主中的重组表达。另一有用的融合包括添加蛋白亲和标签(诸如血清白蛋白亲和标签或六个组氨酸残基)或免疫活性结构域(诸如优选可切割的抗体表位),以促进融合蛋白的纯化。非限制性亲和标签包括多组氨酸、几丁质结合蛋白(cbp)、麦芽糖结合蛋白(mbp)和谷胱甘肽-s-转移酶(gst)。
[0158]
生成融合蛋白的方法是本领域技术人员众所周知的。可例如通过从头合成完整融合蛋白,或通过附着编码异源结构域的dna序列,之后表达完整的融合蛋白来产生此类蛋白。
[0159]
可通过连接基因与编码肽接头的桥接dna区段来促进恢复亲本蛋白功能活性的融合蛋白的产生,所述肽接头在串联连接的多肽之间剪接。接头将有足够的长度以允许所得融合蛋白的恰当折叠。
[0160]
ii.施用方法
[0161]
在一些方面,病毒载体可直接施用于患者(体内),或者它们可用于在体外或离体处理细胞,然后施用于患者。术语“载体”是指小载剂核酸分子、质粒、病毒(例如,aav载体、逆转录病毒载体、慢病毒载体),或可通过插入或掺入核酸进行操作的其他载体。载体(诸如病毒载体)可用于将核酸序列引入/转移到细胞中,使得其中的核酸序列被转录,并且如果编码蛋白,则随后被细胞翻译。
[0162]
任何适合的细胞或哺乳动物均可通过本文所述的方法或用途来施用或处理。通常,需要本文所述方法的哺乳动物被怀疑具有或表达与疾病状态相关的异常或不正常蛋白。或者,哺乳动物受体可患有适于基因替代疗法的病况。如本文所用,“基因替代疗法”是指向受体施用编码治疗剂的外源遗传物质并随后原位表达所施用的遗传物质。因此,短语“适于基因替代疗法的病况”涵盖诸如以下的病况:遗传疾病(即,可归因于一种或多种基因缺陷的疾病病况)、获得性病状(即,不可归因于先天缺陷的病理病况)、癌症和预防过程(即,疾病或不期望的医学病况的预防)。因此,如本文所用,术语“治疗剂”是指对哺乳动物受体具有有益作用的任何药剂或材料。因此,“治疗剂”涵盖具有核酸或蛋白组分的治疗性分子和预防性分子。
[0163]
哺乳动物的非限制性示例包括人、非人灵长类动物(例如,类人猿、长臂猿、黑猩
猩、猩猩、猴、猕猴等)、家畜(例如狗和猫)、农场动物(例如,马、牛、山羊、绵羊、猪)和实验动物(例如,小鼠、大鼠、兔、豚鼠)。在某些实施方案中,哺乳动物是人。在某些实施方案中,哺乳动物是非啮齿类哺乳动物(例如,人、猪、山羊、绵羊、马、狗等)。在某些实施方案中,非啮齿类哺乳动物是人。哺乳动物可以是任何年龄或处于任何发育阶段(例如,成人、青少年、儿童、婴儿或子宫内的哺乳动物)。哺乳动物可以是雄性或雌性。在某些实施方案中,哺乳动物可以是动物疾病模型,例如,具有或表达与疾病状态相关的异常或不正常蛋白的动物模型、或具有引起疾病状态的蛋白表达不足的动物模型。
[0164]
通过本文所述的方法或组合物治疗的哺乳动物(受试者)包括成人(18岁或更大)和儿童(年龄小于18岁)。成人包括老年人。代表性的成人是50岁或以上。儿童的年龄范围为1-2岁,或2-4、4-6、6-18、8-10、10-12、12-15和15-18岁。儿童还包括婴儿。婴儿的年龄通常在1-12个月范围。
[0165]
在某些实施方案中,方法包括向哺乳动物施用如本文所述的多个病毒颗粒,其中降低、减少、预防、抑制或延迟疾病状态(诸如神经退行性疾病)的一种或多种症状的严重性、频率、进展或发作时间。在某些实施方案中,方法包括向哺乳动物施用多个病毒颗粒以治疗疾病状态(诸如神经退行性疾病)的不利症状。在某些实施方案中,方法包括向哺乳动物施用多个病毒颗粒以稳定、延迟或预防疾病状态(诸如神经退行性疾病)的恶化或进展、或逆转和不利的症状。
[0166]
在某些实施方案中,方法包括向哺乳动物的中枢神经系统或其如本文所述的部分施用多个病毒颗粒,并且将疾病状态(诸如神经退行性疾病)的一种或多种症状的严重性、频率、进展或发作时间降低、减少、预防、抑制或延迟至少约5到约10、约10到约25、约25到约50或约50到约100天。
[0167]
在某些实施方案中,症状或不利作用包括早期、中期或晚期症状;行为、性格或语言症状;吞咽、运动、癫痫发作、震颤或坐立不安的症状;共济失调;和/或认知症状,诸如记忆力、组织能力。
[0168]
iii.药物组合物
[0169]
如本文所用,术语“药学上可接受的”和“生理上可接受的”意指适于一种或多种施用途径、体内递送或接触的生物学上可接受的组合物、制剂、液体或固体或其混合物。“药学上可接受的”或“生理上可接受的”组合物是在生物学或其他方面不是不期望的材料,例如,该材料可施用于受试者而不会引起实质上不期望的生物学效应。此类组合物、“药学上可接受的”和“生理上可接受的”制剂和组合物可以是无菌的。此类药物制剂和组合物可用于例如向受试者施用病毒颗粒。
[0170]
此类制剂和组合物包含与药物施用或体内接触或递送相容的溶剂(水性或非水性)、溶液(水性或非水性)、乳液(例如,水包油或油包水)、悬浮液、糖浆、酏剂、分散和悬浮介质、包衣、等渗剂和吸收促进剂或延迟剂。水性和非水性溶剂、溶液和悬浮液可包含悬浮剂和增稠剂。补充的活性化合物(例如,防腐剂、抗细菌剂、抗病毒剂和抗真菌剂)也可掺入制剂和组合物中。
[0171]
药物组合物通常含有药学上可接受的赋形剂。此类赋形剂包括本身不诱导产生对接受组合物的个体有害的抗体并且可被施用而无过度毒性的任何药剂。药学上可接受的赋形剂包括但不限于山梨糖醇、吐温80(tween80)和液体,诸如水、盐水、甘油和乙醇。其中可
包括药学上可接受的盐,例如矿物酸盐,诸如盐酸盐、氢溴酸盐、磷酸盐、硫酸盐等;和有机酸盐,诸如乙酸盐、丙酸盐、丙二酸盐、苯甲酸盐等。另外,辅助物质(诸如表面活性剂、润湿剂或乳化剂、ph缓冲物质等)可存在于此类媒介物中。
[0172]
如本文所述或本领域技术人员已知的,可将药物组合物配制成与特定施用或递送途径相容。因此,药物组合物包含适于通过各种途径施用或递送的载剂、稀释剂或赋形剂。
[0173]
适于注射或输注病毒颗粒的药物形式可包括适于当场制备无菌可注射或可输注溶液或分散液的无菌水溶液或分散液,其任选地封装在脂质体中。在所有情况下,最终形式都应当是无菌流体,并且在制造、使用和储存条件下稳定。液体载剂或媒介物可以是溶剂或液体分散介质,其包含例如水、乙醇、多元醇(例如,甘油、丙二醇、液体聚乙二醇等)、植物油、无毒甘油酯和它们适合的混合物。可例如通过形成脂质体、在分散液的情况下通过维持所需的粒径或通过使用表面活性剂来维持适当的流动性。可包含等渗剂,例如糖、缓冲剂或盐(例如,氯化钠)。可通过在组合物中使用延迟吸收的试剂(例如,单硬脂酸铝和明胶)来产生可注射组合物的延长吸收。
[0174]
病毒颗粒的溶液或悬浮液可任选地包含以下组分中的一种或多种:无菌稀释剂,诸如注射用水、盐水溶液(诸如磷酸盐缓冲盐水(pbs))、人工csf、表面活性剂、不挥发油、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)、甘油或其他合成溶剂;抗细菌剂和抗真菌剂,诸如对羟基苯甲酸酯、氯丁醇、苯酚、抗坏血酸等;抗氧化剂,诸如抗坏血酸或亚硫酸氢钠;螯合剂,诸如乙二胺四乙酸;缓冲剂,诸如乙酸盐、柠檬酸盐或磷酸盐,以及用于调节张力的试剂,诸如氯化钠或右旋糖。
[0175]
适于本发明的组合物、方法和用途的药物制剂、组合物和递送系统是本领域已知的(参见,例如,雷明顿:药学科学与实践(remington:the science and practice of pharmacy)(2003)第20版,mack publishing co.,easton,pa;雷明顿药物科学(remington's pharmaceutical sciences)(1990)第18版,mack publishing co.,easton,pa;默克索引(the merck index)(1996)第12版,merck publishing group,whitehouse,nj;固体剂型的药学原理(pharmaceutical principles of solid dosage forms)(1993),technonic publishing co.,inc.,lancaster,pa.;ansel和stoklosa,药物计算(pharmaceutical calculations)(2001)第11版,lippincott williams&wilkins,baltimore,md;和poznansky等,药物递送系统(drug delivery systems)(1980),r.l.juliano编辑,oxford,n.y.,第253-315页)。
[0176]
可将病毒颗粒和它们的组合物配制成剂量单位形式,以便于施用和剂量的均匀性。如本文所用的剂量单位形式是指适合作为单位剂量用于待治疗个体的物理离散单位;每个单位含有经计算与所需药物载剂联合产生期望治疗作用的预定量的活性化合物。剂量单位形式取决于认为产生一种或多种期望效应所必需的病毒颗粒的数目。必要的量可配制成单剂量,或者可配制成多个剂量单位。可将剂量调整到适合的病毒颗粒浓度,任选地与抗炎剂组合,并包装以供使用。
[0177]
在一个实施方案中,药物组合物将包含足够的遗传物质以提供治疗有效量,即足以减少或改善所讨论疾病状态的症状或不利作用的量或足以赋予期望益处的量。
[0178]
如本文所用的“单位剂型”是指适合作为单位剂量用于待治疗受试者的物理离散单位;每个单位含有任选地与药物载剂(赋形剂、稀释剂、媒介物或填充剂)联合的预定的
量,当以一个或多个剂量施用时,经计算产生期望作用(例如,预防或治疗作用)。单位剂型可在例如安瓿和小瓶内,其可包括液体组合物,或处于冷冻干燥或冻干状态的组合物;例如,可在体内施用或递送之前添加无菌液体载剂。单个单位剂型可被包含在多剂量试剂盒或容器中。因此,例如,可将病毒颗粒和其药物组合物包装在单个或多个单位剂型中,以便于施用和剂量的均匀性。
[0179]
含有病毒颗粒的制剂通常含有有效量,该有效量容易由本领域技术人员确定病毒颗粒通常可在组合物的约1%到约95%(w/w)范围,或者如果适合的话甚至更高。待施用的量取决于诸如以下的因素:考虑治疗的哺乳动物或人受试者的年龄、体重和身体状况。本领域普通技术人员可通过建立剂量反应曲线的常规试验来建立有效剂量。
[0180]
iv.定义
[0181]
术语“多核苷酸”、“核酸”和“转基因”在本文中可互换用于指代所有形式的核酸、寡核苷酸,包括脱氧核糖核酸(dna)和核糖核酸(rna)以及它们的聚合物。多核苷酸包括基因组dna、cdna和反义dna,以及剪接或未剪接的mrna、rrna、trna和抑制性dna或rna(rnai,例如,小或短发夹(sh)rna、微小rna(mirna)、小或短干扰(si)rna、反式剪接rna或反义rna)。多核苷酸可包括天然存在的、合成的和有意修饰或改变的多核苷酸(例如,变体核酸)。多核苷酸可以是单链的、双链的或三联的、线性的或环状的,并且可具有任何适合的长度。在讨论多核苷酸时,可根据在5
′
到3
′
方向上提供序列的惯例在本文中描述特定多核苷酸的序列或结构。
[0182]
编码多肽的核酸经常包含编码多肽的开放阅读框。除非另外指明,否则特定的核酸序列还包含简并密码子取代。
[0183]
核酸可包含一种或多种可操作地连接到开放阅读框的表达控制或调控元件,其中一种或多种调控元件被配置为指导哺乳动物细胞中由开放阅读框编码的多肽的转录和翻译。表达控制/调控元件的非限制性示例包括转录起始序列(例如,启动子、增强子、tata盒等)、翻译起始序列、mrna稳定性序列、多聚a序列、分泌序列等。可从任何适合生物体的基因组获得表达控制/调控元件。
[0184]“启动子”是指通常位于编码序列上游(5
′
)的核苷酸序列,其通过提供对rna聚合酶和正确转录所需的其他因子的识别来指导和/或控制编码序列的表达。pol ii启动子包括最小启动子,该最小启动子是包含tata盒和任选地用于指定转录起始位点的其他序列的短dna序列,调控元件被添加到这些序列以控制表达。1型pol iii启动子包含转录起始位点下游的三个顺式作用序列元件:a)5
′
序列元件(a块(block));b)中间序列元件(i块);c)3
′
序列元件(c块)。2型pol iii启动子包含转录起始位点下游的两个必需的顺式作用序列元件:a)a盒(5
′
序列元件);和b)b盒(3
′
序列元件)。3型pol iii启动子包含转录起始位点上游的若干顺式作用启动子元件,诸如传统的tata盒、近端序列元件(pse)和远端序列元件(dse)。
[0185]“增强子”是可刺激转录活性的dna序列,并且可以是启动子的固有元件或增强表达的水平或组织特异性的异源元件。它能够以任一取向(5
’‑
>3’或3
’‑
>5’)操作,并且即使在位于启动子的上游或下游时也可能能够发挥作用。
[0186]
启动子和/或增强子可全部来源于天然基因,或由来源于自然界中发现的不同元件的不同元件构成,或者甚至包含合成dna区段。启动子或增强子可包含参与蛋白因子结合
的dna序列,所述蛋白因子调节/控制响应于刺激、生理或发育条件的转录起始的有效性。
[0187]
启动子的非限制性示例包括sv40早期启动子、小鼠乳腺肿瘤病毒ltr启动子;腺病毒主要晚期启动子(ad mlp);单纯疱疹病毒(hsv)启动子、巨细胞病毒(cmv)启动子(诸如cmv立即早期启动子区(cmvie))、劳氏肉瘤病毒(rous sarcoma virus)(rsv)启动子、pol ii启动子、pol iii启动子、合成启动子、杂合启动子等。另外,来源于非病毒基因的序列(诸如鼠金属硫蛋白基因)也可用于本文中。示例性组成型启动子包括编码某些组成型或“管家”功能的以下基因的启动子:次黄嘌呤磷酸核糖基转移酶(hprt)、二氢叶酸还原酶(dhfr)、腺苷脱氨酶、磷酸甘油激酶(pgk)、丙酮酸激酶、磷酸甘油变位酶、肌动蛋白启动子、u6和本领域技术人员已知的其他组成型启动子。另外,许多病毒启动子在真核细胞中组成型地发挥作用。这些尤其包括:sv40的早期和晚期启动子;莫洛尼氏白血病病毒(moloney leukemia virus)和其他逆转录病毒的长末端重复(ltr);和单纯疱疹病毒的胸苷激酶启动子。另外,来源于内含子mirna启动子的序列(诸如例如,mir107、mir206、mir208b、mir548f-2、mir569、mir590、mir566和mir128启动子)也可用于本文中(参见例如monteys等,2010)。因此,任何上文所提及的组成型启动子均可用于控制异源基因插入物的转录。
[0188]“转基因”在本文中用于方便地指代所意欲的或已经被引入细胞或生物体中的核酸序列/多核苷酸。转基因包括任何核酸,诸如编码抑制性rna或多肽或蛋白的基因,并且相对于天然存在的aav基因组序列通常是异源的。
[0189]
术语“转导”是指通过载体(例如,病毒颗粒)将核酸序列引入细胞或宿主生物体中。因此,通过病毒颗粒将转基因引入细胞中可被称为细胞的“转导”。可以或可以不将转基因整合到受转导细胞的基因组核酸中。如果引入的转基因整合到受体细胞或生物体的核酸(基因组dna)中,则它可稳定地维持在该细胞或生物体中,并进一步传递给受体细胞或生物体的子代细胞或生物体或由其遗传。最后,所引入的转基因可在受体细胞或宿主生物体中存在于染色体外,或仅短暂存在。因此,“转导的细胞”是已通过转导方式将转基因引入其中的细胞。因此,“转导”的细胞是已将转基因引入其中的细胞或其子代。可繁殖转导的细胞,转录转基因,并表达编码的抑制性rna或蛋白。对于基因治疗用途和方法,转导的细胞可在哺乳动物中。
[0190]
处于诱导型启动子控制之下的转基因仅在诱导剂存在下表达或在更大程度上表达(例如,处于金属硫蛋白启动子控制之下的转录在某些金属离子存在下大大增加)。诱导型启动子包括在结合其诱导因子时刺激转录的响应元件(re)。例如,存在用于血清因子、类固醇激素、视黄酸和环amp的re。可选择含有特定re的启动子以获得可诱导应答,并且在一些情况下,re本身可附着到不同的启动子,从而赋予重组基因可诱导性。因此,通过选择适合的启动子(组成型相对于诱导型;强相对于弱),可控制遗传修饰细胞中多肽的存在和表达水平。如果编码多肽的基因处于诱导型启动子的控制之下,则通过将遗传修饰细胞原位暴露于允许多肽转录的条件,例如通过腹膜内注射控制药剂转录的诱导型启动子的特异性诱导物来触发多肽的原位递送。例如,由处于金属硫蛋白启动子控制之下的基因编码的多肽的由遗传修饰细胞的原位表达通过使遗传修饰细胞与含有适当(即诱导性)金属离子的溶液原位接触而得到增强。
[0191]
当核酸/转基因被置于与另一核酸序列的功能关系中时,它是“可操作地连接的”。编码rnai或多肽的核酸/转基因,或指导多肽表达的核酸可包括诱导型启动子,或用于控制
所编码多肽的转录的组织特异性启动子。可操作地连接到表达控制元件的核酸还可被称为表达盒。
[0192]
在某些实施方案中,在本文所述的方法和用途中采用cns特异性或诱导型启动子、增强子等。cns特异性启动子的非限制性示例包括从来自髓鞘碱性蛋白(mbp)、胶质原纤维酸性蛋白(gfap)和神经元特异性烯醇化酶(nse)的基因中分离的那些。诱导型启动子的非限制性示例包括用于蜕皮激素、四环素、缺氧和ifn的dna响应元件。
[0193]
在某些实施方案中,表达控制元件包括cmv增强子。在某些实施方案中,表达控制元件包括β肌动蛋白启动子。在某些实施方案中,表达控制元件包括鸡β肌动蛋白启动子。在某些实施方案中,表达控制元件包括cmv增强子和鸡β肌动蛋白启动子。
[0194]
如本文所用,术语“修饰”或“变体”和其语法变型意指核酸、多肽或其子序列偏离参考序列。因此,修饰的序列和变体序列可具有与参考序列相比基本上相同、更大或更少的表达、活性或功能,但至少保留了参考序列的部分活性或功能。特定类型的变体是突变蛋白,它是指由具有突变(例如,错义或无义突变)的基因编码的蛋白。
[0195]“核酸”或“多核苷酸”变体是指与野生型相比已被遗传改变的经修饰序列。序列可被遗传修饰而不改变编码的蛋白序列。或者,序列可被遗传修饰以编码变体蛋白。核酸或多核苷酸变体还可指代组合序列,其已被密码子修饰以编码与参考序列(诸如野生型蛋白序列)仍保持至少部分序列同一性的蛋白,并且还已被密码子修饰以编码变体蛋白。例如,此类核酸变体的一些密码子将被改变而不改变由其编码的蛋白的氨基酸,并且核酸变体的一些密码子将被改变,这进而改变由其编码的蛋白的氨基酸。
[0196]
术语“蛋白”和“多肽”在本文中可互换使用。由本文所公开的“核酸”或“多核苷酸”或“转基因”编码的“多肽”包括部分或全长的天然序列,正如天然存在的野生型和功能性多态性蛋白、其功能性子序列(片段)和其序列变体一样,只要多肽保留一定程度的功能或活性即可。因此,在本发明的方法和用途中,由核酸序列编码的此类多肽不需要与在被处理的哺乳动物中有缺陷或活性、功能或表达不足、缺乏或不存在的内源蛋白相同。
[0197]
修饰的非限制性示例包括一个或多个核苷酸或氨基酸取代(例如,约1到约3、约3到约5、约5到约10、约10到约15、约15到约20、约20到约25、约25到约30、约30到约40、约40到约50、约50到约100、约100到约150、约150到约200、约200到约250、约250到约500、约500到约750、约750到约1000或更多个核苷酸或残基)。
[0198]
氨基酸修饰的示例是保守氨基酸取代或缺失。在特定实施方案中,经修饰的序列或变体序列保留了未修饰序列(例如,野生型序列)的至少部分功能或活性。
[0199]
氨基酸修饰的另一示例是引入病毒颗粒的衣壳蛋白中的靶向肽。已鉴别出将重组病毒载体靶向中枢神经系统(诸如靶向独特脑区)的肽。
[0200]
如此修饰的重组病毒可相对于另一种类型的组织(例如,肝组织)优先结合到一种类型的组织(例如,cns组织)。在某些实施方案中,携带经修饰的衣壳蛋白的重组病毒可通过以高于相当的未修饰衣壳蛋白的水平结合来“靶向”脑血管上皮组织。例如,具有经修饰的衣壳蛋白的重组病毒可以比未经修饰的重组病毒大50%到100%的水平结合到脑血管上皮组织。
[0201]“核酸片段”是给定核酸分子的一部分。大多数生物体中的脱氧核糖核酸(dna)是遗传物质,而核糖核酸(rna)参与将dna内所含的信息转移到蛋白中。本发明还涵盖所公开
的核苷酸序列的片段和变体以及由其编码的蛋白或部分长度的蛋白。“片段”或“部分”意指全长或小于全长的编码多肽或蛋白或其氨基酸序列的核苷酸序列。在某些实施方案中,片段或部分具有生物学功能(即,保留野生型的5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或100%活性或功能)。
[0202]
分子的“变体”是与天然分子的序列基本上相似的序列。对于核苷酸序列,变体包括由于遗传密码的简并性而编码天然蛋白的相同氨基酸序列的那些序列。可使用分子生物学技术(如例如使用聚合酶链式反应(pcr)和杂交技术)来鉴别诸如这些的天然存在的等位基因变体。变体核苷酸序列还包括合成来源的核苷酸序列,诸如例如通过使用定点诱变生成的编码天然蛋白的核苷酸序列,以及编码具有氨基酸取代的多肽的核苷酸序列。通常,本发明的核苷酸序列变体将与天然(内源性)核苷酸序列具有至少40%、50%、60%到70%(例如,71%、72%、73%、74%、75%、76%、77%、78%,到79%,通常至少80%,例如,81%-84%,至少85%,例如,86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%,到98%)的序列同一性。在某些实施方案中,变体具有生物学功能(即,保留野生型的5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或100%活性或功能)。
[0203]
特定核酸序列的“保守变异”是指那些编码相同或基本相同的氨基酸序列的核酸序列。由于遗传密码的简并性,大量功能相同的核酸编码任何给定的多肽。例如,密码子cgt、cgc、cga、cgg、aga和agg都编码氨基酸精氨酸。因此,在精氨酸由密码子指定的每个位置,可将密码子改变为所描述的任何对应密码子而不改变所编码的蛋白。此类核酸变异是“沉默变异”,其是“保守修饰的变异”中的一种。除非另有说明,否则本文所述的编码多肽的每个核酸序列还描述了每种可能的沉默变异。本领域技术人员将认识到可通过标准技术修饰核酸中的每个密码子(除了atg,其通常是甲硫氨酸的唯一密码子)以产生功能上相同的分子。因此,编码多肽的核酸的每种“沉默变异”均隐含在每个所述序列中。
[0204]
术语多核苷酸序列的“基本相同”意指多核苷酸包含与使用标准参数描述的比对程序之一的参考序列相比具有至少70%、71%、72%、73%、74%、75%、76%、77%、78%或79%、或至少80%、81%、82%、83%、84%、85%、86%、87%、88%或89%、或至少90%、91%、92%、93%或94%、或甚至至少95%、96%、97%、98%或99%序列同一性的序列。本领域技术人员将认识到,可通过考虑密码子简并性、氨基酸相似性、阅读框定位等,适当地调整这些值以确定由两个核苷酸序列编码的蛋白的对应同一性。用于这些目的的氨基酸序列的基本相同通常意指至少70%、至少80%、90%或甚至至少95%的序列同一性。
[0205]
术语“基本相同”在多肽的背景下指示多肽包含在指定的比较窗口内与参考序列具有至少70%、71%、72%、73%、74%、75%、76%、77%、78%或79%、或80%、81%、82%、83%、84%、85%、86%、87%、88%或89%、或至少90%、91%、92%、93%或94%、或甚至95%、96%、97%、98%或99%序列相同的序列。两个多肽序列相同指示在于一种多肽与针对第二种多肽产生的抗体具有免疫反应性。因此,多肽与第二多肽是相同的,例如,其中两种肽的差异仅在于保守取代。
[0206]
术语“治疗(treat/treatment)”是指治疗性治疗和预防性或防范性措施,其中目的是预防、抑制、降低或减少不期望的生理变化或病症,诸如病症的发展、进展或恶化。出于
本发明的目的,有益的或期望的临床结果包括但不限于症状的减轻、疾病程度的减小、使疾病的症状或不利作用稳定(即,不恶化或进展)、疾病进展的延迟或减慢、疾病状态的改善或缓和以及缓解(无论是部分还是全部),无论是可检测的还是不可检测的。“治疗”还可意指与不接受治疗时的预期存活相比延长存活。那些需要治疗者包括那些已患有病况或病症者以及那些易患病者(例如,如通过基因测定所确定)。
[0207]
v.试剂盒
[0208]
本发明提供具有包装材料和其中的一种或多种组分的试剂盒。试剂盒通常包括标签或包装插页,所述标签或包装插页包括组分的描述或其中组分的体外、体内或离体使用说明。试剂盒可装有一批此类组分,例如核酸、重组载体和/或病毒颗粒。
[0209]
试剂盒是指容纳试剂盒的一种或多种组分的物理结构。包装材料可无菌地维持组分,并且可由通常用于此类目的的材料(例如,纸、波纹纤维、玻璃、塑料、箔、安瓿、小瓶、管等)制成。
[0210]
标签或插页可包括其中的一种或多种组分、剂量量、一种或多种活性成分的临床药理学(包括作用机制、药物代谢动力学和药物效应动力学)的标识信息。标签或插页可包括标识制造商、批号、制造地点和日期、有效日期的信息。标签或插页可包括标识制造商信息、批号、制造商位置和日期的信息。标签或插页可包括关于可使用试剂盒组分的疾病的信息。标签或插页可包括临床医生或受试者在方法、用途或治疗规程或治疗方案中使用一种或多种试剂盒组分的说明。说明可包括剂量量、频率或持续时间,以及实施本文所述的任何方法、用途、治疗规程或预防或治疗方案的说明。
[0211]
标签或插页可包括关于组分可提供的任何益处(诸如预防或治疗益处)的信息。标签或插页可包括关于潜在不利副作用、并发症或反应的信息,诸如关于不适合使用特定组合物的情况向受试者或临床医生发出的警告。当受试者已经、将要或当前正在服用一种或多种可能与组合物不相容的其他药物时,或者当受试者已经、将要或当前正在接受将与组合物不相容的另一种治疗规程或治疗方案时,也可能发生不利副作用或并发症,因此,说明可包括关于此类不相容性的信息。
[0212]
标签或插页包括“印刷品”,例如,纸张或纸板,它们或者是单独的,或者粘贴到组件、试剂盒或包装材料(例如,盒子)上,或附着到装有试剂盒组分的安瓿、试管或小瓶上。标签或插页可另外包括计算机可读介质,诸如条形码印刷标签、磁盘、光盘(诸如cd-或dvd-rom/ram、dvd、mp3)、或电存储介质(诸如ram和rom)或这些的混合体,诸如磁/光存储介质、闪存、混合体和存储器型卡。
[0213]
vi.实施例
[0214]
包括以下实施例以证实本发明的优选实施方案。本领域技术人员应当了解,以下实施例中所公开的技术代表了本发明人发现的在本发明的实施中良好地发挥作用的技术,因此可被视为构成其优选实施模式。然而,本领域技术人员根据本公开应当了解,可在不脱离本发明精神和范围的情况下对所公开的具体实施方案作出许多改变,并且仍然获得相同或类似的结果。
[0215]
实施例1-靶向脑实质的aav变体的鉴别
[0216]
使用aav1、aav2和aav9衣壳作为起始平台开发了高级的条形码aav文库。aav1、aav2和aav9肽展示文库是通过分别在aav1衣壳的590位、aav2衣壳的587位和aav9衣壳的
588位插入随机序列生成的(图1)。该文库具有1
×
107个独特克隆的多样性(图3)。
[0217]
为了测试文库的实用性,用实验台级(bench-grade)(低效价、低纯度)衣壳修饰的aav2进行先导研究。将aav2文库以每只动物8
×
10
10
个载体基因组静脉内注射到两只c57bl/6小鼠中。在72小时后,解剖大脑皮质、小脑和脊髓。值得注意的是,单独收获心脏、骨骼肌和膈膜,以鉴别肌肉向性。分离病毒基因组dna,并通过pcr扩增回收的随机寡核苷酸序列。汇集来自脑的pcr产物以生成第二轮文库,将该文库以每只动物4
×
10
10
个载体基因组注射到两只小鼠中。在第二次注射后,如前所述回收载体基因组,并与起始文库和第1轮组织一起进行nexgen测序。为了测试显示在脑组织中富集的序列是否确实可将aav2延伸到脑,将单个命中物(hit)克隆到aav2衣壳包装质粒中,并生成表达egfp的aav2。制得实验台级载体,并将基于aav2的衣壳修饰病毒的3
×
10
10
个载体基因组注射到小鼠中。在4周后,即使对于这些低滴度变体,在脑中也可以看到egfp荧光。
[0218]
使用这些高级的条形码aav文库,鉴别出可靶向非人灵长类动物中独特灵长类动物脑结构的aav变体。经由脑室内注射将aav1、aav2和aav9文库递送到一种非人灵长类动物中(图2)。在输注后72小时,对脑区进行显微解剖以用于病毒dna分离并通过pcr扩增aav dna。将产物汇集并用于包装第二轮文库,将该文库输注到额外的nhp中。然后在输注后12天对脑区进行显微解剖。在两轮淘选(panning)后,将载体基因组回收并进行下一代测序。具体地说,对从第1轮和第2轮组织提取的基因组dna进行pcr扩增,以在载体条形码位置处生成illumina扩增子测序文库。将所得文库汇集并使用100bp单端读取化学方法在illumina hiseq 4000的单泳道上运行。为了说明该方法的实用性,以若干目标区域作为示例进行了测试:室管膜、脑脊膜和小脑。一般来说,将aavx引导到室管膜、脑脊膜和小脑的序列是不同的,并且对于不同的血清型是不同的。
[0219]
生成以下组织的逐轮富集图(图4)和热图(图5和图6):脑干、尾核、小脑皮质(图5)、大脑皮质、室管膜、苍白球、海马、脑脊膜、视神经、壳核、脊髓、黑质、底丘脑核和丘脑。这些说明了在基线(第0轮)以及通过恒河猕猴体内传代的第一轮和第二轮之后,所指示条形码的富集。为了生成这些,使用自定义python脚本处理每个组织和轮次组合的fastq结果文件,该脚本被设计成对在dna水平下观察到的唯一条形码配置进行提取和定量。使用自定义r脚本来计算每个样品中存在的条形码的百分比,并将dna条形码转换为氨基酸条形码。表1对应于用aav1衍生文库处理的样品;表2代表用aav2衍生文库处理的组织;表3对应于用aav9衍生文库处理的样品。从这三个文库中选择最高命中物,并且将其组装并生成为含有50个(aav1)、58个(aav2)和30个(aav9)衍生条形码的验证文库。通过icv注射将该验证文库递送到额外的恒河猕猴中。再次收集并加工组织以有助于通过深度测序恢复条形码丰度。在回收的组织和输入病毒文库中评价条形码丰度。每个条形码的富集值是相对于它们在输入病毒文库中的丰度计算的。所得到的相对富集值是评价的各种组织中载体性能的稳健指标,有助于鉴别宽泛和特异性的aav载体变体(图7a-c)。
[0220]
为了验证所鉴别的细胞类型特异性,选择aav9-1999(具有kgggfhg seq id no:110的靶向肽序列)用于体内验证。将egfp表达构建体包装到由cag启动子驱动的aav9-1999中。通过icv注射到左侧脑室向5岁龄的雌性恒河猕猴施用1.5e13 vg的aav9-1999。在注射后30天收集脑,用于组织学分析。对小脑切片进行h&e染色以描绘aav9-1999的转导模式(图8)。还从该动物采集耳蜗,并且它令人惊讶地具有强的毛细胞转导。另外,通过以每半球
1e10 vg的icv注射将含有egfp构建体的aav9-1999和aav9衣壳递送到c57bl/6p0小鼠幼崽。在21天后,对小鼠进行灌注。对封固全脑(图9a)、40μm全脑矢状切面(图9b)、40μm s1皮质切面(图9c,左)、40μm海马切面(图9c,中)、40μm小脑矢状切面(图9c,右)和40μm腰脊髓冠状切面(图9d)进行egfp荧光信号成像。注射到b1/6新生小鼠幼崽中的aav9-1999显示出大于剂量匹配注射的aav9的遍在表达。
[0221]
向一只成年恒河猕猴注射四种经修饰的aav的混合物:具有rgdlqwv(seq id no:113)靶向肽序列和mtagbfp2标签的aav9;具有erdrtrg(seq id no:21)靶向肽序列和mtfp1标签的aav1;具有grgapgg(seq id no:80)靶向肽序列和mng标签的aav2;以及具有ddpsarr(seq id no:53)靶向肽序列和mruby3标签的aav2。将病毒以等体积直接混合,以实现如下每种病毒的最终总剂量:
[0222]
aav9.rgdl mtagbfp2
ꢀꢀꢀꢀ
6.13e12总vg
[0223]
aav1.erdr mtfp1
ꢀꢀꢀꢀꢀꢀꢀ
1.23e13总vg
[0224]
aav2.grga mng
ꢀꢀꢀꢀꢀꢀꢀ
8.8e12总vg
[0225]
aav2.ddps mruby3
ꢀꢀꢀꢀ
1.32e13总vg
[0226]
在注射后30天收集脑,用于荧光成像。针对mtagbfp2、mtfp2、mng和mruby3荧光信号对侧脑室切面(图10a)、第四脑室切面(图10b)和脑脊膜切面(图10c)进行成像。
[0227]
通过将aav9-1999注射到恒河猕猴的耳蜗中来进行额外的实验。基于耳蜗转导的结果,动物的侧脑室接受aav9-1999。单只动物接受3e11 vg的aav9-1999,以管开窗术直接注射到它们的圆窗(图11a-c)。
[0228]
根据本公开,无需过度实验即可制备和实施本文所公开和要求保护的所有方法。虽然已经按照优选实施方案对本发明的组合物和方法进行了描述,但对于本领域技术人员将显而易见的是,在不脱离本发明的构思、精神和范围的情况下可对所述方法以及本文所描述的方法的步骤或步骤的顺序作出改变。更具体地,将显而易见的是,与化学上和生理学上两者均相关的某些药剂可代替本文所述的药剂,而仍将实现相同或类似的结果。对于本领域技术人员显而易见的所有此类类似的代替物和修改均被认为在由所附权利要求所定义的本发明的精神、范围和概念内。
[0229]
参考文献
[0230]
以下参考文献以引用方式明确地并入本文中,其引用程度为它们为本文的公开提供补充性的示例性程序性细节或其他细节。
[0231]
美国专利号8,299,215
[0232]
美国专利号8,691,948
[0233]
美国专利申请公开号2018/0142259
[0234]
chen等,患病脑内皮的分子标记为cns导向性酶疗法提供新的位点(molecular signatures of disease brain endothelia provide new sites for cns-directed enzyme therapy).nat med,2009.15(10):第1215-8页。
[0235]
chen等,克服磺酰胺酶固有的限制以改善粘多糖贮积症iiia基因疗法(overcoming limitations inherent in sulfamidase to improve mucopolysaccharidosis iiia gene therapy).mol ther,2018.26(4):第1118-1126页。
[0236]
deverman等,cre依赖性选择产生用于将基因广泛地转移到成人脑的aav变体
(cre-dependent selection yields aav variants for widespread gene transfer to the adult brain).nat biotechnol,2016.34(2):第204-9页。
[0237]
hartz等,从新鲜人脑组织中分离大脑毛细血管(isolation of cerebral capillariesfrom fresh human brain tissue).j vis exp,2018(139)。
[0238]
hordeaux等,aav-php.b的嗜神经性质仅限于c57bl/6j小鼠(the neurotropic properties of aav-php.b are limited to c57bl/6j mice).mol ther,2018.26(3):第664-668页。
[0239]
katz等,aav基因转移延迟晚期婴儿型巴腾病的tpp1缺陷犬模型中的疾病发作(aav gene transfer delays disease onset in a tpp1-deficient canine model of the late infantile form of batten disease).sci transl med,2015.7(313):第313ra180页。
[0240]
keiser等,用于脊髓小脑共济失调1型治疗的恒河猴小脑中共济失调蛋白1沉默的广泛分布(broad distribution of ataxin 1 silencing in rhesus cerebella for spinocerebellar ataxia type 1 therapy).brain,2015.138(pt 12):第3555-66页。
[0241]
koerber等,腺相关病毒的dna改组产生功能多样的病毒子代(dna shuffling of adeno-associated virus yields functionally diverse viral progeny).mol ther,2008.16(10):第1703-9页。
[0242]
matsuzaki等,静脉内施用腺相关病毒-php.b衣壳未能上调狨猴脑中的转导效率(intravenous administration of the adeno-associated virus-php.b capsid fails to upregulate transduction efficiency in the marmoset brain).neurosci lett,2018.665:第182-188页。
[0243]
mcbride等,rnai介导的htt阻抑在恒河猕猴中作为用于亨延顿病的潜在疗法的临床前安全性(preclinical safety of rnai-mediated htt suppression in the rhesus macaque as a potential therapy for huntington
′
s disease).mol ther,2011.19(12):第2152-62页。
[0244]
monteys等,突变亨延顿蛋白等位基因的体外和体内crispr/cas9编辑(crispr/cas9 editing of the mutant huntingtin allele in vitro and in vivo).mol ther,2017.25(1):第12-23页。
[0245]
muller等,用于选择靶向基因治疗载体的展示在腺相关病毒上的随机肽文库(random peptide libraries displayed on adeno-associated virus to select for targeted gene therapy vectors).nat biotechnol,2003.21(9):第1040-6页。
[0246]
schaffer和maheshri,用于增强基因递送的aav突变体的定向进化(directed evolution of aav mutants for enhanced gene delivery).conf proc ieee eng med biol soc,2004.5:第3520-3页。
[0247]
zhong等,下一代腺相关病毒2载体:酪氨酸点突变导致较低剂量下的高效转导(next generation of adeno-associated virus 2 vectors:point mutations in tyrosines lead to high-efficiency transduction at lower doses).proc natl acad sci u s a,2008.105(22):第7827-32页。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。