mir-421在制备治疗缺血性脑卒中药物中的应用
技术领域
1.本发明涉及基因工程、医药技术领域,具体属于mir-421在制备 治疗缺血性脑卒中药物中的应用。
背景技术:
2.随着基因工程研究的深入,科学家对运用基因工程研制药物表现 出浓厚的兴趣。microrna简称为mir,通常长度为19~25个核苷酸, 广泛存在于各种动植物甚至单细胞真核生物中,是一类在进化上高 度保守的小分子单链rna。mirna与下游特定基因(靶基因)的信使 rna(mrna)的3’端非编码区(3’utr)产生碱基互补配对,引起该mrna 的降解或抑制其翻译,导致蛋白表达失败。mirna通过调节靶基因的 表达而参与各种细胞功能。科学家已证实,mirna的核苷酸序列在 不同物种间高度保守,突变率极低,其表达有基因簇集现象,时空及 组织特异性。mirna在转录后水平调控蛋白质的表达谱来决定细胞分 化、胚胎发育等一系列重要生命活动的进程及多样性,为我们从rna 调控的角度揭示疾病发生机制提供理论基础,并为疾病诊断和治疗提 供新的基因靶点和分子标记。
3.脑卒中是一种急性脑血管疾病,具体的发病机制起源于脑部血管 突然破裂或因血管阻塞导致血液不能流入大脑,从而引起脑组织损伤 的一类疾病,俗称“中风”。世界卫生组织已经报道了脑卒中是全世 界致死率居高不下的第二大因素,每年造成至少600万人死亡,预测 截至2030年,脑卒中的致死率在全世界将超过12%。在我国,脑卒 中也是造成永久性伤残的主要原因,导致了健康产业的经济缺失。脑 卒中主要包括缺血性脑卒中和出血性脑卒中,而缺血性脑卒中约占其 中发病的75%。当前,无论使用静脉药物溶栓还是动脉机械取栓等方 法,即使在短时间内恢复脑血流供应,仍然无法避免脑缺血/再灌注 损伤的发生。因此,寻找与研发确切有效的新的治疗药物迫在眉睫。 而目前,并未有相关资料显示可将mir-421应用于制备治疗缺血性脑 卒中药物中,更未见报道有验证mir-421是否真正有利于缺血性脑卒 中等脑血管疾病的治疗。
技术实现要素:
4.针对背景技术中存在的缺陷和不足,本发明提供了mir-421在制 备治疗缺血性脑卒中药物中的应用,能够有利于缺血性脑卒中的治 疗。
5.为实现上述目的,本发明采用以下技术方案予以实现:
6.mir-421在制备治疗缺血性脑卒中药物中的应用,所述mir-421 的序列如下:
[0007]5’‑
aucaacagacauuaauugggcgc-3’(mirbaseid: mimat0003339)。
[0008]
进一步所采取的措施是:所述mir-421应用于制备治疗缺血性脑 卒中的口服类药物中。
[0009]
进一步所采取的措施是:所述mir-421应用于制备治疗缺血性脑 卒中的注射类药物中。
[0010]
进一步所采取的措施是:应用所述mir-421得到的药物施用于治 疗对象出现缺血
性脑卒中症状之后。
[0011]
本发明经过研究发现,在脑缺血前24小时小鼠侧脑室注射给予 mir-421,可显著降低大脑中动脉闭塞(middle cerebral arteryocclusion,mcao)模型小鼠的脑梗死体积,并改善其神经功能障碍, 通过mir-421能够显著减轻脑缺血再灌注急性期小鼠患侧皮层神经 元的损伤,并促进小胶质细胞向m2型极化。表明mir-421对局灶性 脑缺血再灌注小鼠急性期的神经损伤具有保护作用,可以应用于制备 治疗缺血性脑卒中药物,有利于避免脑缺血/再灌注损伤的发生,具 有很好应用前景。
[0012]
本发明人团队经过进一步研究显示,mir-421可以降低脑内tnf
‑ꢀ
α和il6等炎症因子的表达,从而发挥对缺血性脑卒中的治疗作用, 因此,mir-421用于治疗的最佳使用时间是在治疗对象出现缺血性脑 卒中症状之后施用。
[0013]
mir-421可以应用于制备治疗缺血性脑卒中的口服类药物、注射 类药物,以及其他治疗缺血性脑卒中的措施中。
[0014]
通过上述技术方案,本发明与现有技术相比,所具有的有益效果 如下:
[0015]
1、本发明通过研究发现了mir-421在缺血性脑卒中治疗中的作 用,mir-421可对局灶性脑缺血再灌注小鼠急性期损伤具有治疗作用, 并初步明确了mir-421通过抑制脑内的神经炎症而发挥对急性缺血 性脑卒中的治疗作用。
[0016]
2、本发明为寻找与研发治疗缺血性脑卒中等脑血管疾病确切有 效的新治疗药物提供了方向和技术基础,有利于缺血性脑卒中等脑血 管疾病患者早日脱离病痛折磨,抢救更多的生命。
附图说明
[0017]
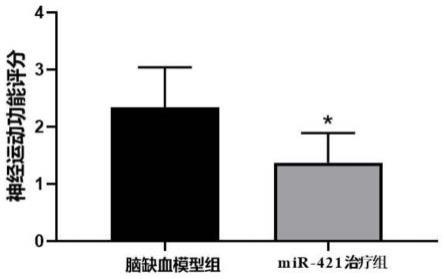
图1为mir-421减轻小鼠局灶性脑缺血再灌注神经损伤所致神 经运动功能障碍的柱状分析图;
[0018]
图2为mir-421减轻小鼠局灶性脑缺血再灌注所致脑梗死体积 的ttc染色结果及其柱状分析图;
[0019]
图3为mir-421减轻小鼠局灶性脑缺血再灌注所致神经元损伤 免疫组化检测及其柱状分析图;
[0020]
图4为mir-421促进急性脑缺血再灌注后小胶质细胞向m2型极 化的荧光显示图;
[0021]
图5为mir-421抑制急性脑缺血再灌注损伤中促炎因子表达水平 的检测结果及其柱状分析图。
具体实施方式
[0022]
为了更清楚的了解本发明所采用的技术方案,下面对本发明的优 选实施例进行说明,应当理解,此处所描述的实施例仅用于说明和解 释本发明,并不用于限定本发明。
[0023]
mir-421在制备治疗缺血性脑卒中药物中的应用,所述mir-421 的序列如下:
[0024]5’‑
aucaacagacauuaauugggcgc-3’(mirbaseid: mimat0003339)。
[0025]
所述mir-421应用于制备治疗缺血性脑卒中的口服类药物中。
[0026]
所述mir-421应用于制备治疗缺血性脑卒中的注射类药物中。
[0027]
应用所述mir-421得到的药物施用于治疗对象出现缺血性脑卒 中症状之后。
[0028]
本发明还进行了以下试验进行验证。
[0029]
1、局灶性脑缺血再灌注动物模型的制备。
[0030]
参照改良后的longa线栓法改良线栓法制作小鼠大脑中动脉栓 塞(middle cerebral artery occlusion,mcao)模型制备。7-8周龄, 体重为18-21g的c57bl/6雄性小鼠,在清洁级环境饲养。首先将小 鼠颈部的皮肤用剃毛器将毛发清理干净,使其暴露出完整的皮肤组 织,之后用手术剪小心剪开皮肤,颈部正中行纵切口1.5cm,同时开 启手术显微镜,在显微镜下用较粗的镊子小心撑开视野中小鼠的颈部 周围的组织,避免造成机械损伤,此时分离气管下肌肉,暴露颈总动 脉(cca),换用显微镊对黏连于颈总动脉的肌肉和筋膜进一步剥离, 向上可见cca的分叉口,继续向前可见颈内动脉(ica)和颈外动脉 (eca)。此时将近心端cca,靠近分叉口的eca进行结扎,由于可 以人为规避线栓误入翼腭动脉(ppa),所以对ppa不进行结扎。之 后在靠近cca结扎处用显微剪在血管上剪开一个小口,用将头端包被 有硅胶的尼龙线栓(0.18mm,广州佳灵生物技术有限公司)经小口插 入cca中,为避免插入线栓时动脉大量出血,在线栓插入前就将血管 中端结扎一个活结,然后松开活结,轻轻推动,使线栓沿着颈内动脉 的走向前进,经过eca与ica的交叉口后,继续随ica血管的走向插 入直至小鼠的大脑中动脉(mca),感觉到有轻微阻力无法深入后停 止,从分叉口计算,线栓进入mca的距离大约有12~14mm,基本堵塞 了由小鼠的大脑中动脉提供大脑的血流。缺血60min后,缓慢抽出线 栓,再结扎颈外动脉,继而松开颈总动脉处丝线恢复右侧颈动脉血流, 缝合切口,再以碘伏消毒后置于笼中,室温25℃饲养,结束mcao完 成局灶性脑缺血再灌注模型。全过程采用激光多普勒血流仪(laserdoppler flowmetry,moorflpi full-field laser perfusion imager, moor instruments let,uk)监测局部脑血流以确保模型制备成功。 从手术开始至动物苏醒前,使用体温仪确保小鼠的体温维持在 36.5℃
±
1℃。假手术组动物麻醉后,仅暴露颈内外动脉分叉,不插 入线栓。
[0031]
2、实验分组及给药。
[0032]
c57bl/6雄性小鼠称重后随机分组:假手术组(sham-vehicle), 脑缺血模型组,mir-421治疗组。
[0033]
给药方法:根据小鼠体重,腹腔注射10%水合氯醛(4.0ml/kg) 麻醉,俯卧位固定,使颅骨保持水平正中。剪毛,碘伏消毒,暴露 颅顶,蘸取适量h2o2擦拭颅顶,暴露前囟点。据小鼠脑图谱查得左 侧脑室坐标为(坐标:x=0.38mm,y=-1mm,z=2.5mm),根据坐标位 置钻开硬脑膜,垂直进针到达预定坐标位置,缓慢注射给药(约 3ul/min),注射完全后留针5min。缓慢回升取出微量进样针后,骨 蜡封闭钻孔。将小鼠从立体定位仪上取下,缝合伤口,碘伏消毒后放 回饲养笼内。
[0034]
3、神经运动功能评分。
[0035]
采用longa五分法对缺血1h再灌注24h的小鼠神经功能进行 评分。评分标准为:
[0036]
0分:小鼠无神经功能缺失,活动无障碍;
[0037]
1分:小鼠对侧前肢、前爪不能充分伸展;
[0038]
2分:小鼠行走时不自主的向手术对侧转圈;
[0039]
3分:小鼠行走时不自主的向手术对侧倾倒;
[0040]
4分:小鼠行走出现严重障碍,意识水平下降或者处于昏迷状态。
[0041]
其中,神经行为学评分>1分为成功模型。
[0042]
动物实验中,手术过程出血过多;术后有呼吸异常、提前死亡及 处死时发现蛛网膜下腔出血的均弃之不用,剔除动物均在后期实验 中随机补充。实验结果如图1所示,给予mir-421治疗组的神经运 动评分值明显低于模型组,表明mir-421可显著改善脑缺血再灌注 后小鼠的神经运动功能障碍。
[0043]
4、脑梗死体积的测定。
[0044]
小鼠于缺血再灌注后24h断头取脑,迅速取出脑组织,去掉嗅球、 小脑和低位脑干,-20℃冰冻20min。然后用脑模具将小鼠脑组织从 距额极3mm处开始,从前向后作冠状位连续切片,等距离切成5片。 置于1%ttc中,37℃恒温下温育10min,不时翻动大脑切片,以确 保染色均匀。ttc染色后,正常组织呈红色,梗死组织呈白色。用image j软件扫描小鼠脑片并计算梗死体积占对侧大脑体积百分率。
[0045]
如附图2所示,与模型组相比,mir-421治疗组脑梗死体积显著 减少。
[0046]
5、石蜡包埋、切片。
[0047]
小鼠经10%水合氯醛溶液腹腔注射麻醉,于左心室插管,快速 推注37℃生理盐水,再缓慢、匀速灌注4%多聚甲醛 (paraformaldehyde,pfa),断头取脑、将小鼠脑组织置于4%多聚 甲醛进行后固定,4℃,24h~48h。取出固定好的脑组织进行修裁、 包埋,经乙醇梯度脱水并用二甲苯透明后浸蜡包埋,蜡块冷却后应用 石蜡切片机(rm2135型,德国leica公司)进行冠状位切片,收集前 脑脑片,脑片厚5μm,隔十取一用于实验。
[0048]
6、免疫组织化学染色。
[0049]
将切片于65℃烘箱中烘片,二甲苯、酒精梯度脱蜡水化,pbs缓 冲液每5min洗3次,滴加3%过氧化氢(h2o2)避光反应20min以灭 活内源性过氧化物酶,pbs缓冲液每5min洗3次。将切片浸入已微 波加热至沸腾的0.01m(ph 6.0)枸橼酸盐缓冲液中,微波恒温修复15min,自然冷却至室温。10%山羊血清封闭非特异性抗原后滴加一 抗(抗体浓度见表1),4℃孵育过夜。次日用0.01m pbs洗尽一抗, 洗3次,每次5min,随后滴加二抗37℃烘箱孵育1h(抗体浓度见表 2),0.01m pbs洗尽二抗,洗3次,每次5min。滴加二氨基联苯 (diaminobenzidin,dab)(凯基,中国)避光显色,脱水、封片后镜 下观察,摄片。
[0050]
表1.免疫组织化学染色所用一抗
[0051]
抗体来源浓度neunabcam1:500
[0052]
表2.免疫组织化学染色所用二抗
[0053]
抗体来源浓度羊抗兔proteintech1:5000
[0054]
如附图3所示,脑缺血再灌注24h后,与假手术组相比,模型组 小鼠大脑皮层中神经元数量明显减少且细胞核固缩;给予mir-421治 疗后,小鼠皮层的神经元数量较模型组显著增多,同时神经元细胞形 态也有所恢复。
[0055]
7、免疫组织荧光染色。
[0056]
将切片于65℃烘箱中烘片,二甲苯、酒精梯度脱蜡水化,滴加pbs配置的3%过氧化氢避光反应15min,pbs缓冲液每5min洗3次。 将切片浸入已微波加热至沸腾的0.01m(ph 6.0)枸橼酸盐缓冲液中, 微波恒温修复15min,自然冷却至室温。加入封闭液(含5%山羊血清 和0.1%的triton x-100)室温封闭1h。滴加一抗(抗体浓度见表3), 4℃孵育过夜。次日
取出后复温1h,0.01m pbs洗尽一抗,洗3次, 每次5min,滴加相应荧光二抗(抗体浓度见表4),37℃孵育1h,0.01m pbs洗3次,每次5min。滴加5ug/ml的hoechest溶液避光反应15min, 0.01m pbs清洗。封片后荧光显微镜下观察相应蛋白表达情况,摄片。
[0057]
表3.免疫组织荧光染色一抗
[0058]
抗体来源浓度iba1proteintech1:100cd68abcam1:100
[0059]
表4.免疫组织荧光染色二抗
[0060]
抗体来源浓度羊抗兔life1:1000驴抗鼠life1:1000
[0061]
正常生理情况下,小胶质细胞呈现为高度分支样静息状态,其胞 体小,呈长形或三角形,具有细长的分枝。病理情况下如脑内发生炎 症、感染、创伤或发生其他神经系统疾病时被迅速激活,形态学上 由多分枝的高度静息状态转变为体积较大、突起消失、胞体变圆的阿 米巴样激活状态。在脑卒中病理生理条件下,小胶质细胞发挥着双相 作用:一方面,小胶质细胞向m1型极化,可发挥促炎、氧化应激、 破坏血-脑屏障、抑制神经再生等神经毒性作用;另一方面,小胶质 细胞向m2型极化从而发挥抗炎、营养神经、促进神经修复、促进血 管再生等神经保护作用。
[0062]
如图4所示,脑缺血再灌注24h后,治疗组较模型组其小胶质细 胞标志物iba1表达有明显减少,同时m1型标记物cd68的表达显著 降低,这表明给予mir-421治疗可以抑制脑内小胶质细胞m1型激活。
[0063]
8、蛋白质免疫印迹(western blotting)。
[0064]
小鼠采用10%水合氯醛溶液腹腔注射麻醉,断头处死,冰上快 速取脑,将大脑半球分为损伤侧与非损伤侧。取损伤侧梗死周围区 新鲜脑组织,将脑组织和裂解液按照质量体积比1:10进行充分匀 浆,将匀浆液放入冰盒中,置于摇床上充分裂解30min后4℃离心 12000rpm 15min,吸取上清液,按照体积比加入6
×
蛋白上样缓冲液, 100℃变性15min,分装后-80℃保存。将-80℃中的蛋白样品拿出溶 解,离心机离心,用微量进样器加入到泳道中,进行sds-聚丙烯酰 胺恒压凝胶电泳分离,利用电转系统(miniprotein-iii wet transferunit,bio-rad,hercules,california,usa)转至pvdf膜(millipore, usa)。10%脱脂奶粉-tbst室温封闭1~2h。加入一抗(抗体浓度见 表5)4℃摇床孵育过夜。次日弃掉一抗加入tbst洗膜10min
×
4次, 加入辣根过氧化物酶标记的二抗(抗体浓度见表6),室温,摇床孵育 1h后经tbst漂洗(10min
×
4)再加入ecl(pierce,thermo scientific,usa)发光底物显色。tanon 5200全自动化学发光成像 分析系统显影分析。将目的蛋白灰度值与内参β-actin灰度值之比 进行半定量分析。
[0065]
表5.蛋白质免疫印迹所用一抗
[0066]
抗体来源浓度gapdhproteintech1:1000tnf-αproteintech1:1000
[0067]
表6.蛋白质免疫印迹所用二抗
[0068]
抗体来源浓度羊抗兔proteintech1:5000
[0069]
如图5所示,给予mir-421治疗能抑制脑缺血再灌注24h后脑内 致炎因子tnf-α表达,表明mir-421治疗可抑制缺血性脑卒中后脑 内的炎症反应。
[0070]
综合上述可知,本发明mir-421有利于避免脑缺血/再灌注损伤 的发生,对局灶性脑缺血再灌注小鼠急性期的神经损伤具有保护作 用,可以在制备治疗缺血性脑卒中药物中的进行推广应用,具有很好 应用前景,也为寻找与研发治疗缺血性脑卒中等脑血管疾病确切有效 的新治疗药物提供了方向和技术基础,有利于缺血性脑卒中等脑血管 疾病患者早日脱离病痛折磨。
[0071]
以上所述仅用以说明本发明的技术方案而非限制,本领域普通人 员对本发明的技术方案所做的均等修饰与变化,只要不脱离本发明创 造整体构思的情况下,均仍属于本发明创造涵盖的范围之中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。