1.本发明属于医药技术领域,尤其涉及巴多索隆在制备抗菌药物中的应用。
背景技术:
2.一直以来,病原微生物都是危害人类健康的重要因素。病原菌感染是致病菌或条件致病菌侵入血循环中生长繁殖,产生毒素和其他代谢产物所引起的急性全身性感染,尤其是老人、儿童、有慢性病或免疫功能低下者、治疗不及时及有并发症者,可发展为败血症或者脓毒血症而死亡。虽然抗生素的出现暂时解决了人类治疗细菌感染的一大难题,但是由于抗生素的不正确使用导致多重耐药菌株急剧增加,大量抗生素也失去了抗菌光环,特别是多重耐药菌和超级耐药菌严重增加发病率、死亡率、住院时间和医疗保健成本。以耐甲氧西林的金黄色葡萄球菌(mrsa)为主的革兰阳性菌的耐药现象已成为全球医疗保健中急需解决的重要问题之一。由于细菌抗生素耐药性产生的速度远远超过新药物研发的速度。因而,寻找抑制耐药菌的药物成为领域内研究人员亟待解决的问题。
技术实现要素:
3.为了克服现有技术的不足,本发明的目的之一在于提供巴多索隆在制备抗菌药物中的应用,巴多索隆能够对包括耐药革兰氏阳性菌在内的革兰氏阳性菌具有抑制作用,且能够抑制革兰氏阳性菌生物膜形成;本发明的目的之二在于提供一种抗菌药物,该抗菌药物在疗效剂量不具有组织毒性,安全性好。
4.巴多索隆在制备抗菌药物中的应用;具体的,所述抗菌药为抗革兰氏阳性菌药物;所述革兰氏阳性菌包括链球菌、芽孢杆菌、葡萄球菌。
5.优选地,所述革兰氏阳性菌为猪链球菌、肺炎链球菌、李斯特菌、枯草芽孢杆菌、溶血葡萄球菌和金黄色葡萄球菌中的至少一种。
6.优选地,所述的革兰氏阳性菌为耐药菌。
7.优选地,所述的耐药菌耐受的药物为:氨苄青霉素、克林霉素、庆大霉素、环丙沙星、甲氧西林、苯唑西林、红霉素、左旋氧氟沙星、莫西沙星、复方新诺明、利福平、妥布霉素、阿米卡星、四环素、阿莫西林、克拉维酸中的至少一种。
8.优选地,所述抗菌药为抗革兰氏阴性菌药物。
9.优选地,所述抗菌药还包含有多粘菌素b九肽。
10.优选地,其特征在于:所述的革兰氏阴性菌为大肠杆菌或铜绿假单胞菌。
11.本发明还提供一种抗菌药物,该药物包含有巴多索隆。
12.优选地,所述的抗菌药还包含有氨苄西林、庆大霉素、环丙沙星或多粘菌素b九肽中的至少一种。
13.本发明提供了巴多索隆在制备抗菌药物中的应用。其有益效果在于:巴多索隆具有杀菌作用,对革兰氏阳性菌的最小抑菌浓度为0.5~5μg/ml,抑菌效果强。并且,在耐药性发展实验中,经过20代的连续抗生素压力培养,金黄色葡萄球菌newman和mrsa(atcc43300)
未对巴多索隆产生耐药,因此该药物的使用能够避免耐药菌株的产生;巴多索隆在体内对金黄色葡萄球菌感染的小鼠肺炎模型具有疗效;巴多索隆在体内对金黄色葡萄球菌感染的小鼠肺炎模型具有疗效所使用的药物剂量未产生小鼠肝、脾、肾组织毒性,安全性好。
14.细菌生物膜指细菌粘附于接触表面,分泌多糖基质、纤维蛋白、脂质蛋白等,将其自身包绕其中而形成的大量细菌聚集膜样物。许多抗生素缺乏根除已建立的生物膜的能力。而巴多索隆在0.5
×
mic及以上就能够抑制革兰氏阳性菌生物膜形成。
15.老药新用作为开发新的治疗细菌感染类药物方法变得越来越重要,这些药物已知的安全概况、药代动力学特性、配方、剂量和制造过程为加快药物的重新利用提供了便捷。老药新用大大降低了药物的研发成本和研发周期。
16.口服巴多索隆是抗氧化和炎症调节剂,其通过激活keap1-nrf2通路,抑制nf-κb炎症途径发挥作用。已经被批准的用于治疗由亚伯氏综合征(又称遗传性肾炎)造成的慢性肾病(ckd)。到目前为止,暂未发现有关巴多索隆在抑制革兰氏阳性细菌方面的研究报道。本发明首次提供临床药物巴多索隆在制备抗菌药物中的应用,巴多索隆能够对革兰氏阳性菌进行比较彻底的抑制,并且对多种耐药菌株具有较为一致的最小抑菌浓度,这将扩大其在临床的应用范围,使其具有作为抗菌感染作用的药物开发潜力。
17.本发明实施方式中,使用的药物、试剂和耗材的信息如下:
18.药物小分子库购于陶素公司(topscience);dmso购于广州斯佳生物科技公司;胰蛋白胨干粉(货号lp0042)、酵母提取物(货号lp0021)、todd-hewittbroth(货号cm0189)均购于sigma;胰蛋白胨大豆肉汤干粉(货号024051)购于广州环凯微生物;氯化钠购于广州化工;多粘菌素九肽购于普西唐(货号p10587),7cm细菌培养皿购于洁特生物。
19.培养基的配制如下:
20.(1)tsb液体培养基:取胰蛋白胨大豆肉汤干粉(货号024051)30g加入1l蒸馏水中混匀,121℃灭菌20min,即得。
21.(2)lb液体培养基:取胰蛋白胨干粉10g、酵母提取物5g和氯化钠10g(固体培养基需再加入15g琼脂粉)加入1l蒸馏水中混匀,灭菌20min,即得。
22.(3)thye液体培养基:取酵母提取物干粉5g和todd-hewittbroth干粉36.4g加入1000ml水中混匀,加入121℃灭菌15min,即得。仪器采用生物安全柜、酶标仪(biotek)、紫外分光光度计和恒温培养箱(thermo)。
附图说明
23.图1为不同药物对金黄色葡萄球菌的抑制效果图;
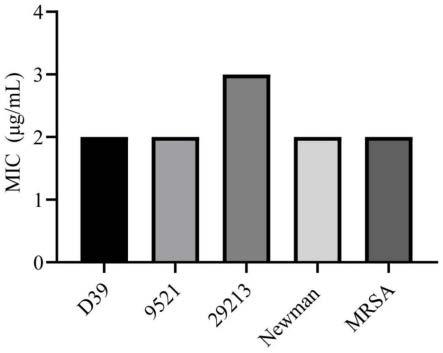
24.图2为巴多索隆对本实施例受试菌株的最小抑菌浓度(mic)图;
25.图3为巴多索隆对金黄色葡萄球菌耐药株(12h)的最小抑菌浓度(mic)图;
26.图4为巴多索隆对多重耐药金黄色葡萄球菌的最小抑菌浓度(mic)图;
27.图5为newman和金黄色葡萄球菌43300的生长曲线图;
28.图6为金黄色葡萄球菌newman和43300对巴多索隆的耐受性
29.图7为巴多索隆与抗生素联合用药的效果图;
30.图8为巴多索隆对金黄色葡萄球菌(newman)敏感株的时间杀菌曲线图;
31.图9为巴多索隆对金黄色葡萄球菌的生物膜的抑制效果图;
32.图10为巴多索隆对肺炎模型的治疗效果;
33.图11为巴多索隆与多粘菌素b九肽联合用药对阴性菌的效果图。
34.为了清楚地展示本发明具体的实施方式以及在实验中采用的某些检测技术,下面将对实施方案及采用的技术进行描述,主要通过附图的形式进行介绍。
35.具体实施的方式
36.本发明具体的实施方式通过实施例来辅助解释,除检测所用的技术对本发明不做任何形式的限制外,描述的实施例中部分方案属发明的一部分实施例,在本领域的普通技术操作人员在没有创造性的成果获得的实施例,均属本发明的保护范围。
37.实施例1抗菌药物的筛选
38.本实施例筛选抗菌药物。本实施例选用常见致病菌金黄色葡萄球菌为模式菌株进行筛选。
39.实验步骤
40.金黄色葡萄球菌按1%的接种量接种到tsb液体培养基过夜活化,次日再按1%的量转接到新鲜培养基培养至od
600
到0.8左右。培养至对数中期后取10μl菌液加入48孔板,同时将50种天然药物分别仪30μm的浓度加到48孔板,每个浓度三个生物学重复。随后用tsb培养基补至1000μl进行培养,将培养板置于200rpm,37℃恒温培养箱中进行培养12h。本实施例采用酶标仪在波长为600nm的条件下对菌液浓度进行测定,吸光值od
600
《0.1的孔。
41.如图1所示,图中如图例所示,颜色越深代表od
600
的吸光度越高,即表明抑制效果越差;本发明通过对50种小分子药物库进行抗s.aureus筛选,筛选结果显示:仅有巴多索隆(图中箭头所示),香豆素等小分子对金黄色葡萄球菌有抑制效果。通过进一步杀菌筛选及文献调研后,选择了巴多索隆进行深入研究。
42.实施例2测定巴多索隆的抗菌作用
43.本实施例对巴多索隆的抗菌作用进行测定。
44.本实施例受试菌株信息如下:
45.肺炎链球菌(s.pneumoniae d39)购自中国典型培养物保藏中心;猪链球菌(bm407)、金黄色葡萄球菌(newman)、李斯特菌购自中国微生物菌种保藏管理委员会普通微生物中心;溶血葡萄球菌(179595)等临床耐药株来自南方医科大学检验科,属于多耐药菌株,菌株耐药信息见表1;枯草芽胞杆菌(b.subtilis 2508)来自广东省微生物菌种保藏中心;革兰氏阴性菌中的大肠杆菌(bw25113)、铜绿假单胞菌(p.aerμginosaatcc9027)来自美国模式培养物集存库。
46.本实施例中,最低抑菌浓度(mic)测定各个菌株三个单克隆。
47.1.实验步骤
48.1.1巴多索隆对受试菌株最低抑菌浓度(mic)的测定。
49.肺炎链球菌和化脓链球菌,按5%的接种量接种到0.5%thye液体培养基过夜活化,次日再按5%的量转接一次到新鲜培养基培养,当od
600
达0.6左右取出,取5μl菌液加入48孔板,同时将10mg/ml巴多索隆母液梯度稀释,设置工作浓度范围在0~10μg/ml,每个浓度三个生物学重复,随后用0.5%thye培养基补至1000μl每孔进行培养,将培养板置于5%co2,37℃恒温培养箱中进行培养12h。
50.枯草芽胞杆菌、大肠杆菌、铜绿假单胞菌分别按1%的接种量接种到新鲜的lb液体
培养基过夜活化,次日再按1%的量转接到新鲜培养基培养至od
600
到0.6左右,取10μl菌液加入48孔板,同时将10mg/ml巴多索隆母液梯度稀释,设置工作浓度范围在1~10μg/ml,每个浓度三个生物学重复。随后用lb液体培养基补至1000μl进行培养,整个培养过程放置200rpm,37℃恒温培养箱进行培养12h。
51.金黄色葡萄球菌、猪链球菌、李斯特菌则按1%的接种量接种到tsb液体培养基过夜活化,次日再按1%的量转接到新鲜培养基培养至od
600
到0.8左右。培养至对数中期后取10μl菌液加入48孔板,同时将10mg/ml巴多索隆母液梯度稀释,设置工作浓度范围在0~10μg/ml,每个浓度三个生物学重复。随后用tsb培养基补至1000μl进行培养,将培养板置于200rpm,37℃恒温培养箱中进行培养12h。
52.本实施例采用酶标仪在波长为600nm的条件下对菌液浓度进行测定,吸光值od
600
《0.1的孔,即肉眼未见细菌生长的最低药物浓度则记为mic,进而得到巴多索隆对上述革兰氏阳性细菌的mic,并用dmso作为阴性对照。数据导出使用graphpad分析。
53.2.实验结果
54.图2为本发明实施例2中巴多索隆对猪链球菌bm407、肺炎链球菌d39、李斯特菌、溶血葡萄球菌和金黄色葡萄球菌newman的最低抑制浓度(mic)为0~5μg/ml,图2为本发明实施例2中巴多索隆对上述革兰氏阳性菌、结果表明,巴多索隆对上述革兰氏阳性细菌感染均具有抑制作用,可以抑制多种革兰氏阳性细菌感染;但巴多索隆对革兰氏阴性菌抑制作用较弱。
55.实施例3测定巴多索隆对金黄色葡萄球菌单耐药菌株的mic
56.本实施例受试菌株信息如下:
57.金黄色葡萄球菌(29213和newman)的敏感株来自中国微生物菌种保藏管理委员会普通微生物中心;金黄色葡萄球菌单氨苄青霉素菌株(newman),金黄色葡萄球菌单耐克林霉素菌株(29213)、金黄色葡萄球菌单耐庆大霉素菌株(29213)、金黄色葡萄球菌单耐环丙沙星菌株(29213)由金黄色葡萄球菌通过亚抑制浓度压力下培养敏感株所得。
58.其中,金黄色葡萄球菌单氨苄青霉素菌株(newman)、金黄色葡萄球菌单耐克林霉素菌株(29213)、金黄色葡萄球菌单耐庆大霉素菌株(29213)、金黄色葡萄球菌单耐环丙沙星菌株(29213)的培养方式为:分别测出氨苄青霉素、克林霉素、庆大霉素、环丙沙星对金黄色葡萄球菌原代敏感株的最低抑制浓度(mic);以所测定的1/2mic的药量加入到含有1%原代细菌的tsb培养基中,37℃,200rpm培养12h后测定新的mic,再以所测得的1/2mic细菌,重复上述步骤直到三种抗生素对金黄色葡萄球菌的耐药倍数提高40倍以上。
59.1.实验步骤
60.挑取金黄色葡萄球菌单氨苄青霉素菌株(newman,r-amp)、金黄色葡萄球菌株(newman)、单耐克林霉素的金黄色葡萄球菌株(29213,r-cli)、单耐庆大霉素的金黄色葡萄球菌菌株(29213,r-gent)和单耐环丙沙星的金黄色葡萄球菌株(29213,r-cip)的三个单克隆保存液,按1%的接种量接种到tsb液体培养基过夜活化。次日再按1%的量转接一次到新鲜tsb培养基培养。当od
600
到0.8左右,取10μl菌液加入细胞板,同时将10mg/ml巴多索隆母液稀释后以1mg/ml为浓度梯度,设置工作浓度范围在0~10μg/ml。随后用tsb培养基补至1000μl,在37℃,200rpm恒温培养箱进行培养12h,再利用酶标仪在波长为600nm的条件下对培养后的菌液浓度进行测定,吸光值od
600
《0.1的孔,即肉眼未见细菌生长的最低药物浓度
则记为mic,进而得知巴多索隆对耐药金黄色葡萄球菌的mic,并用dmso作为阴性对照。
61.2.实验结果
62.结果请参阅图3,为本发明实施例3中巴多索隆对金黄色葡萄球菌耐药株的mic值。结果表明巴多索隆可以以0.5-3μg/ml的浓度抑制金黄色葡萄球菌单耐药株的生长,同时结果显示:同其他单耐药菌相比,巴多索隆对金黄色葡萄球菌的敏感株的效果最佳,这可能是金黄色葡萄球菌在耐药过程中也降低了对其他药物的敏感性。
63.实施例4测定巴多索隆对临床分离的多重耐药金黄色葡萄球菌的mic
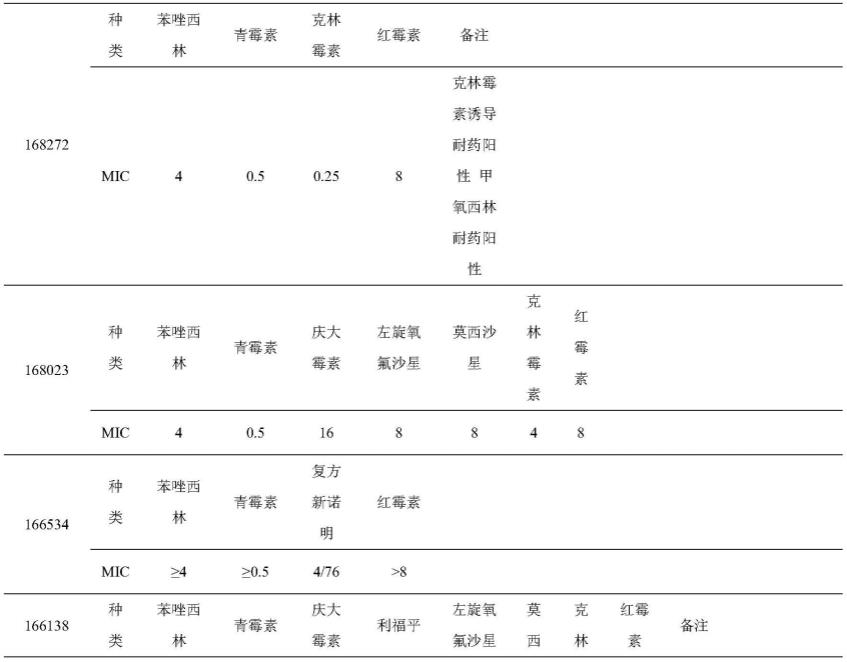
64.本实施例的受试菌株为临床分离的多重耐药金黄色葡萄球菌(168272,168023,166534,166138,168293,900624,168205,179634,179148,179475,179459,178524,178360),来自南方医科大学检验科。上述编号为相应菌株在南方医科大学检验科的系统编号,相关菌株的耐药情况如表1所示。
65.表1相关菌株的耐药情况(mic单位:μg/ml)
66.[0067][0068]
1.实验步骤
[0069]
挑取临床分离的多重耐药金黄色葡萄球菌、溶血葡萄球菌单克隆,保种-80℃备
用。活化临床菌液,按1%的接种量接种到tsb液体培养基过夜活化。次日再按1%的量转接一次到新鲜tsb培养基培养。当od
600
到0.8左右,取10μl菌液加入细胞板,同时将10mg/ml巴多索隆母液梯度稀释,设置工作浓度范围在0~10μg/ml。随后用tsb培养基补至1ml进行培养,整个培养过程置于200rpm,37℃摇床进行培养12h,再利用酶标仪在波长为600nm的条件下对培养后的菌液浓度进行测定,吸光值od
600
《0.1的孔,即肉眼未见细菌生长的最低药物浓度则记为mic,进而得到巴多索隆对耐多种抗生素的金黄色葡萄球菌的mic,并用dmso作为阴性对照。
[0070]
2.实验结果
[0071]
结果如图4所示,为本发明实施例4中巴多索隆对多重耐药金黄色葡萄球菌的mic图,图4为本发明实施例4中巴多索隆对多重耐药金黄色葡萄球菌的mic值(测定时间为12h)。结果表明,巴多索隆以0.5-3μg/ml对革兰氏阳性细菌的临床耐药菌具有抑制作用,可以抑制革兰氏阳性细菌的临床耐药菌的生长。
[0072]
实施例5巴多索隆对金黄色葡萄球菌(newman和43300)的生长影响
[0073]
金黄色葡萄球菌(newman和43300)按1%的接种量接种到tsb液体培养基过夜活化,次日再按1%的量转接一次到新鲜培养基培养。培养至对数中期后取10μl菌液加入细胞板,同时将10mg/ml巴多索隆母液稀释成金黄色葡萄球菌(newman和43300)的1
×
mic、3/4
×
mic、1/2
×
mic、1/4
×
mic、0
×
mic,每个浓度三个生物学重复,以1%dmso作为生长影响的阴性对照。随后用tsb培养基补至1000μl进行培养,将培养板置于酶标仪epoch2tc(biotek)中检测细菌生长情况。程序使用动力学检测模型,37℃,200rpm,每1h检测一次,培养20h。数据导出使用graphpad分析。
[0074]
请参阅图5,为本发明实施例5中不同浓度的巴多索隆对金黄色葡萄球菌(newman和43300)的生长影响图。结果表明,巴多索隆在金黄色葡萄球菌(newman和43300)的mic下,能够完全抑制金黄色葡萄球菌(newman和43300)的生长。
[0075]
实施例6测试巴多索隆对细菌的耐药性发展
[0076]
1.实验步骤
[0077]
为了通过连续传代来检测巴多索隆对细菌的耐药性发展,将指数生长的金黄色葡萄球菌newman和mrsa(atcc43300)按1%稀释到含有不同药物浓度的巴多索隆的tsb培养基(1000μl每孔)。细菌在37℃,200rpm下培养12h后获得新的mic,在1/2mic的孔中取10μl转接到新鲜的990μl tsb培养基中,37℃,200rpm下培养到指数生长期后再按1%稀释到新的巴多索隆浓度梯度进行下一代的mic测定。重复上述步骤,每隔12h传代一次。这一系列传代重复20代。并以amp压力下培养金黄色葡萄球菌newman作为阳性对照,二甲基亚砜(1%dmso)作为生长对照。通过将相应代次菌的mic除以原代的初始mic来计算mic移位。
[0078]
2.实验结果
[0079]
结果请参阅图6,为本发明实施例中巴多索隆和氨苄青霉素对细菌的耐药性发展结果图。结果表明,经过20代的压力下培养,金黄色葡萄球菌newman和mrsa(atcc43300)对巴多索隆产生耐药性仅为第一代的5倍,而金黄色葡萄球菌经过amp(氨苄青霉素)压力下培养20代newman,其对amp产生了较高的耐药性,与原代相比mic提高120倍。由此表明,金黄色葡萄球菌对巴多索隆不易产生抗性,即,巴多索隆作为抗菌药具有良好的前景。
[0080]
实施例7测定巴多索隆与抗生素联合用药的效果
[0081]
本实施例选择了4种不同的抗生素分别与巴多索隆联合用药,分别是β-内酰胺类抗生素氨苄西林(ampicillin,amp)、氨基糖苷类抗生素庆大霉素(gentamicin,gent)、林可霉素类抗生素克林霉素(clindamycin,cli)、喹诺酮类抗生素环丙沙星(ciprofloxacin,cip)。首先分别检测了4种抗生素对金黄色葡萄球菌(newman)的mic,测定mic的方法方式同实施例1中mic的测定方式。再利用4种不同类型的抗生素分别与巴多索隆联合用药,即在48孔板中使用棋盘试验法测定不同浓度配比下抗生素和巴多索隆的联用结果。在孔板中加入抗生素后用tsb培养基补充到990μl,而后加入10μl转接到od
600
=0.8的菌液,200rpm,37℃恒温培养箱进行培养12h,再利用酶标仪在波长为600nm的条件下对培养后的菌液浓度进行测定,通过计算部分抑菌浓度指数(fractional inhibitory concentration,fic)判断相互作用。
[0082]
其中,fic=联合用药时甲药mic/单独应用甲药mic 联合用药时乙药mic/单独应用乙药时mic,fic指数为fic≤0.5、0.5《fic≤1、1《fic≤2、fic》2时分别表示协同、相加、无关、拮抗作用。
[0083]
结果请参阅图7,为本发明实施例7中巴多索隆分别与氨苄西林、庆大霉素、克林霉素、环丙沙星联用的结果图。结果表明,巴多索隆与氨苄西林和庆大霉素联用均具有协同作用,为临床治疗细菌感染、多重耐药感染及重症感染提供了新思路。
[0084]
实施例8测定巴多索隆对金黄色葡萄球菌(newman)敏感株的时间杀菌曲线
[0085]
1.实验步骤
[0086]
金黄色葡萄球菌(newman)敏感株在tsb培养基中过夜培养后,1%转接到新鲜tsb培养基中,培养到od
600
=0.8,随后,将细胞在tsb培养基中1:100稀释至2
×
106cfu/ml,分别加入amp(3
×
mic)、巴多索隆(0.25
×
mic、0.5
×
mic、1
×
mic、2
×
mic、3
×
mic)后在37℃、200rpm孵育,按指定时间点进行连续稀释,涂布在琼脂平板上,37℃培养16小时测定活细胞数(cfu/ml)。
[0087]
2.实验结果
[0088]
结果请参阅图8,为本发明实施例8中巴多索隆对金黄色葡萄球菌(newman)敏感株的时间杀菌曲线图。amp(3
×
mic)作为阳性对照。虚线代表99.99%的杀菌效果。结果表明,巴多索隆可有效杀死金黄色葡萄球菌newman,并且作用效果与amp相当。
[0089]
实施例9巴多索隆对金黄色葡萄球菌的生物膜的抑制实验1.实验步骤
[0090]
金黄色葡萄球菌(mrsa 43300)经过夜活化后,以1%转接,od
600
=0.8后以1%的接种量到含有1%dmso、巴多索隆(0.5
×
mic、1
×
mic、2
×
mic、4
×
mic)的孔板中,每个梯度四个生物学重复,37℃培养箱孵育24h后吸走上清,用pbs洗生物膜三次,37℃干燥3h后室温干燥,以0.2%结晶紫染色10min,去除多余的结晶紫后,pbs洗三次,剩余的生物膜用30%乙酸溶解,1:2稀释后用酶标仪在570nm处测量吸光度。
[0091]
2.实验结果
[0092]
结果请参阅图9,为本发明实施例9中巴多索隆对金黄色葡萄球菌(mrsa43300)生物膜的抑制效果图。结果表明,与control组相比,巴多索隆(0.5
×
mic)抑制金黄色葡萄球菌(mrsa43300)生物膜的能力具有显著性差异,巴多索隆(3/4
×
mic、1
×
mic)具有极显著地抑制金黄色葡萄球菌(mrsa43300)生物膜形成的能力。
[0093]
实施例10测试巴多索隆对肺炎模型的治疗效果
[0094]
1.实验步骤
[0095]
小鼠生存率实验,取24只4-5周龄的balb/c小鼠(北京华阜康生物科技股份有限公司)随机分成感染组(6只)对照组(6只)和药物组(6
×
2只),从小鼠的左侧鼻腔分别滴入40μl临床金黄色葡萄球菌耐药菌株166138菌液(2
×
10
10
cfu/小鼠),药物组小鼠每只按10mg/kg、5mg/kg巴多索隆灌胃给药,对照组给以溶剂灌胃。接种后将小鼠保持直立1min以保证小鼠充分吸收。而后以10mg/kg、5mg/kg巴多索隆或溶剂每天灌胃一次,观察小鼠的行为,记录死亡率。小鼠肺部载菌实验,取24只balb/c小鼠随机分成感染不治疗组(6只)对照组(6只)和感染药物治疗组(6只),从小鼠的左侧鼻腔分别滴入40μl临床金黄色葡萄球菌耐药菌株166138菌液(2
×
108cfu/小鼠),药物组小鼠每只按10mg/kg巴多索隆灌胃给药,对照组给以溶剂。接种后将小鼠保持直立1min以保证小鼠充分吸收。而后以10mg/kg巴多索隆或溶剂每天灌胃一次,48h后对小鼠进行肺部ct扫描,记录小鼠肺部验证阴影,取老鼠肺组织匀浆涂平板,进行小鼠肺部菌落计数。同时对肝和肾进行h&e染色切片观察,并检测血液中肝功能指标alt和ast的酶活性。
[0096]
2.实验结果
[0097]
结果请参阅图10,为本发明实施例10中巴多索隆对肺炎模型的治疗效果图,其中,a为巴多索隆治疗肺炎模型的生存曲线,b为巴多索隆治疗后肺部载菌量的变化图,c为对照组、肺炎组及肺炎治疗组肺部ct扫描图及对应小鼠肺部切片,d、e为对照组与治疗组肺部新鲜组织图以及肺部h&e染色图及血清中ast和alt含量。结果表明,肺炎模型小鼠经过4天给药后,巴多索隆能够提高小鼠生存率,并且给药后显著降低了肺炎模型小鼠的肺部载菌量。组织h&e染色表明,未经药物治疗的小鼠肺部炎性细胞浸润,肺泡壁增厚,肺泡出血,经过巴多索隆治疗之后,体内肺部炎症明显减少。巴多索隆对小鼠脏器的毒性测试结果表明,以上巴多索隆给药方式无肝脾肾组织毒性,并且肝功能指标谷丙转氨酶(alt)、谷草转氨酶(ast)正常,与对照组无显著性差异。
[0098]
实施例11测定巴多索隆与多粘菌素b九肽联合用药对阴性菌的效果
[0099]
本实施例选择了低毒性的多粘菌素b九肽和巴多索隆联合用药,首先分别检测了多粘菌素b九肽和巴多索隆单独作用时对大肠杆菌,铜绿假单胞菌,及临床菌株19771和166254的抑菌效果;再利用120ug/ml的多粘菌素b九肽与巴多索隆联合用药作用于大肠杆菌,铜绿假单胞菌,及临床菌株大肠杆菌19771和大肠杆菌166254,即在48孔板中使用加入120ug/ml的多粘菌素b九肽同时加入不同浓度配比下巴多索隆。在孔板中加入上述药物后用tsb培养基补充到990μl,而后加入10μl转接到od
600
=0.6的菌液,200rpm,37℃恒温培养箱进行培养12h,再利用酶标仪在波长为600nm的条件下对培养后的菌液浓度进行测定细菌生长情况。
[0100]
结果请参阅图11,为本发明实施例11中巴多索隆分别与多粘菌素b九肽联合使用的结果图。结果表明,巴多索隆与多粘菌素b九肽两者单独作用于大肠杆菌,铜绿假单胞菌,及临床菌株大肠杆菌19771和大肠杆菌166254时,都无明显抗菌效果,但是两者联合使用时却表现出较好的抗菌能力,这为临床治疗阴性细菌感染、多重耐药感染及重症感染提供了新思路。
[0101]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应
视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。