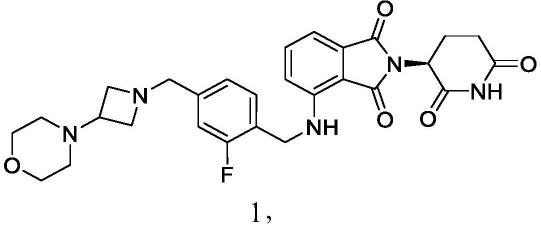
包含(s)-2-(2,6-二氧代哌啶-3-基)-4-((2-氟-4-((3-吗啉代氮杂环丁烷-1-基)甲基)苄基)氨基)异吲哚啉-1,3-二酮的药物组合物及其使用方法
1.本技术要求2019年10月21日提交的美国临时申请号62/923,927的优先权,将其引入文中作为参考。
2.1.领域
3.本文提供了含有(s)-2-(2,6-二氧代哌啶-3-基)-4-((2-氟-4-((3-吗啉代氮杂环丁烷-1-基)甲基)苄基)氨基)异吲哚啉-1,3-二酮或其对映体、对映体混合物、互变异构体、同位素体或药学上可接受的盐,以及载体或稀释剂的药物组合物。本文还提供了使用所述药物组合物用于治疗、预防和管理各种病患的方法。
4.2.背景
5.癌症的主要特征是来自指定的正常组织的异常细胞数量增加,这些异常细胞侵犯邻近组织,或由淋巴或血液传播的恶性细胞扩散到局部淋巴结并转移。临床数据和分子生物学研究表明,癌症是一个多步骤的过程,开始于轻微的癌前变化,该变化在某些条件下可发展为瘤形成(neoplasia)。瘤形成病变可呈克隆性演变,并发展出侵袭、生长、转移和异质性的增加的能力,尤其是在肿瘤细胞逃避宿主免疫监视的情况下。目前的癌症治疗可包括手术、化疗、激素治疗和/或放射治疗,以根除患者的肿瘤细胞。癌症治疗的最新进展由rajkumar等人在nature reviews clinical oncology 11,628
–
630(2014)中讨论。
6.目前所有的癌症治疗方法都给患者带来了明显的缺点。例如,由于患者的健康,手术可能是禁忌的,或者可能是患者不能接受的。此外,手术可能不能完全清除肿瘤组织。只有当肿瘤组织比正常组织对放射表现出更高的敏感性时,放射治疗才有效。放射治疗也常常引起严重的副作用。激素治疗很少作为一种单一药物给药。虽然激素治疗会是有效的,但常常在其他治疗方法清除了大部分癌细胞后,将其用于预防或延缓癌症复发。
7.尽管有多种化疗药物可用,但化疗有许多缺点。几乎所有的化疗药物都是有毒的,并且化疗会引起严重的,而且常常是危险的副作用,包括严重的恶心、骨髓抑制和免疫抑制。此外,即使联合应用化疗药物,许多肿瘤细胞对化疗药物有耐药性或产生耐药性。事实上,那些对治疗方案中使用的特定化疗药物耐药的细胞往往证明对其他药物耐药,即使这些药物的作用机制与特定治疗中所用的药物不同。将这种现象称为多向耐药或多药耐药。由于耐药性,许多癌症证明或变得是标准化疗治疗方案难治的。
8.血液恶性肿瘤(hematological malignancies)是起源于造血组织例如骨髓或免疫系统细胞的癌症。血液恶性肿瘤的示例是白血病、淋巴瘤和骨髓瘤。血液恶性肿瘤更具体的示例包括但不限于急性髓细胞白血病(aml)、急性淋巴细胞白血病(all)、多发性骨髓瘤(mm)、非霍奇金淋巴瘤(nhl)、弥漫性大b-细胞淋巴瘤(dlbcl)、霍奇金淋巴瘤(hl)、t细胞淋巴瘤(tcl)、伯基特(burkitt)淋巴瘤(bl)、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(cll/sll)、边缘区淋巴瘤(mzl)和骨髓增生异常综合征(mds)。
9.各种可能的药物组合物(例如包含不同赋形剂的口服制剂)为给定的药物化合物产生物理和化学性质的潜在多样性。药物组合物的发现和选择对于开发一种有效、稳定和
可市售的药品具有重要意义。
10.3.概述
11.本文提供了药物组合物(例如口服制剂),其包含化合物1:
[0012][0013]
或其对映体、对映体混合物、互变异构体、同位素体或药学上可接受的盐的混合物,以及载体或稀释剂。化合物1具有化学名称(s)-2-(2,6-二氧代哌啶-3-基)-4-((2-氟-4-((3-吗啉代氮杂环丁烷-1-基)甲基)苄基)氨基)异吲哚啉-1,3-二酮。本文还提供了制备药物组合物的方法。化合物1或其对映体、对映体混合物、互变异构体、同位素体或其药学上可接受的盐也统称为“化合物a”。
[0014]
在一实施方案中,载体或稀释剂是甘露醇、乳糖、淀粉、纤维素或其混合物。在一实施方案中,载体或稀释剂是甘露醇、乳糖、淀粉、纤维素、甘露醇和纤维素的混合物或者甘露醇和淀粉的混合物。在一实施方案中,载体或稀释剂是甘露醇和淀粉的混合物。在一些实施方案中,术语“载体”或“稀释剂”可与术语“粘合剂”互换使用。
[0015]
本文提供的药物组合物是用于动物或人类的有用制剂。因此,本文的实施方案包括这些药物组合物作为最终药物产品的用途。某些实施方案提供了用于制备具有改善性质的最终剂型的药物组合物,所述性质例如,粉末流动性、压实性、压片性、稳定性和赋形剂相容性等,这些性质是最终药品的生产、加工、配制和/或储存所需要的。
[0016]
还提供了配制用于通过适当途径和方式施用的药物组合物,其包含有效浓度的化合物a(例如本文提供的化合物1)。在一实施方案中,药物组合物是口服制剂。在一实施方案中,药物组合物是速释(ir)口服制剂。
[0017]
在一实施方案中,药物组合物递送对治疗血液恶性肿瘤有效的量。在一实施方案中,药物组合物递送有效预防血液恶性肿瘤的量。在一实施方案中,药物组合物递送对改善血液恶性肿瘤有效的量。
[0018]
在一实施方案中,血液恶性肿瘤是急性髓细胞白血病(aml)、急性淋巴细胞白血病(all)、多发性骨髓瘤(mm)、非霍奇金淋巴瘤(nhl)、弥漫性大b-细胞淋巴瘤(dlbcl)、霍奇金淋巴瘤(hl)、t-细胞淋巴瘤(tcl)、伯基特淋巴瘤(bl)、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(cll/sll)、边缘区淋巴瘤(mzl)或骨髓增生异常综合征(mds)。
[0019]
在一实施方案中,药物组合物递送对治疗非霍奇金淋巴瘤有效的量。在一实施方案中,药物组合物递送对预防非霍奇金淋巴瘤有效的量。在一实施方案中,药物组合物递送对改善非霍奇金淋巴瘤有效的量。
[0020]
本文还提供了将本文提供的药物组合物单独或与利妥昔单抗联合用于治疗、预防或管理非霍奇金淋巴瘤(nhl)的方法。在一实施方案中,该方法用于治疗nhl。在一实施方案中,该方法用于预防nhl。在一实施方案中,该方法用于管理nhl。
[0021]
在某些实施方案中,nhl是弥漫性大b-细胞淋巴瘤(dlbcl)、滤泡性淋巴瘤(fl)、套
细胞淋巴瘤(mcl)或原发性中枢神经系统淋巴瘤(pcnsl)。
[0022]
本文还提供了将本文提供的药物组合物单独或与阿托珠单抗联合用于治疗、预防或管理慢性淋巴细胞白血病(cll)的方法。在一实施方案中,该方法用于治疗cll。在一实施方案中,该方法用于预防cll。在一实施方案中,该方法用于管理cll。
[0023]
本文还提供了将本文提供的药物组合物单独或与阿托珠单抗联合用于治疗、预防或管理小淋巴细胞性淋巴瘤(sll)的方法。在一实施方案中,该方法用于治疗sll。在一实施方案中,该方法用于预防sll。在一实施方案中,该方法用于管理sll。
[0024]
本文还提供了本文提供的药物组合物,其用于治疗本文提供的疾病的方法中,其中所述方法包括将治疗有效量的药物组合物施用至患者。
[0025]
还提供了包含一个或多个容器的药物包装或药盒,该容器填充有药物组合物的一种或多种成分。任选与所述容器相关的可以是政府机构规定形式的说明(notice),其规范药品或生物制品的生产、使用或销售,所述说明反映生产机构的批准,用于人类用药的销售使用。包装或药盒可以标记与关于施用方式、药物施用顺序(例如单独地、依次地或同时地)等相关的信息。
[0026]
进一步提供了制备本文提供的药物组合物的方法。
[0027]
本文所述主题的上述和其他方面将在参考下文详述后变得显而易见。
[0028]
4.附图简述
[0029]
图1a、图1b和图1c显示分别在40℃/75%rh、无干燥剂,40℃/75%rh、有干燥剂,以及50℃/75%rh、有干燥剂条件下,高达12周,原型制剂的化学稳定性(总杂质)。
[0030]
图2a、图2b和图2c显示分别在40℃/75%rh、无干燥剂,40℃/75%rh、有干燥剂,以及50℃/75%rh、有干燥剂条件下,高达12周,原型制剂的手性稳定性数据。
[0031]
图3提供湿法制粒工艺的流程图。
[0032]
图4提供rc工艺的流程图。
[0033]
图5显示碾压(roller compaction)批次(cap-5)和高剪切湿法制粒批次(cap-10)的溶出曲线。
[0034]
图6显示了cap-5制剂批次的碾压工艺的流程图。
[0035]
图7提供化合物1盐酸盐的形式a的代表性xrpd图。
[0036]
5.详述
[0037]
5.1定义
[0038]
除非另外定义,本文使用的所有技术和科学术语具有与本领域普通技术人员通常理解的相同的含义。将所有专利、申请、公开的申请和其他出版物以其全部引入作为参考。如果文中的术语有多种定义,除非另外说明,否则以本节中的定义为准。
[0039]
如本文,以及说明书和所附权利要求中所用,不定冠词“a”和“an”以及定冠词“the”包括复数和单数事物,除非上下文另外明确说明。
[0040]
如本文所用,术语“包含”和“包括”可以互换使用。术语“包含”和“包括”应理解为指定所提及的所述特征或组成部分的存在,但不排除存在或添加一个或多个特征或组成部分或其组。此外,术语“包含”和“包括”旨在包括由术语“由
…
组成”所涵盖的示例。因此,术语“由
…
组成”可以用来代替术语“包含”和“包括”,以提供本发明的更具体实施方案。
[0041]
术语“由
…
组成”意指主题具有至少90%、95%、97%、98%或99%构成其的所述特
征或组成部分。在另一实施方案中,术语“由
…
组成”从任何后续列举的范围中排除任何其他特征或组成部分,除了那些对要实现的技术效果不是必需的特征或组成部分。
[0042]
如本文所用,术语“或”应理解为包含性的,“或”意指任何一种或任何组合。因此,“a、b或c”意指下列任何一种:“a;b;c;a和b;a和c;b和c;a、b和c”。只有当元素、功能、步骤或行为的组合以某种方式内在地相互排斥时,才会出现这一定义的例外。
[0043]
如本文所用且除非另外规定,当用于与剂量、量或者组合物或剂型成分的重量百分数结合使用时,术语“约”和“大概”意指本领域普通技术人员公认的剂量、量或重量百分数,其提供与从指定剂量、量或重量百分数获得的药理作用等效的药理作用。在某些实施方案中,当用于上下文时,术语“约”和“大概”意指指定剂量、量和重量百分数的30%范围内、20%范围内、15%范围内、10%范围内或5%范围内的剂量、量和重量百分数。
[0044]
如本文所用且除非另外说明,当与提供用于表征特定固体形式的数值或数值范围结合使用时,例如特定温度或温度范围,例如描述融化、脱水、去溶剂化或玻璃化转变温度;质量变化,例如作为温度或湿度函数的质量变化;溶剂或水含量,例如质量或百分比;或者峰位置,例如用ir或拉曼光谱或xrpd分析,术语“约”和“大概”表示值或值的范围可能偏离到本领域普通技术人员认为合理同时仍然描述所述特定固体形式的程度。例如,在特定实施方案中,当用于上下文时,术语“约”和“大概”表示数值或数值范围可在所述值或值范围的25%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1.5%、1%、0.5%或0.25%范围内变化。例如,在一些实施方案中,xrpd峰位置的值可以在至多
±
0.2
°
2θ范围内变化,同时仍然描述所述特定xrpd峰。如本文所用,在数值或数值范围之前的波浪符号(即“~”)表示“约”或“大概”。
[0045]
除非另外规定,术语“x-射线粉末衍射”、“粉末x-射线衍射”、“pxrd”和“xrpd”可以在本技术中互换使用。
[0046]
如本文所用且除非另外说明,术语“固体形式”和相关术语指的是不主要处于液体或气体状态的物理形式。如本文所用,术语“固体形式”包括半固体。固体形式可以是结晶的、无定形的、部分结晶的、部分无定形的或各种形式的混合物。
[0047]
如本文所用且除非另外规定,当用于描述物质、组分、产物或形式时,术语“结晶的”和本文所用的相关术语意指所述物质、组分、产物或形式是基本上结晶的,例如通过x-射线衍射测定的。参见例如雷明顿:药学科学和实践(remington:the science and practice of pharmacy),第21版,lippincott,williams和wilkins,baltimore,md(2005);美国药典(the united states pharmacopeia),第23版,1843-1844(1995)。
[0048]
如本文使用且除非另外规定,术语“无定形的”、“无定形形式”和本文所用的相关术语意指根据x-射线衍射测定的,所讨论的物质、组分或产物基本上不是结晶的。具体而言,术语“无定形形式”描述无序的固体形式,即缺乏长程晶序的固体形式。在某些实施方案中,物质的无定形形式可以基本上没有其他无定形形式和/或晶体形式。在其他实施方案中,无定形形式的物质可包含小于约1重量%、2重量%、3重量%、4重量%、5重量%、10重量%、15重量%、20重量%、25重量%、30重量%、35重量%、40重量%、45重量%或50重量%的一种或多种其它无定形形式和/或晶体形式。在某些实施方案中,物质的无定形形式可以是物理和/或化学纯的。在某些实施方案中,物质的无定形形式可以是约99%、98%、97%、96%、95%、94%、93%、92%、91%或90%物理和/或化学纯的。在某些实施方案中,物质的
无定形形式可以包括其他组分或成分(例如添加剂、聚合物或赋形剂,其可用于进一步稳定无定形形式)。在某些实施方案中,无定形形式可以是固溶体(solid solution)。
[0049]
如本文所用且除非另有规定,术语“药学上可接受的盐”是指由药学上可接受的、相对无毒的酸(包括无机酸和有机酸)制备的盐。在某些实施方案中,合适的酸包括但不限于乙酸、己二酸、4-氨基水杨酸、抗坏血酸、天冬氨酸、苯磺酸、苯甲酸、樟脑酸、樟脑磺酸、癸酸、己酸、辛酸、肉桂酸、碳酸、柠檬酸、环己基氨基磺酸、二氢磷酸、2,5-二羟基苯甲酸(龙胆酸)、1,2-乙烷二磺酸、乙烷磺酸、富马酸、半乳糖醛酸、葡萄糖酸、葡萄糖醛酸、谷氨酸、戊二酸、乙醇酸、马尿酸、氢溴酸、盐酸、氢碘酸、异丁酸、异硫氰酸、乳酸、马来酸、苹果酸、丙二酸、扁桃酸、甲磺酸、单氢碳酸、单氢磷酸、单氢硫酸、粘液酸、1,5-萘二磺酸、烟酸、硝酸、草酸、扑酸、泛酸、磷酸、邻苯二甲酸、丙酸、焦谷氨酸、水杨酸、软木酸、琥珀酸、硫酸、酒石酸、甲苯磺酸等(参见例如s.m.berge等人,j.pharm.sci.,66:1-19(1977);和handbook of pharmaceutical salts:properties,selection and use,p.h.stahl和c.g.wermuth编,(2002),wiley,weinheim)。在某些实施方案中,适当的酸是强酸(例如pka小于约1),包括但不限于盐酸、氢溴酸、硫酸、硝酸、甲磺酸、苯磺酸、甲苯磺酸、萘磺酸、萘二磺酸、吡啶-磺酸,或其他取代的磺酸。还包括具有酸性特性的其他相对无毒的化合物的盐,所述化合物包括氨基酸例如天门冬氨酸等,以及其他化合物,例如阿司匹林、布洛芬、糖精等。酸加成盐可通过将中性形式的化合物与足量的所需酸(纯酸或在合适的溶剂中)接触而获得。作为固体,盐可以以结晶或无定形形式或其混合物存在。盐也可以以多晶形形式存在。
[0050]
应该注意的是,如果绘制的结构和该结构的名称之间存在差异,则应将绘制结构赋予更多的权重。
[0051]
如本文所用且除非另外说明,术语“治疗”是指全部或部分缓解病患、疾病或病症或者与病患、疾病或病症相关的一种或多种症状,或者减缓或停止所述症状的进一步进展或恶化,或者减轻或消除病患、疾病或病症本身的病因。
[0052]
如本文所用且除非另外说明,术语“预防”是指全部或部分延缓和/或阻止病患、疾病或病症发生、复发或扩散的方法;禁止个体获得病患、疾病或病症的方法;或者减少个体患病患、疾病或病症的风险的方法。
[0053]
如本文所用且除非另外说明,术语“管理”包括防止患此病的患者的特定疾病或病患复发,延长患此疾病或病患的患者缓解的时间,降低患者的死亡率和/或保持与所管理的疾病或病症相关的症状的严重程度的降低或者避免与所管理的疾病或病症相关的症状。
[0054]
如本文所用且除非另外说明,与化合物相关的术语“有效量”意指能够治疗、预防或管理病患、疾病或病症或其症状的量。
[0055]
如本文所用且除非另外说明,术语“个体”或“患者”包括动物,包括但不限于牛、猴、马、羊、猪、鸡、火鸡、鹌鹑、猫、狗、小鼠、大鼠、兔或豚鼠等动物,在一实施方案中,其是哺乳动物,在另一实施方案中,其是人。
[0056]
如本文所用且除非另外说明,术语“复发”指的是对治疗有响应(例如获得完全响应)的病患、疾病或病症然后出现恶化。治疗可包括一种或多种疗法。在一实施方案中,所述病患、疾病或病症先前已经用一种或多种疗法治疗。在另一实施方案中,所述病患、疾病或病症先前已经用1种、2种、3种或4种疗法治疗。在一些实施方案中,所述病患、疾病或病症是血液恶性肿瘤。
[0057]
在一实施方案中,“复发的”dlbcl可以指先前已用一种或多种治疗方法治疗的dlbcl。在一实施方案中,复发的dlbcl是先前用1种、2种、3种或4种治疗方法治疗的dlbcl。在一实施方案中,复发的dlbcl是先前用两种或更多种治疗方法治疗的dlbcl。
[0058]
在一实施方案中,“复发的”fl可以指先前用一种或多种疗法治疗的fl。在一实施方案中,复发的fl是先前用1种、2种、3种或4种治疗方法治疗的fl。在一实施方案中,复发的fl是先前用两种或更多种疗法治疗的fl。
[0059]
如本文所用且除非另外说明,术语“难治的”是指对可包括一种或多种疗法的先前治疗没有响应的病患、疾病或病症。在一实施方案中,所述病患、疾病或病症先前已用1种、2种、3种或4种疗法治疗。在一实施方案中,所述病患、疾病或病症先前已用两种或更多种疗法治疗,并且对包含治疗方案的最新疗法小于完全响应(cr,complete response)。在一些实施方案中,所述病患、疾病或病症是血液恶性肿瘤。
[0060]
在一实施方案中,“复发或难治的”cll/sll可以指先前用一种或多种疗法治疗的cll/sll。在一实施方案中,复发或难治的cll/sll是先前已用1种、2种、3种或4种疗法治疗的cll/sll。在一实施方案中,复发或难治的cll/sll是先前已用两种或更多种疗法治疗的cll/sll。在一实施方案中,复发或难治的cll/sll是先前用bruton酪氨酸激酶(btk)抑制剂治疗的cll/sll。在一实施方案中,复发或难治的cll/sll是对btk抑制剂复发或难治的。在一实施方案中,btk抑制剂是依布替尼(ibrutinib)。在一实施方案中,btk抑制剂是阿卡替尼(acalabrutinib)。在一个实施方案中,btk抑制剂是泽布替尼(zanubrutinib)。在一实施方案中,btk抑制剂是替拉鲁替尼(tirabrutinib)。
[0061]
对于癌症例如血液恶性肿瘤,抑制可通过抑制疾病进展、抑制肿瘤生长、减少原发肿瘤、缓解肿瘤相关症状、抑制肿瘤分泌因子、延迟出现原发性或继发性肿瘤、减缓原发或继发肿瘤的发展、降低原发或继发肿瘤的发生、减缓或降低疾病的继发效应严重性、阻止肿瘤生长和肿瘤消退、增加的至进展时间(ttp)、增加的无进展生存期(pfs)、增加的总生存期(os)等评价。本文所用的os是指从治疗开始到任何原因导致死亡的时间。本文所用的ttp是指从治疗开始到肿瘤恶化的时间;ttp不包括死亡。在一实施方案中,pfs是指从治疗开始到肿瘤恶化或死亡的时间。在一实施方案中,pfs是指从第一次施用化合物到任何原因的疾病进展或死亡首次发生的时间。在一实施方案中,利用kaplan-meier评价计算pfs率。无事件生存期(efs)是指从治疗开始到任何治疗失败的时间,包括疾病进展、任何原因的治疗停止或死亡。在一实施方案中,总响应率(orr)是指获得响应的患者的百分比。在一实施方案中,orr表示实现完全和部分响应的患者百分比总和。在一实施方案中,orr表示最佳响应≥部分响应(pr)的患者百分比。在一实施方案中,响应持续时间(dor)是从实现响应直到复发或疾病进展的时间。在一实施方案中,dor是从实现响应≥部分响应(pr)到复发或疾病进展的时间。在一实施方案中,dor是从第一次记录响应到第一次记录疾病进展或死亡的时间。在一实施方案中,dor是从第一次记录响应≥部分响应(pr)到第一次记录疾病进展或死亡的时间。在一实施方案中,响应时间(ttr)是指从第一施用化合物到第一记录响应的时间。在一实施方案中,ttr是指从第一次施用化合物到第一次记录响应≥部分响应(pr)的时间。在极端情况下,完全抑制在文中称为预防或化学预防。在这种情况下,术语“预防”包括完全预防临床上明显的癌症发生或预防癌症的临床前明显分期的发生。这一定义还预期包括防止转化为恶性细胞或者阻止或逆转癌前细胞向恶性细胞的恶化。所述包括对有患癌症风险的
人的预防性治疗。
[0062]
在某些实施方案中,nhl治疗可通过恶性淋巴瘤国际研讨会标准进行评价(参见cheson等人,j.clin.oncol.2014,32(27):3059-3068)和氟脱氧葡萄糖-正电子发射断层扫描(fdg-pet)的扫描解释的deauville标准(the deauville criteria for fluorodeoxyglucose-positron emission tomography(fdg-pet)scan interpretation)(itti等人,eur.j.nucl.med.mol.imaging,2013,40(9):1312-20;meignan等人,leuk lymphoma,2014,55(1):31-37(“lugano标准”),利用表1-3所示的响应和终点定义。
[0063]
表1.相关部位标准.
[0064][0065]
cns=中枢神经系统;csf=脑脊液;ct=计算机断层扫描;fdg=氟脱氧葡萄糖;gi=胃肠道;mri=磁共振成像;pet=正电子发射断层扫描;n/a=不适用。
[0066]apet/ct足以测定骨髓受累,并可认为是其他淋巴外部位受累的高度提示。必要时,可考虑对所述部位进行活检确认。
[0067]
表2.非霍奇金淋巴瘤的lugano响应标准。
[0068]
[0069][0070]
[0071]
cmr=完全代谢响应;ldi=病变的最长横径;ppd=ldi和垂直直径的叉积;sdi=垂直于ldi的最短轴;spd=多发性病变的垂直直径乘积之和;n/a=不适用。
[0072]a基线时骨髓受累,cr需要的
[0073]b在waldeyer环或具有高生理摄取或者脾脏或骨髓内活化的结外部位(例如化疗或髓样集落刺激因子),摄取可大于正常纵隔和/或肝脏。在这种情况下,如果在最初受累部位的摄取不大于周围正常组织,则可以推断cmr。
[0074]cfdg-avid淋巴瘤应通过pet-ct评估其响应。有些疾病通常可以单独进行ct(例如边缘区淋巴瘤)。
[0075]dpet应与增强诊断性ct相结合,可同时进行,也可单独进行。
[0076]
表3.pet五点量表(5-ps)。
[0077]
1背景以上无摄取2摄取≤纵隔3摄取》纵隔但≤肝4中度摄取》肝脏5摄取明显高于肝脏和/或新病变x新的摄取区域不太可能与淋巴瘤有关
[0078]adeauville五点量表(5ps)是国际上推荐的临床常规和临床试验量表,利用fdg-pet/ct进行霍奇金淋巴瘤(hl)和某些类型的非霍奇金淋巴瘤(nhl)的初始分期和治疗响应评估。
[0079]
在一实施方案中,cll/sll的治疗响应可通过国际慢性淋巴细胞白血病研讨会标准(international workshop on chronic lymphocytic leukemia criteria)进行评价(参见hallek,m等人,iwcll诊断指南,治疗指征,响应评估和cll的支持治疗(iwcll guidelines for diagnosis,indications for treatment,response assessment,and supportive management of cll).blood,131(25),2745-2760(2018)(表4)。
[0080]
表4.慢性淋巴细胞白血病患者治疗后的响应定义。
[0081][0082]
cr=完全缓解(必须符合所有标准);pd=疾病进展(必须符合a组或b组的至少1项标准);pr=部分缓解(对于pr,如果先前异常,a组至少有2项参数和b组至少有1项参数需要改善;如果a组和b组在治疗前仅有1项参数异常,只有1项需要改善);sd=疾病稳定(所有标准必须满足;单独的全身症状不能定义pd)。
[0083]a6个或更少的淋巴结产物总和(通过临床试验中的ct扫描和体检或全科医学中的体检评估)。
[0084]b如果脾脏大小《13cm,则视为正常。关于正常肝脏的大小,国际上还没有明确的共识;因此,在临床试验中,应通过影像学和手动触诊来评估肝脏大小,并根据研究方案中使用的定义进行记录。
[0085]
在一个实施方案中,cll/sll的治疗响应可以通过东部肿瘤协作组(eastern cooperative oncology group(ecog))性能状态来评估(表5)。
[0086]
表5.ecog性能状态。
[0087][0088]
ecog=东部肿瘤协作组,robert comis,md,协作组主席。
[0089]
来源:oken m等人,toxicity and response criteria of the eastern cooperative oncology group(东部肿瘤协作组的毒性和反应标准).am j clin oncol,5(6):649-655(1982)。
[0090]
在某些实施方案中,稳定的疾病或缺乏疾病可以通过本领域已知的方法来测定,例如评价患者症状、体检、已经成像的肿瘤的可视化,诸如利用fdg-pet(氟脱氧葡萄糖正电子发射断层扫描)、pet/ct(正电子发射断层扫描/计算机断层扫描)扫描、脑和脊柱的mri(磁共振成像)、csf(脑脊液)、眼科检查、玻璃体液体取样、视网膜照片、骨髓评价和其他公认的评价方法。
[0091]
如本文所用且除非另外说明,术语“共同施用”和“与
…
联合”包括同时、共同或无特定时间限制的依次施用一种或多种治疗物质(例如本文提供的化合物和另一种抗癌物质或支持性护理物质)。在一实施方案中,所述物质同时存在于细胞或患者体内或者同时发挥其生物或治疗作用。在一实施方案中,治疗物质在相同的组合物或单位剂型中。在另一实施方案中,治疗物质在单独的组合物或单位剂型中。
[0092]
术语“支持性护理物质”是指治疗、预防或管理用其他治疗物质治疗产生的不良反应的任何物质。
[0093]
5.2包含化合物1的药物组合物
[0094]
在某些实施方案中,本文提供了药物组合物(例如口服制剂),其包含化合物1:
[0095][0096]
或其对映体、对映体混合物、互变异构体、同位素体或药学上可接受的盐,以及载体或稀释剂。化合物1或其对映体、对映体混合物、互变异构体、同位素体或药学上可接受的盐也统称为“化合物a”。
[0097]
在一实施方案中,载体或稀释剂是甘露醇、乳糖、淀粉、纤维素或其混合物。在一实
施方案中,载体或稀释剂是甘露醇、乳糖、淀粉、纤维素、甘露醇和纤维素的混合物或者甘露醇和淀粉的混合物。在一实施方案中,载体或稀释剂是甘露醇和淀粉的混合物。在一些实施方案中,术语“载体”可与术语“粘合剂”互换使用。
[0098]
在一些实施方案中,本文提供的药物组合物适合于口服施用给患者。在一实施方案中,本文提供的药物组合物显示有利的物理和/或药理学性质。所述性质包括但不限于易于测定、含量均匀度、生产的流动性质、溶出和生物利用度,以及稳定性。在一实施方案中,在不冷藏条件下,本文提供的药物组合物具有至少约6个月、至少约12个月、至少约18个月、至少约24个月、至少约30个月或至少约36个月的保存期。在某些实施方案中,“不冷藏”指在20℃或以上的温度。在一实施方案中,本文提供的药物组合物在冷藏条件下贮存。在一实施方案中,在冷藏条件下贮存,本文提供的药物组合物具有至少约6个月、至少约12个月、至少约18个月、至少约24个月、至少约30个月或至少约36个月的贮存期。在一实施方案中,本文提供的药物组合物的性质使其适合于速释(ir)。
[0099]
可将本文提供的药物组合物配制成适当的药物制剂,例如用于口服施用的溶液剂、混悬剂、片剂、分散片、丸剂、胶囊、散剂、缓释制剂或酏剂,或者用于眼部或肠胃外施用的无菌溶液剂或混悬剂,以及透皮贴剂制剂和干粉吸入剂。通常,利用本领域熟知的技术和方法,将上述化合物配制成药物组合物(参见例如ansel's pharmaceutical dosage forms and drug delivery systems,第10版,2013)。在一实施方案中,本文提供的药物组合物是口服剂型。在一实施方案中,口服单位剂型是片剂。在一实施方案中,口服单位剂型是囊片(caplet)。在一实施方案中,口服单位剂型是胶囊。在一实施方案中,本文提供的药物组合物是速释胶囊。
[0100]
片剂、囊片和胶囊通常含有约50mg至约500mg的药物组合物(即活性成分和赋形剂)。胶囊可以是任何大小。标准尺寸的示例包括#000、#00、#0、#1、#2、#3、#4和#5。参见例如remington's pharmaceutical sciences,第1658-1659页(alfonso gennaro编,mack publishing company,easton pennsylvania,第18版,1990),将其引入作为参考。在一些实施方案中,本文提供的胶囊具有#1或更大、#2或更大、#3或更大或者#4或更大的尺寸。
[0101]
在组合物中,将有效浓度的一种或多种化合物或药学上可接受的盐与适当的药物载体或溶媒混合。在某些实施方案中,组合物中化合物的浓度对于在施用时递送治疗、预防或改善非霍奇金淋巴瘤的一种或多种症状和/或进展的量是有效的。
[0102]
(a)化合物1的形式
[0103]
化合物1具有化学名称(s)-2-(2,6-二氧代哌啶-3-基)-4-((2-氟-4-((3-吗啉代氮杂环丁烷-1-基)甲基)苄基)氨基)异吲哚啉-1,3-二酮。美国申请号16/390,815中描述制备化合物1的方法,将其以其全部引入文中作为参考。
[0104]
在一个实施方案中,化合物1或其对映体、对映体混合物、互变异构体、同位素体或药学上可接受的盐以固体形式提供在药物组合物中。在一实施方案中,固体形式是无定形的。在一实施方案中,固体形式是结晶的。在一实施方案中,固体形式是水合物。在一实施方案中,固体形式是无水化合物。在一实施方案中,固体形式是溶剂化物。在一实施方案中,固体形式是非溶剂化的。在一实施方案中,固体形式是无定形的。
[0105]
固体形式可以利用本领域技术人员已知的许多方法来表征,包括但不限于单晶x-射线衍射、x-射线粉末衍射(pxrd)、显微镜(例如光学显微镜、扫描电子显微镜(sem))、热分
析(例如差示扫描量热法(dsc)、热重分析(tga)和热台显微镜)、动态蒸汽吸附(dvs)、光谱学(例如红外、拉曼和核磁共振)、高效液相色谱(hplc)。本文提供的固体形式的粒度和粒度分布可以通过常规方法例如激光光散射技术来测定。
[0106]
在一实施方案中,药物组合物包含化合物1的游离碱。在一实施方案中,化合物1的游离碱是无定形的。在一实施方案中,化合物1的游离碱是结晶的。在一实施方案中,化合物1的游离碱是一种或多种无定形形式和结晶形式的混合物。
[0107]
在一实施方案中,药物组合物包含化合物1的盐。在一实施方案中,所述盐是化合物1的盐酸盐、富马酸盐、甲苯磺酸盐、马来酸盐或苯磺酸盐。在一实施方案中,化合物1的盐是无定形的。在一实施方案中,化合物1的盐是结晶的。在一实施方案中,化合物1的盐是一种或多种无定形形式和结晶形式的混合物。
[0108]
在一实施方案中,药物组合物包含化合物1的盐酸盐。在一实施方案中,药物组合物包含化合物1的富马酸盐。在一实施方案中,药物组合物包含化合物1的甲苯磺酸盐。在一实施方案中,药物组合物包含化合物1的马来酸盐。在一实施方案中,药物组合物包含化合物1的苯磺酸盐。
[0109]
在一实施方案中,药物组合物包含化合物1盐酸盐的形式a。
[0110]
在一实施方案中,形式a是化合物1盐酸盐的水合物。在一实施方案中,形式a是化合物1盐酸盐的通道水合物。
[0111]
图7中提供化合物1盐酸盐形式a的代表性xrpd图。
[0112]
在一实施方案中,本文提供的药物组合物包含固体形式的化合物1的盐酸盐,所述固体形式特征为位于大约下述位置的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27或所有的峰:4.2、7.8、11.1、12.4、15.1、15.5、16.3、17.1、17.3、17.9、18.2、18.9、19.2、20.1、20.4、20.7、21.7、22.4、23.0、24.4、24.8、25.7、27.5、28.1、29.1、29.8、30.2和30.8
°
2θ。在一实施方案中,固体形式的特征在于3个所述峰。在一实施方案中,固体形式的特征在于5个所述峰。在一实施方案中,固体形式的特征在于7个所述峰。在一实施方案中,固体形式的特征在于9个所述峰。在一实施方案中,固体形式的特征在于11个所述峰。在一实施方案中,固体形式的特征在于所有的所述峰。
[0113]
在一实施方案中,本文提供的药物组合物包含固体形式的化合物1的盐酸盐,其特征在于包括在大约15.1、16.3、和20.7
°
2θ处的峰的xrpd图。在一实施方案中,xrpd图还包括在大约7.8和22.4
°
2θ处的峰。在一实施方案中,xrpd图还包括大约18.2、18.9和24.8
°
2θ处的峰。在一实施方案中,xrpd图包括大约7.8、15.1、16.3、17.9、18.2、18.9、19.2、20.4、20.7、21.7、22.4、24.8
°
2θ处的峰。
[0114]
在一个实施方案中,本文提供的药物组合物包含固体形式的化合物1的盐酸盐,其特征在于包括大约4.2、7.8和11.1
°
2θ处的峰的xrpd图。在一实施方案中,xrpd图包括在大约4.2、7.8、11.1、12.4和15.1
°
2θ处的峰。在一实施方案中,xrpd图包括大约4.2、7.8、11.1、12.4、15.1、15.5和16.3
°
2θ处的峰。在一实施方案中,xrpd图包括在大约4.2、7.8、11.1、12.4、15.1、15.5、16.3、17.1和17.3
°
2θ处的峰。
[0115]
在一实施方案中,本文提供的药物组合物包含固体形式的化合物1的盐酸盐,其特征在于与图7中呈现的xrpd图相匹配的xrpd图。
[0116]
在一实施方案中,利用cu kα辐射获得xrpd图。
[0117]
(b)基于甘露醇-淀粉的药物组合物
[0118]
在一实施方案中,本文提供的药物组合物中的载体或稀释剂是甘露醇和淀粉的混合物。
[0119]
在一实施方案中,药物组合物还包括崩解剂、助流剂、润滑剂或其混合物。
[0120]
在一实施方案中,本文提供了一种药物组合物,其包含:1)化合物1或其对映体、对映体混合物、互变异构体、同位素体或药学上可接受的盐,其量为大约0.05%w/w至大约2%w/w;2)甘露醇和淀粉混合物,其量为大约85%w/w至大约99.7%w/w;3)崩解剂,其量为大约0%w/w至大约6%w/w;4)助流剂,其量为大约0%w/w至大约2%w/w;5)润滑剂,其量大约为0%w/w至大约10%w/w。
[0121]
在一实施方案中,化合物1或其对映体、对映体混合物、互变异构体、同位素体或药学上可接受的盐是化合物1的盐酸盐。在一实施方案中,化合物1的盐酸盐是结晶的化合物1盐酸盐。在一实施方案中,化合物1的盐酸盐的特征在于xrpd图,其包括大约15.1、16.3和20.7
°
2θ处的峰。
[0122]
在一实施方案中,化合物1或其对映体、对映体混合物、互变异构体、同位素体或药学上可接受的盐的量是大约0.05%w/w至大约2%w/w(占药物组合物的总重量)。在一实施方案中,所述量为约0.07%w/w至约1.5%w/w。在一实施方案中,所述量为约0.1%w/w至约1%w/w。在一实施方案中,所述量为约0.14%w/w至约0.71%w/w。在一实施方案中,所述量为约0.1%w/w至约0.2%w/w。在一实施方案中,所述量为约0.6%w/w至约0.8%w/w。
[0123]
在一实施方案中,化合物1或其对映体、对映体混合物、互变异构体、同位素体或药学上可接受的盐的量是大约0.05%w/w、大约0.06%w/w、大约0.08%w/w、大约0.09%w/w、大约0.1%w/w、大约0.11%w/w、大约0.12%w/w、大约0.13%w/w、大约0.14%w/w、大约0.15%w/w、大约0.16%w/w、大约0.17%w/w、大约0.18%w/w、大约0.19%w/w、大约0.2%w/w、大约0.25%w/w、大约0.3%w/w、大约0.35%w/w、大约0.4%w/w、大约0.45%w/w、大约0.5%w/w、大约0.6%w/w、大约0.65%w/w、大约0.7%w/w、大约0.75%w/w、大约0.8%w/w、大约0.85%w/w、大约0.9%w/w、大约0.95%w/w、大约1%w/w、大约1.1%w/w、大约1.2%w/w、大约1.3%w/w、大约1.4%w/w、大约1.5%w/w、大约1.6%w/w、大约1.7%w/w、大约1.8%w/w、大约1.9%w/w或大约2%w/w。在一实施方案中,所述量是大约0.14%w/w。在一实施方案中,所述量是大约0.142%w/w。在一实施方案中,所述量是大约0.71%w/w。在一实施方案中,所述量是大约0.712%w/w。
[0124]
在一实施方案中,所述淀粉是部分预胶化淀粉。在一实施方案中,所述淀粉是预胶化淀粉。
[0125]
在一实施方案中,甘露醇和淀粉混合物的量是大约85%w/w至大约99.7%w/w(占药物组合物总重量)。在一实施方案中,淀粉和乳糖混合物的量是大约87.5%w/w至大约97.5%w/w。在一实施方案中,淀粉和乳糖混合物的量是大约90%w/w至大约95%w/w。在一实施方案中,淀粉和乳糖混合物的量是大约91.5%w/w至大约93%w/w。在一实施方案中,淀粉和乳糖混合物的量是大约92%w/w至大约93%w/w。
[0126]
在一实施方案中,甘露醇和淀粉混合物的量是大约85%w/w、大约86%w/w、大约87%w/w、大约88%w/w、大约89%w/w、大约90%w/w、大约90.5%w/w、大约91%w/w、大约91.5%w/w、大约91.6%w/w、大约91.7%w/w、大约91.8%w/w、大约91.9%w/w、大约92%w/
w、大约92.1%w/w、大约92.2%w/w、大约92.3%w/w、大约92.4%w/w、大约92.5%w/w、大约92.6%w/w、大约92.7%w/w、大约92.8%w/w、大约92.9%w/w、大约93%w/w、大约93.5%w/w、大约94%w/w、大约94.5%w/w、大约95%w/w、大约96%w/w、大约97%w/w、大约98%w/w、大约99%w/w、大约99.5%w/w或大约99.7%w/w。在一实施方案中,甘露醇和淀粉混合物的量是大约91.9%w/w。在一实施方案中,甘露醇和淀粉混合物的量是大约92.3%w/w。在一实施方案中,甘露醇和淀粉混合物的量是大约92.9%w/w。在一实施方案中,甘露醇和淀粉混合物的量是大约91.86%w/w。在一实施方案中,甘露醇和淀粉的混合物的量是大约92.29%w/w。在一实施方案中,甘露醇和淀粉混合物的量是大约92.86%w/w。
[0127]
在一实施方案中,甘露醇的量是大约67%w/w至大约77.7%w/w,并且淀粉的量是大约18%w/w至大约22%w/w。在一实施方案中,甘露醇的量是大约69%w/w至大约76%w/w,并且淀粉的量是大约18.5%w/w至大约21.5%w/w。在一实施方案中,甘露醇的量是大约71%w/w至大约74%w/w,并且淀粉的量是大约19%w/w至大约21%w/w。在一实施方案中,其中甘露醇的量是大约71.5%w/w至大约73%w/w,并且淀粉的量是大约20%w/w。在一实施方案中,其中甘露醇的量是大约72%w/w至大约73%w/w,并且淀粉的量是大约20%w/w。
[0128]
在一实施方案中,甘露醇的量是大约67%w/w、大约68%w/w、大约69%w/w、大约70%w/w、大约70.5%w/w、大约71%w/w、大约71.5%w/w、大约71.6%w/w、大约71.7%w/w、大约71.8%w/w、大约71.9%w/w、大约72%w/w、大约72.1%w/w、大约72.2%w/w、大约72.3%w/w、大约72.4%w/w、大约72.5%w/w、大约72.6%w/w、大约72.7%w/w、大约72.8%w/w、大约72.9%w/w、大约73%w/w、大约73.5%w/w、大约74%w/w、大约74.5%w/w、大约75%w/w、大约76%w/w、大约77%w/w、大约77.5%w/w或大约77.7%w/w。在一实施方案中,甘露醇的量是大约71.9%w/w。在一实施方案中,甘露醇的量是大约72.3%w/w。在一实施方案中,甘露醇的量是大约72.9%w/w。在一实施方案中,甘露醇的量是大约71.86%w/w。在一实施方案中,甘露醇的量是大约72.29%w/w。在一实施方案中,甘露醇的量是大约72.86%w/w。
[0129]
在一实施方案中,淀粉的量是大约18%w/w、大约18.5%w/w、大约19%w/w、大约19.5%w/w、大约20%w/w、大约20.5%w/w、大约21%w/w、大约21.5%w/w或大约22%w/w。在一实施方案中,淀粉的量是大约20%w/w。
[0130]
在一实施方案中,淀粉与甘露醇的重量比是大约1:3至大约1:4。在一实施方案中,淀粉与甘露醇的重量比是大约1:3、大约1:3.1、大约1:3.2、大约1:3.3、大约1:3.4、大约1:3.5、大约1:3.6、大约1:3.7、大约1:3.8、大约1:3.9或大约1:4。在一实施方案中,淀粉与甘露醇的重量比是大约1:3.6。
[0131]
在一实施方案中,崩解剂是交聚维酮。
[0132]
在一实施方案中,崩解剂的量是大约0%w/w至大约6%w/w(占药物组合物总重量的)。在一实施方案中,崩解剂的量是大约l%w/w至大约5%w/w。在一实施方案中,崩解剂的量是大约2%w/w至大约4%w/w。
[0133]
在一实施方案中,崩解剂的量是大约0%w/w、大约1%w/w、大约2%w/w、大约3%w/w、大约4%w/w、大约5%w/w或大约6%w/w。在一实施方案中,崩解剂的量是大约3%w/w。在一实施方案中,崩解剂的量是大约0%w/w(即药物组合物不含崩解剂)。
[0134]
在一实施方案中,崩解剂是大约3%w/w量的交聚维酮。
[0135]
在一实施方案中,助流剂是二氧化硅。在一实施方案中,助流剂是胶体二氧化硅。
[0136]
在一实施方案中,助流剂是亲水性助流剂。在一实施方案中,助流剂具有大约200m2/g的表面积。在一实施方案中,助流剂是aerosil 200。
[0137]
在一实施方案中,助流剂的量是大约0%w/w至大约2%w/w(占药物组合物总重量的)。在一实施方案中,助流剂的量是大约0.25%w/w至大约1.75%w/w。在一实施方案中,助流剂的量是大约0.5%w/w至大约1.5%w/w。在一实施方案中,助流剂的量是大约0.75%w/w至大约1.25%w/w。
[0138]
在一实施方案中,助流剂的量是大约0%w/w、大约0.1%w/w、大约0.2%w/w、大约0.25%w/w、大约0.3%w/w、大约0.4%w/w、大约0.5%w/w、大约0.55%w/w、大约0.6%w/w、大约0.65%w/w、大约0.7%w/w、大约0.75%w/w、大约0.8%w/w、大约0.85%w/w、大约0.9%w/w、大约0.95%w/w、大约1%w/w、大约1.05%w/w、大约1.1%w/w、大约1.15%w/w、大约1.2%w/w、大约1.25%w/w、大约1.3%w/w、大约1.35%w/w、大约1.4%w/w、大约1.45%w/w、大约1.5%w/w、大约1.6%w/w、大约1.7%w/w、大约1.75%w/w、大约1.8%w/w、大约1.9%w/w或大约2%w/w。在一实施方案中,助流剂的量是大约1%w/w。在一实施方案中,助流剂的量是大约0%w/w(即药物组合物不含助流剂)。
[0139]
在一实施方案中,助流剂是大约1%w/w的量的二氧化硅。
[0140]
在一实施方案中,润滑剂是硬脂富马酸钠、硬脂酸或硬脂酸镁。在一实施方案中,润滑剂是硬脂富马酸钠。在一实施方案中,润滑剂是硬脂酸。在一实施方案中,润滑剂是硬脂酸镁。
[0141]
在一实施方案中,润滑剂的量是大约0%w/w至大约10%w/w(占药物组合物的总重量)。在一实施方案中,润滑剂的量是大约1.5%w/w至大约7.5%w/w。在一实施方案中,润滑剂的量是大约2%w/w至大约6%w/w。在一实施方案中,润滑剂的量是大约2%w/w至大约4%w/w。在一实施方案中,润滑剂的量是大约3%w/w至大约5%w/w。在一实施方案中,润滑剂的量是大约4%w/w至大约6%w/w。
[0142]
在一实施方案中,润滑剂的量是大约0%w/w、大约0.5%w/w、大约1%w/w、大约1.5%w/w、大约2%w/w、大约2.5%w/w、大约3%w/w、大约3.5%w/w、大约4%w/w、大约4.5%w/w、大约5%w/w、大约5.5%w/w、大约6%w/w、大约6.5%w/w、大约7%w/w、大约7.5%w/w、大约8%w/w、大约8.5%w/w、大约9%w/w、大约9.5%w/w或大约10%w/w。在一实施方案中,润滑剂的量是大约3%w/w。在一实施方案中,润滑剂的量是大约5%w/w。
[0143]
在一实施方案中,润滑剂是大约3%w/w的量的硬脂富马酸钠。
[0144]
在一实施方案中,润滑剂是大约5%w/w的量的硬脂酸。
[0145]
在一实施方案中,本文提供了药物组合物,其包含:1)化合物1的盐酸盐(例如形式a),其量为大约0.1%w/w至大约0.2%w/w;2)甘露醇,其量为大约71%w/w至大约74%w/w,以及预胶化淀粉,其量为大约19%w/w至大约21%w/w;3)交聚维酮,其量为大约2%w/w至大约4%w/w;4)二氧化硅,其量为大约0.5%w/w至大约1.5%w/w;5)硬脂富马酸钠,其量为大约2%w/w至大约4%w/w。在一实施方案中,本文提供了药物组合物,其包含:1)化合物1的盐酸盐(例如形式a),其量为大约0.14%w/w;2)大约72.86%w/w的量的甘露醇和大约20%w/w的量的预胶化淀粉;3)大约3%w/w的量的交聚维酮;4)大约1%w/w的量的二氧化硅;和5)大约3%w/w量的硬脂富马酸钠。在一实施方案中,药物组合物具有大约75mg的总重量。在一实
施方案中,药物组合物包含在4号胶囊中。
[0146]
在一实施方案中,本文提供了药物组合物,其包含:1)化合物1的盐酸盐(例如形式a),其量为大约0.6%w/w至大约0.8%w/w;2)甘露醇,其量为大约71%w/w至大约74%w/w,以及预胶化淀粉,其量为大约19%w/w至大约21%w/w;3)交聚维酮,其量为大约2%w/w至大约4%w/w;4)二氧化硅,其量为大约0.5%w/w至大约1.5%w/w;和5)硬脂富马酸钠,其量为大约2%w/w至大约4%w/w。在一实施方案中,本文提供了药物组合物,其包含:1)大约0.71%w/w的量的化合物1的盐酸盐(例如形式a);2)大约72.29%w/w的量的甘露醇和大约20%w/w的量的预胶化淀粉;3)大约3%w/w的量的交聚维酮;4)大约1%w/w的量的二氧化硅;和5)大约3%w/w量的硬脂富马酸钠。在一实施方案中,药物组合物具有大约75mg的总重量。在一实施方案中,药物组合物包含在4号胶囊中。在一实施方案中,药物组合物具有大约225mg的总重量。在一实施方案中,药物组合物包含在1号胶囊中。
[0147]
在一实施方案中,本文提供了药物组合物,其包含:1)化合物1的盐酸盐(例如形式a),其量为大约0.1%w/w至大约0.2%w/w;2)甘露醇,其量为大约71%w/w至大约74%w/w,以及预胶化淀粉,其量为大约19%w/w至大约21%w/w;3)交聚维酮,其量为大约2%w/w至大约4%w/w;和4)硬脂酸,其量为大约4%w/w至大约6%w/w。在一实施方案中,本文提供了药物组合物,其包含:1)大约0.14%w/w的量的化合物1的盐酸盐(例如形式a);2)大约71.86%w/w的量的甘露醇和大约20%w/w的量的预胶化淀粉;3)大约3%w/w的量的交聚维酮;和4)大约5%w/w量的硬脂酸。
[0148]
在一实施方案中,本文提供了药物组合物,其包含:1)化合物1的盐酸盐(例如形式a),其量为大约0.1%w/w至大约0.2%w/w;2)甘露醇,其量为大约74%w/w至大约77%w/w,以及预胶化淀粉,其量为大约19%w/w至大约21%w/w;3)交聚维酮,其量为大约2%w/w至大约4%w/w;和4)硬脂酸镁,其量为大约0.5%w/w至大约1.5%w/w。在一实施方案中,本文提供了药物组合物,其包含:1)大约0.14%w/w的量的化合物1的盐酸盐(例如形式a);2)大约75.86%w/w的量的甘露醇和大约20%w/w的量的预胶化淀粉;3)大约3%w/w的量的交聚维酮;和4)大约1%w/w的量的硬脂酸镁。
[0149]
(c)基于甘露醇-纤维素的药物组合物
[0150]
在一实施方案中,本文提供的药物组合物中的载体或稀释剂是甘露醇和纤维素的混合物。在一实施方案中,药物组合物还包括崩解剂、助流剂、润滑剂或其混合物。
[0151]
在一实施方案中,本文提供了一种药物组合物,其包含:1)大约0.05%w/w至大约0.2%w/w的量的化合物1或其对映体、对映体混合物、互变异构体、同位素体或药学上可接受的盐;2)大约85%w/w至大约99.7%w/w的量的甘露醇和纤维素的混合物;3)大约0%w/w至大约6%w/w的量的崩解剂;和4)大约0%w/w至大约10%w/w的量的润滑剂。
[0152]
在一实施方案中,本文提供了一种药物组合物,其包含:1)大约0.1%w/w至大约0.2%w/w的量的化合物1的盐酸盐(例如形式a);2)大约72%w/w至大约75%w/w的量的甘露醇,以及大约19%w/w至大约21%w/w的量的微晶纤维素;3)大约2%w/w至大约4%w/w的量的交聚维酮;和4)大约2%w/w至大约4%w/w的量的硬脂富马酸钠。在一实施方案中,本文提供了一种药物组合物,其包含:1)大约0.14%w/w的量的化合物1的盐酸盐(例如形式a);2)大约73.8%w/w的量的甘露醇,以及大约20%w/w的量的微晶纤维素;3)大约3%w/w的量的交聚维酮;和4)大约3%w/w的量的硬脂富马酸钠。
[0153]
在一实施方案中,本文提供了一种药物组合物,其包含:1)大约0.1%w/w至大约0.2%w/w的量的化合物1的盐酸盐(例如形式a);2)大约70%w/w至大约73%w/w的量的甘露醇,以及大约19%w/w至大约21%w/w的量的微晶纤维素;3)大约2%w/w至大约4%w/w的量的交聚维酮;和4)大约4%w/w至大约6%w/w的量的硬脂酸。在一实施方案中,本文提供了一种药物组合物,其包含:1)大约0.14%w/w的量的化合物1的盐酸盐(例如形式a);2)大约71.86%w/w的量的甘露醇,以及大约20%w/w的量的微晶纤维素;3)大约3%w/w的量的交聚维酮;和4)大约5%w/w的量的硬脂酸。
[0154]
(d)基于纤维素的药物组合物
[0155]
在一实施方案中,本文提供的药物组合物中的载体或稀释剂是纤维素。在一实施方案中,药物组合物还包括崩解剂、助流剂、润滑剂或其混合物。
[0156]
在一实施方案中,本文提供了一种药物组合物,其包含:1)大约0.05%w/w至大约2%w/w的量的化合物1或其对映体、对映体混合物、互变异构体、同位素体或药学上可接受的盐;2)大约75%w/w至大约95%w/w的量的纤维素;3)大约0%w/w至大约20%w/w的量的崩解剂;和4)大约0%w/w至大约10%w/w的量的润滑剂。
[0157]
在一实施方案中,本文提供了一种药物组合物,其包含:1)大约0.1%w/w至大约0.2%w/w的量的化合物1的盐酸盐(例如形式a);2)大约82%w/w至大约87%w/w的量的微晶纤维素;3)大约8%w/w至大约12%w/w的量的交聚维酮;和4)大约4%w/w至大约6%w/w的量的硬脂酸。在一实施方案中,本文提供了一种药物组合物,其包含:1)大约0.14%w/w的量的化合物1的盐酸盐(例如形式a);2)大约84.86%w/w的量的微晶纤维素;3)大约10%w/w的量的交聚维酮;和4)大约5%w/w的量的硬脂酸。
[0158]
(e)药物组合物的其他实施方案
[0159]
在一实施方案中,本文提供的药物组合物可以任选地进一步包含一种或多种其他赋形剂。其他赋形剂包括但不限于润湿剂、增溶剂、结晶稳定剂、抗粘附剂和沉淀抑制剂。
[0160]
在一实施方案中,将本文提供的药物组合物配制为胶囊。在一实施方案中,所述胶囊是hpmc胶囊。
[0161]
通常,将组合物配制成单一剂量施用。为了配制组合物,将重量分数的化合物以有效浓度(以便缓解或改善治疗的病症)溶解、悬浮、分散或以其他方式混合在选择的溶媒中。适于本文提供的化合物施用的药物载体或溶媒包括本领域技术人员已知的适用于特定的施用模式的任何此类载体。
[0162]
此外,可将所述化合物配制为组合物中的唯一药学活性成分,或可与其他活性成分组合。脂质体混悬液,包括组织靶向脂质体例如肿瘤靶向脂质体,也可以适合作为药学上可接受的载体。这些可以根据本领域技术人员已知的方法制备。例如,可以如本领域已知的那样制备脂质体制剂。简言之,可通过在烧瓶内侧上干燥卵磷脂酰胆碱和脑磷脂酰丝氨酸(7:3摩尔比)而形成脂质体例如多层囊泡(mlv's)。加入本文提供的化合物在缺乏二价阳离子的磷酸盐缓冲液(pbs)中的溶液并且摇动瓶子,直到将脂质膜分散。冲洗得到的囊泡,以除去未包裹的化合物,离心沉淀,然后重新悬浮在pbs中。
[0163]
将活性化合物包括在药学上可接受的载体中,其量足以在没有不希望的副作用的情况下,对治疗患者发挥治疗上有用的作用。可以通过在本文所述的体外和体内系统中测试化合物来确定治疗有效浓度,然后从其推断出用于人类的剂量。
[0164]
药物组合物中活性化合物的浓度将取决于活性化合物的吸收、组织分布、失活、代谢和排泄率,化合物的物理化学性质,剂量方案和施用量,以及本领域技术人员已知的其他因素。
[0165]
用于肠胃外、皮内、皮下或局部施用的溶液剂或混悬剂可包括下列任何一种成分:无菌稀释剂例如注射用水、盐水、固定油、聚乙二醇、甘油、丙二醇、二甲基乙酰胺或其他合成溶剂;抗菌剂例如苯甲醇和对羟基苯甲酸甲酯;抗氧化剂例如抗坏血酸和亚硫酸氢钠;螯合剂例如乙二胺四乙酸(edta);缓冲剂例如乙酸盐、柠檬酸盐和磷酸盐;和调节张力的物质例如氯化钠或葡萄糖。可以将肠胃外制剂封装在安瓿、笔、一次性注射器或者玻璃、塑料或其他合适材料制成的单剂量或多剂量小瓶中。
[0166]
在化合物表现出溶解不足的情况下,可以使用用于增溶化合物的方法。所述方法是本领域技术人员已知的,并且包括但不限于使用共溶剂例如二甲亚砜(dmso),使用表面活性剂例如或溶解于碳酸氢钠水溶液中。
[0167]
在混合或添加化合物时,所得混合物可以是溶液、混悬液、乳液等。所得混合物的形式取决于许多因素,包括预期的施用方式和化合物在所选载体或溶媒中的溶解度。有效浓度足以改善所治疗的疾病、疾患或病症的症状,并可根据经验确定。
[0168]
将药物组合物以含有适量所述化合物或其药学上可接受的盐的单位剂型例如片剂、胶囊、丸剂、散剂、颗粒剂、无菌肠胃外溶液剂或混悬剂,以及口服溶液剂或混悬剂和油水乳剂提供,用于施用至人和动物。药物治疗活性化合物及其盐以单位剂量形式或多剂量形式配制和施用。本文所用的单位剂量形式是指适合人类和动物个体的物理离散单位,并根据本领域已知将其单独包装。每个单位剂量包含预定量、足以产生所需治疗效果的治疗活性化合物,以及所需的药物载体、溶媒或稀释剂。单位剂量形式的示例包括安瓿和注射器,以及单独包装的片剂或胶囊。可以将单位剂量形式分次或多次施用。多剂量形式是包装在单个容器中的多个相同的单位剂型,以分隔的单位剂量形式施用。多剂量形式的示例包括片剂或胶囊的小瓶、瓶或者品脱瓶或加仑瓶。因此,多剂量形式是在包装中未分隔的多个单位剂量。
[0169]
可以制备含有0.005%至100%活性成分的剂型或组合物,其剩余部分由无毒性载体组成。对于口服施用,药学上可接受的无毒性组合物是通过掺入任何通常所用的赋形剂形成的,所述赋形剂例如药用级的甘露醇、乳糖、淀粉、硬脂酸镁、滑石粉、纤维素衍生物、交联羧甲基纤维素钠、葡萄糖、蔗糖、碳酸镁或糖精钠。所述组合物包括溶液剂、混悬剂、片剂、胶囊、散剂和缓释制剂,例如但不限于植入物和微囊化递送系统,以及可生物降解的生物相容性聚合物,例如胶原、乙烯醋酸乙烯酯、聚酸酐、聚乙醇酸、聚原酸酯、聚乳酸等。所述组合物的制备方法是本领域技术人员已知的。
[0170]
活性化合物或药学上可接受的盐可与载体一起制备,所述载体可保护化合物免于迅速从体内排出,例如缓释制剂或包衣。
[0171]
组合物可包括其它活性化合物,以获得所需的性质组合。本文提供的化合物或本文所述的其药学上可接受的盐,也可有利地与在通用技术中已知的在治疗上述一种或多种疾病或医学病症(例如与氧化应激相关的疾病)方面有价值的另一种药物一起用于治疗或预防目的。应当理解,所述联合疗法构成了本文提供的组合物和治疗方法的另一个方面。
[0172]
(d)制备剂型的方法
[0173]
可通过任何药学方法制备本文提供的药物组合物(剂型),但所有方法包括使活性成分与赋形剂联合的步骤,该赋形剂构成一种或多种必要成分。通常,通过均匀混合(例如直接混合)活性成分与液体赋形剂或细碎的固体赋形剂或两者而制备组合物,然后,如有必要,将产品塑形成所需的外观(例如压紧(compaction),诸如碾压(roller-compaction))。如果需要,可将片剂用标准的含水或无水技术包衣。
[0174]
本文提供的剂型可以通过压制或模制制备,任选地含一种或多种辅助成分。压制的片剂可以通过在适当的机器中压制自由流动形式(例如粉末或颗粒)的活性成分而制备,所述活性成分任选地混合有如上所述的赋形剂和/或表面活性剂或分散剂。模制片剂可通过在适当的机器中模制用惰性液体稀释剂润湿的粉末状化合物的混合物而制成。本文提供的剂型的封装可利用羟丙基甲基纤维素、海藻酸钙或明胶胶囊完成。
[0175]
在一些实施方案中,将活性成分和赋形剂直接混合并装入例如胶囊中,或直接压制成片剂。
[0176]
在一些实施方案中,本文提供的剂型或药物组合物通过湿法制粒方法制备。在一实施方案中,湿法制粒方法包括下述步骤:(i)将活性成分(例如化合物1或其对映体、对映体混合物、互变异构体、同位素体或药学上可接受的盐)与第一部分赋形剂(颗粒内赋形剂)和水混合,以形成湿颗粒;(ii)干燥,然后研磨(例如通过comil)颗粒;和(iii)将研磨的颗粒与剩余的赋形剂(颗粒外赋形剂)混合,以形成最终的混合物。在一实施方案中,该方法之后是封装(encapsulation)步骤。
[0177]
在一实施方案中,所述颗粒内赋形剂包括粘合剂(例如淀粉)和崩解剂(例如交聚维酮),并且颗粒外赋形剂包括稀释剂(例如甘露醇)和润滑剂(例如硬脂酸)。在一实施方案中,颗粒内赋形剂/颗粒外赋形剂的比率不超过大约33:67。在一实施方案中,颗粒内赋形剂/颗粒外赋形剂的比率不超过大约23:77。在一实施方案中,颗粒内赋形剂/颗粒外赋形剂的比率约为23:77。
[0178]
在一实施方案中,在步骤(i)之前,将活性成分通过60目(250μm)筛网或具有更小孔径的筛网。
[0179]
在一实施方案中,研磨的颗粒的粒度(例如通过d50测量的)匹配(例如在
±
10%、
±
20%或
±
30%内)颗粒外赋形剂(例如稀释剂,诸如甘露醇)主要成分的粒度。
[0180]
在一些实施方案中,本文提供的剂型或药物组合物通过碾压方法制备。在一实施方案中,碾压法包括下述步骤:(i)将活性成分(例如化合物1或其对映体、对映体混合物、互变异构体、同位素体或药学上可接受的盐)与第一部分赋形剂(颗粒内赋形剂)混合,以形成颗粒内混合物;(ii)将颗粒内混合物通过碾压机,以形成干颗粒;和(iii)将干颗粒与剩余的赋形剂(颗粒外赋形剂)混合,以形成最终的混合物。在一实施方案中,步骤(i)包括将活性成分与一小部分粘合剂(例如淀粉)预混合,然后将其与剩余的颗粒内赋形剂混合。在一实施方案中,该方法之后是封装步骤。
[0181]
在一实施方案中,在步骤(i)之前,将活性成分通过60目(250μm)筛网或具有更小孔径的筛网。
[0182]
在一实施方案中,所述颗粒内赋形剂包括粘合剂(例如淀粉)、稀释剂(例如甘露醇)、崩解剂(例如交聚维酮)、助流剂(例如二氧化硅)和润滑剂(例如硬脂富马酸钠),而颗粒外赋形剂包括助流剂(例如二氧化硅)和润滑剂(例如硬脂富马酸钠)。在一实施方案中,
颗粒内赋形剂/颗粒外赋形剂的比率不小于大约67:33。在一实施方案中,颗粒内赋形剂/颗粒外赋形剂的比率不小于大约98:2。在一实施方案中,颗粒内赋形剂/颗粒外赋形剂的比率约为98:2。
[0183]
5.3使用方法
[0184]
在一实施方案中,本文提供了治疗血液恶性肿瘤的方法,其包括向患者施用治疗有效量的本文提供的药物组合物。
[0185]
在一实施方案中,本文提供了预防血液恶性肿瘤的方法,其包括向患者施用治疗有效量的本文提供的药物组合物。
[0186]
在一实施方案中,本文提供了管理血液恶性肿瘤的方法,其包括向患者施用治疗有效量的本文提供的药物组合物。
[0187]
在一实施方案中,血液恶性肿瘤是白血病。
[0188]
在一实施方案中,血液恶性肿瘤是急性髓细胞白血病。在一实施方案中,急性髓细胞白血病是b-细胞急性髓细胞白血病。
[0189]
在一实施方案中,血液恶性肿瘤是急性淋巴细胞白血病。
[0190]
在一实施方案中,血液恶性肿瘤是慢性淋巴细胞白血病/小淋巴细胞淋巴瘤。
[0191]
在一实施方案中,血液恶性肿瘤是骨髓瘤。
[0192]
在一实施方案中,血液恶性肿瘤是多发性骨髓瘤。在一实施方案中,多发性骨髓瘤是浆细胞白血病(pcl)。
[0193]
在一实施方案中,血液恶性肿瘤是淋巴瘤。
[0194]
在一实施方案中,血液恶性肿瘤是非霍奇金淋巴瘤。
[0195]
在一实施方案中,血液恶性肿瘤是弥漫性大b-细胞淋巴瘤。
[0196]
在一实施方案中,血液恶性肿瘤是t-细胞淋巴瘤。在一实施方案中,t-细胞淋巴瘤是间变性大细胞淋巴瘤(alcl)。在一实施方案中,t-细胞淋巴瘤是sezary综合征。
[0197]
在一实施方案中,血液恶性肿瘤是伯基特淋巴瘤。
[0198]
在一实施方案中,血液恶性肿瘤是边缘区淋巴瘤。在一实施方案中,边缘区淋巴瘤是脾边缘区淋巴瘤(smzl)。
[0199]
在一实施方案中,血液恶性肿瘤是霍奇金淋巴瘤。
[0200]
在一实施方案中,血液恶性肿瘤是骨髓增生异常综合征。
[0201]
在一实施方案中,血液恶性肿瘤是新诊断的。在一实施方案中,血液恶性肿瘤是复发或难治的。
[0202]
在一实施方案中,aml是新诊断的aml。在一实施方案中,aml为复发或难治的aml。在一实施方案中,b-细胞aml是新诊断的b-细胞aml。在一实施方案中,b-细胞aml是复发的或难治的b-细胞aml。
[0203]
在一实施方案中,all是新诊断的all。在一实施方案中,all为复发或难治的all。
[0204]
在一实施方案中,mm是新诊断的mm。在一实施方案中,mm为复发或难治的mm。在一实施方案中,pcl是新诊断的pcl。在一实施方案中,pcl为复发或难治的pcl。
[0205]
在一实施方案中,hl是新诊断的hl。在一实施方案中,hl为复发或难治的hl。
[0206]
在一实施方案中,nhl是新诊断的nhl。在一实施方案中,nhl为复发或难治的nhl。
[0207]
在一实施方案中,tcl是新诊断的tcl。在一实施方案中,tcl为复发或难治的tcl。
在一实施方案中,alcl是新诊断的alcl。在一实施方案中,alcl为复发或难治的alcl。在一实施方案中,sezary综合征是新诊断的sezary综合征。在一实施方案中,sezary综合征是复发或难治的sezary综合征。
[0208]
在一实施方案中,bl是新诊断的bl。在一实施方案中,bl为复发或难治的bl。
[0209]
在一实施方案中,mzl是新诊断的mzl。在一实施方案中,mzl为复发或难治的mzl。在一实施方案中,smzl是新诊断的smzl。在一实施方案中,smzl为复发或难治的smzl。
[0210]
在一实施方案中,mds是新诊断的mds。在一实施方案中,mds为复发或难治的mds。
[0211]
在一实施方案中,本文提供了在患者中实现完全响应、部分响应或疾病稳定的方法,其包括向患有本文提供的血液恶性肿瘤的患者施用治疗有效量的本文提供的药物组合物。在一实施方案中,本文提供了用于实现患者总生存期、无进展生存期、无事件生存期、至进展时间或无病生存期的增加的方法,其包括向患有本文提供的血液恶性肿瘤的患者施用治疗有效量的本文提供的药物组合物。在一实施方案中,本文提供了实现患者总生存期增加的方法,其包括向患有本文提供的血液恶性肿瘤的患者施用治疗有效量的本文提供的药物组合物。在一实施方案中,本文提供了实现患者无进展生存期增加的方法,其包括向患有本文提供的血液恶性肿瘤的患者施用治疗有效量的本文提供的药物组合物。在一实施方案中,本文提供了实现患者无事件生存期增加的方法,其包括向患有本文提供的血液恶性肿瘤的患者施用治疗有效量的本文提供的药物组合物。在一实施方案中,本文提供了实现患者至进展时间增加的方法,其包括向患有本文提供的血液恶性肿瘤的患者施用治疗有效量的本文提供的药物组合物。在一实施方案中,本文提供了实现患者无病生存期增加的方法,其包括向患有本文提供的血液恶性肿瘤的患者施用治疗有效量的本文提供的药物组合物。在一实施方案中,血液恶性肿瘤是aml(例如b-细胞aml)。在一实施方案中,血液恶性肿瘤是all。在一实施方案中,血液恶性肿瘤是cll/sll。在一实施方案中,血液恶性肿瘤是mm。在一实施方案中,血液恶性肿瘤是pcl。在一实施方案中,血液恶性肿瘤是nhl。在一实施方案中,血液恶性肿瘤是dlbcl。在一实施方案中,血液恶性肿瘤是tcl(例如alcl或sezary综合征)。在一实施方案中,血液恶性肿瘤是伯基特淋巴瘤。在一实施方案中,血液恶性肿瘤是hl。在一实施方案中,血液恶性肿瘤是mzl(例如smzl)。在一实施方案中,血液恶性肿瘤是mds。
[0212]
在一实施方案中,本文提供了治疗aml的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,aml是b-细胞aml。
[0213]
在一实施方案中,本文提供了预防aml的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,aml是b-细胞aml。
[0214]
在一实施方案中,本文提供了管理aml的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,aml是b-细胞aml。
[0215]
在一实施方案中,本文提供了治疗all的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0216]
在一实施方案中,本文提供了预防all的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0217]
在一实施方案中,本文提供了管理all的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0218]
在一实施方案中,本文提供了治疗mm的方法,其包括向需要其的个体施用治疗有
效量的本文提供的药物组合物。
[0219]
在一实施方案中,本文提供了预防mm的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0220]
在一实施方案中,本文提供了管理mm的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0221]
在一实施方案中,本文提供了治疗pcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0222]
在一实施方案中,本文提供了预防pcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0223]
在一实施方案中,本文提供了管理pcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0224]
在一实施方案中,本文提供了治疗tcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,tcl是alcl。在一实施方案中,tcl是sezary综合征。
[0225]
在一实施方案中,本文提供了预防tcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,tcl是alcl。在一实施方案中,tcl是sezary综合征。
[0226]
在一实施方案中,本文提供了管理tcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,tcl是alcl。在一实施方案中,tcl是sezary综合征。
[0227]
在一实施方案中,本文提供了治疗bl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0228]
在一实施方案中,本文提供了预防bl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0229]
在一实施方案中,本文提供了管理bl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0230]
在一实施方案中,本文提供了治疗hl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0231]
在一实施方案中,本文提供了预防hl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0232]
在一实施方案中,本文提供了管理hl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0233]
在一实施方案中,本文提供了治疗mzl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,mzl是smzl。
[0234]
在一实施方案中,本文提供了预防mzl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,mzl是smzl。
[0235]
在一实施方案中,本文提供了管理mzl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,mzl是smzl。
[0236]
在一实施方案中,本文提供了治疗mds的方法,其包括向需要其的个体施用治疗有
效量的本文提供的药物组合物。
[0237]
在一实施方案中,本文提供了预防mds的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0238]
在一实施方案中,本文提供了管理mds的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0239]
在一实施方案中,本文提供了将本文提供的药物组合物单独或与利妥昔单抗联合用于治疗、预防或管理非霍奇金淋巴瘤(nhl)的方法。
[0240]
在一实施方案中,本文提供了治疗nhl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0241]
在一实施方案中,本文提供了预防nhl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0242]
在一实施方案中,本文提供了管理nhl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0243]
在一实施方案中,nhl是dlbcl。在一实施方案中,dlbcl是原发性dlbcl。在一实施方案中,dlbcl是活化的b-细胞样dlbcl(abc-dlbcl)。在一实施方案中,dlbcl是生发中心(germinal center)b-细胞样dlbcl(gcb-dlbcl)。在一实施方案中,dlbcl是未分类的dlbcl。在一实施方案中,dlbcl是原发性纵隔b-细胞型dlbcl(pmbl dlbcl)。在一实施方案中,dlbcl是双重打击dlbcl(dhit dlbcl),也称为cmyc/bcl-2突变体dlbcl。在一实施方案中,dlbcl是三重打击dlbcl(thit dlbcl),也称为cmyc/bcl2/bcl6重排dlbcl。
[0244]
在一实施方案中,nhl是滤泡性淋巴瘤(fl)。
[0245]
在一实施方案中,nhl是套细胞淋巴瘤(mcl)。
[0246]
在一实施方案中,nhl是原发性中枢神经系统淋巴瘤(pcnsl)。
[0247]
在一实施方案中,nhl是复发的或难治的nhl。在一实施方案中,nhl是复发的nhl。在一实施方案中,nhl是难治的nhl。
[0248]
在某些实施方案中,nhl个体在达到完全响应(cr)后具有进展的放射学证据。在某些实施方案中,nhl个体对于最近包含全身治疗的方案获得低于cr,并且在先前的干细胞移植(sct)的小于或等于12个月内,有疾病活动或疾病进展或复发的放射学证据。
[0249]
在某些实施方案中,nhl个体的一种或多种疗法失败,并且不是其他疗法的候选者。在某些实施方案中,个体已经接受至少一种先前的治疗,并且不符合除本文所述的治疗方法以外的任何疗法。在某些实施方案中,个体在标准抗癌治疗后复发或进展。
[0250]
在某些实施方案中,个体已失败于至少一种现有疗法。在某些实施方案中,个体已失败于至少两种现有疗法。
[0251]
在一实施方案中,nhl是复发或难治的dlbcl。在一实施方案中,dlbcl是复发的dlbcl。在一实施方案中,dlbcl是难治的dlbcl。在一实施方案中,dlbcl是复发/难治的dlbcl。在一实施方案中,dlbcl是阿霉素难治的。在一实施方案中,dlbcl是阿霉素耐受的。在一实施方案中,dlbcl是利妥昔单抗、环磷酰胺、阿霉素、长春新碱、强的松、依托泊苷、苯达莫司汀、来那度胺、吉西他滨、地塞米松、异环磷酰胺、泊洛妥珠单抗(polatuxuab)或者car-t中的一种或多种难治的。
[0252]
在一实施方案中,dlbcl是用两种或两种以上的现有疗法治疗的。
[0253]
在一实施方案中,dlbcl是转化的淋巴瘤。在另一实施方案中,dlbcl不是另外指定的(nos)dlbcl。
[0254]
在一实施方案中,nhl是复发或难治的fl。在一实施方案中,fl是复发的fl。在一实施方案中,fl是难治的fl。
[0255]
在一实施方案中,将fl用一种或多种现有疗法治疗。在一实施方案中,将fl用两种或更多种现有疗法治疗。
[0256]
在一实施方案中,nhl是复发或难治的mcl。在一实施方案中,mcl是复发的mcl。在一实施方案中,mcl是难治的mcl。
[0257]
在一实施方案中,将mcl用一种或多种现有疗法治疗。在一实施方案中,将mcl用两种或更多种现有疗法治疗。
[0258]
在一实施方案中,nhl是复发或难治的pcnsl。在一实施方案中,pcnsl是复发的pcnsl。在一实施方案中,pcnsl是难治的pcnsl。
[0259]
在某些实施方案中,nhl是新诊断的nhl。在某些实施方案中,nhl是新诊断的弥漫性大b-细胞淋巴瘤。在某些实施方案中,nhl是新诊断的滤泡性淋巴瘤。在某些实施方案中,nhl是新诊断的套细胞淋巴瘤。在某些实施方案中,nhl是新诊断的原发性中枢神经系统淋巴瘤。
[0260]
在某些实施方案中,本文提供的方法进一步包括向个体施用治疗有效量的利妥昔单抗。
[0261]
在一实施方案中,将第二疗法(例如利妥昔单抗)施用至个体之前(例如5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周前),将本文提供的第一疗法(例如活性剂,诸如本文提供的药物组合物)施用。
[0262]
在一实施方案中,将本文提供的第一疗法(例如活性剂,诸如本文提供的药物组合物)与第二疗法(例如利妥昔单抗)同时施用至个体。
[0263]
在一实施方案中,将第二疗法(例如利妥昔单抗)施用至个体之后(例如5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周后),将本文提供的第一疗法(例如活性剂,诸如本文提供的药物组合物)施用。
[0264]
在某些实施方案中,将利妥昔单抗根据当地批准的标签或用于制备、施用和贮存信息的药房手册施用。在某些实施方案中,将利妥昔单抗静脉内施用。在某些实施方案中,将利妥昔单抗皮下施用。在某些实施方案中,将利妥昔单抗通过iv注射或iv输注施用。在某些实施方案中,将利妥昔单抗通过iv输注施用。
[0265]
在某些实施方案中,将利妥昔单抗根据医生决定的量施用。在某些实施方案中,将利妥昔单抗每天施用一次或两次。在某些实施方案中,将利妥昔单抗以约50mg/m2至约1000mg/m2、约100mg/m2至约750mg/m2、约250mg/m2至约500mg/m2或者约300mg/m2至约400mg/m2的量施用。在某些实施方案中,将利妥昔单抗以每天375mg/m2的量施用。
[0266]
在一实施方案中,本文提供了治疗dlbcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0267]
在一实施方案中,本文提供了预防dlbcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0268]
在另一实施方案中,本文提供了管理dlbcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0269]
在一实施方案中,本文提供了治疗fl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0270]
在一实施方案中,本文提供了预防fl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0271]
在另一实施方案中,本文提供了管理fl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0272]
在一实施方案中,本文提供了治疗mcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0273]
在一实施方案中,本文提供了预防mcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0274]
在另一实施方案中,本文提供了管理mcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0275]
在一实施方案中,本文提供了治疗pcnsl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0276]
在一实施方案中,本文提供了预防pcnsl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0277]
在另一实施方案中,本文提供了管理pcnsl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0278]
在一实施方案中,本文提供了治疗复发或难治的dlbcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0279]
在一实施方案中,本文提供了预防复发或难治的dlbcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0280]
在另一实施方案中,本文提供了管理复发或难治的dlbcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0281]
在一实施方案中,本文提供了治疗复发或难治的fl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0282]
在一实施方案中,本文提供了预防复发或难治的fl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0283]
在另一实施方案中,本文提供了管理复发或难治的fl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0284]
在一实施方案中,本文提供了治疗复发或难治的mcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0285]
在一实施方案中,本文提供了预防复发或难治的mcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0286]
在另一实施方案中,本文提供了管理复发或难治的mcl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0287]
在一实施方案中,本文提供了治疗复发或难治的pcnsl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0288]
在一实施方案中,本文提供了预防复发或难治的pcnsl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0289]
在另一实施方案中,本文提供了管理复发或难治的pcnsl的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0290]
在另一实施方案中,本文提供了实现根据患者的卢加诺(lugano)响应标准所确定的完全响应、部分响应或疾病稳定的方法,其包括将治疗有效量的本文提供的药物组合物施用至患nhl的患者。在另一实施方案中,本文提供了在患者中实现总生存期、无进展生存期、无事件生存期、至进展时间或无病生存期增加的方法,其包括将治疗有效量的本文提供的药物组合物施用至患nhl的患者。在另一实施方案中,本文提供了实现患者总生存期增加的方法,其包括将治疗有效量的本文提供的药物组合物施用至患nhl的患者。在另一实施方案中,本文提供了实现患者无进展生存期增加的方法,其包括将治疗有效量的本文提供的药物组合物施用至患nhl的患者。在另一实施方案中,本文提供了实现患者无事件生存期增加的方法,其包括将治疗有效量的本文提供的药物组合物施用至患nhl的患者。在另一实施
方案中,本文提供了实现患者至进展时间增加的方法,其包括将治疗有效量的本文提供的药物组合物施用至患nhl的患者。在另一实施方案中,本文提供了实现患者无病生存期增加的方法,其包括将治疗有效量的本文提供的药物组合物施用至患nhl的患者。在一实施方案中,该方法还包括将治疗有效量的利妥昔单抗施用至个体。
[0291]
在一实施方案中,本文提供了将本文提供的药物组合物单独或与阿托珠单抗联合用于治疗、预防或管理慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(cll/sll)的方法。
[0292]
如本文所用且除非另外说明,“cll/sll”或“cll和/或sll”是指cll或sll、或者cll和sll。在一实施方案中,本文提供的方法用于治疗、预防或管理cll。在一实施方案中,本文提供的方法用于治疗、预防或管理sll。在一个实施方案中,本文提供的方法用于治疗、预防或管理cll和cll。
[0293]
在一实施方案中,本文提供了治疗cll/sll的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0294]
在一实施方案中,本文提供了预防cll/sll的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0295]
在一实施方案中,本文提供了管理cll/sll的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。
[0296]
在一实施方案中,cll/sll个体经历了一种或多种疗法的失败。在一实施方案中,个体经历了至少一种现有疗法的失败。在一实施方案中,个体经历了至少两种现有疗法的失败。在一实施方案中,个体先前已用布鲁顿(bruton)酪氨酸激酶(btk)抑制剂治疗。在一实施方案中,个体对btk抑制剂是复发或难治的。在一实施方案中,btk抑制剂是依布替尼。在一实施方案中,btk抑制剂是阿卡替尼。在一实施方案中,btk抑制剂是泽布替尼。在一实施方案中,btk抑制剂是替拉鲁替尼。
[0297]
在一实施方案中,cll/sll是新诊断的cll/sll。在一实施方案中,cll/sll是复发或难治的cll/sll(r/r cll/sll)。
[0298]
在一实施方案中,cll以突变的ighv(免疫球蛋白重链基因)为特征。在一实施方案中,cll以非突变的ighv为特征。
[0299]
在一实施方案中,cll以tp53(肿瘤蛋白53)中的一个或多个突变为特征。在一实施方案中,cll以野生型tp53为特征。
[0300]
在一实施方案中,cll以一个或多个细胞遗传学异常为特征:例如del(13q)、del(11q)、del(17p)、tri12、t(6;17)、del(11q22.3)、t(11;14)、del(18q)和t(14;19)。在一实施方案中,cll以del(17p)为特征。
[0301]
在一实施方案中,cll以里氏(richter)转变(也称为里氏综合征)为特征。
[0302]
在一实施方案中,本文提供的方法进一步包括将治疗有效量的阿托珠单抗施用至个体。
[0303]
在一实施方案中,将第二疗法(例如阿托珠单抗)施用至个体之前(例如5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、120小时、144小时、1周、2周、3周、4周、5周、6周、8周或12周前),将本文提供的第一疗法(例如活性剂,诸如本文提供的药物组合物)施用。
[0304]
在一实施方案中,将本文提供的第一疗法(例如活性剂,诸如本文提供的药物组合
物)与第二疗法(例如阿托珠单抗)同时施用至个体。
[0305]
在一实施方案中,将第二疗法(例如阿托珠单抗)施用至个体之后(例如5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、120小时、144小时、1周、2周、3周、4周、5周、6周、8周或12周后),将本文提供的第一疗法(例如活性剂,诸如本文提供的药物组合物)施用。
[0306]
在一实施方案中,将阿托珠单抗根据当地批准的标签或用于制备、施用和贮存信息的药房手册施用。在一实施方案中,将阿托珠单抗静脉内施用。在一实施方案中,将阿托珠单抗皮下施用。在一实施方案中,将阿托珠单抗通过静脉内(iv)注射或iv输注施用。在一实施方案中,将阿托珠单抗通过iv注射施用。在一实施方案中,将阿托珠单抗通过iv输注施用。
[0307]
在一实施方案中,将阿托珠单抗根据医生决定的量施用。在一实施方案中,将阿托珠单抗每天施用。在一实施方案中,将阿托珠单抗以约75mg/天至约1100mg/天的剂量施用。在一实施方案中,将阿托珠单抗以约75mg/天至约125mg/天、约800mg/天至约1000mg/天或者约900mg/天至约1100mg/天的剂量施用。在一实施方案中,将阿托珠单抗以每天约100mg的剂量施用。在一实施方案中,将阿托珠单抗以每天约900mg的剂量施用。在一实施方案中,将阿托珠单抗以每天约1000mg的剂量施用。在一实施方案中,将阿托珠单抗在第一个28-天周期的第1天以约100mg的剂量施用,在第一个28-天周期的第2天以约900mg的剂量施用,并且在第一个28-天周期的第8天和第15天,以及第2-6个28-天周期的第1天各自以约1000mg的剂量施用。在一实施方案中,将阿托珠单抗在第一个28-天周期的第1天和第2天以合并的约1000mg的剂量施用,并在第一个28-天周期的第8天和第15天、以及第2-6个28-天周期的第1天各自以约1000mg的剂量施用。可将阿托珠单抗施用超过6个周期。在一实施方案中,将阿托珠单抗在根据文中所述的第一个28-天周期施用,并在第2-12个28-天周期的第1天以约1000mg施用。在一实施方案中,将阿托珠单抗在根据文中所述的第一个28-天周期施用,并在第2-24个28-天周期的第1天以约1000mg施用。在一实施方案中,将阿托珠单抗在根据文中所述的第一个28-天周期施用,并在随后的28-天周期的第1天以约1000mg施用,直到疾病进展。
[0308]
在一实施方案中,本文提供了治疗新诊断的cll/sll的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的阿托珠单抗施用至个体。
[0309]
在一实施方案中,本文提供了预防新诊断的cll/sll的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的阿托珠单抗施用至个体。
[0310]
在一实施方案中,本文提供了管理新诊断的cll/sll的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的阿托珠单抗施用至个体。
[0311]
在一实施方案中,本文提供了治疗复发或难治的cll/sll的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的阿托珠单抗施用至个体。
[0312]
在一实施方案中,本文提供了预防复发或难治的cll/sll的方法,其包括向需要其
的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的阿托珠单抗施用至个体。
[0313]
在一实施方案中,本文提供了管理复发或难治的cll/sll的方法,其包括向需要其的个体施用治疗有效量的本文提供的药物组合物。在一实施方案中,该方法还包括将治疗有效量的阿托珠单抗施用至个体。
[0314]
在另一实施方案中,本文提供了在患者中实现根据国际慢性淋巴细胞白血病研讨会标准确定的完全响应、部分响应或疾病稳定的方法,其包括将治疗有效量的本文提供的药物组合物施用至患cll/sll的患者。在一实施方案中,微小残留病变(mrd)检测可以在接受骨髓评价的个体中进行,以确认完全响应(cr)。在一实施方案中,本文提供了用于在患者中实现微小残留病变(mrd)阴性的方法,其包括将治疗有效量的本文提供的药物组合物施用至患cll/sll的患者。在一实施方案中,在外周血和/或骨髓中测量mrd阴性。在一实施方案中,mrd阴性持续至少3个月。在另一实施方案中,本文提供了在患者中实现总生存期、无进展生存期、无事件生存期、至进展时间或无病生存期增加的方法,其包括将治疗有效量的本文提供的药物组合物施用至患cll/sll的患者。在另一实施方案中,本文提供了实现患者总生存期增加的方法,其包括将治疗有效量的本文提供的药物组合物施用至患cll/sll的患者。在另一实施方案中,本文提供了实现患者无进展生存期增加的方法,其包括将治疗有效量的本文提供的药物组合物施用至患cll/sll的患者。在另一实施方案中,本文提供了实现患者无事件生存期增加的方法,其包括将治疗有效量的本文提供的药物组合物施用至患cll/sll的患者。在另一实施方案中,本文提供了实现患者至进展时间增加的方法,其包括将治疗有效量的本文提供的化合物1药物组合物施用至患cll/sll的患者。在另一实施方案中,本文提供了实现患者无病生存期增加的方法,其包括将治疗有效量的本文提供的药物组合物施用至患cll/sll的患者。在一实施方案中,该方法还包括将治疗有效量的阿托珠单抗施用至个体。
[0315]
本文提供的方法包括治疗患者而不考虑患者的年龄。在一些实施方案中,个体年龄是18岁或更大。在其他实施方案中,个体年龄大于18岁、25岁、35岁、40岁、45岁、50岁、55岁、60岁、65岁或70岁。在其他实施方案中,个体年龄小于65岁。在其他实施方案中,个体年龄大于65岁。
[0316]
本文还提供了药物组合物,其用于治疗本文提供的疾病的方法中,其中所述方法包括将治疗有效量的药物组合物施用至患者。
[0317]
5.4施用途径
[0318]
可以将本文提供的药物组合物口服施用。在一实施方案中,当口服施用时,将本文提供的药物组合物与膳食和水一起施用。在另一实施方案中,将本文提供的药物组合物分散在水或果汁(例如苹果汁或橙汁)中,并作为溶液或混悬液口服施用。
[0319]
还可以将本文提供的药物组合物通过皮内、肌内、腹膜内、经皮、静脉内、皮下、鼻内、硬膜外、舌下、大脑内、阴道内、透皮、直肠、粘膜内施用,通过吸入施用或者局部施用至耳、鼻、眼或皮肤。施用方式由保健医生自行决定,并可部分取决于医学病症的部位。
[0320]
组合物可以是片剂、咀嚼片、胶囊剂、溶液剂、肠胃外溶液剂、锭剂、栓剂和混悬剂等形式。可将组合物配制成包含日剂量的剂量单位或方便的部分日剂量的剂量单位,其可以是单一片剂或胶囊剂或方便体积的液体。在一实施方案中,溶液由水溶性盐制备。通常,
所有组合物都是根据药物化学的已知方法制备的。
[0321]
取决于待治疗的疾病的状态和个体的状况,可将本文提供的药物组合物通过口服、肠胃外(例如肌内、腹膜内、静脉内、civ、脑池内注射或输注、皮下注射或植入)、吸入、鼻腔、阴道、直肠、舌下或局部(例如透皮或局部)施用途径施用。可将本文提供的药物组合物以适当剂量单位单独配制或与药学上可接受的赋形剂、载体、辅助剂和溶媒一起配制,适合于各施用途径。
[0322]
在一实施方案中,将本文提供的药物组合物口服施用。在另一实施方案中,将本文提供的药物组合物肠胃外施用。还在另一实施方案中,将本文提供的药物组合物静脉内施用。
[0323]
可将本文提供的药物组合物作为单一剂量施用,例如单次快速推注或口服胶囊、片剂或丸剂;或者历经一段时间施用,例如历经一段时间的连续输注或历经一段时间的分次推注剂量。如果需要,可将本文提供的药物组合物重复施用,例如直到患者经历稳定的疾病或消退,或者直到患者经历疾病进展或不可接受的毒性。
[0324]
可以将本文提供的药物组合物,每日一次(qd)施用,或分成多个日剂量例如每日两次(bid)、每日3次(tid)和每日4次(qid)施用。此外,施用可以是连续的(即每天施用,连续几天或每天)、间歇的例如周期性(即包括几天、几周或几个月没有药物的休息)。如本文所用,术语“每日”旨在表示治疗化合物例如本文提供的药物组合物,每天施用一次或多于一次,例如持续一段时间。术语“连续的”意指治疗化合物例如本文提供的药物组合物,每天施用,持续至少7天到52周的不间断时期。本文所用的术语“间歇的”或“间歇地”意指以规则或不规则的间隔停止和开始。例如,本文提供的药物组合物的间歇施用是每周施用1-6天,按周期施用(例如每天施用,持续2-8周,然后休息一段时间(无施用),至多一周)或隔日施用。本文所用的术语“周期”预期意指治疗化合物,例如本文提供的药物组合物每天施用,或连续施用,但休息一段时间。
[0325]
在一些实施方案中,施用频率在约日剂量至约月剂量的范围内。在某些实施方案中,施用是每天一次、每天两次、每天三次、每天四次、隔天一次、每周两次、每周一次、每两周一次、每三周一次或每四周一次。在一实施方案中,将本文提供的药物组合物每天施用一次。在另一实施方案中,将本文提供的药物组合物每天施用两次。还在另一实施方案中,将本文提供的药物组合物每天施用三次。仍在另一实施方案中,将本文提供的药物组合物每天施用四次。
[0326]
在某些实施方案中,本文提供的方法包括在一个或多个7-天治疗周期中施用治疗有效量的本文提供的药物组合物。在另一实施方案中,本文提供的方法包括在7-天周期的第1-5天施用治疗有效量的本文提供的药物组合物。在另一实施方案中,本文提供的方法包括在7-天周期的第1-3天施用治疗有效量的本文提供的药物组合物。
[0327]
在某些实施方案中,本文提供的方法包括在一个或多个14-天治疗周期中施用治疗有效量的本文提供的药物组合物。在另一实施方案中,本文提供的方法包括在14-天周期的第1-7天施用治疗有效量的本文提供的药物组合物。在另一实施方案中,本文提供的方法包括在14-天周期的第1-10天施用治疗有效量的本文提供的药物组合物。
[0328]
在某些实施方案中,本文提供的方法包括在一个或多个28-天治疗周期中施用治疗有效量的本文提供的药物组合物。在另一实施方案中,本文提供的方法包括在28-天周期
的第1-21天施用治疗有效量的本文提供的药物组合物。在另一实施方案中,本文提供的方法包括在28-天周期的第1-5天、第8-12天、第15-19天和第22-26天施用治疗有效量的本文提供的药物组合物。在另一实施方案中,本文提供的方法包括在28-天周期的第1-10天和第15-24天施用治疗有效量的本文提供的药物组合物。
[0329]
在一实施方案中,将本文提供的药物组合物每天施用一次,持续5天,然后休息2天。在一实施方案中,将本文提供的药物组合物每天施用一次,持续3天,然后休息4天。在一实施方案中,将本文提供的药物组合物每天施用一次,持续7天,然后休息7天。在一实施方案中,将本文提供的药物组合物每天施用一次,持续10天,然后休息4天。在一实施方案中,将本文提供的药物组合物每天施用一次,持续21天,然后休息7天。
[0330]
在某些实施方案中,所述治疗包括在一个或多个治疗周期中施用治疗有效量的利妥昔单抗。在一实施方案中,将利妥昔单抗每7天施用一次。在一实施方案中,将利妥昔单抗每4周施用一次。在一实施方案中,将利妥昔单抗每8周施用一次。在一实施方案中,将利妥昔单抗在第一个28天周期的第1天、第8天、第15天和第22天施用,在第2-6个28天周期的第1天施用,然后每8周施用一次。
[0331]
在一实施方案中,所述治疗包括在一个或多个治疗周期中施用治疗有效量的阿托珠单抗。在一实施方案中,将阿托珠单抗每7天施用两次。在一实施方案中,将阿托珠单抗每周施用一次。在一实施方案中,将阿托珠单抗每4周施用一次。在一实施方案中,将阿托珠单抗在第一个28-天周期的第1天、第2天、第8天和第15天施用,并在第2-6个28-天周期的第1天施用。在一实施方案中,将阿托珠单抗在第2-12个28-天周期的第1天施用。在一实施方案中,将阿托珠单抗在第2-24个28-天周期的第1天施用。在一实施方案中,将阿托珠单抗在随后28-天周期的第1天施用,直到疾病进展。
[0332]
在一实施方案中,将阿托珠单抗在第一个28-天周期的第1天以约100mg的剂量施用,在第一个28-天周期的第2天以约900mg的剂量施用,并在第一个28-天周期的第8天和第15天各以约1000mg的剂量施用。在一实施方案中,将阿托珠单抗在第一个28-天周期的第1天和第2天以合并的约1000mg的剂量施用,并在第一个28-天周期的第8天和第15天各自以约1000mg的剂量施用。在一实施方案中,将阿托珠单抗在第2-6个28-天周期的第1天以约1000mg的剂量施用。在一实施方案中,将阿托珠单抗在第2-12个28-天周期的第1天以约1000mg的剂量施用。在一实施方案中,将阿托珠单抗在第2-24个28-天周期的第1天以约1000mg的剂量施用。在一实施方案中,将阿托珠单抗在随后的28-天周期的第1天以约1000mg的剂量施用,直到疾病进展。
[0333]
可以将本文所述的任何治疗周期重复至少1个周期、2个周期、3个周期、4个周期、5个周期、6个周期、7个周期、8个周期、9个周期、10个周期、11个周期、12个周期、13个周期、14个周期、15个周期、16个周期、17个周期、18个周期、19个周期、20个周期、21个周期、22个周期、23个周期、24个周期、25个周期、26个周期、27个周期、28个周期、29个周期、30个周期或更多个周期。在某些情况下,本文所述的治疗周期包括1个周期至约24个周期、约2个周期至约16个周期或约2个周期至约4个周期。在某些情况下,本文所述的治疗周期包括1个周期至约4个周期。在一些实施方案中,将治疗有效量的本文提供的药物组合物和/或利妥昔单抗施用1至13个28天的周期(例如约1年)。在一些实施方案中,将治疗有效量的本文提供的药物组合物和/或利妥昔单抗施用1至24个28天的周期(例如约2年)。在一些实施方案中,将治
1,3-二酮(0.727g,1.77mmol)的干燥nmp(6ml)溶液冷却至0℃,然后依次加入甲烷磺酰氯(0.275ml,3.35mmol)和diea(0.617ml,3.53mmol)。使反应混合物达到环境温度并搅拌18小时。将反应混合物缓慢加入到h2o(60ml)中,冷却至0℃,剧烈混合。将得到的悬浮液过滤,并将收集的固体用h2o和et2o洗涤。将固体溶解在etoac中,并将溶液用mgso4干燥,过滤并浓缩,提供为黄色固体的(s)-4-((4-(氯甲基)-2-氟苄基)氨基)-2-(2,6-二氧代哌啶-3-基)异吲哚啉-1,3-二酮(0.600g,79%)。lcms(esi)m/z 430.0[m h]
.
[0342]
(s)-2-(2,6-二氧代哌啶-3-基)-4-((2-氟-4-((3-吗啉代氮杂环丁烷-1-基)甲基)苄基)氨基)异吲哚啉-1,3-二酮:向(s)-4-((4-(氯甲基)-2-氟苄基)氨基)-2-(2,6-二氧代哌啶-3-基)异吲哚啉-1,3-二酮(300mg,0.698mmol)的干燥dmso(1.0ml)溶液中,加入4-(氮杂环丁烷-3-基)吗啉盐酸盐(125mg,0.698mmol)和diea(0.122ml,0.698mmol)。将反应混合物在环境温度搅拌18小时,并用dmso(1ml)稀释。将溶液经手性反相色谱纯化,得到(s)-2-(2,6-二氧代哌啶-3-基)-4-((2-氟-4-((3-吗啉代氮杂环丁烷-1-基)甲基)苄基)氨基)异吲哚啉-1,3-二酮(89mg,24%,97%ee)。lcms(esi)m/z 536.2[m h]
.
[0343]
6.2使用化合物1进行基于细胞的测定法
[0344]
下述是基于细胞的测定法的示例,这些方法可利用典型的非霍奇金淋巴瘤(nhl)细胞株,用于测定化合物1的抗增殖活性和凋亡作用。
[0345]
利用su-dhl-4细胞株的细胞增殖和生存能力测定法:下述示例性测定法利用dlbcl细胞株,例如处理后120小时的su-dhl-4细胞株(deutsche sammlon von mikroorganismen und zellkulturen gmbh[dsmz]):目录号acc-495)。可以将su-dhl-4的接种密度优化,以确保1536-孔板的测定线性。
[0346]
通过声学分配器(edc ats-100),将浓度增加的(0.5nm至10μm)化合物1以20-点稀释的方式(非均匀间隔的数据点),各自点进空的1536-孔板里。dmso浓度保持恒定,最终测试浓度为0.1%dmso。在测试之前,su-dhl-4细胞在含有10%fbs(胎牛血清:hyclone)的rpmi-1640(roswell park memorial institute-1640)培养基中生长,并在培养瓶中扩增,以提供足量的原料。然后,将细胞稀释至每孔500个细胞,体积为5μl,并直接加到滴入化合物的1536-孔板中。让细胞在37℃、5%co2下生长120小时。当细胞开始暴露于化合物时(t0),根据制造商(promega corporation,madison,wi)的说明,通过量化活细胞中存在的5
′‑
三磷酸腺苷(atp)产生的发光水平,以1体积:2体积比例通过细胞滴度-发光细胞活力测定(cell titer-luminescent cell viability assay),评估最初的活细胞数。120小时后,通过cell titer-评估处理细胞的细胞活力,并读取发光。所有的生长抑制曲线利用activity base(idbs,alameda,ca)进行处理和评估。利用四参数逻辑斯谛(logistic)模型(sigmoidal剂量-反应模型),计算细胞活力ic
50
值:
[0347]
y=(a ((b-a)/(1 ((c/x)^d))))
[0348]
其中:
[0349]
a=y
min
[0350]
b=y
max
[0351]
c=ec
50
[0352]
d=hill斜率
[0353]
ic
50
=当y=dmso对照的50%时,化合物的浓度
[0354]
y=以发光单位测量的细胞活力,和
[0355]
x=化合物浓度。
[0356]
发现化合物1在su-dhl-4细胞增殖测定中具有活性,ic
50
《0.2μm。
[0357]
利用血液细胞株的细胞增殖和活力测定:下述示例性抗增殖测定使用下述示例性血液细胞株。本文所述的化合物1的体外生长抑制活性利用384-孔流式细胞术测定来评价。
[0358]
表6.血液细胞株
[0359]
[0360]
(annexin v阳性和draq7阴性)和“晚期”(annexin v和draq7阳性)凋亡细胞gates的相对于dmso的凋亡百分比作图。通过graphpad prism 7.03上完成曲线下面积分析和利用log(激动剂)vs.标准化反应
–
变量斜率分析的非线性回归曲线拟合,计算凋亡曲线的auc、ec
50
(产生一半最大凋亡反应的化合物浓度)和y
max
(实现凋亡的最大百分比)值。
[0365]
将一组血液细胞株的剂量-反应增殖曲线和非线性曲线-拟合回归用于测定活细胞百分比的ic
50
、auc和e
max
(存活力的e
max
在低剂量时的100和高剂量时的0之间变化,后者对应于所有活细胞的抑制),并将剂量-反应凋亡曲线用于测定细胞凋亡百分比的ec
50
、auc和y
max
(细胞凋亡的y
max
在低剂量时的0和高剂量时的100之间变化,后者对应于所有细胞的死亡)。将肿瘤细胞暴露于连续稀释(0.00015μm至10μm)的化合物1或二甲基亚砜(dmso)对照,持续5天。用annexin v/7-氨基放线菌素d(7-aad)流式细胞仪检测所有细胞株的存活力和凋亡。化合物1在几乎所有测试的血液细胞株中都有抗增殖活性和/或凋亡作用,如下表所示。
[0366]
表7.化合物1在血液细胞株中的抗增殖活性和凋亡作用
[0367]
[0368][0369][0370]
auc=曲线下面积;ic
50
=50%抑制浓度(μm);e
max
=实现的消除肿瘤细胞的最大效
力,表示为剩余肿瘤细胞的百分比;ec
50
=产生半数最大凋亡反应的化合物浓度(μm);y
max
=在化合物1的最高浓度下计算的对照百分比。
[0371]
6.3赋形剂相容性
[0372]
赋形剂相容性研究设计
[0373]
赋形剂相容性研究的目的是评估每种赋形剂对化合物1稳定性的影响,在每个功能类别中分级赋形剂,并为赋形剂的选择提供合理的依据。
[0374]
下表列出赋形剂相容性混合物(blends)的组成。赋形剂具有许多功能,包括稀释剂、粘合剂、崩解剂、助流剂和润滑剂。考虑到化合物1相对高的溶解度,与低剂量(低至0.1mg)相比,溶出可能不是一个关键问题。因此,表面活性剂不包括在该赋形剂评价中。
[0375]
由于低剂量规格,离析(segregation)和含量均匀度(cu)变化可能是主要的工艺挑战。制粒工艺(碾压或高剪切湿法制粒)可能比直接混合提供更好的选择,以尽量减少离析。因此,对于每种配方混合物,除了粉末混合物外,制备压紧的料块(slug)样品,以模拟滚筒压制条件,并制备湿&干样品,以模拟湿法制粒工艺条件。
[0376]
将混合物置于5℃(对照)、50℃(干)和50℃/75%rh(湿)的开放条件下,持续2周,评价样品的化学和手性稳定性。为每个时间点和条件准备一式两份的样品。
[0377]
表8.赋形剂相容性混合物的组成
[0378]
[0379][0380]
赋形剂相容性方案
[0381]
对于表中的每种混合物,使用不同的形式(混合混合物(blend mix)、料块和湿&干混合物(wet&dried mix))来模拟直接混合、碾压和湿制粒工艺条件。
[0382]
对于每种配方混合物,准确称量120mg化合物1的hcl盐(形式a)和相应的赋形剂。通过在turbula混合器上以32rpm混合20分钟来制备混合物。对于料块样品,将混合物在rrdi中于4.4kn、100ms压制成料块。对于湿混合物样品,将20%水加入到混合物粉末中,磁力搅拌5min,然后放入50℃烘箱中干燥1小时。
[0383]
对于化学稳定性和手性稳定性,将所有样品在5℃、50℃环境下、50℃/75%rh下保持2周测试稳定性。下述两个表分别显示化学分析和手性分析数据。
[0384]
化学稳定性
[0385]
表9.赋形剂相容性研究的化学稳定性数据
[0386][0387]
n/a=未得到数据
[0388]
nt=未测试
[0389]
手性稳定性
[0390]
表10.赋形剂相容性研究的手性稳定性数据
[0391][0392][0393]
n/a=未得到数据
[0394]
nt=未测试
[0395]
6.4原型制剂稳定性
[0396]
原型制剂设计
[0397]
根据赋形剂相容性研究的结果,选择原型胶囊制剂,如下表所示。
[0398]
对于直接混合和碾压工艺,由于mcc和预胶化淀粉在赋形剂相容性方面表现出相似的稳定性,两者都作为粘合剂用于原型制剂;二氧化硅用作助流剂;硬脂酸镁和硬脂富马酸钠用作润滑剂。
[0399]
对于湿法制粒工艺,使用mcc和预胶化淀粉,尽管预胶化淀粉在赋形剂相容性方面显示比mcc稍好的性能;不使用二氧化硅;硬脂酸(非硬脂酸镁或硬脂富马酸钠)用作润滑剂。
[0400]
表11.原型配方组合
[0401][0402]
原型制剂制备
[0403]
对于直接混合制剂(cap-1,cap-2,cap-3),首先将赋形剂过30目/595μm筛网,api过60目/250μm筛网;使用几何稀释(geometric dilution),以提高混合内容物均匀度-将api首先与少量淀粉或mcc以15rpm混合20分钟,然后将comil与其余辅料(硬脂酸镁除外)以15rpm混合20分钟,再次comil,用甘露醇冲洗comil,然后在15rpm下最终混合10分钟。如果使用硬脂酸镁作为润滑剂,最后加入硬脂酸镁,以15rpm再混合3分钟。
[0404]
对于碾压制剂(cap-4,cap-5,cap-6),首先将赋形剂过30目/595μm筛网,api过60目/250μm筛网;使用几何稀释,以提高混合内容物均匀度-将api首先与少量淀粉或mcc以15rpm混合20分钟,然后,comil(457μm筛网)与剩余的颗粒内赋形剂(硬脂酸镁除外)在15rpm混合20分钟,再次comil(457μm筛网),用甘露醇冲洗comil,然后以15rpm混合10分钟。如果使用硬脂酸镁作为润滑剂,最后加入颗粒内的硬脂酸镁部分,以15rpm再混合3分钟。然后,将颗粒内混合物过gerteis polygran碾压机(槽纹滚筒,辊速2rpm,辊隙2.0mm,轧制力4kn/cm,筛孔1.0mm,制粒机转速50rpm)。最后,将颗粒外润滑剂与干颗粒混合。
[0405]
对于湿法制粒制剂(cap-7,cap-8,cap-9),首先将所有赋形剂(润滑剂除外)和api过30目/595μm筛网,然后在freund vector高剪切制粒机碗中以300rpm的叶轮速度和3000rpm的切碎机速度混合10分钟,然后用相同的300rpm的叶轮速度和3000rpm的切碎机速度,以30g/min的速度喷洒20%水,随后进行1分钟的湿聚集(wet massing)。将湿颗粒过5目/4mm筛网,然后在mini glatt流化床干燥器中干燥(进气温度50℃,进气流量50cfm,产品温度nmt 42℃)。将干燥的颗粒过comil(610μm筛网),然后与30目筛选的硬脂酸(润滑剂)在
15rpm混合10分钟。
[0406]
将最终混合物全部用bosch gkf 702封装器封装至4号白色不透明hpmc胶囊,填充重量为75mg。
[0407]
下表显示了不同工艺条件下原型制剂批次的初步测试结果。对于相同的制剂组成,使用碾压工艺的批次始终比使用直接混合工艺的批次具有更小的av值(cap-4vs cap-1,cap-5vs cap-2,cap-6与cap-3);因此,为了获得更好的含量均匀度,对于化合物1的hcl盐药物产品的生产而言,碾压工艺优于直接混合工艺。不同的工艺对化学稳定性有影响。与直接混合相比,碾压工艺后的总化学降解变化不大;然而,湿法制粒工艺后降解增加,这意味着湿法制粒工艺可能比碾压工艺具有更高的化学稳定性风险水平。手性纯度不受不同工艺条件的影响。
[0408]
表12.原型制剂批次结果
[0409][0410]
*av:可接受值
[0411]
原型制剂的稳定性
[0412]
将每种制剂的胶囊包装在50个100cc hdpe瓶子中,感应密封,每瓶10个胶囊,35个瓶子有2g干燥剂,15个瓶子没有干燥剂。在加速条件下(40℃/75%rh和50℃/75%rh)评价稳定性。
[0413]
图1a、图1b和图1c分别显示在40℃/75%rh、无干燥剂下,40℃/75%rh、有干燥剂下,以及50℃/75%rh、有干燥剂下,原型制剂长达12周的化学稳定性(总杂质)。
[0414]
40℃/75%rh下,干燥剂vs无干燥剂对稳定性的影响,用干燥剂包装的制剂显示出比没有干燥剂包装的制剂显著更慢的api杂质增长速率,这意味着湿度控制对药物产品的稳定性很重要,并且水解是化合物1的hcl盐的主要降解途径之一。需要干燥剂来维持化合物1的hcl盐药物产品的保存期。
[0415]
对于三种碾压制剂,在40℃/75%rh、加干燥剂下,cap-5和cap-6制剂显示出相似的总杂质增长率,其比cap-4增长慢。在50℃/75%rh、加干燥剂下,总杂质增长速率比在40℃时快,但制剂间的排序顺序没有改变。cap-4与cap-5/cap-6的主要组成差异是硬脂酸镁作为cap-4的润滑剂,而硬脂富马酸钠(ssf)在cap-5/cap-6中用作润滑剂。因此,作为rc制
剂中的润滑剂,ssf优于硬脂酸镁。在cap-5中使用的粘合剂是预胶化淀粉,而在cap-6中使用的是微晶纤维素。cap-5和cap-6具有相似的化学稳定性。
[0416]
对于三种湿法制粒制剂,在40℃/75%rh、加干燥剂下,cap-9比cap-7和cap-8具有更快的杂质增长速率。在50℃/75%rh、加干燥剂下,杂质增长速率比40℃时快,但各制剂间的排序顺序没有改变;cap-8具有比cap-7稍快的杂质增长速率。
[0417]
cap-5和cap-7具有相似的制剂组成,但经过不同的制粒工艺。湿法制粒制剂(cap-7)比碾压制剂(cap-5)具有更高的初始杂质含量,这可能是由于工艺引起的;而在稳定性期间,它们具有相似的总杂质增长速率。
[0418]
图2a、图2b和图2c分别显示在40℃/75%rh、无干燥剂下,40℃/75%rh、有干燥剂下,以及50℃/75%rh、有干燥剂下,原型制剂长达12周的手性稳定数据。
[0419]
40℃/75%rh下,干燥剂vs无干燥剂对稳定性的影响,用干燥剂包装的制剂显示比没有干燥剂包装的制剂显著更慢的手性异构化速率,这意味着湿度控制对药物产品的手性稳定性很重要,并且需要干燥剂来维持药物产品的保存期。
[0420]
对于碾压制剂,在40℃/75%rh、干燥剂下,所有三种制剂都显示出缓慢的手性异构化速率-在12周内手性纯度下降约1%。手性稳定性的顺序显得是cap-4》cap-5》cap-6。在50℃/75%rh、干燥剂下,手性异构化速率比40℃时更快,但制剂间的排序顺序没有改变。看起来手性稳定性比化学稳定性对药品保存期具有更小的风险。
[0421]
对于湿法制粒制剂,在40℃/75%rh、干燥剂下,三种制剂也显示出缓慢的手性异构化速率-在12周内手性纯度下降低于1.5%。手性稳定性的顺序显得是cap-8》cap-7》cap-9。在50℃/75%rh、干燥剂下,手性异构化速率比40℃时更快,但制剂间的排序顺序没有改变。
[0422]
cap-5和cap-7具有相似的制剂组成,但经过不同的制粒工艺。这两种制剂开始时手性纯度水平相同;12周后,湿法制粒制剂(cap-7)具有比碾压制剂(cap-5)略低的手性纯度水平。选择cap-5和cap-7进行进一步的工艺开发。
[0423]
6.5工艺评价开发
[0424]
(a)高剪切湿法制粒工艺评价与开发
[0425]
颗粒内赋形剂/颗粒外赋形剂比率
[0426]
化合物1的hcl盐药品的推荐临床剂量规格低至0.1mg,填充在75mg胶囊中,约为0.14%的载药量。如此极其低的载药量对工艺和含量均匀度提出了挑战。高剪切湿法制粒不仅可以在混合过程中以高剪切力很好地分散api,而且可以形成颗粒,以在散装贮存和封装过程中防止离析。对于具有含量均匀度问题的低剂量制剂,高剪切湿法制粒工艺可能是一个好的选择。
[0427]
为了改善cap-7批次(cu%rsd 6.1%,av 16.5)的含量均匀度,对湿法制粒工艺进行优化。由于api的药量是固定的,颗粒内赋形剂/颗粒外赋形剂的比例降低(从95/5到23/77),使颗粒内混合物载药量从0.14%增加到0.6%。图3显示湿法制粒工艺的流程图。在原有工艺中,除了润滑剂以外的所有东西都在颗粒内部分;而在新工艺中,api、预胶化淀粉和交聚维酮在颗粒内部分,而甘露醇和润滑剂在颗粒外部分。
[0428]
利用23:77的颗粒内赋形剂/颗粒外赋形剂比例,制备cap-10,而利用95:5的颗粒内赋形剂/颗粒外赋形剂比例,制备cap-7。cap-10(cu%rsd 2.5%,av5.27)的处理结果表
明对于湿法制粒工艺,降低颗粒内赋形剂/颗粒外赋形剂的比例可以提高含量均匀度。为了证实这一结论,制备重复批次
–
cap-11重复cap-7的工艺,其使用95:5的初始的高颗粒内赋形剂/颗粒外赋形剂比例;而cap-13重复cap-10的工艺。下表中的工艺结果表明批次重复性良好
‑‑
cap-7和cap-11的cu%rsd是可比的(6.1vs 6.8),但远高于cap-10和cap-13的批次重复性(2.5vs 3.3)。因此,证实了较低的颗粒内赋形剂/颗粒外赋形剂比例的新型湿法制粒工艺将改善低剂量制剂的含量均匀度。
[0429]
表13.高剪切湿法制粒研制批次的工艺结果总结
[0430]
批次编号规格api筛网赋形剂筛网含量测定(%)cu%rsdavcap-70.1mg30目30目101.466.116.51cap-100.1mg30目30目101.72.55.27cap-110.1mg30目30目109.46.821.5cap-120.1mg60目30目99.13.58.5cap-130.1mg30目30目96.23.310.3cap-140.1mg60目30目912.011.5
[0431]
api筛网孔径
[0432]
api粒度也会影响含量均匀度,因为较小的api颗粒可以更好地分散。化合物1的hcl盐api晶体倾向于凝聚;尽管高剪切混合力能分解凝聚物,但对于低剂量制剂,它不如过筛网效率高。对于高颗粒内赋形剂/颗粒外赋形剂比率工艺,批次cap-12使api过60目(250μm)筛网,与用30目(595μm)筛网的cap-7和cap-11相比。结果,cu%rsd从cap-7的6.1%显著降低到cap-12的3.5%。对于较低的颗粒内赋形剂/颗粒外赋形剂比率的新湿法制粒工艺,所述趋势也是正确的
‑‑
将api筛网目数从30改变为60后,cu%rsd从cap-10的2.5%降低至cap-14的2.0%。因此,使api过较小的筛孔可以提高批次含量均匀度。
[0433]
研磨颗粒粒度匹配
[0434]
在低的颗粒内赋形剂/颗粒外赋形剂比率(23/77)的湿法制粒工艺中,将api与淀粉、交聚维酮和水混合,形成湿颗粒,然后干燥,并经comil研磨;然后,将研磨的颗粒与甘露醇和润滑剂混合,以形成最终的混合物。由于甘露醇粉末占最终混合物的大部分(约72%w/w),因此研磨颗粒的粒度与甘露醇的粒度相匹配,以尽量减少离析是很重要的。
[0435]
cap-13是cap-10的重复批次,使用较低的颗粒内赋形剂/颗粒外赋形剂比率。cap-10具有良好的cu数据,但cap-13的cu数据并不一样好(3.3vs 2.5)。下表列出了cap-10、cap-13和甘露醇赋形剂(pearlitol 200sd)的粒度分布。cap-10研磨颗粒的粒度(d50 145μm)与甘露醇的粒度(d50 148μm)非常匹配;然而,cap-13研磨颗粒(d50 259μm)的粒度远大于甘露醇的粒度(d50 148μm),这也许可以解释为什么cap-13的cu数据不如cap-10好。cap-10和cap-13的最终混合物的粒度是相似的,因为甘露醇是主要成分,并且主导了最终混合物的平均粒度,而不是研磨的颗粒。
[0436]
在另一个重复批次(cap-14)中,在与甘露醇和润滑剂混合之前监测和控制研磨颗粒的粒度。研磨颗粒大小(d50 139μm)与cap-10的研磨颗粒和甘露醇相匹配,这可解释为什么cap-14的cu%rsd(2.0)与cap-10(2.5)一样好。
[0437]
表14.湿法制粒批次及主要赋形剂的粒度分布
[0438]
样品名称d(10)(μm)d(50)(μm)d(90)(μm)
cap-10研磨颗粒38145448cap-10最终混合物73158323cap-13研磨颗粒76259573cap-13最终混合物62150301cap-14研磨颗粒33139440cap-14最终混合物ntntnt甘露醇(pearlitol 200sd)85148237预胶化淀粉(starch 1500)1888183
[0439]
nt:未测试
[0440]
获取赋形剂、研磨颗粒和最终混合物的sem图像(本文未显示),以便更好地了解颗粒的大小和表面形态。预胶化淀粉(starch 1500)和甘露醇(pearlitol200sd)的sem图像显示,大多数预胶化淀粉颗粒小于甘露醇颗粒。cap-10的研磨颗粒的sem图像显示,研磨颗粒粒子主要是淀粉粒子的聚集体,并且颗粒的大小与甘露醇的相似。cap-10最终混合物的sem图像显示它由甘露醇粒子组成。
[0441]
综上所述,对于高剪切湿法制粒工艺,当降低颗粒内赋形剂/颗粒外赋形剂的比例、使api过较小孔径的筛网,并且使研磨颗粒的大小与甘露醇的相匹配时,可以提高低剂量制剂的含量均匀度。
[0442]
碾压工艺的评价和开发
[0443]
颗粒内赋形剂/颗粒外赋形剂比率
[0444]
化合物1的hcl盐药品的推荐临床剂量规格低至0.1mg,填充在75mg胶囊中,约为0.14%载药量。如此极其低的载药量对工艺和含量均匀度提出了挑战。碾压工艺本身并不能帮助api均匀分散,但能有助于防止之后的离析;为了达到良好的含量均匀度,api应该在碾压步骤之前很好地分散。
[0445]
cap-5批次采用几何稀释来提高混合均匀度,并得到了可接受的含量均匀度结果(3.1%rsd,av 7.4)。为了进一步提高含量均匀度,测试碾压前颗粒内药物载量增加。由于api的药量是固定的,需要减少颗粒内赋形剂/颗粒外赋形剂的比例(从98/2到14/86),以将颗粒内混合物的药物载量从0.14%增加至1%。图4显示rc工艺的流程图。
[0446]
cap-5采用颗粒内赋形剂/颗粒外赋形剂比例为98:2的起始碾压工艺,利用颗粒内赋形剂/颗粒外赋形剂比例为14:86的新碾压工艺制备cap-15批次。由于单独的淀粉不能被成功碾压,在cap-15中,颗粒内部分中的赋形剂比率与颗粒外部分中的赋形剂比率保持相似。
[0447]
在cap-5批次中,使api在混合前过60目(250μm)筛网;然而,由于在批量生产中使用60目筛网并不常见,在cap-15批次中使用30目(595μm)筛选api和赋形剂。cap-15和cap-5没有其他工艺变化。
[0448]
下表列出碾压开发批次的工艺结果汇总。cap-15的cu%rsd高于cap-5(9.0vs 3.1)。即使有额外混合和共研磨步骤的重复批次(cap-16)的含量均匀度也没有太大变化(cu%rsd为8.6)。与湿法制粒工艺不同的是,采用较低的颗粒内赋形剂/颗粒外赋形剂比例(14:86)的新方法并不能改善碾压工艺中低剂量制剂的含量均匀度。
[0449]
表15.碾压开发批次的工艺结果总结
[0450]
批次编号规格api筛网赋形剂筛网含量测定(%lc)cu%rsdavcap-50.1mg60目30目98.293.17.42cap-150.1mg30目30目103.49.019.9cap-160.1mg30目30目95.58.620.2cap-170.1mg30目30目103.85.813.9cap-180.1mg60目30目92.42.911.9
[0451]
对研磨颗粒和碾压批次的最终混合物进行粒度分析,并且结果如下表所示。对于cap-15和cap-16批次,研磨颗粒和最终混合物的d(50)值相似;然而,研磨颗粒和最终混合物之间的d(90)值存在巨大差异,这表明研磨颗粒有太多的大颗粒,当颗粒外赋形剂占最终混合物的大部分时,其不能很好地与颗粒外赋形剂混合。需要进一步的工作来找出合适的工艺条件,以控制研磨颗粒的粒度,使其与低颗粒内赋形剂/颗粒外赋形剂比例工艺的颗粒外赋形剂的粒度相匹配。然而,由于传统的高颗粒内赋形剂/颗粒外赋形剂比例工艺已经可以获得可接受的cu,因此没有必要对新工艺进行更多的工作。
[0452]
表16.碾压批次的粒度分布
[0453]
样品名称d(10)(μm)d(50)(μm)d(90)(μm)cap-5最终混合物8110595cap-15研磨颗粒16145568cap-15最终混合物18126238cap-16研磨颗粒16154659cap-16最终混合物18131279cap-17研磨颗粒15165786cap-17最终混合物14146780cap-18研磨颗粒31253864cap-18最终混合物17173832
[0454]
api筛网孔径
[0455]
api粒度也会影响含量均匀度,因为较小的api颗粒倾向于更好的分散。化合物1的hcl盐的api结晶容易凝聚,并且混合过程太温和,不能破碎大的凝聚物。因此,在混合之前,将api粉末过筛网是破碎大凝聚物的有效方法。
[0456]
对于最初的高颗粒内赋形剂/颗粒外赋形剂比率工艺,批次cap-5使api过60目(250μm)筛网,并得到可接受的cu%rsd(3.1%);然而,当cap-17将api筛网孔径增加到30目(595μm)时,cu%rsd增加到5.8%。当cap-18将api筛网孔径缩小至60目(250μm)时,cu%rsd恢复到2.9%。因此,使api过较小的筛孔可以提高碾压批次的含量均匀度。
[0457]
总之,对于碾压工艺,使api过60目而不是30目筛网对于低剂量制剂的含量均匀度很重要。
[0458]
6.6制剂的评价和生产
[0459]
cap-5和cap-7具有相似的制剂组成,但经过不同的制粒工艺。湿法制粒制剂(cap-7)具有比碾压制剂(cap-5)高0.7%的初始总杂质含量,这可能是由于湿法制粒工艺的润湿和干燥导致更多的化学降解;在稳定性研究中,两批的总杂质增长率相似。两种制剂都需要干燥剂以保持合适的保存期。总的来说,湿法制粒工艺在化学稳定性方面比碾压工艺有更
高的风险。对于手性纯度,这两种制剂是相似的。
[0460]
用含量均匀度和含量分析值评价可生产性。根据工艺研发数据,尽管湿制粒批次的含量均匀度(cu%rsd)优于碾压工艺,但碾压批次的含量均匀度仍然是可以接受的。与湿法制粒工艺相比,碾压工艺具有更低的api损失(含量分析值)的风险,因为碾压工艺更为简单。
[0461]
由于与建议的剂量水平相比,化合物1的hcl盐api的溶解度相对较高,药物产品溶出的风险较低。图5显示两种制粒工艺制剂的性能(溶出曲线)。虽然湿法制粒批次(cap-10)有较快的溶出速率,但碾压批次(cap-5)仍有足够好的溶出速率。
[0462]
选择碾压和cap-5制剂进行进一步评价。以下三个表格列出了不同剂量规格的制剂组成。由于需要干燥剂,选择羟丙基甲基纤维素(hpmc)而不是明胶作为胶囊壳材料,因为在贮存过程中,明胶胶囊在干燥剂存在的情况下会破裂。
[0463]
表17.胶囊组成,0.1mg规格
[0464][0465][0466]1基于38.0mg胶囊重量,填充的大约胶囊重量。
[0467]
表18.胶囊组成,0.5mg规格
[0468]
[0469]1基于38.0mg胶囊重量,填充的大约胶囊重量。
[0470]
表19.胶囊组成,1.5mg规格
[0471][0472][0473]1基于75.0mg胶囊重量,填充的大约胶囊重量。
[0474]
图6显示上述批次的碾压工艺流程图。化合物1的hcl盐胶囊的生产工艺描述如下:(i)将化合物1的hcl盐与一小部分预胶化淀粉预混合,然后与剩余的颗粒内赋形剂(预胶化淀粉、甘露醇、交聚维酮、二氧化硅、硬脂富马酸钠)混合;(ii)使颗粒内混合物通过碾压机;(iii)将颗粒外二氧化硅和硬脂富马酸钠过筛网,并加入至颗粒中,且混合;和(iv)将适当大小的胶囊充填至规定的重量。
[0475]
生产并包装3kg规模的三个批次(cap-19、cap-20、cap-21,分别为0.1mg、0.5mg和1.5mg剂量规格)。下表列出稳定性批次的结果。将胶囊包装在100cc不透明高密度聚乙烯(hdpe)瓶中,配有感应密封和防篡改儿童防护聚丙烯帽。每瓶含21粒胶囊和2g干燥剂。
[0476]
表20.批次结果
[0477]
批次#剂量规格含量测定(%lc)cu%rsdavcap-190.1mg96.1%2.43%8.4cap-200.5mg97.2%1.61%3.8cap-211.5mg96.2%1.89%5.5
[0478]
本文提供的实施方案不限于实施例中提供的具体实施方案的范围内,这些具体实施方案旨在作为所提供的实施方案的一些方面的说明,并且将功能上等效的任何实施方案包括于本公开书中。事实上,除了本文所示和所述的那些,本文提供的实施方案的各种修改对本领域技术人员来说将变得显而易见,并且旨在落入所附权利要求的范围内。
[0479]
已经引用了许多参考文献,将其公开书以其全部引入文中作为参考。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。