sirt6蛋白在作为检测糖尿病性白内障标志物及制备防治糖尿病性白内障药物中的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及sirt6蛋白在作为检测糖尿病性白内障标志物及制备防治糖尿病性白内障药物中的应用。
背景技术:
2.糖尿病性白内障是临床常见的眼病,以晶状体浑浊而导致视力障碍为主要特征,患者视功能下降,严重者视力完全丧失。糖尿病性白内障的发病机理复杂,主要原因是血糖高于正常水平,眼睛房水的葡萄糖浓度增高,晶状体累积大量葡萄糖,影响晶状体上皮细胞生理环境和糖代谢途径,造成晶状体透明程度下降或丧失,从而引发白内障。随着社会生活水平的提高,人们饮食结构的改变,糖尿病的发病率屡增不降。已有相关流行病学研究表明,目前全球糖尿病人数达4.25亿人,到2040年糖尿病患者可约达6.42亿。据统计,糖尿病患者中有63%将会并发糖尿病性白内障。因为目前临床上尚未有治疗糖尿病性白内障的有效药物,所以手术是解决糖尿病性白内障致盲的唯一途径。虽然近年来白内障治疗的手术方式、辅助设备和人工晶体等方面都得到了快速发展,但是玻璃体浑浊、眼底出血等术后并发症却难以避免。因此,开发一个有效的糖尿病性白内障预防和治疗的药物靶点,从而延缓糖尿病性白内障的发生发展非常重要。
3.沉默信息调节蛋白6(sirt6)是长寿蛋白sirtuins家族(sirt1-sirt7)中的一员,sirt6主要定位于细胞核,39.1kb,位于染色体19p13.3上,参与调节多条细胞信号通路。研究发现sirt6蛋白可通过对组蛋白去乙酰化作用来调控某些基因的表达及dna的修复,其还可通过核糖基化修饰作用提高氧化应激等导致的dna双链断裂后的核酸修复功能,维持基因组稳定。有研究将实验鼠中 sirt1-sirt7分别敲除后,只有sirt6缺陷鼠出现明显衰老表型。在慢阻肺疾病研究中发现,sirt6可调控akt等途径影响其细胞的自噬水平和活性。但将sirt6 蛋白应用于糖尿病性白内障中的研究尚未见相关报道。因此,寻找安全有效的方法预防及延缓糖尿病性白内障的发生发展具有重要的临床意义和社会经济效益。
技术实现要素:
4.本发明的目的在于提供sirt6蛋白在作为检测糖尿病性白内障标志物及制备防治糖尿病性白内障药物中的应用,sirt6蛋白可以作为检测糖尿病性白内障的标志物和治疗靶点,增加其医药用途。
5.本发明提供了sirt6蛋白在作为检测糖尿病性白内障的标志物中的应用。
6.优选的,所述sirt6蛋白在糖尿病性白内障靶细胞中表达量下调。
7.优选的,所述糖尿病性白内障靶细胞包括晶状体上皮细胞。
8.本发明提供了sirt6蛋白在制备防治糖尿病性白内障的药物中的应用。
9.优选的,将所述sirt6蛋白在糖尿病性白内障靶细胞中过表达。
10.优选的,所述糖尿病性白内障靶细胞包括晶状体上皮细胞。
11.优选的,所述晶状体上皮细胞包括sra01/04细胞。
12.本发明提供了sirt6蛋白在制备促进糖尿病性白内障晶状体上皮细胞中自噬因子表达和/或提高晶状体上皮细胞增殖活性的药物中的应用。
13.优选的,所述sirt6蛋白的氨基酸序列如seq id no.1所示。
14.优选的,编码所述sirt6蛋白的核苷酸序列如seq id no.2所示。
15.有益效果:
16.本发明提供了sirt6蛋白在作为检测糖尿病性白内障的标志物,sirt6蛋白在糖尿病性白内障的靶细胞晶状体上皮细胞中表达量显著下调,因而,可以作为检测糖尿病性白内障的标志物。
17.同时,将sirt6蛋白在糖尿病性白内障靶细胞中过表达可以促进糖尿病性白内障靶细胞中自噬因子表达和提高晶状体上皮细胞增殖活性,对晶状体上皮细胞的正常代谢起到保护作用,在糖尿病性白内障中可以起到缓解病程发展的作用。因而,sirt6蛋白可以作为糖尿病性白内障的治疗靶点。
附图说明
18.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。
19.图1为实施例1中不同浓度葡萄糖对sra01/04细胞增殖活性的影响,20
×
标尺;
20.图2为实施例1中不同浓度葡萄糖对sra01/04细胞sirt6蛋白表达的影响;
21.图3为实施例1中高糖干预不同时间对sra01/04细胞sirt6蛋白表达的影响,与0h组比较,*p<0.05;**p<0.01;
22.图4为实施例2中westernblot检测各组sirt6蛋白的表达水平,****p<0.0001;
23.图5为实施例2中荧光定量pcr法检测各组sirt6mrna的表达水平, ****p<0.0001;
24.图6为实施例2中cck-8法检测过表达sirt6对高糖干预的sra01/04细胞的增殖活性的影响,*p<0.05,****p<0.0001;
25.图7为实施例2中westernblot检测过表达sirt6对高糖干预的sra01/04 细胞lc3a/b、p62、beclin1蛋白表达的影响,a.lc3a/b蛋白表达水平的统计结果,b.p62蛋白表达水平的统计结果,c.beclin1蛋白表达水平的统计结果, *p<0.05,**p<0.01,***p<0.001,****p<0.0001;
26.图8为实施例2中westernblot检测过表达sirt6对高糖干预的sra01/04 细胞atg5、atg12蛋白表达的影响,a.westernblot电泳结果,b.atg5蛋白表达水平的统计结果,c.atg12蛋白表达水平的统计结果,*p<0.05,**p<0.01,***p <0.001,****p<0.0001;
27.图9为实施例2中过表达sirt6对高糖干预的sra01/04细胞t-mtor、 p-mtor蛋白表达的影响,a.westernblot电泳结果,b.p-mtor蛋白表达水平的统计结果,c.t-mtor蛋白表达水平的统计结果,**p<0.01;***p<0.001;****p <0.0001;
28.图10为实施例2中过表达sirt6对高糖干预的sra01/04细胞t-akt、p-akt 蛋白表达的影响,a.westernblot电泳结果,b.p-akt蛋白表达水平的统计结果, c.t-akt蛋白表达水平的统计结果,**p<0.01;***p<0.001;****p<0.0001;
29.图11为实施例2中过表达sirt6对高糖干预的sra01/04细胞p-ampk、 t-ampk蛋白表达的影响,a.westernblot电泳结果,b.p-ampk蛋白表达水平的统计结果,c.t-ampk蛋白表达水平的统计结果,**p<0.01;***p<0.001;****p <0.0001;
30.图12为实施例2中过表达sirt6对高糖干预的sra01/04细胞p-mapk、 t-mapk蛋白表达的影响,a.westernblot电泳结果,b.p-mapk蛋白表达水平的统计结果,c.t-mapk蛋白表达水平的统计结果,**p<0.01;***p<0.001;****p <0.0001;
31.图13为实施例2中过表达sirt6对高糖干预的sra01/04细胞p-p53、t-p53、蛋白表达的影响,a.westernblot电泳结果,b.p-p53蛋白表达水平的统计结果, c.t-p53蛋白表达水平的统计结果,***p<0.001,****p<0.0001;
32.图14为实施例2中过表达sirt6对高糖干预的sra01/04细胞bax、bcl-2 蛋白表达的影响,a.westernblot电泳结果,b.bcl-2蛋白表达水平的统计结果, c.bax白表达水平的统计结果,***p<0.001,****p<0.0001。
33.图15为实施例3中cck-8法检测敲减sirt6对sra01/04细胞增殖活性的影响,*p<0.05,****p<0.0001;
34.图16为实施例3中敲减sirt6对sra01/04细胞p62、beclin1、atg5、atg12、 lc3a/b蛋白表达的影响,a.westernblot电泳结果,b.p62蛋白表达水平的统计结果,c.beclin1蛋白表达水平的统计结果,d.atg5蛋白表达水平的统计结果, e.atg12蛋白表达水平的统计结果,f.lc3a/b蛋白表达水平的统计结果,**p< 0.01,***p<0.001,****p<0.0001;
35.图17为实施例2中敲减sirt6对sra01/04细胞p-mtor/t-mtor、 p-ampk/t-ampk、p-akt/t-akt、p-mapk/t-mapk蛋白表达的影响,a.westernblot 电泳结果,b.p-mtor蛋白表达水平的统计结果,c.t-mtor蛋白表达水平的统计结果,d.p-ampk蛋白表达水平的统计结果,e.t-ampk蛋白表达水平的统计结果,f.p-akt蛋白表达水平的统计结果,g.t-akt蛋白表达水平的统计结果, h.p-mapk蛋白表达水平的统计结果,i.t-mapk蛋白表达水平的统计结果,**p <0.01;***p<0.001;****p<0.0001;
36.图18为实施例3中敲减sirt6对sra01/04细胞p-p53、t-p53、bcl-2和bax 蛋白表达的影响,a.westernblot电泳结果,b.p-p53蛋白表达水平的统计结果, c.t-p53蛋白表达水平的统计结果,d.bcl-2蛋白表达水平的统计结果,e.bax白表达水平的统计结果,**p<0.01,***p<0.001,****p<0.0001。
具体实施方式
37.本发明提供了sirt6蛋白在作为检测糖尿病性白内障的标志物中的应用。本发明所述sirt6蛋白是长寿蛋白sirtuins家族(sirt1-sirt7)中的一员,sirt6 蛋白主要定位于细胞核,39.1kb,位于染色体19p13.3上,其氨基酸序列优选如 seq id no.1所示,具体为: msvnyaaglspyadkgkcglpeifdppeelerkvwelarlvwqsssvvfhtg agistasgipdfrgphgvwtmeerglapkfdttfesarptqthmalvqlerv gllrflvsqnvdglhvrsgfprdklaelhgnmfveecakcktqyvrdtvvg tmglkatgrlctvakarglracrgelrdtildwedslpdrdlaladeasrn adlsitlgtslqirpsgnlplatkrrggrlvivnlqptkhdrhadlrihgyvd evmtrlmkhlgleipawdgprvleralpplprpptpklepkeesptringsipa gpkqepcaqhngsepaspkrerptspaphrppkrvkakavps;编码所述sirt6 蛋白的核苷酸序列优选如seq id no.2所示,在ncbi中的登录号为 nm_016539。本发明所述
sirt6蛋白在糖尿病性白内障靶细胞中表达量下调,可将其作为检测糖尿病性白内障的检测靶点。本发明所述糖尿病性白内障靶细胞优选包括晶状体上皮细胞,更优选包括高浓度葡萄糖损伤晶状体上皮细胞。
38.本发明还提供了sirt6蛋白在制备防治糖尿病性白内障的药物中的应用。本发明优选将所述sirt6蛋白在糖尿病性白内障靶细胞中过表达,增加sirt6 蛋白在糖尿病性白内障靶细胞中的表达量,达到改善因糖尿病对晶状体上皮细胞的损伤情况,进而达到防治糖尿病性白内障的作用。本发明所述糖尿病性白内障靶细胞优选包括晶状体上皮细胞,更优选包括sra01/04细胞。本发明所述药物优选还包括药学上接受的辅料。
39.本发明还提供了sirt6蛋白在制备促进糖尿病性白内障晶状体上皮细胞中自噬因子表达和/或提高晶状体上皮细胞增殖活性的药物中的应用。本发明通过在晶状体上皮细胞中过表达所述sirt6蛋白可以达到促进糖尿病性白内障晶状体上皮细胞中自噬因子表达,抑制晶状体上皮细胞的凋亡,提高晶状体上皮细胞增殖活性的作用,对晶状体上皮细胞的正常代谢起到保护作用,在糖尿病性白内障中可以起到缓解病程发展的作用。
40.为了进一步说明本发明,下面结合附图和实施例对本发明提供的技术方案进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
41.实施例中各抗体的规格和来源:
42.sirt6多克隆抗体(affinity,df12739)、β-actin多克隆抗体(biossion, bs-0061r)、lc3抗体多克隆抗体(proteintech,14600)、beclin1单克隆抗体 (proteintech,66665)、atg5多克隆抗体(proteintech,60061)、atg12多克隆抗体(proteintech,11122)、bcl-2多克隆抗体(proteintech,12789)、bax 多克隆抗体(proteintech,50599)、p62(affinity,af5384)、p-ampk/t-ampk (affinity,af3423/af6423)、p-p53/t-p53(affinity,af3075/af0879)、 p-mapk/t-mapk(affinity,af3455/af6456)和p-akt/t-akt(affinity, af0832/af8355)。
43.实施例1
44.sirt6蛋白在高浓度葡萄糖损伤晶状体上皮细胞中表达下调
45.(一)实验细胞株和主要试剂:人源晶状体上皮细胞永生系sra01/04(北京协和细胞中心)、dmem培养基(美国hyclone公司)、胎牛血清(以色列 bi公司)、0.25%胰酶(美国hyclone公司)、蛋白含量检测试剂盒及蛋白提取试剂盒(中国凯基生物技术股份有限公司)、sirt6多克隆抗体(affinity, df12739)和β-actin多克隆抗体(biossion,bs-0061r)。
46.(二)细胞培养:细胞间超净工作台及所用培养瓶、离心管等灭菌后,从液氮罐的冻存盒中取出sra01/04细胞的冻存管后,转移到冰盒中,迅速放至 37℃水浴锅中,待融化后,用70%酒精将冻存管灭菌处理后,将细胞冻存液融合于两倍体积dmem完全培养基中,以1000rpm/min的速度离心5min后弃去上清,加入4ml完全培养基轻轻吹打混匀,再转移至25ml培养瓶中十字摇匀法轻轻晃匀细胞悬液,放入5%co2,37℃细胞培养箱中培养,24小时细胞贴壁后换液。
47.(三)细胞传代:用显微镜观察细胞长至85%左右且细胞状态良好时(细胞透明度大,折光性强)按1:4比例传代,传代时,先用3ml巴士移液管吸干净培养液,再加入2mlpbs缓冲液十字摇匀法润洗去除培养瓶底部代谢产物, pbs洗3遍,加入700μl无edta的0.25%胰酶,摇匀后放置37℃培养箱中消化1min至细胞变圆部分脱落,用左手小鱼际轻轻拍打培养
瓶底部至细胞完全脱落呈沙粒样流动状态,加入2ml含10%fbs的完全培养基终止消化,用移液器吹打混匀后转移至15ml离心管中,1000rpm离心5min后,弃去上清,加入4ml 完全培养基混匀后,取1ml细胞悬液移至放有3ml培养基的25ml培养瓶中摇匀后放入培养箱中继续培养。
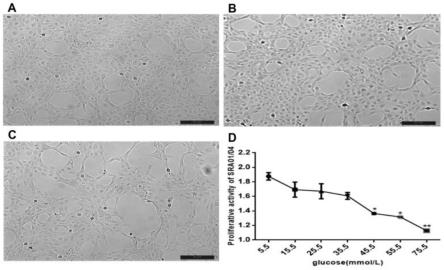
48.(四)不同浓度葡萄糖对晶状体上皮细胞增殖活性的影响:常规培养 sra01/04细胞贴壁固定24小时后,分别加入含5.5mmol/l、15.5mmol/l、 25.5mmol/l、35.5mmol/l、45.5mmol/l、55.5mmol/l、75.5mmol/l葡萄糖的dmem 培养液干预各组细胞,48小时后,用显微镜观察细胞形态变化并拍照。分别以 5
×
103个/孔将各组细胞接种于96孔板中,每孔设4个复孔培养48小后用光镜观察细胞状态后每孔避光加入10μl cck-8试剂,放回37℃细胞培养基中孵育2 小时,用酶标仪在450nm波长测定各孔光密度(od)值,各组取4个复孔的平均值,实验重复3次,结果见图1所示,其中a为葡萄糖浓度5.5mmol/l的细胞形态变化;b图为葡萄糖浓度为55.5mmol/l的细胞形态变化;c图为葡萄糖浓度75.5mmol/l的细胞形态变化;d图为cck-8法检测不同葡萄糖浓度组细胞的增殖活性结果,*p<0.05,**p<0.01。
49.(五)wb检测不同葡萄糖浓度培养下sra01/04细胞sirt6蛋白表达的变化
50.1、不同浓度葡萄糖对sra01/04细胞sirt6表达的影响:用不同浓度葡萄糖干预48h后收集各组细胞,用凯基全蛋白提取试剂盒按照说明书提取全蛋白,蛋白定量试剂盒对所提各组蛋白进行定量,定量好后加入相应loddingbuffer和 ddh2o调至等体积等质量体系,将各组样品进行10%sds-page电泳,280ma 电流湿转45分钟,10%的脱脂奶粉室温封闭4小时,tbst洗膜3次后分别孵育一抗:兔抗sirt6抗体(1:1000稀释)、兔抗β-actin抗体(1:7000稀释), 4℃过夜分别孵育或室温两小时,tbst洗膜3次后用山羊抗兔igg抗体在室温下杂交1.5h,tbst洗膜3次后用1:1配置的ecl工作液用image lab凝胶成像图像分析系统显色并采集图像分析灰度值。
51.westernblot实验证实随着葡萄糖浓度的增加,sra01/04细胞中的sirt6 蛋白表达量逐渐下降,且呈剂量依赖性,与葡萄糖浓度5.5mmol/l组sirt6的表达量比较,葡萄糖浓度15.5mmol/l组和葡萄糖浓度25.5mmol/l组均与其差异无统计学意义(均p》0.05,如图2)葡萄糖浓度45.5mmol/l组和葡萄糖浓度 55.5mmol/l组及葡萄糖浓度75.5mmol/l组均与其差异有统计学意义(与葡萄糖浓度5.5mmol/l组(nc组)比较,*p<0.05;**p<0.01,如图2)。
52.2、高糖干预不同时间对晶状体上皮细胞sirt6表达的影响:常规培养 sra01/04细胞贴壁固定24小时后,用含55.5mmol/l葡萄糖的培养基分别干预sra01/04细胞0h、6h、12h、24h、48h、72h后收集细胞,按上述方法(第(五) 部分第1步)提取蛋白、蛋白定量以及westernblot检测各组细胞sirt6和β-actin 的表达。
53.westernblot实验结果显示,在同样的高浓度葡萄糖干预下,随着时间延长, sra01/04细胞中sirt6的蛋白表达量逐渐下降,呈时间依赖性,与0h组sirt6 蛋白表达量比较,6h组和12h组均与其差异无统计学意义(均为p》0.05,图3) 24h组和48h组及72h组均与其差异具有统计学意义(均为p<0.05,图3)。提示高糖干预时间越久,sra01/04细胞中的sirt6蛋白表达量越低。
54.实施例2
55.sirt6过表达对高糖(55.5mmol/l)条件下的sra01/04细胞的影响及其机制
56.构建sirt6过表达慢病毒sra01/04稳转细胞系,用蛋白印迹技术和荧光定量pcr技
术鉴定sirt6过表达sra01/04稳转细胞系是否成功构建,用于荧光定量pcr的引物对的上游序列为:forward primer: 5
’‑
ggaggagctggagcggaagg-3’(seq id no.3),下游序列为:reverse primer:5
’‑
tgaagtcggggatgccagagg-3’(seq id no.4)。然后将细胞分为正常对照组(con),高糖组(hg lv-con),高糖 sirt6过表达组 (hg lv-sirt6),各组干预48h后,cck-8实验检测各组细胞增殖活性,高糖组(hg lv-con)和正常对照组(con)做对比,可观察高糖干预晶状体上皮细胞后自噬及相关凋亡因子的影响;高糖 sirt6过表达组(hg lv-sirt6) 和高糖组(hg lv-con)比较,可观察过表达sirt6对高糖条件下的sra01/04 细胞自噬及相关凋亡因子的影响;
57.蛋白印迹技术检测各组细胞lc3a/b、beclin1、p62、atg5、atg12、 p-mtor/t-mtor、p-akt/t-akt、p-mapk/t-mapk、p-ampk/t-ampk、p-p53/t-p53、 bcl-2和bax蛋白的表达情况。
58.sirt6过表达慢病毒sra01/04稳转细胞系的构建方法:首先,构建人sirt6 cdna的过表达慢病毒载体,采用pcr鉴定其是否构建成功。同时将其与 genbank上sirt6 cdna标准序列进行对比分析。将鉴定后的慢病毒重组表达质粒lv-sirt6与包装质粒共转染293t细胞,制备携带sirt6的慢病毒 lv-sirt6。将各组sra01/04细胞弃去常规细胞培养基后,用pbs润洗3遍,目的是去除含双抗的培养基,con组加入2ml正常培养基,lv-sirt6组中加入1.2μl sirt6过表达慢病毒(病毒滴度为1.5
×
109tu/ml),40μl病毒感染增强液hitransga(ha),958.8μl无双抗含10%fbs培养基;lv-con组加入 1.8μl sirt6过表达空载慢病毒(病毒滴度为1.0
×
109tu/ml),40μl病毒感染增强液ha,958.2μl无双抗含10%fbs培养基。感染病毒4小时后加1000μl 无双抗培养基,12小时后,吸取含病毒的培养基,加入2ml含20%fbs和1%双抗的培养基。48h间隔换液保持细胞活性,培养至72小时,用荧光显微镜根据荧光强度观察其感染效率。细胞融合至85%左右且荧光显微镜确定感染效率为80%时,用2ug/ml浓度的嘌呤霉素培养基培养,目的是筛选除去正常细胞,留下成功感染sirt6过表达和空载慢病毒的sra01/04细胞。
59.蛋白印迹技术和荧光定量pcr技术检测结果显示,与con组比较, lv-sirt6组sra01/04细胞中的sirt6蛋白和mrna的表达水平显著升高(p <0.05),证实sirt6过表达慢病毒稳转sra01/04细胞系构建成功(图4-5);
60.高浓度葡萄糖干预细胞后,cck-8结果显示,与con组相比,hg lv-con 组的细胞增殖活性显著下降;与hg lv-con组比较,hg lv-sirt6组的细胞增殖活性显著升高(p<0.05)(图6);同时,蛋白印迹技术检测结果显示,与con组相比,hg lv-con组细胞中lc3a/b、beclin1、atg5、atg12、 p-ampk/t-ampk、bcl-2的表达下调,p62、p-mtor/t-mtor、p-akt/t-akt、 p-mapk/t-mapk、p-p53/t-p53、bax的表达上调(均为p<0.05);与hg lv-con 组比较,hg lv-sirt6组细胞中、lc3a/b、beclin1、atg5、atg12、 p-ampk/t-ampk、bcl-2的表达明显上调,p62、p-mtor/t-mtor、p-akt/t-akt、 p-mapk/t-mapk、p-p53/t-p53、bax的表达显著下调(均为p<0.05)(图7-14)。
61.实施例3
62.敲减sirt6表达对sra01/04细胞的影响及其机制
63.构建sirt6干扰慢病毒稳转sra01/04细胞系,设正常对照组(con-常规培养基培养的晶状体上皮细胞)、阴性对照组(lv-si-con-感染sirt6干扰慢病毒的空载质粒的晶状体
上皮细胞)和sirt6干扰组(lv-si-sirt6-感染sirt6 干扰慢病毒的的sirt6被稳定敲减的细胞),细胞培养48h后,用cck-8法检测各组细胞的增殖活性;应用免疫荧光技术和蛋白印迹技术检测各组细胞sirt6 蛋白的表达水平,鉴定稳定敲减sirt6表达的sra01/04细胞系是否成功构建;同时用蛋白印迹技术检测各组细胞lc3a/b、beclin1、p62、atg5、atg12、 p-mtor/t-mtor、p-akt/t-akt、p-mapk/t-mapk、p-ampk/t-ampk、p-p53/t-p53、 bcl-2和bax蛋白的表达情况。
64.阴性对照组和正常对照组可证明空载质粒晶状体上皮细胞的自噬和凋亡无影响;sirt6干扰组和正常对照组(con)比较,可以观察敲减sirt6表达对 sra01/04细胞自噬和凋亡相关蛋白的影响;sirt6干扰组和阴性对照组 (lv-si-con)比较,可证明敲减sirt6表达对sra01/04细胞自噬和凋亡的影响与sirt6感染空载质粒无关。
65.结果表明,蛋白印迹技术和免疫荧光技术检测结果显示,sirt6蛋白定位于细胞核,与con组和lv-si-con组比较,lv-si-sirt6组sirt6表达水平均显著下降(p<0.05),证实sirt6干扰慢病毒稳转sra01/04细胞系构建成功;同时cck-8结果表明,与lv-si-con组和con组比较,lv-si-sirt6组细胞增殖活性显著下降(p<0.05)(图15);蛋白印迹技术检测结果显示,与lv-si-con 组和con组相比,lv-si-sirt6组细胞中lc3a/b、beclin1、atg5、atg12、 p-ampk/t-ampk、bcl-2蛋白表达显著下调(均为p<0.05),p62、 p-mtor/t-mtor、p-akt/t-akt、p-mapk/t-mapk、p-p53/t-p53、bax表达明显上调(均为p<0.05),(图16-18)。
66.上述实施例表明:自噬在糖尿病并发症中可能起到正向作用,sirt6能通过激活自噬保护细胞。高糖干预sra01/04细胞会降低sirt6的表达,促进凋亡的同时抑制其自噬水平,sirt6过表达慢病毒并不影响正常晶状体上皮细胞的增殖活性,但是能够提高高糖干预下的晶状体上皮细胞的增殖活性。
67.同时,本研究显示高糖组sra01/04细胞lc3ⅱ/ⅰ(a/b)降低,过表达 sirt6能逆转lc3的变化,提示sirt6能上调高糖干预的sra01/04细胞lc3ⅰ向lc3ⅱ的转化(图7a)。
68.本研究显示高糖组细胞p62表达上调,过表达sirt6能逆转p62的变化,提示sirt6能下调高糖干预的sra01/04细胞p62的表达(图7b)。
69.实验结果显示高糖组sra01/04细胞beclin1降低,过表达sirt6能逆转 beclin1的变化,提示sirt6能上调高糖干预的sra01/04细胞beclin1的表达(图 7c)。
70.本研究显示高糖组细胞atg5和atg12表达下调,过表达sirt6能逆转atg5 和atg12的变化,提示sirt6能上调高糖干预的sra01/04细胞atg5和atg12 的表达(图8)。
71.本研究显示高糖组细胞活化的mtor表达上调,过表达sirt6能逆转活化的mtor的变化,提示sirt6能下调高糖干预的sra01/04细胞活化的mtor 的表达,促进自噬(图9)。
72.实验结果显示高糖组细胞akt表达上调,过表达sirt6能逆转akt的表达,提示sirt6能下调高糖干预的sra01/04细胞akt的表达,促进自噬(图10)。
73.本研究显示高糖组细胞ampk表达下调,过表达sirt6能逆转ampk的表达,提示sirt6能上调高糖干预的sra01/04细胞ampk的表达,激活自噬(图 11)。
74.实验结果显示高糖组细胞mapk表达上调,过表达sirt6能逆转mapk的表达,提示sirt6能下调高糖干预的sra01/04细胞mapk的表达,促进自噬 (图12)。
75.实验结果显示高糖组细胞磷酸化p53表达上调,过表达sirt6能逆转磷酸化p53的变化,提示sirt6能下调高糖干预的sra01/04细胞磷酸化p53的表达 (图13)。
76.本研究显示高糖组细胞bcl-2表达下调,bax表达上调,过表达sirt6能逆转bcl-2和bax的表达(图14)。
77.总之,高浓度葡萄糖干预的sra01/04细胞中sirt6能够通过促进自噬相关因子的表达,同时影响细胞的凋亡,从而提高sra01/04细胞的增殖活性,对其正常代谢起到保护作用。提示sirt6在糖尿病性白内障中可能起到缓解病程发展的作用,可作为糖尿病性白内障的治疗靶点。
78.尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。