1.本发明属于动物模型构建技术领域,具体涉及一种风寒感冒动物模型的建立方法及应用。
背景技术:
2.风寒感冒在传统中医上被认为是风寒之邪外袭、肺气失宣所致。通常由于吹风受凉发生感冒,主要表现为恶寒,发热,鼻塞流涕、头痛身痛。根据现代医学观点,感冒作为一种呼吸道外感疾病,直接原因是由流感病毒等病原体引起,而风寒环境可能是导致人体免疫能力低下,从而导致流感病毒易感性升高及流感致病性加剧的诱因。风寒诱发呼吸道疾病或者加重疾病程度是生活中的一种常见现象,但目前对于风寒环境因素导致的人体免疫力下降及对呼吸道疾病的易感性的机理研究还较为空白,而由于近年来室外极端气候变化加剧、室内空调使用率的增加,使得风寒环境的暴露可能及场景增多,其对人体健康及疾病的影响研究越发受到关注。同时,由病毒传染的呼吸道疾病大流行使得人们更加关注环境诱因对流行性疾病感染风险及致病风险的影响。因此,进行风寒环境对传染性呼吸道疾病的影响研究以及相应药物的筛选具有重要意义。然而目前,基于风寒诱因的病毒感染型风寒感冒动物模型仍属空白,本领域从业人员在进行风寒刺激对流感患病影响的基础研究、药物开发时至今无有效的风寒感冒动物模型可用,因此,迫切需要研发一种风寒感冒动物模型的建立方法,以用于风寒刺激对流感患病影响的基础研究、药物开发。
技术实现要素:
3.本发明的目的在于克服现有技术中的缺陷,提供了一种风寒感冒动物模型的建立方法及应用,其简单有效,易于操作和控制,且造模稳定性、重复性好。
4.为实现上述目的,本发明所采取的技术方案如下:技术方案一:一种风寒感冒动物模型的建立方法,包括以下步骤:将用于构建风寒感冒模型的小鼠于正常环境进行正常饲养,并正常饲养过程中,每日于风寒刺激环境下进行风寒刺激干预5h,连续干预10天后,对小鼠进行流感病毒感染,获得风寒感冒动物模型。
5.进一步的,所述风寒刺激干预时,环境的温度为15℃,风速设置为1.5m/s,湿度是50~60%。
6.进一步的,在饲养用于构建风寒感冒动物模型的小鼠之前,还需对小鼠进行选择;选择6~8周龄、体重18~20g的spf级balb/c小鼠,用于构建风寒感冒动物模型;所述饲养和所述风寒刺激干预均在spf动物房内进行。
7.进一步的,所述小鼠正常环境的条件为:饲养温度20℃,通气风速《0.1m/s,湿度是50~60%;所述小鼠在进行正常饲养前先适应性饲养3天,所述适应性饲养的饲养温度为20~
22℃,通气风速《0.1m/s,湿度为50~60%;所述正常饲养和所述适应性饲养均于独立通气的鼠笼内进行饲养。
8.更进一步的,所述小鼠正常饲养期间、适应性饲养期间以及风寒刺激干预饲养期间,均提供充足饲料和饮用水,并由所述小鼠自由取食及饮水;所述饲料为经过高温辐照的spf级饲料,所述饮用水为经过高压灭菌的饮用水;小鼠饲养过程中使用的垫料为经高压灭菌的spf及垫料。
9.进一步的,所述流感病毒采用h1n1流感病毒a/pr/8/34鼠肺适应株;进行流行病毒感染时采用滴鼻吸入感染法;所述流感病毒的滴鼻剂量为1*ld50,25μl;所述流感病毒的ld50为10-4.6
/25μl。
10.技术方案二:一种采用上述方法构建的风寒感冒动物模型的用途,将所述风寒感冒动物模型用于筛选预防或治疗风寒诱发的病毒性感染型风寒感冒药物。
11.技术方案三:一种采用上述方法构建的风寒感冒动物模型的用途,将所述风寒感冒动物模型用于研究风寒环境诱因对流感致病影响的原因或机理。
12.与现有技术相比,本发明的有益效果在于:1、本发明结合环境风寒刺激与病毒感染2种干预模式进行风寒感冒动物模型的造模,其利用贴近实际的造模条件及流感致病毒株,完整的模拟了风寒刺激后免疫力下降再到感染患病的整个过程,并通过肺组织病毒滴度、血液炎症指标进行风寒刺激后小鼠流感致病性的评价,验证了本发明风寒感冒模型的有效性,本发明方法构建的风寒感冒模型对于探究风寒诱因对流感疾病诱发的内在机理、对于研究风寒刺激对机体抗病毒免疫的影响具有现实参考意义,可用于对防治风寒诱因下病毒感染型风寒感冒的药物的筛选研究中。
13.2、本发明通过对小鼠进行可控、定量的低温及风速暴露,量化了环境风寒刺激及病毒感染剂量条件,提高了造模的稳定性和重复性。
14.综上,本发明建模方法简单有效、易于操作和控制,采用本发明方法构建的动物模型稳定性和重复性好,能够用于为风寒环境诱因对流感发病影响的原因、机理以及防治风寒感冒的药物的筛选提供可靠的参考。
附图说明
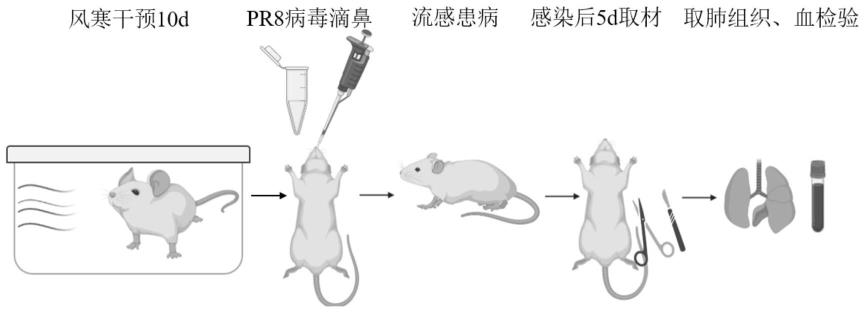
15.图1为本发明风寒感冒动物模型的构建流程图;图2为本发明各干预方法中体重指标的变化曲线图;图3为本发明获得的各动物模型中中性粒细胞水平的对比图;图4为本发明获得的各动物模型中淋巴细胞水平的对比图;图5为本发明获得的各动物模型中流感病毒滴度的对比图。
具体实施方式
16.以下结合具体实施例对本发明进行进一步详细的叙述。
17.如无特别说明,本发明各实施例和对比例小鼠饲养期间,均提供充足饲料和饮用水,并由所述小鼠自由取食及饮水;所述饲料为经过高温辐照的spf级饲料,所述饮用水为
经过高压灭菌的饮用水;小鼠饲养过程中使用的垫料为经高压灭菌的spf及垫料。
18.实施例1:一种动物模型的建立方法,包括以下步骤:s1:小鼠的选择及适宜性饲养:选用小鼠为6~8周龄、体重18~20g的spf级balb/c小鼠24只,平均分成四组,分别为风寒感冒动物模型组,吹风感冒动物对照组、单纯病毒性感冒对照组和空白对照组,将四组小鼠分别置于spf动物房内适应性饲养3天,适应性饲养时置于独立通气鼠笼内,温度设置为20~22℃,鼠笼内通气风速《0.1m/s,湿度为50~60%。
19.s2:环境干预刺激风寒感冒动物模型组的环境干预方式为:适应性饲养结束后,将小鼠置于独立通气鼠笼内于20℃温度,小于0.1m/s风速的正常环境下进行饲养,在饲养过程中,每日将小鼠暂移spf动物房的吹风暴露环境下,于15℃温度和1.5m/s吹风风速的风寒刺激环境下干预饲养5h,连续风寒刺激环境干预10天,每日干预结束后记录小鼠体重,然后放回独立通气鼠笼的正常环境中继续饲养;吹风感冒对照组的环境干预方式为:适应性饲养结束后,将小鼠置于独立通气鼠笼内于20℃温度,小于0.1m/s风速的正常环境下进行饲养,在饲养过程中,每日将小鼠暂移spf动物房的吹风暴露环境下,于20℃温度和1.5m/s吹风风速的风寒刺激环境下干预饲养5h,连续吹风环境干预10天,每日干预结束后记录小鼠体重,然后放回独立通气鼠笼的正常环境中继续饲养;单纯病毒性感冒对照组和空白对照组的环境干预方式为:适应性饲养结束后,将小鼠置于独立通气鼠笼内于20℃温度,0m/s风速的无风环境下饲养10天,饲养过程中,每日记录小鼠体重;s3:病毒感染风寒感冒动物模型组,吹风感冒对照组、单纯病毒性感冒对照组进行病毒感染,空白对照组不进行病毒感染;病毒感染的方法为:完成步骤2的环境刺激干预后,即适应性饲养结束后的第10天,风寒感冒动物模型组,吹风感冒对照组、单纯病毒性感冒对照组分别给小鼠吸入异氟烷麻醉,然后用h1n1流感病毒a/pr/8/34鼠肺适应株进行滴鼻吸入感染,即得风寒感冒动物模型、吹风感冒动物模型和单纯病毒性感冒动物模型;其中,流感病毒的剂量为:25μl、1*ld50;s4:取材检测于流感病毒感染后的第5天,也即适应性饲养结束后的第15天,摘取小鼠眼球取血,血液收集于含有20μl的抗凝剂的ep管内,使得收集到的血液与管内的抗凝剂充分混合;所述抗凝剂采用质量浓度为8%的edta-2k水溶液;取血后处死小鼠取肺脏,加入1mlpbs进行肺组织匀浆,取上清置于-80℃备用;s5:指标分析1)体重指标检测:根据每日记录体重,以适应性饲养结束时首天体重为100%,体重变化率为环境干预期间每天的体重与干预第一天的体重之比。由图1可知,3种不同环境干预情况下小鼠每日体重均有略微波动,空白对照组(20℃,0m/s)小鼠在干预期间体重增加,
10天后的体重增加至(105.4
±
3.2)%;吹风感冒对照组(20℃,1.5m/s)小鼠干预期间体重未见增长,干预第10天体重与干预前基本持平(99.6
±
1.1)%;风寒感冒动物模型组(15℃,1.5m/s)小鼠吹风干预期间体重略有下降,10天后体重下降至(98.6
±
3.4)%。结果表明,在相同的自由取食及饮水条件下,小鼠处于吹风环境中抑制了体重的增长,特别是较冷环境下吹风使得小鼠体重呈下降趋势,说明本发明构建风寒感冒动物模型时,15℃,1.5m/s的风寒造模环境对小鼠体重指标产生负影响。
20.2)血液指标检测通过对各组小鼠进行血细胞计数分析,结果如图3-4所示,病毒感染后第5天(对于空白对照组而言是适应性饲养结束第15天)小鼠中性粒细胞上升,淋巴细胞下降,其中,风寒感冒动物模型组(15℃,1.5m/s,infected)小鼠淋巴细胞为(1.77
±
0.26)
^
109/l,空白对照组(20℃,0m/s)为(3.57
±
1.46)
^
109/l,单纯病毒性感冒对照组(20℃,0m/s,infected)为(2.26
±
0.89)
^
109/l,吹风感冒对照组(20℃,1.5m/s)为(1.89
±
0.47)
^
109/l;风寒感冒动物模型组(15℃,1.5m/s,infected)小鼠中性粒细胞上升及淋巴细胞下降最为明显,与空白对照组(20℃,0m/s)及单纯病毒性感冒对照组(20℃,0m/s,infected)相比有显著差异。
21.3)病毒滴度检测:通过对各组小鼠肺组织进行病毒滴度检测,结果如图5所示,单纯病毒性感冒对照组(20℃,0m/s,infected)小鼠肺组织病毒滴度为(3.34
±
0.93)lgtcid50,吹风感冒对照组(20℃,1.5m/s)小鼠肺组织病毒滴度为(4.49
±
0.36)lgtcid50,风寒感冒动物模型组(15℃,1.5m/s,infected)小鼠肺组织病毒滴度最高(4.69
±
0.15)lgtcid50,与单纯病毒性感冒对照组(20℃,0m/s,infected)间有显著差异,说明本发明风寒感冒动物模型组的风寒刺激导致的流感病毒感染小鼠的致病性较无风寒刺激单纯病毒感染组增加。说明本发明造模条件所选用的15℃,1.5m/s风寒刺激建立风寒感冒动物模型的方法是可行的。
22.以上所述实施方式仅为本发明的优选实施例,而并非本发明可行实施的穷举。对于本领域一般技术人员而言,在不背离本发明原理和精神的前提下对其所作出的任何显而易见的改动,都应当被认为包含在本发明的权利要求保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。