一种含有多聚精氨酸的两亲性高分子材料合成装置及合成方法
1.技术领域
2.本发明涉及生物领域,具体为一种含有多聚精氨酸的两亲性高分子材料合成装置,尤其还涉及一种含有多聚精氨酸的两亲性高分子材料合成方法。
背景技术:
3.多聚精氨酸具有正电性且容易穿透细胞膜的性质,是一种有效的核酸运输载体,通过在多聚精氨酸末端修饰靶向基团,可以轻松实现向目标细胞中靶向运输核酸药物的目的。例如,skye zeller等人将狂犬病毒糖蛋白(rvg)与九聚精氨酸(r9)偶联,偶联后形成的多肽(rvg-r9)可以与sirna发生自组装,从而高效的将sirna运输到neuro2a细胞内[31];priti kumar等人将cd7特异性的单链抗体scfvcd7修饰到r9末端,修饰后的多肽可以与sirna发生自组装,将sirna特异性的运输到cd7高表达的t细胞中,从而抑制hiv-1感染。
[0004]
因此,申请人拟构建上述两亲性高分子材料,其分别含有可靶向肿瘤细胞的rgd基团、可与sirna发生正负电自组装的多聚精氨酸以及疏水性的聚烷烃。该两亲性高分子材料可在缓冲液中与p3h4 sirna(si-p3h4)、pdt光敏剂ce6发生自组装,形成一体化的纳米药物,基于此纳米药物,申请人将探索其向膀胱尿路上皮癌细胞和组织中特异性运输si-p3h4和ce6的效率,并探索其在基因治疗、光动力治疗和免疫治疗中效率,同时在实验过程中,用到的搅拌装置,在固定搅拌时,不能适应不同尺寸的试剂管,导致搅拌效率较低。
技术实现要素:
[0005]
基于此,有必要提供一种含有多聚精氨酸的两亲性高分子材料合成装置及合成方法。
[0006]
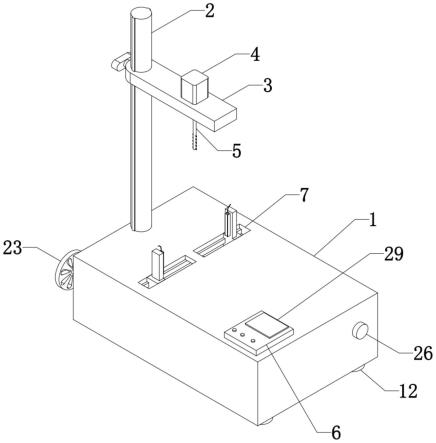
一种含有多聚精氨酸的两亲性高分子材料合成装置,包括矩形壳体,所述矩形壳体的底部四角均固定安装有橡胶减震垫,所述矩形壳体上分别设置有调节机构和夹持机构,所述调节机构上设置有搅拌机构;其中,所述调节机构用于调节所述搅拌机构的高度;其中,所述夹持机构用于固定各种尺寸的试剂管;其中,所述搅拌机构包括马达和转动杆,所述转动杆的外壁固定连接有多个搅拌块,所述转动杆的顶部固定连接有连接头,所述马达转轴的外壁开设有外螺纹,所述连接头的顶部开设有柱形槽,所述柱形槽的内壁开设有内螺纹,所述连接头螺纹固定在所述马达转轴上。
[0007]
通过采用上述技术方案:实现了对不同尺寸试管的夹持,便于更换不同尺寸的转动杆,以适用于不同深度、直径的试管。
[0008]
在其中一个实施方式中,所述调节机构包括柱形支撑杆和安装板,所述安装板的
一端开设有滑孔,所述安装板通过所述滑孔滑动安装所述柱形支撑杆上,所述安装板靠近所述滑孔的一端螺纹安装有手柄螺丝,所述马达固定安装在所述安装板的上表面,所述马达的转轴通过轴承转动安装在所述安装板的底部,所述柱形支撑杆的外壁固定连接有限位凸条,所述滑孔的内壁开设有限位通槽,所述柱形支撑杆固定安装在所述矩形壳体的上表面。
[0009]
通过采用上述技术方案:通过松紧手柄螺丝便于调节搅拌机构的高低。
[0010]
在其中一个实施方式中,所述夹持组件包括蜗杆和丝杆,所述蜗杆和所述丝杆均设置在所述矩形壳体的内部,所述矩形壳体的上表面对称开设有两个滑槽,两个所述滑槽的内部均滑动安装有工形滑块,所述丝杆的一端螺纹贯穿所述工形滑块的下端转动安装在所述矩形壳体的内壁,所述丝杆的另一端固定安装有蜗轮,且靠近所述蜗轮所述丝杆的一端转动安装在所述矩形壳体的内壁,所述矩形壳体的内部固定安装有支撑板,所述蜗杆的一端转动安装在所述支撑板的一侧,所述蜗杆的另一端通过轴承转动安装在所述矩形壳体的外部,所述蜗杆与所述蜗轮相啮合,所述工形滑块的顶部固定安装有立块,两个所述立块相对的一侧面均固定安装有凹槽体,所述蜗杆的一端端部固定安装有手轮,所述丝杆表面的螺纹为由中心向两端旋向相反设置。
[0011]
通过采用上述技术方案:便于对各种尺寸的试剂管进行夹持固定。
[0012]
在其中一个实施方式中,所述凹槽体的内部固定安装有加热棒。
[0013]
通过采用上述技术方案:便于在搅拌的同时,对试剂管进行恒温加热。
[0014]
在其中一个实施方式中,所述矩形壳体的上表面固定安装有智能控制器,所述智能控制器包括单片机,所述单片机的信号输出端分别与所述马达的电控端和所述加热棒的电控端电性连接,所述智能控制器的上表面镶嵌有触摸显示屏,所述单片机与所述触摸显示屏电性连接。
[0015]
通过采用上述技术方案:简化操作步骤。
[0016]
本发明还提供了一种含有多聚精氨酸的两亲性高分子材料合成方法,包括以下步骤:s1、化合物1a合成,首先选择氨基树脂,于dmf中溶胀5min后置于20%的哌啶的dmf溶液中振荡20min以除去树脂上fmoc保护基,加入dmf洗去多余的哌啶后加入3倍当量氨基由fmoc保护、侧链由pbf保护的精氨酸,用3倍当量的hbtu作为缩合剂,6倍当量dipea作为碱,室温振荡反应2h后dmf洗5次,从而将第一个精氨酸连接到树脂上,重复以上步骤11次以延长多肽链,最后将疏水性烷基链连接到肽链上时,采用dmf/dcm混合溶剂,用3倍当量的hbtu作为缩合剂,6倍当量dipea作为碱活化羧基,室温振荡反应2h从而将烷基链修饰到r12的氮端,随后,树脂依次用dmf,dcm,甲醇各洗涤数次,用83%的tfa(6.3%水,4.3%苯甲硫醚,4.3%h2o及2.1�t)的切落剂将多肽从树脂上切落,同时切落侧基保护基切落时间,将切落后的多肽溶液旋转蒸发浓缩然后用冰乙醚沉淀,反复洗涤几次,过滤收集真空干燥然后将产品溶解于纯水中,然后用截留分子量为的透析袋于二次水中透析,除去小分子杂质,冷冻干燥,收集样本,maldi-tof对化合物1a分子量进行表征;s2、化合物1b的合成,将化合物1a(1.2mmol)与氨基-三聚乙二醇-叠氮(1.0mmol)溶于dmso中,加入hbtu(1.0mmol)与diea(4.0mmol),室温搅拌过后,滤去沉淀,将反应液用高效液相色谱分离,流动相为乙腈(0.1%tfa)以及水(0.1%tfa),将收集到的液体冻干则获
得化合物1b,maldi-tof对化合物1b分子量进行了表征;s3、炔键修饰c(rgdfk),将丙烯酸(0.2mmol)溶于dmso中,加入dcc(0.4mmol,102mg)及nhs(0.2mmol,22mg),室温搅拌过后,滤去沉淀,滤液中加入c(rgdfk)(0.3mmol,181mg)以及diea(1.0mmol,165μl)室温搅拌4-6h后,反应体系用高效液相色谱进行纯化并冻干,得到目标化合物炔键修饰c(rgdfk);s4、目标载体化合物的合成,在dmso/水=2/1的混合溶剂中溶解炔键修饰的c(rgdfk)(0.01mmol)与叠氮修饰的多聚精氨酸(0.01mmol),加入200mgvc,3.2mgcuso4以及50mgthpta,通过所述夹持组件将试管固定住,然后通过操作所述触摸显示屏将所述加热棒的加热温度调节到30℃,然后将所述搅拌装置调节到需要的高度,所述单片机控制所述马达启动,开始搅拌反应,通过hplc监测反应进程,反应完成后,利用高效液相色谱进行纯化并冻干,得到最终产物。通过高效液相色谱对产物进行纯化,最终构建出目标载体化合物ch3-r12-rgd,并通过maldi-tof对产物分子量进行了表征;s5、多肽/sirna复合物的制备,将p3h4sirna用40mm的tris-hcl缓冲液稀释,将多肽溶解于nacl(150mm,ph7.4)和hplc级超纯水中,过滤灭菌,然后将该溶液与1.0μlp3h4sirna溶液按照不同的摩尔比直接混合,用nacl溶液稀释至总量100μl,涡旋震荡5s混合均匀,制备成所需的复合物溶液,将该复合物37℃环境下静置半小时,之后用于后续实验;s6、琼脂糖凝胶电泳,将多肽和p3h4sirna按设定比例制备为多肽复合物用溶液稀释至总量为7μl,涡旋混合后于37℃下静置30min,然后将其加入到含有2%溴化乙锭染色的琼脂糖凝胶中进行电泳实验。电泳在tris-醋酸缓冲液(tae)中进行,70v电压下60min,然后在凝胶成像仪(vilberlourmat)下通过紫外照射成像观察在p3h4sirna琼脂糖凝胶中的条带。摩尔比分别为1/0、1/10、1/20、1/30和1/40,并采取100pmol的游离p3h4sirna作为对照;s7、自组装纳米复合物的形貌用jem-100cxii型透射电子显微镜观察,加速电压为80kv,将带有formvar膜的铜网在载体与p3h4sirna自组装形成的纳米复合物溶液中浸泡后取出,沉积数分钟后吸去多余的溶液,之后用磷钨酸溶液负性染色,干燥后观测其结构形态;s8、dls表征,自组装纳米复合物的粒径和zeta电位用nano-zszen3600型粒径仪(malverninstruments)在25℃下测定,首先按照上述比例制备载体与p3h4sirna自组装形成的纳米复合物,涡旋混合后于37℃静置30min,然后置于zetasizer仪器下测定其粒径和zeta电位,每组样品分别测定6次,并取平均值作为测定结果;s9、自组装纳米复合物的体外细胞摄取,将膀胱癌细胞(hcv29细胞)种于玻底皿中,培养12h。然后将fam标记的sip3h4和纳米探针转染到细胞内,培养2h后移除培养液,用pbs洗涤3次加入400ul甲醛溶液固定30min。固定完成后用pbs洗涤3次,加入细胞核染料dapi染色3min。染色结束后用pbs洗涤然后置于激光共聚焦显微镜进行成像(dapi激发波长为405nm);s10、活性氧检测,将膀胱癌细胞种在无菌24孔板中,每孔4*104个细胞。培养12h后加入纳米复合物,4h后移除培养液,用pbs将细胞洗涤3次,根据dcfh-da试剂盒实验说明将dcfh-da荧光探针装在到细胞内。然后将细胞置于660nm波长色激光光源下照射5min,光照强度为0.76w
·
cm-2。然后用dapi染色3min,置于激光共聚焦显微镜下观察;
s11、体外细胞光毒性的研究,将细胞仪6000个/孔的密度接种于96孔细胞培养板中,每孔加入100μl含有10�s的dmem培养基中,然后在5%co2培养箱中于37℃培养24h,之后将纳米复合物溶解于含有10�s的dmem培养基中,过滤灭菌,配制成设定梯度浓度的溶液,将纳米探针和纳米复合物的梯度溶液样品加入到培养板孔中,孵育24小时后使用cck8试剂盒并参考附带说明书测量细胞存活率;s12、q-pcr检测基因表达量;s13、wb检测相关蛋白的表达。
[0017]
在其中一个实施方式中,所述步骤s12中包括以下步骤:s14、细胞、组织样本rna抽提及浓度测定;s15、rt-pcr。
[0018]
在其中一个实施方式中,所述步骤s14中包括以下步骤:s16、收集细胞或组织样本加入1mltrizol(组织样本研磨后加入trizol),室温下放置5min,混匀;s17、加入200μl氯仿,用手上下颠倒摇晃15秒,室温下放置2-3min。2-8℃条件下,15000rpm,离心15min。可见标本分三层,rna存在于上层水相中;s18、取上清,至1.5mleppendorf管加600μl氯仿,混匀,15000rpm离心5min;s19、小心将rna转移到另一管中,1.5mleppendorf管加两倍体积的异丙醇,混匀,-20℃条件下放置10min,13000rpm、10min、4℃离心,离心后管底部可见棉絮状沉淀,即为rna沉淀;s20、弃上清,加入500μl75%乙醇,用移液枪反复吹打洗涤rna沉淀,8000rpm,5min,4℃条件下离心;s21、尽量弃尽上清,将管开口置于超净台中2-3min,使rna沉淀干燥,加入20μl无rnase水溶解rna沉淀,用移液枪反复吹打帮助溶解;s22、取1μlrna溶解液,以去离子水作对照,测od260值及rna浓度。
[0019]
在其中一个实施方式中,s27、制备标准蛋白,浓度分别为0.375mg/ml,0.75mg/ml,1.5mg/ml,3mg/ml,通过制备标准曲线来检测样品蛋白的浓度;s28、将标准蛋白及样品蛋白加入酶标板,每孔4μl;配制bca液,其中,a液:s液=50
×
n:1
×
n,n为待测样品蛋白的数量;,将配好的混合液加入蛋白所在孔中,每孔20μl;再加入b液,每孔160μl,37℃条件下孵育15min;s29、用酶标仪测定波长562nm下的od值,得到标准曲线,根据标准曲线计算待测蛋白样品的浓度;s30、sds-page电泳:根据各样本蛋白浓度,计算各样品相同蛋白量所需体积。蛋白样品中加入2
×
loadingbuffer,于变性仪95℃下变性5min,室温下冷却后上样进行sds-page电泳,电压为80v,电流为100ma进行电泳50min;s31、转膜:电泳后进行湿转转膜;s32、封闭:转膜后将其置于5%脱脂奶的tbst封闭液室温摇床上封闭1h,1
×
tbst洗涤3
×
5min;s33、抗体反应:加入特异性一抗(均为1:1000稀释)4℃冰箱中过夜孵育,摇床上摇30min,1
×
tbst洗涤3
×
5min,再分别加入相应的二抗(1:5000稀释)室温孵育1h,1
×
tbst洗
涤3
×
5min;s34、化学发光、显影。
[0020]
本发明的技术效果和优点:1、本发明通过调节机构、夹持组件配合搅拌机构,实现了对不同尺寸的试剂管进行夹持固定,以及通过更换转动杆实现了对不同深度、直径的试剂管进行搅拌,有效提高了搅拌效率,同时通过智能控制器配合加热棒,实现了恒温加热的功能;2、通过压力传感器、喇叭配合智能控制器,实现了在保证夹持力度的同时,避免损坏试剂管;3、本发明利用化学修饰的方法,在多聚精氨酸的末端分别修饰上疏水结构和肿瘤特异性靶向基团,不仅可以实现对于疏水性药物及sirna的包裹,构建一体化纳米药物,同时实现了膀胱肿瘤的精准靶向与药物递送的目的。
附图说明
[0021]
图1为本发明一种含有多聚精氨酸的两亲性高分子材料合成装置的结构示意图;图2为本发明一种含有多聚精氨酸的两亲性高分子材料合成装置的丝杆的结构示意图;图3为本发明一种含有多聚精氨酸的两亲性高分子材料合成装置的蜗杆的构示意图;图4为本发明一种含有多聚精氨酸的两亲性高分子材料合成装置的连接头的结构示意图;图5为本发明一种含有多聚精氨酸的两亲性高分子材料合成装置的滑孔的结构示意图;图6为本发明一种含有多聚精氨酸的两亲性高分子材料合成装置的工形滑块的结构示意图;图7为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s2中化合物1a生成化合物1b的反应式;图8为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s3中的反应式;图9为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s4中的反应式;图10为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s1中的目标载体化合物1a的分子量值;图11为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s2中目标载体化合物1b的分子量值;图12为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s4中的目标载体化合物ch3-r12-rgd的分子量值;图13为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s6-步骤s8中自组装纳米复合物的表征图一;图14为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s6-步骤
s8中自组装纳米复合物的表征图二;图15为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s6-步骤s8中自组装纳米复合物的表征图三;图16为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s9中的实验结果图一;图17为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s9中的实验结果图二;图18为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s9中的实验结果图三;图19为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s10中的实验结果图;图20为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s11中的实验结果图一;图21为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s11中的实验结果图二;图22为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s12、s14、s15-s26中的实验结果图;图23为本发明一种含有多聚精氨酸的两亲性高分子材料合成方法的步骤s13、s27-s34中的实验结果图。
[0022]
图中:1、矩形壳体;2、柱形支撑杆;3、安装板;4、马达;5、转动杆;6、智能控制器;7、滑槽;8、支撑板;9、工形滑块;10、丝杆;11、立块;12、橡胶减震垫;13、手柄螺丝;14、外螺纹;15、连接头;16、内螺纹;17、凹槽体;18、加热棒;19、蜗杆;20、蜗轮;21、限位凸条;22、限位通槽;23、手轮;24、压力传感器;25、搅拌块;26、喇叭;27、柱形槽;28、滑孔;29、触摸显示屏。
具体实施方式
[0023]
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施方式。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式。相反地,提供这些实施方式的目的是使对本发明的公开内容理解的更加透彻全面。
[0024]
需要说明的是,当元件被称为“固定于”另一个元件,它可以直接在另一个元件上或者也可以存在居中的元件。当一个元件被认为是“连接”另一个元件,它可以是直接连接到另一个元件或者可能同时存在居中元件。本文所使用的术语“垂直的”、“水平的”、“左”、“右”以及类似的表述只是为了说明的目的,并不表示是唯一的实施方式。
[0025]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中所使用的术语只是为了描述具体的实施方式的目的,不是旨在于限制本发明。本文所使用的术语“及/或”包括一个或多个相关的所列项目的任意的和所有的组合。
[0026]
请参阅图1-图6,一种含有多聚精氨酸的两亲性高分子材料合成装置,包括矩形壳体1和用于固定试剂管的夹持机构和用混匀搅拌的搅拌机构以及用于调节搅拌机构的高度
的调节机构,其中,请参阅图1,为了避免本含有多聚精氨酸的两亲性高分子材料合成装置在使用时出现震动的现象,设置有四个橡胶减震垫12,四个橡胶减震垫12分别固定在矩形壳体1的底部四角;其中,请参阅图2-图3和图6,夹持机构包括蜗杆19、蜗轮20、螺纹以中心向两端旋向相反的丝杆10、两个工形滑块9、支撑板8、两个立块11、两个凹槽体17以及手轮23,矩形壳体1的上表面对称开设有两个滑槽7,两个工形滑块9分别滑动安装在滑槽7的内部,两个立块11分别固定安装在两个工形滑块9的上表面,两个凹槽体17分别固定安装在两个立块11相对的侧面上,且两个凹槽体17为对称设置,丝杆10的一端螺纹贯穿工形滑块9的下端转动安装在矩形壳体1的内壁,丝杆10的另一端转动安装在矩形壳体1的内壁,蜗轮20固定安装在丝杆10的一端,支撑板8固定安装在矩形壳体1的内部,蜗杆19的一端转动安装在支撑板8的一侧,蜗杆19的另一端通过轴承转动安装在矩形壳体1的外部,蜗杆19与蜗轮20相啮合,手轮23固定安装在蜗杆19的一端端部;夹持机构的夹持原理:将试管放置在两个凹槽体17之间,然后通过旋转手轮23,在蜗轮20和蜗杆19配合下,丝杆10通过工形滑块9带动两个凹槽体17相向或背向运动,进而可以将试管进行夹紧或者松开,使用方便,同时具有锁止功能,不会出现松动的情况,夹持效果好。
[0027]
其中,请参阅图1-图2和图5,调节机构包括柱形支撑杆2、安装板3和手柄螺丝13,柱形支撑杆2的底部固定安装在矩形壳体1的上表面,为了方便安装板3在柱形支撑杆2上滑动,设置有滑孔28,滑孔28开设在安装板3的一端,为了避免安装板3在滑动时发生旋转,设置有限位凸条21和限位通槽22,限位凸条21固定连接在矩形壳体1的外壁,限位通槽22开设在滑孔28的内壁上,限位凸条21滑动插接在限位通槽22的内部,手柄螺丝13固定安装在靠近滑孔28安装板3的一端;调节机构的调节原理:通过松紧手柄螺丝13,进而实现调节安装板3的高度,最终实现调节搅拌机构的高度。
[0028]
请参阅图1和图4,其中,搅拌机构包括用于驱动的马达4和转动杆5以及多个搅拌块25,马达4固定安装在安装板3的上表面,且马达4的转轴通过轴承转动安装在安装板3的底部,多个搅拌块25等距连接在转动杆5的外壁上,为了发方便对转动杆5的拆装,转动杆5的顶部固定连接有开设有内螺纹16的连接头15,连接头15的顶部开设有柱形槽27,内螺纹16开设在柱形槽27的内壁上,马达4转轴的外壁开设有外螺纹14,连接头15与马达4转轴之间通过螺纹固定连接,为了减少搅拌时试管的内壁的磨损,搅拌块25设置为弹性橡胶块,在保证搅拌效果的同时可以起到保护试管的作用,同时通过设置螺纹连接,便于更换不同尺寸的转动杆5,以适用于不同深度、直径的试管。
[0029]
为了操作方便,设置了智能控制器6,智能控制器6固定安装在矩形壳体1的上表面,智能控制器6包括单片机和触摸显示屏29,触摸显示屏29镶嵌在智能控制器6的上表面,单片机与触摸显示屏29电性连接,单片机的信号输出端与马达4的电控端电性连接。
[0030]
为了实现恒温搅拌的功能,设置有两个加热棒18,两个加热棒18分别固定安装在凹槽体17的内部,单片机的信号输出端与加热棒18的电控端电性连接。
[0031]
请参阅图1和图6,为了避免在夹持试管时,夹持的压力过大损坏试管,或者夹持的
压力过小,使得试管容易脱落的现象,设置有压力传感器24和喇叭26,喇叭26固定安装在矩形壳体1的一侧表面,压力传感器24设置在立块11和凹槽体17之间,单片机的信号输入端与压力传感器24电性连接,单片机的信号输出端与喇叭26电性连接。
[0032]
本含有多聚精氨酸的两亲性高分子材料合成装置,在使用时,先将试管放置在两个凹槽体17的内部,转动手轮23,在蜗轮20和蜗杆19配合下,丝杆10通过工形滑块9带动两个凹槽体17相向动,进而将试管夹紧,当夹持的压力达到设定的压力阈值时,单片机控制喇叭26响起,告知使用人员停止转动手轮23,再根据需要,通过松手柄螺丝13调节搅拌机构至适合的高度,然后通过操作触摸显示屏29通过单片机启动马达4,马达4带动转动杆5转动,对试管内的药剂进行搅拌,搅拌期间当需要恒温加热时,通过操作触摸显示屏29设置好恒温的温度,然后单片机控制加热棒18开始对夹持的试管进行加热,当搅拌结束时,只需反方向转动手轮23,即可将试管从夹持机构上取下。
[0033]
采用上述设备,本发含有多聚精氨酸的两亲性高分子材料合成方法,包括以下步骤:s1、化合物1a合成,首先选择氨基树脂,于dmf中溶胀5min后置于20%的哌啶的dmf溶液中振荡20min以除去树脂上fmoc保护基,加入dmf洗去多余的哌啶后加入3倍当量氨基由fmoc保护、侧链由pbf保护的精氨酸,用3倍当量的hbtu作为缩合剂,6倍当量dipea作为碱,室温振荡反应2h后dmf洗5次,从而将第一个精氨酸连接到树脂上,重复以上步骤11次以延长多肽链,最后将疏水性烷基链连接到肽链上时,采用dmf/dcm混合溶剂,用3倍当量的hbtu作为缩合剂,6倍当量dipea作为碱活化羧基,室温振荡反应2h从而将烷基链修饰到r12的氮端,随后,树脂依次用dmf,dcm,甲醇各洗涤数次,用83%的tfa(6.3%水,4.3%苯甲硫醚,4.3%h2o及2.1�t)的切落剂将多肽从树脂上切落,同时切落侧基保护基切落时间,将切落后的多肽溶液旋转蒸发浓缩然后用冰乙醚沉淀,反复洗涤几次,过滤收集真空干燥然后将产品溶解于纯水中,然后用截留分子量为的透析袋于二次水中透析,除去小分子杂质,冷冻干燥,收集样本,maldi-tof对化合物1a分子量进行表征,如图10所示,最高峰为目标载体化合物1a的分子量值,为3958.470;如图7所示,s2、化合物1b的合成,将化合物1a(1.2mmol)与氨基-三聚乙二醇-叠氮(1.0mmol)溶于dmso中,加入hbtu(1.0mmol)与diea(4.0mmol),室温搅拌过后,滤去沉淀,将反应液用高效液相色谱分离,流动相为乙腈(0.1%tfa)以及水(0.1%tfa),将收集到的液体冻干则获得化合物1b,maldi-tof对化合物1b分子量进行了表征,如图11所示,最高峰为目标载体化合物1b的分子量值,为1890.935;如图8所示,s3、炔键修饰c(rgdfk),将丙烯酸(0.2mmol)溶于dmso中,加入dcc(0.4mmol,102mg)及nhs(0.2mmol,22mg),室温搅拌过后,滤去沉淀,滤液中加入c(rgdfk)(0.3mmol,181mg)以及diea(1.0mmol,165μl)室温搅拌4-6h后,反应体系用高效液相色谱进行纯化并冻干,得到目标化合物炔键修饰c(rgdfk);s4、目标载体化合物的合成,在dmso/水=2/1的混合溶剂中溶解炔键修饰的c(rgdfk)(0.01mmol)与叠氮修饰的多聚精氨酸(0.01mmol),加入200mgvc,3.2mgcuso4以及50mgthpta,通过夹持组件将试管固定住,然后通过操作触摸显示屏29将加热棒18的加热温度调节到30℃,然后将所述搅拌装置调节到需要的高度,单片机控制所述马达4启动,开始搅拌反应,通过hplc监测反应进程,反应完成后,利用高效液相色谱进行纯化并冻干,得到
最终产物。通过高效液相色谱对产物进行纯化,最终构建出目标载体化合物ch3-r12-rgd,并通过maldi-tof对产物分子量进行了表征,如图12所示,最高峰为目标载体化合物ch3-r12-rgd的分子量值,为2558.0000;s5、多肽/sirna复合物的制备,将p3h4sirna用40mm的tris-hcl缓冲液稀释,将多肽溶解于nacl(150mm,ph7.4)和hplc级超纯水中,过滤灭菌,然后将该溶液与1.0μlp3h4sirna溶液按照不同的摩尔比直接混合,用nacl溶液稀释至总量100μl,涡旋震荡5s混合均匀,制备成所需的复合物溶液,将该复合物37℃环境下静置半小时,之后用于后续实验;s6、琼脂糖凝胶电泳,将多肽和p3h4sirna按设定比例制备为多肽复合物用溶液稀释至总量为7μl,涡旋混合后于37℃下静置30min,然后将其加入到含有2%溴化乙锭染色的琼脂糖凝胶中进行电泳实验。电泳在tris-醋酸缓冲液(tae)中进行,70v电压下60min,然后在凝胶成像仪(vilberlourmat)下通过紫外照射成像观察在p3h4sirna琼脂糖凝胶中的条带。摩尔比分别为1/0、1/10、1/20、1/30和1/40,并采取100pmol的游离p3h4sirna作为对照;s7、自组装纳米复合物的形貌用jem-100cxii型透射电子显微镜观察,加速电压为80kv,将带有formvar膜的铜网在载体与p3h4sirna自组装形成的纳米复合物溶液中浸泡后取出,沉积数分钟后吸去多余的溶液,之后用磷钨酸溶液负性染色,干燥后观测其结构形态,如图13所示,通过琼脂糖凝胶电泳可以发现,随着ch3-r12-rgd多肽量的增加,游离的sip3h4的条带逐渐变浅,在ch3-r12-rgd多肽与sip3h4的摩尔比大于20/1时,游离的sip3h4的条带完全消失,提示所有的sip3h4均已经与ch3-r12-rgd多肽自组装形成了纳米复合物的结构;如图13-图15所示,s8、dls表征,自组装纳米复合物的粒径和zeta电位用nano-zszen3600型粒径仪(malverninstruments)在25℃下测定,首先按照上述比例制备载体与p3h4sirna自组装形成的纳米复合物,涡旋混合后于37℃静置30min,然后置于zetasizer仪器下测定其粒径和zeta电位,每组样品分别测定6次,并取平均值作为测定结果,如图14所示,通过dls对不同摩尔比下的自组装形成的纳米复合物的粒径进行分析可以发现随着ch3-r12-rgd与sip3h4的摩尔比的增加,自组装所形成的纳米复合物水合粒径逐渐增加,在ch3-r12-rgd与sip3h4的摩尔比达到30/1时,逐渐稳定在170 nm左右,相应的zeta电位随着ch3-r12-rgd与sip3h4的摩尔比的增加也逐渐增加,如图15所示,纳米复合物的粒径为160 nm左右,且为均一的球形结构,与dls结果吻合;s9、自组装纳米复合物的体外细胞摄取,将膀胱癌细胞(hcv29细胞)种于玻底皿中,培养12h。然后将fam标记的sip3h4和纳米探针转染到细胞内,培养2h后移除培养液,用pbs洗涤3次加入400ul甲醛溶液固定30min。固定完成后用pbs洗涤3次,加入细胞核染料dapi染色3min。染色结束后用pbs洗涤然后置于激光共聚焦显微镜进行成像(dapi激发波长为405nm),如图16所示,我们用fam标记si-p3h4,并分别对si-p3h4和纳米探针@sip3h4成像,通过成像结果我们可以看出sip3h4成功负载到多肽载体上且具有良好的渗透性,如图17所示,对化疗药物ce6进行成像,结果显示成功负载到纳米药物上且具有良好的渗透性,如图18所示,对最终纳米复合物进行成像,从图中可以看出,纳米复合物成功包裹si-p3h4和ce6,可以靶向运输至膀胱癌细胞中,实现对膀胱癌细胞的一体化治疗;s10、活性氧检测,将膀胱癌细胞种在无菌24孔板中,每孔4*104个细胞。培养12h后
加入纳米复合物,4h后移除培养液,用pbs将细胞洗涤3次,根据dcfh-da试剂盒实验说明将dcfh-da荧光探针装在到细胞内。然后将细胞置于660nm波长色激光光源下照射5min,光照强度为0.76w
·
cm-2。然后用dapi染色3min,置于激光共聚焦显微镜下观察,用dcfh-da荧光探针对ros进行检测,如图19所示,可以看出光照之后,ce6引起细胞内ros水平上升,dcf通道可以看出明显的绿色荧光;s11、体外细胞光毒性的研究,将细胞仪6000个/孔的密度接种于96孔细胞培养板中,每孔加入100μl含有10�s的dmem培养基中,然后在5%co2培养箱中于37℃培养24h,之后将纳米复合物溶解于含有10�s的dmem培养基中,过滤灭菌,配制成设定梯度浓度的溶液,将纳米探针和纳米复合物的梯度溶液样品加入到培养板孔中,孵育24小时后使用cck8试剂盒并参考附带说明书测量细胞存活率,如图20-图21所示,通过mtt检测结果显示,我们发现在光照射作用下,膀胱癌细胞活力大幅度下降,具有一定杀伤力;s12、q-pcr检测基因表达量;s13、wb检测相关蛋白的表达。
[0034]
其中,所述步骤s12中包括以下步骤:s14、细胞、组织样本rna抽提及浓度测定;s15、rt-pcr。
[0035]
其中,所述步骤s12中包括以下步骤:s14、细胞、组织样本rna抽提及浓度测定;s15、rt-pcr。
[0036]
其中,所述步骤s14中包括以下步骤:s16、收集细胞或组织样本加入1mltrizol(组织样本研磨后加入trizol),室温下放置5min,混匀;s17、加入200μl氯仿,用手上下颠倒摇晃15秒,室温下放置2-3min。2-8℃条件下,15000rpm,离心15min。可见标本分三层,rna存在于上层水相中;s18、取上清,至1.5mleppendorf管加600μl氯仿,混匀,15000rpm离心5min;s19、小心将rna转移到另一管中,1.5mleppendorf管加两倍体积的异丙醇,混匀,-20℃条件下放置10min,13000rpm、10min、4℃离心,离心后管底部可见棉絮状沉淀,即为rna沉淀;s20、弃上清,加入500μl75%乙醇,用移液枪反复吹打洗涤rna沉淀,8000rpm,5min,4℃条件下离心;s21、尽量弃尽上清,将管开口置于超净台中2-3min,使rna沉淀干燥,加入20μl无rnase水溶解rna沉淀,用移液枪反复吹打帮助溶解。
[0037]
其中,所述步骤s15中包括以下步骤:s23、将rna逆转录为cdna,按照vazyme逆转录试剂盒说明书进行逆转录反应,以下列顺序在1.5ml离心管中加入下列反应物(体积为10μl):表1逆转录反应物试剂用量5
×
hiscriptiiselectqrtsupermix2μlp3h4或u6茎环引物1μl
totalrna1μgrnasefreeh2o加水至10μl其中条件为55℃反应15min和85℃反应5s;s24、表2pcr反应体系试剂体积h2o8.2μl2
×
chamquniversalsybrqpcrmastermix10μlprimer1(10μm)0.4μlprimer2(10μm)0.4μlcdna1μls25、荧光定量pcr反应条件为预变性:cycs1,95℃,30s;荧光定量pcr反应(cycs40):95℃,10s;60℃,20s;72℃,1min;s26、检测和计算基因相对表达量,反应中的ct值数据的采集采用校正的阈值设定,实时荧光定量pcr的方法以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,gapdh)作为内参基因,采用2
‑△△
ct
法进行相对定量,结果如图22所示。
[0038]
其中,所述步骤s13中包括以下步骤:s27、制备标准蛋白,浓度分别为0.375mg/ml,0.75mg/ml,1.5mg/ml,3mg/ml,通过制备标准曲线来检测样品蛋白的浓度;s28、将标准蛋白及样品蛋白加入酶标板,每孔4μl;配制bca液,其中,a液:s液=50
×
n:1
×
n,n为待测样品蛋白的数量;,将配好的混合液加入蛋白所在孔中,每孔20μl;再加入b液,每孔160μl,37℃条件下孵育15min;s29、用酶标仪测定波长562nm下的od值,得到标准曲线,根据标准曲线计算待测蛋白样品的浓度;s30、sds-page电泳:根据各样本蛋白浓度,计算各样品相同蛋白量所需体积。蛋白样品中加入2
×
loadingbuffer,于变性仪95℃下变性5min,室温下冷却后上样进行sds-page电泳,电压为80v,电流为100ma进行电泳50min;s31、转膜:电泳后进行湿转转膜;s32、封闭:转膜后将其置于5%脱脂奶的tbst封闭液室温摇床上封闭1h,1
×
tbst洗涤3
×
5min;s33、抗体反应:加入特异性一抗(均为1:1000稀释)4℃冰箱中过夜孵育,摇床上摇30min,1
×
tbst洗涤3
×
5min,再分别加入相应的二抗(1:5000稀释)室温孵育1h,1
×
tbst洗涤3
×
5min;s34、化学发光、显影,结果如图23所示。
[0039]
以上实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0040]
以上实施方式仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不
能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
