多价肺炎球菌多糖-蛋白质缀合物组合物及其使用方法
相关申请的交叉引用
1.本技术要求2019年12月17日提交的美国临时专利申请号62/949,164以及2019年 7月31日提交的韩国专利申请号10-2019-0093276的权益并依赖于上述申请的提交日期,将上述申请的全部公开内容通过引用并入本文。
技术领域
2.本技术总体上涉及多价肺炎球菌缀合物组合物、包含所述多价肺炎球菌缀合物组合物的疫苗以及使用这些组合物和疫苗以预防受试者的肺炎链球菌(streptococcuspneumoniae)感染或疾病的方法。
背景技术:
3.肺炎球菌(肺炎链球菌)是一种革兰氏阳性、柳叶刀形状、兼性厌氧细菌,具有超过90种已知的血清型。大多数肺炎链球菌血清型已经显示出导致疾病(如肺炎、菌血症、脑膜炎和耳炎疾病),其中23种最常见的血清型占全世界侵袭性疾病的约90%。血清型是基于荚膜多糖的血清学应答来归类的,荚膜多糖是肺炎球菌最重要的毒力因子。荚膜多糖是t细胞独立抗原,其在不存在t辅助细胞的情况下诱导抗体产生。t细胞独立抗原通常诱导具有低亲和力和短期免疫应答且几乎没有免疫记忆的抗体。
4.最初的肺炎球菌疫苗包括来自不同血清型的荚膜多糖的组合。这些疫苗可以在具有发达或健康免疫系统的患者中赋予针对肺炎链球菌的免疫,然而,它们在缺乏发达免疫系统的婴儿和通常具有受损免疫功能的老年患者中无效。为了改善特别是在有较高风险出现肺炎链球菌感染的婴儿和老年患者中对肺炎球菌疫苗的免疫应答,将荚膜多糖与合适的载体蛋白缀合以产生肺炎球菌缀合物疫苗。与合适的载体蛋白的缀合将荚膜多糖从t细胞独立抗原改变为t细胞依赖性抗原。因此,对缀合的荚膜多糖的免疫应答涉及 t辅助细胞,这有助于在再暴露于荚膜多糖时诱导更有效和更快速的免疫应答。
5.开发肺炎球菌糖缀合物疫苗有至少两种方法:单一载体方法和混合载体方法。不同荚膜多糖缀合物的免疫原性可能根据所使用的肺炎球菌血清型和载体蛋白而变化。在单一载体方法中,来自不同血清型的荚膜多糖与单一蛋白质载体缀合。pfizer的 prevnar疫苗系列是单一载体方法的例子,其中不同的荚膜多糖与crm
197
蛋白质载体 (一种具有谷氨酸对甘氨酸的单个氨基酸取代的白喉类毒素的无毒变体)缀合。2000年首次批准了7价prevnar疫苗(prevnar),并且其含有来自在批准时最普遍的如下肺炎链球菌血清型的荚膜多糖:4、6b、9v、14、18c、19f和23f。13价疫苗prevnar 13将血清型1、5、7f、3、6a和19a添加到crm
197
蛋白质载体中。merck正在开发一种15 价v114疫苗,其包含prevnar 13中存在的13种血清型以及与crm
197
缀合的22f和33f。参见美国专利号8,192,746。merck还公开了一种21价肺炎球菌缀合物组合物(pcv21),其包含与crm
197
缀合的21种肺炎链球菌血清型:3、6c、7f、8、9n、10a、11a、12f、 15a、16f、17f、19a、20a、22f、23a、23b、24f、31、33f、35b以及15b、15c或去
ꢀ‑
o-乙酰化15b中的至少一种。参见us2019/0192648。
6.所述第二个肺炎球菌缀合物疫苗方法是混合载体方法。在混合载体方法中,代替使用单一蛋白质载体,使用两种或更多种蛋白质载体,其中来自特定血清型的荚膜多糖与第一蛋白质载体缀合且来自不同血清型的荚膜多糖与至少第二、不同的蛋白质载体缀合。例如,glaxosmithkline已经开发了synflorix,一种10价(血清型1、4、5、6b、 7f、9v、14、18c、19f和23f)混合载体、肺炎球菌缀合物疫苗,其使用流感嗜血杆菌(h.influenzae)蛋白d、破伤风类毒素和白喉类毒素作为蛋白质载体。在synflorix 中,血清型1、4、5、6b、7f、9v、14和23f与蛋白d缀合;血清型18c与破伤风类毒素缀合;并且血清型19f与白喉类毒素缀合。vesikari等人,pidj,28(4):s66-76(2009)。最近, sanofi pasteur和sk biosciences已制备了16价(血清型1、3、4、5、6a、6b、7f、9v、 12f、14、18c、19a、19f、22f、23f和33f)、20价(血清型1、3、4、5、6a、6b、7f、 8、9v、10a、11a、12f、14、15b、18c、19a、19f、22f、23f和33f)以及21价(1、 3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、19f、22f、 23f和33f)混合载体、肺炎球菌缀合物疫苗,如公布的国际申请wo 2018/027123、wo 2018/027126、wo 2019/152921和wo 2019/152925中所公开,将所述申请中的每一个通过引用以其整体并入。在这些混合载体、多价肺炎球菌缀合物疫苗中,两种血清型(血清型1、3和5中的两种)或四种血清型(血清型15b和22f以及血清型1、3和5中的两种)与破伤风类毒素缀合,而其余血清型与crm
197
缀合。
7.虽然单一载体和混合载体糖缀合物疫苗已用于提供针对所述疫苗中所含有的肺炎球菌血清型的不同水平的保护,但已经观察到血清型替代、或所述糖缀合物疫苗中不包含的强毒性肺炎球菌菌株/血清型流行的增加并且这仍然是一个问题。daniels等人,jpediatr pharmacol ther.2016年1月-2月;21(1):27-35。
技术实现要素:
8.本应用提供了新的和改善的多价肺炎球菌缀合物组合物和包含所述新的和改善的多价肺炎球菌缀合物组合物的疫苗。在一个方面,本技术提供了一种多价肺炎球菌缀合物组合物,其包含22-27种不同的肺炎球菌荚膜多糖-蛋白质缀合物,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、4、5、6a、6b、7f、8、9n、9v、10a、 11a、12f、14、15a、15b、15c、18c、19a、19f、22f、23a、23b、23f、24f、33f 和35b。可以将其他目的肺炎链球菌血清型添加至所述多价肺炎球菌缀合物组合物中。在某些实施方案中,每种荚膜多糖与相同的蛋白质载体缀合。在称为混合载体实施方案的某些实施方案中,使用多于一种蛋白质载体,例如两种不同的蛋白质载体。例如,在某些实施方案中,某些荚膜多糖与第一蛋白质载体缀合,并且其余荚膜多糖附接至第二蛋白质载体。在某些实施方案中,所述第一蛋白质载体和第二蛋白质载体包括crm
197
和破伤风类毒素。在某些实施方案中,所述荚膜多糖中的两种与破伤风类毒素缀合,并且其余荚膜多糖与crm
197
缀合。在某些实施方案中,与破伤风类毒素缀合的所述两种荚膜多糖选自血清型1、3和5。在某些实施方案中,与破伤风类毒素缀合的所述两种荚膜多糖选自血清型1、3、5、15b和22f。在某些实施方案中,所述荚膜多糖中的四种与破伤风类毒素缀合,并且其余荚膜多糖与crm
197
缀合。在某些实施方案中,四种荚膜多糖与破伤风类毒素缀合,其中与破伤风类毒素缀合的所述四种荚膜多糖中的两种选自血清型1、3和5,并且其余两种荚膜多糖是血清型15b和22f。
9.在一个方面,所述多价肺炎球菌缀合物组合物包含27种不同的肺炎球菌荚膜多糖-蛋白质缀合物,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、4、5、 6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、 22f、23a、23b、23f、24f、33f和35b。
10.在某些实施方案中,来自血清型1和5的荚膜多糖与破伤风类毒素缀合,并且来自血清型3、4、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、 19a、19f、22f、23a、23b、23f、24f、33f和35b的荚膜多糖与crm
197
缀合。在另一个实施方案中,来自血清型1和3的荚膜多糖与破伤风类毒素缀合,并且来自血清型4、5、 6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、22f、23a、23b、23f、24f、33f和35b的荚膜多糖与crm
197
缀合。在又另一个实施方案中,来自血清型3和5的荚膜多糖与破伤风类毒素缀合,并且来自血清型1、4、6a、6b、 7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、22f、23a、 23b、23f、24f、33f和35b的荚膜多糖与crm
197
缀合。
11.在某些实施方案中,所述荚膜多糖中的四种与破伤风类毒素缀合,并且其余荚膜多糖与crm
197
缀合,其中与破伤风类毒素缀合的所述四种荚膜多糖中的两种选自血清型1、3和5,并且其余两种荚膜多糖是血清型15b和22f。
12.在一个实施方案中,所述混合载体、多价肺炎球菌缀合物组合物包含27种不同的肺炎球菌荚膜多糖-蛋白质缀合物,其中来自血清型1、5、15b和22f的荚膜多糖与破伤风类毒素缀合,并且来自血清型3、4、6a、6b、7f、8、9n、9v、10a、11a、12f、14、 15a、15c、18c、19a、19f、23a、23b、23f、24f、33f和35b的荚膜多糖与crm
197
缀合。
13.在另一个实施方案中,所述混合载体、多价肺炎球菌缀合物组合物包含27种不同的肺炎球菌荚膜多糖-蛋白质缀合物,其中来自血清型1、3、15b和22f的荚膜多糖与破伤风类毒素缀合,并且来自血清型4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、 14、15a、15c、18c、19a、19f、23a、23b、23f、24f、33f和35b的荚膜多糖与crm
197
缀合。
14.在另一个实施方案中,所述混合载体、多价肺炎球菌缀合物组合物包含27种不同的肺炎球菌荚膜多糖-蛋白质缀合物,其中来自血清型3、5、15b和22f的荚膜多糖与破伤风类毒素缀合,并且来自血清型1、4、6a、6b、7f、8、9n、9v、10a、11a、12f、 14、15a、15c、18c、19a、19f、23a、23b、23f、24f、33f和35b的荚膜多糖与crm
197
缀合。
15.在某些实施方案中,所述多价肺炎球菌缀合物组合物包含26种不同的肺炎球菌荚膜多糖-蛋白质缀合物,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、4、 5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、 22f、23a、23b、23f、24f、33f和35b。
16.在某些实施方案中,所述多价肺炎球菌缀合物组合物包含25种不同的肺炎球菌荚膜多糖-蛋白质缀合物,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、4、 5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、 22f、23a、23b、23f、24f、33f和35b。
17.在某些实施方案中,所述多价肺炎球菌缀合物组合物包含24种不同的肺炎球菌荚
膜多糖-蛋白质缀合物,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、4、 5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、 22f、23a、23b、23f、24f、33f和35b。
18.在某些实施方案中,所述多价肺炎球菌缀合物组合物包含23种不同的肺炎球菌荚膜多糖-蛋白质缀合物,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、4、 5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、 22f、23a、23b、23f、24f、33f和35b。
19.在某些实施方案中,所述多价肺炎球菌缀合物组合物包含22种不同的肺炎球菌荚膜多糖-蛋白质缀合物,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、4、 5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、22f、23a、23b、23f、24f、33f和35b。
20.在一些实施方案中,所述多价肺炎球菌缀合物组合物还包含佐剂,如铝基佐剂,包括但不限于磷酸铝、硫酸铝和氢氧化铝。
21.另一方面涉及使用多价肺炎球菌缀合物组合物作为疫苗。
22.另一方面涉及包含所述多价肺炎球菌缀合物组合物和药学上可接受的赋形剂的疫苗。
23.又另一方面涉及一种用于预防受试者如人的肺炎链球菌感染或疾病的方法,所述方法包括向所述受试者施用预防有效量的所述多价肺炎球菌缀合物组合物或包含其的疫苗。
24.在某些实施方案中,所述受试者是至少50岁的人,并且所述疾病是肺炎或侵袭性肺炎球菌疾病(ipd)。
25.在其他实施方案中,所述受试者是至少6周龄的人,并且所述疾病是肺炎、侵袭性肺炎球菌疾病(ipd)或急性中耳炎(aom)。在一些实施方案中,所述人受试者是6周龄至5岁。在其他实施方案中,所述人受试者是2至15月龄或6至17岁。
26.在某些实施方案中,将所述多价肺炎球菌缀合物组合物或疫苗通过肌内注射施用。在某些实施方案中,将所述多价肺炎球菌缀合物组合物或疫苗作为免疫系列的一部分施用。
27.又另一方面涉及包含至少一种多糖-蛋白质缀合物的免疫原性组合物及其制备方法,其中所述至少一种多糖-蛋白质缀合物中的多糖是来自肺炎链球菌血清型15a的荚膜多糖。
28.又另一方面涉及包含至少一种多糖-蛋白质缀合物的免疫原性组合物及其制备方法,其中所述至少一种多糖-蛋白质缀合物中的多糖是来自肺炎链球菌血清型15c的荚膜多糖。
29.又另一方面涉及包含至少一种多糖-蛋白质缀合物的免疫原性组合物和制备方法,其中所述至少一种多糖-蛋白质缀合物中的多糖是来自肺炎链球菌血清型23a的荚膜多糖。
30.又另一方面涉及包含至少一种多糖-蛋白质缀合物的免疫原性组合物和制备方法,其中所述至少一种多糖-蛋白质缀合物中的多糖是来自肺炎链球菌血清型23b的荚膜多糖。
31.又另一方面涉及包含至少一种多糖-蛋白质缀合物的免疫原性组合物和制备方法,其中所述至少一种多糖-蛋白质缀合物中的多糖是来自肺炎链球菌血清型24f的荚膜多糖。
32.又另一方面涉及包含至少一种多糖-蛋白质缀合物的免疫原性组合物和制备方法,其中所述至少一种多糖-蛋白质缀合物中的多糖是来自肺炎链球菌血清型35b的荚膜多糖。
33.从以下详细描述中,所述肺炎球菌缀合物组合物的前述和其他目的、特征和优点将变得更加清楚。定义
34.为了更容易理解本公开文本,首先在下面定义某些术语。以下术语和其他术语的另外的定义可以通过说明书来阐述。
35.除非上下文另有明确规定,否则如在本说明书和所附权利要求书中所使用的,单数形式“一种/一个”(“a”)、“一种/一个”(“an”)和“所述”包括复数指示物。因此,例如,对“一种方法”的提及包括一种或多种方法、和/或本文所述的和/或在阅读本公开文本之后对于本领域技术人员而言将变得清楚的类型的步骤等等。
36.施用:如本文所用,将组合物“施用”至受试者意指将所述组合物给予、施加至所述受试者或使所述组合物与所述受试者接触。可以通过以下多种途径中的任一种来实现施用:例如像局部、口服、皮下、肌内、腹膜内、静脉内、鞘内和皮内。
37.大约:如本文所用,如应用于一个或多个目的值的术语“大约”或“约”是指与所陈述的参考值类似的值。在某些实施方案中,除非另外陈述或者上下文另有明确含义,否则术语“大约”或“约”是指落在所陈述参考值的任一方向(大于或小于)上的 25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、 7%、6%、5%、4%、3%、2%、1%或更小内的值的范围(这个数字会超过可能值的100%的情况除外)。
38.缀合物:如本文所用以及从适当的背景理解,术语“一种或多种缀合物”或“一种或多种糖缀合物”是指使用任何共价或非共价生物缀合策略与载体蛋白缀合的肺炎链球菌多糖。
39.氧化程度:如本文所用,术语“氧化程度”(do)是指当用氧化剂激活纯化的或特定大小的糖时在每个醛基团产生的糖重复单元的数量。糖的氧化程度可以使用本领域普通技术人员已知的常规方法确定。
40.实施方案:除非上下文另有明确指示,否则如本文所用,术语“在某些实施方案中”、“在一些实施方案中”等是指本公开文本的所有方面的实施方案。
41.赋形剂:如本文所用,术语“赋形剂”是指可以包含在组合物中例如以提供或有助于所需的稠度或稳定作用的任何非治疗剂。
42.混合载体:如本文所用,混合载体、肺炎球菌缀合物组合物是指具有多于一种蛋白质载体类型的肺炎球菌缀合物组合物。
43.22价肺炎球菌缀合物组合物:如本文所用,术语“一种或多种22价肺炎球菌缀合物
组合物”或“pcv-22”是指包含肺炎球菌荚膜多糖-蛋白质缀合物的组合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物包含22种不同的肺炎球菌荚膜多糖-蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、4、5、6a、6b、 7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、22f、23a、 23b、23f、24f、33f和35b。
44.23价肺炎球菌缀合物组合物:如本文所用,术语“一种或多种23价肺炎球菌缀合物组合物”或“pcv-23”是指包含肺炎球菌荚膜多糖-蛋白质缀合物的组合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物包含23种不同的肺炎球菌荚膜多糖-蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、4、5、6a、6b、 7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、22f、23a、 23b、23f、24f、33f和35b。
45.24价肺炎球菌缀合物组合物:如本文所用,术语“一种或多种24价肺炎球菌缀合物组合物”或“pcv-24”是指包含肺炎球菌荚膜多糖-蛋白质缀合物的组合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物包含24种不同的肺炎球菌荚膜多糖-蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、22f、23a、 23b、23f、24f、33f和35b。
46.25价肺炎球菌缀合物组合物:如本文所用,术语“一种或多种25价肺炎球菌缀合物组合物”或“pcv-25”是指包含肺炎球菌荚膜多糖-蛋白质缀合物的组合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物包含25种不同的肺炎球菌荚膜多糖-蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、4、5、6a、6b、 7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、22f、23a、23b、23f、24f、33f和35b。
47.26价肺炎球菌缀合物组合物:如本文所用,术语“一种或多种26价肺炎球菌缀合物组合物”或“pcv-26”是指包含肺炎球菌荚膜多糖-蛋白质缀合物的组合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物包含26种不同的肺炎球菌荚膜多糖-蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、4、5、6a、6b、 7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、22f、23a、 23b、23f、24f、33f和35b。
48.27价肺炎球菌缀合物组合物:如本文所用,术语“一种或多种27价肺炎球菌缀合物组合物”或“pcv-27”是指包含肺炎球菌荚膜多糖-蛋白质缀合物的组合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物包含27种不同的肺炎球菌荚膜多糖-蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型是1、3、4、5、6a、6b、 7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、22f、23a、 23b、23f、24f、33f和35b。
49.分子量:除非另有说明,否则如本文所用,术语荚膜糖或荚膜糖-载体蛋白缀合物的“分子量”是指通过尺寸排阻色谱(sec)与多角度激光器光散射(malls)结合计算的平均分子量。
50.多价:如本文所用,术语“多价”是指具有来自多于一种肺炎链球菌血清型的肺炎
球菌荚膜多糖的肺炎球菌缀合物组合物。
51.药学上可接受的赋形剂:可用于本公开文本的药学上可接受的赋形剂是常规的。 e.w.martin的remington's pharmaceutical sciences,mack publishing co.,easton,pa,第15 版(1975)描述了适用于一种或多种治疗组合物的药物递送的组合物和配制品,包括疫苗和另外的药剂。合适的药物赋形剂包括例如淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、稻、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂乳粉、甘油、丙烯、二醇、水、乙醇等。通常,所述赋形剂的性质将取决于所使用的特定施用方式。例如,肠胃外配制品通常包括可注射的流体,其包括作为媒介物的药学上和生理学上可接受的流体,如水、生理盐水、平衡盐溶液、缓冲液、右旋糖溶液、甘油等。对于固体组合物(例如,粉末、药丸、片剂或胶囊形式),常规的无毒固体赋形剂可以包括例如药用级别的甘露醇、乳糖、淀粉或硬脂酸镁。除了生物中性载体外,待施用的药物组合物可以含有少量的无毒辅助物质,如润湿剂或乳化剂、表面活性剂、防腐剂和ph缓冲剂等,例如乙酸钠或者脱水山梨糖醇单月桂酸酯。
52.预防有效量:如本文所定义,术语“预防性有效量”或“预防有效剂量”是指诱导足以延迟肺炎链球菌感染引起的一种或多种症状的发作和/或降低其频率和/或严重程度的免疫应答所需的量或剂量。
53.预防:如本文所用的术语“预防”,是指避免疾病显现、延迟特定疾病、障碍或病症(例如,肺炎链球菌感染)的一种或多种症状的发作、和/或降低其频率和/或严重程度。在一些实施方案中,在群体的基础上评估预防,使得如果在易患特定疾病、障碍或病症的群体中观察到所述疾病、障碍或病症的一种或多种症状的发展、频率和/或强度的统计上显著的降低,则认为药剂提供针对所述疾病、障碍或病症的预防。
54.受试者:如本文所用,术语“受试者”意指任何哺乳动物,包括小鼠、兔和人。在某些实施方案中,所述受试者是成年人、青少年或婴儿。在一些实施方案中,术语“个体”或“患者”被使用并且旨在与“受试者”可互换。
具体实施方式
55.对所公开的一个或多个实施方案和实施例的以下描述本质上仅是示例性的,并且绝不旨在限制本发明、其应用或用途。
56.本应用提供了新的和改善的多价肺炎球菌缀合物组合物和包含所述新的和改善的多价肺炎球菌缀合物组合物的疫苗。如实施例所示,获得了针对pcv-27中的27种血清型的稳健抗体应答,所述血清型包括未被现有肺炎球菌疫苗覆盖的血清型,如血清型 15a、血清型15c、血清型23a、血清型23b、血清型24f和血清型35b。肺炎球菌多糖血清型15a
57.可以通过使用本领域普通技术人员已知的分离程序(包括但不限于美国专利申请公开号2006/0228380中所公开的方法)直接从细菌获得血清型15a多糖。另外,可以使用合成方案产生15a寡糖。
58.血清型15a肺炎链球菌菌株可以从已建立的培养物保藏中心(例如,疾病控制与预防中心的链球菌参考实验室(亚特兰大,乔治亚州))或临床样本获得。
59.细菌细胞通常在培养基如大豆基培养基中生长。在产生肺炎链球菌血清型15a 荚
膜多糖的细菌细胞的发酵后,将细菌细胞裂解以产生细胞裂解物。然后,可以使用本领域已知的纯化技术从细胞裂解物分离血清型15a多糖,所述纯化技术包括离心、深度过滤、沉淀、超滤、用活性炭处理、渗滤和/或柱色谱(包括但不限于美国专利申请公开号 2006/0228380中公开的方法)。
60.纯化的血清型15a多糖与载体蛋白缀合,以形成包含至少一种含有血清型15a 多糖和载体蛋白的多糖-蛋白质缀合物的免疫原性组合物。在一个方面,可以通过包括以下步骤的方法制备15a多糖-蛋白质缀合物:(i)使纯化的肺炎链球菌血清型15a多糖经历酸水解反应和高温或微流化床,然后与氧化剂反应以产生激活的肺炎链球菌血清型15a多糖;(ii)任选地冻干所述激活的肺炎链球菌血清型15a多糖和载体蛋白;(iii)使所述激活的肺炎链球菌血清型15a多糖和所述载体蛋白悬浮于二甲基亚砜 (dmso)中;(iv)使所述激活的肺炎链球菌血清型15a多糖和所述载体蛋白与还原剂反应,以产生肺炎链球菌血清型15a多糖-载体蛋白缀合物;以及(v)对所述肺炎链球菌血清型15a多糖-载体蛋白缀合物中未反应的醛封端,以制备包含与所述载体蛋白共价连接的肺炎链球菌血清型15a多糖的免疫原性缀合物。有关试剂(例如,氧化剂、还原剂、载体蛋白等)的其他细节和可用于该方法的条件公开在本技术中的其他地方,包括公开在以下章节和实施例中。
61.激活的血清型15a荚膜多糖可以通过包括例如分子量(mw)和/或氧化程度(do) 在内的不同参数来表征。
62.在一个方面,激活的肺炎链球菌血清型15a多糖在缀合之前具有小于120kda 的分子量,包括例如激活的血清型15a荚膜多糖在缀合之前具有约10-120kda、50-120kda、 70-120kda、70-80kda、70-118kda、114-118kda或约116kda的分子量。上述任何范围内的任何整数被认为是本公开文本的实施方案。
63.在一个方面,当在缀合之前肺炎链球菌血清型15a多糖的分子量小于120kda 时,可以产生约1,000-5,000kda的多糖-蛋白质缀合物,如约1,200-4,000kda、1,200-1,500 kda、1,200-3,500kda、1,400-4,000kda、约1,200kda、约1,400kda或约4,000kda的多糖
ꢀ‑
蛋白质缀合物。上述任何范围内的任何整数被认为是本公开文本的实施方案。
64.纯化的血清型15a多糖可以通过用氧化剂激活后的氧化程度来表征。在一个方面,激活的血清型15a多糖可以具有1至15的范围内(如4-10、4-8、4-5、5-8或约4)的氧化程度。
65.在一个方面,具有约4的氧化水平(do)的激活的肺炎链球菌血清型15a多糖与载体蛋白缀合,以得到具有如下游离多糖(游离ps)含量的血清型15a荚膜多糖-蛋白质缀合物:40%或更少,如5%-40%、20%-40%、25%-40%、20%-35%、25%-35%或30%-35%。
66.在正常纯化程序中,所述多糖的大小可能略微降低。另外,如本公开文中所述,所述多糖可以在缀合之前进行定型。上述分子量范围是指在缀合之前的最终定型步骤(例如,在纯化、水解和激活之后)之后的纯化多糖的分子量范围。肺炎球菌多糖血清型15c
67.可以通过使用本领域普通技术人员已知的分离程序(包括但不限于美国专利申请公开号2006/0228380中所公开的方法)直接从细菌获得血清型15c多糖。另外,可以使用合
成方案产生15c寡糖。
68.血清型15c肺炎链球菌菌株可以从已建立的培养物保藏中心(例如,疾病控制与预防中心的链球菌参考实验室(亚特兰大,乔治亚州))或临床样本获得。可替代地,血清型15c多糖可以通过血清型15b多糖的去-o-乙酰化,通常通过碱性处理获得。
69.细菌细胞通常在培养基如大豆基培养基中生长。在产生肺炎链球菌血清型15c 荚膜多糖的细菌细胞的发酵后,将细菌细胞裂解以产生细胞裂解物。然后,可以使用本领域已知的纯化技术从细胞裂解物分离血清型15c多糖,所述纯化技术包括离心、深度过滤、沉淀、超滤、用活性炭处理、渗滤和/或柱色谱(包括但不限于美国专利申请公开号 2006/0228380中公开的方法)。
70.纯化的血清型15c多糖与载体蛋白缀合,以形成包含至少一种含有血清型15c 多糖和载体蛋白的多糖-蛋白质缀合物的免疫原性组合物。在一个方面,可以通过包括以下步骤的方法制备15c多糖-蛋白质缀合物:(i)使纯化的肺炎链球菌血清型15c多糖与氧化剂反应,以产生激活的肺炎链球菌血清型15c多糖;(ii)任选地冻干所述激活的肺炎链球菌血清型15c多糖和载体蛋白;(iii)使所述激活的肺炎链球菌血清型15c多糖和所述载体蛋白悬浮于二甲基亚砜(dmso)或磷酸盐缓冲液中;(iv)与所述激活的血清型15c多糖和所述载体蛋白的混合物与还原剂反应,以产生血清型15c多糖-载体蛋白缀合物;以及(v)对所述血清型15c多糖-载体蛋白缀合物中未反应的醛封端,以制备包含与所述载体蛋白共价连接的肺炎链球菌血清型15c多糖的免疫原性缀合物。有关试剂(例如,氧化剂、还原剂、载体蛋白等)的其他细节和可用于该方法的条件公开在本技术中的其他地方,包括公开在以下章节和实施例中。
71.激活的血清型15c荚膜多糖可以通过包括例如分子量(mw)和/或氧化程度(do) 在内的不同参数来表征。
72.在一个方面,激活的肺炎链球菌血清型15c多糖可以在缀合之前具有200-1,000 kda,如400-800kda、500-775kda、470-775kda、500-770kda、520-680kda、510-770kda、 510-550kda、670-770kda的分子量或相似的分子量范围。上述任何范围内的任何整数被认为是本公开文本的实施方案。
73.可以产生具有约1,000-10,000kda的分子量的15c多糖-蛋白质缀合物,如约 2,000-6,000kda、2,500-5,000kda、6,000-10,000kda或6,200-9,400kda的15c多糖-蛋白质缀合物。上述任何范围内的任何整数被认为是本公开文本的实施方案。
74.纯化的血清型15c多糖可以通过用氧化剂激活后的氧化程度来表征。在一个方面,激活的血清型15c多糖可以具有1至40的范围内的氧化程度。通过向肺炎链球菌血清型15c多糖中添加高碘酸钠获得8-35、15-35、8-20、8-9、9-20或30-35的氧化程度。
75.在一个方面,具有30-35的氧化水平(do)的激活的肺炎链球菌血清型15c多糖与载体蛋白缀合,以得到具有如下游离多糖(游离ps)含量的血清型15c荚膜多糖-蛋白质缀合物:40%或更少,如5%-40%、20%-40%、25%-40%、20%-35%、25%-35%或 30%-35%。
76.在正常纯化程序中,所述多糖的大小可能略微降低。另外,如本公开文中所述,所
述多糖可以在缀合之前进行定型。上述分子量范围是指在缀合之前的最终定型步骤(例如,在纯化、水解和激活之后)之后的纯化多糖的分子量范围。肺炎球菌多糖血清型23a
77.可以通过使用本领域普通技术人员已知的分离程序(包括但不限于美国专利申请公开号2006/0228380中所公开的方法)直接从细菌获得血清型23a多糖。另外,可以使用合成方案产生23a寡糖。
78.血清型23a肺炎链球菌菌株可以从已建立的培养物保藏中心(例如,疾病控制与预防中心的链球菌参考实验室(亚特兰大,乔治亚州))或临床样本获得。
79.细菌细胞通常在培养基如大豆基培养基中生长。在产生肺炎链球菌血清型23a 荚膜多糖的细菌细胞的发酵后,将细菌细胞裂解以产生细胞裂解物。然后,可以使用本领域已知的纯化技术从细胞裂解物分离血清型23a多糖,所述纯化技术包括离心、深度过滤、沉淀、超滤、用活性炭处理、渗滤和/或柱色谱(包括但不限于美国专利申请公开号 2006/0228380中公开的方法)。
80.纯化的血清型23a多糖与载体蛋白缀合,以形成包含至少一种含有血清型23a 多糖和载体蛋白的多糖-蛋白质缀合物的免疫原性组合物。在一个方面,可以通过包括以下步骤的方法制备23a多糖-蛋白质缀合物:(i)使纯化的肺炎链球菌血清型23a与氧化剂反应,以产生激活的肺炎链球菌血清型 23a多糖;(ii)任选地冻干所述激活的肺炎链球菌血清型23a多糖和载体蛋白;(iii)使所述激活的肺炎链球菌血清型23a多糖和所述载体蛋白悬浮于二甲基亚砜 (dmso)或磷酸盐缓冲液中;(iv)使所述激活的肺炎链球菌血清型23a多糖和所述载体蛋白的混合物与还原剂反应,以产生肺炎链球菌血清型23a多糖-载体蛋白缀合物;以及(v)对所述肺炎链球菌血清型23a多糖-载体蛋白缀合物中未反应的醛封端,以制备包含与所述载体蛋白共价连接的肺炎链球菌血清型23a多糖的免疫原性缀合物。有关试剂(例如,氧化剂、还原剂、载体蛋白等)的其他细节和可用于该方法的条件公开在本技术中的其他地方,包括公开在以下章节和实施例中。
81.激活的血清型23a荚膜多糖可以通过包括例如分子量(mw)和/或氧化程度(do) 在内的不同参数来表征。
82.在一个方面,激活的肺炎链球菌血清型23a多糖可以在缀合之前具有300-700 kda,如400-650kda、430-650kda、470-650kda、470-570kda、470-490kda的分子量或相似的分子量范围。上述任何范围内的任何整数被认为是本公开文本的实施方案。
83.可以使用本文公开的方法产生约2,000-7,000kda的血清型23a多糖-蛋白质缀合物。血清型23a荚膜多糖-蛋白质缀合物的分子量可以是约2,000-4,000kda、4,000-7,000 kda、4,200-6,700kda、4,350-6,650kda、5,000-6,700kda、约4,300kda、约5,000kda或约6,600kda。上述任何范围内的任何整数被认为是本公开文本的实施方案。
84.纯化的血清型23a多糖可以通过用氧化剂激活后的氧化程度来表征。在一个方面,激活的血清型23a多糖可以具有4至25的范围内(如6-24、6-18、9-18、6-9、6-10、 6-11或9-11)的氧化程度。
85.在一个方面,具有9-11的氧化水平(do)的激活的肺炎链球菌血清型23a多糖与载体蛋白缀合,以得到具有如下游离多糖(游离ps)含量的血清型23a荚膜多糖-蛋白质缀合物:40%或更少,如5%-40%、20%-40%、25%-40%、20%-35%、25%-35%或30%-35%。
86.包括dmso或磷酸盐缓冲液在内的任何合适的缓冲液可以用于缀合。当使用 dmso时,所述多糖的反应浓度可以是2.5mg/ml或更少,包括例如1.0mg/ml至2.5mg/ml、 1.0mg/ml至2.0mg/ml、或1.0mg/ml至1.5mg/ml。当使用磷酸盐缓冲液时,所述多糖的反应浓度可以是10至20mg/ml,包括例如15mg/ml。
87.在正常纯化程序中,所述多糖的大小可能略微降低。另外,如本公开文中所述,所述多糖可以在缀合之前进行定型。肺炎球菌多糖血清型23b
88.可以通过使用本领域普通技术人员已知的分离程序(包括但不限于美国专利申请公开号2006/0228380中所公开的方法)直接从细菌获得血清型23b多糖。另外,可以使用合成方案产生23b寡糖。
89.血清型23b肺炎链球菌菌株可以从已建立的培养物保藏中心(例如,疾病控制与预防中心的链球菌参考实验室(亚特兰大,乔治亚州))或临床样本获得。
90.细菌细胞通常在培养基如大豆基培养基中生长。在产生肺炎链球菌血清型23b 荚膜多糖的细菌细胞的发酵后,将细菌细胞裂解以产生细胞裂解物。然后,可以使用本领域已知的纯化技术从细胞裂解物分离血清型23b多糖,所述纯化技术包括离心、深度过滤、沉淀、超滤、用活性炭处理、渗滤和/或柱色谱(包括但不限于美国专利申请公开号 2006/0228380中公开的方法)。
91.纯化的血清型23b多糖与载体蛋白缀合,以形成包含至少一种含有血清型23b 多糖和载体蛋白的多糖-蛋白质缀合物的免疫原性组合物。在一个方面,可以通过包括以下步骤的方法制备23b多糖-蛋白质缀合物:(i)使纯化的肺炎链球菌血清型23b与氧化剂反应,以产生激活的肺炎链球菌血清型 23b多糖;(ii)任选地冻干所述激活的肺炎链球菌血清型23b多糖和载体蛋白;(iii)使所述激活的肺炎链球菌血清型23b多糖和所述载体蛋白悬浮于二甲基亚砜 (dmso)中;(iv)使所述激活的肺炎链球菌血清型23b多糖和所述载体蛋白的混合物与还原剂反应,以产生肺炎链球菌血清型23b多糖-载体蛋白缀合物;以及(v)对所述肺炎链球菌血清型23b多糖-载体蛋白缀合物中未反应的醛封端,以制备包含与所述载体蛋白共价连接的肺炎链球菌血清型23b多糖的免疫原性缀合物。有关试剂(例如,氧化剂、还原剂、载体蛋白等)的其他细节和可用于该方法的条件公开在本技术中的其他地方,包括公开在以下章节和实施例中。
92.激活的血清型23b荚膜多糖可以通过包括例如分子量(mw)和/或氧化程度(do) 在内的不同参数来表征。
93.在一个方面,激活的肺炎链球菌血清型23b多糖可以在缀合之前具有100-800 kda,如200-700kda、200-650kda、300-650kda、380-640kda、550-675kda、200-250kda、 220-230kda、220-225kda的分子量或相似的分子量范围。上述任何范围内的任何整数被认为是
本公开文本的实施方案。
94.可以使用本文公开的方法产生约2,000-7,000kda的血清型23b多糖-蛋白质缀合物。血清型23b荚膜多糖-蛋白质缀合物的分子量可以在约2,000-4,000kda、2,000-5,000、 4,000-7,000kda、2,400-6,800kda、4,600-6,800kda或6,400-6,800kda的范围内。上述任何范围内的任何整数被认为是本公开文本的实施方案。
95.纯化的血清型23b多糖可以通过用氧化剂激活后的氧化程度来表征。在一个方面,激活的血清型23b多糖可以具有5.4或更小的氧化程度,如1-5.4、2-5.4、2.3-5.4、2-3 或2.3-2.8的氧化程度。
96.在一个方面,具有3或更小(如上所讨论)的氧化水平(do)的激活的肺炎链球菌血清型23b多糖与载体蛋白缀合,以得到具有如下游离多糖(游离ps)含量的血清型23b荚膜多糖-蛋白质缀合物:40%或更少,如5%-40%、20%-40%、25%-40%、20%-35%、 25%-35%或30%-35%。
97.在正常纯化程序中,所述多糖的大小可能略微降低。另外,如本公开文中所述,所述多糖可以在缀合之前进行定型。肺炎球菌多糖血清型24f
98.可以通过使用本领域普通技术人员已知的分离程序(包括但不限于美国专利申请公开号2006/0228380中所公开的方法)直接从细菌获得血清型24f多糖。另外,可以使用合成方案产生24f寡糖。
99.血清型24f肺炎链球菌菌株可以从已建立的培养物保藏中心(例如,疾病控制与预防中心的链球菌参考实验室(亚特兰大,乔治亚州))或临床样本获得。
100.细菌细胞通常在培养基如大豆基培养基中生长。在产生肺炎链球菌血清型24f 荚膜多糖的细菌细胞的发酵后,将细菌细胞裂解以产生细胞裂解物。然后,可以使用本领域已知的纯化技术从细胞裂解物分离血清型24f多糖,所述纯化技术包括离心、深度过滤、沉淀、超滤、用活性炭处理、渗滤和/或柱色谱(包括但不限于美国专利申请公开号 2006/0228380中公开的方法)。
101.纯化的血清型24f多糖与载体蛋白缀合,以形成包含至少一种含有血清型24f 多糖和载体蛋白的多糖-蛋白质缀合物的免疫原性组合物。在一个方面,可以通过包括以下步骤的方法制备24f多糖-蛋白质缀合物:(i)使纯化的肺炎链球菌血清型24f多糖经历酸水解反应或微流化床,然后与氧化剂反应以产生激活的肺炎链球菌血清型24f多糖;(ii)任选地冻干所述激活的肺炎链球菌血清型24f多糖和载体蛋白;(iii)使所述激活的肺炎链球菌血清型24f多糖和所述载体蛋白悬浮于二甲基亚砜 (dmso)或磷酸盐缓冲液中;(iv)使所述激活的肺炎链球菌血清型24f多糖和所述载体蛋白与还原剂反应,以产生肺炎链球菌血清型24f多糖-载体蛋白缀合物;以及(v)对所述肺炎链球菌血清型24f多糖-载体蛋白缀合物中未反应的醛封端,以制备包含与所述载体蛋白共价连接的肺炎链球菌血清型24f多糖的免疫原性缀合物。有关试剂(例如,氧化剂、还原剂、载体蛋白等)的其他细节和可用于该方法的条件公开在本技术中的其他地方,包括公开在以下章节和实施例中。
102.激活的血清型24f荚膜多糖可以通过包括例如分子量(mw)和/或氧化程度(do) 在内的不同参数来表征。
103.在一个方面,激活的肺炎链球菌血清型24f多糖可以在缀合之前具有100-500 kda,如150-350kda、200-400kda、200-300kda、225-275kda、240-260kda、245-255kda、约250kda的分子量或相似的分子量范围。上述任何范围内的任何整数被认为是本公开文本的实施方案。
104.可以使用本文公开的方法产生约1,000-5,000kda的血清型24f多糖-蛋白质缀合物。血清型24f荚膜多糖-蛋白质缀合物的分子量可以在约1,500-5,000kda、2,000-4,500 或2,500-3,500kda的范围内。上述任何范围内的任何整数被认为是本公开文本的实施方案。
105.纯化的血清型24f多糖可以通过用氧化剂激活后的氧化程度来表征。在一个方面,激活的血清型24f多糖可以具有至少90的氧化程度,包括约90-100。
106.在一个方面,2.0或更小的摩尔当量的还原剂可以用于具有至少90的氧化程度的激活的血清型24f多糖和载体蛋白的反应步骤中,以获得具有如下游离糖(游离ps)的血清型24f荚膜多糖-蛋白质缀合物:40%或更少,如5%-40%、20%-40%、25%-40%、 20%-35%、25%-35%或30%-35%。可以使用0.5至1.2、1.0至1.2或约1.2的摩尔当量的还原剂。
107.在正常纯化程序中,所述多糖的大小可能略微降低。另外,如本公开文中所述,所述多糖可以在缀合之前进行定型。肺炎球菌多糖血清型35b
108.可以通过使用本领域普通技术人员已知的分离程序(包括但不限于美国专利申请公开号2006/0228380中所公开的方法)直接从细菌获得血清型35b多糖。另外,可以使用合成方案产生35b寡糖。
109.血清型35b肺炎链球菌菌株可以从已建立的培养物保藏中心(例如,疾病控制与预防中心的链球菌参考实验室(亚特兰大,乔治亚州))或临床样本获得。
110.细菌细胞通常在培养基如大豆基培养基中生长。在产生肺炎链球菌血清型35b 荚膜多糖的细菌细胞的发酵后,将细菌细胞裂解以产生细胞裂解物。然后,可以使用本领域已知的纯化技术从细胞裂解物分离血清型35b多糖,所述纯化技术包括离心、深度过滤、沉淀、超滤、用活性炭处理、渗滤和/或柱色谱(包括但不限于美国专利申请公开号 2006/0228380中公开的方法)。
111.纯化的血清型35b多糖与载体蛋白缀合,以形成包含至少一种含有血清型35b 多糖和载体蛋白的多糖-蛋白质缀合物的免疫原性组合物。在一个方面,可以通过包括以下步骤的方法制备35b多糖-蛋白质缀合物:(i)使纯化的肺炎链球菌血清型35b与氧化剂反应,以产生激活的肺炎链球菌血清型 35b多糖;(ii)任选地冻干所述激活的肺炎链球菌血清型35b多糖和载体蛋白;(iii)使所述激活的肺炎链球菌血清型35b多糖和所述载体蛋白悬浮于二甲基亚砜 (dmso)或磷酸盐缓冲液中;(iv)使所述激活的肺炎链球菌血清型35b多糖和所述载体蛋白与还原剂反应,以产生肺炎链球菌血清型35b多糖-载体蛋白缀合物;以及
(v)对所述肺炎链球菌血清型35b多糖-载体蛋白缀合物中未反应的醛封端,以制备包含与所述载体蛋白共价连接的肺炎链球菌血清型35b多糖的免疫原性缀合物。有关试剂(例如,氧化剂、还原剂、载体蛋白等)的其他细节和可用于该方法的条件公开在本技术中的其他地方,包括公开在以下章节和实施例中。
112.激活的血清型35b荚膜多糖可以通过包括例如分子量(mw)和/或氧化程度(do) 在内的不同参数来表征。
113.例如,可以在与载体蛋白缀合之前例如通过高压均质化或机械均质化降低纯化的血清型35b多糖的大小。在一个方面,激活的血清型35b多糖在缀合之前具有10至20,000 kda、10至1,000kda、10至500kda、10至300kda、20至200kda或20至120kda的分子量。
114.纯化的血清型35b多糖可以通过用氧化剂激活后的氧化程度来表征。在一个方面,激活的血清型35b多糖可以具有1-50、1-45、1-40、1-35、1-30、2-50、2-45、2-40、 2-35、2-30、3-40、3-35、3-30、4-40、4-35或4-30的氧化程度。
115.在一个方面,具有4-30的氧化水平(do)的激活的肺炎链球菌血清型35b多糖与载体蛋白缀合,以得到具有如下游离多糖(游离ps)含量的血清型35b荚膜多糖-蛋白质缀合物:40%或更少,如5%-40%、20%-40%、25%-40%、20%-35%、25%-35%或30%-35%。
116.为了产生具有有利免疫原性的血清型35b糖缀合物,激活(氧化)、缀合和/ 或封端步骤中的以下过程参数中的一种或多种可以进行组合:
·
在激活步骤中,高碘酸盐(例如,高碘酸钠或高碘酸钾)以每1m血清型35b多糖中 0.005至0.5、0.005至0.3、0.005至0.2或0.007至0.15摩尔当量反应;
·
激活步骤可以在水性溶剂(如乙酸钠缓冲液或去离子水)中进行;
·
激活步骤可以在0.1mm至15mm或0.1至10mm乙酸钠缓冲液中进行;
·
激活步骤可以在ph 4-8或ph 4-7.5下进行;
·
在激活步骤中,可以在21℃至25℃下处理高碘酸盐;
·
在激活步骤中,高碘酸盐和血清型35b多糖可以反应0.5至50小时或1至25小时;
·
在激活步骤之后,可以使用例如30kda mwco超滤过滤器浓缩激活的血清型35b多糖;
·
在缀合步骤中,在缀合反应中激活的血清型35b多糖的浓度可以是5mg/ml至30 mg/ml或10mg/ml至20mg/ml;
·
在缀合步骤中,载体蛋白和激活的血清型35b多糖的初始负载比率(pr:ps)可以是1:0.3、1:0.4、1:0.5、1:0.6、1:0.7、1:0.8、1:0.9、1:1、1:1.1、1:1.2、1:1.3、 1:1.4、1:1.5、1:1.6、1:1.7、1:1.8、1:1.9、1:2、1:2.1、1:2.2、1:2.3、1:2.4、1: 2.5、1:2.6、1:2.7、1:2.8、1:2.9或1:3,以及优选1:0.5至2;
·
在缀合步骤中,所用的还原剂的量可以是每1m激活的多糖中0.1至5摩尔或0.5至2当量,优选每1m激活的糖中0.5、0.6、0.7、0.8、0.9、1、1.1、1.2、1.3、1.4、1.5、1.6、 1.7、1.8、1.9或2摩尔当量,或更优选每1m激活的多糖中0.8至1.6摩尔当量;
·
在缀合步骤中,温度可以是20℃至45℃、30℃至40℃、35至40℃或37
±
2℃;
·
在缀合步骤中,ph可以是5.5至8.5、5.5至7.5或6至7.5;
·
在缀合步骤中,载体蛋白和激活的血清型35b多糖可以与还原剂反应1至70小时或40 至60小时;
80、 20-60、20-50、20-40、20-35、25-100、25-50、25-35、28-32或29-31的do。上述任何范围内的任何整数被认为是本公开文本的实施方案。
120.血清型22f多糖-蛋白质缀合物可以通过包括例如在缀合后蛋白质与多糖 (ps/pr)比率、游离糖(游离ps)、msd%或分子量(malls)在内的不同参数来表征。在某些实施方案中,22f荚膜多糖-蛋白质缀合物(例如,22f-tt)的ps/pr比率可以是0.2至1.5、0.2至0.5、0.3至0.4、0.6至1.0、0.7至0.9或0.6至0.8。在某些实施方案中,22f 荚膜多糖-蛋白质缀合物(例如,22f-tt)具有如下游离ps:40%或更少,如2%-40%、 2%-20%、2%-10%、5%-30%、10%-25%、15%-25%、17%-21%或约19%。在某些实施方案中,血清型22f荚膜多糖-蛋白质缀合物(例如,22f-tt)具有如下msd(%):5%-60%、 5%-10%、5%-50%、10%-50%、25%-50%、40%-50%、42%-46%或约44%。在某些实施方案中,22f荚膜多糖-蛋白质缀合物(例如,22f-tt)的分子量可以在1,000-6,000kda、 2,000-5,000kda、2,500-4,000kda、3,000至3,500kda或3,000至3,100kda的范围内。上述任何范围内的任何整数被认为是本公开文本的实施方案。
121.血清型22f的任何上述参数可以根据需要进行组合。例如,在某些实施方案中,用于制备血清型22f多糖-蛋白质缀合物的激活的血清型22f多糖具有约29-31的do且蛋白质(tt)与多糖的反应比率为约1:1。在某些实施方案中,最终缀合物中的多糖/载体蛋白比率(ps/pr)为约0.6至0.8,游离ps为约17%-21%,并且msd%为约42%-46%,任选地具有通过malls测定的3,000至3,100kda分子量。肺炎球菌多糖血清型15b
122.激活的血清型15b荚膜多糖可以通过包括例如用氧化剂激活后的氧化程度(do) 在内的不同参数来表征。在某些实施方案中,激活的血清型15b多糖可以具有1至15、5 至10、6至8或约7的氧化程度。上述任何范围内的任何整数被认为是本公开文本的实施方案。
123.血清型15b多糖-蛋白质缀合物可以通过包括例如在缀合后蛋白质与多糖 (ps/pr)比率、游离糖(游离ps)、msd%或分子量(malls)在内的不同参数来表征。在某些实施方案中,15b荚膜多糖-蛋白质缀合物(例如,15b-tt)的ps/pr比率可以是0.2至1.5、0.2至0.5、0.3至0.4、0.6至1.0、0.7至0.9或0.8至1.0。在某些实施方案中, 15b荚膜多糖-蛋白质缀合物(例如,15b-tt)具有如下游离ps:30%或更少,如2%-30%、 2%-20%、2%-10%、5%-10%、8%-10%或约9%。在某些实施方案中,血清型15b荚膜多糖-蛋白质缀合物(例如,15b-tt)具有如下msd(%):50%-90%、60%-85%、65%-80%、 70%-80%、74%-78%或约76%。在某些实施方案中,15b荚膜多糖-蛋白质缀合物(例如, 15b-tt)的分子量可以在约2,000-15,000kda、10,000-15,000kda、2,000-10,000kda、3,000 至7,500kda、4,000至6,000kda、5,000至6,000kda或5,500至5,600kda的范围内。上述任何范围内的任何整数被认为是本公开文本的实施方案。
124.血清型15b的任何上述参数可以根据需要进行组合。例如,在某些实施方案中,用于制备血清型15b多糖-蛋白质缀合物的激活的血清型15b多糖具有约7.0的do且蛋白质 (tt)与多糖的反应比率为约1.25:1。在某些实施方案中,最终缀合物中的多糖/载体蛋白比率(ps/pr)为约0.8至1.0,游离ps为约8%-10%,并且msd%为约74%-78%,任选地具有通过malls测定的5,500至5,600分子量。肺炎球菌多糖血清型19a
比率、游离糖(游离ps)、msd%或分子量(malls)在内的不同参数来表征。在某些实施方案中,4荚膜多糖-蛋白质缀合物(例如,4-crm
197
)的ps/pr比率可以是0.2至1.5、 0.8至1.1、0.8至1.3、0.9至1.1或约1.0。在某些实施方案中,血清型4荚膜多糖-蛋白质缀合物(例如,4-crm
197
)具有如下游离ps:40%或更少,如5%-30%、15%-35%、5%-15%、 7%-13%、9%-11%或约10%。在某些实施方案中,血清型4荚膜多糖-蛋白质缀合物(例如, 4-crm
197
)具有如下msd(%):40%-80%、45%-75%、45%-55%、60%-75%或70%-75%。在某些实施方案中,血清型4荚膜多糖-蛋白质缀合物(例如,4-crm
197
)的分子量可以在约500-2,500kda、500-1,000kda、1,000-2,000kda、1,500至2,000kda、1,800至2,000kda 或1,850至1,950kda的范围内。上述任何范围内的任何整数被认为是本公开文本的实施方案。
132.血清型4的任何上述参数可以根据需要进行组合。例如,在某些实施方案中,用于制备血清型4多糖-蛋白质缀合物的激活的血清型4多糖具有约1.4的do且蛋白质(crm
197
)与多糖的反应比率为约1.25:1。在某些实施方案中,最终缀合物中的多糖/ 载体蛋白比率(ps/pr)为约1.0,游离ps为约9%-11%,并且msd%为约70%-75%,任选地具有通过malls测定的1,850至1,950分子量。肺炎球菌多糖血清型9v
133.血清型9v多糖-蛋白质缀合物可以通过包括例如在缀合后蛋白质与多糖 (ps/pr)比率、游离糖(游离ps)、msd%或分子量(malls)在内的不同参数来表征。在某些实施方案中,9v荚膜多糖-蛋白质缀合物(例如,9v-crm
197
)的ps/pr比率可以是0.2至1.5、0.2至0.5、0.3至0.4、0.8至1.3、1.0至1.2或约1.1。在某些实施方案中,血清型9v荚膜多糖-蛋白质缀合物(例如,9v-crm
197
)具有如下游离ps:35%或更少,如 10%-35%、20%-35%、5%-15%、7%-13%、9%-11%或约10%。在某些实施方案中,血清型9v荚膜多糖-蛋白质缀合物(例如,9v-crm
197
)具有如下msd(%):40%-80%、45%-75%、 45%-60%、50%-65%、55%-65%、57%-61%或约59%。在某些实施方案中,血清型9v荚膜多糖-蛋白质缀合物(例如,(9v-crm
197
)的分子量可以在约500-2,000kda、500-1,500 kda、1,000-2,000kda、1,000至1,500kda、1,000至1,200kda或1,100至1,200kda的范围内。上述任何范围内的任何整数被认为是本公开文本的实施方案。
134.血清型9v的任何上述参数可以根据需要进行组合。例如,在某些实施方案中,用于制备血清型9v多糖-蛋白质缀合物的激活的血清型9v多糖具有约7.4的do且蛋白质 (crm
197
)与多糖的反应比率为约1.25:1。在某些实施方案中,最终缀合物中的多糖/ 载体蛋白比率(ps/pr)为约1.1,游离ps为约9%-11%,并且msd%为约57%-61%,任选地具有通过malls测定的1,100至1,200分子量。
135.多价肺炎球菌缀合物组合物及其制备方法
136.本公开文本提供了包含不同肺炎球菌荚膜多糖-蛋白质缀合物的多价肺炎球菌缀合物组合物,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体。本文描述了所述多价肺炎球菌缀合物组合物的不同方面和实施方案。
137.在一个方面,所述多价肺炎球菌缀合物组合物包含肺炎球菌荚膜多糖-蛋白质缀合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物包含22-27种不同的肺炎球菌荚膜多糖
ꢀ‑
蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链
球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、 4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、 19f、22f、23a、23b、23f、24f、33f和35b。
138.在一个方面,所述多价肺炎球菌缀合物组合物包含肺炎球菌荚膜多糖-蛋白质缀合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物包含27种不同的肺炎球菌荚膜多糖
‑ꢀ
蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型是1、3、4、 5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、 22f、23a、23b、23f、24f、33f和35b。该多价肺炎球菌缀合物组合物也称为pcv-27。
139.在一个方面,所述多价肺炎球菌缀合物组合物包含肺炎球菌荚膜多糖-蛋白质缀合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物包含26种不同的肺炎球菌荚膜多糖
‑ꢀ
蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、 4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、 19f、22f、23a、23b、23f、24f、33f和35b。该多价肺炎球菌缀合物组合物也称为pcv-26。在pcv-26的某些实施方案中,所述肺炎链球菌血清型中的至少一种是35b。在pcv-26的某些实施方案中,所述肺炎链球菌血清型包含1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、19f、22f、23f、33f和35b,并且四种血清型选自15a、15c、23a、23b和24f。例如,pcv-26包含肺炎球菌荚膜多糖-蛋白质缀合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物可以包含26种不同的肺炎球菌荚膜多糖-蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型是:a)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15a、15c、23a和23b;b)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15a、15c、23a和24f;c)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15a、15c、23b和24f。d)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15a、23a、23b和24f;或e)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15c、23a、23b和24f。
140.在一个方面,所述多价肺炎球菌缀合物组合物包含肺炎球菌荚膜多糖-蛋白质缀合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物包含25种不同的肺炎球菌荚膜多糖
‑ꢀ
蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、 4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、 19f、22f、23a、23b、23f、24f、33f和35b。该多价肺炎球菌缀合物组合物也称为pcv-25。在pcv-25的某些实施方案中,所述肺炎链球菌血清型中的至少一种是35b。在pcv-25的某些实施方案中,所述肺炎链球菌
血清型包含1、3、4、5、6a、6b、7f、8、9n、9v、 10a、11a、12f、14、15b、18c、19a、19f、22f、23f、33f和35b,并且三种血清型选自15a、15c、23a、23b和24f。例如,pcv-25包含肺炎球菌荚膜多糖-蛋白质缀合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物可以包含25种不同的肺炎球菌荚膜多糖-蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型是:a)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15a、15c和23a;b)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15a、15c和23b;c)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15a、15c和24f;d)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15a、23a和23b;e)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15a、23a和24f;f)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15a、23b和24f;g)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15c、23a和23b;h)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15c、23a和24f;i)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15c、23b和24f;或j)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、23a、23b和24f。
141.在一个方面,所述多价肺炎球菌缀合物组合物包含肺炎球菌荚膜多糖-蛋白质缀合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物包含24种不同的肺炎球菌荚膜多糖
‑ꢀ
蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、 4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、 19f、22f、23a、23b、23f、24f、33f和35b。该多价肺炎球菌缀合物组合物也称为pcv-24。在pcv-24的某些实施方案中,所述肺炎链球菌血清型中的至少一种是35b。在pcv-24的某些实施方案中,所述肺炎链球菌血清型包含1、3、4、5、6a、6b、7f、8、9n、9v、 10a、11a、12f、14、15b、18c、19a、19f、22f、23f、33f和35b,并且两种血清型选自15a、15c、23a、23b和24f。例如,pcv-24包含肺炎球菌荚膜多糖-蛋白质缀合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物可以包含24种不同的肺炎球菌荚膜多糖-蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型是:
a)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15a和15c;b)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15a和23a;c)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15a和23b;d)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15a和24f;e)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15c和23a;f)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15c和23b;g)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、15c和24f;h)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、23a和23b;i)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、23a和24f;或j)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b、23b和24f。
142.在一个方面,所述多价肺炎球菌缀合物组合物包含肺炎球菌荚膜多糖-蛋白质缀合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物包含23种不同的肺炎球菌荚膜多糖
‑ꢀ
蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、 4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、 19f、22f、23a、23b、23f、24f、33f和35b。该多价肺炎球菌缀合物组合物也称为pcv-23。在pcv-23的某些实施方案中,所述肺炎链球菌血清型中的至少一种是35b。在pcv-23的某些实施方案中,所述肺炎链球菌血清型包含1、3、4、5、6a、6b、7f、8、9n、9v、 10a、11a、12f、14、15b、18c、19a、19f、22f、23f、33f和35b,并且一种血清型选自15a、15c、23a、23b和24f。例如,pcv-23包含肺炎球菌荚膜多糖-蛋白质缀合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物可以包含23种不同的肺炎球菌荚膜多糖-蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型是:a)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b和15a;b)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b和15c;c)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b和23a;
d)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b和23b;或e)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f、35b和24f。
143.在一个方面,所述多价肺炎球菌缀合物组合物包含肺炎球菌荚膜多糖-蛋白质缀合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物包含22种不同的肺炎球菌荚膜多糖
‑ꢀ
蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型选自1、3、 4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、 19f、22f、23a、23b、23f、24f、33f和35b。该多价肺炎球菌缀合物组合物也称为pcv-22。例如,pcv-22包含肺炎球菌荚膜多糖-蛋白质缀合物,其中所述肺炎球菌荚膜多糖-蛋白质缀合物可以包含22种不同的肺炎球菌荚膜多糖-蛋白质缀合物或由其组成,其中每种肺炎球菌荚膜多糖-蛋白质缀合物包含与来自肺炎链球菌的不同血清型的荚膜多糖缀合的蛋白质载体,其中所述肺炎链球菌血清型是:a)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f和15a;b)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f和15c;c)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f和23a;d)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f和23b;e)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f和24f;或f)1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、 19f、22f、23f、33f和35b。
144.pcv-22、pcv-23、pcv-24、pcv-25、pcv-26和pcv-27实施方案还可以包含除血清型1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、 15c、18c、19a、19f、22f、23a、23b、23f、24f、33f和35b以外的目的肺炎链球菌血清型。例如,在某些实施方案中,pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27 还包含肺炎链球菌血清型2、12a、16f、17f、20a、20b、20f、31、45和46中的一种或多种。在某些实施方案中,pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27还包含肺炎链球菌血清型6c、6d、7b、7c、18b、21、22a、24b、27、28a、34、35f、38 和39中的一种或多种。也可以将其他目的肺炎链球菌血清型添加至pcv-22、pcv-23、 pcv-24、pcv-25、pcv-26或pcv-27中的任何一种中。
145.还可以用除血清型1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、 14、15a、15b、15c、18c、19a、19f、22f、23a、23b、23f、24f、33f和35b以外的一种或多种目的肺炎链球菌血清型替代pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27的一种或多种肺炎链球菌血清型。例如,在某些实施方案中,pcv-22、pcv-23、 pcv-24、pcv-25、pcv-26或pcv-27中的血清型1、3、4、5、6a、6b、7f、8、9n、9v、 10a、11a、12f、14、15a、15b、15c、18c、19a、19f、22f、23a、23b、23f、
24f、 33f和35b中的一种或多种被肺炎链球菌血清型2、12a、14、16f、20a、20b、20f、31、 45和46中的一种或多种替代。在某些实施方案中,pcv-22、pcv-23、pcv-24、pcv-25、 pcv-26或pcv-27中的血清型1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、 14、15a、15b、15c、18c、19a、19f、22f、23a、23b、23f、24f、33f和35b中的一种或多种被肺炎链球菌血清型6c、6d、7b、7c、18b、21、22a、24b、27、28a、34、 35f、38和39中的一种或多种替代。其他目的肺炎链球菌血清型也可以用于替代pcv-22、 pcv-23、pcv-24、pcv-25、pcv-26或pcv-27中的任一种中的血清型1、3、4、5、6a、 6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、22f、 23a、23b、23f、24f、33f和35b中的一种或多种。
146.载体蛋白
147.在多糖-蛋白质缀合物疫苗中,载体蛋白与多糖抗原缀合以形成糖缀合物。载体蛋白有助于增强对多糖抗原的免疫应答(例如抗体应答)。使用标准缀合程序,载体蛋白应能够与肺炎球菌多糖缀合。
148.可用于糖缀合物中的载体蛋白包括但不限于dt(白喉类毒素)、tt(破伤风类毒素)、tt的片段c、crm
197
(保留了野生型白喉毒素的免疫学特性的白喉毒素遗传衍生非毒性变体)、其他遗传衍生白喉毒素变体(例如,crm176、crm228、crm45 (uchida等人(1973)j.biol.chem.218:3838-3844)、crm9、crm102、crm103或crm107;以及nicholls和youle在genetically engineered toxins,ed:frankel,marcel dekker inc. (1992)中描述的其他突变;glu-148的缺失或突变为asp、gln或ser和/或ala 158突变为gly 以及美国专利号4,709,017和4,950,740中公开的其他突变;至少一种或多种残基lys 516、 lys 526、phe 530和/或lys 534的突变以及美国专利号5,917,017和6,455,673中公开的其他突变;或美国专利号5,843,711中公开的片段、肺炎球菌肺炎球菌溶血素(ply)(kuo等人(1995)infect immun 63:2706-2713)(包括以某种方式脱毒的ply,例如dply-gmbs(wo 2004/081515、wo 2006/032499)或dply-甲醛)、phtx(包括phta、phtb、phtd、phte (phta、phtb、phtd或phte的序列公开在wo 00/37105和wo 00/39299中))以及pht蛋白的融合物(例如phtde融合物、phtbe融合物、pht a-e(wo 01/98334、wo 03/054007、 wo 2009/000826)、通常从脑膜炎奈瑟氏菌(neisseria meningitidis)血清组b提取 (ep0372501)的ompc(脑膜炎球菌外膜蛋白)、porb(来自脑膜炎奈瑟氏菌)、pd (流感嗜血杆菌蛋白d;参见例如,ep0594610 b)或其免疫功能等同物、合成肽 (ep0378881、epo427347)、热休克蛋白(wo 93/17712、wo 94/03208)、百日咳蛋白(wo 98/58668、epo471177)、细胞因子、淋巴因子、生长因子或激素(wo 91/01146)、来自多种病原体衍生抗原的包含多个人cd4 t细胞表位的人造蛋白(falugi等人(2001) eur j immunol 31:3816-3824),所述病原体衍生抗原如n19蛋白(baraldoi等人(2004)infect immun 72:4884-4887)、肺炎球菌表面蛋白pspa(wo 02/091998)、铁摄取蛋白(wo 01/72337)、艰难梭菌(clostridium difficile)的毒素a或b(wo 00/61761)、转铁蛋白结合蛋白、肺炎球菌黏附蛋白(psaa)、重组铜绿假单胞菌(pseudomonas aeruginosa) 外毒素a(特别是其无毒突变体(如携带谷氨酸553处的取代的外毒素a(douglas等人 (1987)j.bacteriol.169(11):4967-4971))。其他蛋白质(如卵白蛋白、钥孔戚血蓝素(klh)、牛血清白蛋白(bsa)或结核菌素的纯化蛋白衍生物(ppd))也可以用作载体蛋白。其他合适的载体蛋白包括灭活的细菌毒素,如霍乱类毒素(例如,如wo 2004/083251中所述)、大肠杆菌lt、大肠杆菌st和来自铜绿假单胞菌的外毒素a及其免疫功能等同物也可以用作本发明中
的载体蛋白。当在本说明书中提及每一种所述载体蛋白时,它们应理解为包括其免疫功能等同物。
149.在某些实施方案中,糖缀合物的载体蛋白选自tt(包括tt的片段c)、dt(包括dt变体,如crm
197
和上面讨论的其他变体)、pd、phtx、phtd、phtde融合物(尤其是在wo 01/98334和wo 03/054007中公开的那些)、脱毒的肺炎球菌溶血素、porb、n19 蛋白、pspa、ompc、艰难梭菌的毒素a或b以及psaa。当在本说明书中提及每一种所述载体蛋白时,它们应理解为包括其免疫功能等同物。本领域技术人员将理解,当在说明书中提及dt时,例如作为其免疫功能等同物的dt突变体(包括但不限于以上讨论的那些) 也被包括在内。
150.在某些实施方案中,所述糖缀合物的载体蛋白选自dt(白喉类毒素)、crm
197
、 tt(破伤风类毒素)、tt和pd(流感嗜血杆菌的蛋白d)的片段c。
151.在一个实施方案中,本发明的糖缀合物的载体蛋白可以是dt(白喉类毒素)。天然存在的或野生型白喉毒素可以从产生毒素的菌株获得,所述产生毒素的菌株可从多种公共来源(包括美国菌种保藏中心(atcc))获得。如本文所用,术语dt(白喉类毒素)旨在包括用作其功能等同物的所有dt变体。此类dt突变体包括例如crm176、 crm228、crm45、crm9、crm102、crm103或crm107;与野生型dt相比,glu148 缺失或突变为asp(公开在美国专利号4,709,017中);美国专利号4,709,017和4,950,740 中公开的glu148缺失或突变为asp、ala158缺失或突变为gly;美国专利号5,917,017中公开的选自lys 516、lys 526、phe 530和lys 534的至少一个或多个残基的突变以及美国专利号6,455,673或美国专利号5,843,711中公开的glu148、glu349、lys516或/和phe530的突变等,但不限于此。在一个实施方案中,分离的荚膜糖与crm
197
蛋白缀合。crm
197
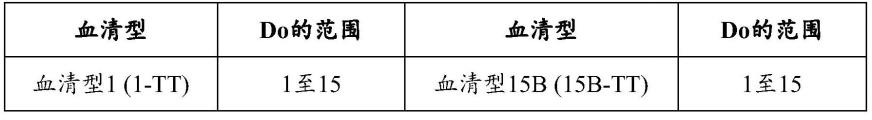
蛋白是一种无毒形式的白喉毒素,其保留了野生型白喉毒素的免疫特性。crm
197
是由通过亚硝基胍诱变产毒性棒状噬菌体β而产生的非产毒性噬菌体β
197
tox感染的白喉棒状杆菌 (corynebacterium diphtheriae)产生的(uchida等人(1971)nature new biology 233:8-11)。 crm
197
蛋白与白喉毒素具有相同的分子量,但与其不同之处在于结构基因中的单个碱基变化(鸟嘌呤至腺嘌呤)。这种单个碱基变化导致成熟蛋白质中的氨基酸取代(甘氨酸取代谷氨酸),并消除了白喉毒素的毒性。crm
197
蛋白是一种用于糖的安全且有效的t 细胞依赖性载体。关于crm
197
及其产生的进一步细节可以在例如美国专利号5,614,382中找到,将所述专利通过引用以其整体并入于此。
152.在另一个实施方案中,所述糖缀合物的载体蛋白是tt(破伤风类毒素)。破伤风类毒素被制备并在全球范围内用于针对由破伤风梭菌(clostridium tetani)引起的破伤风(或牙关紧闭症)的大规模免疫。破伤风类毒素既可单独使用又可与白喉和/或百日咳疫苗组合使用。母体蛋白质破伤风毒素通常在破伤风梭菌的培养物中获得。破伤风毒素是约150kda的蛋白质,并且由通过二硫键连接的两个亚基(约100kda和约50kda)组成。所述毒素通常用甲醛脱毒,并且可以使用已知方法如硫酸铵沉淀(参见例如,levin 和stone,j.immunol.,67:235-242(1951);w.h.o.manual for the production and control ofvaccines:tetanus toxoid,1977(blg/undp/77.2rev.i.))或例如wo 1996/025425中公开的色谱技术从培养物滤液纯化。破伤风毒素也可以通过重组遗传手段来灭活。
153.在另一个实施方案中,所述糖缀合物的载体蛋白可以是pd(流感嗜血杆菌的蛋白d;参见例如,ep 0594610b)。
154.在某些实施方案中,在多价肺炎球菌缀合物组合物中使用单一载体蛋白。在某些
实施方案中,使用多于一种蛋白质载体(“混合载体”)。在这些混合载体实施方案中,可以使用2、3、4、5、6、7、8、9或更多种载体蛋白。通常,混合载体实施方案包含两种载体蛋白。例如,在某些实施方案中,某些荚膜多糖与第一蛋白质载体缀合,并且其余荚膜多糖附接至第二蛋白质载体。
155.在一个方面,第一蛋白质载体是crm
197
并且第二蛋白质载体是破伤风类毒素。在某些实施方案中,所述荚膜多糖中的两种与破伤风类毒素缀合,并且其余荚膜多糖与 crm
197
缀合。在某些实施方案中,与破伤风类毒素缀合的所述两种荚膜多糖选自血清型1、3和5。在某些实施方案中,所述荚膜多糖中的四种与破伤风类毒素缀合,并且其余荚膜多糖与crm
197
缀合。在某些实施方案中,与破伤风类毒素缀合的所述四种荚膜多糖选自血清型1、3、5、15b和22f。在某些实施方案中,与破伤风类毒素缀合的所述四种荚膜多糖是血清型1、5、15b和22f;血清型1、3、15b和22f;或血清型3、5、15b和22f。
156.在pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27的一些实施方案中,来自血清型1和5的荚膜多糖与破伤风类毒素缀合,并且来自其余血清型的荚膜多糖与 crm
197
缀合。在pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27中的另一个实施方案中,来自血清型1和3的荚膜多糖与破伤风类毒素缀合,并且其余荚膜多糖与crm
197
缀合。在pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27中的另一个实施方案中,来自血清型3和5的荚膜多糖与破伤风类毒素缀合,并且其余荚膜多糖与crm
197
缀合。在 pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27的另一个实施方案中,来自血清型1、5、15b和22f的荚膜多糖与破伤风类毒素缀合,并且其余荚膜多糖与crm
197
缀合。在pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27的另一个实施方案中,来自血清型1、3、15b和22f的荚膜多糖与破伤风类毒素缀合,并且其余荚膜多糖与crm
197
缀合。在pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27的另一个实施方案中,来自血清型3、5、15b和22f的荚膜多糖与破伤风类毒素缀合,并且其余荚膜多糖与crm
197
缀合。
157.包括来自血清型1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、 14、15a、15b、15c、18c、19a、19f、22f、23a、23b、23f、24f、33f和35b的荚膜多糖在内的用于本文所述的组合物和疫苗中的肺炎球菌荚膜多糖可以使用可用技术从肺炎链球菌制备,所述可用技术包括本领域普通技术人员已知的标准技术,包括例如wo 2006/110381、wo 2008/118752、wo 2006/110352以及美国专利申请公开号2006/0228380、 2006/0228381、2007/0184071、2007/0184072、2007/0231340、2008/0102498和2008/0286838 中公开的那些,将其全部通过引用以其整体并入。例如,每种肺炎球菌荚膜多糖血清型可以在培养基(例如,大豆基培养基)中生长。裂解细胞,并且可以通过离心、沉淀、超滤和/或柱色谱从裂解物纯化单独多糖。另外,可以使用合成方案产生肺炎球菌荚膜寡糖。
158.肺炎链球菌的荚膜多糖包含重复寡糖单元,其可以含有最多8个糖残基。荚膜糖抗原可以是全长多糖,或者可以降低其大小(例如,单个寡糖单元或短于重复寡糖单元的糖链的天然长度)。通过本领域已知的多种方法可以降低荚膜多糖的大小,所述方法如酸水解处理、过氧化氢处理、通过高压均化器定型任选地接着进行过氧化氢处理以产生寡糖片段、或微流化。在某些实施方案中,在使纯化的荚膜多糖与氧化剂反应以产生激活的荚膜多糖之前,使纯化的荚膜多糖进行定型步骤以降低其大小,如酸水解处理或微流化。在某些实施方案中,在使纯化的荚膜多糖与氧化剂反应以产生激活的荚膜多糖之前,荚膜多糖不进行定
型步骤,如酸水解处理或微流化。
159.每种血清型的肺炎球菌缀合物可以通过将每种血清型的荚膜多糖与载体蛋白缀合来制备。不同的肺炎球菌缀合物可以配制成一种组合物,包括单剂量配制品。
160.荚膜多糖的激活
161.为了制备多糖-蛋白质缀合物,可以将从每种肺炎球菌血清型制备的荚膜多糖进行化学激活,使得荚膜多糖可以与载体蛋白反应。激活后,每种荚膜多糖可以与载体蛋白单独缀合以形成糖缀合物。通过常规方法可以实现多糖的化学激活和随后的载体蛋白的缀合。
162.例如,荚膜多糖的末端处的邻接羟基基团可以通过氧化试剂(如高碘酸盐(包括高碘酸钠、高碘酸钾或高碘酸))氧化为醛基团,如例如美国专利号4,365,170、4,673,574 和4,902,506中所公开,将其通过引用以其整体并入于此。高碘酸盐将碳水化合物的邻接羟基基团随机氧化以形成反应性醛基团,并导致c-c键的切割。术语“高碘酸盐”包括高碘酸盐和高碘酸二者。该术语还包括偏高碘酸盐(io
4-)和正高碘酸盐(io
65-)二者。术语“高碘酸盐”还包括高碘酸盐的各种盐,包括高碘酸钠和高碘酸钾。在某些实施方案中,所述多糖可以在偏高碘酸钠的存在下氧化。
163.在某些实施方案中,高碘酸盐可以以每1μg多糖约0.03-0.17μg的量使用。在某些实施方案中,高碘酸盐可以以每1μg多糖约0.025-0.18μg或约0.02-0.19μg的量使用。可以在上述范围内根据需要激活所述糖。在所述范围之外,效果可能是不令人满意的。
164.也可以用1-氰基-4-二甲基氨基吡啶四氟硼酸盐(cdap)激活多糖以形成氰酸酯。然后将激活的多糖直接或经由间隔物或接头基团与载体蛋白上的氨基基团偶联。
165.例如,所述间隔物可以是胱胺或半胱胺以得到硫醇化多糖,其可以经由与马来酰亚胺激活的载体蛋白(例如使用n-[y-马来酰亚胺基丁氧基]琥珀酰亚胺酯(gmbs)) 或卤代乙酰化载体蛋白(例如使用碘乙酰胺、n-琥珀酰亚胺基溴乙酸酯(sba;sib)、 n-琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯(slab)、磺基琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯(磺基-siab)、n-琥珀酰亚胺基碘乙酸酯(sia)或琥珀酰亚胺基3-[溴乙酰胺基]丙酸酯(sbap))反应后得到的硫醚连接与所述载体偶联。优选地,氰酸酯(任选地通过coap化学制备)与己烷二胺或己二酸二酰肼(aoh)偶联,并且氨基衍生化糖使用碳二亚胺(例如,edac或edc)化学经由蛋白质载体上的羧基基团与载体蛋白缀合。此类缀合物描述在例如wo 93/15760、wo 95/08348和wo 96/129094中,将其全部通过引用以其整体并入于此。
[0166]
在激活步骤之后,将激活的荚膜多糖任选地冻干,之后将激活的多糖与载体蛋白混合。所述激活的多糖和载体蛋白可以单独冻干,或者可以彼此合并,然后冻干。
[0167]
激活的荚膜多糖可以在任何低温保护剂如糖的存在下冻干。例如,所述糖可以选自但不限于蔗糖、海藻糖、棉子糖、水苏碱(stachiose)、松三糖、葡聚糖、甘露醇、乳糖醇和帕拉金糖醇(palatinit)。在某些实施方案中,所述糖是蔗糖。然后在缀合反应将冻干的多糖重悬于溶剂中。冻干的激活的荚膜多糖可以与包含载体蛋白的溶液混合。可替代地,在缀合反应之前将共同冻干的多糖和载体蛋白重悬于溶剂中。
[0168]
激活的荚膜多糖与载体蛋白的缀合
[0169]
可以例如通过还原胺化实现激活的荚膜多糖和载体蛋白的缀合,如例如美国专利申请公开号2006/0228380、2007/0231340、2007/0184071和2007/0184072、wo 2006/
110381、wo 2008/079653和wo 2008/143709中所描述,将其全部通过引用以其整体并入。例如,激活的荚膜多糖和载体蛋白可以与还原剂反应以形成缀合物。合适的还原剂包括硼氢化物,如氰基硼氢化钠、硼烷-吡啶、三乙酰氧基硼氢化钠、硼氢化钠或硼氢化物交换树脂。在还原反应结束时,缀合物中可能存在未反应的醛基团。可以使用合适的封端剂如硼氢化钠(nabh4)对未反应的醛基团封端。在实施方案中,还原反应在水性溶剂中进行。在另一个实施方案中,反应在非质子溶剂中进行。在一个实施方案中,还原反应在dmso(二甲基亚砜)中或在dmf(二甲基甲酰胺)溶剂中进行。其他可能的还原剂包括但不限于胺-硼烷,如吡啶-硼烷、2-皮考啉-硼烷、2,6-二硼烷-甲醇、二甲胺
ꢀ‑
硼烷、t-bumeiprn-bh3、苄胺-bh3或5-乙基-2-甲基吡啶-硼烷(pemb)。
[0170]
激活的荚膜多糖可以直接或间接地通过使用间隔物或接头如双官能接头与载体蛋白缀合。所述接头是任选的异双官能的或同双官能的,具有例如一个反应性氨基基团和一个反应性羧酸基团、2个反应性氨基基团或两个反应性羧酸基团。
[0171]
其他合适的缀合技术使用碳二亚胺、酰肼、活性酯、降冰片烷、对硝基苯甲酸、 n-羟基琥珀酰亚胺、s
‑‑
nhs、edc、tstu,如例如在国际专利申请公开号wo 98/42721 中所描述,将其通过引用以其整体并入。缀合可以涉及羰基接头,其可以通过糖的游离羟基基团与1,1'-羰二咪唑(cdl)的反应形成(参见bethell等人(1979)j.biol.chem. 254:2572-2574;hearn等人(1981)j.chromatogr.218:509-518),接着与蛋白质反应形成氨基甲酸酯连接。这可能涉及将异头物末端还原为伯醇羟基基团、任选伯醇羟基基团的保护/脱保护、伯醇羟基基团与cdi反应以形成cdi氨基甲酸酯中间体以及使cdl氨基甲酸酯中间体与蛋白质上的氨基基团偶联。
[0172]
用于肺炎球菌缀合物疫苗的多糖与载体蛋白的比率通常在0.3-3.0(w/w)的范围内,但可以随着血清型变化。所述比率可以通过独立测量存在的蛋白质和多糖的量,或通过本领域中已知的给出所述比率的直接测量值的方法来确定。采用双重监测(例如分别针对总物质和蛋白质含量的折射率和uv)的包括1h nmr光谱或sec-hplc-uv/ri 的方法以及通过sec-hplc-malls或maldi-tof-ms可以对糖/蛋白质比率在缀合物的大小分布上进行谱分析。
[0173]
可以纯化如此获得的多糖-蛋白质缀合物并通过各种方法纯化和富集。这些方法包括浓缩/渗滤、柱色谱和深度过滤。将纯化的多糖-蛋白质缀合物组合以配制多价肺炎球菌缀合物组合物,其可以用作疫苗。
[0174]
配制品
[0175]
可以使用本领域公认的方法完成疫苗组合物的配制。疫苗组合物被配制为与其预期的施用途径相容。单独肺炎球菌荚膜多糖-蛋白质缀合物可以与生理学上可接受的媒介物一起配制以制备所述组合物。此类媒介物的例子包括但不限于水、缓冲盐水、多元醇(例如,甘油、丙二醇、液体聚乙二醇)和右旋糖溶液。
[0176]
在一些实施方案中,多价肺炎球菌缀合物组合物还包含佐剂。如本文所用,“佐剂”是指非特异性增强对抗原的免疫应答的物质或媒介物。佐剂可以包括但不限于以下:
[0177]
(1)铝盐(铝),如氢氧化铝、磷酸铝、硫酸铝、羟基磷酸硫酸铝等;
[0178]
(2)水包油乳液配制品(有或没有其他特异性免疫刺激剂,例如胞壁肽(下文定义的)或细菌细胞壁组分),例如像(a)使用微流化床如型号110y微流化床 (microfluidics,
newton,mass.)配制成亚微米颗粒的mf59(wo 90/14837),其含有5%角鲨烯、0.5%tween 80和0.5%span 85(任选含有各种量的mtp-pe(参见下文),虽然未要求),(b)微流化为亚微米乳液或涡旋以生成较大粒度乳液的saf,其含有10%角鲨烯、0.4%tween 80、5%普朗尼克阻断的聚合物l121以及thr-mdp(参见下文),以及(c) ribi
tm
佐剂系统(ras)(corixa,hamilton,mont.),其含有2%角鲨烯、0.2%tween 80 以及一种或多种细菌细胞壁组分,所述细菌细胞壁组分来自由美国专利号4,912,094中描述的3-o-脱酰化单磷酰脂质a(mpl
tm
)、海藻糖二霉菌酸酯(tdm)以及细胞壁骨架 (cws)、优选mpl cws(detox
tm
)组成的组;
[0179]
(3)皂苷佐剂,如quil a或stimulon
tm
qs-21(antigenics,framingham,mass.) (美国专利号5,057,540)或由其产生的颗粒如iscom(免疫刺激复合物);
[0180]
(4)细菌脂多糖、合成脂质a类似物(如氨基烷基葡糖胺磷酸盐化合物(agp) 或其衍生物或类似物),其可从corixa获得并且描述在美国专利号6,113,918中;一个这样的agp是2-[(r)-3-十四酰基氧基十四酰基氨基]乙基2-脱氧-4-0-磷酸-3-0-[(r)-3-十四酰基氧基十四酰基]-2-[(r)-3-十四酰基氧基十四酰基氨基]-b-d-吡喃葡萄糖苷,其也称为529 (以前称为rc529),其被配制成水性形式或作为稳定的乳液,
[0181]
(5)合成多核苷酸,如含有一个或多个cpg基序(美国专利号6,207,646)的寡核苷酸;
[0182]
(6)细胞因子,如白介素(例如,il-1、il-2、il-4、il-5、il-6、il-7、il-12、 il-15、il-18等)、干扰素(例如,γ干扰素)、粒细胞巨噬细胞菌落刺激因子(gm-csf)、巨噬细胞菌落刺激因子(m-csf)、肿瘤坏死因子(tnf)、共刺激分子b7-1和b7-2等;
[0183]
(7)细菌adp核糖基化毒素的脱毒突变体,如根据wo 00/18434(还参见wo 02/098368和wo 02/098369)的呈野生型或突变形式(例如其中氨基酸位置29处的谷氨酸被另一种氨基酸、优选组氨酸替代)的霍乱毒素(ct)、百日咳毒素(pt)或大肠杆菌热不稳定毒素(lt)、特别是lt-k63、lt-r72、ct-s109、pt-k9/g129(参见例如, wo 93/13302和wo 92/19265);以及
[0184]
(8)补体组分,如补体组分c3d;
[0185]
(9)生物分子,如脂质和共刺激分子。示例性生物佐剂包括as04、il-2、rantes、gm-csf、tnf-α、ifn-γ、g-csf、lfa-3、cd72、b7-1、b7-2、ox-40l和 41bbl。
[0186]
胞壁肽包括但不限于n-乙酰基-胞壁酰-l-苏氨酰-d-异谷氨酰胺(thr-mdp)、 n-乙酰基-正胞壁酰-l-丙氨酸-2-(1'-2’二棕榈酰-sn-甘油-3-羟基磷酰氧基)-乙胺(mtp-pe) 等。
[0187]
所述佐剂是根据组合物中缀合物的量和效价来适当选择的。在一些实施方案中,所述佐剂是铝基佐剂。当使用铝基佐剂时,可以添加基于铝元素的组合物中的铝元素以包含0.01mg/ml至1mg/ml。通常,单个0.5ml疫苗剂量被配制为含有约0.1mg至2.5mg 铝基佐剂。在其他实施方案中,单个0.5ml疫苗剂量被配制为含有在0.1mg至2mg、0.1mg 至1mg、0.1mg至0.5mg、0.1mg至0.2mg、0.125mg至2.5mg、0.125mg至0.5mg、0.125 mg至0.2mg或0.125至0.25mg之间的铝基佐剂。在某些实施方案中,单个0.5ml疫苗剂量被配制为含有约0.125mg至约0.250mg铝基佐剂。在某些实施方案中,单个0.5ml疫苗剂量被配制为含有约0.125mg铝基佐剂。在某些实施方案中,单个0.5ml疫苗剂量被配制为含有约0.250mg铝基佐剂。
[0188]
在特定实施方案中,所述佐剂选自磷酸铝、硫酸铝和氢氧化铝。
[0189]
在特定实施方案中,所述佐剂是磷酸铝。
[0190]
在一些实施方案中,所述组合物用作针对肺炎链球菌感染的疫苗。肺炎球菌荚膜多糖-蛋白质载体缀合物的表征
[0191]
在某些实施方案中,所述多糖-蛋白质载体缀合物可以具有100-10,000kda的分子量。在某些实施方案中,所述缀合物具有200-9,000kda的分子量。在某些实施方案中,所述缀合物具有300-8,000kda的分子量。在某些实施方案中,所述缀合物具有400-7,000 kda的分子量。在某些实施方案中,所述缀合物具有500-6,000kda的分子量。在某些实施方案中,所述缀合物具有600-5,000kda的分子量。在某些实施方案中,所述缀合物具有 500-4,000kda分子量的分子量。上述任何范围内的任何整数被认为是本公开文本的实施方案。
[0192]
当分子量在上述范围内时,所述缀合物可以稳定地以高产率形成。此外,可以降低游离多糖的比例。另外,可以在上述分子量范围内实现优异的免疫原性。
[0193]
在纯化单独多糖-蛋白质缀合物之后,它们被混合以配制本公开文本的免疫原性组合物。
[0194]
本公开文本的血清型的糖-蛋白质缀合物可以通过多糖与蛋白质载体的比率 (多糖的量/蛋白质载体的量,w/w)来表征。
[0195]
在某些实施方案中,对于每种血清型,多糖-蛋白质载体缀合物中的多糖与蛋白质载体的比率(w/w)是0.5-2.5、0.4-2.3、0.3-2.1、0.24-2、0.2-1.8、0.18-1.6、0.16-1.4、 0.14-1.2、0.12-1、0.1-1、0.4-1.3、0.5-1或0.7-0.9(例如,约0.7、约0.8、约0.9、约1.0、约 1.1、约1.2、约1.3、约1.4、约1.5、约1.6、约1.7、约1.8、约1.9、约2.0、约2.1、约2.2、约2.3、约2.4或约2.5)。
[0196]
当多糖与蛋白质载体的比率在上述范围内时,所述缀合物可以稳定地以高产率形成。此外,可以降低游离多糖的比例。另外,可以实现优异的免疫原性,并且所述缀合物可以稳定地保持而不会被上述范围内的其他血清型干扰。
[0197]
本公开文本的缀合物和免疫原性组合物可以含有不与蛋白质载体共价缀合但是仍然存在于多糖-蛋白质载体缀合物组合物中的游离多糖。游离多糖可以与多糖-蛋白质载体缀合物非共价缔合(即,非共价结合至、吸附至或截留在多糖-蛋白质载体缀合物中)。
[0198]
在某些实施方案中,基于每种血清型的多糖的总量,所述多糖-蛋白质载体缀合物含有少于约60%、约50%、45%、40%、35%、30%、25%、20%或15%的每种血清型的游离多糖。在某些实施方案中,基于每种血清型的多糖的总量,每种血清型的多糖-蛋白质载体缀合物含有少于约60%的每种血清型的游离多糖。在某些实施方案中,基于每种血清型的多糖的总量,每种血清型的多糖-蛋白质载体缀合物含有少于约50%的每种血清型的游离多糖。在某些实施方案中,基于每种血清型的多糖的总量,每种血清型的多糖-蛋白质载体缀合物含有少于约40%的每种血清型的游离多糖。在某些实施方案中,基于每种血清型的多糖的总量,每种血清型的多糖-蛋白质载体缀合物含有少于约30%的每种血清型的游离多糖。在某些实施方案中,基于每种血清型的多糖的总量,每种血清型的多糖-蛋白质载体缀合物含有少于约25%的每种血清型的游离多糖。在某些实施方案中,基于每种血清型的多糖的总量,每种血清型的多糖-蛋白质载体缀合物含有少于约20%的每种血清型的游离多糖。在某些实施方案中,基于每种血清型的多糖的总量,每种血清型的多糖-蛋白质载体缀
合物含有少于约15%的每种血清型的游离多糖。在某些实施方案中,基于每种血清型的多糖的总量,每种血清型的多糖-蛋白质载体缀合物含有少于约10%的每种血清型的游离多糖。
[0199]
每种血清型的多糖-蛋白质载体缀合物也可以通过其分子大小分布(kd)来表征。尺寸排阻色谱介质(cl-4b;交联琼脂糖珠,4%)可以用于测定缀合物的相对分子大小分布。尺寸排阻色谱(sec)用于重力给料柱以对缀合物的分子大小分布进行谱分析。从介质中的孔排除的大分子比小分子更快地洗脱。级分收集器用于收集柱洗脱液。通过糖测定通过比色测试级分。为了确定kd,校准所述柱以确定分子被完全排除的级分 (v0;kd=0)以及代表最大保留的级分(vi;kd=1)。达到指定样品属性的级分(ve) 通过表达式kd=(v
e-v0)/(v
i-v0)与kd相关联。
[0200]
在某些实施方案中,至少15%的每种血清型的多糖-蛋白质载体缀合物可以在 cl-4b柱中具有0.3或更低的kd。
[0201]
在某些实施方案中,至少20%的每种血清型的多糖-蛋白质载体缀合物可以在 cl-4b柱中具有0.3或更低的kd。在某些实施方案中,至少15%、20%、25%、30%、35%、 40%、45%、50%、55%、60%、65%、70%、75%、80%、85%或90%的每种血清型的多糖-蛋白质载体缀合物可以在cl-4b柱中具有0.3或更低的kd。在某些实施方案中,至少60%的每种血清型的多糖-蛋白质载体缀合物可以在cl-4b柱中具有0.3或更低的kd。在某些实施方案中,至少50%-80%的每种血清型的多糖-蛋白质载体缀合物可以在cl-4b柱中具有 0.3或更低的kd。在某些实施方案中,至少65%-80%的每种血清型的多糖-蛋白质载体缀合物可以在cl-4b柱中具有0.3或更低的kd。在某些实施方案中,至少15%-60%的每种血清型的糖-蛋白质缀合物可以在cl-4b柱中具有0.3或更低的kd。预防方法与用途
[0202]
在一个方面,本公开文本提供了一种疫苗,其包含多价肺炎球菌缀合物组合物 (例如,pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)和药学上可接受的赋形剂。在一些实施方案中,所述药学上可接受的赋形剂至少包括缓冲液(如琥珀酸盐缓冲液)、盐(如氯化钠)和/或表面活性剂(如聚氧乙烯脱水山梨糖醇酯(例如,聚山梨醇酯80)。
[0203]
在一些实施方案中,所述疫苗引发了通过肺炎链球菌感染引起的在人受试者中的保护性免疫应答。
[0204]
根据另一方面,本公开文本提供了一种用于预防肺炎链球菌感染或疾病的方法,所述方法包括向人受试者施用预防有效量的多价肺炎球菌缀合物组合物(例如,pcv-22、 pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)或包含其的疫苗。所述多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)或包含其的疫苗可以通过任何途径施用,包括例如通过系统性或黏膜途径,如下面进一步详细描述的。
[0205]
在某些实施方案中,所述人受试者是老年受试者,并且所述疾病是肺炎或侵袭性肺炎球菌疾病(ipd)。在某些实施方案中,所述老年受试者至少50岁。在其他实施方案中,所述老年受试者至少55岁。在又其他实施方案中,所述老年受试者至少60岁。
[0206]
在其他实施方案中,所述人受试者是婴儿,并且所述疾病是肺炎、侵袭性肺炎球菌疾病(ipd)或急性中耳炎(aom)。在某些实施方案中,所述婴儿是0-2岁。在其他实施方案中,所述婴儿是2至15个月。
[0207]
在另一个实施方案中,所述人受试者是6周龄至17岁,并且所述疾病是肺炎、侵袭性肺炎球菌(ipd)或急性中耳炎(aom)。在某些实施方案中,所述人受试者是6 周龄至5岁。在其他实施方案中,所述人受试者是5至17岁。
[0208]
可以选择每个疫苗剂量中的缀合物的量或混合载体、多价肺炎球菌缀合物的预防有效量作为诱导预防且无明显不良作用的量。这种量可以根据肺炎球菌血清型而变化。通常,每个剂量可以包含约0.1μg至约100μg多糖,特别地约0.1至10μg以及更特别地约1 μg至约5μg。通过涉及观察受试者中的适当免疫应答的标准研究,可以确定特定疫苗的组分的最佳量。例如,可以通过外推动物测试结果来确定人受试者的疫苗接种量。另外,可以根据经验确定剂量。
[0209]
在一些实施方案中,所述疫苗或所述多价肺炎球菌缀合物组合物(例如, pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)可以是单个0.5ml剂量,其被配制为含有约1μg至约5μg的每种荚膜多糖;约20μg至约85μg载体蛋白(例如,crm
197
);以及任选约0.1mg至约0.5mg元素铝佐剂。在一些实施方案中,所述疫苗或所述多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)可以是单个0.5ml剂量,其被配制为含有约2μg至约2.5μg的每种荚膜多糖,但血清型6b以及任选血清型3除外,它们以约4μg至约5μg的量存在;约40μg至约75μg蛋白质载体(例如,crm
197
);以及任选约0.1mg至约0.25mg元素铝佐剂。
[0210]
在一些实施方案中,所述疫苗或所述混合载体、多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)可以是单个0.5ml剂量,其被配制为含有约1μg至约5μg的每种荚膜多糖;约1μg至约30μg第一载体蛋白(例如, tt);约20μg至约100μg第二载体蛋白(例如,crm
197
);以及任选约0.1mg至约0.5mg 元素铝佐剂。
[0211]
在一些实施方案中,所述疫苗或所述混合载体、多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)可以是单个0.5ml剂量,其被配制为含有约2μg至约2.5μg的每种荚膜多糖,但血清型6b以及任选血清型3除外,它们以约4μg至约5μg的量存在;约2μg至约25μg第一载体蛋白(例如,tt);约40μg 至约100μg第二载体蛋白(例如,crm
197
);以及任选约0.1mg至约0.25mg元素铝佐剂。
[0212]
在一些实施方案中,所述疫苗或所述多价肺炎球菌缀合物组合物(例如, pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)可以是单个0.5ml剂量,其被配制为含有约至约2.2μg的每种荚膜多糖,但血清型6b除外,它以约4.4μg的量存在。
[0213]
在一些实施方案中,所述疫苗或所述多价肺炎球菌缀合物组合物(例如, pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)可以是单个0.5ml剂量,其被配制为含有约2μg至约2.5μg的每种荚膜多糖,但选自血清型1、3、4、5、6b、9v、19a 和19f的多达六种荚膜多糖除外,其中每一种以约4μg至约5μg的量存在。在一个实施方案中,以约4μg至约5μg的量存在的所述多达六种荚膜多糖选自血清型1、3、4、6b、9v、 19a和19f。在其他实施方案中,所述疫苗或所述混合载体、多价肺炎球菌缀合物组合物 (例如,pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)可以是单个0.5ml剂量,其被配制为含有约2.2μg的每种荚膜多糖,但选自血清型1、3、4、5、6b、9v、19a 和19f的多达六种荚膜多糖除外,其中每一种以约4.4μg的量存在。在一个实施方案中,以约4.4μg的量存在的所述多达六种荚膜多糖选自血清型1、3、4、6b、9v、19a和19f。
[0214]
在一些实施方案中,所述疫苗或所述多价肺炎球菌缀合物组合物(例如, pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)可以是单个0.5ml剂量,其被配制为含有约2μg至约2.5μg的如下血清型的荚膜多糖:1、5、6a、7f、8、9n、10a、 11a、12f、14、15a、15b、15c、18c、22f、23a、23b、23f、24f、33f和/或35b,以及约4μg至约5μg的如下血清型的荚膜多糖:3、4、6b、9v、19a和/或19f。
[0215]
在某些实施方案中,所述疫苗或所述多价肺炎球菌缀合物组合物(例如, pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)可以是单个0.5ml剂量,其被配制为含有约2至约2.5μg的如下血清型的荚膜多糖:1、4、5、6a、7f、8、9v、9n、10a、 11a、12f、14、15a、15b、15c、18c、19a、19f、22f、23a、23b、23f、24f、33f 和/或35b,以及约4至约5μg的血清型3和/或6b的荚膜多糖。
[0216]
在一些实施方案中,所述疫苗或所述多价肺炎球菌缀合物组合物(例如, pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)可以是单个0.5ml剂量,其被配制为含有约2至约2.5μg的如下血清型的荚膜多糖:1、4、5、6a、7f、8、9v、9n、10a、 11a、12f、14、15a、15b、15c、18c、19a、19f、22f、23a、23b、23f、24f、33f 和/或35b,和约4至约5μg的血清型6b的荚膜多糖和/或约8至约9μg的血清型3的荚膜多糖以及更优选约8.8μg的血清型3的荚膜多糖。
[0217]
在某些实施方案中,所述多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、 pcv-24、pcv-25、pcv-26或pcv-27)或包含其的疫苗还包含氯化钠和琥珀酸钠缓冲液作为赋形剂。
[0218]
在一些实施方案中,可以将所述多价肺炎球菌缀合物组合物(例如,pcv-22、 pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)配制成液体配制品,其中来自血清型1、 3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、 19f、22f、23a、23b、23f、24f、33f和/或35b的每种肺炎球菌荚膜多糖与载体蛋白(例如,crm
197
)缀合。可以将每个0.5ml剂量配制成含有以下项的液体:约2.2μg的每种荚膜多糖,但血清型6b为约4.4μg;约40μg至约100μg载体蛋白(例如,crm
197
);约0.125 至0.250mg元素铝(约0.5至约1.2mg磷酸铝)作为佐剂;以及氯化钠和琥珀酸钠缓冲液作为赋形剂。
[0219]
在一些实施方案中,所述混合载体、多价肺炎球菌缀合物组合物(例如,pcv-22、 pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)包含两种或更多种载体蛋白(混合载体)。例如,在某些实施方案中,至少两种血清型与第一载体蛋白(例如,破伤风类毒素)缀合,并且其余的血清型与第二载体蛋白(例如,crm
197
)缀合。在某些实施方案中,与破伤风类毒素缀合的所述两种荚膜多糖选自血清型1、3和5。在某些实施方案中,与破伤风类毒素缀合的所述两种荚膜多糖选自血清型1、3、5、15b和22f。作为选自血清型1、3、 5、15b和22f的血清型的替代或补充,还可以将血清型4、6a、6b、7f、8、9n、9v、10a、 11a、12f、14、15a、15c、18c、19a、19f、23a、23b、23f、24f、33f和/或35b中的一种或多种与破伤风类毒素缀合。可以将其他目的血清型与破伤风类毒素缀合。
[0220]
在一些实施方案中,可以将所述混合载体、多价肺炎球菌缀合物组合物(例如, pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)配制成液体配制品,其中血清型1和3的每种肺炎球菌荚膜多糖与tt缀合,并且来自血清型4、5、6a、6b、7f、8、9n、 9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、22f、23a、23b、23f、 24f、33f和/或35b的荚膜多糖与crm
197
缀合。可以将每个0.5ml剂量配制成含有以下项的液体:约2.2μg的每种荚膜多糖,但血清型
6b为约4.4μg;约2μg至约25μg tt载体蛋白(仅用于血清型1和3)以及约40μg至约100μg crm
197
载体蛋白;约0.125至0.250mg 元素铝(约0.5至约1.2mg磷酸铝)作为佐剂;以及氯化钠和琥珀酸钠缓冲液作为赋形剂。
[0221]
在一些实施方案中,可以将混合载体、多价肺炎球菌缀合物组合物配制成液体配制品,其中血清型1和5的每种肺炎球菌荚膜多糖与tt缀合,并且来自血清型3、4、6a、 6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、22f、 23a、23b、23f、24f、33f和/或35b的荚膜多糖与crm
197
缀合。在一个实施方案中,可以将每个0.5ml剂量配制成含有以下项的液体:约2.2μg的每种荚膜多糖,但血清型6b为约4.4μg且血清型3为约2.2-8.8μg;约2μg至约25μg的tt载体蛋白(仅用于血清型1和5) 以及约40μg至约100μg的crm
197
载体蛋白;约0.125至0.250mg元素铝(约0.5至1.2mg磷酸铝)佐剂;以及氯化钠和琥珀酸钠缓冲液作为赋形剂。在某些实施方案中,血清型3以约2.2μg存在。在其他实施方案中,血清型3以约4.4μg存在。在其他实施方案中,血清型 3以约8.8μg存在。在又另一个实施方案中,可以将每个0.5ml剂量配制成含有以下项的液体:约2.2μg的每种荚膜多糖,但选自1、3、4、5、6b、9v、19a和19f的多达六种荚膜多糖为约4.4μg;约2μg至约25μg tt载体蛋白(仅用于血清型1和5)和约40μg至约100 μg crm
197
载体蛋白;约0.125mg至0.250mg元素铝(0.5mg至1.2mg磷酸铝)佐剂;以及氯化钠和琥珀酸钠缓冲液作为赋形剂。在一个实施方案中,约4.4μg的所述多达六种荚膜多糖选自血清型1、3、4、6b、9v、19a和19f。在另一个实施方案中,可以将每个0.5ml 剂量配制成含有以下项的液体:约2.2μg的每种荚膜多糖,但血清型3、4、6b、9v、19a 和19f为约4.4μg;约2μg至约25μg的tt载体蛋白(仅用于血清型1和5)和约40μg至约100 μg的crm
197
载体蛋白;约0.125mg至0.250mg元素铝(0.5mg至1.2mg磷酸铝)佐剂;以及氯化钠和琥珀酸钠缓冲液作为赋形剂。在另一个实施方案中,可以将每个0.5ml剂量配制成含有以下项的液体:约2.2μg的每种荚膜多糖,但血清型3和4为约为4.4μg;约2μg 至约25μg tt载体蛋白(仅用于血清型1和5)和约40μg至约100μg crm
197
载体蛋白;约 0.125mg至0.250mg元素铝(0.5mg至1.2mg磷酸铝)佐剂;以及氯化钠和琥珀酸钠缓冲液作为赋形剂。
[0222]
在一些实施方案中,可以将混合载体、多价肺炎球菌缀合物组合物配制成液体配制品,其中血清型3和5的每种肺炎球菌荚膜多糖与tt缀合,并且来自血清型1、4、6a、 6b、7f、8、9n、9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、22f、 23a、23b、23f、24f、33f和35b的荚膜多糖与crm
197
缀合。可以将每个0.5ml剂量配制成含有以下项的液体:约2.2μg的每种荚膜多糖,但6b为约4.4μg;约2μg至约25μg tt 载体蛋白(仅用于血清型3和5)以及约40μg至约100μg crm
197
载体蛋白;约0.125至0.250 mg元素铝(约0.5至1.2mg磷酸铝)佐剂;以及氯化钠和琥珀酸钠缓冲液作为赋形剂。
[0223]
在一些实施方案中,可以将所述混合载体、多价肺炎球菌缀合物组合物配制成液体配制品,其中血清型1、3和5以及两种血清型15b和22f的至少两种肺炎球菌荚膜多糖与破伤风类毒素缀合,并且来自其余血清型的荚膜多糖与crm
197
缀合。
[0224]
在一些实施方案中,可以将混合载体、多价肺炎球菌缀合物组合物配制成液体配制品,其中血清型1、5、15b和22f的每种肺炎球菌荚膜多糖与破伤风类毒素缀合,并且来自血清型3、4、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15c、18c、 19a、19f、23a、23b、23f、24f、33f和35b的荚膜多糖与crm
197
缀合。可以将每个0.5 ml剂量配制成含有以下项的液体:约2.2μg的每种荚膜多糖,但6b为约4.4μg;约2μg至约25μg tt载体蛋白(仅用于血清型3和
5)以及约40μg至约100μg crm
197
载体蛋白;约 0.125至0.250mg元素铝(约0.5至1.2mg磷酸铝)佐剂;以及氯化钠和琥珀酸钠缓冲液作为赋形剂。
[0225]
在一些实施方案中,可以将混合载体、多价肺炎球菌缀合物组合物配制成液体配制品,其中血清型1、3、15b和22f的每种肺炎球菌荚膜多糖与破伤风类毒素缀合,并且来自血清型4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15c、18c、 19a、19f、23a、23b、23f、24f、33f和35b的荚膜多糖与crm
197
缀合。可以将每个0.5 ml剂量配制成含有以下项的液体:约2.2μg的每种荚膜多糖,但6b为约4.4μg;约2μg至约25μg tt载体蛋白(仅用于血清型3和5)以及约40μg至约100μg crm
197
载体蛋白;约 0.125至0.250mg元素铝(约0.5至1.2mg磷酸铝)佐剂;以及氯化钠和琥珀酸钠缓冲液作为赋形剂。
[0226]
在一些实施方案中,可以将混合载体、多价肺炎球菌缀合物组合物配制成液体配制品,其中血清型3、5、15b和22f的每种肺炎球菌荚膜多糖与破伤风类毒素缀合,并且来自血清型1、4、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、15c、18c、 19a、19f、23a、23b、23f、24f、33f和35b的荚膜多糖与crm
197
缀合。可以将每个0.5 ml剂量配制成含有以下项的液体:约2.2μg的每种荚膜多糖,但6b为约4.4μg;约2μg至约25μg tt载体蛋白(仅用于血清型3和5)以及约40μg至约100μg crm
197
载体蛋白;约 0.125至0.250mg元素铝(约0.5至1.2mg磷酸铝)佐剂;以及氯化钠和琥珀酸钠缓冲液作为赋形剂。
[0227]
在一些实施方案中,可以将混合载体、多价肺炎球菌缀合物组合物配制成液体配制品,其中血清型1和5的每种肺炎球菌荚膜多糖与tt缀合。
[0228]
在一些实施方案中,可以将混合载体、多价肺炎球菌缀合物组合物配制成液体配制品,其中血清型3和5的每种肺炎球菌荚膜多糖与tt缀合。
[0229]
在一些实施方案中,可以将混合载体、多价肺炎球菌缀合物组合物配制成液体配制品,其中血清型1和3的每种肺炎球菌荚膜多糖与tt缀合。
[0230]
在一些实施方案中,可以将混合载体、多价肺炎球菌缀合物组合物配制成液体配制品,其中血清型1、5、15b和22f的每种肺炎球菌荚膜多糖与tt缀合。
[0231]
在一些实施方案中,可以将混合载体、多价肺炎球菌缀合物组合物配制成液体配制品,其中血清型3、5、15b和22f的每种肺炎球菌荚膜多糖与tt缀合。
[0232]
在一些实施方案中,可以将混合载体、多价肺炎球菌缀合物组合物配制成液体配制品,其中血清型1、3、15b和22f的每种肺炎球菌荚膜多糖与tt缀合。
[0233]
在一些实施方案中,可以将液体配制品填充至不含防腐剂的单剂量针筒中。摇动后,液体配制品变成疫苗,其为准备用于肌内施用的均匀白色悬浮液。
[0234]
所述多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、pcv-24、pcv-25、 pcv-26或pcv-27)可以在单个注射剂中或作为免疫系列的一部分施用。例如,所述多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27) 可以以适当隔开的间隔施用2、3、4次或更多次,如1、2、3、4、5或6个月间隔或其组合。在一些实施方案中,将所述多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、pcv-24、 pcv-25、pcv-26或pcv-27)在出生后15个月内4次施用至婴儿,包括例如在大约2、3、 4和12-15月龄时;在大约3、4、5和12-15月龄时;或在大约2、4、6和12-15月龄时。该第一剂量可以早在6周龄时施用。在另一个实施方案中,将所述多价肺炎球菌缀合物组合物 (例如,pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)在出生后15个月内3 次施用至婴儿,包括例如在大约2、4和11-12个月时。
[0235]
所述多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、pcv-24、pcv-25、 pcv-26或pcv-27)还可以包含来自肺炎链球菌的一种或多种蛋白质。适合包含的肺炎链球菌蛋白的例子包括在国际专利申请wo02/083855中鉴定的那些,以及国际专利申请 wo02/053761中描述的那些。
[0236]
多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、pcv-24、pcv-25、 pcv-26或pcv-27)可以经由本领域技术人员已知的一种或多种施用途径(如肠胃外、透皮或经黏膜、鼻内、肌内、腹膜内、皮内、静脉内或皮下途径)施用至受试者,并相应地配制。可以将所述多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、pcv-24、 pcv-25、pcv-26或pcv-27)配制为与其预期的施用途径相容。
[0237]
在一些实施方案中,所述多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、 pcv-24、pcv-25、pcv-26或pcv-27)可以通过肌内、腹膜内、皮下、静脉内、动脉内或透皮注射或呼吸道黏膜注射作为液体配制品施用。所述多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)可以以液体形式或以冻干形式配制。在一些实施方案中,可注射组合物以常规形式制备,作为液体溶液或悬浮液、适合于在注射前溶解或悬浮于液体中的固体形式,或作为乳剂。在一些实施方案中,注射溶液和悬浮液由无菌粉末或颗粒制备而来。在用于通过这些途径施用的药剂的配制和制造中的一般考虑可以见于例如remington’s pharmaceutical sciences,第19版,mackpublishing co.,宾夕法尼亚州伊斯顿,1995(通过引用并入本文)中。目前,口服或鼻用喷雾剂或气溶胶途径(例如,通过吸入)最常用于将治疗剂直接递送至肺和呼吸系统。在一些实施方案中,使用递送组合物的计量剂量的装置施用所述多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)。用于递送本文所述的皮内药物组合物的合适装置包括短针装置,如描述在以下专利中的那些:美国专利号4,886,499、美国专利号5,190,521、美国专利号5,328,483、美国专利号5,527,288、美国专利号4,270,537、美国专利号5,015,235、美国专利号5,141,496、美国专利号5,417,662 (将其全部通过引用并入本文)。皮内组合物也可以通过限制针进入皮肤的有效穿透长度的装置施用,如通过引用并入本文中的wo1999/34850中描述的那些及其功能等同物。此外,射流注射装置也是合适的,其经由液体射流注射器或经由刺穿角质层的针将液体疫苗递送至真皮,并产生到达真皮的射流。射流注射装置描述在例如以下专利中:美国专利号5,480,381、美国专利号5,599,302、美国专利号5,334,144、美国专利号5,993,412、美国专利号5,649,912、美国专利号5,569,189、美国专利号5,704,911、美国专利号5,383,851、美国专利号5,893,397、美国专利号5,466,220、美国专利号5,339,163、美国专利号5,312,335、美国专利号5,503,627、美国专利号5,064,413、美国专利号5,520,639、美国专利号4,596,556、美国专利号4,790,824、美国专利号4,941,880、美国专利号4,940,460、wo1997/37705和 wo1997/13537(将其全部通过引用并入本文)。此外,弹道粉末/颗粒递送装置也是合适的,其使用压缩气体来加速呈粉末形式的疫苗穿过皮肤外层至真皮。另外,常规针筒可以用于皮内施用的经典mantoux方法。
[0238]
用于肠胃外施用的制剂包括无菌的水性或非水性溶液、悬浮液和乳液。非水性溶剂的例子是丙二醇、聚乙二醇、油(如橄榄油)以及可注射的有机酯(如油酸乙酯)。油的例子包括植物油或动物油、花生油、大豆油、橄榄油、葵花油、肝油、合成油(如海洋石油)以及从牛奶或鸡蛋获得的脂质。水性载体包括水、醇性/水性溶液、乳液或悬浮液,包括盐水和缓冲
介质。肠胃外媒介物包括氯化钠溶液、林格氏右旋糖、右旋糖和氯化钠、乳酸林格氏液或固定油。静脉内媒介物包括流体和营养补充剂、电解质补充剂 (如基于林格氏右旋糖的那些)等。也可以存在防腐剂和其他添加剂,例如抗微生物剂、抗氧化剂、螯合剂和惰性气体等。
[0239]
所述多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、pcv-24、pcv-25、 pcv-26或pcv-27)可以以单位剂量小瓶、多剂量小瓶或预填充针筒的形式配制。用于液体配制品的药学上可接受的载体包括水性或非水性溶剂、悬浮液、乳液或油。所述组合物可以是等渗的、高渗的或低渗的。然而,希望用于输注或注射的组合物基本上是等渗的。因此,等渗性或高渗性对于组合物的储存可能是有利的。当所述组合物具有高渗性时,所述组合物可以在施用前稀释至等渗性。张力剂可以是离子张力剂,如盐或非离子张力剂如碳水化合物。所述离子张力剂包括但不限于氯化钠、氯化钙、氯化钾和氯化镁。所述非离子张力剂包括但不限于山梨糖醇和甘油。优选地,至少一种药学上可接受的缓冲液被包括在内。例如,当所述组合物是输注剂或注射剂时,其优选在ph 4至ph 10如ph 5至ph 9或ph 6至ph 8下具有缓冲能力的缓冲液中配制。所述缓冲液可以选自适用于美国药典(usp)的那些。例如,所述缓冲液可以选自一元酸,如乙酸、苯甲酸、葡糖酸、甘油酸和乳酸;二元酸,如乌头酸、己二酸、抗坏血酸、碳酸、谷氨酸、苹果酸、琥珀酸和酒石酸;多元酸,如柠檬酸和磷酸;以及碱,如氨、二乙醇胺、甘氨酸、三乙醇胺和tris。
[0240]
所述多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、pcv-24、pcv-25、 pcv-26或pcv-27)可以包含表面活性剂。表面活性剂的例子包括但不限于聚氧乙烯脱水山梨糖醇酯(通常称为tween)、特别是聚山梨醇酯20和聚山梨醇酯80;环氧乙烷(eo)、环氧丙烷(po)、氧化丁烷(bo)的共聚物(如dowfax);具有乙氧基(氧-1,2-乙酰基)基团、特别是辛苯聚醇-9(triton-100)的不同重复单元的辛苯聚醇;乙基苯氧基聚乙氧基乙醇(igepal ca-630/np-40);磷脂如卵磷脂;壬基酚乙氧基化物如tergitol np 系列;月桂基、十六烷基、硬脂酰基、油醇衍生的聚氧乙烯脂肪醚(brij表面活性剂)、特别是三乙烯乙二醇单月桂醚(brij 30);称为span的脱水山梨糖醇醚、特别是脱水山梨糖醇三油酸甘油酯(span 85)和脱水山梨糖醇单月桂酸酯。
[0241]
可以使用表面活性剂如tween 80/span 85的混合物。聚氧乙烯脱水山梨糖醇酯 (如tween 80)和辛苯聚醇(如triton x-100)的组合也是合适的。laureth 9和tween和/ 或辛苯聚醇的组合也是有利的。优选地,所包含的聚氧乙烯脱水山梨糖醇酯(如tween 80) 的量可以为0.01%至1%(w/v)、0.01%至0.1%(w/v)、0.01%至0.05%(w/v)或约0.02%;所包含的辛基苯氧基聚氧乙醇或壬基苯氧基聚氧乙醇(如triton x-100)的量可以为0.001%至0.1%(w/v)、特别是0.005%至0.02%;并且所包含的聚氧乙烯醚(如laureth 9)的量可以为0.1%至20%(w/v),可能是0.1%至10%,特别是0.1%至1%或约0.5%。
[0242]
在一些实施方案中,可以经由释放控制系统递送所述多价肺炎球菌缀合物组合物(例如,pcv-22、pcv-23、pcv-24、pcv-25、pcv-26或pcv-27)。例如,静脉内输注、透皮贴剂、脂质体或其他途径可以用于施用。在一个方面,可以使用诸如微球或植入物的大分子。
[0243]
上述公开文本总体上描述了本发明。通过引用以下具体实施例可以获得更完整的理解。这些实施例仅用于说明的目的,并且不旨在限制本发明的范围。实施例
[0244]
实施例1.肺炎链球菌荚膜多糖的制备
[0245]
如本领域技术人员所知进行肺炎链球菌的培育和荚膜多糖的纯化。肺炎链球菌血清型是从美国菌种保藏中心(atcc)获得的(血清型1:atcc号6301;血清型3:atcc 号6303;血清型4:atcc号6304;血清型5:atcc号6305;血清型6a:atcc号6306;血清型6b:atcc号6326;血清型7f:atcc号10351;血清型9n:atcc号6309;血清型9v:atcc号10368;血清型14:atcc号6314;血清型18c:atcc号10356;血清型 19a:atcc号10357;血清型19f:atcc号6319;血清型23b:atcc号10364;血清型 23f:atcc号6323)。对于血清型8、10a、11a、12f、15a、15b、15c、22f、23a、 23b、24f、33f和35b,使用内部菌株或从其他来源获得的菌株,但可以使用任何公众可获得的菌株。肺炎链球菌的特征在于荚膜和运动性、革兰氏阳性、柳叶刀形状的双球菌属以及在血液琼脂培养基中的α溶血现象。使用特异性抗血清通过quelling测试鉴定血清型(美国专利号5,847,112)。
[0246]
细胞库的制备
[0247]
产生了若干代种子储备物,以扩大菌株并去除动物来源的组分(f1、f2和f3 代)。产生了另外的两代种子储备物。另外的第一代首先从f3小瓶培养,随后的一代是从所述另外的第一代的小瓶培养。将种子小瓶用合成甘油作为低温保护剂来冷冻储存(低于-70℃)。对于细胞库制备,所有培养物在大豆基培养基中生长。在冷冻之前,将细胞通过离心浓缩,去除废培养基,并且将细胞沉淀物重悬于含有低温保护剂(如合成甘油) 的新鲜培养基中。
[0248]
培养和收获
[0249]
将来自工作细胞库的培养物接种至含有大豆基培养基的种子瓶中并培养。在达到目标光密度(吸光度)之后,使用种子瓶接种含有大豆基培养基的发酵罐。当光学密度值开始保持恒定时终止培养。在终止培养后,将脱氧胆酸钠添加至培养物中以裂解细胞。冷却所得的发酵罐内容物,并诱导蛋白质沉淀。然后,将混合物离心以去除沉淀的蛋白质和细胞碎片。
[0250]
纯化
[0251]
通过深度过滤器过滤从离心获得的溶液,以去除在离心时未沉淀的蛋白质和细胞碎片。将滤液浓缩在100kda mw膜上,并将浓缩物用10个体积的25mm磷酸钠缓冲液 (ph 7.2)进行渗滤以得到样品。过滤样品以收集上清液,从所述上清液沉淀并过滤多糖。将滤液浓缩在30kda膜上,并使用约10个体积的三重蒸馏水对浓缩物进行渗滤。在进行渗滤后,使剩余的溶液通过0.2μm过滤器过滤。对滤液进行了过程中的控制测试(外观、剩余蛋白质、剩余核酸、内毒素、分子量和多糖的总量)。将浓缩物进行无菌过滤并在
ꢀ‑
20℃下储存。
[0252]
实施例2.肺炎链球菌荚膜多糖和载体蛋白的缀合物(血清型1、3、4、5、6a、 6b、7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、19f、22f、23f和33f) 的制备
[0253]
将不同血清型的多糖按照不同的途径激活,然后与载体蛋白crm
197
或tt缀合。具体地,如下所述通过以下方法制备包含来自血清型1、3、4、5、6a、6b、7f、8、9n、 9v、10a、11a、12f、14、15a、15b、15c、18c、19a、19f、22f、23a、23b、23f、 24f、33f和35b的荚膜多糖的多价肺炎球菌多糖-蛋白质缀合物:将血清型3、4、6a、6b、 7f、8、9n、9v、10a、11a、12f、14、15b、18c、19a、19f、22f、23f和33f的每种荚膜多糖与crm
197
缀合并且将血清型1和5的每种荚膜多糖与tt缀合。在实施例3-8中描述了血清型15a、15c、23a、23b、24f和35b与crm
197
的缀合。如下所述通过以下方法制备包含来自血清型1、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、 15b、15c、18c、19a、19f、22f、23a、23b、23f、24f、33f和35b的荚膜多糖的另一种多价肺
炎球菌多糖-蛋白质缀合物:将血清型3、4、6a、6b、7f、8、9n、9v、10a、 11a、12f、14、18c、19a、19f、23f和33f的每种荚膜多糖与crm
197
缀合并且将血清型 1、5、15b和22f的每种荚膜多糖与tt缀合。
[0254]
作为血清型1或5的替代或补充,还预期可以将血清型3与tt缀合,如 wo2019/152925中所公开。取决于天然血清型的大小,激活过程可以包括使每种荚膜多糖的大小降低至目标分子量、化学激活和经由超滤的缓冲液交换。
[0255]
将不同血清型的多糖按照不同的途径激活,然后与载体蛋白crm
197
或tt缀合。具体地,通过将所有血清型(15b和22f除外)的每种荚膜多糖与crm
197
缀合并且将血清型1、3、5、15b和22f的每种荚膜多糖与tt缀合来制备缀合物。取决于天然血清型的大小,激活过程可以包括使每种荚膜多糖的大小降低至目标分子量、化学激活和经由超滤的缓冲液交换。将缀合物使用超滤进行纯化,并且最后通过0.2μm过滤器过滤。诸如ph、温度、浓度和时间的过程参数如下。
[0256]
(1)激活过程
[0257]
第1步:水解
[0258]
还原胺化是一种已知用于缀合聚合物的方法,其中在蛋白质的伯胺(-nh2) 基团与糖的醛基之间形成酰胺键。将醛基团添加至肺炎球菌荚膜多糖中以促进与载体蛋白的缀合。单糖的邻接二醇结构可以通过高碘酸钠(naio4)氧化以形成醛基团。来自血清型1、3、4、6a、8、11a、12f、14、15b、18c、22f和33f的荚膜多糖进行如下预处理。
[0259]
在血清型1的情况下,将氢氧化钠(以0.05m的最终碱浓度)添加至荚膜多糖的溶液中,并将溶液在50
±
2℃下孵育。然后将溶液冷却至约21℃至约25℃范围内的温度,并且向其中添加盐酸至6.0
±
0.1的最终ph,从而停止水解。
[0260]
在血清型3、8、11a和15b的情况下,将盐酸(以0.01m的最终酸浓度)添加至荚膜多糖的溶液中,并将溶液在60
±
2℃下孵育。然后将溶液冷却至约21℃至约25℃范围内的温度,并且向其中添加0.1m磷酸钠至6.0
±
0.1的最终ph,从而停止水解。
[0261]
在血清型4的情况下,将盐酸(以0.1m的最终酸浓度)添加至荚膜多糖的溶液中,并将溶液在45
±
2℃下孵育。然后将溶液冷却至约21℃至约25℃范围内的温度,并且向其中添加1m磷酸钠至6.0
±
0.1的最终ph,从而停止水解。
[0262]
在血清型6a的情况下,将冰醋酸(以0.1m的最终酸浓度)添加至荚膜多糖的溶液中,并将溶液在60
±
2℃下孵育。然后将溶液冷却至约21℃至约25℃范围内的温度,并且向其中添加1m氢氧化钠至6.0
±
0.1的最终ph,从而停止水解。
[0263]
在血清型12f的情况下,将盐酸(以0.01m的最终酸浓度)添加至荚膜多糖的溶液中,并将溶液在70
±
2℃下孵育。然后将溶液冷却至约21℃至约25℃范围内的温度,并且向其中添加0.1m磷酸钠至6.0
±
0.1的溶液最终ph,从而停止水解。
[0264]
在血清型14和18c的情况下,将冰醋酸(以0.2m的最终酸浓度)添加至荚膜多糖的溶液中,并将溶液在94
±
2℃下孵育。然后将溶液冷却至约21℃至约25℃的温度,并且向其中添加1m磷酸钠使得溶液的最终ph为6.0
±
0.1,从而停止水解。
[0265]
在血清型22f和33f的情况下,将盐酸(以0.01m的最终酸浓度)添加至荚膜多糖的溶液中,并将溶液在60
±
2℃下孵育。然后将溶液冷却至约21℃至约25℃范围内的温度,并且向其中添加0.1m磷酸钠至6.0
±
0.1的最终ph,从而停止水解。
[0266]
将每种获得的荚膜多糖在注射用水(wfi)、乙酸钠和磷酸钠中稀释至在1.0 mg/ml与约2.0mg/ml之间的终浓度。
[0267]
第2步:高碘酸盐反应
[0268]
基于重复单元摩尔质量测定用于每种肺炎球菌糖激活的高碘酸钠摩尔当量。对于所述血清型,通过彻底混合允许在21℃至25℃下进行氧化反应16至20小时,但1、7f和 19f除外,其中温度为10℃或更低。为了帮助维持缀合物的一致且稳定的产生,在缀合过程中每种血清型的氧化程度(do)水平的范围是有针对性的。对于每种血清型的优选针对性do水平范围如表1和表2所示。表1.用于待与crm
197
缀合的所有血清型的do范围血清型do的范围血清型do的范围血清型14至10血清型10a1至12血清型32至8血清型11a1至15血清型41至5血清型12f1至9血清型6a5至15血清型146至13血清型6b7至13血清型18c6至14血清型7f2至8血清型19a20至40血清型81至17血清型19f20至40血清型9n5至10血清型23f6至14血清型9v4至9血清型33f1至15表2.用于待与tt缀合的血清型1、3、5、15b和22f的do范围15b和22f的do范围
[0269]
第3步:超滤
[0270]
将氧化糖浓缩,并在100kda mwco超滤器上(对于血清型1,30kda超滤器;并且对于血清型18c,5kda超滤器)用wfi渗滤。对于血清型1,使用0.9%氯化钠溶液进行渗滤,对于血清型7f和23f,使用0.01m乙酸钠缓冲液(ph 4.5)进行渗滤,并且对于血清型19f,使用0.01m磷酸钠缓冲液(ph 6.0)。丢弃渗透物,并使渗余物通过0.2μm 过滤器过滤。
[0271]
第4步:冻干
[0272]
对于将通过使用水性溶剂与载体蛋白缀合的血清型3、4、5、8、9n、9v、10a、 14和33f的荚膜多糖,在不添加另外的蔗糖的情况下制备多糖和载体蛋白的混合溶液,将其冻干,然后在-25℃
±
5℃下储存。
[0273]
对于将通过使用水性溶剂与载体蛋白缀合的血清型1和18c的荚膜多糖,在不添加另外的蔗糖的情况下单独地制备多糖和载体蛋白,将其冻干,然后在-25℃
±
5℃下储存。
[0274]
对于将通过使用dmso溶剂与载体蛋白缀合的血清型6a、6b、7f、15b-tt、 19a、19f、
22f-tt和23f的荚膜多糖,将达到最终蔗糖浓度5%
±
3%(w/v)的预定量的蔗糖添加至激活的糖中,并且单独地制备样品,将其冻干,然后在-25℃
±
5℃下储存。
[0275]
对于血清型11a的荚膜多糖,将达到最终蔗糖浓度20%
±
5%(w/v)的预定量的蔗糖添加至激活的糖中,并且单独地制备多糖和载体蛋白,将其冻干,然后在-25℃
±ꢀ
5℃下储存。
[0276]
对于血清型12f的荚膜多糖,将达到最终蔗糖浓度10%
±
5%(w/v)的预定量的蔗糖添加至激活的糖中,并且单独地制备多糖和载体蛋白,将其冻干,然后在-25℃
±ꢀ
5℃下储存。
[0277]
(2)缀合过程
[0278]
对于血清型1、3、4、5、8、9n、9v、10a、14、18c和33f,进行水性缀合,并且对于血清型6a、6b、7f、11a、12f、15b-tt、19a、19f、22f-tt和23f,进行dmso 缀合。将每种荚膜多糖与载体蛋白以0.2至2:1的比率缀合。
[0279]
第1步:溶解
[0280]
水性缀合
[0281]
对于血清型1、3、4、5、8、9n、9v、10a、14、18c和33f,将冻干样品解冻并在室温下平衡。通过在23℃
±
2℃下以对于每种血清型设定的比率使用磷酸钠缓冲液将冻干样品重构至反应浓度。
[0282]
二甲基亚砜(dmso)缀合
[0283]
对于血清型6a、6b、7f、11a、12f、15b-tt、19a、19f、22f-tt和23f,将冻干样品解冻,在室温下平衡,并在dmso中重构。
[0284]
第2步:缀合反应
[0285]
水性缀合
[0286]
对于血清型3-tt、4、5-tt、8、9n、9v、10a、14、18c和33f,通过添加氰基硼氢化钠溶液(100mg/ml)以达到每摩尔糖中1.0至1.4摩尔氰基硼氢化钠开始缀合反应。然而,对于血清型1、1-tt和3,通过添加氰基硼氢化钠溶液以达到每摩尔糖中0.5摩尔氰基硼氢化钠开始反应。
[0287]
将反应混合物在23℃至37℃下孵育44至106小时。通过血清型调节反应温度和时间。然后将温度降至23℃
±
2℃并向反应器中添加0.9%氯化钠。添加硼氢化钠溶液(100 mg/ml)以达到每摩尔糖中1.8至2.2摩尔当量的硼氢化钠。将混合物在23℃
±
2℃下孵育3 至6小时。该程序降低了在糖上存在的任何未反应的醛。然后,将混合物用0.9%氯化钠稀释,并使用0.8或0.45μm预过滤器过滤稀释的缀合混合物。
[0288]
dmso缀合
[0289]
对于血清型6a、6b、7f、11a、12f、15b-tt、19a、19f、22f-tt和23f的荚膜多糖,通过添加氰基硼氢化钠溶液(100mg/ml)以达到每一摩尔激活的糖中0.8至1.2 摩尔当量的氰基硼氢化钠的比率来开始缀合反应。将wfi添加至反应混合物中以达到1% (v/v)的目标浓度,并将混合物在23℃
±
2℃下孵育12至26小时。将100mg/ml硼氢化钠溶液(典型的,每摩尔激活的糖中1.8至2.2摩尔当量的硼氢化钠)和wfi(目标5%v/v) 添加至反应物中,并将混合物在23℃
±
2℃下孵育3至6小时。该程序降低了在糖上存在的任何未反应的醛。然后,将反应混合物用0.9%氯化钠稀释,并使用0.8或0.45μm预过滤器过滤稀释的缀合混合物。
[0290]
第3步:超滤
[0291]
将稀释的缀合物混合物浓缩并在100kda mwco超滤过滤器或300kdamwco超滤过滤器上用至少15个体积的0.9%氯化钠或缓冲液进行渗滤。此外,所述过程中使用的缓冲液的组成和ph根据每种血清型而变化。
[0292]
第4步:无菌过滤
[0293]
将超滤后的渗余物进行无菌过滤(0.2μm),并对过滤的缀合物进行过程中的控制(外观、游离蛋白质、游离糖、分子大小分布、无菌、糖含量、蛋白质含量、ph、内毒素、残留氰化物、残留dmso、糖标识、tt标识和crm
197
标识)。将最终浓缩物在 2℃至8℃下冷藏并储存。
[0294]
在实施例3-8中描述了血清型15a、15c、23a、23b、24f和35b与crm
197
的缀合。
[0295]
实施例3.血清型15a和crm
197
的单一缀合物的制备
[0296]
可以如上所讨论或参考wo2013/191459中描述的用于纯化其他血清型的多糖的方法来纯化血清型15a多糖。通过向如表1所示的纯化的血清型15a多糖施加酸和高温来进行酸水解,然后进行激活过程。观察到水解的条件影响激活的多糖的氧化程度(do) 和分子量以及缀合结果。在相同条件下进行激活过程和缀合过程。添加高碘酸钠,并使氧化反应在21℃至25℃下进行16至20小时。将激活的多糖和crm
197
蛋白冻干并悬浮在 dmso中。将激活的多糖和蛋白质以1:1的比率混合,而基于多糖含量,反应浓度为1.5 mg/ml。添加氰基硼氢化物以开始缀合反应,并将混合物在23℃
±
2℃下孵育20至28小时。将硼氢化物溶液混合物在23℃
±
2℃下孵育3至6小时。通过该过程,减少存在于糖中的任何未反应的醛,接着将其用超滤过滤器浓缩和透析。
[0297]
表3.根据水解条件的15a缀合结果表3.根据水解条件的15a缀合结果
[0298]
评估氧化水平(do)对血清型15a和crm
197
的缀合的影响。将0.1m hcl在60℃下添加至15a多糖中,持续90分钟。调节高碘酸钠的量,并且氧化反应在21℃至25℃下进行16至20小时。将激活的多糖和crm
197
蛋白冻干并悬浮在dmso中。将激活的多糖和蛋白质以1:1的比率混合,而基于多糖含量,反应浓度为1.5mg/ml,并且当评估酸水解对血清型15a的影响时,
如上所述用氰基硼氢化物进行缀合。
[0299]
表4.根据氧化水平的15a缀合结果
[0300]
还评估了多糖与蛋白质的反应比率对缀合的影响。将激活的15a多糖和crm
197
蛋白冻干并悬浮在dmso中。将激活的多糖和蛋白质以表5中所述的比率混合,并且基于多糖含量,反应浓度为1.0mg/ml,并且当评估酸水解对血清型15a的影响时,如上所述用氰基硼氢化物进行缀合。
[0301]
表5.根据多糖与蛋白质比率的缀合结果
[0302]
实施例4.血清型15c和crm
197
的单一缀合物的制备
[0303]
可以如上所讨论或参考wo2013/191459中描述的用于纯化其他血清型的多糖的方法来纯化血清型15c多糖。调节添加至15c多糖的高碘酸钠的量,并且氧化反应在 21℃至25℃下进行16至20小时。将激活的多糖和crm
197
蛋白冻干并悬浮在磷酸盐缓冲液中。将激活的多糖和蛋白质以1:1的比率混合,而基于多糖含量,反应浓度为15mg/ml。添加氰基硼氢化物以开始缀合反应,并将混合物在37℃
±
2℃下孵育44至52小时。将硼氢化物溶液混合物在23℃
±
2℃下孵育3至6小时。通过该过程,减少存在于糖中的任何未反应的醛,接着将其用超滤过滤器浓缩和透析。
[0304]
表6.使用磷酸盐缓冲液的根据氧化水平的15c缀合结果
[0305]
评估氧化水平(do)对血清型15c和crm
197
使用dmso进行的缀合的影响。调节添加至15c多糖的高碘酸钠的量,并且氧化反应在21℃至25℃下进行16至20小时。将激活的多糖和crm
197
蛋白冻干并悬浮在dmso中。将激活的多糖和蛋白质以1:1的比率混合,而基于多糖含量,反应浓度为1.5mg/ml。添加氰基硼氢化物以开始缀合反应,并将混合物在23℃
±
2℃下孵育20至28小时。将硼氢化物溶液混合物在23℃
±
2℃下孵育3至6 小时。通过该过程,减少存在于糖中的任何未反应的醛,接着将其用超滤过滤器浓缩和透析。
[0306]
表7.使用dmso的根据氧化水平的15c缀合结果
[0307]
实施例5.血清型23a和crm
197
的单一缀合物的制备
[0308]
可以如上所讨论或参考wo2013/191459中描述的用于纯化其他血清型的多糖的方法来纯化血清型23a多糖。为了评估氧化程度(do)对缀合的影响,调节高碘酸钠的量,并且氧化反应在21℃至25℃下进行16至20小时。将激活的多糖和crm
197
蛋白冻干并悬浮在dmso中。将激活的多糖和蛋白质以1:1的比率混合,而基于多糖含量,反应浓度为1mg/ml。可替代地,将激活的多糖和蛋白质以表8中所述的比率混合,而基于多糖含量,反应浓度为1.5mg/ml。添加氰基硼氢化物以开始缀合反应,并将混合物在23℃
±ꢀ
2℃下孵育20至28小时。将硼氢化物溶液混合物在23℃
±
2℃下孵育3至6小时。通过该过程,减少存在于糖中的任何未反应的醛,接着将其用超滤过滤器浓缩和透析。表8中显示了不同do水平对缀合的影响。
[0309]
表8.根据氧化水平的23a缀合结果
[0310]
表9中显示了多糖与蛋白质的反应比率对缀合的影响。
[0311]
表9.根据多糖与蛋白质比率的23a缀合结果
[0312]
评估反应浓度对血清型23a与crm
197
之间的缀合的影响。如上所讨论用高碘酸钠激活纯化的血清型23a多糖。将激活的多糖和crm
197
蛋白冻干并悬浮在dmso中。将激活的多糖和蛋白质以1:1的比率混合,而基于多糖含量,反应浓度如表10中所述,并且当评估do对血清型23a的影响时,如上所述用氰基硼氢化物进行缀合。
[0313]
表10.根据缀合物反应的浓度的23a缀合结果
[0314]
评估酸水解对血清型23a与crm
197
之间的缀合的影响。通过向如表11所示的纯化的血清型23a多糖施加酸和高温来进行酸水解,然后进行激活过程。在相同条件下进行激活过程和缀合过程。添加高碘酸钠,并使氧化反应在21℃至25℃下进行16至20小时。将激活的多糖和crm
197
蛋白冻干并悬浮在磷酸盐缓冲液中。将激活的多糖和蛋白质以1: 1的比率混合,而基于多糖含量,反应浓度为1.5mg/ml。添加氰基硼氢化物以开始缀合反应,并将混合物在37℃
±
2℃下孵育44至52小时。将硼氢化物溶液混合物在23℃
±
2℃下孵育3至6小时。通过该过程,减少存在于糖中的任何未反应的醛,接着将其用超滤过滤器浓缩和透析。
[0315]
表11.对多糖的酸水解后的23a糖缀合物的制备
[0316]
评估使用磷酸盐缓冲液对血清型23a与crm
197
之间的缀合的影响。调节高碘酸钠的量以激活血清型23a,并且氧化反应在21℃至25℃下进行16至20小时。将激活的血清型23a多糖和crm
197
蛋白冻干并悬浮在磷酸盐缓冲液中。将激活的多糖和蛋白质以1:1 的比率混合,而基于多糖含量,反应浓度为15mg/ml。添加氰基硼氢化物以开始缀合反应,并将混合物在23℃
±
2℃下孵育20至28小时。将硼氢化物溶液混合物在23℃
±
2℃下孵育3至6小时。通过该过程,减少存在于糖中的任何未反应的醛,接着将其用超滤过滤器浓缩和透析。
[0317]
表12.使用磷酸盐缓冲液制备23a糖缀合物
[0318]
实施例6.血清型23b和crm
197
的单一缀合物的制备
[0319]
可以如上所讨论或参考wo2013/191459中描述的用于纯化其他血清型的多糖的方法来纯化血清型23b多糖。为了评估氧化程度(do)对缀合的影响,调节高碘酸钠的量以激活血清型23b,并且氧化反应在21℃至25℃下进行16至20小时。将激活的多糖和 crm
197
蛋白冻干并悬浮在dmso中。将激活的多糖和蛋白质以1:1的比率混合,而基于多糖含量,反应浓度为1.5mg/ml。可替代地,高碘酸钠的量保持恒定并且将激活的多糖和蛋白质以表13中所述的比率混合,而基于多糖含量,反应浓度为1.5mg/ml。添加氰基硼氢化物以开始缀合反应,并将混合物在23℃
±
2℃下孵育20至28小时。将硼氢化物溶液混合物在23℃
±
2℃下孵育3至6小时。通过该过程,减少存在于糖中的任何未反应的醛,接着将其用超滤过滤器浓缩和透析。表13中显示了不同do水平对缀合的影响。
[0320]
表13.根据氧化水平的23b缀合结果
[0321]
表14中显示了多糖与蛋白质的反应比率对缀合的影响。
[0322]
表14.根据多糖与蛋白质比率的23b缀合结果合结果
[0323]
实施例7.血清型24f和crm
197
的单一缀合物的制备
[0324]
可以如上所讨论或参考wo2013/191459中描述的用于纯化其他血清型的多糖的方法来纯化血清型24f多糖。使纯化的血清型24f多糖经受酸水解或微流化床,接着将高碘酸钠添加至血清型24f多糖中,并在21℃至25℃下进行氧化反应16至20小时。将激活的多糖和crm
197
蛋白冻干并悬浮在磷酸盐缓冲液中。将激活的多糖和蛋白质以1:1的比率混合,而基于多糖含量,反应浓度为10mg/ml。添加氰基硼氢化物以开始缀合反应,并将混合物在37℃
±
2℃下孵育44至52小时。将硼氢化物溶液混合物在23℃
±
2℃下孵育3 至6小时。通过该过程,减少存在于糖中的任何未反应的醛,接着将其用超滤过滤器浓缩和透析。氰基硼氢化物和硼氢化物的摩尔当量如表15中所述。随着将氰基硼氢化物替代封端试剂(硼氢化物)添加至激活的24f多糖和crm
197
蛋白中,改善了缀合物的质量,如通过增加的缀合物分子量所示。添加过量的封端试剂(硼氢化物)对24f-crm
197
缀合物具有负面作用,如通过降低的缀合物分子量所示。
[0325]
表15.根据还原剂的量的缀合结果(po4缓冲液)
[0326]
实施例8:血清型35b和crm
197
的单一缀合物的制备
[0327]
可以如上所讨论或参考wo2013/191459中描述的用于纯化其他血清型的多糖的方法来纯化血清型35b多糖。将纯化的血清型35b多糖在dw(蒸馏水)中稀释至1.0 mg/ml至2.0mg/ml的终浓度。
[0328]
高碘酸反应。为了评估氧化程度(do)对缀合的影响,调节高碘酸钠的量以激活血清型35b,并且氧化反应在21℃至25℃下进行16至20小时。使用相对于多糖含量的 0.007至0.15摩尔当量的高碘酸钠。
[0329]
超滤。将血清型35b多糖浓缩并使用30kda mwco超滤过滤器用dw进行渗滤。丢弃渗透物,并使残留物通过0.22μm过滤器过滤。
[0330]
冻干。向激活的血清型35b多糖中添加计算的用于达到5%
±
3%蔗糖浓度的特定量的蔗糖。浓缩的糖和crm
197
载体蛋白均各自填充在小瓶中并冻干。可替代地,将激活的血清型35b多糖和载体蛋白混合并填充至玻璃瓶中并冻干。
[0331]
溶解。将冻干的激活的血清型35b糖和冻干的crm
197
载体在室温下平衡。将激活的血清型35b糖以12.5g/l至17.5g/l糖的浓度重悬于磷酸盐缓冲液中。将用于缀合反应的磷酸盐缓冲液的ph调节至ph 6.0至ph 7.2。此时,使用浓度为6.25g/l至约35g/l的载体蛋白(pr:ps重量比率对应于1:0.5至2)。
[0332]
缀合反应。通过以每1摩尔激活的糖1.0至1.4摩尔当量的比率添加氰基硼氢化钠溶液(100mg/ml)来开始缀合反应。将混合物在37℃
±
2℃下孵育44至52小时。将100 mg/ml硼氢化钠溶液(通常每1摩尔激活的糖1.8至2.2摩尔当量的硼氢化钠)添加至反应物质中,并将混合物在23℃
±
2℃下孵育3至6小时。通过该过程,减少存在于糖中的任何未反应的醛,接着将其用超滤过滤器浓缩和透析。然后用0.9%氯化钠稀释反应混合物,并将稀释的缀合物混合物通过0.45μm过滤器过滤。
[0333]
超滤。将稀释的缀合物混合物浓缩并使用100kda mwco超滤过滤器用至少20 个体积的0.9%氯化钠溶液或缓冲液进行渗滤。丢弃渗透物。
[0334]
无菌过滤。将100kda mwco渗滤后的残留物通过0.22μm过滤器过滤。对过滤产物35b-crm
197
缀合物进行过程中的控制(糖含量、游离蛋白质、游离糖和残留的氰化物)。对过滤的残留物进行过程中的控制,以确定是否需要另外的浓缩、渗滤和/或稀释。如果需要的话,用0.9%氯化钠稀释过滤的缀合物,使得终浓度小于0.55g/l。在此阶段,进行糖含量、蛋白质含量和糖:蛋白质比率的测试。过滤缀合物(0.22μm过滤器) 和并进行游离(free)测试(外观、游离蛋白质、游离糖、内毒素、分子定型、残留的氰化物、糖标识和crm
197
标识)。血清型35b糖缀合物包含每mm 35b多糖至少0.2mm乙酸盐。最终的缀合物浓缩物在2℃至8℃下冷藏。下表16中显示了血清型35b糖缀合物的一些代表性制备例子的分析结果。
[0335]
表16.根据氧化水平的缀合结果(po4缓冲液)
[0336]
如表16中所见,用于制备血清型35b糖缀合物的本文所述的方法显示出良好的缀合产率,并且允许制备具有低游离糖%和良好稳定性的缀合物。
[0337]
实施例9:血清型特异性igg浓度测量
[0338]
测试了以下单一缀合物诱导兔子中的免疫原性应答的能力:在实施例3中制备的血清型15a-crm
197
单一缀合物、在实施例4中制备的血清型15c-crm
197
单一缀合物、在实施例5中制备的血清型23a-crm
197
单一缀合物、在实施例6中制备的血清型 23b-crm
197
单一缀合物、在实施例7中制备的血清型24f-crm
197
单一缀合物、以及在实施例8中制备的血清型35b-crm
197
单一缀合物。通过针对血清igg浓度的抗原特异性 elisa以及通过针对抗体功能的调理吞噬测定(opa)进行的免疫原性评估。将新西兰白兔在第0周和第2周用人剂量(2.2μg多糖)进行肌内免疫。免疫后每2周对血清进行采样。
[0339]
将血清型15a、15c、23a、23b、24f和35b中每一种的荚膜多糖(pnps)以0.5 μg/孔至
1μg/孔包被在96孔板上。从每名受试者采样相等量的血清并按组进行合并。将板用洗涤缓冲液洗涤,并在37℃下用封闭缓冲液孵育1小时。将血清池用抗体稀释缓冲液系列稀释2.5次,然后在室温下反应30分钟,所述抗体稀释缓冲液包含tween 20和从国家血清研究所获得的肺炎球菌细胞壁多糖(cwps)(5μg/ml)。将板用洗涤缓冲液洗涤5 次,然后将预吸附和稀释的血清50μl添加至包被的孔板中,接着在室温下孵育2小时至18 小时。用相同的方式洗涤孔板,然后将山羊抗兔igg-碱性磷酸酶缀合物添加至每个孔中,接着在室温下孵育2小时。如上所述洗涤板,并将1mg/ml对硝基苯胺缓冲液添加至每个孔中,接着在室温下反应2小时。通过添加50μl 3m naoh淬灭反应,并测量405nm和690 nm处的吸光度。结果显示于表17中。
[0340]
表17.二次免疫后2周的igg浓度(u/ml) 血清型之前-1之后-1之前-2之后-215a312.55637.2312.55703.215c13084369.0
‑‑
23a130367.9
‑‑
23b141.530775.9152.1185474.024f309.03200.1476.14529.5
[0341]
对于血清型35b,基于如表18中所示的缀合反应的ph和35b糖缀合物的分子量,测量不同的糖缀合物组的igg浓度。
[0342]
表18.二次免疫后2周的igg浓度*ci:置信区间第1、2和3组的显著性:p=0.384
[0343]
单价缀合物的功能性免疫原性测试(mopa)
[0344]
通过在mopa测定中测试血清来评价抗体功能。将在-70℃或更低温度下储存的肺炎链球菌mopa菌株稀释至相应的最终稀释倍数,使得每种菌株的浓度为约50,000 cfu/ml。从每名受试者采样相等量的血清,按组合并,并系列稀释2倍,使得在u底板中保留20μl血清。将样品稀释后,将对于每种血清型准备的10μl菌株与稀释的样品混合,并使混合物在室温下反应30分钟,使得肺炎链球菌和抗体均匀混合。添加预分化的hl-60 细胞和补体的混合物,并在co2培养箱(37℃)中反应45分钟。将温度降低以停止吞噬作用,并将10μl反应溶液点样在预先干燥30至60分钟的thy琼脂板上,然后使其在板上吸收20分钟直至干燥。将25mg/ml ttc储备溶液添加至制备的覆盖琼脂中,并向其中添加适合于相应菌株的抗体。将混合物彻底混合,然后将约25ml混合物添加至板上并硬化约 30分钟。将完全硬化的板在
co2培养箱(37℃)中孵育12至18小时,然后对菌落进行计数。 mopa滴度表示为如下稀释率,在该稀释率下观察到50%杀伤。结果显示于表19中。
[0345]
表19.二次免疫后2周对于单一缀合物的mopa滴度血清型之前-1之后-1之前-2之后-215a5355510310715c231575.3
‑‑
23a2313.7
‑‑
23b281880757737524f22602367
[0346]
对于血清型35b,基于如表20中所示的缀合反应的ph和35b糖缀合物的分子量,测量不同的糖缀合物组的mopa滴度。
[0347]
表20.二次免疫后2周对于35b-crm
197
的mopa滴度*ci:置信区间第1、2和3组的显著性:p=0.621
[0348]
实施例10:具有与破伤风类毒素缀合的来自血清型1和5的多糖的27价肺炎球菌缀合物疫苗的配制
[0349]
基于批体积和主体糖浓度计算从实施例2-8获得的最终主体浓缩物的所需体积。在将0.85%氯化钠(生理盐水)、聚山梨醇酯80和琥珀酸盐缓冲液添加至预标记的配制容器中之后,添加主体浓缩物。然后将制剂彻底混合并通过0.2μm膜进行无菌过滤。在添加主体磷酸铝期间和之后,将配制的主体轻轻混合。如果必要的话,检查并调节ph。将配制的主体产物在2℃至8℃下储存。制备以下多价肺炎球菌缀合物疫苗配制品并命名为 pcv27-(1/5)-tt。
[0350]
pcv27(1/5)-tt包含通过以下方法制备的多糖-缀合物:将血清型1和5的每种多糖与tt缀合并且将血清型3、4、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15a、 15b、15c、18c、19a、19f、22f、23a、23b、23f、24f、33f和35b的每种多糖与crm
197
缀合。
[0351]
总剂量0.5ml的pcv27(1/5)-tt包含2.2μg的每种糖,但血清型6b除外,其为4.4 μg;约2μg至25μg tt(对于血清型1和5)和约45μg至100μg crm
197
;0.125mg元素铝 (0.5mg磷酸铝)佐剂;4.25mg氯化钠;约295μg琥珀酸盐缓冲溶液;以及约120μg聚山梨醇酯80。
[0352]
实施例11.多价肺炎球菌缀合物疫苗(pcv27(1/5)-tt)的免疫原性
[0353]
测试了在实施例10中制备的混合载体、多价肺炎球菌疫苗pcv27(1/5)-tt诱导兔子中免疫原性应答的能力。通过针对血清igg浓度的抗原特异性elisa以及通过针对抗体功
能的调理吞噬测定(opa)进行的免疫原性评估。将新西兰白兔在第0周和第2周用人剂量(2.2μg的每种多糖,但6b除外,其为4.4μg)进行肌内免疫。免疫后每2周对血清进行采样。
[0354]
血清型特异性igg浓度测量
[0355]
将每种血清型的荚膜多糖(pnps)以0.5μg/孔至1μg/孔包被在96孔板上。从每名受试者采样相等量的血清并按组进行合并。将血清池用抗体稀释缓冲液系列稀释2.5次,然后在室温下反应30分钟,所述抗体稀释缓冲液包含tween 20和从国家血清研究所获得的肺炎球菌细胞壁多糖(cwps)(5μg/ml)。将板用洗涤缓冲液洗涤5次,然后将预吸附和稀释的血清50μl添加至包被的孔板中,接着在室温下孵育2小时至18小时。用相同的方式洗涤孔板,然后将山羊抗兔igg-碱性磷酸酶缀合物添加至每个孔中,接着在室温下孵育2小时。如上所述洗涤板,并将1mg/ml对硝基苯胺缓冲液添加至每个孔中,接着在室温下反应2小时。通过添加50μl 3m naoh淬灭反应,并测量405nm和690nm处的吸光度。结果显示于表21中。
[0356]
表21.二次免疫后2周的igg浓度(u/ml)
[0357]
功能性免疫原性测试(mopa)
[0358]
通过在mopa测定中测试血清来评价抗体功能。将在-70℃或更低温度下储存的肺炎链球菌mopa菌株稀释至相应的最终稀释倍数,使得每种菌株的浓度为约50,000 cfu/ml。
从每名受试者采样相等量的血清,按组合并,并系列稀释2倍,使得在u底板中保留20μl血清。将样品稀释后,将对于每种血清型准备的10μl菌株与稀释的样品混合,并使混合物在室温下反应30分钟,使得肺炎链球菌和抗体均匀混合。添加预分化的hl-60 细胞和补体的混合物,并在co2培养箱(37℃)中反应45分钟。将温度降低以停止吞噬作用,并将10μl反应溶液点样在预先干燥30至60分钟的琼脂板上,然后使其在板上吸收20 分钟直至干燥。将25mg/ml ttc储备溶液添加至制备的覆盖琼脂中,并向其中添加适合于相应菌株的抗体。将混合物彻底混合,然后将约25ml混合物添加至板上并硬化约30 分钟。将完全硬化的板在co2培养箱(37℃)中孵育12至18小时,然后对菌落进行计数。 mopa滴度表示为如下稀释率,在该稀释率下观察到50%杀伤。结果显示于表22中。
[0359]
表22.二次免疫后2周的mopa滴度
[0360]
实施例12:具有与破伤风类毒素缀合的来自血清型1、5、15b和22f的多糖的 27价肺炎球菌缀合物疫苗的配制
[0361]
通过实施例2-8中描述的一般方法获得单一缀合物。基于批体积和主体糖浓度计算最终主体浓缩物的所需体积。在将0.85%氯化钠(生理盐水)、聚山梨醇酯80和琥珀酸盐缓冲液添加至预标记的配制容器中之后,添加主体浓缩物。然后将制剂彻底混合并通过0.2
μm膜进行无菌过滤。在添加主体磷酸铝期间和之后,将配制的主体轻轻混合。如果必要的话,检查并调节ph。将配制的主体产物在2℃至8℃下储存。制备以下多价肺炎球菌缀合物疫苗配制品并命名为pcv27-(1/5/15b/22f)-tt。
[0362]
pcv27(1/5/15b/22f)-tt包含通过以下方法制备的多糖-缀合物:将血清型1、5、 15b和22f的每种多糖与tt缀合并且将血清型3、4、6a、6b、7f、8、9n、9v、10a、11a、 12f、14、15a、15c、18c、19a、19f、23a、23b、23f、24f、33f和35b的每种多糖与 crm
197
缀合。
[0363]
总剂量0.5ml的pcv27(1/5/15b/22f)-tt包含2.2μg的每种糖,但血清型6b除外,其为4.4μg;约2μg至25μg tt(对于血清型1、5、15b、22f)和约45μg至100μg crm
197
;0.125mg元素铝(0.5mg磷酸铝)佐剂;4.25mg氯化钠;约295μg琥珀酸盐缓冲溶液;以及约120μg聚山梨醇酯80。
[0364]
实施例13.多价肺炎球菌缀合物疫苗pcv27(1/5/15b/22f)-tt的免疫原性
[0365]
测试了在实施例12中制备的混合载体、多价肺炎球菌疫苗 pcv27(1/5/15b/22f)-tt诱导兔子中免疫原性应答的能力。通过针对血清igg浓度的抗原特异性elisa以及通过针对抗体功能的调理吞噬测定(opa)进行的免疫原性评估。将新西兰白兔在第0周和第2周用人剂量(2.2μg的每种多糖,但6b除外,其为4.4μg)进行肌内免疫。免疫后每2周对血清进行采样。
[0366]
血清型特异性igg浓度测量
[0367]
将每种血清型的荚膜多糖(pnps)以0.5μg/孔至1μg/孔包被在96孔板上。从每名受试者采样相等量的血清并按组进行合并。将血清池用抗体稀释缓冲液系列稀释2.5次,然后在室温下反应30分钟,所述抗体稀释缓冲液包含tween 20和从国家血清研究所获得的肺炎球菌细胞壁多糖(cwps)(5μg/ml)。将板用洗涤缓冲液洗涤5次,然后将预吸附和稀释的血清50μl添加至包被的孔板中,接着在室温下孵育2小时至18小时。用相同的方式洗涤孔板,然后将山羊抗兔igg-碱性磷酸酶缀合物添加至每个孔中,接着在室温下孵育2小时。如上所述洗涤板,并将1mg/ml对硝基苯胺缓冲液添加至每个孔中,接着在室温下反应2小时。通过添加50μl 3m naoh淬灭反应,并测量405nm和690nm处的吸光度。作为比较的例子,对可商购13价疫苗(prevnar13)进行相同的程序。结果显示于表23中。
[0368]
表23.二次免疫后2周的igg浓度(u/ml)
[0369]
功能性免疫原性测试(mopa)
[0370]
当血清型1和5的荚膜多糖与tt缀合时,血清型特异性igg浓度与当它们与 crm
197
缀合时获得的相比显著增加。用pcv27(1/5/15b/22f)-tt免疫的兔子还显示出针对另外十四种不存在于prevnar13中的血清型(即,8、9n、10a、11a、12f、15a、15b、15c、22f、23a、23b、24f、33f和35b)的igg浓度的显著增加。特别地,相对于prevnar13,血清型8和9n具有血清特异性igg浓度的大于50倍增加。
[0371]
通过在mopa测定中测试血清来评价抗体功能。将在-70℃或更低温度下储存的肺炎链球菌mopa菌株稀释至相应的最终稀释倍数,使得每种菌株的浓度为约50,000 cfu/ml。从每名受试者采样相等量的血清,按组合并,并系列稀释2倍,使得在u底板中保留20μl血清。将样品稀释后,将对于每种血清型准备的10μl菌株与稀释的样品混合,并使混合物在室温下反应30分钟,使得肺炎链球菌和抗体均匀混合。添加预分化的hl-60 细胞和补体的混合物,并在co2培养箱(37℃)中反应45分钟。将温度降低以停止吞噬作用,并将10μl反应溶液点样在预先干燥30至60分钟的琼脂板上,然后使其在板上吸收20 分钟直至干燥。将25mg/ml ttc储备溶液添加至制备的覆盖琼脂中,并向其中添加适合于相应菌株的抗体。将混合物彻底混合,然后将约25ml混合物添加至板上并硬化约30 分钟。将完全硬化的板在co2培养箱(37℃)中孵育12至18小时,然后对菌落进行计数。 mopa滴度表示为如下稀释率,
在该稀释率下观察到50%杀伤。作为比较的例子,对可商购13价疫苗(prevnar13)进行相同的程序。结果显示于表24中。
[0372]
表24.二次免疫后2周的mopa滴度表24.二次免疫后2周的mopa滴度
[0373]
当血清型1和5与tt缀合时,与当它们与crm
197
缀合时获得的mopa滴度相比,功能性mopa滴度显著增加。用pcv27(1/5/15b/22f)-tt免疫的兔子还显示出针对另外十四种不存在于prevnar13中的血清型(即,8、9n、10a、11a、12f、15a、15b、15c、 22f、23a、23b、24f、33f和35b)中每一种的功能性mopa滴度的显著增加。
[0374]
虽然在说明书中已描述了一个或多个示例性实施方案,但本领域普通技术人员将理解,在不脱离如以下权利要求所限定的本发明构思的精神和范围的情况下,可以在其中进行形式和细节上的各种改变。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。