瘤内注射变异胶原酶治疗癌症的方法
1.优先权和相关申请
2.本技术要求2020年12月29日提交的名称为“瘤内注射胶原酶治疗癌症的方法”的中国专利申请202011596224.5的优先权,该申请包括附录在内的全部内容作为参考并入本技术。
技术领域
3.本发明属于生物药品的癌症治疗方法应用领域,具体涉及瘤内注射变异胶原酶治疗癌症的方法。
背景技术:
4.癌症是现今世界上公共卫生的棘手问题之一,2018年大约有1800万癌症患者,960万人死于癌症,也就是每六人中有一人死于癌症
[1,2]
。世界卫生组织预测,到2040年,全世界将有2940万癌症患者
[1]
。为了治疗癌症,找到有效的癌症治疗方法成为了重要任务。黑色素瘤、胰腺癌和胆管癌这一类以肿瘤纤维化为特征的疾病值得注意,因为其肿瘤微环境的纤维化,为免疫细胞或药物的作用带来了更多困难。2020年,全球有大约32万黑色素瘤患者、50 万胰腺癌患者,并且胰腺癌也成为了第七高死亡人数的癌症,约47万人
[3,4]
。
[0005]
如今,治疗癌症的方法主要分为:手术切除、放射疗法、抗癌药物疗法 (化学疗法)以及免疫阻断抑制剂联合疗法。然而基于肿瘤的特性,让靶向药物有效的到达肿瘤细胞并产生作用成为了难题。肿瘤的细胞外基质,如胶原蛋白和透明质酸,会促进肿瘤的增长和转移,成为天然的药物扩散屏障,阻断淋巴细胞和靶向药物的浸润
[5,6]
。例如,胶原蛋白参与癌组织的纤维化,并且在胶原蛋白充足的区域,纤连蛋白、透明质酸、层粘连蛋白和基质金属蛋白酶与胶原蛋白作用影响癌细胞。又如,透明质酸是一种糖胺聚糖,它聚集在肿瘤细胞表面及其周围空间。在免疫细胞向肿瘤的行进中,透明质酸构成了一道屏障,并压迫血管、阻碍化疗的进行。因此对于纤维化的、硬质的肿瘤,现有的抗肿瘤疗法也并不能很好的发挥作用,近几年来,大家在积极的找寻能够协助治疗的通路。
[0006]
实体瘤的结构复杂,既包含了肿瘤细胞,也包含了脉管系统、细胞外基质、基质细胞和免疫细胞。其中,肿瘤微环境占肿瘤块的较大部分,细胞外基质是肿瘤微环境中最丰富的成分,而胶原蛋白和透明质酸又在细胞外基质中最丰富
[6]
。有研究发现肿瘤微环境出现细胞外基质和间质成分改变,是可能影响治疗效果和导致组织僵硬的因素,也提出肿瘤的硬度与富含胶原蛋白和成纤维细胞的肿瘤体积正相关,进一步分析也发现胶原蛋白的密度与肿瘤的硬度呈正相关,但透明质酸的密度与肿瘤的硬度并未显著相关
[6,7]
。在实体瘤中,细胞外基质的作用与在正常器官内有所不同,瘤内信号传导、转运机制、新陈代谢、氧合作用和免疫原性都受到细胞外基质的影响。也有研究提出,胶原蛋白不仅构成肿瘤微环境的支架,而且能够影响肿瘤微环境,参与到了肿瘤进展的过程
[8]
。
[0007]
一个理想的抗癌方法是能够在杀死癌细胞的同时不伤害正常的细胞,现有的化疗药物并没没有很好的解决这一问题,因此有了一系列的通过利用肿瘤的特异性免疫活性的
靶向疗法和免疫治疗方法。其中,针对免疫检验点 (checkpoint)的抗程序性死亡分子(programme death-1,pd-1)/pd-1配体 (pd-1ligand,pd-l1)单抗的免疫疗法在近几年发展迅速,该免疫疗法与现有的治疗手段组合,在黑色素瘤、肺癌、肾癌等多种肿瘤或晚期癌症治疗中表现出良好的疗效
[9-11]
。然而有研究发现40%-60%的黑色素瘤患者对免疫检查点阻断疗法(如pd-1/pd-l1阻断,ctla4抑制)有抵抗,并且另一部分患者在两年内复发
[12]
。近两年,又有研究表明pd-1/pd-l1免疫治疗在实体瘤的效用的局限性,也只有一部分患者对pd-1/pd-l1疗法有临床反应,对很大一部分患者是无效的
[13]
。研究表明对pd-1//pd-l1的抵抗机制有可能在于肿瘤免疫原性不足、对干扰素γ(interferon gamma,ifn-γ)信号的抗性和免疫微环境异质性等
[13]
。2018年,有综述提出变异胶原酶通过抑制胶原蛋白合成通路或利用变异胶原酶消耗肿瘤胶原蛋白,能够调整肿瘤微环境、提升药物输送的效率,理论上减少肿瘤的细胞外基质能够增加药物的渗透性,从而使得肿瘤细胞内药物浓度的升高
[8]
。但是现有技术中的药物是通过溶解胶原蛋白用来治疗掌腱膜筋缩症,而将变异胶原酶用于癌症治疗的应用尚未建立
[8]
。
技术实现要素:
[0008]
发明要解决的问题
[0009]
针对现有技术中存在的问题,本发明提供了瘤内注射变异胶原酶治疗癌症的方法,通过变异胶原酶溶解细胞外基质中的胶原蛋白、调节瘤内细胞微环境,并联合现有的抗癌治疗手段(如化疗、免疫治疗、靶向治疗)等来提升抗癌效果。
[0010]
用于解决问题的方案
[0011]
本发明人鉴于上述现有技术中存在的问题,进行了深入的研究、反复试验,基于胰腺腺癌和胆管癌在内的几种类型的肿瘤的特征是肿瘤微环境中的致密胶原纤维,本发明提供了一种瘤内注射变异胶原酶治疗癌症的方法。具体来说,本发明通过将从梭状芽孢杆菌(具体为溶组织梭菌)纯化的重组变异胶原酶注射到实体瘤中以减少肿瘤微环境的细胞外基质内的胶原蛋白丰度,从而完成了本发明。
[0012]
本发明旨在通过变异胶原酶溶解实体瘤微环境中的胶原蛋白,改善药物在治疗肿瘤方法中的扩散和渗透。本发明将变异胶原酶直接注射在瘤内微环境中、发挥作用,同时与靶向疗法和免疫疗法联用,为免疫细胞浸润和靶向药物扩散渗透提供更多的空间,变异胶原酶注射的作用机制如图1所示。
[0013]
在本发明的第一方面,提供了一种治疗癌症的方法,其特征在于,在患有癌症的个体的肿瘤内注射包含变异胶原酶的组合物,以减少肿瘤微环境的细胞外基质内的胶原蛋白的丰度。
[0014]
在具体的实施方式中,所述肿瘤为实体瘤;优选的,所述肿瘤选自由黑色素瘤、胰腺癌、胆管癌、乳腺癌、大肠癌、卵巢癌、肺癌组成的组中的任一种;更优选的,所述肿瘤为选自由黑色素瘤、胰腺癌和胆管癌组成的组的任一种。
[0015]
在另外一些具体的实施方式中,所述组合物中的变异胶原酶为纯度98%以上的重组变构变异胶原酶;优选的,所述重组变构变异胶原酶为由溶组织梭菌表达的变异胶原酶colh的451位点被突变为天冬氨酸,所述重组变构变异胶原酶的氨基酸序列如seq id no:2所示。
[0016]
更具体的,所述注射为多点位注射或两点位注射,所述变异胶原酶在所述组合物中的浓度为0.005~0.15mg/100μl。
[0017]
另外,本发明在第一方面提供的治疗癌症的方法可以与化学药物治疗、免疫治疗或靶向治疗联合应用。
[0018]
在本发明的第二方面,提供了一种包含变异胶原酶的组合物在制备治疗癌症的药物中的用途。
[0019]
在具体的实施方式中,所述癌症为恶性肿瘤;优选的,所述癌症自由黑色素瘤、胰腺癌、胆管癌、乳腺癌、大肠癌、卵巢癌、肺癌组成的组中的任一种;更优选的,所述癌症为选自由黑色素瘤、胰腺癌和胆管癌组成的组的任一种。
[0020]
在另外一些具体的实施方式中,所述组合物中的变异胶原酶为纯度98%以上的重组变构变异胶原酶;优选的,所述重组变构变异胶原酶为由溶组织梭菌表达的变异胶原酶colh的451位点被突变为天冬氨酸,所述重组变构变异胶原酶的氨基酸序列如seq id no:2所示。
[0021]
更具体的,所述组合物进一步包括药学上可接受的载体。
[0022]
另外,本发明在第二方面提供的组合物的剂型为注射剂;优选的,所述注射剂为注射液或粉针。
[0023]
发明定义
[0024]
除非另有定义,否则本文中使用的所有技术和科学术语均具有与本领域一般技术人员通常所理解的含义相同的含义。为了本发明的目的,下文定义了以下术语。
[0025]
在本发明的具体实施方式中,所述“变异胶原蛋白酶”优选为中国专利 cn108949730a中涉及的重组变构变异胶原酶,其为溶组织梭菌(clostridiumhistolyticum)中表达变异胶原酶colh的451位点谷氨酸被突变成天冬氨酸,所述重组变构变异胶原酶的氨基酸序列如seq id no:2所示,该氨基酸序列的编码序列如seq id no:1所示。所述变异胶原酶colh的编号为rjv001。该变异胶原酶的具体制备方法参见中国专利cn108949730a。
[0026]
在本发明中,“变异胶原蛋白酶”又可以称为“变异胶原酶”,它们两者可以相互替换、表示相同的含义。
[0027]
术语“癌症”指特征在于在体外(例如经转化的细胞)或体内的过度增殖性细胞生长的广泛病症类别。癌症的具体例子包括但不限于:血液癌症、结肠癌、直肠癌、肾细胞癌、肝癌,肺的非小细胞癌、小肠癌,食道癌、黑素瘤、骨癌、胰腺癌、皮肤癌、头颈癌、皮肤或眼内恶性黑素瘤、子宫癌、卵巢癌、直肠癌、肛区癌、胃癌、睾丸癌、子宫癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、阴户癌、霍奇金氏病、非霍奇金淋巴瘤、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、儿童实体瘤、膀胱癌、肾或输尿管癌、肾盂癌、中枢神经系统(cns)瘤、原发性cns 淋巴瘤、肿瘤血管发生、脊椎肿瘤、脑干神经胶质瘤、垂体腺瘤、卡波西肉瘤、表皮样癌、鳞状细胞癌、t细胞淋巴瘤、环境诱发的癌症、所述癌症的组合和所述癌症的转移性病灶。
[0028]
术语“治疗”是指由于施用一种或多种疗法减慢或改善增生性病症的进展、严重程度和/或持续时间,或改善增生性病症的一种或多种症状(优选地,一种或多种可辨别的症状)。在特定实施方式中,术语“治疗”是指改善增生性病症的至少一种可测量的物理参数比
如肿瘤生长,不必是患者可辨别的。在其它实施方案中,术语“治疗”是指通过例如稳定可辨别的症状以物理方式、通过例如稳定物理参数以生理学方式或两者抑制增生性病症的进展。在其它实施方案中,术语“治疗”是指减小或稳定肿瘤尺寸、癌细胞计数或延长个体的生存期。
[0029]
术语“治疗癌症”不意味着是绝对术语。在一些方面,本发明的方法寻求减少肿瘤尺寸或癌细胞数目,促使癌症进入缓解,或阻止癌细胞的尺寸或细胞数目的生长。在一些情况下,治疗导致改善的预后。
[0030]
术语“多点位注射”在本发明中是指在小鼠皮下,对肿瘤组织原位进行 4点注射,每点50μl变异胶原酶。
[0031]
术语“两点位注射”在本发明中是指在小鼠皮下,对肿瘤组织原位进行 2点注射,每点50μl变异胶原酶。
[0032]
本说明书中,如没有特别说明,则“%”均表示质量百分含量。
[0033]
在本发明中,术语“药学上可接受的载体”是指适于与人体或动物体的细胞、组织或器官相容,且不会诱发毒性、刺激性、变态反应性等毒副作用的辅料成分。示例性的,药学上可接受的载体是本领域所熟知的,包括溶剂、增溶剂、助溶剂、乳化剂、矫味剂、矫嗅剂、着色剂、粘合剂、崩解剂、填充剂、润滑剂、润湿剂、渗透压调节剂、ph调节剂、稳定剂、表面活性剂和/或防腐剂。
[0034]
在本发明中,术语“有效量”指的是足以提供所需的作用但不存在毒性或存在可接受的毒性的化合物的量。该量在受试者之间可能有所不同,取决于受试者的物种、年龄以及身体状况、正在治疗的疾病的严重度、所使用的具体化合物、它的施用方式等。合适的有效量可以由本领域的普通技术人员确定。
[0035]
在本发明中,术语“治疗有效量”用于指示活性化合物或药物制剂引起所指示的生物反应或药物反应的量。这种反应可以出现在由研究人员、兽医、内科医生或其他临床医师所试图治疗的组织、系统(包括人类在内的动物)中。
[0036]
发明的效果
[0037]
由本发明的技术方案可见,本发明的技术方案与现有技术相比,具有以下有益效果:
[0038]
1,本发明在肿瘤内注射重组变异的胶原酶,可以溶解瘤内的胶原蛋白、改变微环境中的细胞外基质,使得杀伤性免疫细胞(主要为t细胞)和靶向药物可以有效侵入,通过本发明提供的方法可降低肿瘤的僵硬度和体积以及协助免疫细胞的浸润,特别是细胞毒性t淋巴细胞(ctl)的浸润增加。具体来说,通过本发明提供的方法能够降低肿瘤细胞的纤维性即减少细胞外基质中胶原蛋白的丰度,从而软化肿瘤降低其硬度。
[0039]
2,本发明提供的治疗方法的适应症为实体瘤与纤维性肿瘤相关癌,本发明尤其对黑色素瘤、胰腺癌、胆管癌等纤维性肿瘤有治疗作用。本发明提供的治疗方法对其它具有致密细胞外基质特性的癌症(如乳腺癌、大肠癌、卵巢癌、肺癌)也有良好的治疗效果。
[0040]
3,本发明提供的变异胶原酶注射剂可多点直接注射入肿瘤细胞/癌细胞;当与免疫检查点阻断疗法、靶向疗法和化学疗法相结合时,本发明提供的变异胶原酶注射剂具有协同的抗肿瘤活性,达到抗肿瘤的治疗目的。
[0041]
为了让本发明的上述和其他目的、特征和优点能更明显易懂,下面特举较佳实施
例,并配合说明书附图,作详细说明如下:
附图说明
[0042]
图1为变异胶原酶注射的作用机制。
[0043]
图2为b16f10黑色素瘤小鼠模型的肿瘤体积随时间变化的示意图。
[0044]
图3为马森三色染色法下胶原蛋白在不同体积的肿瘤组织中的分布,其中所述肿瘤组织来源于b16f10黑色素瘤小鼠模型。
[0045]
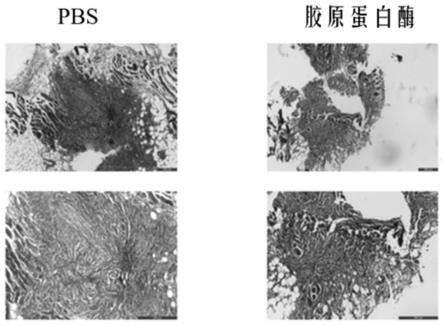
图4为注射0.15mg/100μl变异胶原酶后b16f10黑色素瘤小鼠模型肿瘤组织的变化,其中pbs为磷酸盐缓冲液。
[0046]
图5为注射0.05mg/200μl变异胶原酶后b16f10黑色素瘤小鼠模型肿瘤组织的变化。
[0047]
图6为注射磷酸盐缓冲液(pbs)和0.15mg/100μl的变异胶原酶后b16f10 黑色素瘤小鼠模型肿瘤组织中胶原蛋白的分布。
[0048]
图7为多点位注射小鼠示意图。
[0049]
图8为小鼠皮下注射示意图。
[0050]
图9为多点位注射不同低剂量变异胶原酶后b16f10黑色素瘤小鼠模型肿瘤组织的变化。
[0051]
图10为b16f10黑色素瘤小鼠模型肿瘤组织中多点位注射变异胶原酶和磷酸盐缓冲液(pbs)后的变化。
[0052]
图11为b16f10黑色素瘤小鼠模型多点位注射0.05mg/200μl,h&e染色下的胶原蛋白分布。
[0053]
图12为b16f10黑色素瘤小鼠模型多点位注射0.05mg/200μl,肿瘤形态变化。
[0054]
图13为马森三色染色法下pan02胰腺癌小鼠模型的胰腺癌组织中的胶原蛋白分布。
[0055]
图14为两点位在pan02胰腺癌小鼠模型肿瘤组织中注射磷酸盐缓冲液 (pbs)和0.025mg/100μl的变异胶原酶后的变化。
[0056]
图15为马森三色染色法下两点位在pan02胰腺癌小鼠模型肿瘤组织中注射磷酸盐缓冲液(pbs)和0.025mg/100μl变异胶原酶后的胶原蛋白的分布。
[0057]
图16为在pan02胰腺癌小鼠模型肿瘤组织中两点为注射变异胶原酶 0.025mg/100μl,h&e染色下的胶原蛋白分布(具体参见图17)。
[0058]
图17为pan02胰腺癌小鼠模型两点位注射0.025mg/100μl,免疫细胞浸润情况。
[0059]
图18为pan02胰腺癌小鼠模型注射变异胶原酶后肿瘤大小和体积的变化情况。
[0060]
图19为pan02胰腺癌小鼠模型注射变异胶原酶后肿瘤体积的变化趋势。-具体实施方式
[0061]
本发明所列举的具体实施例只作为本发明的范例,本发明并不限制于下文所描述的具体实施例。对于本领域技术人员而言,任何对下文所述的实施例进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
[0062]
应理解已描述的本发明的实施方案仅为本发明原理的某些应用的说明。在不脱离本发明的真实精髓和范围的情况下,可由本领域技术人员基于本文所提供的教义进行多种修改。为了所有目的,贯穿本技术所引用的所有文献、专利和公开的专利申请的内容将其全部内容在此引入以作参考。
[0063]
实施例中未注明具体条件者,按照常规条件如j.萨姆布鲁克等编著,《分子克隆实验指南(第三版)》(科学出版社,2002)中所述的条件,或制造商建议的条件进行。所有试剂或仪器未注明生产厂商者,均为可以通过市购的常规产品。为了更好地说明本发明,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本发明同样可以实施。在另外一些实施例中,对于本领域技术人员熟知的方法、手段、器材和步骤未作详细描述,以便凸显本发明的主旨。
[0064]
除非另有定义,否则本文中使用的所有技术和科学术语均具有与本领域一般技术人员通常所理解的含义相同的含义。如无特殊说明,本说明书中所使用的单位均为国际标准单位,并且本发明中出现的数值和数值范围,均应当理解为包含了工业生产中所不可避免的系统性误差。
[0065]
实施例1基于b16f10黑色素瘤小鼠模型注射变异胶原酶
[0066]
仪器与材料
[0067]
(1)小鼠模型的构建方法为将小鼠黑色素瘤细胞b16f10同种移植到 c57bl/6小鼠皮下,选取100mm3、300mm3、600mm3和1000mm3体积的肿瘤组织观察。
[0068]
(2)选取不同大小的小鼠的肿瘤组织在不同变异胶原酶剂量下进行实验。所述不同剂量变异胶原酶的分组情况如下:
[0069]
剂量组a(0.15mg/100μl):小鼠编号分别为5-n、5-l、3-n、和5-ll;对应的肿瘤组织体积分别为300mm3、394mm3、467mm3和1139mm3,其中对编号为5-n的小鼠注射0.9%磷酸盐缓冲液(pbs)100μl,对编号为5-l、3-n 和5-ll的小鼠均分别注射0.15mg/100μl的变异胶原酶;
[0070]
剂量组b(0.05mg/200μl):小鼠编号分别为4-r、4-rr和5-rr;对应的肿瘤组织体积分别为446mm3、487mm3和1142mm3。
[0071]
实验方法
[0072]
(1)在5倍与10倍马森三色染色法下观察100mm3、300mm3、600mm3和1000mm3体积的肿瘤组织的胶原蛋白分布与含量。
[0073]
(2)将变异胶原酶和pbs分别以单一位点注射到不同编号的小鼠的肿瘤组织中,24小时后观察其肿瘤组织的变化。不同组实验的变异胶原酶注射剂量分别为剂量组a 0.15mg/100μl和剂量组b 0.05mg/200μl。
[0074]
实验结果
[0075]
(1)随着肿瘤的增长,胶原蛋白总体呈上涨趋势,并在肿瘤组织体积为300mm3下可被清晰的观察到,在体积达到600mm3时变得丰富(具体参见图2和图3)。
[0076]
(2)与注射pbs的肿瘤组织相比较,在不同剂量下注射变异胶原酶后的肿瘤组织,其质地均展现出了变小、变软、分散的趋势(具体参见图4-图 5)。
[0077]
(3)在马森三色染色法中可观察到注射浓度为0.15mg/100μl变异胶原酶的肿瘤组织(编号为5-l)中,大量胶原蛋白断裂、消失;注射了pbs的肿瘤组织中有大量胶原蛋白堆积
(具体参见图6)。
[0078]
实施例2基于b16f10黑色素瘤小鼠模型多点位注射变异胶原酶
[0079]
仪器与材料
[0080]
小鼠模型为同种移植了黑色素瘤b16f10的c57bl/6小鼠,选取不同体积的肿瘤组织多点位注射(具体为4点注射,每点50μl)进行实验(具体注射方式参见图7)。具体分组方式和注射剂量如下:
[0081]
组a:小鼠编号分别为3-rr、4-l和5-r,对应的肿瘤组织体积分别为 1055mm3、449mm3和423mm3,对3-rr、4-l和5-r注射变异胶原酶的剂量分别为0.025mg/200μl、0.01mg/200μl和0.005mg/200μl(具体参见图8);
[0082]
组b:小鼠编号分别为4-n和3-r,对应的肿瘤组织体积分别为2690mm3和2354mm3,对4-n注射变异胶原酶的剂量为0.05mg/200μl,对3-r注射pbs 的剂量为0.05mg/200μl。
[0083]
实验方法
[0084]
针对组a,将三种不同剂型的低剂量变异胶原酶注射在b15f10黑色素瘤小鼠模型组织中并观察其变化;针对组b,在大体积肿瘤组织中多点位注射变异胶原酶并观察其变化(与注射pbs进行对比)。通过马森三色染色法观察注射变异胶原酶后肿瘤组织中胶原蛋白的分布。
[0085]
实验结果
[0086]
(1)在黑素瘤肿瘤成长初期,多点位注射变异胶原酶也改善了肿瘤组织的纤维性,有变小、分散、变软的趋势(具体参见图9)。
[0087]
(2)在大体积肿瘤组织中,明显观察到注射变异胶原酶使得肿瘤组织分散、软化(具体参见图10)。
[0088]
实施例3 b16f10黑色素瘤小鼠模型注射变异胶原酶
[0089]
仪器与材料
[0090]
b16f10黑色素瘤细胞系,6-8周大c57bl/6小鼠。
[0091]
h&e染色实验材料:固定液,苏木精染液,伊红染液,稀盐酸乙醇溶液,培养瓶、培养皿、眼科镊、盖玻片、载玻片、显微镜。
[0092]
免疫组化/荧光分析材料:切片,试剂/试剂盒,仪器/耗材。
[0093]
实验方法
[0094]
(1)构建模型:将小鼠黑色素瘤细胞系b16f10活细胞同种移植到c57bl/6小鼠皮下,进行体积检测及不同体积解剖分析,进行组织切片h&e/ 胶原染色及免疫组化/荧光分析。
[0095]
(2)变异胶原酶梯度给药及条件优化:对接种后的模型小鼠给药,进行生存分析与副作用分析,对于肿瘤的体积、质地及转移情况分析,进行组织切片h&e/胶原染色及免疫组化/荧光分析,进行肿瘤浸润免疫细胞(tils) 流式分析。
[0096]
实验结果
[0097]
4点注射,200μl,0.0125mg/250mm3。
[0098]
(1)肿瘤胶原蛋白减少,丰度减少(具体参见图11)。
[0099]
(2)肿瘤变软,组织松散(具体参见图12)。
[0100]
实施例4基于pan02胰腺癌小鼠模型两点注射变异胶原酶
[0101]
仪器与材料
[0102]
小鼠模型的构建方法为将小鼠胰腺癌细胞系pan02接种到c57bl/6小鼠皮下,选取不同体积的肿瘤组织进行两点位注射(具体为2点注射,每点50 μl,共包含0.025mg变异胶原酶)。
[0103]
实验方法
[0104]
(1)用马森三色染色法观察pan02小鼠模型的胰腺癌组织的胶原蛋白分布。所用小鼠编号分别为2-l、1-r和1-rr。
[0105]
(2)将0.025mg变异胶原酶以2点形式注射在本实施例小鼠模型的胰腺癌组织中(小鼠编号为2-n)观察其变化,与注射100μl的0.9%磷酸盐缓冲液 (pbs)组(小鼠编号为2-rr)进行对比。通过马森三色染色法观察注射变异胶原酶后肿瘤组织中胶原蛋白的分布。
[0106]
实验结果
[0107]
(1)在马森三色染色法下,观察到pan02小鼠模型的胰腺癌组织(组织体积小于100mm3)中存在大量胶原蛋白(具体参见图13)。
[0108]
(2)注射变异胶原酶的编号为2-n的小鼠模型的胰腺癌组织中明显变小(具体参见图14),并且胶原蛋白大量消失;注射pbs的编号为2-rr的小鼠模型的胰腺癌组织中仍有大量胶原蛋白(具体参见图15)。
[0109]
实施例5 pan02胰腺导管腺癌小鼠模型注射变异胶原酶
[0110]
仪器与材料
[0111]
pan02胰腺癌瘤细胞系,6-8周大c57bl/6小鼠。
[0112]
h&e染色实验材料:固定液,苏木精染液,伊红然也,稀盐酸乙醇溶液,培养瓶、培养皿、眼科镊、盖玻片、载玻片、显微镜。
[0113]
免疫组化/荧光分析材料:切片,试剂/试剂盒,仪器/耗材。
[0114]
实验方法
[0115]
(1)构建模型:将胰腺癌细胞系pan02活细胞同种移植到c57bl/6小鼠皮下,进行体积检测及不同体积解剖分析,进行组织切片h&e/胶原染色及免疫组化/荧光分析。
[0116]
(2)变异胶原酶梯度给药及条件优化:对接种后的模型小鼠给药,进行生存分析与副作用分析,对于肿瘤的体积、质地及转移情况分析,进行组织切片h&e/胶原染色及免疫组化/荧光分析,进行肿瘤浸润免疫细胞(tils) 流式分析。
[0117]
实验结果
[0118]
两点注射,100μl,0.0125mg,300
±
100mm3[0119]
(1)肿瘤胶原蛋白减少,丰度减少(具体参见图16)。
[0120]
(2)肿瘤变软,组织松散。
[0121]
(3)免疫细胞浸润明显(具体参见图17)。
[0122]
实施例6 pan02胰腺导管腺癌小鼠模型注射变异胶原酶
[0123]
仪器与材料
[0124]
pan02胰腺癌瘤细胞系,6-8周大c57bl/6小鼠20只。
[0125]
实验方法
[0126]
(1)胰腺癌细胞系pan02活细胞同种移植到c57bl/6小鼠皮下,取10 只注射pbs对照,10只注射0.0125mg/100μl变异胶原酶。
[0127]
(2)观察注射后第45、50、55、60天后肿瘤大小的变化。
[0128]
实验结果
[0129]
(1)对照组6只小鼠存活,药物剂量组4只小鼠存活。
[0130]
(2)与对照组相比变异胶原酶注射组的肿瘤体积明显减小(图18)。
[0131]
(3)与对照组相比变异胶原酶注射组的肿瘤生长有抑制趋势(图19,注:a1~a6为对照组,b1~b4为药物组)。
[0132]
【参考文献】:
[0133]
1.worldhealthorganization.whoreportoncancer:settingpriorities,investingwiselyandprovidingcareforall.2020.
[0134]
2.siegelrl,millerkd,jemala.cancerstatistics,2020.ca:acancerjournalforclinicians.2020;70(1):7-30.
[0135]
3.worldhealthorganization.《13-pancreas-fact-sheet.pdf》.2020.
[0136]
4.worldhealthorganization.《16-melanoma-of-skin-fact-sheet.pdf》.2020.
[0137]
5.fangm,yuanj,pengc,liy.collagenasadouble-edgedswordintumorprogression.tumorbiology.2014;35(4):2871-82.
[0138]
6.henkee,nandigamar,erg
ü
ns.extracellularmatrixinthetumormicroenvironmentanditsimpactoncancertherapy.frontiersinmolecularbiosciences.2020;6:160.
[0139]
7.rieglerj,labyedy,rosenzweigs,javinalv,castiglionia,dominguezcx,etal.tumorelastographyanditsassociationwithcollagenandthetumormicroenvironment.clinicalcancerresearch.2018;24(18):4455-67.
[0140]
8.dolora,szokajrfc.digestingapathforward:theutilityofcollagenasetumortreatmentforimproveddrugdelivery.molecularpharmaceutics.2018;15(6):2069-83.
[0141]
9.hany,liud,lil.pd-1/pd-l1pathway:currentresearchesincancer.americanjournalofcancerresearch.2020;10(3):727.
[0142]
10.wuy,chenw,xuzpg,guw.pd-l1distributionandperspectiveforcancerimmunotherapy
–
blockade,knockdown,orinhibition.frontiersinimmunology.2019;10:2022.
[0143]
11.goodmanam,piccionid,katos,boicharda,wangh-y,framptong,etal.prevalenceofpdl1amplificationandpreliminaryresponsetoimmunecheckpointblockadeinsolidtumors.jamaoncology.2018;4(9):1237-44.
[0144]
12.imbertc,montforta,fraissem,marcheteaue,gilhodesj,martine,etal.resistanceofmelanomatoimmunecheckpointinhibitorsisovercomebytargetingthesphingosinekinase-1.naturecommunications.2020;11(1):1-14.
[0145]
13.leiq,wangd,sunk,wangl,zhangy.resistancemechanismsofanti-pd1/pdl1therapyinsolidtumors.frontiersincellanddevelopmentalbiology.2020;8。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。