1.本发明提供了用在治疗或预防肺部炎症性疾病、肺炎和/或支气管炎(bronchitis)的组合物、药物和方法中的分子。
背景技术:
2.肺内的炎症和超常的细胞因子/化学因子应答会导致一些破坏性的病理。例如,感染可以导致炎症,炎症引起组织损伤和其他并发症。肺炎和支气管炎是这样的两种并发症,它们会因病毒、细菌和/或真菌感染而发生。肺炎和支气管炎也可能是由于重症监护设置中的通风和有毒物质和化学品吸入而产生。
3.在抗生素耐药性的时代,需要有可以用于预防或治疗肺部炎症的替代药物、组合物和方法。
技术实现要素:
4.本公开内容是基于以下发现:对细胞表面的唾液酸(特别是唾液酸糖缀合物)(这些包括含有唾液酸的糖蛋白和细胞表面唾液酸受体)具有亲和力(或与之结合的能力)的分子,在治疗和/或预防炎症性疾病和/或具有炎症性病原学的病症方面具有用途。这种类型的疾病和/或病症可包括,例如,那些特征在于由于细胞因子级联反应而发生的炎症的疾病和/或病症。
5.本文所述的各种分子可用于治疗或预防可能发生在肺部组织和/或结构中及其周围的炎症的方法。
6.肺部的炎症可能因感染而发生。因此,本公开内容的分子可用于治疗或预防因微生物,例如病毒、细菌和/或真菌在肺部感染而发生的炎症。技术人员会理解,这种类型的感染会诱发潜在的有害细胞因子和/或趋化因子级联,导致细胞涌入(肿胀)和组织损伤。
7.肺部感染可能导致支气管炎、毛细支气管炎(bronchiolitis)或肺炎的形式。因此,使用本文所述的各种唾液酸结合分子可以治疗或预防的疾病和/或病症可包括,例如那些选自由以下组成的组:
8.(i)(慢性和急性)肺炎;
9.(ii)(慢性和急性)支气管炎;和
10.(iii)(慢性和急性)毛细支气管炎。
11.更具体地说,本文所述的分子可用于治疗或预防下列一种或多种类型或形式的肺炎:
12.(a)细菌性肺炎:这可以因肺炎球菌感染而发生。例如,涉及肺炎链球菌(streptococcus pneumoniae)、流感嗜血杆菌(haemophilus influenzae)和金黄色葡萄球菌(staphylococcus aureus)的感染,都可以导致肺炎;
13.(b)病毒性肺炎-经常由呼吸道合胞病毒(rsv)和有时由a型或b型流感引起;和
14.(c)真菌性肺炎
‑‑
可以发生在免疫系统受损的受试者身上。真菌性肺炎可能是曲
霉病(aspergillosis)感染后的并发症。
15.另一类可以由本文所述分子治疗或预防的肺炎是”吸入性肺炎"
‑‑
这是由吸入呕吐物、异物或颗粒和/或有害或有毒物质,如烟雾或化学品引起的肺炎。
16.可以使用本文所述分子进行治疗的其他形式的肺炎可包括,例如那些发生在医院或护理机构环境中的受试者中的肺炎,通常是在所述受试者正在接受另一种不相关病症的治疗时。例如,使用呼吸机的重症监护受试者(或患者)特别处于发生通风机相关的肺炎的风险。因此,本发明的分子可用于,也许是预防性的,确保降低易患/倾向于患肺炎的受试者的肺炎风险(这将包括有潜在健康问题的患者或受试者、重症监护患者(特别是那些正在通气的患者)和/或免疫系统受损的患者)。
17.其他疾病和/或病症,包括那些没有微生物病因的疾病和/或病症,也可能导致某种程度的肺部炎症。这种类型的疾病和/或病症可以使用本文所述的任何分子进行治疗和/或预防,且可能包括(例如)以下列出的一种或多种疾病:
18.(i)慢性阻塞性肺病(copd);
19.(ii)哮喘;
20.(iii)肺气肿;和
21.(iv)间质性肺部疾病。
22.为方便起见,本文所述的所有疾病和病症都应在”肺部炎症性疾病”这一术语下提及。
23.本公开内容提供了用于治疗和/或预防肺部炎症性疾病的唾液酸结合分子。
24.进一步提供的是唾液酸结合分子在制备用于治疗和/或预防肺部炎症性疾病的药物中的用途。
25.本公开内容还提供了治疗或预防肺部炎症性疾病的方法,所述方法包括向需要其的受试者施用治疗有效量的唾液酸结合分子。
26.本公开内容还提供了唾液酸结合分子和包含唾液酸结合分子的药物和方法,用于治疗或预防肺部炎症性疾病的方法中。
27.在本说明书中,术语”包括"、"包含"和/或”包括(单数)"被用来表示本发明"包括"一个或多个特定特征的方面和实施方案。应该理解的是,这/这些术语也可以涵盖"基本上由"或"由"相关特征或多个特征组成的方面和/或实施方案。
28.不希望受到理论约束,认为当向受试者施用本公开内容的唾液酸结合分子时,可以遏制、抑制或减少肺内的细胞因子应答和/或遏制、抑制或减少细胞(包括免疫细胞)涌入肺组织。这些作用结合在一起,导致了肺内炎症应答的减少,也减少了通常与超常的细胞因子/化学因子级联有关的任何损害。
29.虽然可能已经确定,某些唾液酸结合蛋白可以通过增加某些细胞因子(包括各种促炎细胞因子)的水平来激发或调节免疫系统,而且激发或调节的免疫应答可能会影响一大批不同病原体(包括那些在发病过程中不结合或不主要结合唾液酸的病原体)的病理,但技术人员仍然不会发现本文所述的唾液酸结合分子抑制细胞因子应答和细胞迁移,因此可以用于治疗或预防由激活的细胞因子和增加的细胞迁移引起或促成的疾病或病症。
30.此外,对于现有技术公开的内容,其中唾液酸结合分子已被用作能够阻断病原体与细胞表面唾液酸/唾液酸糖缀合物的结合的药剂,唾液酸结合分子的效用源于唾液酸结
合分子和病原体都结合唾液酸的事实;这里并非这种情况。许多导致本文所述类型的肺部炎症性疾病的病原体或临床情况,并不关注或涉及病原体与唾液酸之间的结合。如前所述,本公开内容是基于意外的发现,即某些唾液酸结合分子起到了抑制特定细胞因子(包括促炎细胞因子)和细胞迁移的作用。
31.本公开内容所报告的发现对具有唾液酸结合亲和力的分子的配制和施用以及随后将这些制剂用于治疗和/或预防肺部炎症性疾病具有重要意义。
32.例如,发现本文所述的唾液酸结合分子可以用于治疗或预防肺部炎症性疾病,使得允许使用或制备所公开的唾液酸结合分子作为适合粘膜、鼻内或吸入施用的制剂。
33.因此,本公开内容提供了用于粘膜施用的组合物,所述组合物包括用于治疗和/或预防肺部炎症性疾病的唾液酸结合分子。
34.应该注意的是,术语"粘膜施用"囊括为在任何粘膜表面(例如包括呼吸道表面、鼻腔通道等)施用而配制的组合物。该术语还囊括为通过吸入施用而配制的组合物。适合(或配制)用于粘膜施用的组合物可包括旨在鼻内(或鼻腔)给药的组合物。
35.因此,用于粘膜施用的组合物可与适合用于上述任何类型粘膜施用的赋形剂、稀释剂和/或缓冲剂一起配制。
36.用于粘膜(例如鼻内)施用的组合物可包括待施用的唾液酸结合分子的溶液和/或用于气溶胶分散或在饮用水中分配的颗粒(包含其)。分散时,此类组合物应理想地具有在10至200微米范围的颗粒直径,以便能够保留在例如鼻腔内;这可以通过酌情使用适当的颗粒大小的粉末或选择适当的阀来实现。其他合适的组合物包括具有在20至500微米范围的颗粒直径的粗粉末,用于从靠近鼻子的容器中通过鼻腔通道快速吸入施用,以及通过包含0.2至5%w/v的活性化合物水溶液或悬浮液的滴鼻剂施用。用于粘膜施用的组合物可以以液体喷雾的形式提供。
37.重要的是,本公开内容提供了用于预防用途的唾液酸结合分子。具体来说,本文所述的唾液酸分子可用于预防,以防止受试者的肺部炎症性疾病。
38.因此,本公开内容提供了用于预防肺部炎症性疾病的唾液酸结合分子。还提供了唾液酸结合分子在制备用于预防肺部炎症性疾病的药物中的用途。预防或防止肺部炎症性疾病的方法可包括向需要其的受试者施用治疗有效量的唾液酸结合分子。在所有情况下,唾液酸结合分子可以是:
39.(i)制备成适合粘膜(包括鼻内)施用的制剂;和/或
40.(ii)施用至受试者的粘膜表面和/或鼻内施用。
41.此外,在所有情况下,肺部炎症性疾病可以是肺炎、毛细支气管炎和/或支气管炎。
42.如本文和任何预防方法或用于预防肺部炎症性疾病的方法或唾液酸结合分子中使用的,术语"受试者"可扩展至任何易受、易感或有患肺部炎症性疾病风险的受试者,肺部炎症性疾病包括肺炎、毛细支气管炎和/或支气管炎。受试者可以是新生儿、婴儿或儿童。受试者可以是成年人或老年人。受试者可以是免疫系统受损的受试者。受试者可具有一个或多个潜在或慢性健康问题
‑‑
特别是影响呼吸道和/或呼吸的问题。例如,受试者可能患有哮喘。受试者可能有病毒、细菌和/或真菌感染;感染可存在于受试者的肺部。受试者可能是重症监护患者。
43.在本说明书中,术语"唾液酸结合分子"囊括任何有用的唾液酸结合分子。有用的
唾液酸结合分子可采取任何形式和/或属于任何类别的分子或化合物(例如,它们可以是蛋白质、肽、碳水化合物、抗体等),并且术语"唾液酸"囊括所有形式的n-或o-取代的神经氨酸,并包括所有合成的、天然发生的和/或其修饰的形式。唾液酸可作为细胞表面分子、糖蛋白和糖脂的组分被发现。最常见的是,唾液酸存在于与细胞膜和/或蛋白质相连的糖链的末端(末端区域)。例如,人类上呼吸道的一些细胞包括α-2,6-连接的唾液酸受体,上呼吸道和下呼吸道的其他细胞包括α-2,3-连接的唾液酸受体。唾液酸家族包括一些(大约50种)衍生物,这些衍生物可能是由c4、c5、c7、c8和c9的乙酰化、糖基化、内酯化和甲基化产生的。所有这些衍生物都囊括在术语"唾液酸"中。
44.此外,还发现唾液酸α(2,3)或α(2,6)与gal和galnac连接,或α(2,8)或α(2,9)与另一个唾液酸连接。因此,重要的是要理解,虽然本说明书中一直使用"唾液酸"一词,但它包括其所有衍生物、类似物或变体(无论是天然存在的还是合成产生的),以及包含它的单体、二聚体、三聚体、寡聚体、聚合物或多联体。
45.因此,本公开内容(以及用于本文所述的)的唾液酸结合分子包括对唾液酸表现出亲和力的部分—其包括上述所有形式的唾液酸和存在于细胞,例如哺乳动物细胞表面的任何形式的唾液酸(也许是细胞表面受体的一部分)。这些不同形式的唾液酸可统称为"唾液酸部分"。
46.本公开内容中的唾液酸结合分子表现出对唾液酸的亲和力,因此它们可以与一个或多个唾液酸部分结合/耦合和/或缔合。因此,术语"唾液酸结合分子”可进一步涵盖整个唾液酸结合分子中保留了与唾液酸部分结合或以其他方式与之耦合或缔合的能力的片段。
47.唾液酸结合分子,包括那些用于本文所述的用途、组合物和方法的唾液酸结合分子,可以包括单一的唾液酸结合分子(例如单体或单价分子),或者,两个或更多的唾液酸结合分子
‑‑
这两个或更多的分子可以是相同或不同的
‑‑
例如聚合或多价分子。
48.唾液酸结合分子,包括用于本文所述的用途、组合物和方法的唾液酸结合分子,可包括、基本上由或由一个或多个被称为”碳水化合物结合模块"(cbm)的唾液酸结合分子组成。适合使用的cbm表现出对唾液酸的亲和力。cbm被分为不同的家族,属于40cbm家族(cbm40)成员的cbm可能是有用的。40cbm家族囊括大约200个残基的分子,通常在gh33唾液酸酶(sialidase)的n端发现。它们也可以被发现插入到gh33唾液酸酶的β螺旋桨中。
49.本公开内容可囊括包括唾液酸结合成分的分子,例如较大的分子的用途。如前所述,该唾液酸结合组分(即唾液酸结合分子)本身可包括(由或基本上由其组成)cbm,例如cbm40。作为(非限制性)实例,本公开内容的分子(例如,唾液酸结合分子)不仅可以表现出结合唾液酸的能力,而且还可以有一个或多个其他功能。例如,这些分子可以具有酶活性。例如,有用的分子可包括cbm(如本文所述),并表现出一些唾液酸酶的活性。
50.有用的唾液酸结合分子可以是融合蛋白,其包括酶部分和唾液酸结合部分
‑‑
其中唾液酸结合部分包括本公开内容的唾液酸结合分子。在这种情况下,酶部分可以与唾液酸结合部分融合。如前所述,任何有用的融合蛋白的酶部分可包括(或具有,或表现出)唾液酸酶活性。
51.用于本文所述各种用途、方法和组合物的唾液酸结合蛋白或cbm,可不作为具有酶(例如唾液酸酶)活性的分子(例如融合蛋白)的一部分,或不被包含在其中提供。此外或替代性地,所述唾液酸结合分子可不(i)结合肝素或硫酸肝素和/或(ii)包括结合肝素或硫酸
肝素部分的蛋白质的gag结合结构域。
52.因此,本公开内容提供了cbm或cbm40用于治疗和/或预防本文所公开的肺部炎症性疾病。
53.进一步提供了cbm或cbm40在制备用于治疗和/或预防本文公开的肺部炎症性疾病的药物中的用途。
54.本公开内容还提供了治疗或预防本公开内容的肺部炎症性疾病的方法,所述方法包括向需要其的受试者施用治疗有效量的cbm或cbm40。
55.本公开内容还提供了包含cbm或cbm40的唾液酸结合分子和药物及方法,用在治疗或预防肺部炎症性疾病的方法中,肺部炎症性疾病例如肺炎、毛细支气管炎和/或支气管炎。
56.本公开内容提供了用于粘膜施用的组合物,所述组合物包含cbm和/或cbm40,用于治疗和/或预防本公开的肺部炎症性疾病。如前所述,用于粘膜施用的组合物可与适合用于任何类型的粘膜施用,包括例如鼻内施用的辅料、稀释剂和/或缓冲剂一起配制。
57.本公开内容可进一步提供cbm或cbm40用于预防用途。具体而言,本文所述的cbm或cbm40可预防性地使用以防止感染肺部炎症性疾病,包括例如肺炎、毛细支气管炎和/或支气管炎。
58.示例性的碳水化合物结合模块(cbm)可包括霍乱弧菌(vibrio cholerae)nanh唾液酸酶(vccbm:cbm40)的唾液酸结合结构域和/或来自肺炎链球菌(streptococcus pneumoniae)nana唾液酸酶(spcbm:也是cbm40)的等效(或同源)结构域。当然,存在于其他生物体中的类似或同源的唾液酸结合模块也应包括在术语“cbm”的范围内。
59.示范性的霍乱弧菌nanh唾液酸酶的氨基酸序列以登录号a5f7a4保存,并作为seq id no:1(781个氨基酸)复制在下面。
60.mrfknvkkta lmlamfgmat ssnaalfdyn atgdtefdsp akqgwmqdnt nngsgvltna
61.dgmpawlvqg iggraqwtys lstnqhaqas sfgwrmttem kvlsggmitn yyangtqrvl
62.piisldssgn lvvefegqtg rtvlatgtaa teyhkfelvf lpgsnpsasf yfdgklirdn
63.iqptaskqnm ivwgngssnt dgvaayrdik feiqgdvifr gpdripsiva ssvtpgvvta
64.faekrvgggd pgalsntndi itrtsrdggi twdtelnlte qinvsdefdf sdprpiydps
65.sntvlvsyar wptdaaqngd rikpwmpngi fysvydvasg nwqapidvtd qvkersfqia
66.gwggselyrr ntslnsqqdw qsnakirivd gaanqiqvad gsrkyvvtls idesgglvan
67.lngvsapiil qsehakvhsf hdyelqysal nhtttlfvdg qqittwagev sqenniqfgn
68.adaqidgrlh vqkivltqqg hnlvefdafy laqqtpevek dleklgwtki ktgntmslyg
69.nasvnpgpgh gitltrqqni sgsqngrliy paivldrffl nvmsiysddg gsnwqtgstl
70.pipfrwksss iletlepsea dmvelqngdl lltarldfnq ivngvnyspr qqflskdggi
71.twslleanna nvfsnistgt vdasitrfeq sdgshfllft npqgnpagtn grqnlglwfs
72.fdegvtwkgp iqlvngasay sdiyqldsen aivivetdns nmrilrmpit llkqkltlsq
73.n
74.seq id no:1的cbm区域是从氨基酸残基25到216-这个序列可以是seq id no:2。
75.示例性的肺炎链球菌nana唾液酸酶的氨基酸序列以登录号p62575被保存,并作为seq id no:3(1035个氨基酸)复制在下面。
76.msyfrnrdid iernsmnrsv qerkcrysir klsvgavsmi vgavvfgtsp vlaqegaseq
77.planetqlsg esstltdtek sqpssetels gnkqeqerkd kqeekiprdy yardlenvet
78.viekedvetn asngqrvdls seldklkkle natvhmefkp dakapafynl fsvssatkkd
79.eyftmavynn tatlegrgsd gkqfynnynd aplkvkpgqw nsvtftvekp taelpkgrvr
80.lyvngvlsrt slrsgnfikd mpdvthvqig atkranntvw gsnlqirnlt vynraltpee
81.vqkrsqlfkr sdlekklpeg aaltektdif esgrngkpnk dgiksyripa llktdkgtli
82.agaderrlhs sdwgdigmvi rrsedngktw gdrvtitnlr dnpkasdpsi gspvnidmvl
83.vqdpetkrif siydmfpegk gifgmssqke eaykkidgkt yqilyregek gaytirengt
84.vytpdgkatd yrvvvdpvkp aysdkgdlyk gnqllgniyf ttnktspfri akdsylwmsy
85.sdddgktwsa pqditpmvka dwmkflgvgp gtgivlrngp hkgrilipvy ttnnvshlng
86.sqssriiysd dhgktwhage avndnrqvdg qkihsstmnn rraqntestv vqlnngdvkl
87.fmrgltgdlq vatskdggvt wekdikrypq vkdvyvqmsa ihtmhegkey iilsnaggpk
88.rengmvhlar veengeltwl khnpiqkgef aynslqelgn geygilyeht ekgqnaytls
89.frkfnwdfls kdlispteak vkrtremgkg viglefdsev lvnkaptlql angktarfmt
90.qydtktllft vdsedmgqkv tglaegaies mhnlpvsvag tklsngmngs eaavhevpey
91.tgplgtsgee paptvekpey tgplgtsgee paptvekpey tgplgtagee aaptvekpef
92.tggvngtepa vheiaeykgs dslvtlttke dytykaplaq qalpetgnke sdllaslglt
93.afflglftlg kkreq
94.seq id no:3的cbm区域是从氨基酸残基121到305-这个序列可以是seq id no:4。
95.因此,在本公开内容的各方面和实施方案中,用于作为唾液酸结合分子的cbm可以包括具有seq id no:1、2、3或4的序列或由其衍生的序列或片段的蛋白质或肽。从seq id no:1、2、3或4中的任一项衍生的序列或片段本身可以提供或编码具有结合唾液酸能力的分子(换句话说,唾液酸结合分子编码seq id nos:1、2、3或4的片段的一部分)。
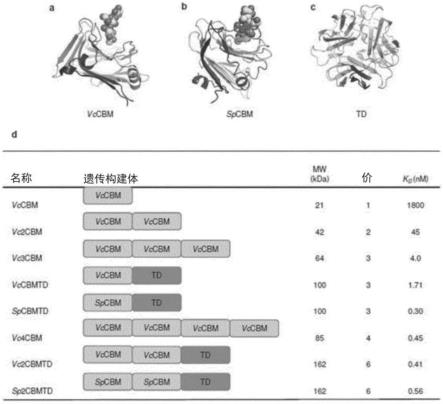
96.使用的唾液酸结合分子可包括氨基酸序列,该序列与seq id no:1、2、3或4提供的任何序列具有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%。至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%的同一性。
97.此外,使用的唾液酸结合分子可包括seq id no:1和2的霍乱弧菌唾液酸酶分子的从大约残基1、5、10、15、25或30(即从1-30或其间的任何氨基酸残基)到大约残基150、175、200、210、216、220-781(到150到781的任何残基,包括其间的任何残基)。例如,使用的唾液酸结合分子可以包括具有对应于上述seq id no:1的残基25到大约残基216的序列的肽。
98.使用的唾液酸结合分子可包括seq id no:3和4的肺炎链球菌唾液酸酶分子从大约残基80、90、100、110、120、121至130(即从大约残基80至130的任一项,包括其间的任何残基)到大约残基250、275、300、305、310、320-1035(即到大约250-1035的任一项,包括到其间的任何残基)。例如,使用的唾液酸结合分子可包括具有对应于上述seq id no:3的残基121至大约残基305的序列的肽。
99.使用的唾液酸结合分子可包括一个或多个cbm。例如,合适的唾液酸结合分子可以包括单个cbm
‑‑
例如源自vccbm的单个唾液酸结合分子(示例性的vccbm序列在上面公开为
seq id no:1和2)或从spcbm衍生的单个唾液酸结合分子(示例性的spcbm序列在上面公开为seq id no:3和4)。另外,使用的唾液酸结合分子可包括多个或多(即两个或更多个)cbm。包含多个cbm的唾液酸结合分子可被称为”多价唾液酸结合分子”或”多价cbm"。例如,多价cbm可以包括两个或更多(例如三个、四个、五个或六个)源自vccbm的唾液酸结合分子或两个或更多个源自spcbm的唾液酸结合分子。多价cbm可包括不同cbm的混合物,例如,一个或多个来自vccbm的唾液酸结合分子与一个或多个来自spcbm的唾液酸结合分子。
100.使用的唾液酸结合分子可进一步包括寡聚化结构域。合适的寡聚化结构域可以表现出自我缔合而形成多聚体结构(例如三聚体)的能力。使用的寡聚化结构域可包括任何具有上述寡聚化特性的分子或其任何功能片段。例如,一个或多个(例如两个)唾液酸结合分子(例如来自本文所述cbm的唾液酸结合分子)可以与寡聚化结构域结合、耦合或融合
‑‑
然后可以将所得的唾液酸结合分子:寡聚化结构域”融合体”用(与一个或多个其他此类”融合体"一起)作用于调节细胞生长和/或活性和/或用于治疗或预防本文所公开的任何疾病和/或病症的分子。
101.合适的寡聚化结构域可以衍生自例如铜绿假单胞菌(pseudomonas aeruginosa)假胺化酶(pseudaminidase)。示范性的铜绿假单胞菌假胺化酶序列的氨基酸序列以登录号pao579保存,并作为seq id no:5(438个氨基酸)复制在下面。
102.mntyfdiphr lvgkalyesy ydhfgqmdil sdgslyliyr ratehvggsd grvvfskleg
103.giwsaptiva qaggqdfrdv aggtmpsgri vaastvyetg evkvyvsdds gvtwvhkftl
104.arggadynfa hgksfqvgar yviplyaatg vnyelkwles sdggetwgeg stiysgntpy
105.netsylpvgd gvilavarvg sgaggalrqf islddggtwt dqgnvtaqng dstdilvaps
106.lsyiyseggt phvvllytnr tthfcyyrti llakavagss gwtervpvys apaasgytsq
107.vvlggrrilg nlfretsstt sgayqfevyl ggvpdfesdw fsvssnslyt lshglqrspr
108.rvvvefarss spstwnivmp syfndgghkg sgaqvevgsl nirlgtgaav wgtgyfggid
109.nsattrfatg yyrvrawi
110.seq id no:5的寡聚化结构域是从氨基酸残基333到438-这个序列可以是seq id no:6。
111.因此,使用的寡聚化结构域可以包括氨基酸序列,该序列与seq id no:5或6提供的序列具有至少30%,至少35%,至少40%,至少45%,至少50%,至少55%,至少60%,至少65%,至少70%,至少75%,至少80%,至少85%,至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%的同一性。
112.此外,使用的寡聚化结构域可包含seq id no:5提供的铜绿假单胞菌假胺化酶三聚化结构域(patd)的大约残基250、275、300、310、320、333、340至350(即大约残基250至大约残基350,包括其间的大约任何残基)至大约残基400、410、420、430或438(即至从大约残基400残基438的大约任何残基,包括到其间的大约任何残基)。例如,有用的唾液酸酸结合分子可以利用包含seq id no:6的残基333至438的寡聚化结构域。
113.图1描述了一系列的唾液酸结合分子,包括:包含(基本上由其组成,或由其组成)两个或更多的vccbm,任选地与寡聚化结构域(例如patd或其寡聚化片段)融合、结合或缀合的分子。唾液酸结合分子可包括、基本上由或由两个融合(或结合)的vccbm组成,所述vccbm
又与寡聚化结构域融合(例如,见图1所示的分子vc2cbmtd)。
114.其他唾液酸结合结构域可包括两个或更多个spcbm,任选地与寡聚化结构域(例如patd或其寡聚化片段)融合、结合或缀合。唾液酸结合分子可包括、由或基本上由两个融合(或结合)的spcbm组成,所述spcbm又与寡聚化结构域融合(参见例如,图1所示的分子sp2cbmtd)。
115.本公开内容涉及有用的唾液酸结合分子,所述唾液酸结合分子是由本文所述的各种唾液酸结合分子(例如包括本公开内容的各种cbm)"衍生”而来。这些”衍生的"(和有用的)分子可包括代表本文所述任何分子的修饰形式的唾液酸结合分子,包括所公开的cbm序列的修饰形式。
116.应该理解的是,术语”修饰”包括相对于参考序列含有一个或多个突变的分子。
117.在本公开内容的上下文中,"参考序列”可以是任何编码或提供唾液酸结合分子的野生型序列,例如,野生型cbm序列。例如,参考序列可以包括、基本上由或由野生型家族40cbm序列组成,例如来自霍乱弧菌nanh唾液酶或肺炎链球菌nana唾液酶的野生型cbm序列(应理解为存在于其他生物体中的类似或同源的cbm(包括cbm40)应包括在术语”cbm”和/或作为cbm参考序列的范围内)。可衍生出有用的唾液酸结合分子(包括本文所述的有用的多价cbm)的参考序列可包括本文所述的任何特定序列(例如seq id no:1、2、3、4和5)。
118.例如,使用的修饰的cbm序列可衍生自特定或特别的野生型cbm。有用的修饰的cbm序列可包括野生型cbm序列,它包括一个或多个突变。
119.一个或多个突变可以是功能性的。例如,突变可改变使用的cbm的整体一级序列,但可以不(实质上)改变cbm的特性
‑‑
因此,虽然修饰的cbm的序列可能不同于衍生它的野生型序列,但修饰的cbm的整体功能(实质上)与野生型cbm相同。或者,一个或多个突变可单独(和/或独立)或集体(例如协同)调节(改善或遏制/抑制)一个或多个野生型cbm(例如衍生出修饰的cbm的野生型cbm)的生理学、生物学免疫学和/或药理学特性。特别是,一个或多个突变可:
120.(i)改变cbm的免疫原性(或抗原性);和/或
121.(ii)改变(例如提高)(cbm或包括修饰的cbm的任何多聚体分子的)功效和/或
122.(iii)它们可调节(例如改善)cbm的热稳定性;和/或
123.(iv)它们可调节(例如改善)cbm的溶解度;和/或
124.(v)它们可调节(例如改善)分子的体内半衰期。
[0125]“突变”可包括对野生型cbm分子的任何改变。例如,术语”突变”可囊括,例如:
[0126]
(i)一个或多个氨基酸置换(其中一个或多个野生型氨基酸被交换或改变为另一个(不同的)氨基酸
‑‑
术语“置换”将包括保守的氨基酸置换);和/或
[0127]
(ii)一个或多个氨基酸缺失(其中一个或多个野生型氨基酸残基被移除);和/或
[0128]
(iii)一个或多个氨基酸的添加/插入(其中在野生型(或参考)一级序列上添加另外的氨基酸残基);和/或
[0129]
(iv)一个或多个氨基酸/序列倒位(通常一级序列中两个或更多个连续的氨基酸被倒位);和/或
[0130]
(v)一个或多个氨基酸/序列重复(其中氨基酸或一级氨基酸序列的一部分(例如5-10个氨基酸的一段)重复)。
[0131]
因此,有用的修饰的cbm(即用于本文所述的医疗用途和方法的cbm)可包括本文所述的一个或多个突变。
[0132]
作为非限制性的实例,以下代表了可用于制造六聚体唾液酸结合分子的单个单元(称为“hex”单元),所述六聚体唾液酸结合分子在本文所述的各种组合物、药物、方法和用途中具有特殊的应用(例如用于治疗或预防肺部炎症性疾病的方法,所述肺部炎症性疾病包括肺炎和/或支气管炎)。在每种情况下,hex单元包括两个修饰的cbm(表示为cbm1和cbm2),这些修饰的cbm来自肺炎链球菌nana唾液酸酶(spcbm:cbm40家族成员)的唾液酸结合结构域。括号内标明了引入每个修饰的cbm的具体突变。应该注意的是,"
‑‑‑‑
"符号表示氨基酸接头(将一个cbm连接到另一个cbm或将cbm连接到寡聚化结构域)。因此,六聚体('hex')的唾液酸结合分子可以由几个(例如3个)hex单元组成。寡聚化结构域(表示为”td")将这些单元缀合在一起,成为三聚体。虽然任何给定的六聚体可包括上述单元(以及下文标题hex1单元、hex2单元、hex3单元、hex4单元、hex5单元、hex6单元和hex17单元)的相同副本但技术人员会理解,还有进一步的选择。例如,hex单元可以由两个cbm组成,每个cbm都具有不同的突变(突变是选自本文详述的选择的一个或多个)。
[0133]
(i)hex1单元
[0134]
cbm1(l170t v239a v246g i286a y292e)
‑‑‑‑‑
cbm2(l170t v239a v246g i286a y292e)
‑‑‑‑‑
td(s342d l348d r403k)
[0135]
(ii)hex2单元
[0136]
cbm1(v239a v246g i286a y292e)
‑‑‑‑
cbm2(v239a v246g i286a y292e)
‑‑‑‑
td(s342d r403k)
[0137]
(iii)hex3单元
[0138]
cbm1(v239a v246g i286a)
‑‑‑‑‑
cbm2(v239a v246g i286a)
‑‑‑‑‑
td(s342d r403k)
[0139]
(iv)hex4单元
[0140]
cbm1(v239a v246g)
‑‑‑‑‑
cbm2(v239a v246g)
‑‑‑‑‑
td(s342d)
[0141]
(v)hex5单元
[0142]
cbm1(v239a v246g)
‑‑‑‑‑
cbm2(v239a v246g)
‑‑‑‑‑
td(r403k)
[0143]
(vi)hex6单元
[0144]
cbm1(v239a v246g)
‑‑‑‑‑
cbm2(v239a v246g)
‑‑‑‑‑
td(s342d r403k)
[0145]
(vii)hex17单元
[0146]
cbm1(v239a v246g a162p)
‑‑‑‑‑
cbm2(v239a v246g a162p)
‑‑‑‑‑
td(s342d r403k)
[0147]
需要指出的是,hex6和hex17是相同的,除了另外的a162p突变。这种脯氨酸突变(在残基162处置换野生型的丙氨酸)已被证明改善热稳定性(单一cbm tm提高3-4℃)。关于使用脯氨酸突变的更多信息可以从fu 2009,'increasing protein stability by improving beta-turns'(doi10.1002/prot.22509)中得到,其描述了一般的方法。脯氨酸突变不影响(增加或减少)cbm分子的预测免疫原性,不位于其他突变、n端或c端或配体结合位点附近。相当意想不到的是,除了热稳定性的适度改善外,注意到a162p突变产生的六聚体cbm(即包含3
×
hex17单元的分子)在体内实验中表现出明显的改善,特别是与那些使用
包含3
×
hex6单元的六聚体分子进行的相同实验相比。例如,修饰的分子(特别是包含3
×
hex17单元的分子)表现出对促炎细胞因子(包括例如il-8)的调节作用。事实上,包含3
×
hex17单元的分子对il-8的产生的调节作用(特别是抑制作用)比其他测试的修饰的分子得到了改善。
[0148]
相对于sp2cbmtd(又名”sporig”seq id no:7)的氨基酸序列,hex6(seq id no:8)和hex17(seq id no:9)分子的氨基酸序列为:
[0149]
sporig
[0150]
gamviekedvetnasngqrvdlsseldklkklenatvhmefkpdakapafynlfsvssat
[0151]
hex6
[0152]
gamviekedvetnasngqrvdlsseldklkklenatvhmefkpdakapafynlfsvssat
[0153]
hex17
[0154]
gamviekedvetnasngqrvdlsseldklkklenatvhmefkpdpkapafynlfsvssat
[0155]
sporig
[0156]
kkdeyftmavynntatlegrgsdgkqfynnyndaplkvkpgqwnsvtftvekptaelpkg
[0157]
hex6
[0158]
kkdeyftmavynntatlegrgsdgkqfynnyndaplkvkpgqwnsvtftvekptaelpkg
[0159]
hex17
[0160]
kkdeyftmavynntatlegrgsdgkqfynnyndaplkvkpgqwnsvtftvekptaelpkg
[0161]
sporig
[0162]
rvrlyvngvlsrtslrsgnfikdmpdvthvqigatkranntvwgsnlqirnltvynralt
[0163]
hex6
[0164]
rarlyvngglsrtslrsgnfikdmpdvthvqigatkranntvwgsnlqirnltvynralt
[0165]
hex17
[0166]
rarlyvngglsrtslrsgnfikdmpdvthvqigatkranntvwgsnlqirnltvynralt
[0167]
sporig
[0168]
peevqkrsgggsgviekedvetnasngqrvdlsseldklkklenatvhmefkpdakapaf
[0169]
hex6
[0170]
peevqkrsgggsgviekedvetnasngqrvdlsseldklkklenatvhmefkpdakapaf
[0171]
hex17
[0172]
peevqkrsgggsgviekedvetnasngqrvdlsseldklkklenatvhmefkpdpkapaf
[0173]
sporig
[0174]
ynlfsvssatkkdeyftmavynntatlegrgsdgkqfynnyndaplkvkpgqwnsvtftv
[0175]
hex6
[0176]
ynlfsvssatkkdeyftmavynntatlegrgsdgkqfynnyndaplkvkpgqwnsvtftv
[0177]
hex17
[0178]
ynlfsvssatkkdeyftmavynntatlegrgsdgkqfynnyndaplkvkpgqwnsvtftv
[0179]
sporig
[0180]
ekptaelpkgrvrlyvngvlsrtslrsgnfikdmpdvthvqigatkranntvwgsnlqir
[0181]
hex6
[0182]
ekptaelpkgrarlyvngglsrtslrsgnfikdmpdvthvqigatkranntvwgsnlqir
[0183]
hex17
[0184]
ekptaelpkgrarlyvngglsrtslrsgnfikdmpdvthvqigatkranntvwgsnlqir
[0185]
sporig
[0186]
nltvynraltpeevqkrsggalgvpdfesdwfsvssnslytlshglqrsprrvvvefars
[0187]
hex6
[0188]
nltvynraltpeevqkrsggslgvpdfesdwfdvssnslytlshglqrsprrvvvefars
[0189]
hex17
[0190]
nltvynraltpeevqkrsggslgvpdfesdwfdvssnslytlshglqrsprrvvvefars
[0191]
sporig
[0192]
sspstwnivmpsyfndgghkgsgaqvevgslnirlgtgaavwgtgyfggidnsattrfat
[0193]
hex6
[0194]
sspstwnivmpsyfndgghkgsgaqvevgslniklgtgaavwgtgyfggidnsattrfat
[0195]
hex17
[0196]
sspstwnivmpsyfndgghkgsgaqvevgslniklgtgaavwgtgyfggidnsattrfat
[0197]
sporig gyyrvrawi
[0198]
hex6
ꢀꢀꢀ
gyyrvrawi
[0199]
hex17
ꢀꢀ
gyyrvrawi
[0200]
所公开的分子,包括用于所述组合物、药物和方法的分子,可使用基于pcr的克隆技术产生,例如connaris等人,2009(enhancing the receptor affinity of the sialic acid-binding domain of vibrio cholerae sialidase through multivalency;j.biol.chem;vol.284(11);pp 7339-7351)描述了产生这种类型的多价分子的合适方法。例如,多价cbm分子,包括hex17和/或hex17变体等,可被制备为包含通过氨基酸/肽接头连接的多个唾液酸结合分子(例如修饰的cbm)的构建体。
[0201]
如前所述,每个cbm(例如修饰的cbm)可以通过例如包含5、10或15个氨基酸的肽与另一个cbm连接。举例来说,以下肽的任何一种或多种可用于连接两个或更多个cbm(包括所述修饰的cbm)以产生多价cbm:
[0202]
(i)5个氨基酸接头:alxgs
[0203]
lqalg
[0204]
ggxsg
[0205]
ggalg
[0206]
ggggs
[0207]
(ii)10个氨基酸接头:alxgsgggsg
[0208]
lqalggggsl
[0209]
(iii)15个氨基酸接头:alxgsgggsggggsg
[0210]
其中“x”是任何氨基酸。
[0211]
因此,示例性的唾液酸结合分子(例如hex17单元)可以采取以下形式:
[0212][0213]
该示意图在下文中被称为通式1。
[0214]
因此,hex17单元可符合上述通式1,包括两个修饰的cbm(“修饰的cbm 1”和“修饰的cbm 2”)和三聚体化结构域td,其中肽接头a和/或b选自上面提出的接头选项(i)、(ii)和/或(iii)。
[0215]
应该注意的是,术语“hex17”不仅囊括上述完整的hex17序列,还包括由其衍生的功能性(例如,唾液酸结合和/或抗炎性)片段。事实上,通式1中所示的每个“修饰的cbm”单元都可以是上述的hex17单元。
[0216]
鉴于上述情况,用于本公开内容各方面的hex17分子包括三个通过三聚化结构域结合在一起的hex17单元。
[0217]
因此,本文所述的各种用途、组合物、使用的唾液酸结合分子、方法和药物可以利用唾液酸结合分子,所述唾液酸结合分子包括、由或基本上由选自由以下组成的组的唾液酸结合分子组成:
[0218]
(i)一个或多个修饰的cbm(s);
[0219]
(ii)功能性的hex17片段;
[0220]
(iii)唾液酸结合分子,包含与seq id no:9具有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%。至少85%,至少86%,至少87%,至少88%,至少89%,至少90%,至少91%,至少92%,至少93%,至少94%,至少95%,至少96%,至少97%,至少98%,至少99%同一性的序列;和
[0221]
(iv)hex17分子(即包含、由或基本上由seq id no:9组成的唾液酸结合分子)。
[0222]
为避免疑问,术语“hex17”包括具有对应于seq id no.9提供的序列,或与之表现出一定程度的序列同一性(例如,与seq id no:9具有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%。至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%的同一性)的唾液酸结合分子。具有显示与seq id no:9一定同一性水平的序列的唾液酸分子(该同一性水平选自上面公开的%同一性值)可被称为“hex17变体”。hex17变体可具有功能性,因为它们与唾液酸结合和/或具有抗炎性(即它们抑制某些促炎细胞因子的产生或表达)。
[0223]
因此,本公开内容提供了:
[0224]
hex17和/或hex17变体;
[0225]
用于治疗和/或预防肺部炎症性疾病、肺炎、毛细支气管炎和/或支气管炎。
[0226]
本公开内容还提供了hex17和/或hex17变体在制备用于治疗和/或预防肺部炎症性疾病、肺炎、毛细支气管炎和/或支气管炎的药物中的用途。
[0227]
本公开还涉及治疗或预防肺部炎症性疾病、肺炎、毛细支气管炎和/或支气管炎的
方法,所述方法包括以下步骤:向需要其的受试者施用治疗有效量的hex17和/或hex17变体。
[0228]
为完整起见,应注意vc2cbm包括、基本上由或由两个霍乱弧菌nanh唾液酸酶cbm单元连接、结合或缀合而成。示例性的vc2cbm序列可以包括、基本上由或由以下组成:
[0229]
gamalfdynatgdtefdspakqgwmqdntnngsgvltnadgmpawlvqgiggraqwtyslstnqhaq
[0230]
assfgwrmttemkvlsggmitnyyangtqrvlpiisldssgnlvvefegqtgrtvlatgtaateyhkfelvflpgsnpsasfyfdgklirdniqptaskqnmivwgngssntdgvaayrdikfeiqgdalngsmalfdynatgdtefdspakqgwmqdntnngsgvltnadgmpawlvqgiggraqwtyslstnqhaqassfgwrmttemkvlsggmitnyyangtqrvlpiisldssgnlvvefegqtgrtvlatgtaateyhkfelvflpgsnpsasfyfdgklirdniqptaskqnmivwgngssntdgvaayrdikfeiqgd
[0231]
此外,vc4cbm包括、基本上由或由四个霍乱弧菌nanh唾液酸酶cbm单元连接、结合或缀合在一起。示例性的vc4cbm序列可以包括、基本上由或由以下序列组成:
[0232]
gamalfdynatgdtefdspakqgwmqdntnngsgvltnadgmpawlvqgiggraqwtyslstnqhaqassfgwrmttemkvlsggmitnyyangtqrvlpiisldssgnlvvefegqtgrtvlatgtaateyhkfelvflpgsnpsasfyfdgklirdniqptaskqnmivwgngssntdgvaayrdikfeiqgdalngsmalfdynatgdtefdspakqgwmqdntnngsgvltnadgmpawlvqgiggraqwtyslstnqhaqassfgwrmttemkvlsggmitnyyangtqrvlpiisldssgnlvvefegqtgrtvlatgtaateyhkfelvflpgsnpsasfyfdgklirdniqptaskqnmivwgngssntdgvaayrdikfeiqgdlqalgmalfdynat
[0233]
gdtefdspakqgwmqdntnngsgvltnadgmpawlvqgiggraqwtyslstnqhaqassfgwrmttemkvlsggmitnyyangtqrvlpiisldssgnlvvefegqtgrtvlatgtaateyhkfelvflpgsnpsasfyfdgklirdniqptaskqnmivwgngssntdgvaayrdikfeiqgdggnsgmalfdynatgdtefd
[0234]
spakqgwmqdntnngsgvltnadgmpawlvqgiggraqwtyslstnqhaqassfgwrmttemkvlsggmitnyyangtqrvlpiisldssgnlvvefegqtgrtvlatgtaateyhkfelvflpgsnpsasfyfdgklirdniqptaskqnmivwgngssntdgvaayrdikfeiqgd
[0235]
另外,sp2cbm包括、基本上由或由两个肺炎链球菌nana唾液酸酶单元连接、结合或缀合在一起。示例性的sp2cbm序列可以包括、基本上由或由以下序列的两个拷贝组成:
[0236]
gsmviekedvetnasngqrvdlsseldklkklenatvhmefkpdakapafynlfsvssatkkdeyftmavynntatlegrgsdgkqfynnyndaplkvkpgqwnsvtftvekptaelpkgrvrlyvngvlsrtslrsgnfikdmpdvthvqigatkranntvwgsnlqirnltvynraltpeevqkrs
[0237]
上述序列的两个拷贝可以通过本文所述的任何一种肽接头序列连接。例如,sp2cbm序列可包括、基本上由或由以下组成:
[0238]
gsmviekedvetnasngqrvdlsseldklkklenatvhmefkpdakapafynlfsvssatkkdeyftmavynntatlegrgsdgkqfynnyndaplkvkpgqwnsvtftvekptaelpkgrvrlyvngvlsrtslrsgnfikdmpdvthvqigatkranntvwgsnlqirnltvynraltpeevqkrs[xxxxx][xxxxxxxxxx][xxxxxxxxxxxxxxx]gsmviekedvetnasngqrvdlsseldklkklenatvhmefkpdakapafynlfsvssatkkdeyftmavynntatlegrgsdgkqfynnyndaplkvkpgqwnsvtftvekptaelpkgrvrlyvngvlsrtslrsgnfikdmpdvthvqigatkranntvwgsnlqirnltvynraltpeevqkrs
[0239]
其中[xxxx]、[xxxxxxxxx]和[xxxxxxxxxx]
‑‑
代表下文所述的接头肽序列的选择。两个cbm序列将由本文所述的5、10或15个氨基酸的接头序列之一连接。
[0240]
vc2cbm和vc4cbm可被描述为基于编码霍乱弧菌的唾液酸酶的nanh基因的40家族唾液酸结合结构域(cbm)的串联重复的多价蛋白。sp2cbm可被描述为基于编码来自肺炎链球菌的唾液酸酶的nana基因的家族40唾液酸结合结构域(cbm)的串联重复的多价蛋白。
[0241]
此外,应该注意的是,本文所述的各种用途、方法和药物可以利用本文所述的一种或多种唾液酸结合分子。例如,包含hex17(即根据seq id no:9的序列)或hex17变体的唾液酸结合分子可与另一种唾液酸结合分子或和/或其他治疗性部分或佐剂一起、同时或单独施用至受试者。
[0242]
本公开内容提供了用于本文所述各种用途的组合物、药物组合物和方法。因此,本文所述的任何有用的唾液酸结合分子(例如hex17或hex17变体)可被配制以后续使用。例如,可将一个(或多个)唾液酸结合分子配制成治疗或药物组合物。各种组合物可包括一种或多种本文所述的唾液酸结合分子,任何给定的治疗可能需要(一起、同时或单独)施用这些组合物中的一种或多种。
[0243]
根据本发明的药物组合物,特别是那些用于粘膜或鼻内施用的制剂可按常规制备,包括习惯上用于制药的物质,以及例如remington的the sciences and practice of pharmacy,第22版(pharmaceutical press 2012)和/或handbook of pharmaceutical excipients,第7版(由rowe等人编纂,pharmaceutical press,2012)中描述的物质
‑‑
所有这些文件和参考文献的全部内容均通过引用纳入本文。
[0244]
可以使用任何合适量的唾液酸结合分子(例如本文所述的hex17分子)。例如,包含唾液酸结合分子(例如hex17)的组合物不管是静脉注射还是粘膜注射(例如鼻内注射),唾液酸结合分子的剂量可以包括约0.1μg和约1000μg之间的任何值。例如,可以使用剂量约为(例如 /-0.5μg)0.1μg、0.5μg、1μg、5μg、10μg、11μg、12μg、13μg、14μg、15μg、20μg、30μg、40μg、50μg、100μg、200μg、300μg、400μg、500μg、600μg、700μg、800μg、900μg或950μg的唾液酸结合分子。这些量可以在任何合适体积的赋形剂、稀释剂或缓冲液中提供。例如,可在约1μl至约5ml之间的赋形剂、稀释剂或缓冲液的任何点提供唾液酸结合分子的量。例如,所需量的唾液酸结合分子可与约5μl、10μl、15μl、20μl、25μl、30μl、35μl、40μl、45μl、50μl、55μl、60μl、65μl、70μl、75μl、80μl、85μl、90μl、95μl、100μl、200μl、300μl、400μl、500μl、600μl、700μl、800μl、900μl、1ml、2ml、3ml或4ml结合(或配制)。每毫升(赋形剂、稀释剂或缓冲液)0.1-1mg(唾液酸结合蛋白)的浓度可能是最有用的。
[0245]
本公开内容的组合物(例如,包含hex17或hex17变体的组合物)可在定期和/或预定的时间(预防性地)施用至受试者。例如,本文所述的组合物可在受试者进入或遇到他们可能易受和/或易患肺部炎症性疾病(例如,肺炎和/或支气管炎)的情况之前、期间和之后定期和/或预定的时间给药。可以每天和/或每隔几天施用本公开内容的组合物。本公开内容的组合物可在任何给定日内多次施用。所述组合物可在数周或数月或数年的时间内施用。准确的给药方案将取决于受试者、该受试者的健康状况以及该受试者被认为有患肺部炎症性疾病(如肺炎或支气管炎)的风险或易患肺部炎症性疾病的时间段。
[0246]
详细说明
[0247]
现在将参照以下附图对本发明进行详细描述,这些附图显示:
[0248]
图1:多价cbm形式的结构单元(building block)和它们对唾液酸的亲和力。a,vccbm,具有α-2,3-唾液乳糖的霍乱弧菌唾液酸酶的残基25-216(pdb:1w0p),画成球状。b,
spcbm,具有α-2,3-唾液乳糖的肺炎链球菌nana唾液酸酶的121-305个残基(pdb:4c1w)。c,td,三聚化结构域,呈彩虹色的铜绿假单胞菌假胺化酶残基333-438(pdb:2w38);其他两种单体为单一颜色。d,多价形式:它们的分子量、价位和对α2,3-唾液乳糖的结合亲和力,由表面等离子体共振(spr)在25℃下测定(vccbm、vc2cbm和vc3cbm的kd值以前已经报道过7)。串联重复的cbm,以及融合到td的寡聚化cbm是由5-氨基接头连接的。
[0249]
图2:propred对抗原肽的预测。a.spcbm序列。b.patd序列。预测的结合物用蓝色表示,每个结合区的第一个残基用红色表示。nordic biopharma(绿条)和proimmune(紫条)预测的抗原性肽显示在序列下。
[0250]
图3:野生型和突变型结构域的表达测试。泳道1,m12标准;泳道2,wtspcbm;泳道3-11,im15-im23;泳道12-15,im24-im27;泳道16,wt patd。a)全细胞提取物,b)可溶性提取物。
[0251]
图4:肽167-181在spcbm结构中的位置
[0252]
图5:im28至im34变体的表达和ni-nta沉降
[0253]
图6:hex17变体在六聚体结构上的位置。hex17的四元结构是通过将个体spcbm(pdb代码4c1x)和patd(pdb代码2w38)的晶体结构组装成六聚体(即每个分子有6拷贝的spcbm和3拷贝的patd)来建模的。结合的配体(α2,3-唾液乳糖)的位置以棒状显示(橙色)。突变的位点也被显示出来。蓝色,a162p突变的位点;青色,其他两个cbm突变的位点;洋红色,td突变的位点。
[0254]
图7:il-8刺激。通过添加10μg的生物制剂(hex17)刺激a549细胞。在24或48h的时间点收获细胞上清液,用elisa测定il-8含量。对照组和处理的细胞之间的统计学显著性用单因素方差分析和tukey多重比较试验来确定。
[0255]
图8:炎症介质的多重分析。通过添加10μg的生物制剂(sp2cbmtd(又名sporig)、hex6或hex17)刺激a549细胞。在6h、24或48h的时间点收获细胞上清液,用人类细胞因子12-plex测定法分析炎症介质。使用单因素方差分析(tukey's多重比较试验)确定对照和/或wt六聚体与六聚体变体之间的统计学显著性。
[0256]
图9:散点图示出对感染rsv-a2并用neumifil(hex17:100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)中的细胞总数的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的总细胞。每一列代表组的平均值,每条代表n=8只动物的平均值的标准误差(sem)。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。**p《0.01,***p《0.001。
[0257]
图10.散点图示出对感染rsv-a2并用neumifil(hex17:100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)中的嗜中性粒细胞数量的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的总细胞。每一列代表组的平均值,每条代表n=8只动物的平均值的标准误差(sem)。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。*p《0.05,**p《0.01。
[0258]
图11.散点图示出对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)中巨噬细胞数量的影响。各组代表运载体(pbs)对照组(第1组)、运载体(rsv-a2)对照组(第2组)和neumifil处理组,在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的总细胞。每一列代表组的平均值,每条代表n=8只动物的平均值的标准误差(sem)。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。
[0259]
图12.散点图示出对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)中的淋巴细胞数量的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的总细胞。每一列代表组的平均值,每条代表n=8只动物的平均值的标准误差(sem)。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。*p《0.05,****p《0.0001。
[0260]
图13.散点图示出了对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)上清液中ip-10浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。****p《0.0001.
[0261]
图14.散点图示出对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)上清液中kc浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。****p《0.0001.
[0262]
图15.散点图示出对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)上清液中il-6浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。****p《0.0001.
[0263]
图16.散点图示出对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)上清液中il-12浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。
每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。*p《0.05,****p《0.0001。
[0264]
图17.散点图示出对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)上清液中干扰素-γ浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。*p《0.05,**p《0.01,****p《0.0001。
[0265]
图18.散点图示出对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)上清液中il-1β浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。*p《0.05,***p《0.001,****p《0.0001。
[0266]
图19.散点图示出对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)上清液中il-1α浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。**p《0.01,****p《0.0001。
[0267]
图20.散点图示出了对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)上清液中tnfα浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。**p《0.01,***p《0.001,****p《0.0001。
[0268]
图21.散点图示出了对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)上清液中mip-1α浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。**p《0.01,***p《0.001,****p《0.0001。
[0269]
图22.散点图示出对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气
管肺泡灌洗液(balf)上清液中rantes浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体治疗的rsv感染动物进行比较。***p《0.001.
[0270]
图23.散点图示出对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)上清液中mip-2浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。**p《0.01,***p《0.001,****p《0.0001。
[0271]
图24.散点图示出对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)上清液中mcp-1浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。****p《0.0001。
[0272]
图25.散点图示出对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)上清液中g-csf浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体治疗的rsv感染动物进行比较。***p《0.001,****p《0.0001。
[0273]
图26.散点图示出对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)上清液中il-2浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。****p《0.0001。
[0274]
图27.散点图示出对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)上清液中vegf浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8
只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。**p《0.01,***p《0.001,****p《0.0001。
[0275]
图28.散点图示出对感染rsv-a2并用neumifil(100μg,静脉注射)处理的小鼠支气管肺泡灌洗液(balf)上清液中gm-csf浓度的影响。各组代表运载体(pbs)对照组(第1组),运载体(rsv-a2)对照组(第2组),以及neumifil处理组在感染前1小时(第3组);感染前3天、1天和1小时(第4组);感染前1小时、感染后1天和3天(第5组);感染后1天和3天(第6组)给药。每个符号代表每组和每行的每只个体动物的浓度。每一列代表组的平均值,每条代表n=8只动物的sem。用dunnett单因素方差分析法将各处理组的变化与用运载体处理的rsv感染动物进行比较。*p《0.05,***p《0.001,****p《0.0001.
[0276]
方法和结果
[0277]
实施例1
[0278]
sp2cbmtd:免疫原性区域预测
[0279]
nordic biopharma的计算机筛选
[0280]
计算机t细胞表位筛选确定了四个重要的和两个边缘的免疫原性集群。
[0281]
显著的:
[0282][0283]
边缘:
[0284][0285]
proimmune人类供体t细胞增殖测定
[0286]
proimmune研究强调了两个高抗原性区域和两个中等抗原性区域:
[0287]
高抗原性:
[0288][0289]
中等抗原性:
[0290][0291]
propred计算机分析
[0292]
还使用了另一个计算机工具,在线propred服务器4。propred服务器的输出显示在图2中。nordic biopharma/proimmune表位的相对位置也被突出显示,表明三种方法之间有合理的一致性。除了上面列出的表位外,propred还强烈预测了spcbm结构域中的另一个免疫原性表位。
[0293]
结构域
ꢀꢀ
残基范围
ꢀꢀ
序列
[0294]
spcbm
ꢀꢀ
286至294
ꢀꢀ
irnltvynr
[0295]
单个cbm和td结构域的突变
[0296]
为了指导设计可能降低免疫原性的突变,propred被用来测试将这些多肽中的每个残基改变为每个替代残基的效果。注意到那些在预测的等位基因结合数量上有最大的减少。由于spcbm和td结构域两者的晶体结构是已知的,这些突变也被建模以减少引入明显破坏蛋白质结构的突变的可能性。
[0297]
最初,在spcbm中引入了9个单突变,在patd中引入了4个单突变,并列在下面("im”是免疫原性突变体的简称):
[0298][0299]
备注:im1至im14(未示出)是在proimmune数据可用之前,通过诱变引入非密码子优化背景。
[0300]
wt和突变的构建体的合成
[0301]
编码wt spcbm、wt patd和im15至im27变体的基因针对大肠杆菌表达进行密码子优化并由geneart合成。然后在内部将这些基因克隆到phistev载体上,作为6his标记的蛋白质进行表达。
[0302]
表达和生物物理学表征
[0303]
进行了初步的表达测试以评估溶解度。结果显示,所有均表达,但不是所有都可溶(图3)。注意:溶解度(或缺乏溶解度)不一定是实用性的预测因素。技术人员会理解,在制造或生产蛋白质时,某些过程需要使用不溶性材料,因为这很容易被提纯(从包涵体等)。然后,下游方案可以重新工程化蛋白质,以调节诸如溶解度等特征。
[0304]
表达试验的结果表明:
[0305]
·
im16(l170a)不溶于水或溶解性很差
[0306]
·
im25(td,s345d)是不溶性的
[0307]
·
im15(y168w)和im17(l170t)的溶解度降低
[0308]
·
im18(v173g)和im22(i286a)略有降低。
[0309]
·
其余的显示可溶性表达。
[0310]
13个可溶性蛋白在大肠杆菌中表达,并通过固定化金属亲和色谱(imac)进行纯化,然后用tev消化去除6his标签,然后进行反向imac和尺寸排阻色谱(sec)。
[0311]
10个纯化的结构域(wtsp、im19、im20、im21、im22、im23、wttd、im24、im26和im27)通过以下方法被进一步表征:
[0312]
(i)用热氟法(thermofluor)测量熔化温度(tm)
[0313]
(ii)近紫外圆二色法(cd)将三级结构与wt进行比较
[0314]
(iii)动态光散射(dls)以检查溶液中的寡聚状态
[0315]
(iv)表面等离子体共振(spr)来测量与唾液乳糖的结合亲和力
[0316]
(v)测量il-8细胞因子的刺激情况
[0317]
结果总结于表1。
[0318][0319][0320]
表1.wt结构域和其变体的生物物理特征的定性总结。颜色编码从绿色到红色(包括绿色'、橙色和黄色),其中绿色表示变体在该特定特征上与wt对应体非常相似,淡绿色
(绿色')或黄色表示差异程度增加。红色或橙色表示显著差异。n/a:由于蛋白质的溶解度/纯度差,没有进行这些表征。n/d:未确定。
[0321]
sp肽167-181:
[0322]
im15、im16、im17、im18都是不溶或难溶的(如前所述,这不一定影响蛋白质的效用)。这些都在“中度”抗原性区域167-181(fynlfsvssatkkde)。这个区域显然对变化非常敏感。
[0323]
早先的结果显示,与l170(和i286)相邻的m156f使tm增加~4℃。
[0324]
因此,这可以与l170t相结合。m156f并不增加预测的免疫原性。
[0325]
m185i使tm增加5℃,并与l170平行(图4)。这个突变也可以包括在内。注意,与m156f一样,m185i没有增加预测的免疫原性,但略微减少了预测的等位基因结合剂的数量。
[0326]
sp肽236-250:
[0327]
im19、im20、im21都与wt表现类似。这些都是在“高”抗原性区域236-250(kgrvrlyvngvlsrt)。
[0328]
选择im19(v239a)而不是苏氨酸突变(im20,v239t)。预测的免疫原性没有区别,但im19与wt的thermofluor tm和近紫外光谱更匹配。这将与im21(v246g)相结合。
[0329]
sp肽286-294:
[0330]
im22(i286a)与wt大致相似,而im23(y292e)似乎表现出降低的配体亲和力。这个区域,286-294irnltvynr,没有被proimmune标记出来,但被propred强烈预测为免疫原性。
[0331]
有一些迹象表明im22的tm比wt低。这个残基与m156相邻,所以如果包括m156f,可能会表现不同。
[0332]
td肽338-352:
[0333]
im24(s342d)和im26(l348d)显示出与wt三聚化结构域相似的特征,但im26的tm有一些降低的迹象。这些都是在“中度”抗原区域338-352sdwfsvssnslytls。预测wt序列结合9个等位基因,而im24预测为2个等位基因,im24/im26双突变体预测为1个等位基因。
[0334]
td肽392-406:
[0335]
im27(r403k)与wt相似。它是“高度”抗原性区域392-406gaqvevgslnirlgt的一部分。当这个突变被引入时,预测的等位基因从21个减少到3个。
[0336]
多突变组合im28-34的合成
[0337]
引入了以下突变:
[0338]
i)m156f/l170t
[0339]
ii)m156f/l170t/m185i:在propred中,预测该区域的等位基因从wt的31个减少到该组合的19个。
[0340]
iii)v239a/v246g:在propred中,该区域的等位基因从44个减少到3个。
[0341]
iv)i286a/y292e:在propred中,等位基因从41个减少到1个。
[0342]
v)v239a/v246g/i286a/y292e结合了前面两个双倍体。
[0343]
vi)m156f/l170t/m185i/v239a/v246g/i286a/y292e结合了所有的sp突变。
[0344]
vii)td:s342d/l348d/r403k:预测的td肽338-352的等位基因从9个减少到1个,肽td肽392-406的等位基因从21个减少到3个。这个三突变体结合了所有的td突变体。它们都是表面暴露的,而且是在td的n端远端,所以预计不会干扰六聚体形式的spcbm。
[0345]
这些构建体被命名为im28至im34。
[0346][0347][0348]
2.5 im28-im34的表达和生物物理学表征
[0349]
与单突变一样,im28到im34的组合由geneart合成,并亚克隆到phistev中进行表达分析。还对his标记的可溶性提取物进行了镍珠沉降(pull-down)(图5)。
[0350]
六聚体形式
[0351]
六聚体构建体hex1至he17的设计
[0352]
编码六聚体形式的基因(称为hex1至he17)是由geneart合成的。
[0353]
sp2cbmtd
[0354][0355]
六聚体形式分两部分合成,以避免与合成串联cbm拷贝中的重复序列有关的问题。第一基因覆盖第一cbm,第二部分涵盖第二cbm加td。然后,然后这些基因同时克隆到phistev中,以形成表达时三聚化的sp2cbmtd构建体。
[0356]
第一六聚体,hex1,含有cbm中的l170t/v239a/v246g/i286a/y292e和td中的s342d/l348d/r403k突变。
[0357]
个体结构域的溶解度数据表明,hex1不可能是可溶性的(同样,不一定反映了该分子的效用);合成了另外的构建体,hex3。注意,hex2含有与hex3相同的突变,但增加了y292e。
[0358]
合成了hex3并将其亚克隆到phistev载体上。在所有测试条件下(改变温度、iptg浓度、诱导时的细胞密度、有无热休克),表达都是不溶性的。含有同样三个突变(v239a v246g i286a)的仅-cbm结构域是可溶的。双突变体(v239a v246g)的表现与wt非常相似。因此,设计了进一步的变体(hex4、hex5和hex6)并通过pcr/连接构建,这些变体排除了i286a,并含有td突变中的一个或两个。
[0359]
在研究hex6的过程中,还设计了一些含有hex6突变的不同组合的其他版本(编号为hex7至hex16;未表征)。
[0360]
hex17含有hex6的突变和额外的a162p突变。这个脯氨酸突变已被证明可使单个cbm的tm增加3-4℃。脯氨酸突变不在其他突变、n-端或c-端或配体结合位点附近。
[0361]
六聚体变体的表征
[0362]
表2中示出了表达、纯化和表征的结果。基于这些结果,hex6和hex17被向前推进。hex17突变体在六聚体上的位置在图6中示出。
[0363]
表2
[0364][0365][0366]
表2.六聚体sp2cbmtd变体的生物物理特征的定性总结。颜色编码从绿色到红色,其中绿色表示该变体在该特定特征上与wt对应体非常相似,淡绿色(绿色')或黄色表示差异程度增加。红色或橙色表示显著差异。n/a:由于蛋白质的溶解度/纯度差,没有进行这些表征。n/d:未确定。
[0367]
实施例2:炎症介质。
[0368]
目的:通过分析随着时间变化的炎症介质的水平,测量经mcbm处理的人肺上皮细
胞(a549)的先天免疫应答。
[0369]
向哺乳动物细胞施用sp2cbmtd,在体外和体内都刺激促炎症应答
1,2
。为了确定这一点是否仍可通过修饰的六聚唾液酸结合分子观察到,通过添加10μg的生物制剂(sp2cbmtd(又名sporig)、hex6(即包含3
×
hex6单元的唾液酸结合分子)或hex17(即包含3
×
hex17单元的唾液酸结合分子)来刺激哺乳动物a549细胞,在施用后的特定时间点收获细胞培养液。炎症介质的浓度通过elisa和多重测定进行测量。
[0370]
人类il-8(研究的基准细胞因子)应答使用人类1
×
小鼠cxcl1/kc定量分析elisa试剂盒(r&d biosystems)。来自受刺激的a549细胞的il-8浓度水平在图7中示出。很明显,当a549细胞受到修饰的六聚体hex17的刺激时,il-8水平显著低于sp2cbmtd(又名sporig)刺激的细胞。
[0371]
使用人类细胞因子12-plex测定(bio-plex pro
tm
,bio-rad)进行炎症介质应答。图8展示了sp2cbmtd(wt,又名sporig)、hex6和hex17(变体)在特定时间点(6h、24h、48h)刺激a549细胞后,对培养液中12种炎症介质的分析。在分析之前,样品被解冻并在pbs中1:4稀释,然后使用人类hs cytokine-12plex测定(r&d systems)。数据表明:
[0372]
·
与sporig和hex6相比,hex17影响了几乎所有测试的细胞因子的水平。与sporig和hex6相比,在48小时,分析物il-6、il-8、gm-csf和ifn-γ的观察浓度(pg/ml)有显著下降。
[0373]
·
当在48小时与对照组相比时,hex17似乎导致所有测试的细胞因子水平的增加,但il-5和vegf除外(尚待确认)。
[0374]
·
与sporig相比,hex6在48h时仅显示减少的il-6刺激。
[0375]
实施例3
[0376]
·
本研究的目的是评估hex17(又名“neumifil”)对小鼠感染后第4天的rsv病毒复制、细胞积累和生物标志物的影响。
[0377]
·
小鼠在rsv-a2感染前的第3天、第1天和1小时,或在rsv-a2感染前的1小时接受运载体或neumifil(100μg,静脉注射)的预防处理,在rsv-a2感染后的第1天和第3天接受治疗性处理,或在rsv-a2感染前1小时和感染后第1天和第3天接受预防性和治疗性的联合方案。
[0378]
·
与pbs感染的动物相比,在感染后4天,经运载体处理的感染rsv-a2的小鼠显示出肺部病毒载量的显著增加。这伴随着显著的肺部炎症,表现为支气管肺泡灌洗液(balf)中的细胞数量增加,特别是中性粒细胞和淋巴细胞。在balf液中,促炎症细胞因子也显著升高。
[0379]
·
用neumifil处理感染rsv-a2的小鼠产生明显的保护作用,表现为肺组织病毒载量减少,炎症细胞流入和balf中细胞因子浓度降低。这在接受预防性用药方案的动物中特别明显,其中感染前第3天、第1天和1小时接受用药的动物提供了最大的保护。
[0380]
·
这项研究的数据表明,neumifil对治疗rsv-a2感染具有可能的保护性和治疗性作用。
[0381]
测试运载体
[0382]
由pneumagen提供。数量:10
×
1ml等分的磷酸盐缓冲盐水(10x),用milliq水,ph 7.2稀释至1x。制造商:life technologies。产品编号:70013-016。储存:室温或20℃
[0383]
测试剂(hex17:neumifil)
[0384]
由pneumagen提供(批号:20190410a;证书号:pgn0030/290419)。数量:11
×
100μl等分的蛋白质,浓度为10mg/ml,储存:-20℃。
[0385]
rsv感染
[0386]
对未进食的小鼠(雌性balb/c,17-20g)进行称重,用永久性记号笔在尾巴上单独标识,然后在异氟烷(5%在o2中)麻醉下用rsv或病毒稀释液(dmem,2%v/v fcs,12.5%w/v蔗糖)进行鼻内感染。将a2株rsv(50μl,5
×
106pfu)以滴注的方式灌入每个鼻孔,两者交替进行,直到递送了50μl的体积。在研究开始时,对a2株rsv进行反滴定以确定病毒的活力。
[0387]
测试剂的配制
[0388]
在整个试验过程中,测试运载体和测试剂的配制详见下文。
[0389]
对于测试运载体(pbs)的制备:
[0390]
在用药的每一天,用无内毒素的水将测试运载体的等份量(1ml小瓶)从10倍稀释到1倍,体积为10ml。然后用1倍的pbs来稀释neumifil,同时也用于给运载体对照组用药。
[0391]
对于测试剂(neumifil)的制备:
[0392]
在用药的每一天,解冻等份量的neumifil(每瓶100μl,10mg/ml),并转移到新的无菌0.5ml eppendorf管中,并在13,000rpm下离心5min。将上清液转移到新的无菌1.5ml eppendorf管中,用1
×
pbs稀释到400μl的体积,配制成2.5mg/ml的浓度(相当于100μg/40μl)。neumifil管被清楚地标记,并室温保存。在用药前,用吸管轻轻混合制剂内容物,避免产生气泡。
[0393]
每组和每一天的用药都使用新的neumifil小瓶或运载体。剩余的制剂(包括稀释的和未稀释的neumifil)储存在-20℃,并在研究结束后运回pneumagen。
[0394]
剂量
[0395]
测试剂(neumifil)或运载体(pbs)在感染前3天或感染前1小时或感染后1天作为第一剂量进行鼻内施用(40μl)(详见以下剂量表)。运载体对照组(第1组)和仅有病毒对照组(第2组)均在感染前1小时给予第一剂40μl pbs(运载体)。
[0396]
处理组用药
[0397][0398]
临床评价
[0399]
从第-3天开始,每天记录每只动物的临床症状一次,包括细节立毛、呼吸、活动、体位、眼/鼻分泌物、身体状况和共济失调。这些变量按以下严重程度进行评分:
[0400]
0.-正常
[0401]
1.-轻度
[0402]
2.
–
吃力的
[0403]
3.-严重(宰杀点)。
[0404]
从第-3天开始,还记录了每只动物的每日体重测量。
[0405]
将出现两个或更多个相当于方案严重程度限制的任何限制性临床症状的动物(根据内政部指南)从研究中移除,并在机构中以方案1的方法(颈椎脱位)进行宰杀。如果动物达到了前两种症状中的任何一种或两种,同时有或没有任何其他症状,则从研究中被移除,并在机构中以方案1的方法进行宰杀。
[0406]
体重下降超过最高测量个体体重的20%。
[0407]
·
食物和水的消耗量3天低于正常值的40%,或厌食(食欲不振72小时)。
[0408]
·
明显的立毛,并伴有其他脱水的迹象,如皮肤隆起。
[0409]
·
对活动和挑衅没有反应。
[0410]
·
持续弓背(冻结)。
[0411]
·
烦躁-持续发声。
[0412]
·
眼鼻排出物持续且多。
[0413]
·
呼吸吃力。
[0414]
·
持续的震颤。
[0415]
·
持续的抽搐。
[0416]
在这项研究中,没有动物因为福利问题而被移出研究。
[0417]
样品采集
[0418]
感染4天后,所有的动物都用戊巴比妥过量腹腔注射,并通过静脉穿刺收集血样到eppendorf管(0.5ml)。每个样品被轻轻地混合并在室温下保持30min以使其凝固,然后离心(1500rpm,4℃下10min)以制备血清。每个样品的2个等分试样(50μl)保存在-80℃。收集血样后,立即通过颈部中线切口和分离肌肉层来分离气管。在气管上做一小切口,插入塑料插管,并用缝线固定。然后用1ml磷酸盐缓冲盐水冲刷肺部,对气道进行灌洗。然后重复这一程序,直到回收的体积为1.6ml。然后将分离的balf在4℃下以1500rpm离心10min,在-80℃下抽出上清液(400μl)用于未来的细胞因子分析。然后将细胞颗粒重新悬浮在0.8ml的0.2%w/v nacl中,以诱导任何红细胞溶血。用相同体积的1.6%w/v nacl进行等张化(isotonization)后,分析bal细胞的总数和差异数。
[0419]
使用xt-2000iv分析仪(sysmex)测量bal流体样品的总细胞数和差异细胞数。结果以细胞/ml(总数和差异数)表示。差异化分类的细胞类型将是中性粒细胞、嗜酸性细胞或单核细胞(巨噬细胞和淋巴细胞)。
[0420]
肺组织去除
[0421]
采集balf后,从每只动物身上取下并分离左、右肺叶,在冰冷的dulbecco改良的eagles培养基(含有1%w/v bsa和25%w/v蔗糖的dmem)中匀浆2
×
20秒破裂,体积为
×
10克-肺重(如果0.11g,使用1.1ml)。将匀浆转移到无菌管中,在4℃下以2000rpm旋转5分钟。然后将澄清的匀浆转移到冷冻的冷冻瓶中,在液氮中快速冷冻并储存在-80℃。
[0422]
斑块测定
[0423]
感染前,hep2细胞在含有10%v/v fbs的dmem中在24孔板中生长,直到它们达到100%汇合度。将肺部匀浆在室温下解冻,在无血清的dmem中制备10倍的连续稀释液。吸出hep2细胞的生长培养基,用300μl系列稀释的肺部匀浆(连同储备液rsv仅阳性对照)替换,并在37℃/5%co2下感染4小时。然后吸出感染性的培养基,用500μl plaque assay overlay(mem中1%w/v甲基纤维素,2%v/v fbs,1%w/v青霉素/链霉素,0.5μg/ml两性霉素b)替换,并在37℃/5%co2下放置7天。用冰冷的甲醇固定细胞10分钟,然后用无菌pbs清洗两次。将抗rsv f-蛋白抗体[2f7]在封闭缓冲液(在0.05%v/v pbs-tween 20中5%w/v奶粉(marvel))中稀释到1:150的浓度,在室温摇动下将150μl加入细胞中2小时。用pbs清洗细胞2次,然后将150μl在封闭缓冲液中1:400稀释的二抗(山羊抗小鼠/hrp缀合物)加入细胞中,在室温下摇动1小时。移除二抗溶液,用pbs清洗细胞两次,然后用超纯水制备金属增强显影底物dab(根据制造商的说明)。每个孔接受150μl的显影底物,直到斑块可见。用眼睛计数斑块,并用光学显微镜确认,从而计算出每毫升的斑块形成单位。
[0424]
生物标志物分析
[0425]
根据制造商的说明,使用磁性多重检测法一式两份测量balf上清液的细胞因子水平(见下文评估的细胞因子的细节)。使用magpix系统(luminex公司)测量水平。
[0426]
数据以细胞因子(pg/ml),平均值
±
s.e.m.(平均值的标准误差)报告。
[0427][0428][0429]
数据分析
[0430]
数据以每毫升balf的细胞总数和差异数、细胞因子浓度(pg/ml)或每个处理组的斑块形成单位(pfu),
±
(平均值的标准误差)来报告。
[0431]
组间差异通过单因素方差分析(anova)进行统计分析。在不同水平的处理之间的平均值有显著差异的情况下,与运载体组的比较将使用dunnett检验进行。在等方差检验失败的情况下,将提出对等级进行kruskal-wallis单因素方差分析,然后再进行dunn检验。p《
0.05被认为具有统计学显著性。
[0432]
结论
[0433]
用neumifil(hex17)对rsv-a2感染的小鼠进行预防性处理,可产生显著的保护作用,证据是肺部组织的病毒载量减少。在感染前第3天、第1天和1小时接受三剂neumifil方案的小鼠中,可以看到强烈的效果。此外,在感染前1小时接受单一预防剂量的小鼠,示出统计学显著的病毒载量减少。没有接受预防性处理而只是在感染后处理的小鼠也显示出肺组织病毒载量统计学显著性的减少,尽管比接受预防性处理的小鼠少。
[0434]
小鼠的rsv-a2感染导致了强烈的免疫应答,证据是bal液细胞计数(总细胞数、中性粒细胞和淋巴细胞)和bal液中测得的细胞因子的变化。用neumifil处理的小鼠组在一些免疫参数上显示出统计学显著的改善;这些结果与观察到的肺组织病毒载量的减少相关性良好。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。