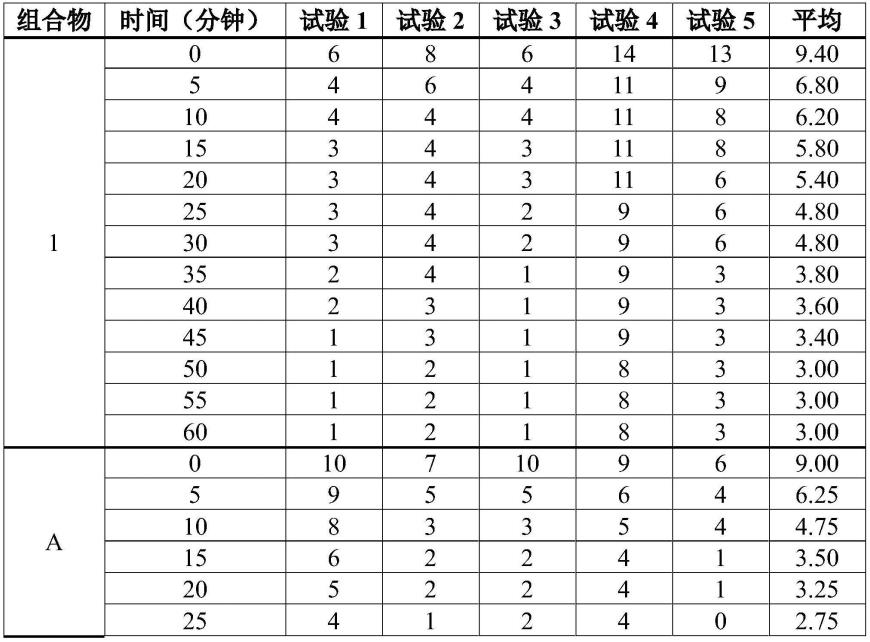
药物及sirna共递送纳米复合物及其制备方法与应用
技术领域
1.本发明属于生物材料和医学技术领域,尤其是指药物及sirna共递送纳米复合物及其制备方法与应用。
背景技术:
2.近年来,急性心肌梗死的发病率逐渐上升,由于其高死亡率而受到广泛的关注。再灌注是心肌梗死后抢救心肌的一个重要策略。然而,再灌注同时会导致二次损伤,即心肌缺血再灌注损伤(miri),这主要是由自由基损伤和炎症引起的。在这些过程中,中性粒细胞是miri病理生理学的一个关键因素。中性粒细胞首先在外周循环中被激活,然后穿过血管壁渗透到缺血的心肌中。被招募的中性粒细胞产生大量的活性氧(ros)和促炎因子,从而导致炎症连锁反应和心肌损伤。此外,这些中性粒细胞释放的促炎因子会不断招募循环中的中性粒细胞,形成一个积极的自我放大循环。因此,干预中性粒细胞对缺血心肌的招募是治疗miri的一个重要手段。
3.中性粒细胞被招募到受伤的心肌可以分为两个过程,迁移到发炎的血管,然后是粘附和转徙。中性粒细胞的激活和向发炎血管的迁移主要是由促症因子,特别是肿瘤坏死因子-α(tnf-α)介导的。临床上,地塞米松(dxm)是一种常用的抗炎药物,它通过抑制上游转录因子nf-κb从而抑制促炎因子如tnf-α的产生。中性粒细胞迁移到发炎的血管后,依靠内皮细胞粘附分子(cams)来粘附和转入间质。血管细胞粘附分子-1(vcam-1)是负责中性粒细胞粘附的重要分子,下调vcam-1的表达可以抑制中性粒细胞被招募到缺血心肌。虽然缺乏vcam-1的小分子抑制剂,但小干扰rna(sirna)介导的rna干扰(rnai)提供了一种有效的方式,通过信使rna(mrna)的序列特异性降解使vcam-1沉默。因此,假设dxm与vcam-1sirna(sivcam-1)共同递送可以同时抑制中性粒细胞的迁移和粘附,这将对中性粒细胞的招募产生合作效应,并加强对miri的抗炎功效。
4.由纳米粒子核心和表面装饰的阳离子聚合物组成的混合纳米复合物(ncs)经常被用来共同传递化学药物和sirna。其中,经fda批准的聚(乳酸-甘醇酸)(plga)纳米颗粒(nps)由于其理想的生物相容性和可降解性而被广泛用于药物的装载。在外层,通常需要具有高分子量(mw)的阳离子聚合物,使得sirna被有效凝结和递送至细胞内。然而,与sirna的强结合力将延缓其在细胞内释放,阻碍有效的基因沉默,这对sirna的传递构成了关键的挑战。另外,多聚物通常显示出mw依赖性的长期细胞毒性。为了弥补这些缺陷,人们广泛开发了能够在细胞内降解的触发反应型阳离子聚合物,其中ros可降解阳离子聚合物是介导有效的sirna传递到ros过度分泌的炎症细胞的理想候选物质。虽然已经报道了各种ros可降解多聚物,但它们的ros敏感性往往不够。例如,浓度为1~10mm的h2o2需要降解联硒交联的聚乙烯亚胺(pei)或二硫交联的pei,远高于病变细胞中的实际浓度(50~200μm)。除了sirna凝结/释放的困境,基于阳离子聚合物的带正电的ncs在血液循环中往往稳定性差,导致ncs被网状内皮细胞清除。因此,能够在炎症细胞的病理ros浓度下释放sirna的疾病细胞靶向性、血清稳定的ncs是非常理想的。
技术实现要素:
5.为解决上述技术问题,本发明提供了药物及sirna共递送纳米复合物及其制备方法与应用。其中纳米复合物能有效抑制中性粒细胞的浸润,同时能够抑制促炎因子的高表达,在全身施用后具备长时间的血液循环,在促炎因子高表达和中性粒细胞过度浸润相关疾病(尤其是炎性疾病)的临床治疗中具有极大的潜力。
6.本发明的第一个目的在于提供一种纳米复合物,包括载药的纳米核与包被所述纳米核的阳离子聚合物,以及sirna(小干扰rna);所述载药的纳米核呈负电,吸附正电的阳离子聚合物,然后吸附带负电荷的sirna。
7.其中,所述纳米核选自聚合物纳米颗粒和/或无机纳米颗粒;
8.在本发明的一个实施例中,所述纳米核的粒径为50-200nm。
9.在本发明的一个实施例中,纳米核载药中的药为抗炎药。
10.在本发明的一个实施例中,所述抗炎药为地塞米松、甲泼尼松、倍他米松、氢化可的松、丙酸倍率米松、阿司匹林、对乙酰氨基酚、吲哚美辛、双氯芬酸、布洛芬或塞来昔布。
11.在本发明的一个实施例中,所述阳离子聚合物选自含有敏感键如偶氮苯键、缩硫酮键、二硫键、联硒键、联碲键等的阳离子聚合物。
12.在本发明的一个实施例中,所述sirna为vcam-1sirna、icam-1sirna、icam-2sirna、p-selectin sirna和e-selectin sirna中的一种或多种。
13.在本发明的一个实施例中,所述vcam-1sirna序列选自表中之一:
14.sense(5
’‑3’
)(正义链)anti-sense(5
’‑3’
)(反义链)aaacaguauccaaaguaccgugguacuuuggauacuguuugcucucgauuuuaaaagcuugagcaagcuuuuaaaaucgagaucauuuaguggacugucuaucuggauagacaguccacuaaauggucaauuggguaaacaucaggacugauguuuacccaauugacaugucaauuggguaaacaucaggauguuuacccaauugacagaaaaauccuguuucuucaugagcaugaagaaacaggauuuuguuacaaaauccuguuucuucaugaagaaacaggauuuuguagaucaauauccucaaugacaggacugucauugaggauauugaaaauuuagcucggcaaacaagagcuuguuugccgagcuaaauuaucaauguauaauuuagcucgggagcuaaauuauacauugaccuuucuuugggaauagaaucaggauucuauucccaaagaaagguccauuaucuaauuucuugcucaagaaauuagauaauggaguauagauuccagaaucuuccauggaagauucuggaaucuauguuaaaugguuucucuugaacaaguucaagagaaaccauuuacuauugucuucuccaguuuccuuggaaacuggagaagacaauccuuaaaaauuuauucaacagugcuguugaauaaauuuuuaagguaauuccacuucuguuuuguccaaaacagaaguggaauuaau
15.在本发明的一个实施例中,所述vcam-1sirna sense(正义链):cug cag ccu cuu ucu caa adtdt,vcam-1sirna antisense(反义链):uuu gag aaa gag gcu gca gdtdt。
16.在本发明的一个实施例中,所述纳米复合物形态为球形、立方体、圆锥形、圆柱形、
棱柱形、棱锥形、或其它规则或不规则的形状,所述纳米复合物的粒径范围为1nm~10μm;进一步的,粒径范围为10nm~5μm;进一步的,粒径范围为500nm~1μm。
17.在本发明的一个实施例中,所述聚合物纳米颗粒中聚合物选自聚乳酸-羟基乙酸共聚物(plga)、聚乳酸(pla)、聚乙醇酸(pga)、聚己酸内酯(pcl)、聚赖氨酸、聚谷氨酸、聚氰基丙烯酸正丁酯(pbca)、壳聚糖和明胶中的一种或多种。
18.在本发明的一个实施例中,所述聚合物纳米颗粒中聚合物选自聚乳酸-羟基乙酸共聚物(plga)、聚乳酸(pla)、聚乙醇酸(pga)或聚己酸内酯(pcl)中的一种或多种。
19.在本发明的一个实施例中,所述无机纳米颗粒选自由金、硅、铁和铜中任一种物质制备得到的纳米颗粒。
20.在本发明的一个实施例中,所述纳米核带负电。
21.在本发明的一个实施例中,所述载药的纳米核通过以下方法制备得到:纳米沉淀法、乳化溶剂挥发法、离子凝胶法、直接溶解法、透析法、乳化法、介质研磨法、高压均质法、超临界流体法、类乳化溶剂扩散法或固态反相胶束溶液法。
22.在本发明的一个实施例中,所述阳离子聚合物选自含有敏感键如偶氮苯键、缩硫酮键、二硫键、联硒键、联碲键等的阳离子聚合物的一种或多种。
23.在本发明的一个实施例中,所述阳离子聚合物选自壳聚糖、β-环糊精、聚β-氨基糖胺、右旋糖苷、聚乙烯亚胺、聚多肽、聚甲基丙烯酸酯、聚l-赖氨酸和聚酰胺胺中的一种或多种。
24.在本发明的一个实施例中,所述阳离子聚合物选自联碲交联的pei。
25.在本发明的一个实施例中,所述阳离子聚合物经peg(聚乙二醇)和\或crgd(五元环肽)修饰。
26.在本发明的一个实施例中,所述阳离子聚合物与纳米核的质量比为1:100~1:0.1;进一步的,所述阳离子聚合物与所述纳米核的质量比为1:80~1:20;进一步的,所述阳离子聚合物与所述纳米核的质量比为1:20~1:10;进一步的,所述阳离子聚合物与所述纳米核的质量比为1:10。
27.在本发明的一个实施例中,所述阳离子聚合物与sirna的质量比为50:1~1:10;进一步的,所述阳离子聚合物与sirna的质量比为8:1~1:1;进一步的,所述阳离子聚合物与sirna的质量比为5:1。
28.本发明的第二个目的在于提供所述的纳米复合物的制备方法,包括以下步骤:通过静电吸附使得带正电的阳离子聚合物吸附在带负电的纳米核上。随后带正电的阳离子聚合物通过静电相互作用吸附带负电的sirna,形成所述纳米复合物。
29.在本发明的一个实施例中,本发明所述纳米复合物具有选自下组的一个或多个如下特征:(1)具有内皮细胞靶向的能力;(2)具有ros特异性响应释放sirna的能力;(3)具有抑制中性粒细胞浸润的能力;(4)具有抑制促炎因子过度产生的能力;(5)与载药的纳米核相比,具有延长的体内半衰期。
30.本发明的第三个目的在于提供一种药物组合物,所述药物组合物包括所述的纳米复合物,以及药学上或生理学上可接受的载体。
31.在本发明的一个实施例中,所述载体包括赋形剂、崩解剂、稀释剂、润滑剂、粘合剂、湿润剂、矫味剂、助悬剂、表面活性剂和防腐剂中的一种或多种。
32.在本发明的一个实施例中,所述载体可含有液体,如水、盐水、甘油和乙醇。另外,这些载体中还可能存在辅助性的物质,如填充剂、崩解剂、润滑剂、助流剂、泡腾剂、润湿剂或乳化剂、矫味剂、ph缓冲物质等。通常,可将这些物质配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中ph通常约为5-8,较佳地,ph约为6-8。
33.在本发明的一个实施例中,所述药物的剂型为片剂、胶囊剂、软胶囊剂、颗粒剂、丸剂、口服液、乳剂、干混悬剂、干浸膏剂或注射剂。
34.在本发明的一个实施例中,所述药物的给药途径可采用:静脉注射、腹腔注射、病灶内注射、口服、局部给药、肌内、皮内、直肠、吸入等方式。
35.本发明的第四个目的在于提供一种试剂盒,所述试剂盒包括任一项所述纳米复合物或所述的药物组合物。
36.本发明的第五个目的在于提供所述的纳米复合物、所述的药物组合物或所述的试剂盒在制备预防或/和治疗炎性疾病药物中的应用。
37.在本发明的一个实施例中,所述炎性疾病包括心肌缺血再灌注损伤、炎症性肠病、脓毒症、支气管肺炎或胰腺炎。
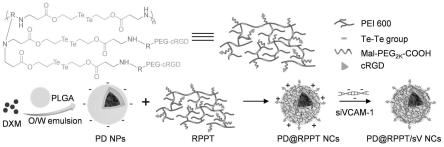
38.本发明提供了一种具有超高ros敏感性的内皮细胞靶向、血清稳定的ncs,以介导sivcam-1和dxm有效地共同传递到缺血心肌中的炎症内皮细胞。plganps作为封装dxm的储存器,其上涂有crgd-聚乙二醇(peg)修饰的联碲交联pei(rppt),以有效凝聚sivcam-1。peg段将提高ncs的血清稳定性,而crgd将使ncs通过与细胞表面过度表达的整合素αvβ3结合而靶向心脏微血管内皮细胞(cmecs)。由于碲的电负性低于硒的电负性,且碲的键能(126kj/mol)远低于硒的键能(172kj/mol),因此联碲交联的pei具有更高的ros敏感性,这将使其在发炎的内皮细胞中降解为低mw段,以促进细胞内sivcam-1的释放并增强vcam-1的沉默效率。因此,sivcam-1和dxm合作抑制中性粒细胞招募到受伤的心肌,减弱心肌炎症,并促进miri大鼠的心肌恢复。
39.本发明的上述技术方案相比现有技术具有以下优点:
40.1.由crgd修饰的阳离子聚合物制备得到的纳米复合物,可以高效地识别血管内皮细胞,并将纳米复合物递送至细胞内。
41.2.由peg修饰的阳离子聚合物制备得到的纳米复合物,可以避免血液中蛋白成分的粘附,大大提高了纳米复合物的血清稳定性。
42.3.由联碲交联pei制备得到的纳米复合物,可以在炎性细胞内ros的作用下高效降解释放sivcam-1,大大提高了基因沉默效率,直接抑制中性粒细胞的粘附。
43.4.纳米复合物进入细胞后,载药plga纳米核逐渐降解,dxm逐步释放,减少炎症内皮细胞产生过多的促炎因子。
44.5.相比于现行炎性疾病的治疗药物,本技术的纳米复合物具备长循环、高中性粒细胞浸润抑制效率、高促炎因子抑制效率、高效抑制炎性连锁反应、高安全性等优势。
附图说明
45.为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明,其中
46.图1:本发明pd@rppt/svncs纳米复合物制备流程示意图。
47.图2:本发明阳离子聚合物rppt的合成图。
48.图3:本发明compound 1(b)与compound 2(b)的1h nmr谱图。
49.图4:本发明compound 2的maldi-tof-ms谱图。
50.图5:本发明rppt的ft-ir谱图。
51.图6:本发明rppt的1h nmr谱图。
52.图7:本发明pt、rppt及h2o2处理后的rppt的gpc谱图。
53.图8:本发明pd@rppr/sv ncs在不同rppt/sirna质量比下ncs的粒径和zeta电位。
54.图9:本发明pd@rppr/sv ncs在不同rppt/sirna质量比下凝结sirna的琼脂糖凝胶电泳图。
55.图10:本发明pd@rppt/svncs在不同rppt/sirna重量比(pd/rppt=10,w/w,n=3)下的sirna凝结水平。
56.图11:本发明pd@rppt/svncs(pd/rppt=10,rppt/sirna=5,w/w)与含10%胎牛血清的dmem孵育不同时间后的粒径。
57.图12:本发明pd@rppt/svncs与大鼠血清孵育不同时间后的sirna完整性(pd/rppt=10,rppt/sirna=5,w/w);其中,裸sirna与血清孵育不同时间作为对照。
58.图13:本发明在不同rppt/sirna或rppc/sirna重量比下,h2o2触发(0.1mm,4h)pd@rppt/sv和pd@rppc/sv ncs中的sirna释放(pd/rppt=10,w/w);其中,n代表裸sirna。
59.图14:本发明未处理pd@rppt/sv ncs和h2o2处理(pd/rppt=10,rppt/sirna=5,w/w)的tem图像;其中,bar=100nm。
60.图15:本发明在h2o2处理(0.1mm,1h)前后,pd@rppt/sv ncs和pd@rppc/sv ncs的大小变化(pd/rppt(或rppc)=10,rppt(或rppc)/sirna=5,w/w)。
61.图16:本发明流式细胞术分析裸fam-sinc或各种含fam-sinc的ncs(1μg fam-sinc/ml,pd/ppt(或rppt)=10,ppt(或rppt)/sirna=5,w/w)培养4h后的rcmecs。
62.图17:本发明rcmecs与pi@rppt/sn
fam ncs或pi@ppt/sn
fam ncs孵育4小时后的clsm图像(pi/ppt(或rppt)=10,ppt(或rppt)/sirna=5,w/w)。
63.图18:rcmecs与pd@rppt/sn
fam ncs共孵育4小时后的clsm图像(pd/rppt=10,rppt/sirna=5,w/w);其中,细胞核用dapi染色,内溶酶体用lysotrackerdeep red染色。
64.图19:本发明rcmecs与pd@rhb-rppt/sn
fam ncs或pd@rhb-rppc/sn
fam ncs孵育4小时后clsm图像(pd/rhb-ppt(或rhb-rppt)=10,rhb-ppt(或rhb-rppt)/sirna=5,w/w)。
65.图20:本发明不同rppt或rppc浓度的ncs在rcmecs中的细胞毒性(n=3)。对于h2o2处理,ncs在加入细胞前先用h2o2(0.1mm)预处理4h。
66.图21:本发明pd@rppt/svncs(0.1μg sirna/孔)在不同rppt/sirna重量比的rcmecs中孵育4小时后的细胞毒性(pd/rppt=10,w/w,n=3)。
67.图22:本发明大鼠静脉注射pbs或pd@rppt/svncs(400μg sirna/kg和2.5mg dxm/kg,n=3)后的血液学指标和血液生化指标。
68.图23:本发明静脉注射250μg sirna/kg后,游离cy5-sinc和pd@rppt/sn
cy5 ncs(pd/rppt=10,rppt/sirna=5,w/w)在大鼠体内的药代动力学(n=3)。。
69.图24:本发明大鼠静脉注射含cy5-sinc的ncs(150μg cy5-sinc/kg)6h后的体外荧光成像和缺血心肌荧光强度的定量(n=3)。
70.图25:本发明静脉注射pd@rppt/svncs(400μg sirna/kg和2.5mg dxm/kg)后24h缺血心脏中vcam-1和tnf-αmrna的相对水平(n=4)。
71.图26:本发明通过western blot检测静脉注射pd@rppt/sv ncs 24h后缺血心脏vcam-1和tnf-α蛋白水平。
72.图27:本发明心肌切片经vcam-1和tnf-α免疫荧光染色后的代表性clsm图像。
73.图28:本发明miri后24h,流式细胞术分析损伤心肌组织中中性粒细胞的浸润情况。
74.图29:本发明心肌梗死3天后心肌切片经ttc染色后的代表性图像及梗死面积定量。
75.图30:本发明缺血心肌切片经h&e染色后的代表性图像。
76.图31:本发明缺血心肌切片经mt和tunel染色后的代表性图像以及纤维面积和凋亡率的定量。
77.图32:本发明miri大鼠经生理盐水或不同ncs治疗后的超声心动图图像。
78.图33:本发明miri大鼠经生理盐水或不同ncs治疗后左心室射血分数(ef)和缩短分数(fs,c)(n=3)。
79.各图中,“*”表示p《0.05,“**”表示p《0.01,“***”表示p《0.001。
具体实施方式
80.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
81.本技术中提供了一种药物与sirna共递送的纳米复合物,其能够特异性靶向内皮细胞,在ros存在下高效释放sivcam-1,逐步释放dxm,抑制中性粒细胞粘附和浸润,抑制促炎因子的产生,两者结合高效地抑制炎症连锁反应。尤其是,阳离子聚合物的ros超敏响应和内皮细胞靶向能力,实现了向炎症内皮细胞的高效递送和sirna释放能力时间,解决了现有技术递送sirna凝结/释放的矛盾。此外,阳离子聚合物的peg修饰,解决了血液循环时间短等缺点。
82.在本技术的一些具体实施方式中,首先将pei 600通过联碲linker交联得到大分子的联碲交联pei(pt),随后pt经过peg和crgd修饰进一步得到最终的阳离子聚合物rppt。dxm经过单乳法包载进plga中得到pd nps。随后pd nps与rppt混合,涡旋混匀并在室温下静置30分钟,形成pd@rppt ncs。最后将sivcam-1与pd@rppt ncs混合,涡旋混匀并在室温下静置30min得到最终的纳米复合物pd@rppt/sivcam-1ncs。相关实验表明,这种纳米复合物具备高效的内皮靶向能力,且能够抑制vcam-1及促炎因子的表达从而抑制中性粒细胞向炎症部位的浸润。在miri大鼠模型中,使用尾静脉注射方式将pd@rppt/sivcam-1ncs纳米复合物注入大鼠体内,成功下调异常增高的促炎因子和vcam-1,并显著抑制中性粒细胞的浸润。
83.本文中提供的所有数值范围旨在清楚地包括落在范围端点之间的所有数值及它们之间的数值范围。可对本技术提到的特征或实施例提到的特征进行组合。本说明书所揭示的所有特征可与任何组合物形式并用,说明书中所揭示的各个特征,可以任何可提供相同、均等或相似目的的替代性特征取代。因此除有特别说明,所揭示的特征仅为均等或相似特征的一般性例子。
84.如本文所用,“含有”、“具有”或“包括”包括了“包含”、“主要由
……
构成”、“基本上由
……
构成”、和“由
……
构成”;“主要由
……
构成”、“基本上由
……
构成”和“由
……
构成”属于“含有”、“具有”或“包括”的下位概念。例如,“基本上”可包括所指全部的90%或以上。
85.当在一系列两个或更多个事项中使用时,术语“和/或”意指任何一个所列出的事项可以单独或与所列出的事项中的任何一个或多个组合采用。例如,表述“a和/或b”旨在意指a和b之一或两者,即单独a、单独b或a与b组合。表述“a、b和/或c”旨在意指单独a、单独b、单独c、a与b组合、a与c组合、b与c组合或a、b与c组合。
86.数值范围的描述应当被认为具有确切公开的所有可能的子范围以及所述范围内的单独数值。例如,如1至6的范围描述应当被认为具有确切公开的子范围,如1至3、1至4、1至5、2至4、2至6、3至6等等,以及所述范围内的单独数字,例如1、2、3、4、5以及6。
87.纳米复合物
88.如本文所用,术语“阳离子聚合物”是指带正电的有机高分子材料。本技术中的阳离子聚合物可经过不同化学方法合成,其交联键具备炎症响应性如ros响应、缺氧响应、氧化还原响应等,其表面修饰有助于提高炎症细胞靶向及循环时间增长。
89.如本文所用,术语“纳米核”是指具有纳米级尺寸的可用于支持本技术载药纳米粒的任何纳米颗粒。可用于制备本技术纳米复合物纳米核的材料包括但不限于高分子纳米材料或无机纳米材料,例如聚乳酸-羟基乙酸共聚物(plga)、聚乳酸(pla)、聚乙醇酸(pga)、聚己酸内酯(pcl)、聚赖氨酸、聚谷氨酸、聚氰基丙烯酸正丁酯(pbca)、壳聚糖、明胶;金、硅、铁、铜等。
90.根据所用材料或方法的不同,本技术的纳米复合物可具有各种适合的形状,例如球形、立方体、圆锥形、圆柱形、棱柱形、棱锥形、或其它规则或不规则的形状。本技术纳米复合物的尺寸可为1纳米~10微米或其间的任何数值或数值范围,例如10纳米~5微米,500纳米~1微米等。
91.纳米复合物的制备方法
92.本技术中还提供了制备本技术纳米复合物的方法,所述方法包括:
93.(a)提供载药纳米核;
94.(b)提供内皮细胞靶向、ros降解的阳离子聚合物;
95.(c)使所述阳离子聚合物吸附所述纳米核上,并进一步吸附sirna,形成所述纳米复合物。
96.本技术的纳米核可采用本领域中已知的各种方法,从原料制得(例如采用纳米沉淀法),也可直接购自各供应商。纳米核可与阳离子聚合物具有相反的电势,以形成电荷吸引进一步稳定纳米复合物。
97.载药的纳米核可以通过乳化法、化学沉淀法、薄膜分散法、逆相蒸发法、注入法、超声波分散法等制备得到。
98.药物、药物组合物或试剂盒
99.本技术还提供了一种药物、药物组合物或试剂盒,其中含有有效量的本技术的纳米复合物或组分(a)和(b)的组合物,以及药学上可接受的载体。如本文所用,术语“活性物质”或“本技术的活性物质”可互换使用,是指纳米复合物或组分(a)和(b)的组合物。其中,组分(a)和(b)的组合物中可包含独立存放的组分(a)和组分(b)以及可任选的载剂,在临用
前,可将组分(a)和组分(b)与可任选的载剂混合并制备成可供预防和/或治疗用的纳米复合物药物。
100.在一些实施方案中,所述药物可用于预防和/或治疗促炎因子过度表达及中性粒细胞浸润的炎性疾病。例如,本技术的活性物质、包含所述活性物质的产品可用于预防和/或治疗促炎因子过度表达和中性粒细胞浸润导致的心肌缺血再灌注损伤,例如。
101.如本文所用,术语“含有”或“包括”包括了“包含”、“基本上由
……
构成”、和“由
……
构成”。如本文所用,术语“药学上可接受的”成分是适用于人和/或动物而无过度不良副反应(如毒性、刺激和变态反应)的,即有合理的效益/风险比的物质。如本文所用,术语“有效量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。
102.如本文所用,术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。该术语指这样一些药剂载体:它们本身并不是必要的活性成分,且施用后没有过分的毒性。合适的载体是本领域普通技术人员所熟知的。在《雷明顿药物科学》(remington’s pharmaceutical sciences,mack pub.co.,n.j.1991)中可找到关于药学上可接受的赋形剂的充分讨论。
103.在组合物中药学上可接受的载体可含有液体,如水、盐水、甘油和乙醇。另外,这些载体中还可能存在辅助性的物质,如填充剂、崩解剂、润滑剂、助流剂、泡腾剂、润湿剂或乳化剂、矫味剂、ph缓冲物质等。通常,可将这些物质配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中ph通常约为5-8,较佳地,ph约为6-8。
104.应理解,所用活性物质的有效剂量可随待施用或治疗的对象的严重程度而变化。具体情况根据对象的个体情况(例如对象体重、年龄、身体状况、所需达到的效果)来决定,这在熟练医师可以判断的范围内。
105.本技术的组合物,可以为固态(如颗粒剂、片剂、冻干粉、栓剂、胶囊、舌下含片)或液态(如口服液)或其它合适的形状。给药途径可采用:静脉注射、腹腔注射、病灶内注射、口服、局部给药、肌内、皮内、直肠、吸入等方式。
106.此外,本技术的组合物中还可含有用于改善和治疗破骨细胞过多或功能亢进相关疾病的其它活性物质。例如,所述的其它活性物质选自下组:临床常用破骨细胞抑制剂、抗生素、抗肿瘤剂、抗炎剂等。
107.本技术的纳米复合物还可以与其它药物和治疗手段联合,例如化疗、放疗、光疗、冷冻疗法、手术、细胞疗法、移植等。
108.具体示例
109.本部分中提供了本技术的一些具体实施方式,应理解这些示例并不用于限制本技术的保护范围,而仅为了帮助理解本技术。
110.在本技术的一些具体实施方式中,提供了一种药物及sirna共递送的纳米复合物,其结构为pd@rppt/sv ncs,其中pd为载有dxm的plga纳米核,rppt为crgd、peg修饰的联碲交联pei。
111.在本技术的一些具体实施方式中,pd@rppt/svncs的制备方法可包括,载有dxm的plgapd nps是用油/水单乳方制备的。将plga(10mg)和dxm(2mg)溶于dcm(1ml)并超声处理30秒。将得到的单一乳液倒入pva溶液(0.1%,30ml),在室温下搅拌过夜,使溶剂蒸发。最后,用超纯水清洗pd nps三次,并通过离心机收集。
112.在本技术的一些具体实施方式中,将联碲linker(100mg,221mmol)和pei 600(177mg,294mmol)以伯胺/二丙烯酸酯的摩尔比4:1溶解于二甲基甲酰胺(5ml),并在50℃搅拌2天,产物经透析冻干得到pt。将mal-peg
2k-cooh(20mg,0.01mmol)、pt(50mg)、n-羟基琥珀酰亚胺(nhs,2mg,0.02mmol)和1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(edc-hcl,3mg,0.02mmol)溶于无水的二甲亚砜(dmso,2ml),在室温搅拌1天。产品经透析和冻干,得到peg-pei-tete(ppt,43mg,61.4%)。将crgd(7mg,0.01mmol)和ppt溶于pbs(2ml,ph7.4)并在室温下搅拌1天,对混合物进行透析和冻干,得到最终产品crgd-peg-pei-tete(rppt)。
113.在本技术的一些具体实施方式中,pd@rppt/sivcam-1ncs纳米复合物通过静电相互作用制备。具体的,在超纯水中以10:1的nps/rppt重量比向pd nps添加rppt,并在室温下孵育30分钟。然后,将sivcam-1以5:1的rppt/sivcam-1重量比加入到pd@rppt ncs中,然后在室温孵育30分钟,形成pd@rppt/svncs。
114.本技术进一步公开了上述pd@rppt/svncs纳米复合物在制备抗心肌缺血再灌注药物中的应用。
115.作为具体示例,本技术制备pd@rppt/svncs纳米复合物的方法如图1所示。具体制备方法举例为:
116.(1)通过单乳法制备载有dxm的plga纳米核(pd nps)。将plga(10mg)和dxm(2mg)溶于dcm(1ml)并超声处理30秒。将得到的单一乳液倒入pva溶液(0.1%,30ml),在室温下下搅拌过夜,使溶剂蒸发。最后,用超纯水清洗pd nps三次,并通过离心机收集。
117.(2)制备联碲交联的pei。将联碲linker(100mg,221mmol)和pei 600(177mg,294mmol)以伯胺/二丙烯酸酯的摩尔比4:1溶解于二甲基甲酰胺(5ml),并在50℃搅拌2天,产物经透析冻干得到pt。将mal-peg
2k-cooh(20mg,0.01mmol)、pt(50mg)、n-羟基琥珀酰亚胺(nhs,2mg,0.02mmol)和1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(edc-hcl,3mg,0.02mmol)溶于无水的二甲亚砜(dmso,2ml),在室温搅拌1天。产品经透析和冻干,得到peg-pei-tete(ppt,43mg,61.4%)。将crgd(7mg,0.01mmol)和ppt溶于pbs(2ml,ph7.4)并在室温下搅拌1天,对混合物进行透析和冻干,得到最终产品crgd-peg-pei-tete(rppt)。
118.(3)在超纯水中以10:1的nps/rppt重量比向pd nps添加rppt,并在室温下孵育30分钟。然后,将sivcam-1以5:1的rppt/sivcam-1重量比加入到pd@rpptncs中,然后在室温孵育30分钟,形成pd@rppt/svncs。
119.实施例
120.下面结合具体实施例,进一步阐述本技术。应理解,这些实施例仅用于说明本技术而不用于限制本技术的范围。本领域技术人员可对本技术做出适当的修改、变动,这些修改和变动都在本技术的范围之内。
121.下列实施例中未注明具体条件的实验方法,可采用本领域中的常规方法,例如参考《分子克隆实验指南》(第三版,纽约,冷泉港实验室出版社,newyork:cold spring harbor laboratory press,1989)、《动物细胞培养》(animal cell culture,r.i.freshney编著,1987)或按照供应商所建议的条件。dna的测序方法为本领域常规的方法,也可由商业公司提供测试。
122.除非另外说明,否则百分比和份数按重量计算。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均
等的方法及材料皆可应用于本技术方法中。文中所述的较佳实施方法与材料仅作示范之用。
123.所有数据均以平均值
±
标准差表示,并使用student’s t-test进行统计分析。在*p《0.05时判断两组之间差异显著,在**p《0.01和***p《0.001时差异非常显著。
124.实施例一、pd@rppt/svncs纳米复合物的制备和表征
125.按照图1中所述流程制备本技术的细胞膜包被纳米复合物-prmnds纳米复合物。具体制备步骤如下:
126.(1)通过单乳法制备载有dxm的plga纳米核(pd nps)。将plga(10mg)和dxm(2mg)溶于dcm(1ml)并超声处理30秒。将得到的单一乳液倒入pva溶液(0.1%,30ml),在室温下下搅拌过夜,使溶剂蒸发。最后,用超纯水清洗pd nps三次,并通过离心机收集。
127.(2)制备联碲交联的pei。将联碲linker(100mg,221mmol)和pei 600(177mg,294mmol)以伯胺/二丙烯酸酯的摩尔比4:1溶解于二甲基甲酰胺(5ml),并在50℃搅拌2天,产物经透析冻干得到pt。将mal-peg
2k-cooh(20mg,0.01mmol)、pt(50mg)、n-羟基琥珀酰亚胺(nhs,2mg,0.02mmol)和1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(edc-hcl,3mg,0.02mmol)溶于无水的二甲亚砜(dmso,2ml),在室温搅拌1天。产品经透析和冻干,得到peg-pei-tete(ppt,43mg,61.4%)。将crgd(7mg,0.01mmol)和ppt溶于pbs(2ml,ph7.4)并在室温下搅拌1天,对混合物进行透析和冻干,得到最终产品crgd-peg-pei-tete(rppt)。
128.(3)在超纯水中以10:1的nps/rppt重量比向pd nps添加rppt,并在室温下孵育30分钟。然后,将sivcam-1以5:1的rppt/sivcam-1重量比加入到pd@rpptncs中,然后在室温孵育30分钟,形成pd@rppt/svncs。
129.ros响应性pt是通过低分子量pei 600和联碲linker之间的迈克尔加成反应合成的,并进一步用peg和crgd修饰,得到最终的rppt(图2)。交联剂的化学结构通过1hnmr确认(图3)。如图4所示,联碲linker(compound2)的计算摩尔质量(m)约为457g/mol,其中测量的m na
约为480g/mol,这表明联碲linker的成功合成。rppt进一步通过ft-ir和1h nmr进行了表征。如图5所示,ft-ir在1650cm-1
处出现了新的波段,对应于羰基的拉伸振动峰,验证了rppt的成功制备。1h nmr分析进一步证明了rppt的成功合成,从积分面积的比率(3.64-3.73ppm/7.95-8a.03ppm)计算出的peg和crgd的比率约为2/1(图6)。rppc是rppt的非反应性类似物,也是类似地合成的。经gpc测定,rppt的mn为45400da,mw/mn值为1.52(图7)。在用h2o2(0.1mm)处理后,rppt的mn明显下降到5800da,证实了rppt在ros触发的联碲键的裂解后降解为低mw段。(此处sivcam-1是指vcam-1sirna,vcam-1sirna sense cug cag ccu cuu ucu caa adtdt,vcam-1sirna antisense uuu gag aaa gag gcu gca gdtdt。)
130.pd nps是通过单一的o/w乳液方法构建所得,然后带负电荷的pd nps通过静电作用与rppt包被,形成pd@rppt ncs。pd nps具有-10mv的负zeta电位,在涂上rppt后,zeta电位转变为正(图8)。然后,带负电荷的sivcam-1与pd@rpptncs复合,得到最终的pd@rppt/svncs。通过hplc测定,dxm在pd@rppt/svncs中的dlc和dle分别为12.4%和61.9%。琼脂糖凝胶缓释试验表明,pd@rppt ncs在pd/rppt重量比为10时,在rppt/sirna重量比≥1时可以有效地凝集sirna,而在pd/rppt重量比为15和20时,需要更高的rppt/sirna重量比才能有效凝集sirna(图9)。类似的发现也来自于定量的eb排斥试验(图10)。当pd/rppt和rppt/sirna的重量比分别固定为10和5时,得到的pd@rppt/svncs的平均直径为148.2nm,zeta电
位为8.7mv(图8)。进一步增加rppt/sirna的重量比并没有明显改变颗粒大小,但增加了zeta电位,因此这种最佳配方被确定为ncs。
131.如图11所示,pd@rppt/svncs与含10%fbs的dmem培养2小时后,其大小几乎没有变化。随着pd@rppt/svncs与含10%fbs的dmem孵育时间的延长,ncs的尺寸在孵育8小时后略微增加到200nm,这是由于含10%fbs的dmem中带负电的蛋白质对带正电的ncs的吸附。此外,在与大鼠血清孵化4小时后,封装在pd@rppt/svncs中的sirna被降解的程度可以忽略不计,这与裸sirna的明显降解形成鲜明对比(图12)。因此,这表明ncs可以保护sirna在血液循环中不被水解降解,这有可能有助于增强整体sirna在病变部位的传递。
132.ros触发的sirna释放首先通过凝胶电泳进行了评估。用h2o2(0.1mm,4小时)处理pd@rppt/svncs后,所有测试的rppt/sirna重量比(≤8,图13)都有sirna迁移。此外,在h2o2处理后,pd@rppt/svncs的粒径从145nm上升到396nm,这表明ncs在ros的作用下解离并释放了sirna(图14)。相比之下,非反应性的pd@rppc/svncs的sirna凝结能力和颗粒大小在h2o2处理后没有明显的变化。因此,pd@rppt/sv ncs和pd@rppc/sv ncs之间的这种差异表明rppt的ros反应性降解促进了sirna的释放。tem也被用来直观地观察h2o2处理后pd@rppt/svncs的形态变化。如图15所示,未处理的pd@rppt/sv ncs显示出明显的壳-核结构,但h2o2处理的ncs的壳是松散和模糊的,这是由于rppt对h2o2的降解反应。
133.实施例二、pd@rppt/sv ncs纳米复合物的细胞摄取核细胞内动力学
134.通过流式细胞仪分析探讨了各种含fam-sinc的ncs在rcmecs中的细胞摄取水平。如图16,pd@rppt/sn
fam ncs被99.3%的细胞有效内化,明显高于非靶向的pd@ppt/sn
fam ncs(~79.6%)。在每个细胞的平均荧光强度方面得到了一致的结果,其中pd@rppt/sn
fam ncs比pd@ppt/sn
fam ncs高出3倍以上
135.clsm观察进一步显示,pi@rppt/sn
fam ncs可以被rcmecs广泛地内化,相比之下,pi@ppt/sn
fam ncs的细胞质分布水平较低(图17)。这些结果表明,crgd介导的靶向rcmecs促进了sirna和化学药物在细胞内的传递。
136.此外,内化的ncs能够有效地摆脱内溶酶体的束缚,clsm图像中绿色(fam-sinc)和红色(lysotracker deep red染色的内溶酶体)荧光的明显分离就是证明(图18)。
137.通过clsm进一步探讨了由rhb-rppt和fam-sinc组成的ncs的细胞内sirna释放(图19)。在rcmecs中,绿色荧光(fam-sinc)与红色荧光(rhb-rppt)在4小时培养后基本分离,共定位比率为15.3%。相比之下,由无反应的rhb-rppc和fam-sinc组成的ncs显示出更高的共聚焦比率(79.6%)。因此,这种差异证明了rppt的ros反应性降解促进了细胞内sirna的释放,这将潜在地加强基因沉默的效率。
138.实施例三、细胞毒性
139.将细胞与rppt/sirna或rppc/sirna纳米复合物以递增的聚合物浓度孵化后,首先通过mtt试验研究了rppt和rppc在rcmecs中的细胞毒性(图20)。在10和20μg/ml的浓度下,rppt的细胞毒性明显低于rppc。另外,用h2o2预处理,在10、20和40μg/ml时,rppt的细胞毒性降低,但rppc却没有。rppt和rppc之间的这种差异可能是由于ros诱导的rppt在炎症细胞中降解为低分子量段,从而消除了转染后的材料毒性。当pd/rppt重量比固定为10时,pd@rppt/svncs在rppt/sirna的重量比从1增加到8时没有表现出明显的细胞毒性(图21),这表明pd@rppt/sv ncs在转染期间不会对细胞产生毒性。
140.实施例四、生物相容性、药代动力学和生物分布
141.通过尾静脉向健康sd大鼠按照400μg sirna/kg和2.5mg dxm/kg的剂量注射ncs,随后取得大鼠血液做血生化和血常规检测。如图22所示,大鼠肾功能(肌酐,cr;尿素,ur)和肝功能(天冬氨酸氨基转移酶,ast;丙氨酸氨基转移酶,alt)均无明显变化。同时,血液学参数包括白细胞(wbc)、红细胞(rbc)、血小板(plt)和血红蛋白(hgb)也无明显变化,这表明pd@rppt/svncs具有良好的生物相容性。
142.如图23所示,pd@rppt/sn
cy5 ncs的血液循环半衰期(t
1/2
)(约3.63小时)比游离的cy5-sinc(约0.41小时)长约9倍,主要是因为ncs表面的peg分子可以屏蔽rppt的正电荷并立体地阻碍血清蛋白的结合。
143.利用小动物离体器官成像评估了pd@rppt/sn
cy5 ncs和pd@ppt/sn
cy5
ncs在静脉注射后6小时的生物分布情况。pd@rppt/sn
cy5 ncs处理的心脏的荧光强度比pd@ppt/sncy5 ncs处理的心脏高3倍,这再次证明了crgd介导的ncs靶向发炎血管内皮(图24)。
144.实施例五、体内基因沉默及抗炎效率
145.如图25所示,pd@rppt/svncs可使vcam-1和tnf-αmrna水平明显下调,分别为72.9%和68.8%,明显优于pn@rppt/svncs(仅vcam-1)和pd@rppt/sn ncs(仅dxm)。通过western blot分析(图26)和免疫荧光染色(图27)评估,vcam-1和tnf-α蛋白水平也明显下降。与vcam-1和tnf-α的下调相一致,pd@rppt/svncs在抑制中性粒细胞渗入受伤心脏组织方面优于pn@rppt/svncs和pd@rppt/sn ncs(图28)。这些结果共同表明,pd@rppt/svncs中的sivcam-1和dxm可以有效地合作降低ir损伤心肌中的vcam-1和tnf-α水平,这相应地抑制了中性粒细胞的浸润,这是炎症级联中的一个重要过程。
146.实施例六、梗塞面积、心脏纤维化和心肌细胞凋亡的减少
147.如图29所示,使用pd@rppt/sv ncs处理后,梗死面积明显减少,计算出的梗死面积(8.1%)远远小于使用生理盐水(45.1%)、pn@rppt/svncs(28.5%)和pd@rppt/snncs(29.1%)处理后的梗死面积,这与体内抗炎能力的趋势很相关。
148.miri损伤还伴随着组织损伤、心脏纤维化和心肌细胞凋亡。通过h&e染色对受伤的心肌组织进行组织学评估,表明pd@rppt/svncs明显减轻了心肌变性的病理症状,如心肌细胞排列紊乱和心肌纤维的萎缩显示(图30)。通过马松(mt)染色和tunel染色进一步评估了心脏纤维化和心肌细胞凋亡。如图31所示,pd@rppt/svncs明显减少了13.4%的纤维化面积和20.8%的凋亡细胞比例,明显优于pn@rppt/svncs和pd@rppt/snncs。因此,这些结果验证了sivcam-1和dxm在减少梗死面积、防止肌肉变性、抑制心脏纤维化和禁止心肌细胞凋亡方面的合作效应,这是它们在缓解miri后心肌炎症方面的协同能力的结果。
149.实施例七、心功能的恢复
150.在临床上,心功能的评价指标主要包括对左心室(lv)收缩功能的评价,其主要指标是射血分数(ef)和分数缩短(fs)。miri与左心室功能的明显下降有关,表现为ef和fs的下降。m型超声心动图被用来确定pd@rppt/sv ncs对心脏功能的保护作用。如图32所示,用pd@rppt/svncs治疗的大鼠心脏的左心室功能没有明显的异常,心腔尺寸的扩大和心室壁运动的变化可以忽略不计。特别是用pd@rppt/svncs治疗的大鼠心脏的ef和fs值明显高于用pn@rppt/svncs或pd@rppt/sn ncs治疗的大鼠心脏,而且它们几乎恢复到没有miri的大鼠的正常值(图33),表明pd@rppt/sv ncs有效地减轻了心室功能的下降。因此,这种发现证
实了pd@rppt/svncs在减弱心脏重塑和阻碍向心力衰竭过渡方面的效力,这有助于心功能的恢复。
151.显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。