1.本发明属于药物合成技术领域,具体涉及一种比拉斯汀中间体化合物及其制备方法。
背景技术:
2.比拉斯汀(bilastine),化学名为4-[2-[4-[1-(2-乙氧基乙基)-1h-2-苯并咪唑基]-1-哌啶 基]-乙基]-α,α-二甲基苯乙酸,cas号202189-78-4,是西班牙faes制药公司开发的一种 口服第2代非镇静组胺h1受体拮抗药,2012年8月被欧盟批准用于治疗过敏性鼻炎和荨 麻疹。本品选择性作用于外周组胺受体,对其他组胺受体无影响,无心脏毒性,口服给药 吸收迅速,具有良好的耐受性、安全性和较高的生物利用度。
[0003]
其化学结构式为:
[0004][0005]
对于比拉斯汀的合成目前最常用的方法是先经过多步反应合成关键中间体 4-[2-[4-[1-(2-乙氧基乙基)-1h-2-苯并咪唑基]-1-哌啶基]-乙基]-α,α-二甲基苯乙酸酯,该酯 水解生成比拉斯汀。
[0006]
中国专利cn104326909a及文献比拉斯汀重要中间体的合成,《中国医药工业杂志》, 2015,46(7):677-679以α,α-二甲基苯乙酸酯为起始物料,先经傅-克酰基化和还原反应制得 α,α-二甲基-4-(2-溴乙基)苯乙酸甲酯,依次与2-(4-哌啶基)-1h-苯并咪唑和2-氯乙基乙醚发 生亲核取代反应后得4-[2-[4-[1-(2-乙氧基乙基)-1h-2-苯并咪唑基]-1-哌啶基]-乙基]-α,α
‑ꢀ
二甲基苯乙酸甲酯,水解得比拉斯汀。
[0007]
反应路线如下:
[0008][0009]
另外,以上路线中以2-(4-哌啶基)苯并咪唑为原料,分子结构中含有两个易于被取代 的氢,对选择性要求较高,反应条件苛刻,且容易产生副产物。
[0010]
中国专利cn102675101a以α,α-二甲基苯乙酸酯为原料,经傅-克酰基化和还原反应制 得α,α-二甲基-4-(2-卤乙基)苯乙酸酯,再与1-(2-乙氧基乙基)-2-(4-哌啶基)-1h-苯并咪唑经 取代得中间体4-[2-[4-[1-(2-乙氧基乙基)-1h-2-苯并咪唑基]-1-哌啶基]-乙基]-α,α-二甲基 苯乙酸甲酯、水解制得目标产品。
[0011]
反应路线如下:
[0012][0013]
但该法采用wolff-kishner-黄鸣龙法还原羰基,其反应条件需高温、毒性较大;且1-(2
‑ꢀ
乙氧基乙基)-2-(4-哌啶基)-1h-苯并咪唑的合成需要经过上保护基、取代、脱保护基等反应, 步骤繁琐、不适合工业化生产。
[0014]
文献synth.commun.,2011,41(9):1394-1402、j.org.chem.,1988,53(6):1170-1176及 比拉斯汀关键中间体的合成,《河北化工》,2013,36(3):14-15以α,α-二甲基-4-溴苯乙酸甲 酯为原料,通过stille偶联反应,再经水合、上保护基、烷基化、脱保护基和酯水解等反应 制得比拉斯汀。但该方法使用了对环境不友好的有机锡、硼烷二甲硫醚络合物,后处理成 本高。
[0015]
反应路线如下:
[0016][0017]
专利wo2009102155(cn101952273a)以4-溴苯乙醇为原料经钯催化偶联、磺酰化,再 与1-(2-乙氧基乙基)-2-(4-哌啶基)-1h-苯并咪唑经取代、水解等反应制得目标产品。但是 该方法中,关键中间体2-(4-羟乙基苯基)-2-甲基丙酸乙酯的合成是以对溴苯乙醇与1-甲氧 基-1-(三甲基甲硅氧基)-2-甲基-1-丙烯为原料,在催化剂双(二亚芐基丙酮)钯,三叔丁基磷 和氟化锌存在下反应制得。
[0018]
反应路线如下:
[0019][0020]
该反应主要有三个缺点:
①
原料1-甲氧基-1-(三甲基甲硅氧基)-2-甲基-1-丙烯及催化剂 双(二亚芐基丙酮)钯和三叔丁基磷等价格都极其昂贵,不易购得,且不易保存;
②
该反应 需要极为严格的无水无氧条件,操作复杂,且所得产物很难纯化;
③
反应完成后剩余的钯 和磷都会对环境造成严重污染。
[0021]
中国专利cn110903278a以哌啶-4-羧酸为起始物料,经α,α-二甲基-4-(2-溴乙基)苯乙 酸甲酯取代后,与邻苯二胺环化制得α,α-二甲基-4-(2-(4-(1h-2-苯并[d]咪唑基)哌啶-1-基) 乙基)苯乙酸甲酯,然后与氯乙基乙醚发生n-烷基化反应、水解反应制得比拉斯汀。
[0022]
反应路线如下:
[0023]
[0024]
但是该工艺中的起始物料α,α-二甲基-4-(2-溴乙基)苯乙酸甲酯需要参照文献比拉斯汀 重要中间体的合成,《中国医药工业杂志》,2015,46(7):677-679中的方法制备(α,α-二甲基
ꢀ‑
苯乙酸甲酯与溴乙酰溴先经傅-克酰基化反应后、再经三氟乙酸/三乙基硅烷体系还原制 得),不仅延长了反应步骤,同时傅-克酰基化反应用到活性较高的alcl3催化,其用量大, 后处理不仅危险,同时产生的大量铝盐影响产品的分离,此外还原体系运行成本较高。同 时环化步骤中用到大量缩合剂,如:二环己基碳二亚胺、n-羟基琥珀酰亚胺、1-(3-二甲氨 基丙基)-3-乙基碳二亚胺盐酸盐、1-羟基苯并三唑等,不仅原子经济性较差,同时后处理同 样繁琐,较难实现产业化放大生产。
[0025]
中国专利cn111039922a以2-(4-(2-羟乙基)苯基)-2-甲基丙酸为一起始物料,与碘甲 烷反应后生成2-(4-(2-碘乙基)苯基)-2-甲基丙酸甲酯,以4-(1-(2-乙氧基乙基)-1h-苯并[d] 咪唑-2-基)哌啶-1-甲酸叔丁酯为另一起始物料,先脱除boc保护基,再与2-(4-(2-碘乙基) 苯基)-2-甲基丙酸甲酯反应后,经酯水解制得目标产品。但是该工艺同样用到毒性及沸点较 低的碘甲烷进行碘代反应,操作安全性较低。
[0026]
反应路线如下:
[0027][0028]
中国专利cn110950837a及cn107365297a则以4-羟乙基苯基叔丁酸酯或其下游中间 体为起始物料,先通过氧化反应生成4-乙醛基苯基叔丁酸酯,然后与1-(2-乙氧基乙 基)-2-(哌啶-4-基)-1h-苯并[d]咪唑经nabh4或libh4还原胺化后再水解制得比拉斯汀。但 氧化反应在工业化中操作较危险,同时也容易得到过氧化的酸杂质。
[0029]
反应路线如下:
[0030][0031]
中国专利cn104530002a及cn104177331a以对甲基苯乙醇或其下游中间体为起始原 料,经对甲苯磺酰氯磺酰化后制得磺酸酯,然后与1-乙氧基乙基-2-哌啶基苯并咪唑反应, 再在苄位溴化,经格氏反应在苄位引入羧基后将羧基转化成甲酯,再以硫酸二甲酯或碘甲 烷最后上甲基后再水解在苄位进行二甲基化,最后进行水解反应制得比拉斯汀。反应中用 到格式试剂引入羧基,需要无水无氧操作,条件要求苛刻,工业化难度较大;
[0032]
反应路线如下:
[0033][0034]
此外,中国专利cn106146459a及文献比拉斯汀重要中间体的合成,《中国医药工业 杂志》,2016,47(11):1363-1365则采用廉价易得的2-硝基苯胺为原料,先与4-甲酰基哌啶
ꢀ‑
1-羧酸叔丁酯经还原-关环反应制得4-(1h-苯并[d]咪唑-2-基)哌啶-1-甲酸叔丁酯,然后
再 与氯乙基乙醚发生n-烷基化反应、水解反应,最后与2-甲基-2-(4-(2-(甲苯磺酰氧基)乙基) 苯基)丙酸钠经取代反应制得比拉斯汀。
[0035]
反应路线如下:
[0036][0037]
但该反应路线中化合物4-甲酰基哌啶-1-羧酸叔丁酯和2-甲基-2-(4-(2-(甲苯磺酰氧基) 乙基)苯基)丙酸钠均不能从市场购得,因此反应路线较长,另外在比拉斯汀合成过程中, 需要进行20小时的纯化,大大延长了工艺时间,降低了工业化生产效率。
[0038]
综上可知,由关键中间体4-[2-[4-[1-(2-乙氧基乙基)-1h-2-苯并咪唑基]-1-哌啶基]-乙 基]-α,α-二甲基苯乙酸甲酯水解制备比拉斯汀的工艺在多条路线中体现,因此 4-[2-[4-[1-(2-乙氧基乙基)-1h-2-苯并咪唑基]-1-哌啶基]-乙基]-α,α-二甲基苯乙酸甲酯作 为合成比拉斯汀的关键中间体,直接影响该药品的生产、市场供应和质量问题,其化学结 构式如下:
[0039][0040]
鉴于目前4-[2-[4-[1-(2-乙氧基乙基)-1h-2-苯并咪唑基]-1-哌啶基]-乙基]-α,α-二甲基 苯乙酸甲酯的制备工艺中存在以上较多不足。因此,研究寻找一条反应条件温和,操作过 程简便,产品收率高、纯度高的适合工业化生产该中间体的工艺仍是目前需要解决的问题。
技术实现要素:
[0041]
针对目前现有比拉斯汀关键中间体4-[2-[4-[1-(2-乙氧基乙基)-1h-2-苯并咪唑基]-1-哌 啶基]-乙基]-α,α-二甲基苯乙酸甲酯制备技术存在的问题,本发明提供了一种新的中间体化 合物及其制备方法,同时提供了该新化合用于制备4-[2-[4-[1-(2-乙氧基乙基)-1h-2-苯并咪 唑基]-1-哌啶基]-乙基]-α,α-二甲基苯乙酸甲酯的制备方法。该方法反应条件温和,操作过 程简便,所制得的目标产品具有较高的纯度、收率。
[0042]
本发明的具体技术方案如下:
[0043]
本发明第一方面提供了一种比拉斯汀中间体化合物,其结构如式i-2所示:
[0044][0045]
本发明第二方面提供了一种比拉斯汀中间体化合物i-2的制备方法,具体包括以下步 骤:惰性气体保护,室温条件下,将化合物
ⅰ‑
1、化合物sm-1、碱、催化剂加入反应溶剂a 中,控温搅拌反应,监测反应结束后,反应液降至室温,向反应液中加入碱及纯化水,加 入化合物sm-2,控温至反应结束后,反应经后处理得中间体i-2,合成路线如下:
[0046][0047]
优选地,所述的催化剂选自pd(pph3)4、pd(pph3)2cl2、pd(dppf)cl2中的一种,特别优 选pd(pph3)4。
[0048]
优选地,所述的碱选自koac、k2co3、na2co3、k3po4、na3po4、naoac中的一种, 特别优选koac。
[0049]
优选地,所述的化合物i-1与化合物sm-1、化合物sm-2、碱、催化剂的投料摩尔比 为1:1.0~1.5:1.5~2.5:1.3~2.2:0.03~0.08,特别优选1:1.3:2.0:1.6:0.05。
[0050]
优选地,所述的反应溶剂a选自二甲基亚砜、n,n-二甲基甲酰胺、1,4-二氧六环、n,n
‑ꢀ
二甲基乙酰胺中的一种或其组合,特别优选二甲基亚砜。
[0051]
优选地,所述的反应温度为80~110℃,特别优选100~105℃。
[0052]
在一优选方案中,所述的后处理步骤为:将反应液过滤,滤液倾入纯化水中,二氯甲 烷提取,合并有机相,无水硫酸钠干燥,过滤,所得滤液减压浓缩至干,即为中间体化合 物i-2。
[0053]
本发明第三方面提供了一种比拉斯汀中间体化合物i-2用于制备比拉斯汀重要中间体 4-[2-[4-[1-(2-乙氧基乙基)-1h-2-苯并咪唑基]-1-哌啶基]-乙基]-α,α-二甲基苯乙酸甲酯的 用途。
[0054]
比拉斯汀中间体化合物i-2制备比拉斯汀重要中间体4-[2-[4-[1-(2-乙氧基乙基)-1h-2
‑ꢀ
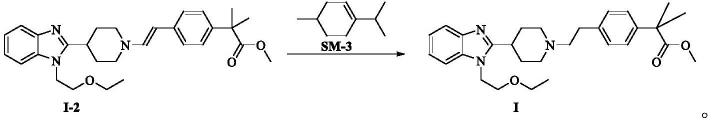
苯并咪唑基]-1-哌啶基]-乙基]-α,α-二甲基苯乙酸甲酯的方法包括如下步骤:室温下,将中 间体i-2、化合物sm-3、钯碳加入反应溶剂b中,控温至反应结束后,反应经后处理得目 标产品比拉斯汀中间体i,合成路线如下:
[0055][0056]
优选地,所述的反应溶剂b选自二甲苯、甲苯、1,4-二氧六环、n,n-二甲基甲酰胺中的 一种或其组合,其中特别优选二甲苯。
[0057]
优选地,所述的化合物i-2与化合物sm-3的投料摩尔比为1:1.5~2.8,其中特别优选 1:2.1。
[0058]
优选地,所述的化合物i-2与钯碳的投料质量比为1:0.05~0.15,其中特别优选1:0.10。
[0059]
优选地,所述的反应温度为95~130℃,其中特别优选110~115℃。
[0060]
优选方案,所述的后处理步骤为:将反应液降温至室温,过滤,滤液纯化水洗,加入 乙酸乙酯萃取,有机层经饱和食盐水洗,无水硫酸钠干燥,过滤,滤液减压浓缩至干即为 比拉斯汀中间体化合物i。
[0061]
本发明的有益效果:
[0062]
1.本发明提供了一种新的比拉斯汀中间体化合物及其制备方法,该新中间体制备
方法 简单,该中间体后续合成比拉斯汀过程中无杂质产生,且该中间体合成工艺简单收率高。
[0063]
2.本发明同时提供了一种比拉斯汀中间体4-[2-[4-[1-(2-乙氧基乙基)-1h-2-苯并咪唑 基]-1-哌啶基]-乙基]-α,α-二甲基苯乙酸甲酯的制备工艺,相较于现有技术所得产品具有较 高的收率与纯度,并且操作简便、安全,适合工业化生产。
具体实施方式
[0064]
下面通过实施例来进一步说明本发明,应该正确理解的是:本发明的实施例仅仅是用 于说明本发明,而不是对本发明的限制,所以,在本发明的方法前提下对本发明的简单改 进均属于本发明要求保护的范围。
[0065]
对本发明得到的中间体及产物结构确证数据如下:
[0066][0067]
esi-hrms(m/z):476.2910[m h]
;1h nmr(400mhz,dmso-d6)δ7.62~7.53(m, 3h),7.50(d,j=7.5hz,2h),7.34(d,j=7.5hz,2h),7.23~7.14(m,2h),5.13(d,j=16.2hz, 1h),4.48(t,j=7.0hz,2h),4.03~3.91(m,1h),3.81(t,j=7.0hz,2h),3.74(s,3h),3.51(q, j=7.2hz,2h),3.42~3.30(m,2h),3.17~3.06(m,2h),2.31~2.22(m,2h),1.82~1.74(m, 2h),1.69(s,6h),1.20(t,j=7.2hz,3h);
13
c nmr(100mhz,dmso-d6):δ178.29,162.30, 142.97,138.80,138.17,136.51,132.65,128.56,126.22,123.52,122.53,119.98,112.81,95.68, 71.18,66.87,52.56,50.13,48.48,46.35,29.14,27.90,24.98,14.87.
[0068][0069]
esi-hrms(m/z):478.3068[m h]
;1h nmr(300mhz,cdcl3)δ7.78~7.75(m,1h), 7.33~7.20(m,7h),4.31(t,j=5.5hz,2h),3.72(t,j=5.5hz,2h),3.65(s,3h),3.41(q,j=7.0 hz,2h),3.20~3.17(m,4h),3.04~3.01(m,1h),2.87~2.82(m,2h),2.70~2.67(m,2h), 2.23~2.20(m,4h),1.59(s,6h),1.10(t,j=7.0hz,3h);
13
c nmr(100mhz,cdcl3):δ 178.30,162.31,141.90,138.82,138.30,136.51,127.05,126.93,123.52,122.53,119.98,112.77, 71.18,66.87,56.18,52.61,52.56,50.13,46.35,33.63,29.14,27.66,24.96,14.90.
[0070]
本发明采用hplc测定4-[2-[4-[1-(2-乙氧基乙基)-1h-2-苯并咪唑基]-1-哌啶基]-乙 基]-α,α-二甲基苯乙酸甲酯的纯度,色谱条件如下:
[0071]
色谱柱:ymc-triart c
18
柱(4.6mm
×
150mm,5μm)或效能相当的色谱柱;
[0072]
流动相a:10mmol/l磷酸氢二钾:乙腈:四氢呋喃(用磷酸调ph 7.0)(750:150:100);
[0073]
流动相b:10mmol/l磷酸氢二钾:乙腈:四氢呋喃(用磷酸调ph 8.0)(150:800:50);
[0074]
梯度洗脱(0—30min:a 100%—70%,30—50min:a 75%—0%,50—60min,0%—0%);
[0075]
柱温:50℃;
[0076]
检测波长:210nm;
[0077]
流速:0.8ml/min;
[0078]
进样量:10μl;
[0079]
其中,4-[2-[4-[1-(2-乙氧基乙基)-1h-2-苯并咪唑基]-1-哌啶基]-乙基]-α,α-二甲基苯乙 酸甲酯的保留时间为42.0min左右。
[0080]
以下各实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。
[0081]
化合物i-1的合成
[0082]
实施例1
[0083]
室温,将1-(2-乙氧基乙基)-2-(哌啶-4-基)-1h-苯并[d]咪唑(54.68g,0.20mol)、三乙 胺(44.52g,0.44mol)加入n,n-二甲基甲酰胺(300ml)中,加入(e)-1,2-二溴乙烯(39.03g, 0.21mol)的n,n-二甲基甲酰胺(100ml)溶液,控温80~85℃反应,经检测反应完毕后,将 反应液降温至室温,过滤,滤液加入纯化水(2000ml)中,二氯甲烷(600ml
×
3)提取,合并 有机相,饱和食盐水(500ml
×
2)洗,无水硫酸钠干燥,过滤滤液减压浓缩至干即为中间体 i-1,收率85.3%,hplc纯度99.63%。
[0084]
化合物i-2的合成
[0085]
实施例2
[0086]
氩气保护室温条件下,将化合物i-1(37.83g,0.10mol)、联硼酸频那醇酯(sm-1,33.01 g,0.13mol)、醋酸钾(15.70g,0.16mol)、pd(pph3)4(5.78g,5.0mmol)加入二甲基亚砜 (250ml)中,控温100~105℃反应,经检测反应完毕后,反应液降至室温,加入k3po4(33.96 g,0.16mol)的纯化水(110ml)溶液,2-(4-溴苯基)-2-甲基丙酸甲酯(sm-2,51.42g,0.20 mol),控温95~100℃反应,经检测反应完毕后,过滤,将滤液加入纯化水(500ml)中,乙 酸乙酯(200ml
×
3)提取,合并有机相,无水硫酸钠干燥,过滤,滤液减压浓缩至干后制得 中间体i-2,收率86.6%,hplc纯度99.66%。
[0087]
实施例3
[0088]
氩气保护室温条件下,将化合物i-1(37.83g,0.10mol)、联硼酸频那醇酯(25.39g,0.1 mol)、k2co3(22.11g,0.16mol)、pd(pph3)4(5.78g,5.0mmol)加入二甲基亚砜(250ml) 中,控温105~110℃反应,经检测反应完毕后,反应液降至室温,加入koac(15.70g,0.16 mol)的纯化水(110ml)溶液,2-(4-溴苯基)-2-甲基丙酸甲酯(sm-2,38.57g,0.15mol), 控温95~100℃反应,经检测反应完毕后,过滤,将滤液加入纯化水(500ml)中,乙酸乙酯 (200ml
×
3)提取,合并有机相,无水硫酸钠干燥,过滤,滤液减压浓缩至干后制得中间体 i-2,收率82.5%,hplc纯度99.32%。
[0089]
实施例4
[0090]
氩气保护室温条件下,将化合物i-1(37.83g,0.10mol)、联硼酸频那醇酯(38.09g,
0.15 mol)、k3po4(33.96g,0.16mol)、pd(pph3)2cl2(3.51g,5.0mmol)加入n,n-二甲基乙酰胺 (250ml)中,控温80~85℃反应,经检测反应完毕后,反应液降至室温,加入k2co3(22.11 g,0.16mol)的纯化水(110ml)溶液,2-(4-溴苯基)-2-甲基丙酸甲酯(sm-2,64.28g,0.25 mol),控温95~100℃反应,经检测反应完毕后,过滤,将滤液加入纯化水(500ml)中,乙 酸乙酯(200ml
×
3)提取,合并有机相,无水硫酸钠干燥,过滤,滤液减压浓缩至干后制得 中间体i-2,收率83.3%,hplc纯度99.22%。
[0091]
实施例5
[0092]
氩气保护室温条件下,将化合物i-1(37.83g,0.10mol)、联硼酸频那醇酯(43.17g,0.17 mol)、na3po4(26.23g,0.16mol)、pd(pph3)2cl2(3.51g,5.0mmol)加入1,4-二氧六环(250 ml)中,控温75~80℃回流反应,经检测反应完毕后,反应液降至室温,加入k3po4(33.96 g,0.16mol)的纯化水(110ml)溶液,2-(4-溴苯基)-2-甲基丙酸甲酯(sm-2,51.42g,0.27 mol),控温95~100℃反应,经检测反应完毕后,过滤,将滤液加入纯化水(500ml)中,乙 酸乙酯(200ml
×
3)提取,合并有机相,无水硫酸钠干燥,过滤,滤液减压浓缩至干后制得 中间体i-2,收率78.8%,hplc纯度98.82%。
[0093]
实施例6
[0094]
氩气保护室温条件下,将化合物i-1(37.83g,0.10mol)、联硼酸频那醇酯(33.01g,0.12 mol)、koac(12.76g,0.13mol)、pd(dppf)cl2(3.66g,5.0mmol)加入二甲基亚砜(250ml) 中,控温105~110℃反应,经检测反应完毕后,反应液降至室温,加入koac(12.76g,0.13 mol)的纯化水(110ml)溶液,2-(4-溴苯基)-2-甲基丙酸甲酯(sm-2,51.42g,0.20mol), 控温95~100℃反应,经检测反应完毕后,过滤,将滤液加入纯化水(500ml)中,乙酸乙酯 (200ml
×
3)提取,合并有机相,无水硫酸钠干燥,过滤,滤液减压浓缩至干后制得中间体 i-2,收率82.5%,hplc纯度99.32%。
[0095]
实施例7
[0096]
氩气保护室温条件下,将i-1(37.83g,0.10mol)、联硼酸频那醇酯(33.01g,0.12mol)、 koac(21.59g,0.22mol)、pd(pph3)4(5.78g,5.0mmol)加入1,4-二氧六环(250ml)中,控 温100~105℃回流反应,经检测反应完毕后,反应液降至室温,加入koac(21.59g,0.22 mol)、的纯化水(110ml)溶液,2-(4-溴苯基)-2-甲基丙酸甲酯(sm-2,51.42g,0.20mol), 控温95~100℃反应,经检测反应完毕后,过滤,将滤液加入纯化水(500ml)中,乙酸乙酯 (200ml
×
3)提取,合并有机相,无水硫酸钠干燥,过滤,滤液减压浓缩至干后制得中间体 i-2,收率83.1%,hplc纯度99.25%。
[0097]
实施例8
[0098]
氩气保护室温条件下,将化合物i-1(37.83g,0.10mol)、联硼酸频那醇酯(33.01g,0.12 mol)、koac(10.79g,0.11mol)、pd(dppf)cl2(3.66g,5.0mmol)加入二甲基亚砜(250ml) 中,控温75~80℃反应,经检测反应完毕后,反应液降至室温,加入koac(10.79g,0.11 mol)的纯化水(110ml)溶液,2-(4-溴苯基)-2-甲基丙酸甲酯(sm-2,51.42g,0.20mol), 控温95~100℃反应,经检测反应完毕后,过滤,将滤液加入纯化水(500ml)中,乙酸乙酯 (200ml
×
3)提取,合并有机相,无水硫酸钠干燥,过滤,滤液减压浓缩至干后制得中间体 i-2,收率78.5%,hplc纯度98.90%。
[0099]
实施例9
[0100]
氩气保护室温条件下,将i-1(37.83g,0.10mol)、联硼酸频那醇酯(33.01g,0.12mol)、 koac(23.55g,0.24mol)、pd(pph3)4(5.78g,5.0mmol)加入n,n-二甲基乙酰胺(250ml) 中,控温100~105℃反应,经检测反应完毕后,反应液降至室温,加入koac(23.55g,0.24 mol)、的纯化水(110ml)溶液,2-(4-溴苯基)-2-甲基丙酸甲酯(sm-2,51.42g,0.20mol), 控温110~105℃反应,经检测反应完毕后,过滤,将滤液加入纯化水(500ml)中,乙酸乙酯 (200ml
×
3)提取,合并有机相,无水硫酸钠干燥,过滤,滤液减压浓缩至干后制得中间体 i-2,收率77.8%,hplc纯度98.85%。
[0101]
实施例10
[0102]
氩气保护室温条件下,将i-1(37.83g,0.10mol)、联硼酸频那醇酯(33.01g,0.12mol)、 naoac(13.13g,0.16mol)、pd(pph3)4(3.47g,3.0mmol)加入n,n-二甲基甲酰胺(250ml) 中,控温105~110℃反应,经检测反应完毕后,反应液降至室温,加入naoac(13.13g,0.16 mol)的纯化水(110ml)溶液,2-(4-溴苯基)-2-甲基丙酸甲酯(sm-2,51.42g,0.20mol), 控温95~100℃反应,经检测反应完毕后,过滤,将滤液加入纯化水(500ml)中,乙酸乙酯(200ml
×
3)提取,合并有机相,无水硫酸钠干燥,过滤,滤液减压浓缩至干后制得中间体 i-2,收率82.2%,hplc纯度99.33%。
[0103]
实施例11
[0104]
氩气保护室温条件下,将i-1(37.83g,0.10mol)、联硼酸频那醇酯(33.01g,0.12mol)、 na3po4(26.23g,0.16mol)、pd(pph3)4(9.24g,8.0mmol)加入二甲基亚砜(250ml)中,控 温95~100℃反应,经检测反应完毕后,反应液降至室温,加入na3po4(32.79g,0.20mol) 的纯化水(110ml)溶液,2-(4-溴苯基)-2-甲基丙酸甲酯(sm-2,51.42g,0.20mol),控温 95~100℃反应,经检测反应完毕后,过滤,将滤液加入纯化水(500ml)中,乙酸乙酯(200 ml
×
3)提取,合并有机相,无水硫酸钠干燥,过滤,滤液减压浓缩至干后制得中间体i-2, 收率83.0%,hplc纯度99.25%。
[0105]
实施例12
[0106]
氩气保护室温条件下,将i-1(37.83g,0.10mol)、联硼酸频那醇酯(33.01g,0.12mol)、 na2co3(16.96g,0.16mol)、pd(pph3)4(1.16g,1.0mmol)加入n,n-二甲基甲酰胺(250ml) 中,控温105~110℃反应,经检测反应完毕后,反应液降至室温,加入na2co3(21.20g, 0.20mol)的纯化水(110ml)溶液,2-(4-溴苯基)-2-甲基丙酸甲酯(sm-2,33.43g,0.13mol), 控温75~80℃反应,经检测反应完毕后,过滤,将滤液加入纯化水(500ml)中,乙酸乙酯(200 ml
×
3)提取,合并有机相,无水硫酸钠干燥,过滤,滤液减压浓缩至干后制得中间体i-2, 收率78.3%,hplc纯度98.92%。
[0107]
实施例13
[0108]
氩气保护室温条件下,将化合物i-1(37.83g,0.10mol)、联硼酸频那醇酯(33.01g,0.12 mol)、na3po4(26.23g,0.16mol)、pd(pph3)4(11.56g,10.0mmol)加入二甲基亚砜(250ml) 中,控温95~100℃反应,经检测反应完毕后,反应液降至室温,加入k3po4(46.70g,0.22 mol)的纯化水(110ml)溶液,2-(4-溴苯基)-2-甲基丙酸甲酯(sm-2,51.42g,0.20mol), 控温105~110℃反应,经检测反应完毕后,过滤,将滤液加入纯化水(500ml)中,乙酸乙酯 (200ml
×
3)提取,合并有机相,无水硫酸钠干燥,过滤,滤液减压浓缩至干后制得中间体 i-2,收率78.1%,hplc纯度98.85%。
碳(3.57g)加入n,n-二甲基甲酰胺(200ml)中,控温110~115℃反应,经检测反应完毕后, 将反应液降温至室温,过滤,滤液纯化水(60ml
×
2)洗涤,乙酸乙酯(100ml
×
2)萃取,有 机层经饱和食盐水(60ml
×
2)洗涤,无水硫酸钠干燥,过滤,滤液减压浓缩至干即为目标产 品i,收率92.9%,hplc纯度99.52%。
[0124]
实施例21
[0125]
室温,将中间体i-2(23.78g,0.05mol)、α-蒎烯(sm-3,14.52g,0.105mol)、10%钯 碳(0.71g)加入甲苯(200ml)中,控温90~95℃反应,经检测反应完毕后,将反应液降温至 室温,过滤,滤液纯化水(60ml
×
2)洗涤,乙酸乙酯(100ml
×
2)萃取,有机层经饱和食盐 水(60ml
×
2)洗涤,无水硫酸钠干燥,过滤,滤液减压浓缩至干即为目标产品i,收率87.6%, hplc纯度99.96%。
[0126]
实施例22
[0127]
室温,将中间体i-2(23.78g,0.05mol)、α-蒎烯(sm-3,14.52g,0.105mol)、10%钯 碳(4.04g)加入邻二甲苯(200ml)中,控温115~120℃反应,经检测反应完毕后,将反应液 降温至室温,过滤,滤液纯化水(60ml
×
2)洗涤,乙酸乙酯(100ml
×
2)萃取,有机层经饱 和食盐水(60ml
×
2)洗涤,无水硫酸钠干燥,过滤,滤液减压浓缩至干即为目标产品i,收 率86.9%,hplc纯度98.82%。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。