一种高纯度水飞蓟宾葡甲胺药物新制剂及其制备方法和应用
1.本发明为要求申请日为2021年03月31日、申请号为202110369625.5、发明名称为《一种水飞蓟宾葡甲胺药物制剂及其制备方法和应用》本国部分优先权的申请文件
技术领域
2.本发明属于药物制剂技术和药理学领域,尤其涉及一种水飞蓟宾葡甲胺药物制剂及其制备方法和应用。
背景技术:
3.随着社会经济的蓬勃高速发展,人民生活水平的巨大改善,人们的生活方式发生了很大变化,肝脏疾病的发病率逐年升高,位于三大致死性疾病之首。肝脏疾病具有高发病率、高患病率、高死亡率、高致残率、高复发率、并发症多的五高一多特点。肝脏疾病主要包括病毒型肝炎、酒精性肝炎、非酒精性脂肪性肝病等。
4.目前国内外临床应用的药物主要包括核苷类和干扰素、甘草酸及其盐类、水飞蓟宾及其盐类新制剂等,但由于病人参与率低,依从性差,疗效不明等诸多问题,肝脏疾病的发病率和对人们健康的危害日益增加,改善肝功能,降低氧化应激和炎症反应,减少细胞死亡是防治急性肝功能衰竭(alf) 的重要途径;降低血氨和炎症因子是治疗肝性脑病(he)的重要策略之一,肝性脑病(he)是急性肝衰竭患者死亡的主要原因,伴随he症状患者死亡率显著升高。针对性防治肝病的药物市场品种不多,有效性也不是尽如人意,有着巨大亟待满足的新药需求,保肝护肝药物有很大的应用前景和广阔的市场需求,尤其是对于肝衰竭及其肝昏迷等急、危、重症肝病患者,临床上迫切需要高纯度高生物利用度药物,特别是急性肝衰竭和肝性脑病需要的供注射用的注射新制剂。
5.水飞蓟宾葡甲胺盐产品具有高有效性、低水溶性,高热敏性和低稳定性的特点。因为它的低水溶性、低稳定性和高热敏性的严重影响,导致生物利用度极低,水飞蓟宾的生物利用度只有0.73%,水飞蓟宾葡甲胺的生物利用度约为2.5%,后者虽为前者的3.4倍,其绝对值仍然是很低的,有待提高。
技术实现要素:
6.有鉴于此,本发明的目的在于提供一种高纯度水飞蓟宾葡甲胺药物新剂型制备方法和新用途研发,本发明提供的水飞蓟宾葡甲胺药物新剂型包括缓释微丸胶囊、注射用水飞蓟宾葡甲胺、微丸和肠溶片等;本发明提供的口服新制剂通过改进剂型、增溶和促吸收,实现水飞蓟宾葡甲胺生物利用度的提高,进而实现疗效的提高。
7.为了实现上述发明目的,本发明提供了以下技术方案:
8.本发明提供了一种水飞蓟宾葡甲胺药物制剂,包括水飞蓟宾葡甲胺和辅料,所述水飞蓟宾的纯度为99%~100%;所述辅料包括聚乙烯吡咯烷酮。
9.优选的,所述水飞蓟宾葡甲胺药物制剂的剂型为微丸、肠溶片或注射制剂。
10.优选的,所述微丸为缓释微丸。
11.优选的,当所述水飞蓟宾葡甲胺药物新制剂的剂型为缓释微丸时,所述辅料还包括缓释剂,所述水飞蓟宾葡甲胺与缓释剂的质量比为(15~50):(5~20)。
12.优选的,当所述水飞蓟宾葡甲胺药物新制剂的剂型为微丸时,所述辅料包括聚乙烯吡咯烷酮k30,所述水飞蓟宾葡甲胺与聚乙烯吡咯烷酮k30的质量比为(15~50):(5~20)。
13.优选的,所述微丸的制备方法包括以下步骤:
14.1)用无水乙醇溶解水飞蓟宾获得水飞蓟宾无水乙醇液,用体积浓度80%~90%的乙醇水溶液溶解葡甲胺获得葡甲胺乙醇水溶液,将所述水飞蓟宾无水乙醇液和所述葡甲胺乙醇水溶液微流混合获得水飞蓟宾葡甲胺;所述微流混合通过微流体反应器实现;
15.2)用体积浓度80%~90%的乙醇水溶液溶解聚乙烯吡咯烷酮k30获得聚乙烯吡咯烷酮k30乙醇水溶液;将水飞蓟宾葡甲胺和聚乙烯吡咯烷酮k30乙醇水溶液利用微流体系统进行即混即喷流化床上药或挤压滚圆法制含药丸心、干燥获得水飞蓟宾葡甲胺微丸。
16.优选的,当所述水飞蓟宾葡甲胺药物制剂的剂型为注射制剂时,所述辅料包括聚乙烯吡咯烷酮 c12和甘露醇。
17.优选的,所述注射制剂的制备方法包括以下步骤:
18.将聚乙烯吡咯烷酮c12、水飞蓟宾葡甲胺、甘露醇和水混合,过滤所得滤液即为水飞蓟宾葡甲胺注射制剂。
19.优选的,所述聚乙烯吡咯烷酮-c12替换为聚乙烯吡咯烷酮-k12。
20.本发明还提供了上述的水飞蓟宾葡甲胺药物制剂在制备预防和/或治疗肝衰竭、肝性脑病、非酒精性肝病和酒精性肝病中一种或多种的药物中的应用。
21.本发明的有益效果:
22.本发明提供的水飞蓟宾葡甲胺药物制剂采用高纯度(纯度≥99%)的水飞蓟宾原料,用水飞蓟宾、葡甲胺和辅料聚乙烯吡咯烷酮制备药物制剂,聚乙烯吡咯烷酮兼有助溶和促吸收的双重作用,制备获得的药物制剂生物利用度高,疗效好。
23.进一步的,当所述水飞蓟宾葡甲胺药物制剂的剂型为注射制剂时,辅料采用的是聚乙烯吡咯烷酮 k12或聚乙烯吡咯烷酮c12,聚乙烯吡咯烷酮k12或聚乙烯吡咯烷酮c12的分子量约为2000,为聚乙烯吡咯烷酮k30分子量的1/25,分子量更小,不良反应少而轻,助溶性更好;注射制剂可以控制滴药速度维持较长时间治疗药浓度,尤适于重症和/或服药不便者的治疗。
24.进一步的,本发明提供的本发明提供的水飞蓟宾葡甲胺药物制剂微丸,尤其是缓释微丸,具有吸收快、半衰期短的特性,制成缓释微丸胶囊,缓缓释药,维持较长时间的治疗血药浓度,能够拓宽治疗窗,提高疗效,减低不良反应。
25.进一步的,本发明提供的水飞蓟宾葡甲胺注射制剂,从根本上解决了口服生物利用度不高的状况,凸显了注射制剂的剂量优势,尤其是应用于防治急、危、重症肝衰竭和肝性脑病(肝昏迷),填补了临床上防、治肝衰竭和肝性脑病用药的空白,为急、危、重症肝病患者带来福音。
附图说明
26.图1为水飞蓟宾葡甲胺缓释微丸胶囊的hplc谱图;
(x sd,n=6);
##
p《0.01vs.空白组;
**
p《0.01vs.模型组;
46.图21为不同剂量水飞蓟宾葡甲胺对taa诱导he小鼠alt、ast、总胆红素的影响 (x sd,n=6);
##
p《0.01vs.空白组;
**
p《0.01vs.模型组;
47.图22为不同剂量水飞蓟宾葡甲胺对taa诱导的he小鼠血氨水平的影响(x sd,n=6);
##
p《0.01vs.空白组;
**
p《0.01vs.模型组;
48.图23为不同给药剂量水飞蓟宾葡甲胺对taa诱导的he小鼠脑组织炎症的影响 (x sem,n=6);
##
p《0.01vs.空白组;
**
p《0.01vs.模型组;
$$
p《0.01vs.给药组,其中a为tnf-α, b为il-1β;
49.图24不同剂量水飞蓟宾葡甲胺对taa诱导he小鼠脑组织gsh及mda水平的影响 (x sd,n=6);
##
p《0.01vs.空白组;
*
p《0.05,
**
p《0.01vs.模型组;
50.图25为水飞蓟宾葡甲胺对nafld大鼠肝脏组织病理变化的影响;
51.图26为水飞蓟宾葡甲胺对nafld大鼠肝脏纤维化的影响;
52.图27为水飞蓟宾葡甲胺对nafld大鼠肝脏组织肝功能(alt)的影响(x sd,n=8);
##
p《0.01vs. 空白组;
*
p《0.05,
**
p《0.01vs.模型组;
53.图28为水飞蓟宾葡甲胺对nafld大鼠肝脏tc、tg的影响(x sd,n=8);
##
p《0.01vs.空白组;
*
p《0.05,
**
p《0.01vs.模型组;
54.图29为水飞蓟宾葡甲胺对nafld大鼠中tnf-α、no的作用影响(x sd,n=8);
##
p《0.01vs. 空白组;
*
p《0.05,
**
p《0.01vs.模型组;
55.图30为水飞蓟宾葡甲胺对nafld大鼠肝脏中fxr的表达的影响(x sd,n=3);
##
p《0.01vs. 空白组;
**
p《0.01vs.模型组;
56.图31为水飞蓟宾葡甲胺对nafld大鼠肝脏ampk和ppar-γ的影响(x sd,n=3);
##
p《0.01vs. 空白组;
*
p《0.05,
**
p《0.01vs.模型组;
57.图32为水飞蓟宾葡甲胺对nafld大鼠肝脏脂肪生成代谢酶有关蛋白的影响(x sd,n=3);
##
p《0.01vs.空白组;
**
p《0.01vs.模型组;
58.图33为水飞蓟宾葡甲胺对ald小鼠肝脏组织病理变化的影响;
59.图34为水飞蓟宾葡甲胺对ald小鼠肝脏纤维化的影响;
60.图35为水飞蓟宾葡甲胺对ald小鼠肝功能(alt)的作用影响(x sd,n=8);
##
p《0.01vs. 空白组;
*
p《0.05,
**
p《0.01vs.模型组;
61.图36为水飞蓟宾葡对ald小鼠肝脏tc、tg的影响(x sd,n=8);
##
p《0.01vs.空白组;
*
p《0.05,
**
p《0.01vs.模型组;
62.图37为水飞蓟宾葡对ald小鼠il-6、tnf-α的影响(x sd,n=8);
##
p《0.01vs.空白组;
*
p《0.05,
**
p《0.01vs.模型组;
63.图38为水飞蓟宾葡甲胺对ccl4诱导小鼠急性肝损伤相关酶表达的影响;sm:水飞蓟宾葡甲胺; smt:水飞蓟宾葡甲胺片;sc:水飞蓟宾胶囊,下同;小鼠灌胃ccl410min后分别给予水飞蓟宾葡甲胺sm(2.5、5、10mg/kg);ccl4攻毒24h后检测alt(a)、ast(b)和alp(c);数据代表mean
±
sd (n=8);##与对照组比p《0.05,##与对照组比p《0.01;*p《0.05,**p《0.01与ccl4组比较;
64.图39为水飞蓟宾葡甲胺对ccl4诱导小鼠急性肝损伤软骨组织评分的影响;(a)用h&e染色ccl4诱导的急性肝损伤的代表性显微照片,sm(2.5,5,10mg/kg),smt(25mg/kg),sc
(20mg/kg)或对照组;比例尺条=100μm;数据代表mean
±
sd(n=3);##与对照组比p《0.05,##与对照组比p《0.01;*p《0.05, **p《0.01与ccl4组比较;
65.图40为水飞蓟宾葡甲胺对ccl4诱导的小鼠急性肝损伤中氧化应激表达的影响;小鼠灌胃ccl
4 10min后分别给予sm(2.5、5、10mg/kg);ccl4攻毒24h后测定血清中no(a)、mda(b)、cat(c)、 sod(d)和inos(e);数据代表mean
±
sd(n=8);##与对照组比p《0.05,##与对照组相比p《0.01;*p《0.05, **p《0.01与ccl4组比较;
66.图41为水飞蓟宾葡甲胺对ccl4诱导小鼠急性肝损伤炎症介质表达的影响;小鼠灌胃ccl410min 后分别给予sm(2.5、5、10mg/kg);ccl4攻毒24h后测定血清中tnf-α(a)、il-6(b)、il-1β(c)和 cox-2(d);数据代表mean
±
sd(n=8);##与对照组比p《0.05,##与对照组比p《0.01;*p《0.05,**p《0.01 与ccl4组比较;
67.图42为水飞蓟宾葡甲胺对ccl4诱导小鼠急性肝损伤炎症介质表达的影响;小鼠灌胃ccl410min 后分别给予sm(2.5、5、10mg/kg);ccl4攻毒24h后,检测组织匀浆中tnf-α(a)、il-6(b)、il-1β(c) 和cox-2(d);数据代表mean
±
sd(n=8);##与对照组比p《0.05,##与对照组比p《0.01;*p《0.05,**p《0.01 与ccl4组比较;
68.图43为水飞蓟宾葡甲胺对apap诱导小鼠急性肝损伤相关酶表达的影响;小鼠灌胃apap 10min 后分别给予sm(2.5、5、10mg/kg);apap攻毒24h后检测血清alt(a)、ast(b)水平;数据代表mean
±
sd (n=8);##与对照组比p《0.05,##与对照组比p《0.01;*p《0.05,**p《0.01与apap组比较;
69.图44为水飞蓟宾葡甲胺对apap诱导急性肝损伤小鼠软骨组织评分的影响;(a)用h&e染色apap 诱导的急性肝损伤的肝脏代表性显微照片,sm(2.5,5,10mg/kg),smt(25mg/kg),sc(20mg/kg) 或对照组;比例尺条=100μm;数据代表mean
±
sd(n=3);##与对照组相比p《0.05,##与对照组相比 p《0.01;*p《0.05,**p《0.01与apap组比较;
70.图45为水飞蓟宾葡甲胺对apap诱导小鼠急性肝损伤中氧化应激表达的影响;小鼠灌胃apap 10min后分别给予sm(2.5、5、10mg/kg);apap攻毒24h后测定血清btc(a)、sod(b)、mda(c) 和gsh(d);数据代表mean
±
sd(n=8);##与对照组相比p《0.05,##与对照组相比p《0.01;*p《0.05, **p《0.01与apap组比较;
71.图46为水飞蓟宾葡甲胺对apap诱导小鼠急性肝损伤炎症介质表达的影响;小鼠灌胃apap 10min后分别给予sm(2.5、5、10mg/kg);apap攻毒24h后检测血清tnf-α(a)、il-6(b)、il-1β(c) 和cox-2(d);数据代表mean
±
sd(n=8);##与对照组相比p《0.05,##与对照组相比p《0.01;*p《0.05, **p《0.01与apap组比较;
72.图47为水飞蓟宾葡甲胺对apap诱导小鼠急性肝损伤炎症介质表达的影响;小鼠灌胃apap 10min后分别给予sm(2.5、5、10mg/kg);apap攻毒24h后检测组织匀浆中tnf-α(a)、il-6(b)、il-1β(c) 和cox-2(d);数据代表mean
±
sd(n=8);##与对照组相比p《0.05,##与对照组相比p《0.01;*p《0.05, **p《0.01与apap组比较。
具体实施方案
73.本发明提供了一种水飞蓟宾葡甲胺缓释微丸胶囊新剂型,包括水飞蓟宾葡甲胺和辅料,所述水飞蓟宾葡甲胺的纯度为99%~100%;所述辅料包括聚乙烯吡咯烷酮。
74.在本发明中,所述水飞蓟宾葡甲胺的原料水飞蓟宾的来源没有特殊限定,对其纯
度要求更高。在本发明具体实施过程中,只有高纯度水飞蓟宾,才能制备出高纯度水飞蓟宾葡甲胺,高纯度水飞蓟宾葡甲胺是不能用重结晶方法获得。在本发明中水飞蓟宾葡甲胺的原料水飞蓟宾的纯度优选为99%~100%,进一步优选为不低于99.5%,更优选为99.6%~99.9%。本发明对所述水飞蓟宾的来源没有特殊限定,关键是纯度能够符合要求即可。在本发明具体实施过程中,所述水飞蓟宾葡甲胺优选的通过中国专利201710102438.4中记载的方法制备获得。
75.在本发明中,所述水飞蓟宾葡甲胺的药物新制剂的剂型优选为微丸、肠溶片或注射制剂;所述微丸优选为缓释微丸。
76.在本发明中,当所述水飞蓟宾葡甲胺药物新制剂的剂型优选为微丸时,所述辅料优选包括聚乙烯吡咯烷酮k30(pvpk30),所述水飞蓟宾葡甲胺与聚乙烯吡咯烷酮k30的质量比优选为(15~50): (5~20),进一步优选为(20~40):(10~15),更优选为30:11;所述辅料优选还包括微晶纤维素、氯化钠和蔗糖,所述水飞蓟宾葡甲胺与微晶纤维素的质量比优选为(15~50):(35~65),进一步优选为(20~40):(40~55),更优选为30:48;所述水飞蓟宾葡甲胺与氯化钠的质量比优选为(15~50): (0~15),进一步优选为(20~40):(1~6),更优选为30:3;所述水飞蓟宾葡甲胺与蔗糖的质量比优选为(15~40):(0~20),进一步优选为(20~35):(5~10),更优选为30:8。在本发明中,水飞蓟宾微丸优选还包括空白丸心,所述空白丸心的质量优选为所述水飞蓟宾质量的3~5倍,更优选为 3.5~4.5倍,最优选为4倍。
77.在本发明中,水飞蓟宾微丸或缓释微丸的制备方法优选包括但不限于用流化床丸心上药法或挤出滚圆法制备。
78.在本发明中,当所述水飞蓟宾葡甲胺药物制剂的剂型为微丸时,制备方法优选包括以下步骤:
79.1)用无水乙醇溶解水飞蓟宾获得水飞蓟宾无水乙醇液,用体积浓度80%~90%的乙醇水溶液溶解葡甲胺获得葡甲胺乙醇水溶液,将所述水飞蓟宾无水乙醇液和所述葡甲胺80%~90%乙醇水溶液微流混合获得水飞蓟宾葡甲胺;所述微流混合通过微流体反应器实现;
80.2)用体积浓度80%~90%的乙醇水溶液溶解聚乙烯吡咯烷酮k30获得聚乙烯吡咯烷酮k30乙醇水溶液;将水飞蓟宾葡甲胺和聚乙烯吡咯烷酮k30乙醇水溶液利用微流体系统进行即混即喷流化床上药或挤压滚圆法制含药丸心、干燥获得水飞蓟宾葡甲胺微丸。
81.本发明优选用无水乙醇溶解水飞蓟宾获得水飞蓟宾无水乙醇液;在本发明中,所述水飞蓟宾和无水乙醇的质量体积比优选为50g:(400~600)ml,更优选为50g:(450~550)ml,最优选为50g:500ml。
82.本发明优选用体积浓度为80%~90%的乙醇水溶液溶解葡甲胺获得葡甲胺80%~90%乙醇水溶液。本发明更优选用体积浓度85%的乙醇水溶液溶解葡甲胺获得葡甲胺85%乙醇水溶液。
83.本发明优选将所述水飞蓟宾无水乙醇液和所述葡甲胺80%~90%乙醇水溶液微流混合获得水飞蓟宾葡甲胺。在本发明中,所述微流混合优选的在微流体反应器中进行,所述微流混合的时间优选为 15~18min。本发明通过将微流混合在微流体反应器中进行,能够避免水飞蓟宾的不稳定。
84.本发明优选用体积浓度80%~90%的乙醇水溶液溶解聚乙烯吡咯烷酮k30获得聚乙烯吡咯烷酮 k3080%~90%乙醇水溶液;更优选用体积浓度85%乙醇水溶液溶解聚乙烯吡咯烷酮k30获得聚乙烯吡咯烷酮k3085%乙醇水溶液。
85.得到水飞蓟宾葡甲胺后,本发明优选将水飞蓟宾葡甲胺和聚乙烯吡咯烷酮k3080%~90%乙醇水溶液利用微流体系统进行即混即喷流化床上药或挤压滚圆法制含药丸心。在本发明中,当辅料还包括微晶纤维素、氯化钠和蔗糖时,优选先将水飞蓟宾葡甲胺、微晶纤维素、氯化钠和蔗糖混合,得到混合物,将混合物和聚乙烯吡咯烷酮k3080%~90%乙醇水溶液利用微流体系统进行即混即喷流化床上药。本发明对所述流化床上药的具体操作没有特殊限定,采用本领域公知的流化床上药操作即可。本发明在所述流化床上药后,进行干燥;所述干燥的温度优选为38~42℃,更优选为40℃,所述干燥的时间优选为12~18min,更优选为15min;所述干燥优选为热风干燥。
86.本发明所述微丸制备软材的难度在于软硬度的控制,与室内环境湿度、温度、操作速度密切相关;并且直接影响挤压成条;制备微丸的挤出孔板优选为0.8mm,挤出转速优选为30rpm,本发明中切割滚圆的特征在于滚圆的转速对微丸的圆整度影响较大,虽然只有10分钟,要适度控制梯度增速是关键,滚圆转速梯度优选为1500rpm,2min;1800rpm,3min;2100rpm,5min。
87.本发明在所述干燥后,优选的还包括包裹缓释助剂的步骤。本发明优选的将上述步骤制备获得的微丸置于包括缓释助剂和95%乙醇的溶液中进行包衣;本发明在所述包衣结束后,微丸增重优选为 5%~20%,进一步优选为7%~10%,更优选为8%;所述包衣的原材料优选包括12h缓释剂;所述12h 缓释剂优选包括乙基纤维素、葵二酸二丁酯和聚乙烯吡咯烷酮k30;所述葵二酸二丁酯与乙基纤维素质量比优选为1:(0.1~0.3),更优选为1:0.13;所述聚乙烯吡咯烷酮k30与乙基纤维素质量比优选为1:(0.1~0.4),更优选为1:0.25;所述包衣原材料在溶液中的固含量优选为5%~15%,更优选为 6%。本发明所述乙基纤维素优选作为成膜剂,所述葵二酸二丁酯优选作为增塑剂,所述聚乙烯吡咯烷酮k30优选作为致孔剂和粘合剂。
88.在本发明中,所述包衣时的喷枪压力优选为0.12mp、蠕动泵转速优选为2.2rpm、温度优选为32℃、风机频率优选为35~38hz,包衣的过程优选为3h。水飞蓟宾葡甲胺是对水、时间、温度都很敏感,直接影响微丸的质量和产品的质量。
89.本发明在所述包衣结束后,优选的进行干燥,所述干燥优选为真空干燥,所述真空干燥的温度优选为38~42℃,更优选为40℃,所述真空干燥的时间优选为1.5~2.5h,更优选为2h。
90.真空干燥后,本发明优选将水飞蓟宾葡甲胺缓释微丸装胶囊,得水飞蓟宾葡甲胺缓释微丸胶囊。
91.水飞蓟宾葡甲胺是对水、时间、温度敏感,严重影响原料及其缓释微丸剂型的研发,本发明采用微流体反应/双微流体反应设备,解决了水飞蓟宾葡甲胺缓释微丸制备的技术难题。
92.在本发明中,当所述水飞蓟宾葡甲胺药物制剂的剂型为注射制剂时,所述辅料优选包括聚乙烯吡咯烷酮c12(pvpc12)和甘露醇;所述水飞蓟宾葡甲胺、聚乙烯吡咯烷酮c12(pvpc12)和甘露醇的质量比优选为(60~80):(20~40):(0~20),更优选辅料为50质量份
的飞蓟宾葡甲胺和20 质量份的聚乙烯吡咯烷酮c12(pvpc12);所述注射制剂的制备原料优选还包括注射用水;所述注射用水优选包括10℃~15℃新鲜注射用水;所述注射制剂中的聚乙烯吡咯烷酮c12优选还可以替换为聚乙烯吡咯烷酮k12,聚乙烯吡咯烷酮c12替换为聚乙烯吡咯烷酮k12为本发明可替代的方案,但考虑到聚乙烯吡咯烷酮c12的无菌性能更好,本发明最优选的辅料为聚乙烯吡咯烷酮c12。本发明所述聚乙烯吡咯烷酮c12优选购自亚什兰(中国)投资有限公司。本发明通过选择无菌材料聚乙烯吡咯烷酮c12和聚乙烯吡咯烷酮k12作为水飞蓟宾葡甲胺注射制剂的辅料,可以提高注射制剂的安全性。本发明对所述注射用水的制备方法没有特殊限定,采用本领域常规注射用水的制备方法即可。
93.在本发明中,当所述水飞蓟宾葡甲胺药物制剂的剂型为注射制剂时,制备方法优选的包括以下步骤:将水飞蓟宾葡甲胺、辅料和水混合,过滤收集滤液,作为水飞蓟宾葡甲胺注射制剂;当辅料为聚乙烯吡咯烷酮c12时,即将聚乙烯吡咯烷酮c12、水飞蓟宾葡甲胺和水混合;当辅料为聚乙烯吡咯烷酮c12和甘露醇时,即将聚乙烯吡咯烷酮c12、水飞蓟宾葡甲胺、甘露醇和水混合。
94.本发明优选用水溶解聚乙烯吡咯烷酮c12;所述水的温度优选为10~15℃,所述溶解优选为伴随搅拌,本发明对所述搅拌的转速没有要求,能够实现溶解即可。
95.在本发明中,用水溶解聚乙烯吡咯烷酮c12后,优选的将溶解后的聚乙烯吡咯烷酮c12和水飞蓟宾葡甲胺混合,最后用水定容。本发明在所述定容后,进行过滤,所述过滤优选为错流过滤,所述错流过滤滤网的孔径优选为0.2μm。
96.本发明优选循环过滤2~4min后,再收集滤液。本发明在收集滤液后,优选进行分装、冻干、扎盖包装和检验,得到的冻干粉为水飞蓟宾葡甲胺注射制剂。在本发明中,所述分装优选为将滤液分装至西林瓶中,装液量优选为1.0ml;所述分装后,悬塞。本发明将所述西林瓶置于冷冻干燥机中进行冻干,所述冷冻干燥机优选的预冷至-50~-60℃;本发明所述冻干的程序优选的如下:冷冻1.5~2.5h 后,干燥18~22h,升温至20~25℃干燥1.5~2.5h;再次升温至34~36℃干燥1.5~2h,然后压紧。在本发明具体实施过程中,优选的将西林瓶置于预冷至-50℃的冷冻干燥机中,冷冻2h后,开始干燥20h,再升至25℃干燥2h,升温至35℃干燥2h,压紧冻干产品。在本发明中,所述扎盖包装优选的包括取出压紧的冻干产品、扎盖、贴标签、分装、包装、入库。在本发明中,所述检验优选的按临床研究用质量标准进行全检,各项检测结果均应符合规定。
97.本发明还提供了所述的水飞蓟宾葡甲胺药物制剂在制备预防和/或治疗肝衰竭、肝性脑病、非酒精性肝病和酒精性肝病中的一种或多种的药物中的应用;所述肝性脑病优选包括急肝性脑病、危肝性脑病和重症肝性脑病。
98.本发明优选还提供了所述的水飞蓟宾葡甲胺药物制剂在制备预防和/或治疗药物性肝损伤的药物中的应用。在本发明中,所述的水飞蓟宾葡甲胺药物制剂微丸和注射制剂对于肝衰竭、肝性脑病、非酒精性肝病和酒精性肝病均有效,本发明提供的不同剂型各有其适应症;注射制剂在剂量上具有明显的优势,更适合临床急、重、危症患者的治疗。
99.在本发明中,所述的水飞蓟宾葡甲胺药物制剂用于包括但不限于预防和治疗肝衰竭-肝性脑病等急、重、危症肝病患者有明显的疗效,填补了国内外该领域空白。
100.水飞蓟宾葡甲胺注射制剂用于防治急、重、危症肝衰竭和肝性脑病等肝病患者的急性肝衰竭 (acute liver failure,alf)或严重肝功能损害,出现以黄疸、腹水、肝性脑病
和凝血功能障碍等为主要表现的临床综合征。
101.水飞蓟宾葡甲胺(sm)注射制剂对d-galn/lps诱导的急性肝衰竭小鼠具有明显的防治作用:对d-galn/lps诱导的小鼠急性肝衰竭模型,sm可显著降低小鼠死亡率,改善肝脏功能,降低小鼠总胆红素、alt、ast水平,与上市药物n-乙酰半胱氨酸(nac)相比,sm 5mg/kg降酶作用显著优于nac(1.04g/kg),后者剂量为前者的208倍;sm可显著提高小鼠肝组织gsh,sod,cat水平,降低inos,mda水平,sm 5mg/kg对mda的抑制优于nac,其他指标与nac相当;sm可显著降低tnf-α,il-6,il-1β水平,升高il-10水平,其中sm 5mg/kg对tnf-α、il-6水平的降低作用显著优于nac,其他指标与nac相当;sm可促进肝脏再生,与nac相比,作用更显著。
102.水飞蓟宾注射制剂改善d-galn/lps诱导的小鼠急性肝衰竭,sm与gsk-3β具有较强结合力, sm可能通过gsk-3β/β-catenin-nf-κb通路调节炎症反应;sm可能通过抑制gsk-3β活性,调节β-catenin蛋白表达,调节nf-κb通路,从而发挥抗炎作用。sm改善taa诱导的小鼠肝性脑病的药效学。
103.sm对taa诱导肝性脑病中,sm在静脉注射给予2.5、5mg/kg剂量,可显著改善肝脏功能,降低小鼠血氨、alt、ast水平,与上市药物门冬氨酸鸟氨酸(oa,1.3g/kg)和多烯磷脂酰胆碱(ppc, 60.45mg/kg)相比,5mg/kg剂量注射sm优于oa,与ppc相当;sm 5mg/kg注射剂量下可发挥抗炎作用,显著降低小鼠血浆炎症水平,抗炎作用优于oa,次于ppc;sm 2.5、5mg/kg剂量,可显著提高小鼠脑组织gsh水平,降低mda水平,sm 5mg/kg与oa,ppc相当;sm 5mg/kg可显著抑制神经炎症,降低肝性脑病小鼠脑组织炎症水平,抑制率与oa、ppc相近,无统计学意义。
104.水飞蓟宾葡甲胺微丸、缓释微丸和注射制剂改善taa诱导的小鼠肝性脑病的药效学;sm静脉注射能够提高肝性脑病小鼠的生存率,注射组生存率高于口服组;sm静脉注射2.5mg/kg及口服20、 40mg/kg均能有效改善肝脏功能,其中静脉注射2.5mg/kg组抑制血氨、ast水平升高的作用优于sm 口服20、40mg/kg组;sm静脉注射2.5mg/kg及口服20、40mg/kg均能有效抑制外周炎症,作用相似;sm静脉注射2.5mg/kg及口服20、40mg/kg均能提高小鼠脑抗氧化应激及抗炎作用,其中对脑组织il-1β、il-6的抑制作用优于口服20、40mg/kg。
105.水飞蓟宾葡甲胺微丸、缓释微丸和注射制剂对肝衰竭与肝性脑病的防治均有效,各有其适应症。注射制剂在剂量上具有明显的优势,更为临床急、重、危症患者带来福音;sm可显著改善小鼠急性肝衰竭,是通过抑制gsk-3β-nf-κb信号通路的激活途径发挥抑制炎症的作用。
106.sm缓释微丸用于治疗包括但不限于防治非酒精性和酒精性肝病。所述非酒精性肝病(nafld) 是一种无过量饮酒史、由多种病因诱导的肝实质细胞脂肪变性和脂肪积聚过多的临床病理综合征;sm 对非酒精性脂肪肝大鼠的药效:sm对nafld大鼠的药效:给药后,第2周时,模型组肝功能与血脂指标均有显著性差异,sm高剂量组有降低tg、tc作用。各干预组均显著降低炎症因子;第四周时,sm(高剂量)组降低tg和tc,作用与smt相当,略低于tc;均显著降低血清中no的水平;第6周时,sm表现出显著改善血脂、肝功能、氧化应激,也有显著的抗炎作用。sm(高剂量) 组在降低肝脏指数、改善组织,且优于smt,与sc相当。在降低血清alt、tg高于smt,相当或略低于sc;sm(高剂量)组抗氧化应激的作用较好。sm在抑制血清tnf-α、no较好,并表现出一定的量-效关系。sm可显著改善nafld大鼠的胰岛素抵抗作用,高
剂量组作用好于阳性药组。综合评价:sm可改善nafld,作用强于(smt),与(sc)相当。
107.水飞蓟宾葡甲胺sm对nafld脂肪肝大鼠的作用机制,sm可能通过激活fxr,下调srebp-1c,增加pi3k/akt磷酸化的活性,改善nafld大鼠肝脏脂质蓄积和胰岛素抵抗。
108.sm对酒精性肝病小鼠的药效学研究:酒精性肝病(ald)是指由于长期大量嗜酒导致的肝脏疾病,发病进程包括酒精性脂肪肝、肝炎、肝纤维化、肝硬化、肝癌等。sm改善急性ald小鼠肝组织学,sm中剂量组疗效最好。sm可降低急性酒精性肝损伤小鼠血脂tg,降低肝脏tg、tc和脂质过氧化产物mda;作用与smt相当,强于sc。sm可显著抑制血清与肝脏炎症,作用与smt相当,略低于sc。sm对急性大量酒精的摄入具有明显的保肝作用。sm对慢性酒精性肝病小鼠的药效学: sm改善肝脏组织学,降低慢性酒精性肝病小鼠血清中的alt、tg和tc,降低肝脏tg含量,并使肝脏指数降低,作用与阳性药相似;sm高剂量组可增加gsh、sod的活性,作用比smt、sc好;显著降低肝脏中的mda、降低no的含量,作用与smt、sc相当;sm高剂量组可显著抑制血清和肝脏炎症,作用优于smt、sc。
109.sm对慢性酒精性肝病小鼠的作用机制:sm可抑制慢性ald小鼠srebp-1c以及ppar-γ的表达水平,进而抑制脂肪合成与代谢相关基因fas和acc的表达,减少肝脏脂质蓄积。sm还可降低 sma的含量,表明可抑制肝纤维化的早期过程。sm对nafld和ald的药效学的综合评价:sm 可降低肝脏脂质蓄积,改善组织学,与空白组相比无统计学意义;sm对nafld的作用优于smt,与sc相当;sm改善急性ald组织学,中剂量较好;对急性ald作用与smt相当,优于sc;sm 显著改善慢性ald组织学。sm对慢性ald作用优于smt和sc;相比于nafld,sm对ald模型血脂、组织学、肝功能以及氧化应激的改善作用更好。
110.sm对nafld和ald的作用机制:sm可能通过激活fxr,下调srebp-1c,增加pi3k/akt 磷酸化的活性,改善nafld大鼠肝脏脂质蓄积和胰岛素抵抗;sm可能通过下调srebp-1c/pparγ改善ald小鼠的肝脏脂质蓄积。
111.本发明提供的水飞蓟宾葡甲胺微丸,能够提高生物利用度,增强疗效,降低不良反应,减少服药次数,提高患者的顺应性,适用于广大非急、危、重症患者或预后有发展急、危、重症趋势患者的临床治疗的迫切需求;既可以治疗,又可以预防;注射用水飞蓟宾葡甲胺新剂型尤适于急、危、重症肝衰竭、肝性脑病(肝昏迷)患者的临床治疗,注射制剂不仅仅是增加剂型提高生物利用度,更重要是与口服缓释微丸胶囊,优势互补,相得益彰。
112.本发明提供的水飞蓟宾葡甲胺注射制剂从根本上解决了口服水飞蓟宾生物利用度不高的状况,凸显了注射制剂的剂量优势,尤其适用于防治急、危、重症肝衰竭和肝性脑病(肝昏迷),填补了临床上防、治肝衰竭和肝性脑病用药的空白,为急、危、重症肝病患者带来福音。
113.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
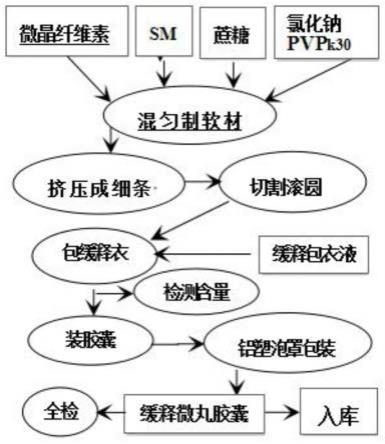
114.实施例1水飞蓟宾葡甲胺缓释微丸胶囊的制备
115.处方规格:水飞蓟宾葡甲胺150.0mg/粒,组成为:
116.(1)缓释微丸芯处方:
[0117][0118][0119]
(2)缓释包衣液处方
[0120][0121]
(3)工艺过程
[0122]
①
、原辅料预处理
[0123]
原辅料分别过80目筛,并称取处方量,备用;
[0124]
取pvpk30以60%乙醇溶解制成5wt.%pvpk30乙醇溶液;
[0125]
取缓释12h包衣材料(乙基纤维素、葵二酸二丁酯、pvpk30和60%乙醇)适量加纯化水制成12wt.%的悬浊液,使其充分溶胀;
[0126]
②
、混料与制软材
[0127]
按处方称取水飞蓟宾葡甲胺、微晶纤维素、蔗糖、氯化钠按等量递增的原则加入高速混合机中,开机混合3~4min,直至原辅料加完,再开机混合8min;缓缓加入5%pvpk3060%乙醇液,制成软材 (较常规略偏干);
[0128]
③
、挤压成条、切割滚圆
[0129]
将软材放入挤压机内,挤压成细条;轻轻将细条移至切割滚圆机内,按设定的转速将细条切割滚圆成微丸;
[0130]
④
、烘干、整粒、测微丸含量工序
[0131]
取上述湿微丸置40℃烘箱中烘干2h,整粒、测定水飞蓟宾葡甲胺的含量(烘干后的微丸含水飞蓟宾葡甲胺应为36.0wt.%~38.0wt.%);
[0132]
⑤
、包缓释12h缓释衣
[0133]
取合适微丸,用预配的浓度为12wt.%的缓释包衣液,包缓释衣至微丸增重7%~8%,包衣结束后在38~42℃中进行真空干燥2h,得到缓释微丸。
[0134]
⑥
、测缓释微丸含量
[0135]
测定包衣好的缓释微丸中水飞蓟宾葡甲胺的含量。
[0136]
⑦
、装胶囊
[0137]
根据测得的缓释微丸中水飞蓟宾葡甲胺的含量,计算应装缓释微丸的重量,分装于1号空胶囊 (150mg主药/粒,重量差异应控制在合适的范围内)。
[0138]
⑧
、包装工序
[0139]
将缓释微丸胶囊分装于铝塑(3.2pvp/铝)泡罩包装内,每板7粒;连同使用说明书装在玻璃卡纸小盒内;
[0140]
⑨
、包装、入库、抽样全检
[0141]
每20小盒用热缩塑料膜做成中包装;每20捆做成一个大包装卡伦纸箱,印好批号和生产日期后入成品库。
[0142]
实施例2
[0143]
注射用水飞蓟宾葡甲胺的制备
[0144]
处方:
[0145][0146][0147]
制备方法:
[0148]
1、配制取pvpc12加新鲜制备的10~15℃注射用水900ml搅拌使溶解,再加高纯度水飞蓟宾葡甲胺搅拌使溶解,加新鲜制备的10℃~15℃注射用水至1000ml,用0.2μm错流精滤,先循环过滤3min 再过滤收集滤液。
[0149]
2、分装分装于7ml中硼硅西林瓶中,每瓶装1.0ml(25mg),悬塞。
[0150]
3、冻干将装药西林瓶立即置已预冷至-50℃的冷冻干燥机中,冷冻2h后,开始干燥20h,再升至25℃干燥2h,升温至35℃干燥2h,压塞。
[0151]
4、扎盖包装取出压紧塞的冻干产品、扎铝塑复合盖、贴标签、包装、入库。
[0152]
5、全检按临床研究用质量标准,抽样进行全检,各项检测结果均应符合规定。
[0153]
注:本品的制备方法已放大到4万瓶试生产验证,各技术参数可行,收率略有提高。
[0154]
实施例3
[0155]
注射用水飞蓟宾葡甲胺(sm)防治急性肝衰竭的药效学研究(iv)
[0156]
实验方法:
[0157]
(1)实验动物
[0158]
实验动物为c57bl/6j雄性小鼠,体重22~25g,8周龄,spf级,购于扬州大学比较医学中心,符合普通实验动物质量标准。许可证号syxk(苏)2018-0019。小鼠分笼饲养,自由饮水进食,饲养室温23~25℃,相对湿度40~80%。
[0159]
(2)动物分组和药物干预
[0160]
将c57bl/6j小鼠随机分为6组,分别为空白组、模型组、sm 1.25mg/kg、sm 2.5mg/kg、sm 5 mg/kg、乙酰半胱氨酸注射液组(nac组1.04g/kg)。采用d-galn(500mg/kg)联合10lps(μg/kg) 溶液腹腔注射小鼠诱导急性肝衰竭模型,造模前sm给药组分别以1.25mg/kg、2.5mg/kg、5mg/kg 三种剂量连续3天静脉注射(实施例2中制备获得的水飞蓟宾葡甲胺注射制剂)。nac组以1.04g/kg 进行干预,方法同sm组,空白组、模型组给予等剂量生理盐
水。第3次给药后间隔0.5h腹腔给予 d-galn/lps进行造模(空白组以等剂量生理盐水腹腔注射)。每组有25只小鼠,其中每组9只在 d-galn/lps处理后监测24小时,统计存活率及生存时间;其余在d-galn/lps处理后6h取血和组织用于检测。
[0161]
实验结果:
[0162]
(1)sm对d-galn/lps诱导的小鼠急性肝衰竭模型死亡率的影响
[0163]
通过对不同组小鼠腹腔注射d-galn/lps后24h内小鼠的存活率及存活时间进行统计,图6结果显示模型组小鼠在注射后4.5h开始出现死亡,于7小时死亡率达100%。相比于模型组,预先注射 sm可显著延长alf小鼠的生存时间,降低死亡率。其中sm(5mg/kg)可显著提高alf小鼠存活率达44%,存活率比nac组高。
[0164]
(2)sm对d-galn/lps诱导的小鼠急性肝衰竭模型的总胆红素、alt、ast的影响
[0165]
图7结果显示,与空白组相比,模型组小鼠总胆红素显著增加。sm组以剂量依赖性显著抑制总胆红素。模型组小鼠的alt和ast水平显著增加,而不同给药剂量sm显著或非常显著降低模型小鼠alt和ast的水平。
[0166]
(3)sm对d-galn/lps诱导的小鼠急性肝衰竭模型的肝组织中gsh、sod、cat、mda、inos 的影响
[0167]
图8~10结果显示,与空白组相比,模型组小鼠肝组织中gsh、sod、cat的含量显著降低,模型组小鼠肝组织中mda、inos显著升高。与模型组比较,sm组可显著逆转肝组织gsh、sod、 cat、mda、inos的活性,其中sm以剂量依赖性提高gsh水平。
[0168]
(4)sm对d-galn/lps诱导的小鼠急性肝衰竭模型血清中tnf-α、il-6、il-1β、il-10的影响
[0169]
采用elisa检测小鼠血清中tnf-α、il-6、il-10和il-1β的含量来评估alf小鼠的炎症水平。图11和12结果显示,与空白组相比,模型组小鼠的血清中tnf-α、il-6和il-1β含量明显升高,而 il-10的含量明显降低,sm组小鼠可明显逆转炎症因子的含量。统计结果显示sm对tnf-α、il-6 抑制作用显著优于nac。
[0170]
上述实验结果表明:水飞蓟宾葡甲胺注射制剂可降低d-galn/lps诱导急性肝衰竭模型小鼠的死亡率,sm具有明显的抗氧化应激能力,可有效增强肝细胞清除自由基的能力,减轻肝细胞过氧化损伤,且可有效调节炎症反应,抑制肝脏炎症介质的过度产生。
[0171]
实施例4
[0172]
注射用水飞蓟宾葡甲胺(sm)注射制剂改善急性肝衰竭的作用机制的研究
[0173]
实验方法:
[0174]
通过反向分子对接技术筛选到结合的蛋白,综合分子间的相互作用力及与sm的活性位点的结合情况,筛选出gsk3β作为d-galn/lps-alf的潜在靶点。并通过蛋白免疫印迹法检测肝脏组织中相关蛋白的表达情况,对潜在靶点及相关信号通路进行初步的验证。
[0175]
实验结果:
[0176]
(1)sm与gsk3β蛋白的分子对接结果
[0177]
从分子水平上探讨sm与gsk3β的结合的亲和性,图13中橙色部分代表gsk3β蛋白,黄色部分代表sm分子。再次使用对接姿态进行软件分析,将二者相互作用区域进行计算机二维平面投影,遴选可能的氨基酸位点。其中绿色代表侧链氢键,蓝色代表骨架氢键,紫色代表金属离子键,sm与19 个氨基酸具有较强的氢键相互作用。结果提示sm与gsk3β存在着
高亲和性结合的可能性。
[0178]
(2)sm对d-galn/lps诱导的alf小鼠肝脏组织中p-gsk3β蛋白表达的影响
[0179]
采用蛋白免疫印迹法检测alf小鼠肝脏组织中p-gsk3β蛋白表达以考察sm对gsk3β的活性的影响。如图14所示,与空白组相比,模型小鼠肝脏组织中p-gsk3β表达显著降低;给予sm后,与模型相相比,sm组小鼠肝组织中gsk3β磷酸化水平显著提高,表明gsk3β活性受到明显抑制,而 nac组无显著变化。
[0180]
(3)sm对d-galn/lps诱导的alf小鼠肝脏组织中β-catenin蛋白表达的影响
[0181]
考察sm抑制gsk3β的活性后,是否影响下游的β-catenin蛋白的表达。图15结果显示与空白组相比,模型小鼠肝脏组织中β-catenin表达显著降低,表明gsk3β活性的升高导致了细胞中β-catenin 的降解。给予sm后,与模型相相比,sm组小鼠肝组织中β-catenin含量显著提高,与gsk3β活性的降低相对应。
[0182]
(4)sm对d-galn/lps诱导的alf小鼠肝脏组织中nf-κb通路p65蛋白磷酸化的影响
[0183]
考察sm是否影响d-galn/lps诱导的alf小鼠肝脏组织中p65蛋白磷酸化表达。图16结果显示与空白组相比,模型小鼠肝脏组织中p65磷酸化水平显著提高。相比于模型组,sm组小鼠肝组织中p-p65含量显著降低。
[0184]
上述实验结果表明:sm可显著改善小鼠急性肝衰竭,是通过抑制gsk-3β-nf-κb信号通路的激活途径发挥抑制炎症的作用。
[0185]
实施例5
[0186]
sm不同给药方式改善taa-he药效学研究
[0187]
实验方法:
[0188]
(1)实验动物
[0189]
实验动物为icr雄性小鼠,体重25~28g,8周龄,spf级,购于扬州大学比较医学中心,符合普通实验动物质量标准。许可证号scxk(苏)2018-0004。小鼠分笼饲养,自由饮水进食,饲养室温23-25℃,相对湿度40~80%。
[0190]
(2)实验分组和药物干预
[0191]
i.v.:静脉注射
[0192]
i.g.:口服给药
[0193]
将icr小鼠随机分为8组:空白组、模型组、sm(i.v.1.25mg/kg)组,sm(i.g.2.5mg/kg)组、 sm(i.g.5mg/kg)组、sm(i.g.10mg/kg)组、sm(i.g.20mg/kg)组、sm(i.g.40mg/kg)组,腹腔注射taa诱导he模型,s空白组与模型组按同等剂量给予相应溶液。以10ml/kg小鼠体重的剂量连续2d腹腔注射taa(200mg/kg)诱导he模型,sm(i.v.2.5mg/kg)组在第2d注射taa的同时静脉注射sm,连续3d,1次/d。其余sm给药组第2d注射taa的同时灌胃口服sm,连续3d, 1次/d。在第三次给予sm后1h后取材,空白组与模型组按同等剂量给予相应溶液。
[0194]
实验结果:
[0195]
(1)sm不同给药方式对taa诱导的he小鼠相关转氨酶水平(alt、ast)的影响
[0196]
图17结果显示,注射sm(2.5mg/kg)和口服sm(20mg/kg和40mg/kg)均可显著减少he小鼠血清中的alt、ast的含量,说明注射sm(2.5mg/kg)和口服sm(20mg/kg、40mg/kg)是改善taa诱导的he小鼠肝功能的有效剂量,且口服剂量为注射制剂量的8倍及16倍。
[0197]
(2)sm不同给药方式对taa诱导的he小鼠血氨的影响
[0198]
图18结果显示,注射sm(2.5mg/kg)和口服sm(20mg/kg和40mg/kg)均显著降低he小鼠血氨水平,其对血氨的抑制率分别为22.48、%18.41%、20.05%。
[0199]
(3)sm不同给药方式对taa诱导的he小鼠脑组织炎症水平(tnfα、il-6、il-1β)的影响
[0200]
通过elisa检测脑组织中tnf-α、il-1β与il-6水平以考察sm口服给药对神经炎症的影响。图 19结果显示注射sm(2.5mg/kg)和口服sm(20mg/kg和40mg/kg)均可显著降低脑组织中的tnf-、 il-1β与il-6水平,sm(2.5mg/kg)与口服sm(20mg/kg、40mg/kg)的抑制作用相当。
[0201]
(4)sm不同给药方式对taa诱导的he小鼠脑组织gsh和mda的影响
[0202]
通过检测脑组织中gsh和mda的含量,图20结果显示注射sm(2.5mg/kg)和口服sm(20mg/kg) 可显著提高脑组织中gsh的水平,降低mda含量,注射sm(2.5mg/kg)与口服sm(20mg/kg、 40mg/kg)组作用相当。
[0203]
上述实验结果表明:口服高剂量组和注射组均可显著改善肝脏功能,降低小鼠血氨、alt、ast 水平;发挥抗炎作用,显著降低小鼠血浆炎症水平;sm口服高剂量亦可减轻taa诱导的he小鼠脑组织中过度氧化应激损伤。
[0204]
实施例6
[0205]
注射用水飞蓟宾葡甲胺(sm)注射制剂改善taa-he的药效学研究
[0206]
实验方法:
[0207]
(1)实验动物
[0208]
实验动物为icr雄性小鼠,体重25~28g,8周龄,spf级,购于扬州大学比较医学中心,符合普通实验动物质量标准。许可证号scxk(苏)2018-0004。小鼠分笼饲养,自由饮水进食,饲养室温23~25℃,相对湿度40~80%。
[0209]
(2)动物分组和药物干预
[0210]
将icr小鼠随机分为7组,分为空白组、模型组、sm 1.25mg/kg、sm 2.5mg/kg、sm 5mg/kg、 oa组及ppc组。连续2d腹腔注射taa(200mg/kg)诱导he模型,空白组以等剂量生理盐水腹腔注射。sm组以(1.25mg/kg、2.5mg/kg、5mg/kg)三种剂量静脉注射,门冬氨酸鸟氨酸组(oa组) 以1.3g/kg干预,多烯磷脂酰胆碱组(ppc组)以60.45mg/kg干预。每组有20只小鼠,其中每组6 只在最后一次给药后间隔1h考察行为学,其余小鼠取血及组织用于生化或分子检测。
[0211]
实验结果:
[0212]
(1)不同给药剂量sm对taa诱导的he小鼠alt、ast、总胆红素的影响
[0213]
通过检测转氨酶和总胆红素的水平来评估sm对he小鼠肝功能的影响,图21结果显示与空白组相比,模型组alt、ast和总胆红素水平显著升高。与模型组相比,sm组可有效降低alt、ast、总胆红素的水平。其中sm(5mg/kg)对alt抑制率为31.91%,显著高于门冬氨酸鸟氨酸组(oa 组8.45%),与多烯磷脂酰胆碱组(ppc组31.59%)相当;对ast抑制率为39.52%,高于oa组(22.45%)。
[0214]
(2)不同给药剂量sm对taa诱导的he小鼠血氨水平的影响
[0215]
图22结果显示,与空白组相比,模型组中血氨的水平显著升高。sm(2.5mg/kg、5mg/kg)组可显著抑制血氨升高。其中sm(5mg/kg)组对血氨抑制率达28.78%,高于门冬氨酸鸟
氨酸组及多烯磷脂酰胆碱组(oa组23.97%、ppc组17.83%)。
[0216]
(3)不同给药剂量sm对taa诱导的he小鼠脑组织炎症的影响
[0217]
通过elisa测定小鼠脑组织中的tnf-α和il-1β的水平。图23结果显示,与空白组相比,模型组小鼠组织中tnf-α和il-1β含量明显升高,sm组明显降低。sm(5mg/kg)、门冬氨酸鸟氨酸组(oa 组)及多烯磷脂酰胆碱组(ppc组)对tnf-α抑制率分别为19.04%、7.42%、16.97%,对il-1β的抑制率分别为21.03%、2.36%、33.55%。
[0218]
(4)不同给药剂量sm对taa诱导的he小鼠脑组织gsh及mda水平的影响
[0219]
通过检测小鼠脑组织中gsh活性以及mda的含量,评估sm对he小鼠脑组织氧化应激的影响。图24结果所示,模型小鼠脑组织gsh活性显著降低,mda水平显著升高;相比于模型组,sm (2.5mg/kg、5mg/kg)及门冬氨酸鸟氨酸组(oa组)、多烯磷脂酰胆碱组(ppc组)均可显著增强 gsh活性,降低mda含量。
[0220]
上述实验结果表明:sm注射制剂可显著改善肝脏功能,降低小鼠血氨、alt、ast水平;能显著降低小鼠血浆炎症水平进而发挥抗炎作用;显著提高小鼠脑组织gsh水平,降低细胞的损伤程度。
[0221]
实施例7
[0222]
水飞蓟宾葡甲胺(sm)缓释微丸防治非酒精性肝病的药效学及作用机制的研究(i.g.)
[0223]
实验方法:
[0224]
(1)实验动物
[0225]
spf级雄性sprague dawley(sd)大鼠,8周龄,180~200g;购买于青龙山动物繁殖场。大鼠清洁级环境饲养,给予充分营养的饲料以及足够的水;湿度为50%,温度24℃,光暗周期为12h/12h。动物许可证号为scxk(苏)2014-0001。
[0226]
(2)动物分组和药物干预
[0227]
大鼠随机分成7组,分别为空白组(空白)、模型组(模型)、给药组(低剂量3.5mg/kg、中剂量7mg/kg、高剂量14mg/kg)在以及阳性药组(水飞蓟宾葡甲胺片smt、水飞蓟宾胶囊sc)。空白对照组给予普通饲料,nafld模型大鼠饲喂高脂饲料hfd(10%猪油、2%胆固醇、0.2%胆盐、5%蔗糖、5%蛋黄粉和77.8%普通饲料)和丙硫氧嘧啶(60mg/kg/d)。
[0228]
实验结果:
[0229]
(1)sm对nafld大鼠肝脏组织病理变化的影响
[0230]
sm干预hfd喂养的大鼠6周后,采集肝脏的外观照片,并进行肝组织的he染色。如图25所示,相比于空白组,模型组肝脏外形变成淡棕黄色,肝脏体积肥大;he染色中有大量空泡化脂滴和炎性细胞的浸润,中心静脉周围的细胞排布无序,说明已形成明显的脂肪肝。与模型组相比,sm高剂量组显著减少空泡化的脂滴和炎性细胞的浸润,中央静脉周围的细胞有放射状排布的变化,肝脏指数降低,药效与阳性药sc相当,sm高剂量组降低肝指数的药效优于smt。
[0231]
(2)sm对nafld大鼠肝脏纤维化的影响
[0232]
为观察sm对肝脏脂质和纤维化的作用,取各组肝组织分别进行油红染色和天狼星红染色。图 26为油红染色图,与空白组相比,模型组肝脏存在大量的大小块脂滴;与模型组相比,sm高剂量组可减少肝脏的大块油滴,与阳性药smt和sc相当。在天狼星红染色图中模
型组的肝组织的胶原纤维比空白组多,与模型组相比,sm高剂量组明显抑制肝脏胶原纤维生成,抑制纤维化。
[0233]
(3)sm对nafld大鼠肝脏组织肝功能(alt)的影响
[0234]
sm干预hfd喂养的大鼠6周后,通过生化检测方法检测肝功能酶。如图27所示,与空白组相比,模型组中alt含量明显升高;与模型组比较,sm显著降低alt含量,sm高剂量组的作用与阳性药sc相当,优于smt。
[0235]
(4)sm对nafld大鼠肝脏tc、tg的影响
[0236]
sm干预hfd喂养的大鼠6周后,通过生化检测方法检测血脂中tc和tg。如图28为所示,与空白组相比,模型组中的tc、tg的含量都有明显升高;与模型组比较,sm显著降低tc、tg的含量,sm高剂量组的作用与阳性药sc相当,优于smt。
[0237]
(5)sm对nafld大鼠中tnf-α、no的作用影响
[0238]
采用elisa方法检测肝脏中tnf-α和no的含量。图29结果显示,与空白组比较,模型组中的 tnf-α水平和no的含量增加;与模型组相比,sm可显著降低组织中tnf-α水平,作用与阳性药smt 和sc相当。sm降低血清中no的水平,sm高剂量组在血清中的作用与阳性药smt和sc相当。
[0239]
(6)sm对nafld大鼠肝脏中fxr的表达的影响
[0240]
图30免疫印迹结果显示,与空白组相比,hfd诱导的nafld大鼠肝脏fxr的蛋白表达量明显减少。药物干预显示,sm高剂量组、smt和sc都可以显著增加肝脏fxr的表达。
[0241]
(7)sm对nafld大鼠肝脏ampk和ppar-γ的影响
[0242]
图31免疫印迹结果显示,与空白组相比,模型组肝脏ampk的蛋白表达降低,ppar-γ蛋白含量显著增加。sm高剂量组可增加ampk的蛋白表达量,但没有统计学意义,smt可显著增加ampk 的蛋白含量。sm高剂量组、smt和sc都可以显著降低肝脏ppar-γ的蛋白表达。
[0243]
(8)sm对nafld大鼠肝脏脂肪生成代谢酶有关蛋白的影响
[0244]
图32免疫印迹结果显示,与空白组相比,模型组肝脏srebp-1c和fas的蛋白表达量明显增加。药物干预后,sm高剂量组、smt和sc都可以显著抑制srebp-1c和fas的蛋白表达。
[0245]
上述实验结果表明:sm可显著改善nafld大鼠肝脏纤维化、肝功能指标(alt)、血脂(tc、 tg),也有显著的抗炎(tnf-α、no)作用;sm可能通过激活fxr,上调ampk的表达,下调ppar-γ和srebp-1c的表达,增加pi3k/akt的活性。
[0246]
实施例8
[0247]
sm缓释微丸对防治酒精性肝病的药效学研究(ig)
[0248]
实验方法:
[0249]
(1)实验动物实验动物为spf级雄性c57bl/6j小鼠,8周龄,18~22g;分笼饲养,自由饮水进食,饲养室温23~25℃,相对湿度40~80%。许可证号为scxk(苏)2017-0004。
[0250]
(2)实验分组小鼠随机分成7组,分别为空白组(空白)、模型组(模型)、给药组(低剂量2.5mg/kg、中剂量5mg/kg、高剂量10mg/kg)以及阳性药组(smt、sc)。除空白组给予生理盐水外其余各组均饲喂等量50%酒精,各组饲喂的体积一致(1ml/只),然后给予药物治疗。用药物干预小鼠6天;并于干预的第4天,各组小鼠给予相应药物或生理盐水,取组织样品进行检测。
[0251]
实验结果:
[0252]
(1)sm对ald小鼠肝脏组织病理变化的影响
[0253]
图33肝脏图片和肝组织he染色显示,与空白组相比,模型组肝脏颜色泛白,肝组织有较多小空泡化;与模型组相比,sm可以改善小鼠急性摄入大量酒精肝脏的泛白的外观,减少肝细胞的小空泡,sm低剂量组、中剂量组以及sc改善肝脏组织学的作用较好。
[0254]
(2)sm对ald小鼠肝脏纤维化的影响
[0255]
图34肝组织油红染色显示,与空白组相比,模型组肝脏组织有明显的脂滴蓄积,sm可减少肝组织的脂滴的蓄积,可降低肝脏脂质的积聚。
[0256]
(3)sm对ald小鼠肝功能(alt)的作用影响
[0257]
采用生物化学检测ald小鼠的肝功能酶,图35结果显示,与空白组比较,模型组中的alt差异显著。sm组可以降低alt的含量;sm高剂量组药效比阳性药降酶效果更好。
[0258]
(4)sm对ald小鼠肝脏tc、tg的影响
[0259]
采用生物化学检测小鼠的tc和tg水平,图36结果显示,与空白组比较,模型组中肝脏中tc 和tg含量增加,sm可以降低肝脏tc和的tg含量。
[0260]
(5)sm对ald小鼠炎症的影响
[0261]
采用elisa检测急性ald小鼠肝脏中炎症因子,图37结果显示,相比空白组,模型组肝脏中 tnf-α和il-6的水平均有显著提高。sm可以抑制肝脏tnf-α和il-6的升高,sm高剂量组药效与smt 相当,sc抗炎作用的最好。
[0262]
上述实验结果表明:sm可显著改善ald大鼠肝脏纤维化、肝功能指标(alt)、血脂(tc、tg),也有显著的抗炎(tnf-α、no)作用。
[0263]
实施例9
[0264]
水飞蓟宾葡甲胺改善四氯化碳(ccl4)诱导小鼠急性肝损伤的作用研究
[0265]
水飞蓟宾葡甲胺对ccl4诱导小鼠急性肝损伤中相关酶水平的影响
[0266]
由图38结果可得出灌胃ccl4后,与control组相比,模型组血清中alt,ast,alp含量显著提高,表明ccl4造模成功。灌胃水飞蓟宾葡甲胺sm(5,10mg/kg)可以显著降低血清中alt,ast, alp的水平,表明sm具有一定的降酶作用。并且a中sm(10mg/kg)抑制率为65.53%,阳性药水飞蓟宾葡甲胺片smt(25mg/kg)抑制率41.38%,sc水飞蓟宾胶囊(20mg/kg)抑制率为41.57%,表明sm(10mg/kg)抑制率高于阳性药。
[0267]
图38为水飞蓟宾葡甲胺对ccl4诱导小鼠急性肝损伤相关酶表达的影响。sm:水飞蓟宾葡甲胺; smt:水飞蓟宾葡甲胺片;sc:水飞蓟宾胶囊,下同。小鼠灌胃ccl410min后分别给予水飞蓟宾葡甲胺sm(2.5、5、10mg/kg)。ccl4攻毒24h后检测alt(a)、ast(b)和alp(c)。数据代表mean
±
sd (n=8)。##与对照组相比p《0.05,##与对照组相比p《0.01;*p《0.05,**p《0.01与ccl4组比较。
[0268]
水飞蓟宾葡甲胺对ccl4诱导小鼠急性肝损伤中肝组织形态学的影响
[0269]
如图39所示,通过he染色研究水飞蓟宾葡甲胺对ccl4诱导小鼠急性肝损伤中肝组织形态学的影响,结果所示空白组肝组织表面光滑平整,无明显组织坏死和炎症细胞浸润。模型组可见组织表面大面积坏死,大量炎症细胞浸润,在给予sm后,组织表面逐渐趋于光滑平整,并且损伤面积不断减小,炎症细胞减少,相对于模型组,水飞蓟宾葡甲胺高剂量组中央静脉周围肝细胞放射水肿减轻,门管区病变减轻,损伤面积减小(图中箭头指向为损伤区域。依据he染色评分标准,结果显示与模型组相比,sm给药高剂量组可以降低染色评分,提
示sm给药可以一定程度上保护肝脏组织。
[0270]
图39水飞蓟宾葡甲胺对ccl4诱导小鼠急性肝损伤软骨组织评分的影响。(a)用h&e染色ccl4诱导的急性肝损伤的代表性显微照片,sm(2.5,5,10mg/kg),smt(25mg/kg),sc(20mg/kg)或对照组。比例尺条=100μm。数据代表mean
±
sd(n=3)。##与对照组相比p《0.05,##与对照组相比 p《0.01;*p《0.05,**p《0.01与ccl4组比较。
[0271]
水飞蓟宾葡甲胺对ccl4诱导小鼠急性肝损伤中氧化应激的影响
[0272]
如图40中的a可得,与对照组比较,模型组小鼠血清中一氧化氮(no)含量显著增加,与模型组比较,低、中、高剂量sm组(2.5,5,10mg/kg)的no含量显著减少。如图40中的b可得,与对照组比较,模型组小鼠血清中丙二醛(mda)含量显著增加,与模型组比较,低、中、高剂量sm组(2.5,5,10mg/kg)的mda含量显著减少。如图40中的c可得,与对照组比较,模型组小鼠血清中过氧化氢酶(cat)含量显著降低,与模型组比较,中、高剂量sm组(5,10mg/kg)的 cat含量显著增加。如图40中的d可得,与对照组比较,模型组小鼠血清中超氧化歧化酶(sod) 含量显著降低,与模型组比较,低、中、高剂量sm组(2.5,5,10mg/kg)的sod含量显著增加。如图40中的e可得,与对照组比较,模型组小鼠血清中诱导型一氧化氮(inos)含量显著升高,与模型组比较,低、中、高剂量sm组(2.5,5,10mg/kg)的inos含量显著降低。图40中的ano 指标中,sm(10mg/kg)抑制率为57.89%,阳性药smt抑制率为33.68%,sc抑制率为36.8%,sm (10mg/kg)抑制率高于阳性药。其他指标抑制率与阳性药相当。
[0273]
图40为水飞蓟宾葡甲胺对ccl4诱导的小鼠急性肝损伤中氧化应激表达的影响。小鼠灌胃ccl
4 10min后分别给予sm(2.5、5、10mg/kg)。ccl4攻毒24h后测定血清中no(a)、mda(b)、cat(c)、 sod(d)和inos(e)。数据代表mean
±
sd(n=8)。##与对照组相比p《0.05,##与对照组相比p《0.01;* p《0.05,**p《0.01与ccl4组比较。
[0274]
水飞蓟宾葡甲胺对ccl4诱导小鼠急性肝损伤中炎症介质表达的影响
[0275]
如图41所示,ccl4造模后,通过检测elisa,结果显示ccl4造模组小鼠血清中tnf-α,il-6, il-1β和cox-2表达显著增高,给予sm(2.5,5,10mg/kg)后能够显著降低体内炎症因子的水平。其中图41中的a的tnf-α指标中,sm(10mg/kg)抑制率为27.48%,阳性药smt抑制率为11.59%, sc抑制率为12.59%,sm(10mg/kg)抑制率高于阳性药,其他指标与其相一致。
[0276]
图41为水飞蓟宾葡甲胺对ccl4诱导小鼠急性肝损伤炎症介质表达的影响。小鼠灌胃ccl410min 后分别给予sm(2.5、5、10mg/kg)。ccl4攻毒24h后测定血清中tnf-α(a)、il-6(b)、il-1β(c)和 cox-2(d)。数据代表mean
±
sd(n=8)。##与对照组相比p《0.05,##与对照组相比p《0.01;*p《0.05, **p《0.01与ccl4组比较。
[0277]
如图42所示,ccl4造模后,通过检测elisa,结果显示ccl4造模组小鼠组织匀浆中tnf-α, il-6,il-1β和cox-2表达显著增高,给予sm(2.5,5,10mg/kg)后能够显著抑制体内炎症因子的表达。其中图42中的atnf-α指标中,sm(10mg/kg)抑制率为34.41%,阳性药smt抑制率为9.13%, sc抑制率为17.51%,sm(10mg/kg)抑制率高于阳性药,其他指标与其相一致。表明sm可以通过抑制炎症介质的表达,改善ccl4诱导的小鼠急性肝损伤,来达到保肝效果。
[0278]
图42为水飞蓟宾葡甲胺对ccl4诱导小鼠急性肝损伤炎症介质表达的影响。小鼠灌胃ccl410min 后分别给予sm(2.5、5、10mg/kg)。ccl4攻毒24h后,检测组织匀浆中tnf-α(a)、
il-6(b)、il-1β(c) 和cox-2(d)。数据代表mean
±
sd(n=8)。##与对照组相比p《0.05,##与对照组相比p《0.01;*p《0.05, **p《0.01与ccl4组比较。
[0279]
水飞蓟宾葡甲胺改善对乙酰氨基酚(apap)诱导小鼠急性肝损伤的作用研究
[0280]
水飞蓟宾葡甲胺对apap诱导小鼠急性肝损伤中相关酶水平的影响
[0281]
由图43中的a可得,与对照组比较,模型组小鼠血清中alt含量显著增加,与模型组比较,高剂量sm组(10mg/kg)的alt含量显著减少。此外,由图43中的b可得,与对照组比较,模型组小鼠血清中ast含量显著增加,与模型组比较,高剂量sm组(10mg/kg)的ast含量显著减少。表明sm可以通过对apap诱导小鼠急性肝损伤中相关酶的调节,来达到保肝作用。其中图43中a 的alt指标中,sm(10mg/kg)抑制率为57.76%,阳性药smt抑制率为52.62%,sc抑制率为39.99%, sm(10mg/kg)抑制率高于阳性药。图43中b的ast指标中sm(10mg/kg)抑制率与阳性药相当。
[0282]
图43为水飞蓟宾葡甲胺对apap诱导小鼠急性肝损伤相关酶表达的影响。小鼠灌胃apap 10min 后分别给予sm(2.5、5、10mg/kg)。apap攻毒24h后检测血清alt(a)、ast(b)水平。数据代表 mean
±
sd(n=8)。##与对照组相比p《0.05,##与对照组相比p《0.01;*p《0.05,**p《0.01与apap组比较。
[0283]
水飞蓟宾葡甲胺对apap诱导小鼠急性肝损伤中组织形态学的影响
[0284]
如图44中的a所示,通过he染色研究水飞蓟宾葡甲胺对apap诱导小鼠急性肝损伤中肝组织形态学的影响,结果所示空白组肝组织表面光滑平整,无明显组织坏死和炎症细胞浸润。但模型组可见组织表面大面积坏死,大量炎症细胞浸润,在给予sm后,损伤面积和炎症细胞均有一定程度上的减少,相对于模型组,水飞蓟宾葡甲胺高剂量组中央静脉周围肝细胞呈放射水肿减轻,门管区病变减轻,损伤面积减小(图中箭头指向为损伤区域)。依据he染色评分标准,结果显示与模型组相比, sm给药高剂量组可以降低染色评分,提示sm给药可以一定程度上改善apap诱导的药物性肝损伤。
[0285]
图44为水飞蓟宾葡甲胺对apap诱导急性肝损伤小鼠软骨组织评分的影响。(a)用h&e染色apap 诱导的急性肝损伤的肝脏代表性显微照片,sm(2.5,5,10mg/kg),smt(25mg/kg),sc(20mg/kg) 或对照组。比例尺条=100μm。数据代表mean
±
sd(n=3)。##与对照组相比p《0.05,##与对照组相比p《0.01;*p《0.05,**p《0.01与apap组比较。
[0286]
水飞蓟宾葡甲胺对apap诱导小鼠急性肝损伤中氧化应激的影响
[0287]
由图45中的a可得,与对照组比较,模型组小鼠血清中btc含量显著增加,与模型组比较,低、中、高剂量sm组(2.5,5,10mg/kg)的btc含量显著减少。如图45中的b可得,与对照组比较,模型组小鼠血清中sod含量显著降低,与模型组比较,低、中、高剂量sm组(5,10mg/kg) 的sod含量显著增加。如图45中的c可得,与对照组比较,模型组小鼠血清中mda含量显著增加,与模型组比较,低、中、高剂量sm组(2.5,5,10mg/kg)的mda含量显著减少。如图45中的d 可得,与对照组比较,模型组小鼠血清中gsh含量显著降低,与模型组比较,低、中、高剂量sm 组(2.5,5,10mg/kg)的gsh含量显著升高。其中图45中的btc指标中,sm抑制率为28.81%,阳性药smt抑制率为9.59%,sc抑制率为20.97%,sm(10mg/kg)抑制率高于阳性药。其他指标中sm(10mg/kg)抑制率与阳性药相当。
[0288]
图45为水飞蓟宾葡甲胺对apap诱导小鼠急性肝损伤中氧化应激表达的影响。小鼠灌胃apap 10min后分别给予sm(2.5、5、10mg/kg)。apap攻毒24h后测定血清btc(a)、sod(b)、
mda(c) 和gsh(d)。数据代表mean
±
sd(n=8)。##与对照组相比p《0.05,##与对照组相比p《0.01;*p《0.05, **p《0.01与apap组比较。
[0289]
水飞蓟宾葡甲胺对apap诱导小鼠急性肝损伤中炎症介质表达的影响
[0290]
由图46中的a可得,与对照组比较,模型组小鼠血清中tnf-α含量显著增加,与模型组比较,低、中、高剂量sm组(2.5,5,10mg/kg)的tnf-α含量显著减少。图46中的b可得,与对照组比较,模型组小鼠血清中il-6含量显著升高,与模型组比较,低、中、高剂量sm组(2.5,5,10mg/kg) 的il-6含量显著降低。如图46中的c可得,与对照组比较,模型组小鼠血清中il-1β含量显著增加,与模型组比较,低、中、高剂量sm组(2.5,5,10mg/kg)的il-1β含量显著减少。如图46中的d 可得,与对照组比较,模型组小鼠血清中cox-2含量显著增加,与模型组比较,低、中、高剂量sm 组(2.5,5,10mg/kg)的cox-2含量显著减少。其中图a中,sm(10mg/kg)抑制率为19.25%, smt抑制率为8.85%,sc抑制率为19.06%,表明sm(10mg/kg)抑制率高于smt,与sc相当,图46中的d与其相一致。图46中的b中sm(10mg/kg)抑制率为15.23%,smt抑制率为8.66%, sc抑制率为28.19%,表明sm(10mg/kg)抑制率高于smt抑制率,低于sc抑制率,图c与其相一致。
[0291]
图46为水飞蓟宾葡甲胺对apap诱导小鼠急性肝损伤炎症介质表达的影响。小鼠灌胃apap 10min后分别给予sm(2.5、5、10mg/kg)。apap攻毒24h后检测血清tnf-α(a)、il-6(b)、il-1β(c) 和cox-2(d)。数据代表mean
±
sd(n=8)。##与对照组相比p《0.05,##与对照组相比p《0.01;*p《0.05, **p《0.01与apap组比较。
[0292]
由图47中的a可得,与对照组比较,模型组小鼠组织匀浆中tnf-α含量显著增加,与模型组比较,中、高剂量sm组(5,10mg/kg)的tnf-α含量显著减少。如图47中的b可得,与对照组比较,模型组小鼠组织匀浆中il-6含量显著升高,与模型组比较,低、中、高剂量sm组(2.5,5,10mg/kg) 的il-6含量显著降低。如图47中的c可得,与对照组比较,模型组小鼠组织匀浆中il-1β含量显著增加,与模型组比较,低、中、高剂量sm组(2.5,5,10mg/kg)的il-1β含量显著减少。如图47中的 d可得,与对照组比较,模型组小鼠组织匀浆中cox-2含量显著增加,与模型组比较,高剂量sm 组(10mg/kg)的cox-2含量显著减少。图47中的a中,sm(10mg/kg)抑制率为16.26%,smt 抑制率为5.62%,sc抑制率为16.26%,表明sm(10mg/kg)抑制率高于smt抑制率,低于sc抑制率,图47中的b与其相一致。图47中的c和d中sm(10mg/kg)抑制率与阳性药相当。以上对炎症介质的影响与血清中结果一致,表明水飞蓟宾葡甲胺可以通过调节炎症介质的表达来改善apap 诱导的急性肝损伤,发挥保肝作用。
[0293]
图47为水飞蓟宾葡甲胺对apap诱导小鼠急性肝损伤炎症介质表达的影响。小鼠灌胃apap 10min后分别给予sm(2.5、5、10mg/kg)。apap攻毒24h后检测组织匀浆中tnf-α(a)、il-6(b)、il-1β(c) 和cox-2(d)。数据代表mean
±
sd(n=8)。##与对照组相比p《0.05,##与对照组相比p《0.01;*p《0.05, **p《0.01与apap组比较。
[0294]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
[0295]
附:本文主要缩略语
[0296]
[0297]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
