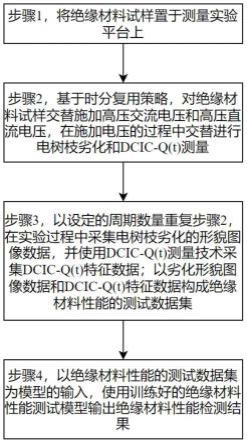
1.本发明属于生物医学工程材料和体外诊断(ivd)领域,具体涉及一种基于表面等离子体广谱荧光增强的通用基底及其制备方法与应用。
背景技术:
2.金属荧光增强是指当荧光基团靠近金属纳米结构附近时,利用贵金属表面的表面等离子体振荡和能量转移效应,使分布在贵金属表面的荧光基团的荧光发射强度比自由态荧光发射强度有所增强的一种物理现象。至今为止,由于荧光信号强大的通用性、简单性、非侵入性测量和多分析物检测等多种优点使其在传感器检测领域很有前景。然而,基于荧光信号检测的基本问题之一就是如何提高荧光团的量子产率。量子效率低、光漂白、自发荧光多种缺点限制了基于荧光的检测实现高灵敏度,用于生物检测应用的荧光基团需要高荧光强度和光稳定性两种不可或缺的特点。
技术实现要素:
3.为解决相关问题,本发明的首要目的在于提供一种基于表面等离子体广谱荧光增强的通用基底的制备方法。本发明基于金属荧光增强效应构建等离子体纳米银检测平台,通过种子-生长的两步合成法,可修饰现有所有聚苯乙烯材质的基底。
4.本发明的另一目的在于提供通过上述制备方法制备得到的基于表面等离子体广谱荧光增强的通用基底。
5.本发明的再一目的在于提供上述基于表面等离子体广谱荧光增强的通用基底的应用。该基底可实现三种荧光信号多重检测,适用于修饰现有任何聚苯乙烯材质的基底,如常用的96孔板或培养皿。
6.为了实现上述发明目的,本发明采用以下技术方案:
7.一种基于表面等离子体广谱荧光增强的通用基底的制备方法,包括如下步骤:
8.s1、取带正电的聚合物溶于水中,添加到可用于荧光信号检测的聚苯乙烯基底中,孵育;除去未结合至聚苯乙烯基底表面的聚合物,烘干,获得聚合物包被的基底;
9.s2、取纳米颗粒作为催化剂,添加到步骤s1所得聚合物包被的基底,孵育,获得纳米颗粒吸附的基底;
10.s3、配制银氨溶液和还原剂的混合溶液,添加到步骤s2所得纳米颗粒吸附的基底,反应;倒出反应液,清洗,获得所述的基于表面等离子体广谱荧光增强的通用基底。
11.本发明方法中所述的水均为超纯水。
12.进一步地,步骤s1中所述的带正电的聚合物包括但不限于多聚赖氨酸、聚多巴胺、聚乙烯亚胺等;优选为多聚赖氨酸。
13.进一步地,步骤s1中所述的带正电的聚合物的重均分子量范围为5w~100w;优选为15w~30w。
14.进一步地,步骤s1中所述的带正电的聚合物与水的配比为0.001~1mg:1ml;优选为0.001mg:1ml。
15.进一步地,步骤s1中所述的聚苯乙烯基底可以是各种规格的聚苯乙烯材质的培养板、培养皿或培养瓶。
16.进一步地,步骤s1中所示例的孵育的时间为7~9h;优选为8h。
17.进一步地,步骤s1中所述的除去未结合至聚苯乙烯基底表面的多聚赖氨酸通过水清洗实现。
18.进一步地,步骤s1中所示例的烘干过程的温度为55~65℃;优选为60℃。
19.进一步地,步骤s2中所述的纳米颗粒通过柠檬酸钠还原四氯金酸制备得到。
20.进一步地,步骤s2中所示例的柠檬酸钠还原法的操作为:在放有搅拌子的容器中加入摩尔浓度为1mmol/l的四氯金酸溶液,将容器放置于磁力搅拌器上,设置转速为350rpm,反应温度为100℃;待水溶液煮沸后按体积比20:3加入质量分数为1%的柠檬酸钠溶液,保持反应温度与转速不变,继续煮沸15min;关闭磁力搅拌器,加水将反应溶液体积补足至100ml,待溶液温度降至室温后,使用0.22μm的滤器过滤反应后的金纳米颗粒溶液。
21.进一步地,步骤s2中所示例的孵育的时间为1~3h;优选为2h。
22.进一步地,步骤s3中所示例的还原剂包括但不限于甘露糖、葡萄糖、木糖、半乳糖、阿拉伯糖等;优选为甘露糖。
23.进一步地,步骤s3中所述混合溶液中银氨溶液的浓度为0.5~12mmol/l,还原性糖的浓度为3~7mmol/l;优选的,银氨溶液的浓度为10mmol/l,还原性糖的浓度为5mmol/l。
24.进一步地,步骤s3中所示例的反应的时间为10~20min;优选为15min。
25.进一步地,步骤s3中所述的清洗所用的试剂为水,方法为摇床震荡5分钟后倒出废液,清洗的次数为4~6次。
26.一种基于表面等离子体广谱荧光增强的通用基底,通过上述制备方法制备得到。
27.进一步地,所述的基于表面等离子体广谱荧光增强的通用基底的产生450nm~900nm的等离子体。
28.上述基于表面等离子体广谱荧光增强的通用基底在分析物检测中的应用,所述的分析物包括但不限于细胞、蛋白质、核酸、外泌体和生物标志物。
29.当所述的分析物为细胞时,所述的应用的具体操作为:在所述的基于表面等离子体广谱荧光增强的通用基底上孵育ⅰ型胶原;将带有荧光蛋白的细胞直接孵育至基底表面,检测荧光信号来检测细胞。
30.进一步地,所述的荧光蛋白包括但不限于绿色荧光蛋白、红色荧光蛋白。
31.当所述的分析物为蛋白质时,所述的应用的具体操作为:在所述的基于表面等离子体广谱荧光增强的通用基底上孵育ⅰ型胶原;加入细胞,待其贴壁后进行甲醇固定;将分别带有一种或多种特异性目的蛋白抗体加入,检测荧光信号来检测目的蛋白的表达量。
32.进一步地,所述的生物标志物包括血清、血浆、体液、组织裂解液、全血等不同类型样本中的所有生物标志物,包括但不限于磷酸化蛋白和前列腺特异性抗原。
33.当所述的分析物为前列腺特异性抗原时,所示例的应用的具体操作为:首先在所述的基于表面等离子体广谱荧光增强的通用基底上孵育生物素标记的牛血清白蛋白,随后加入链霉亲和素标记的鼠抗人psa抗体,将该抗体固定于基底;加入待测样本,孵育,加入带
有荧光信号的鼠抗人psa检测抗体;检测荧光信号,分析荧光强度后对psa含量进行定量检测。
34.进一步地,除上述免疫吸附检测方法外,也可以包括间接法、竞争法等。
35.本发明相对于现有技术具有如下的优点及效果:
36.本发明在聚苯乙烯基底表面中依次包被多聚l型多聚赖氨酸和柠檬酸钠还原的金纳米颗粒,在甘露糖还原的银镜反应作用下,在聚苯乙烯表面合成可显著增强荧光信号的半连续银纳米岛结构。利用其可实现在450nm~900nm间宽光谱的荧光增强效应,从而检测荧光信号,并且可实现同时检测此波段三种荧光信号,具备荧光信号多重检测的临床潜能。
37.本发明具有反应条件温和且易于操作等优点,有望在生物医学领域发挥其潜在的应用价值。
附图说明
38.图1为不同合成条件(五种多个浓度下的糖)下对cf488a,cf555,cf647三种染料的增强效果;其中,glucose表示葡萄糖,mannose表示甘露糖,xylose表示木糖,arabinose表示阿拉伯糖,galactose表示半乳糖。
39.图2为班氏试剂还原反应监测不同糖类之间还原性能的差异结果分析图;其中,a为吸光度统计结果,b为还原速率统计结果。
40.图3为使用酶标仪检测分别孵育了cf488a-bsa、cf555-bsa、cf647-bsa的普通96孔板和agnis 96孔板(最优增强条件下:0.001mg/ml多聚赖氨酸,20mm甘露糖,10mm银氨溶液)的荧光发射光谱图;其中,a为cf488a-bsa孵育,b为cf555-bsa孵育,c为cf647-bsa孵育。
41.图4为agnis材料表征结果图;其中,a、b为xps表征,c为sem-edx表征。
42.图5为宽场荧光显微镜检测293t/gfp细胞和b16-f10/rfp细胞在聚苯乙烯和等离子体银修饰的培养皿上的荧光信号结果图;其中,a为显微镜观察结果,b为结果分析。
43.图6为in cell western检测结果图;其中,a为两种细胞在ps表面检测三个蛋白标志物的表达情况,b为两种细胞在agnis表面检测三个蛋白标志物的表达情况。
44.图7为agnis平台检测psa绘制的标准曲线图。
45.图8为agnis批内和批间检测结果图;其中,a为批内差异分析结果,b为批间差异分析结果。
46.图9为健康人与前列腺癌病人psa的检测结果图;a为psa检测结果,b为线性关系分析结果。
47.图10为临床样本(血清,血浆,全血)细胞培养基上清和皮下瘤组织裂解液等多种不同类型样本的检测结果图;其中,a为不同类型临床样本检测结果,b为细胞培养基上清检测结果,c为裸鼠皮下瘤组织裂解液检测结果。
具体实施方式
48.下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
49.下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。所使用的材料、试剂等,如无特殊说明,为从商业途径得到的试剂
和材料。
50.实施例1
51.取多聚赖氨酸(重均分子量=15~30w)溶于超纯水中,稀释至不同浓度(0.001,0.01,0.025,0.05,0.1,0.25,0.5,1mg/ml)加入可用于荧光信号检测的黑色透明底聚苯乙烯96孔板中,每孔50微升,室温孵育8小时。随后将孔板中液体吸出,使用超纯水清洗孔中未结合至孔板表面的多聚赖氨酸,倒出超纯水后60℃烘干孔板,制备所得为多聚赖氨酸包被的96孔板。
52.实施例2
53.合成:使用超纯水将1g氯金酸三水合物溶解配制为100mmol/l的氯金酸溶液。称取0.2g柠檬酸钠,加入20ml超纯水配制为质量分数为1%的柠檬酸钠溶液。在放有搅拌子的锥形瓶中加入99ml双蒸水,加入1ml 100mmol/l的氯金酸溶液。将锥形瓶放置于磁力搅拌器上,设置转速为350rpm,反应温度为100℃。待水溶液煮沸后加入15ml 1%的柠檬酸钠溶液,保持反应温度与转速不变,继续煮沸15min后,关闭磁力搅拌器。加入一定量的超纯水将反应溶液体积补足至100ml,待溶液温度降至室温后,使用0.22μm的滤器过滤反应后的金纳米颗粒溶液。将上述金纳米颗粒溶液加入至多聚赖氨酸包被的96孔板,每孔50微升,室温孵育2小时。
54.实施例3
55.2ml 100mmol/l银氨溶液配制方法为:400μl 500mmol/l硝酸银溶液,80μl 3mol/l氢氧化钠溶液,88μl浓氨水(28%),1432μl双蒸水。将银氨溶液分别倍比稀释至相应浓度(1mmol/l,2.5mmol/l,5mmol/l,10mmol/l,15mmol/l,20mmol/l),且将五种不同的还原性糖(葡萄糖,甘露糖,半乳糖,木糖和阿拉伯糖)分别配制成浓度为10mmol/l的储存溶液。在上一步所制得的金纳米颗粒种子吸附的96孔板中每孔加入100μl不同浓度的银氨溶液,及100μl10mmol/l的糖类溶液,吹打混匀后室温反应10min。倒出废液后停止还原反应,在96孔板中每孔加入250μl双蒸水,然后将96孔板放置于摇床上清洗5min,倒出各孔中废液,共重复清洗5次。以上反应过程即制得不同合成反应条件下的等离子体银纳米结构。
56.实施例4不同合成条件下荧光增强效果的验证(合成条件参数优化)
57.荧光标记牛血清白蛋白:在每管染料中加入无水dmso将荧光染料溶解为10mmol/l储存溶液,在1ml浓度为3mg/ml的牛血清白蛋白溶液(由ph=8的磷酸盐缓冲液配制)中按摩尔浓度比1:10(蛋白:荧光染料)加入不同荧光染料(cf488a,cf555,cf647),荧光染料的体积比小于0.5%。将反应混合液室温孵育2h后使用pd-10脱盐柱纯化,去除未标记的小分子染料。通过紫外可见光光谱仪检测荧光染料及荧光蛋白溶液的吸收光谱,tecan酶标仪检测荧光染料及荧光蛋白溶液荧光发射光谱的变化。
58.实施例5通过不同合成条件下荧光增强的效果优化合成参数
59.在96孔板未处理孔及不同合成条件下所修饰孔中加入50μl蛋白浓度为100nmol/l的荧光染料,4℃孵育过夜。吸出各孔中的荧光蛋白染料后,每孔中加入250μl 1
×
pbs清洗未与基底结合的荧光蛋白染料,将96孔板放置于摇床清洗5min,重复清洗三次。使用bio-rad荧光扫描仪检测每孔荧光强度,quantity one软件分析计算不同合成条件下孵育荧光蛋白后荧光强度,扣除基底荧光背景后,得出增强倍数。最终比较得出最优合成条件。由图1可以看出,当孵育0.001mg/ml的多聚赖氨酸,银生长条件为20mmol/l银氨溶液和10mmol/l
甘露糖溶液时,对cf647染料有最优增强,将其命名为ag nanoisland substrate(agnis)。后续应用主要针对该合成条件。
60.实施例6班氏试剂还原反应监测不同糖之间还原性的差异
61.班氏试剂配制:1.73g五水硫酸铜,10g碳酸钠和17.3g柠檬酸钠溶解于100ml超纯水中。取50μl的10mmol/l各类糖溶液加入到450μl班氏试剂中,100℃沸水浴孵育不同时间。然后取出水浴后反应液,使用超纯水稀释后记录260nm处吸光度的变化。图2a证明甘露糖的还原性略微低于葡萄糖,但明显高于其他糖类,而图2b还原速率变化结果证明甘露糖还原能力温和而持续。因此,不同糖类之间还原性能的差异可能是其增强效果存在差异的原因。
62.实施例7酶标仪检测荧光发射强度
63.使用酶标仪检测荧光蛋白孵育在两种基底表面(agnis和未修饰聚苯乙烯表面(ps))后,三种染料相对应的荧光发射强度。由图3可以看出,agnis基底表面可显著增强三种染料的荧光发射强度。
64.实施例8agnis材料表征
65.使用x射线光电子能谱(xps)谱图和sem-edx技术对agnis进行表征。由图4a、图4b可知,agnis基底含有金,银元素,且银元素多为0价态。图4c sem-edx表征证明,agnis基底为半连续的银纳米岛结构。
66.实施例9宽场显微镜检测细胞荧光信号
67.(1)在60mm的聚苯乙烯培养皿基底上进行合成。首先,在60mm培养皿中加入1ml0.001mg/ml多聚赖氨酸,室温孵育过夜,超纯水清洗后烘干培养皿。在培养皿中加入0.5ml柠檬酸钠还原的金纳米颗粒作为合成种子。室温孵育2h后,倒出培养皿中溶液。清洗后加入0.4ml 20mmol/l银氨溶液和0.4ml 10mmol/l甘露糖混合溶液,反应15min后即在培养皿基底上合成银纳米岛结构。为降低银基底对细胞的毒性,在培养皿中加入1ml 0.1mg/ml的ⅰ型胶原溶液(cas号9007-34-5),室温静置30min后弃出培养皿中溶液,加入pbs清洗培养皿。待其自然晾干后使用紫外照射灭菌。
68.(2)将人胚肾细胞系293t/gfp(atcc)和小鼠皮肤黑色素瘤细胞系b16-f10/rfp(atcc)细胞使用胰蛋白酶消化后,离心重悬制得细胞悬液。进行细胞计数后,使用完全培养基将细胞数目浓度稀释为1
×
106个/ml。在修饰有银纳米结构的培养皿基底和未修饰的培养皿中分别加入1ml细胞悬液,37℃培养过夜后,将培养皿拿出进行拍照检测。
69.(3)使用olympus bx53正置荧光显微镜拍照。对于同一细胞在不同基底表面的检测,拍照时采用相同激光强度和曝光时间。使用image j软件分析细胞荧光强度。
70.结果:由图5可以看出,相同的拍摄条件下,agnis基底上细胞表面的绿色荧光和红色荧光都一定程度被增强。
71.实施例10in cell western
72.(1)抗体荧光标记:首先使用ph=8的磷酸缓冲液稀释抗体溶液(β-actin,itgb3,itga5,proteintech),采用10kd超滤管对抗体溶液进行纯化,纯化后使用nanodrop检测蛋白溶度。使用cf488a-nhs染料标记鼠抗人β-actin抗体,cf555-nhs标记鼠抗人itgb3抗体,cf647-nhs染料标记鼠抗人itga5抗体。
73.(2)将人乳腺癌细胞系hs 578t(itga5 itgb3均为阳性)与hcc1937(itga5 itgb3均为阴性)(atcc)细胞使用胰蛋白酶消化制成消化悬液,进行细胞计数。使用完全培养基将
细胞悬液浓度稀释至1
×
105个/ml,在96孔板中每孔加入100μl,37℃孵育过夜。
74.(3)弃出孔板中培养基,使用pbs清洗两次。每孔加入100μl 100%冰甲醇,室温放置10min。
75.(4)吸出孔板中甲醇溶液,使用pbs清洗两次,每孔加入100μl 3%bsa溶液,室温孵育封闭2h。
76.(5)倒出孔板中蛋白溶液,每孔加入50μl 1%bsa稀释的混合抗体稀释液(50nmol/lβ-actin/cf488a,37nmol/l itgb3/cf555,37nmol/l itga5/cf647),4℃孵育过夜。
77.(6)荧光扫描仪成像检测。
78.结果:图6a为两种细胞在ps表面检测三个蛋白标志物的表达情况,图6b为两种细胞在agnis表面检测三个蛋白标志物的表达情况。根据图示结果可知,ps表面无法检测到两种细胞itgb3、itga5的表达差异,而agnis表面itgb3 itga5蛋白表达差异可以被明显检测到。
79.实施例11检测各种样本中前列腺特异性抗原(psa)的含量
80.(1)生物素标记的bsa孵育:使用pbs稀释生物素标记的bsa溶液至20μg/ml,在96孔板中每孔加入100μl,4℃孵育过夜。
81.(2)清洗:倒出孔板中液体,每孔加入300μl pbs溶液,摇床震荡5min。重复此步骤3次。
82.(3)封闭:每孔中加入100μl 5%的bsa溶液,室温孵育30min,按照步骤(2)中方法清洗。
83.(4)链霉亲和素标记的鼠抗人psa igg(sa-igg)孵育:使用0.1%bsa溶液将sa-igg母液稀释至15μg/ml,每孔中加入50μl,室温孵育1h。按照步骤(2)中方法清洗。
84.(5)抗原孵育:绘制标准曲线时,使用0.1%bsa溶液将psa抗原倍比稀释至不同浓度,每孔中加入50μl,每个浓度3个复孔。检测临床样本时,使用0.1%bsa溶液将临床样本(血清、血浆、全血)稀释五倍,每孔中加入50μl稀释后溶液,每个样本3个复孔。室温孵育1h。按照步骤(2)中方法清洗。
85.(6)检测抗体:使用0.1%bsa溶液将cf647-igg母液(金斯瑞)稀释至5μg/ml,每孔中加入50μl,室温孵育1h。按照步骤(2)中方法清洗。
86.(7)信号检测:使用bio-rad荧光扫描仪检测信号,使用quantity one软件分析荧光强度。图7为不同浓度标准品所绘制的标准曲线。
87.实施例12批内和批间差异分析
88.批内差异分析:在同一块96孔板中(agnis)进行psa检测,方法参考实施例7。三种高中低浓度的psa抗原浓度分别为30nmol/l、3nmol/l、0.3nmol/l。每个浓度9个复孔,计算其荧光强度的均值和标准差,求出各浓度下的变异系数(coefficients of variability)。
89.批间差异分析:在三个批次的96孔板中(agnis)进行psa检测,方法参考实施例7。三种高中低浓度的psa抗原浓度分别为30nmol/l、3nmol/l、0.3nmol/l。每个浓度每块板3个复孔,计算其荧光强度的均值和标准差,求出各浓度下的变异系数(coefficients of variability)。由图8可知,每种浓度下的cv值均小于10%。
90.实施例13血清样本检测
91.从中山大学肿瘤防治中心收集了19例健康人与50例前列腺癌病人的血清样本,进
行前列腺特异性抗原psa检测,以评价agnis该平台在标志物检测临床应用的潜能。从图9a可知,agnis可灵敏的区别健康人与前列腺癌病人的psa表达差异,且从图9b可知该平台检测结果与临床检测结果具有一定的线性相关性。
92.实施例14血清、血浆、全血样本检测
93.从中山大学肿瘤防治中心收取健康人的不同类型样本(血清,血浆,全血),在10μl临床样本中加入相同的psa蛋白标准品,使其终浓度为30nmol/l。方法参考实施例7。比较加入不同类型临床样本后,是否影响agnis基底检测psa的性能。由图10a可知,不同类型的临床样本不影响psa的检测值。
94.实施例15细胞培养基上清
95.(1)将前列腺癌细胞系pc-3和lncap(atcc)细胞使用胰蛋白酶消化离心后,加入完全培养基制得细胞悬液,细胞计数后将浓度稀释至1
×
106个/ml。在6孔板中每孔加入1ml细胞悬液,37℃培养12h。
96.(2)孔板中培养基吸出,加入1ml无血清培养基。分别在不同孔内加入二氢睾酮(psa诱导剂)与enza(enzalutamide,psa分泌抑制剂),使其终浓度分别为10nmol/l和100μmol/l,37℃培养24h。
97.(3)收集培养基:将孔板中不同处理组的培养基吸出转移至离心管,5000rpm离心10min去除细胞碎片。
98.(4)每个不同的处理组每孔取50μl进行检测。由图10b可知,agnis可以检测到lncap细胞(psa阳性)培养基上清中psa的变化,而pc-3细胞(psa阴性)培养基中psa含量无变化。
99.实施例16裸鼠皮下成瘤组织裂解液检测
100.(1)裸鼠皮下瘤制备:将前列腺癌细胞系pc-3或lncap(atcc)细胞不断传代增殖,达一定细胞数目后,胰酶消化制备细胞悬液,细胞计数后调整至相应浓度,与基质胶以2:1的体积比混合,每只老鼠背部皮下注射200μl。一定时间观察到瘤体后,将老鼠安乐死,取出瘤体组织。
101.(2)组织裂解液制备:取约50mg瘤体组织,在相应时间点将各组老鼠脱颈处死后,剥离下肿瘤组织。每个组织剪下约50mg,放置于ep管中,加入500μl含蛋白酶抑制剂的ripa蛋白裂解液。在每个ep管中加入2颗陶瓷珠,使用组织匀浆仪(luka)在-35℃、70hz、10min将其制成细胞悬液,4℃孵育30min。将组织裂解液进行bca定量后,计算每个样本20μg总蛋白所需体积,使用0.1%bsa将所需体积稀释至50μl进行检测。
102.从图10c可知,agnis可以检测到lncap细胞瘤体组织中psa的表达,而pc-3细胞和鼠前列腺组织中检测不到psa的表达。以上证明该检测平台可以灵敏地检测到多种样本中psa的表达,不受样本类型的限制。
103.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受所述的实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。