1.本发明涉及对细胞进行分析的装置系统及细胞分析方法。
背景技术:
2.多细胞生物中的生物体组织维持由各种细胞分担作用而整体上取得协调的功能。或者,细胞的一部分癌化(在此也包含肿瘤,统称为癌),成为与周边区域不同的新生物,但是,癌区域和远离该癌区域的正常组织部分不一定以某个边界来进行划分,癌周边区域也受到某些影响。因此,为了对脏器组织中的功能进行解析,需要对存在于狭窄区域的少数细胞在短时间内尽可能简单且损失最小地进行分离和分析。
3.另外,在再生医疗领域中,进行了以下尝试,即,从组织中分离脏器干细胞,对其进行再培养并分化诱导,想要再生目标组织乃至脏器。
4.若想要对细胞进行识别或分离,则需要按照某些指标进行区分。细胞的区分通常使用以下方式。
5.1)基于目视的形态学上的细胞分类:例如可以举出通过尿中出现的异型细胞检查进行的膀胱癌、尿道癌等的检查、血中的异型细胞分类、通过组织中的细胞诊断进行的癌检查等。
6.2)基于利用荧光抗体法进行的细胞表面抗原(标记物)染色的细胞分类:通常将称为cd标记物的细胞表面抗原用对其具有特异性的荧光标识抗体来进行染色,再用于采用细胞分选器(cell sorter)的细胞分离、采用流式细胞仪或组织染色的癌检查等。当然,这些不仅在医疗方面而且在细胞生理研究用途、工业上的细胞利用的方面也经常使用。
7.3)或者,关于干细胞的分离,有以下的例子,即,以取入细胞内的荧光色素作为报告子(reporter)来大致地分离包含干细胞的细胞,然后通过实际进行培养而分离出目标干细胞。这是由于干细胞的有效标记物尚未确立,因此通过仅利用实际进行培养并分化诱导得到的细胞,从而实质上分离出目标细胞。
8.这样对培养液中的特定细胞进行的分离和回收在生物学
·
医学分析中是重要的技术。在通过细胞比重的不同来分离细胞的情况下,能够利用速度沉降法来进行分离。然而,在辨别未致敏细胞和致敏细胞那样的细胞比重几乎没有差异的情况下,需要基于用荧光抗体染色后的信息或者目视的信息而将细胞一个一个地分离。
9.关于分离该细胞的技术,例如有细胞分选器。细胞分选器是以下技术,即,将荧光染色处理后的细胞以一个细胞为单位进行离析并滴加到具有电荷的液滴中,基于该液滴中的细胞有无荧光、光散射量的大小,在液滴落下的过程中,在相对于落下方向呈法平面方向上向任意方向施加高电场,由此,控制液滴的落下方向而分级至放置于下部的多个容器以进行回收(非专利文献1)。
10.然而,存在以下问题:该技术的装置价格高昂;装置大型;需要数千伏特的高电场;需要大量浓缩至一定以上浓度的试样;在制作液滴的阶段中有可能对细胞造成损伤;无法直接观察试样等。为了解决这些问题,近年来开发了以下细胞分选器,即,使用微加工技术
制作微细的流路,并对在流路内的层流中流动的细胞一边直接显微镜观察一边进行分离的细胞分选器(非专利文献2~3)。
11.现有技术文献
12.专利文献
13.专利文献1:日本专利3898103号公报
14.专利文献2:日本专利4420900号公报
15.专利文献3:日本专利4630015号公报
16.专利文献4:日本专利4677254号公报
17.专利文献5:日本专利5170647号公报
18.专利文献6:日本专利5320510号公报
19.专利文献7:日本专利5580117号公报
20.专利文献8:日本专利5712396号公报
21.非专利文献
22.非专利文献1:kamarck,m.e.,methods enzymol.vol.151,p150-165(1987)
23.非专利文献2:a.wolff et al.,micro totalanalysis,98,pp.77-80(kluwer academicpublishers,1998)
24.非专利文献3:s.fiedler et al.,analyticalchemistry,70,pp.1909-1915(1998)
技术实现要素:
25.用于解决课题的方案
26.本发明鉴于重视在临床现场中确认与癌转移相关的血中循环癌细胞(ctcs)存在情况,而提供并确立了以血中循环癌细胞作为癌转移的指标的诊断基准。本发明解决了以下问题,即,由于血中循环癌细胞本身的多样性
·
稀少性,因此在将采血后的试样视为均匀的组织,并检测其中是否存在稀少的突变基因的现有方法中要求非常高的检测灵敏度。
27.特别地,本发明解决了以下课题,即,由于至今为止均是在没有确认荧光标识后的血中的癌细胞是与其他细胞形成细胞块还是独立的单个细胞的情况下进行细胞内的基因、表达解析,因此获取的是包含除成为靶的癌细胞以外的细胞的信息在内的群体平均的信息,从而不能得到成为对象的癌细胞的准确信息。
28.另外,本发明不需要除了以一个细胞为单位的回收机构之外还利用将稀少的细胞筛选
·
浓缩后以微量细胞为单位进行基因诊断、表达解析的机构来进行较高s/n比的诊断。
29.另外,在至今为止的以细胞为基础的血中癌细胞中,仅着眼于细胞的尺寸、多核细胞等满足某种基准的细胞的有无,而本发明着眼于通过血中的细胞的大小分布等的全量检查而得到的细胞尺寸的分布变异等。
30.另一方面,作为确认癌细胞的方法,存在本发明人们已经申请过的基于细胞团簇的图像识别的解析机构(专利文献1~8),但为了基于图像更准确地获取细胞的形状、周长、面积并且更准确地回收细胞,需要同时获取准确的细胞流速、且根据该得到的流速而不断地优化细胞分选器的图像获取机构和细胞的回收机构,而本发明没有这种需要。
31.另外,为了通过图像对作为对象的细胞进行全量观察,需要在更短时间内进行全
量观察,为了在更短时间内进行全量观察,需要能够仅将作为对象候补的尺寸的细胞及细胞团簇不堵塞地连续浓缩的前处理技术,而本发明不需要这种前处理技术。另外,本发明也不需要为了实现该技术而必须考虑的加工技术,该加工技术为了制造要使用的构件而构建直立的微细结构。
32.而且,本发明不需要在通过图像观察而回收的细胞的分离回收后进行的基因解析,且不需要为了防止再培养时的污染而将细胞填充至内装有细胞的胶囊的前处理。
33.另外,为了同时获取关于图像获取的更详细的细胞信息,需要用于同时连续地获取细胞的更多波长的吸光或者荧光图像的机构,而本发明不需要这种机构。
34.即,本发明提供对源自被检体的细胞试样中的异常细胞进行分离
·
鉴定的技术。
35.在使用微加工技术制作的细胞分选器中,试样分离对观察机构的响应速度慢,为了进行实际应用而需要不会对试样造成损伤且响应更快的分离处理方法,而本发明不需要这种分离处理方法。另外,本发明解决了以下课题:若不事先将所使用的样品溶液中的细胞浓度提高到一定以上的浓度,则在稀薄的细胞浓度的情况下,无法充分地提高装置的分离效率。而且,本发明解决了以下课题:在用另外的装置进行了微量样品的浓缩的情况下,不仅难以没有损失地回收该浓缩液,而且在繁琐的前处理阶段中产生细胞被污染等在再生医疗等中不期望的问题。
36.本发明人为了解决这样的问题而开发出的细胞分析分离装置(即,活用微加工技术而基于试样的微细结构和试样中的荧光分布对试样进行分级,能够在不对回收的试样造成损伤的情况下简便地对细胞试样进行分析分离的细胞分析分离装置,参见专利文献1~8)超越了能充分实际应用在实验室水平下的细胞分选器,而本发明能够更有效地提高效率来用于实际应用,提供了关于准确地测量在微细流路中流动的细胞的流速的方法、图像的获取方法、图像处理的方法、细胞的液输送法、回收法、试样制备等前处理的新技术开发。
37.癌组织的检测通过mri(核磁共振图像法)、ct(计算机断层摄影法)的改良而得到了飞跃性地改善,结果本发明提供对于良性
·
恶性肿瘤的鉴定而言超过基于活检(biopsy)的评价的方法。作为恶性肿瘤的问题,已知由于从癌细胞自身的组织浸润至血管或者淋巴管的能力而转移到其他脏器。这样,在外周血中循环的恶性肿瘤细胞被称为外周血循环癌细胞(circulatingtumor cells:ctcs),并认为在血液细胞(包含红血球)10万个细胞中存在数百个细胞左右的癌细胞。近年来,不断开发出针对特定靶的抗癌剂,若是能够鉴定出血液中的恶性肿瘤的种类,则能够选择有效地灭杀该细胞的抗癌剂。本发明使对血液中流动的ctcs进行监视的技术得以实现,提供了以下世界首创的方法,即,能够定量地对血液中流动的成为转移癌的原因的恶性肿瘤细胞的存在进行测量,由此能够定量地持续评价所施用的抗癌剂的效果,不仅能够防止不需要的抗癌剂的施用、过量的抗癌剂的施用,而且还能够针对有无复发进行检测。
38.如上所述,本发明人提供能够高速地对具有转移能力且在血中流动的癌细胞的种类、状态以及数量(血中浓度)进行鉴定的细胞分析装置系统。
39.更具体而言,本发明提供了具有以下功能的细胞分析装置系统以及在该装置中使用的细胞分析方法,所述功能为:对细胞进行连续浓缩的功能;然后,持续将细胞连续配置于流路的特定区域的功能;基于图像以一个细胞为单位同时对其明视野的形状和荧光的形状进行识别的功能;以及对基于将所述形状与细胞的流动速度相匹配地进行校正后的形状
和荧光的发光的信息而进行识别并对细胞进行分离纯化的功能。
40.更具体而言,本发明提供了以下的装置、系统及方法。
41.本发明提供一种细胞分析装置系统,其中,所述细胞分析装置系统具备:
42.(a)第一装置,从源自被检体的细胞试样液中对成为候补的尺寸区域的细胞进行纯化、浓缩、染色和/或清洗的处理;
43.(b)第二装置,其制作将由所述第一装置处理后的细胞封入胶囊中而成的胶囊粒子;
44.(c)第三装置,其获取并判别由所述第一装置处理后的细胞或由所述第二装置封入至胶囊粒子中的细胞的图像,连续地获取该细胞的流速作为流速数据,基于该流速数据而获取准确的细胞形状,连续地对基于该细胞形状得到的细胞的图像的信息进行解析,输出全量被检试样的细胞信息的分布,并且,判别并回收靶细胞;以及
45.(d)控制
·
判断部,其控制所述第一装置至第三装置的各装置的动作,并针对所述细胞试样液进行判定。
46.在本发明的细胞分析装置系统中,存在以下情况:
47.(a)所述第一装置具备腔室、容器以及细胞浓缩
·
染色
·
清洗机构,该腔室具备对源自被检体的细胞试样液中得到的细胞进行浓缩、染色、清洗的膜过滤器,该容器对含有所述细胞的溶液、染色液以及清洗液分别进行收容,该细胞浓缩
·
染色
·
清洗机构将各所述容器中的各溶液依次导入所述腔室中,或者
48.(a’)所述第一装置具备交变电场施加机构,该交变电场施加机构包括柱阵列和一对电极,该柱阵列能够对所述细胞试样液中的细胞选择性地连续进行尺寸分级,且与想要尺寸分级的细胞尺寸相匹配地调整间隔而相对于流路的流动倾斜地配置在微小流路中,该一对电极在与该微小流路正交的两侧壁面相对配置且能够在微小流路中施加正弦交变电场;
49.(b)所述第二装置具备胶囊粒子构建机构,并且具备胶囊粒子粒径筛选机构和细胞
·
胶囊粒子回收机构,该胶囊粒子构建机构通过从微小管的出口向含有二价离子的溶液中排出含有溶胶状态的海藻酸和所述细胞的溶液来构建含有细胞的海藻酸的胶囊粒子,该胶囊粒子粒径筛选机构通过在所述微小管的内部及外部流过微小电流并根据电阻值的变化来测量排出速度以进行控制从而使海藻酸的胶囊粒子的粒径一致,该细胞
·
胶囊粒子回收机构判别含有细胞的胶囊粒子和不含细胞的胶囊粒子并选择性地回收含有细胞的胶囊粒子;
50.(c)所述第三装置是具有图像检测型单细胞分离
·
纯化部(以下,也记作“细胞分选部”)的模块,该图像检测型单细胞分离
·
纯化部具备使含有对象细胞的细胞或含有对象细胞的胶囊粒子的试样液流动的流路,所述流路包括合流区域、检测
·
筛选区域、流路组合、以及离子电流施加工具,该合流区域与来自两肋侧的鞘液合流并且用于将细胞或胶囊粒子配置成一列而使其向下游流动,该检测
·
筛选区域进行该排列成一列的细胞或胶囊粒子的检测以及所述对象细胞的筛选,该流路组合通过施加离子电流使细胞或含有细胞的胶囊粒子移动并选择性地移动到与所述合流区域连续的分支出的流路,从而回收靶细胞,该离子电流施加工具施加离子电流,所述第三装置具备光学工具和解析工具,该光学工具判定在所述合流区域中细胞的流速,该解析工具从基于光学上得到的细胞的流速而进行校正
后的细胞的像中获取特征并进行解析。
51.在本发明的细胞分析装置系统中,存在以下情况:
52.所述第三装置是具有图像检测型单细胞分离
·
纯化部的模块,该图像检测型单细胞分离
·
纯化部具备使包含对象细胞或胶囊粒子的试样液流动的流路,该流路具有合流区域和观察区域,该合流区域与来自两肋侧的鞘液合流并且用于将所述细胞或胶囊粒子配置成一列而使其向下游流动,该观察区域进行所述排列成一列的细胞或胶囊粒子的检测,
53.所述第三装置具备光源、聚光光学系统、图像获取相机机构、细胞流速获取机构、细胞形状校正机构、细胞解析工具、以及图像晃动抑制机构,该光源能够对照射两个以上不同波长的光的照射区域中的照射时间进行时间控制,使得在比拍摄相机的拍摄时间间隔短的时间内分别以不同的时长发光,该聚光光学系统将来自该光源的光向该照射区域进行照射,该图像获取相机机构根据波长的差异来分割所得到的两个以上不同波长的图像,从而获取各个波长的图像,该细胞流速获取机构根据所得到的两个以上波长的图像在细胞的流动方向上的长度与光源的照射时间之差的比较,来获取细胞的流速,该细胞形状校正机构根据该获取到的细胞的流速,对所得到的细胞的形状信息进行校正,该细胞解析工具根据基于光学上得到的细胞的流速而进行校正后的细胞的形状,获取细胞的特征并进行解析,该图像晃动抑制机构通过根据所得到的流速并按照“光源的闪光时间=获取图像的相机的像素尺寸/所得到的细胞的流速”的关系来控制光源的闪光时间,从而抑制图像晃动。
54.在本发明的细胞分析装置系统中,存在以下情况:
55.所述第三装置是具有图像检测型单细胞分离
·
纯化部的模块,该图像检测型单细胞分离
·
纯化部包括流路组合和离子电流施加工具,该流路组合通过在所述观察区域的下游施加离子电流使细胞或胶囊粒子移动并选择性地移动到与所述合流区域连续的分支出的流路,从而对靶细胞或含有靶细胞的胶囊粒子进行回收,该离子电流施加工具施加离子电流,
56.所述第三装置具备施加时序控制工具,该施加时序控制工具基于在所述合流区域中由所述细胞流速获取机构获取到的流速,控制对回收的细胞或胶囊粒子施加离子电流的时序。
57.在本发明的细胞分析装置系统中,存在以下情况:
58.所述第三装置在所述光源以及观察像中使用荧光。
59.在本发明的细胞分析装置系统中,存在以下情况:
60.所述第三装置是具有图像检测型单细胞分离
·
纯化部的模块,该图像检测型单细胞分离
·
纯化部具备使包含对象细胞或胶囊粒子的试样液流动的流路,所述流路具有合流区域和观察区域,该合流区域与来自两肋侧的鞘液合流并且用于将所述细胞配置成一列而使其向下游流动,该观察区域进行所述排列成一列的细胞或胶囊粒子的检测,
61.所述第三装置具备图像重构机构,该图像重构机构具有聚光光学系统、流速测定用一维光电传感器阵列、细胞图像获取用一维光电传感器阵列,该聚光光学系统将用于观察细胞或胶囊粒子的光连续进行照射并向照射区域进行照射,该流速测定用一维光电传感器阵列在对所得到的图像进行成像的图像获取面上沿着细胞或胶囊粒子的流动配置,该细胞图像获取用一维光电传感器阵列具有在其最下端沿与细胞的流动正交的方向覆盖流路宽度而能够获取全部细胞像的长度,该图像重构机构根据所测定出的流速测定用一维光电
传感器阵列的细胞像的移动速度信息来推算流速,组合该速度信息和数据获取时间并根据细胞图像获取用一维光电传感器阵列的信息来重构二维的图像信息。
62.在本发明的细胞分析装置系统中,存在以下情况:
63.所述第三装置是具有图像检测型单细胞分离
·
纯化部的模块,该图像检测型单细胞分离
·
纯化部包括流路组合和离子电流施加工具,该流路组合通过在所述观察区域的下游施加离子电流使细胞或胶囊粒子移动并选择性地移动到与所述合流区域连续的分支出的流路,从而对靶细胞或含有靶细胞的胶囊粒子进行回收,该离子电流施加工具施加离子电流,
64.所述第三装置具备施加时序控制工具,该施加时序控制工具基于在所述合流区域中由所述流速的推算获取到的流速,控制对回收的细胞或胶囊粒子施加离子电流的时序。
65.在本发明的细胞分析装置系统中,存在以下情况:
66.所述第三装置在所述光源以及观察像中使用荧光。
67.在本发明的细胞分析装置系统中,存在以下情况:
68.所述第三装置在所述图像获取面上除了所述细胞图像获取用一维光电传感器阵列之外还具有图像模糊抑制机构,该图像模糊抑制机构通过以另外的一个以上的不同高度平行地配置并排列,能够同时获取不同的成像高度的图像。
69.在本发明的细胞分析装置系统中,存在以下情况:
70.所述第三装置具有图像分割机构1,该图像分割机构1使所述光源的波长为多个,并且除了所述细胞图像获取用一维光电传感器阵列之外还在所述图像获取面上配置多个细胞图像获取用一维光电传感器阵列,在各个一维光电传感器阵列上配置仅使特定波长的光透过的带通滤波器,从而能够同时获取多个不同波长域的图像。
71.在本发明的细胞分析装置系统中,存在以下情况:
72.所述第三装置具有波长光谱分离机构和图像分割机构2,该波长光谱分离机构使所述光源的波长为多个,并且将所得到的与流动正交的带状区域的线状的光作为波长光谱进行分离,该图像分割机构2通过在所述图像获取面上于各波长光谱的位置分别配置细胞图像获取用一维光电传感器阵列,从而能够同时获取多个不同波长域的图像。
73.另外,本发明提供一种细胞分析方法,其中,所述细胞分析方法使用所述细胞分析装置系统,测定溶液中的细胞或微粒的形状的全量下的尺寸、周长、和/或内部微细结构的粒子量比例的分布,并根据该分布的变化来判定异常的有无。
74.而且,本发明提供以下技术方案。
75.(项目a1)一种方法,其对源于被检者的细胞进行分析,其中,所述方法包括以下工序:
76.a)获取所述细胞的图像的步骤;
77.b)根据获取到的所述图像而生成所述细胞的流速数据的步骤;
78.c)基于所述流速数据而生成准确的细胞形状数据的步骤;
79.d)基于所述细胞形状数据而连续地解析细胞的信息的步骤;
80.e)根据基于所述细胞形状数据得到的细胞的信息而输出被检试样整体的细胞信息的分布的步骤;以及
81.f)根据所述细胞信息的分布而判别所述被检者的细胞中的异常的步骤。
82.(项目a2)一种程序,其使计算机执行对源于被检者的细胞进行分析的方法的处理,其中,所述方法包括以下工序:
83.a)使所述计算机获取细胞的图像的步骤;
84.b)使所述计算机根据获取到的所述图像而生成所述细胞的流速数据的步骤;
85.c)使所述计算机基于所述流速数据而生成准确的细胞形状的数据的步骤;
86.d)使所述计算机基于所述细胞形状数据而连续地解析细胞的信息的步骤;
87.e)使所述计算机根据基于所述细胞形状数据得到的细胞的信息而输出被检试样整体的细胞信息的分布的步骤;以及
88.f)使所述计算机根据所述细胞信息的分布而判别所述被检者的细胞中的异常的步骤。
89.(项目a3)一种记录介质,其保存计算机程序,该计算机程序使计算机执行对源于被检者的细胞进行分析的方法的处理,其中,所述方法包括以下工序:
90.a)使所述计算机获取细胞的图像的步骤;
91.b)使所述计算机根据获取到的所述图像而生成所述细胞的流速数据的步骤;
92.c)使所述计算机基于所述流速数据而生成准确的细胞形状的数据的步骤;
93.d)使所述计算机基于所述细胞形状数据而连续地解析细胞的信息的步骤;
94.e)使所述计算机根据基于所述细胞形状数据得到的细胞的信息而输出被检试样整体的细胞信息的分布的步骤;以及
95.f)使所述计算机根据所述细胞信息的分布而判别所述被检者的细胞中的异常的步骤。
96.(项目a4)一种系统,其对源于被检者的细胞进行分析,其中,所述系统包含:
97.a)获取所述细胞的图像的机构;
98.b)根据获取到的所述图像而生成所述细胞的流速数据的机构;
99.c)基于所述流速数据而生成准确的细胞形状的数据的机构;
100.d)基于所述细胞形状数据而连续地解析细胞的信息的机构;
101.e)根据基于所述细胞形状数据得到的细胞的信息而输出被检试样整体的细胞信息的分布的机构;以及
102.f)根据所述细胞信息的分布而判别所述被检者的细胞中的异常的机构。
103.(项目b)从由细胞的大小、细胞的形状、细胞是否形成聚集体(团簇)即有无群集、群体尺寸(构成的细胞数和种类)、细胞内的核的尺寸、以及有无多核细胞组成的组中选择的至少一个指标的用于细胞分析的用途。
104.(项目c1)一种判定某细胞是否为有核细胞和/或多核细胞的方法,其中,所述方法包括:同时获取该细胞的明视野的细胞形状的图像以及该细胞中的荧光图像作为至少一个波长的图像。
105.(项目c2)根据项目c1所述的方法,其中,所述方法还包括:获取细胞的形状、大小、细胞有无成块的状态、形成细胞块时的细胞群体的个数的概数等。
106.(项目c3)根据项目c1或c2所述的方法,其中,所述方法还包括:通过使用对核进行特异性地染色的荧光色素,从而求出细胞内部的核的个数以及各个核的面积。
107.(项目c4)根据项目c1~3所述的方法,其中,所述方法还包括:通过根据所得到的
细胞团簇的细胞的核的荧光信息来鉴定多核细胞,从而鉴定癌细胞的存在。
108.(项目c5)根据项目c4所述的方法,其中,所述方法为癌的诊断法。
109.(项目d)一种进行细胞块的判别的方法,其中,所述方法包括组合以下步骤来提取细胞块的数据,所述步骤为:
110.获取细胞未流动时的背景图像数据;
111.获取细胞正在流动时的明视野像数据;
112.通过从该明视野像数据中减去该背景图像数据而提取仅细胞块的像;以及
113.获取该提取到的像的边界线(细胞或者细胞块的外围线)的长度和由该边界线包围的区域的面积。
114.(项目e1)一种鉴定血中癌细胞的方法,其中,所述方法包括由以下的(1)~(4)所组成的组中的至少一个工序,并且根据需要还包括(5),
115.(1)将在健康的血液中不存在的细胞团簇(块)鉴定为存在血中癌细胞的工序;
116.(2)将在健康的血液中不存在的多核细胞鉴定为存在血中癌细胞的工序;
117.(3)将在健康的血液中不存在的巨大细胞鉴定为存在血中癌细胞的工序;
118.(4)在根据血中的白血球(从血液中除去红血球成分后剩余的细胞整体)的尺寸分布图而具有以下尺寸分布的情况下鉴定为存在癌细胞的工序,该尺寸分布与健康者的特征不同且具有转移癌患者所特有的尺寸分布;
119.(5)通过与利用荧光强度测量而测量出的针对癌细胞的一个或者多个生物标记物(例如epcam抗体、k-ras抗体、细胞角蛋白抗体等)的荧光抗体的荧光强度的存在进行了组合的解析,而鉴定为癌细胞的工序。
120.(项目e2)根据项目e2所述的方法,其特征在于,在所述方法中,使用下述(1)~(3)的三个判断条件中的任一个条件或者下述这三个条件按照“和”的关系的组合(即,(1)且(2)、或者(1)且(3)、或者(2)且(3)、或者(1)且(2)且(3))作为存在血中癌细胞的判断基准,
121.(1)根据获取图像来测量细胞(团簇)的约150μm2以上的核的面积;
122.(2)根据获取图像来测量细胞(团簇)的约250μm2以上的面积;
123.(3)根据获取图像来测量细胞(团簇)的三个以上核的存在。
124.(项目e3)根据项目e1或e2所述的方法,其中,所述方法还包括:
125.通过组合微小细胞用的pcr解析技术等的基因解析机构来进行基因变异的测量、或者进行再培养来评价细胞功能,从而最终鉴定是否为癌细胞,并且在为癌细胞的情况下最终鉴定是具有何种特征的癌细胞。
126.(项目f1)一种方法,其对源自被检体的细胞进行分析,其中,所述方法包括:
127.(a)对源自被检体的细胞试样液所含的细胞进行处理的工序;
128.(b)将处理后的所述细胞封入胶囊中来制作胶囊粒子的工序;
129.(c)对处理后的所述细胞或封入至胶囊粒子中的所述细胞的图像进行获取的工序;以及
130.(d)对所述图像实施上述项目a1的方法的判别工序。
131.(项目f2)根据项目f1所述的方法,其中,
132.所述进行处理的工序包括:对成为候补的尺寸区域的细胞进行纯化、浓缩、染色和/或清洗。
133.(项目f3)根据项目f1或f2所述的方法,其中,
134.在所述进行处理的工序中,对所述细胞试样液中的细胞选择性地连续进行尺寸分级。
135.(项目f4)根据项目f1~f3中任一项所述的方法,其中,
136.在所述制作胶囊粒子的工序中,通过在含有二价离子的溶液中混合含有溶胶状态的海藻酸和所述细胞的溶液,从而构建含有细胞的海藻酸的胶囊粒子。
137.(项目f5)根据项目f1~f4中任一项所述的方法,其中,
138.在所述制作胶囊粒子的工序中,使所述海藻酸的胶囊粒子的粒径一致,判别含有细胞的胶囊粒子和不含细胞的胶囊粒子并选择性地回收含有细胞的胶囊粒子。
139.(项目f6)根据项目f5所述的方法,其中,
140.所述回收通过对细胞或含有细胞的胶囊粒子施加离子电流来回收靶细胞或含有靶细胞的胶囊粒子。
141.(项目f7)根据项目f1~f6中任一项所述的方法,其中,
142.在所述判别工序中,对细胞的流速进行光学判定,从基于光学上得到的细胞的流速而进行校正后的细胞的像中获取特征并进行解析。
143.(项目f8)根据项目f1~f7中任一项所述的方法,其中,
144.所述方法用于对所述细胞试样液中的细胞的形状的全量下的尺寸、周长、和/或内部微细结构的粒子量比例的分布进行测定,并根据该分布的变化来判定异常的有无。
145.(项目f9)根据项目f1~f8中任一项所述的方法,其中,所述方法用于对源自被检体的细胞试样中的异常细胞进行分离
·
鉴定。
146.(项目g1)一种方法,其对源于被检者的细胞试样中的异常细胞的有无进行判定,其中,所述方法包括以下工序:
147.(a)对源于被检者的细胞试样液所含的细胞进行处理的工序;
148.(b)将处理后的所述细胞封入胶囊中来制作胶囊粒子的工序;
149.(c)对源于所述被检者的细胞试样中的异常细胞的有无进行判定的工序,其中,所述判别包括以下步骤,即,
150.a)对处理后的所述细胞或封入至胶囊粒子中的所述细胞的图像进行获取的步骤;
151.b)根据获取到的所述图像而生成所述细胞的流速数据的步骤;
152.c)基于所述流速数据而生成准确的细胞形状数据的步骤;
153.d)基于所述细胞形状数据而连续地解析细胞的信息的步骤;
154.e)根据基于所述细胞形状数据而得到的细胞的信息而输出被检试样整体的细胞信息的分布的步骤;以及
155.f)根据所述细胞信息的分布而判别所述被检者的细胞中的异常的步骤。
156.(项目g2)根据项目g1所述的方法,其中,所述进行处理的工序包括:对成为候补的尺寸区域的细胞进行纯化、浓缩、染色和/或清洗。
157.(项目g3)根据项目g1或g2所述的方法,其中,在所述进行处理的工序中,对所述细胞试样液中的细胞选择性地连续进行尺寸分级。
158.(项目g4)根据项目g1~g3中任一项所述的方法,其中,在所述制作胶囊粒子的工序中,通过在含有二价离子的溶液中混合含有溶胶状态的海藻酸和所述细胞的溶液,来构
建含有细胞的海藻酸的胶囊粒子。
159.(项目g5)根据项目g1~g4中任一项所述的方法,其中,在所述制作胶囊粒子的工序中,使所述海藻酸的胶囊粒子的粒径一致,判别含有细胞的胶囊粒子和不含细胞的胶囊粒子并选择性地回收含有细胞的胶囊粒子。
160.(项目g6)根据项目g5所述的方法,其中,所述回收通过对细胞或含有细胞的胶囊粒子施加离子电流来回收靶细胞或含有靶细胞的胶囊粒子。
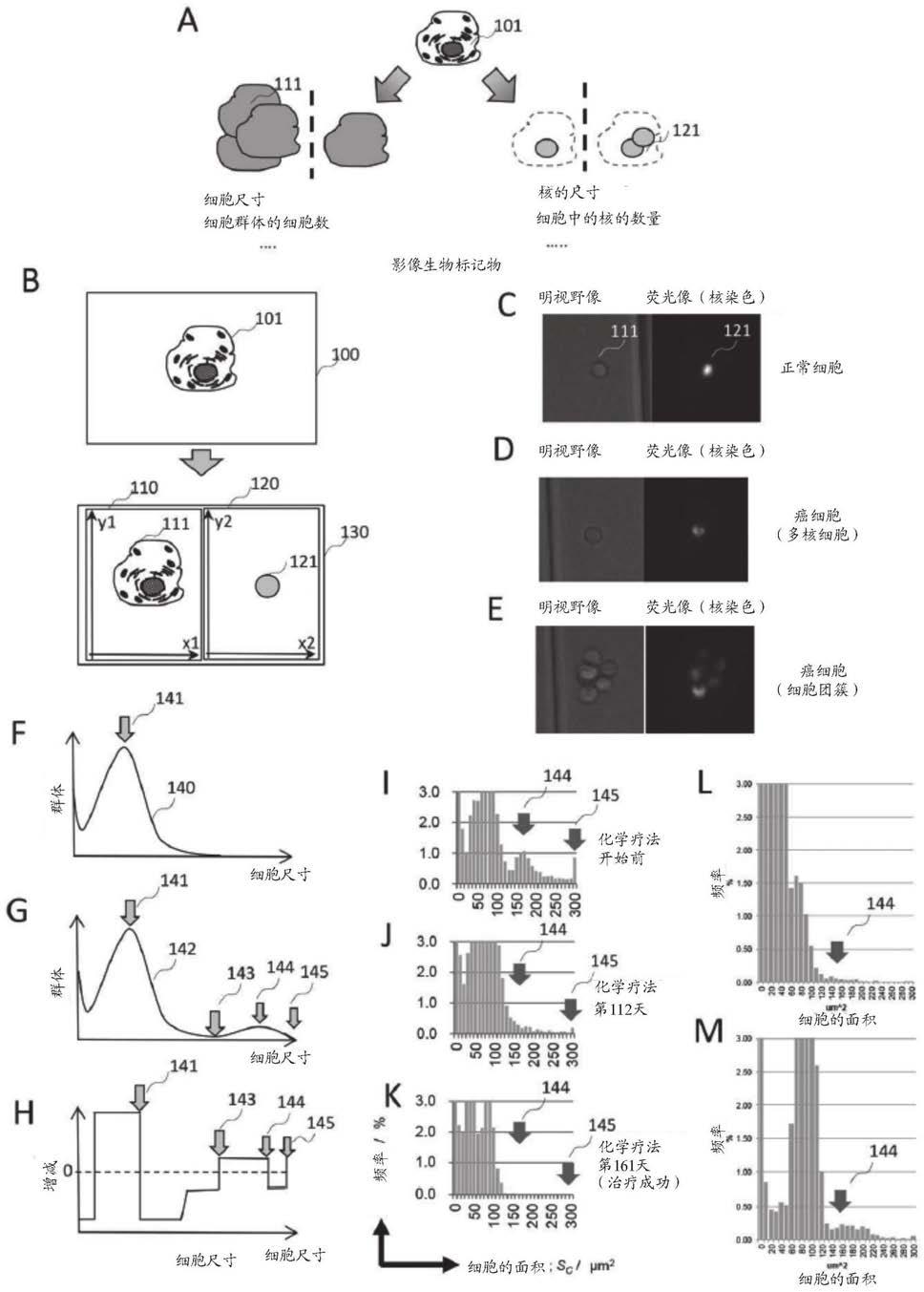
161.(项目g7)根据项目g1~g6中任一项所述的方法,其中,在所述进行判别的工序中,对细胞的流速进行光学判定,从基于光学上得到的细胞的流速而进行校正后的细胞的像中获取特征并进行解析。
162.(项目g8)一种程序,其使计算机执行对源于被检者的细胞试样中的异常细胞的有无进行判定的方法的处理,其中,所述方法包括以下工序:
163.(a)使所述计算机对源于被检者的细胞试样液所含的细胞进行处理的工序;
164.(b)使所述计算机将处理后的所述细胞封入胶囊中来制作胶囊粒子的工序;
165.(c)使所述计算机对源于所述被检者的细胞试样中的异常细胞的有无进行判定的工序,其中,所述判别包括以下步骤,即,
166.a)使所述计算机对处理后的所述细胞或封入至胶囊粒子中的所述细胞的图像进行获取的步骤;
167.b)使所述计算机根据获取到的所述图像而生成所述细胞的流速数据的步骤;
168.c)使所述计算机基于所述流速数据而生成准确的细胞形状数据的步骤;
169.d)使所述计算机基于所述细胞形状数据而连续地解析细胞的信息的步骤;
170.e)使所述计算机根据基于所述细胞形状数据得到的细胞的信息而输出被检试样整体的细胞信息的分布的步骤;以及
171.f)使所述计算机根据所述细胞信息的分布而判别所述被检者的细胞中的异常的步骤。
172.(项目g9)一种记录介质,其保存计算机程序,该计算机程序使计算机执行对源于被检者的细胞试样中的异常细胞的有无进行判定的方法的处理,其中,
173.所述方法包括以下工序:
174.(a)使所述计算机对源于被检者的细胞试样液所含的细胞进行处理的工序;
175.(b)使所述计算机将处理后的所述细胞封入胶囊中来制作胶囊粒子的工序;
176.(c)使所述计算机对源于所述被检者的细胞试样中的异常细胞的有无进行判定的工序,其中,所述判别包括以下步骤,即,
177.a)使所述计算机对处理后的所述细胞或封入至胶囊粒子中的所述细胞的图像进行获取的步骤;
178.b)使所述计算机根据获取到的所述图像而生成所述细胞的流速数据的步骤;
179.c)使所述计算机基于所述流速数据而生成准确的细胞形状数据的步骤;
180.d)使所述计算机基于所述细胞形状数据而连续地解析细胞的信息的步骤;
181.e)使所述计算机根据基于所述细胞形状数据得到的细胞的信息而输出被检试样整体的细胞信息的分布的步骤;以及
182.f)使所述计算机根据所述细胞信息的分布而判别所述被检者的细胞中的异常的
步骤。
183.(项目g10)一种系统,其对源于被检者的细胞试样中的异常细胞的有无进行判定,其中,所述系统系统包括:
184.(a)对源于被检者的细胞试样液所含的细胞进行处理的机构;
185.(b)将处理后的所述细胞封入胶囊中来制作胶囊粒子的机构;
186.(c)对源于所述被检者的细胞试样中的异常细胞的有无进行判定的机构,其中,所述判别包括以下机构,即,
187.a)对处理后的所述细胞或封入至胶囊粒子中的所述细胞的图像进行获取的机构;
188.b)根据获取到的所述图像而生成所述细胞的流速数据的机构;
189.c)基于所述流速数据而生成准确的细胞形状数据的机构;
190.d)基于所述细胞形状数据而连续地解析细胞的信息的机构;
191.e)根据基于所述细胞形状数据得到的细胞的信息而输出被检试样整体的细胞信息的分布的机构;以及
192.f)根据所述细胞信息的分布而判别所述被检者的细胞中的异常的机构。
193.发明效果
194.根据本发明,能够对源自被检体的细胞试样中的异常细胞进行分离
·
鉴定。
附图说明
195.图1是概念性地示出针对使用本发明的细胞分析装置系统进行的细胞分析而由细胞分析装置的系统所进行的以图像为基准的细胞筛选技术的概要的一例的示意图以及照片。
196.图2是概念性地示出使用本发明的细胞分析装置系统进行的细胞分析的整体过程、以及与各个工序对应的装置内的机构的一例的示意图。
197.图3是示意性地示出图2中的本发明的细胞分析装置系统的整体结构的一例的图。
198.图4是示意性地示出图3中的细胞浓缩
·
尺寸分级
·
染色
·
清洗部模块的结构的一例的图。
199.图5是示意性地示出图3中的细胞浓缩
·
尺寸分级
·
染色
·
清洗部模块的结构的另一例(柱阵列方式)的图。
200.图6是示意性地示出图3中的细胞浓缩
·
尺寸分级
·
染色
·
清洗部模块的结构的另一例(柱阵列方式)的动作原理的图。
201.图7是示意性地示出图3中的细胞浓缩
·
尺寸分级
·
染色
·
清洗部模块中使用的微细加工技术的一例的图。
202.图8是示意性地示出图3中的细胞
·
细胞块胶囊化部模块的结构的图。
203.图9是示意性地示出图3中的图像检测型单细胞分离
·
纯化部(细胞分选部)模块的结构的一例的图。
204.图10是示意性地示出图3中的图像检测型单细胞分离
·
纯化部(细胞分选部)模块的结构的另一例的图。
205.图11是示意性地示出图9中的图像检测型单细胞分离
·
纯化部(细胞分选部)模块的构成要素的组合的一例的图。
206.图12是示意性地示出图10中的图像检测型单细胞分离
·
纯化部(细胞分选部)模块的构成要素的组合的另一例的图。
207.图13示意性地示出同时进行高速明视野显微镜图像获取和高速荧光显微镜图像获取的解析系统的结构的一例的图。
208.图14是示意性地示出同时进行荧光强度测量、高速明视野显微镜图像获取、以及高速荧光显微镜图像获取的解析系统的结构的一例的图。
209.图15是示意性地示出同时进行荧光强度测量、高速明视野显微镜图像获取、以及高速荧光显微镜图像获取的解析系统的光学模块部分的结构的另一例的外观的图。
210.图16是示意性地示出本发明中的图像检测型单细胞分离
·
纯化部(细胞分选部)模块的芯片结构的一例的图。
211.图17是示意性地示出图像检测型单细胞分离
·
纯化部(细胞分选部)模块中的高速闪光光源的发光时序与电子快门(electronic shutter)的关系的一例的图。
212.图18是示意性地示出图像检测型单细胞分离
·
纯化部(细胞分选部)模块中的用于防止图像模糊的光学系统的结构的一例的图。
213.图19是示意性地示出图像检测型单细胞分离
·
纯化部(细胞分选部)模块中的使用了线性传感器组(line sensor set)的连续高速图像获取系统的结构的一例的图。
214.图20是示意性地示出在图像检测型单细胞分离
·
纯化部(细胞分选部)模块的使用了线性传感器组的连续高速图像获取系统中,同时获取多个成像面的像的线性传感器阵列组的结构、以及同时获取多色荧光的线性传感器阵列组的结构的一例的图。
215.图21是示出对同时获取高速明视野显微镜图像和高速荧光显微镜图像之后的图像处理的过程进行说明的图、以及同时获取了高速明视野显微镜图像和核荧光染色后的高速荧光显微镜图像的图像的例子的照片。
具体实施方式
216.本发明的实施方式为细胞分析装置系统以及使用了该细胞分析装置系统的细胞分析方法。以下,一起结合附图的说明和实施例的说明对这些优选的实施方式进行说明。
217.需要说明的是,在本说明书中提及的全部文献通过引用而将其整体并入本说明书中。这里记载的实施例是对本发明的实施方式的例示,而不应被解释为限制本发明的范围。
218.<1.细胞分析装置的系统所进行的细胞筛选技术的概念的概要>
219.图1是概念性地示出针对使用本发明的细胞分析装置系统进行的细胞分析而由细胞分析装置的系统所进行的以图像为基准的细胞筛选技术的概念的概要的一例的图。
220.图1的a说明了在本发明中系统实际获取到的细胞像101直接用作用于根据该获取图像本身详细地分析细胞的指标(即影像生物标记物)的情况。就在此所述的指标而言,首先,不仅包括能够通过明视野显微镜观察来判别的信息、即细胞的大小、形状的特征,而且还包括细胞是否形成聚集体(团簇)即有无群集及群体尺寸(构成的细胞数和种类)等信息。而且,有利用核染色等而能够通过荧光显微镜观察来判别的信息、即细胞内的核的尺寸、是否形成多核细胞这样的信息。特别是,关于细胞的形状、团簇化的信息,难以通过现有的光散射测量、光吸收、或者电阻抗的变化的解析技术等来得到,而需要获取图像并对其进行解析的技术。
221.图1的b是说明为了实现上述图1的a的说明中所述的手法而使用本发明的细胞分析装置系统进行的细胞分析的图。通过物镜而得到的输入图像100成为由多个波长的光的信息重合而得到的细胞101的数据,但经过对波长进行分离的机构,由此,能够同时获取例如明视野的输出图像110、以及由荧光标识后的核的荧光像构成的输出图像120。因此,细胞像101通过以相同的放大率被同时分解为各光波长,例如将明视野的细胞形状的图像111和细胞中的荧光染色后的核成分的荧光图像121同时作为各个波长的图像而被同时获取,从而能够将它们作为相同并行的两个二维相对坐标轴x1-y1和x2-y2上的坐标来进行比较,能够推定具有荧光的核成分121的位置相当于细胞111的哪个位置。通过使用该功能,能够明确例如明视野像中得到的细胞像111是否为有核细胞、或者是否为多核细胞。另外,在明视野图像111中,能够获取细胞的形状、大小、细胞有无成块的状态、形成细胞块时的细胞群体的个数的概数等。另外,在荧光图像121中,例如通过使用对核特异性地染色的荧光色素,能够获取细胞内部的核的个数和核各自的面积等。
222.图1的c至图1的e是示出将高速明视野显微镜图像和核荧光染色后的高速荧光显微镜图像通过分割出一个超高速相机受光面而同时获取到的两张图像的例子的显微镜照片。如上述的图1的b所述,在本发明中,通过预先使两个图像的相对坐标一致,对于能够借助荧光像来鉴定的核的位置而言,能够使用彼此的相对坐标来对照核分布于明视野像的细胞像或者细胞团簇像中的哪个部位。通过该相对坐标的对照,例如如图1的c的显微镜照片所示,能够同时获取明视野像和荧光像,可知对于健康者的正常细胞而言,在光滑的细胞表面和正常尺寸的细胞中,一个核以显示正常截面积尺寸的荧光发光。另一方面,对于癌细胞而言,多核化是一个癌细胞的指标,但如图1的d的照片所示,可知通过相对坐标的对照,在左照片的明视野像中与正常细胞相同形状及尺寸的独立单个细胞中,分裂出的两个核发光。另外,在正常血液中虽未存在,但如图1的e的照片所示,在癌转移症例的血液中,通过细胞团簇以及该团簇中的各细胞的核的荧光,观察到团簇内的多个核的荧光,从这样的多个核的荧光可知是团簇。另外,关于这样的细胞呈团簇形状的判别,只要是如该照片所示那样根据图像获取的解析,则能够容易地进行判断,但在作为现有技术的光散射、阻抗测量方法等中,即使得到大小不同这样的信息,也难以判别其是细胞尺寸的不同,还是多个细胞聚集而成的细胞块。而且,基于图像的解析法的特征还在于,通过从相同的图像中进行波长分离而同时获取明视野像和荧光像,能够对基于空间信息而得到的核与细胞的位置关系进行比较。为了针对获取到的图像在流动方向y1、y2上都求出准确的细胞的体积(在此为二维投影的面积),通过变换作为图像而获取到的图像在流动方向上的长度,从而变换成流动方向(y1,y2)与垂直于流动的方向(x1,x2)的长度相等,获取准确的二维图像。
223.另外,在本发明中,例如预先通过图像处理从图1的e的细胞团簇的明视野像中减去细胞未流动时所获取到的背景图像数据,由此将仅对细胞或者细胞块的像进行提取的步骤(procedure)与获取该提取到的像的边界线(细胞或者细胞块的外围线)的长度及由边界线包围的区域的面积的机构进行组合,从而即使仅使用明视野像也能够进行细胞块的判别。这有效地利用了在观察区域相同的位置处定点观察而得到的连续图像中细胞流动这样的细胞分选器的特征。在此,由于与背景像相同的像的像素全部通过减法运算而成为零,因此仅自动地提取与背景像不同的细胞图像的各像素的数据,而不需要以往的通过复杂的对比度比较而相对地求出溶液中的细胞与溶液的边界线的方法,对于根据像素的数据不为零
的边界线的二维坐标而容易获取到的细胞或者细胞块的边界线的实测周长l、以及相应地由该边界线包围的细胞的区域整体的实测面积s而言,前者可以通过对边界线的像素数进行计数而求出,后者可以通过对边界线内的区域的全像素数进行计数而求出。另外,细胞块的判别的步骤例如按如下步骤进行。根据实测面积s,首先,求出将该面积s假定为细胞是半径r的圆球时的投影像的情况下的假想半径r。r可以根据从图像实测出的截面积s并通过r=(s/π)
1/2
求出,接着,通过l0=2πr=2(πs)
1/2
求出此时的以圆换算的假想周长l0。在将实测出的周长l与假想周长l0之比设为d时,若d=l/l0为1则细胞为圆球,细胞或者细胞块的形状越偏离圆球则周长l越长,因此d越大。在此,根据测量出的细胞或者细胞块的实测面积s,一并确认是否成为比单个细胞大的尺寸,在其结果同时满足的情况下,能够判定是否为细胞团簇。即,例如通过使用“(d》1.1)且(s>800μm2)”这样的指标,即使不使用荧光像,仅使用明视野像也能够判定是细胞团簇。
224.同样地,在本发明中,例如预先通过图像处理从图1的c、图1的d、以及图1的e的细胞团簇的荧光像中减去细胞未流动时所获取到的背景图像数据,由此,通过将仅对细胞或者细胞块的像进行提取的步骤与获取该提取到的像的边界线(细胞或者细胞块的外围线)的长度及由边界线包围的区域的面积的机构进行组合,从而例如若是对核进行荧光染色后的情况,则能够简单地对核的个数、尺寸进行计数。这与上述的明视野像的情况同样,也有效地利用了在观察区域相同的位置处定点观察而得到的连续图像中细胞流动这样的细胞分选器的特征。在此,也同样地由于与背景像相同的像的像素全部通过减法运算而全部成为零,因此仅自动地提取与背景像不同的不为零的像素部分作为细胞的图像的各像素的数据,对于根据像素的数据不为零的边界线的二维坐标而容易获取到的细胞或者细胞块的边界线的实测周长l、以及相应地由该边界线包围的细胞的区域整体的实测面积s而言,前者可以通过对边界线的像素数进行计数而求出,后者可以通过对边界线内的区域的全像素数进行计数而求出。另外,在此,由于为了使单个细胞或者单个细胞块进入一个获取图像,而使细胞或者细胞块以在流动的中心保持间隔地串联成一列的形式流动,因此虽然在明视野像中的一个画面形成单个细胞或者单个细胞块,但在荧光像中观察到多个核。因此,在荧光观察中获取多个独立的区域(核)以及它们各自的边界线(外围线)。针对各个核,通过与明视野像时相同的步骤,并根据各个区域(核)的周长与截面积的比较解析来判断它们是否为正常的核。核尺寸的判别的步骤例如按如下步骤进行。根据实测面积s,首先,求出将该面积s假定为细胞是半径r的圆球时的投影图像的情况下的假想半径r。r可以根据从图像实测出的截面积s并通过r=(s/π)
1/2
来求出,接着,通过l0=2πr=2(πs)
1/2
求出此时的以圆换算的假想周长l0。
225.在将实测出的周长l与假想周长l0之比设为d时,若d=l/l0为1则核为圆球,形状越偏离圆球则周长l越长,因此d越大。因此,在d》1.2的情况下,能够进行核的状态为异常这样的判断。另外,针对核的个数,算出各荧光的面积并相应地获取各个被视为核的面积的重心,在各个核的重心的位置离开3μm以上时,能够判断为单独的核。
226.另外,在图1的f至h中,示意性地示出在本发明的装置中进行测量时通过明视野显微镜观察从血液中除去红血球成分之后的白血球成分(血液中除去红血球后剩余的细胞整体)的细胞的情况下的面积的尺寸分布图的例子。图1的f示意性地示出健康者的血液的尺寸分布,但正常的每一个细胞以独立的状况流动,其分布140成为50μm2至100μm2的尺寸区域
中具有一个细胞数峰141的分布。这相当于细胞尺寸为直径10μm左右。图1的g示意性地示出转移癌发病患者的血液的白血球成分的尺寸分布。在该分布142中,在健康者的血液的分布140中没有观察到的第二峰144一旦在100μm2至150μm2的区域中存在极小值143后就产生于150μm2至200μm2的区域中。这相当于换算成细胞尺寸而直径为16μm左右。另外,作为特征,一并产生超过300μm2的尺寸区域的峰(箭头145)。它们的存在能够如图1的h所示那样根据对血液中的白血球成分的分布(140或者142)的差异进行微分得到的结果的增减来更容易地求出。如果使用该曲线图,若有细胞尺寸超过150μm2时增加的情况(箭头143),则能够推定为转移癌患者的血液。
227.具体而言,图1的i至图1的k示出例如转移癌模型(哥本哈根大鼠,copenhagen rat)的血液样品的处方前到化疗(chemotherapy)完成为止的血中的细胞尺寸分布的变化。开始化疗前的转移癌模型的血液的尺寸分布具有图1的i那样的分布,在细胞尺寸150μm2至200μm2的区域存在明确的第二尺寸的峰(箭头144),另外,存在许多细胞尺寸超过300μm2的细胞(箭头145)。然后,以化疗药(多西他赛(docetaxel)水合物)为处方,观察第112天的血液样品的细胞尺寸分布的图1的j时,处方开始前的图1的i中所存在的细胞尺寸150μm2至200μm2的区域的明确的第二尺寸的峰消失,另外,细胞尺寸超过300μm2的细胞的数量也观察到减少。然后,在化疗开始的第161天,转移癌从模型中消失,另外,从图1的k的细胞尺寸的分布图也可知,在细胞尺寸150μm2至200μm2的区域中明确的第二尺寸的峰完全消失,另外,细胞尺寸超过300μm2的细胞也消失。另外,图1的l是健康的模型的血液的细胞尺寸分布。健康的模型的血液的尺寸分布和上述的图1的k的治疗成功后的转移癌模型同样地,在细胞尺寸150μm2至200μm2的区域中不存在明确的第二尺寸的峰,另外,也不存在细胞尺寸超过300μm2的细胞。
228.另外,图1的m是患有感染症的动物模型(哥本哈根大鼠)的血液的细胞尺寸分布。在患上感染症的情况下,在细胞尺寸150μm2至200μm2的区域中产生小的第二尺寸的峰,但无法确认细胞尺寸超过300μm2的细胞的显著增多。这样,表示出根据细胞尺寸150μm2至200μm2的区域的明确的增多与细胞尺寸超过300μm2的细胞有无显著增多之间的差异,能够在血液的诊断中识别并判断转移癌和感染症的感染。
229.这样,使用本发明的装置系统的图像解析判别的机构,通过以下的(1)~(5)来确认血液中是否存在转移癌,另外,也可以不使用以往的分子生物标记物,而用“细胞的形状、群集状态、或者多核化等内部结构等的图像影像”这样的新的生物标记物来鉴定并选择性地回收血中癌细胞。即,(1)将在健康的血液中不存在的细胞团簇(块)鉴定为血中癌细胞候补的方法;(2)将在健康的血液中不存在的多核细胞鉴定为血中癌细胞候补并选择性地回收的方法;(3)将在健康的血液中不存在的巨大细胞鉴定为血中癌细胞候补并选择性地回收的方法;(4)根据血中的白血球(从血液中除去红血球成分后剩余的细胞整体)的尺寸分布图来判定具有以下尺寸分布、即该尺寸分布与健康者的特征不同且具有转移癌患者所特有的尺寸分布的方法以及对特征性的尺寸分布区域的细胞进行选择性地回收的方法;(5)通过在上述(1)(2)(3)或者(4)的基础上组合了荧光强度的检测的解析而鉴定为癌细胞并选择性地回收的方法,该荧光强度的检测表示与利用荧光强度测量而测量出的针对癌细胞的一个或者多个生物标记物(例如epcam抗体、k-ras抗体、细胞角蛋白抗体等)的抗体标识了荧光的荧光标识抗体的存在。另外,用上述方法回收到的血中癌细胞候补,接着,通过组
合上述微小细胞用pcr解析技术等基因解析机构来进行基因变异的测量或者进行再培养来评价细胞功能,由此能够最终鉴定是否为癌细胞,并且在为癌细胞的情况下最终鉴定是具有何种特征的癌细胞。
230.关于(1),能够通过基于明视野像的细胞像的d>1.1以及s>800μm2而得到的评价、或者、明视野像的尺寸、荧光像的核的数量及分布(即,对于相邻的多个核的像,它们重心的距离相互离开3μm以上)以及基于核的d>1.3而得到的评价,来进行判别。关于(2),能够通过基于明视野像的d<1.1、s<800μm2、且核的数量及分布(即,对于相邻的多个核的像,它们重心之间的距离相互离开3μm以内)以及基于核的d<1.3而得到的评价,来进行判别。关于(3),能够通过基于明视野像的d<1.1、且细胞尺寸s>800μm2,来进行判别。关于(4),可以通过如图1的f至图1的m所说明的那样在细胞尺寸150μm2至200μm2的区域中存在明确的第二尺寸的峰(箭头144)且存在许多细胞尺寸超过300μm2的细胞,来进行判别。关于该条件,与上述(1)至(3)的条件不同,为了获取细胞尺寸分布的直方图,需要获取所需的细胞数量的血液中的白血球细胞的全量数据,这最少需要5000个白血球细胞。另外,特别地,能够组合上述(1)至(4)并将具有一个以上的符合条件的细胞判定为癌细胞。
231.<2.典型的实施方式的概要(装置的概要)>
232.为了进行以图1中所说明的图像数据为基础的细胞判别,本发明的细胞分析装置系统大致如图2中示意性地示出那样包括以下三个要素。即,具备:
233.(1)细胞前处理部,其包括细胞浓缩
·
染色
·
清洗部和细胞
·
细胞块胶囊化部,该细胞浓缩
·
染色
·
清洗部连续地进行包含细胞的浓缩、细胞的尺寸分级、利用荧光抗体标识(或者在进行再培养的情况下根据需要而使用的适体等可逆荧光标识标记物)的染色、以及清洗在内的过程,该细胞
·
细胞块胶囊化部以单个细胞或者单个细胞块为单位进行胶囊化;
234.(2)图像检测型单细胞分离
·
纯化部(细胞分选部),其从在形成于芯片基板上的微流路中流动的细胞,高速地获取细胞像的图像数据,并基于该图像信息的分析结果进行细胞的种类的定量分布解析(quantitative distribution analysis),另外实时且高速地对细胞进行分离纯化;以及
235.(3)控制解析部,其用于控制上述各部的动作并进行上述解析。
236.另外,为了以一个细胞为单位对分级出的细胞进行解析,在上述部分的后段可以添加以下部分等,即
237.(4)基因解析
·
表达解析部,其对单个细胞或者单个细胞块水平下的细胞内状态进行测量;
238.(5)无污染再培养部,其将纯化过的细胞或者细胞块一边防止污染一边分别单独地再培养。
239.本发明的细胞分析装置系统的典型的实施方式的特征在于,将上述三个模块中的(1)~(2)按照上述顺序连续地进行组合,并且由于利用微小流路以及微小容器连续地处理细胞,因此,能够使微量细胞的由于污染、操作导致的消失为最低限度。
240.通过使用本发明的该细胞分析装置系统,为了判别细胞的种类,能够使用明视野显微镜图像,并根据其形状的特征以及从二维图像得到的尺寸(体积、体积的二维图像)、以及周长,以单个细胞水平来检测并确认细胞,且确认并判定细胞为未团簇化的独立单个细
胞还是团簇化的细胞群体。因此,根据本发明的细胞分析装置系统,能够基于在现有的散射光检测型细胞分选器技术中无法识别的指标,对细胞和聚集成的细胞群体进行识别并计数,并选择性地进行分离
·
纯化。
241.另外,通过使用本发明的细胞分析装置系统,能够以单个细胞水平来检测并确认用于判别细胞的种类的由核染色引起的细胞的荧光标识的有无,并针对荧光标识后的细胞,确认细胞为未团簇化的独立单个细胞,另外,能够确认并判定是否为多核细胞。因此,根据本发明的细胞分析装置系统,能够根据基于在现有的散射光检测型细胞分选器技术中无法识别的影像而得到的核的形状、尺寸、以及各核的空间配置的状况这样的指标,来对细胞进行判别并计数,进而进行分离
·
纯化。
242.另外,通过使用本发明的细胞分析装置系统,能够以单个细胞水平来检测并确认用于判别细胞种类的荧光标识抗体中的细胞的荧光标识的有无,并针对荧光标识后的细胞,确认细胞为未团簇化的独立单个细胞,而且能够判定在细胞中是否发生凋亡。因此,根据本发明的细胞分析装置系统,能够基于在现有的散射光检测型细胞分选器技术中无法识别的指标对细胞进行分离
·
纯化。
243.根据本发明的细胞分析装置系统,能够准确地以一个细胞为单位对特定形状或者细胞块、或者特定区域被以特定形状染色后的细胞进行判定并计数,而且对它们选择性地进行回收,另外,能够确认回收的细胞的凋亡等的细胞状态,若与各细胞的荧光信息及细胞状态的信息一起组合基因解析
·
表达解析装置,则能够对细胞的基因信息、表达信息进行解析。
244.另外,根据本发明的细胞分析装置系统,能够准确地以单个细胞或者单个细胞块为单位对具有特定形状的特征的细胞、或者特定区域被以特定形状染色后的细胞进行判定并计数,且获取并解析符合各指标的细胞的数量相对于上述判定并计数的细胞的全部数量的比例分布。
245.使用图2来说明用于实现上述功能的结构的概要。但是,图2所示的结构示意性地示出通过组合上述三个模块(1)~(3)而构成的细胞分析装置系统所进行的以图像为基准的细胞筛选技术的结构的概要的一例。另外,示出了在其中增添(4)的基因解析
·
表达解析部、或者(5)的无污染再培养部的情况。例如,还存在以下用法:仅使用(1)的尺寸分级的结构且使其最适合于细胞尺寸超过300μm2的细胞的回收,并将选择性地回收到的细胞使用于(4)的基因变异解析;或者不进行(1)的细胞的前处理而使用(2)的通过高速地获取细胞像的图像数据并基于该图像信息的分析结果进行细胞的种类的定量分布解析来确认血中的异常细胞以及异常细胞团簇的存。
246.以下说明通过将(1)至(5)的模块按照该顺序连续地进行组合而构成的细胞分析装置系统的详细的一例。
247.首先,在(1)中,将从患者采集到的血液样品导入细胞浓缩
·
尺寸分级
·
染色
·
清洗部。在此,进行从血液中仅浓缩并提取细胞成分的步骤。在此,特别是,连续地分离红血球成分及其他成分,并选择性地回收白血球成分(血液中除红血球成分以外的其他细胞的全量)。或者,特别是在想要选择性地回收白血球细胞块的情况下,通过将细胞尺寸的阈值设定为以体积换算计细胞尺寸超过300μm2,也能够在该前处理阶段中仅选择性地回收细胞团簇。之后,在其中添加荧光癌标记物等荧光标识剂,并在使荧光标识剂与试样细胞反应后将
未反应的剩余的荧光标识剂清洗除去。
248.接着,以单个细胞或者单个团簇为单位向封入海藻酸胶囊的细胞
·
细胞块胶囊化部进行导入。在此,通过将细胞封入海藻酸凝胶胶囊,能够防止之后的来自外界对细胞的污染,另外,在后段的细胞检测提取部的图像检测型单细胞分离纯化部(细胞分选部)中,在借助电泳力进行选择回收时,能够不依赖于细胞的表面电荷,而借助内装有这些细胞的海藻酸胶囊的稳定的恒定表面电荷,来一边防止对胶囊内部的细胞的损伤一边实现能够进行稳定的选择回收的附加性能的改善。但是,即使没有该海藻酸胶囊化,也能够进行本装置的一系列的图像检测型单细胞分离纯化部(细胞分选部)中的作业。另外,此时,通过在海藻酸胶囊中混合将粒径100μm以下的尺寸的铁、锰等的强磁性体微粒粉碎至不形成磁畴结构的尺寸而得到的物质,能够附加海藻酸胶囊作为超顺磁体而被磁场吸引的功能,由此,能够容易地进行选择性的回收。另外,通过使用调制成折射率与由海藻酸凝胶构成的海藻酸胶囊的折射率相同的溶液,能够使溶液中的海藻酸胶囊看似透明化,且能够容易地进行胶囊内的细胞的光学显微镜观察。具体而言,例如在海藻酸胶囊的折射率为1.4时,通过向溶液加入40wt%的蔗糖而能够成为相同的折射率,且通过上述使海藻酸胶囊含有铁纳米粒子,也能够调制浮力。
249.接着,在(2)的图像检测型单细胞分离纯化部(细胞分选部)中,进行基于两个光学图像的指标下的检测。首先,通过单个细胞水平下的明视野显微镜像,来确认细胞的外形、细胞内部的细胞内细胞器的形状、细胞内部的核与细胞质的尺寸之比、以及细胞块的状况。并且,确认与在明视野像中得到的细胞的位置对应的坐标中的基于荧光标识的荧光的发光的有无、以及它们的位置及大小。由此,能够确认细胞是否为成为对象的细胞。
250.该细胞检测功能构成为:在将细胞作为图像进行捕捉并评价的情况下,在流路分支部分的上游设置由高速相机进行观测的部位,根据需要在其下游设置细胞分离区域。也可以与图像无关地,对通过流路的细胞照射激光等,在用荧光修饰细胞横穿时的散射光、细胞的情况下,用光检测器检测该荧光。在该情况下,也构成为在检测部的下游设置成为细胞分离区域的分离流路点。
251.在该图像获取机构中,为了根据高速流动的细胞的获取图像而重构准确的细胞及细胞团簇的形状,而具备对各细胞的流速同时进行测量的功能,得到与该获取到的细胞的流速的信息相匹配地校正了细胞形状的信息的经准确重构的细胞形状信息,基于该结果并利用例如图1中所说明的基于细胞形状而得到的细胞尺寸、周长、内部结构等指标来进行判定。
252.对于测量细胞的流速,具体而言,在使用高速相机的情况下,例如,将某一瞬间的细胞图像同时作为两个不同波长且不同照射时间的明视野光源的图像,并经由双波长图像分割光学系统通过高速相机同时获取为各自分开的图像,根据它们的形状的差异,通过一次图像获取来算出细胞的移动速度,在基于该结果得到例如周长以及体积(的二维投影图像)的情况下,通过使所得到的细胞的轮廓形状中的流动的下游侧的前端部的边界线向流动的上游侧平行移动(移动速度
×
光源的照射时间)的量的距离,能够准确地算出原来的细胞的轮廓像以及体积。关于图像获取,可以使用具有1/200秒以下的时间分辨率的高速相机,与高速相机的快门周期相匹配地调整光源的发光,并使光源的光仅在各快门被释放的周期期间中的一定时间内发光。例如,在快门速度为1/10000秒的情况下,通过仅在其1/10
的期间内用led光源或者脉冲激光光源等能够进行高速发光控制的光源对作为对象的细胞照射光,能够获取细胞的精细形状。在以此为基准使两个波长的可见光源同时发光的情况下,例如,设定1/100000秒和1/50000秒的两个照射时间,并根据因照射时间之差而产生的流动方向上的细胞外形的全长的差异来算出流速。
253.另外,在使用高速线性传感器的情况下,基于由配置在流动方向上的线性传感器检测出的细胞的移动速度,能够将由与流动方向垂直地配置的线性传感器连续检测出的细胞的截面数据在流动方向上进行重构配置并获取。
254.通过将这样获取到的由高速相机或者高速线性传感器获取的图像作为与静止时相同的形状信息进行重构并实时分析所采集到的图像,1)能够判别细胞是具有一个核的独立细胞、还是多核细胞、还是无核细胞或者细胞分裂中的细胞、还是成为与其他细胞形成的细胞块,另外,2)能够判别发出荧光的细胞是健康的状态、还是变成细胞的核和细胞形状变形的凋亡等状态,根据目的,可以进行健康细胞的回收、细胞块的回收、多核细胞的回收、或者引起凋亡的细胞的回收。
255.另外,在本发明中,为了对细胞进行判定并进一步地分离
·
纯化,在用高速相机进行观察的区域的上游,使细胞或者细胞团簇在细胞正在流动中的流路的中央排列成直线状,因此,使用在含有细胞的溶液所流动的上游区域中,从其两肋侧添加相同速度的溶液以使流路宽度变窄排列的机构。而且,在进行观察的区域的下游,具有分支为两个非对称的流路宽度的结构,在不对细胞施加外力的情况下,细胞向包含中央在内的宽度较宽的分支流动,在施加外力的情况下,使细胞的位置从中央向宽度较窄的分支侧移动,从而能够使得细胞向较窄的分支流动,接着,通过仅对排列着流动而来的细胞中想要回收的细胞进一步施加外力而使细胞的流动位置移动,从而仅在施加该外力时细胞被导入上述分支为两个流路中的另一流路。在此,具体而言,作为外力,例如可以使用组装在想要施加流路的外力的区域中的含有钠离子等电解质的1对凝胶电极。通过使用凝胶电极,具有以下优点,即,即使流过较大的离子电流,也不会在流路中发生在蒸镀电极等观察到的由电解引起的气泡的产生、蒸镀电极的消失。另外,作为其他外力,在使用低电压或者用于使用感应电泳力的交变电场的情况下,也可以使用蒸镀电极。
256.另外,上述的装置结构记载了以对细胞进行分离
·
纯化为目的的结构的一例,在以进行细胞的判定为目的的结构的情况下,使用不具有施加外力的机构以及分支出的下游流路的结构。
257.可以将回收到的细胞导入下一级的高速
·
微量对应的基因解析
·
表达解析部,以使得能够针对各个细胞的方式分别进行(4)的基因解析、表达解析、或者(5)的以防止污染的形式再培养。
258.另外,对于在该阶段中识别并纯化出的细胞,在使用封入海藻酸胶囊的细胞的情况下,能够直接导入基因解析
·
表达解析部来防止污染并进行高速pcr解析等。另外,在进行再培养的情况下,也能够以纯化出的细胞为单位,使细胞在放入至海藻酸胶囊的状态下移动到无污染地进行再培养的容器,然后,用edta等药剂将使海藻酸凝胶化的钙等金属离子螯合,由此,除去海藻酸胶囊以进行再培养。
259.关于本发明中假定为检测对象的细胞,小的细胞为细菌,大的细胞为在血中流动的转移癌细胞团簇等。因此,作为细胞尺寸,典型地直径为约0.5μm至约200μm左右的范围。
当在基板的一面形成组合了细胞浓缩功能及细胞分离功能两者的流路并连续进行细胞浓缩及分离的情况下,首先成为问题的是流路宽度(截面形状)。另外,对于流路,最典型的尺寸是在基板的一个表面使用在基板的厚度方向上约10~约200μm的流路空间。
260.另外,在本发明中,由于向流路内导入试样液的导入压力成为液体移动的驱动力,因此,优选构成为分支出的多个导入流路以及多个排出流路的压力大致相同。因此,使这些入口、出口相对于重力的高度方向的位置为相同的高度。
261.另外,关于本发明的细胞识别和分离的算法,具有如下特征。首先,通过上述说明的机构求出细胞的流速,校正细胞的形状并进行重构。接着,对校正后的正确的细胞像的各像素进行二值化,求出其亮度重心。求出二值化后的细胞的亮度重心、面积、周长、长径、短径,并使用这些参数按照获取到各细胞的图像的顺序进行编号。由于将各细胞像在该时刻作为图像进行自动保存也对使用者而言是有益的,因此可以进行自动保存。
262.接着,是用于细胞分离的情况,但在编号后的细胞中,仅特定细胞必须分离。分离的指标既可以是上述说明的亮度重心、细胞的面积、周长、长径、短径等信息,也可以与图像分开地并用荧光检测,而得到利用荧光的上述图1的说明中所述的信息。总之,按照编号对由检测部得到的细胞进行分离。具体而言,通过与上述得到的细胞的移动速度(流速v)相匹配地,将从对细胞进行图像获取的检测部位置到施加外力的筛选部为止的距离设为(a),并且根据施加时间(t)而将施加时序设为(a/v)至(a/v t),从而在目标编号的细胞正好到达电极之间时,对细胞如上述那样施加外力来分配、分离细胞。
263.另外,关于本发明中使用的上述(4)的高速下的基因解析
·
表达解析部中的单个细胞基因组解析
·
表达解析的机构,为了达成上述目的,例如,所使用的反应控制装置具备:对于样品液的温度变化、对于想要变化的多个温度,将维持各温度的热容量大的液体用作热交换的介质,使该热容量大的多个不同温度的液体高速变化的机构;迅速进行该热容量大的液体与样品液之间的热交换的微小反应槽;以及对各液体进行更换的机构。
264.另外,基因解析
·
表达解析部能够在由上述(1)的前处理部将细胞或者细胞块封入到海藻酸胶囊的状态下进行pcr反应时,将无污染地导入海藻酸胶囊的细胞以微量的胶囊内的细胞为单位,而作为基于图像检测型单细胞分离纯化部的信息而被判别为同一细胞的单个细胞,或者,以同一细胞的群体单位进行基因的鉴定、或者表达的鉴定。
265.例如,根据图1的l所示的实验结果,由于在健康的血液中未检测到具有约250μm2以上的面积的细胞或者细胞块(团簇),因此在进行医疗诊断的情况下,由图像检测型单细胞分离
·
纯化部(细胞分选部)对具有250μm2以上的面积的细胞或者细胞块(团簇)进行筛选,并对其进行回收,通过再培养、或者基因变异检查、或者表达解析检查,对该细胞团簇进行鉴定,由此,可以进行判定血中是否存在转移癌细胞,或者不是判定癌而是判定是否为肝脏、肾脏等脏器由于因疾病而受到损伤所产生的细胞块。或者,在产生具有150μm2以上且小于250μm2的面积的细胞的峰的情况下,对150μm2以上且小于250μm2的细胞进行回收,确认这些细胞是否为因感染症而肥大化的白血球细胞,并且在感染症的情况下,能够作为用以明确包括根据掺入白血球中的异物的基因来鉴定致病菌的诊断装置来进行利用。特别是,对于血中转移癌的检测,以各团簇为单位更详细地比较解析其基因变异来进行确认,由此,在各团簇为同一基因变异物的情况下,可以推定癌症的进展程度为从原发性转移癌开始的初期,另外,在各团簇的变异的履历相同但很多不同的变异点处于各团簇之间的情况下,可以
推定转移癌的所在范围已经发展到扩散至多个区域。
266.另外,对于转移癌患者的血液,也能够确认以化疗、激素疗法处理之后的效果。对于该方法而言,若参照图1的i至图1的k的针对化疗的变化的经过,则在按照处方化疗之前,首先采集微量的患者血液,获取其细胞尺寸分布图,特别是记录具有150μm2以上且小于250μm2的面积的细胞的峰的存在与具有250μm2以上的面积的细胞或者细胞块(团簇)的存在的比例。接着,在各次按照处方化疗之后,同样采集微量的患者血液,获取其细胞尺寸分布图,特别是记录具有150μm2以上且小于250μm2的面积的细胞的峰的存在与具有250μm2以上的面积的细胞或者细胞块(团簇)的存在的比例,每次比较与上次获取到的试样之差。此时,在能够确认到两者减少的情况下,推定为化疗有效地起作用。因此,通过将施用量减少到能够确认抗癌功能的最小量,能够将副作用抑制在最低限度并使药效发挥到最大限度。另一方面,在未确认到减少的情况下,尝试施用至药剂的最大允许量,当即使在该情况下也没有效果时,则推荐判断变更为其他抗癌剂或者其他方法。
267.另外,在转移癌患者的外科手术后的癌残留可能性的检查、以及复发的早期发现中也可以使用本方法。具体而言,在进行外科手术之前,首先采集微量的患者血液,获取其细胞尺寸分布图,特别是记录具有150μm2以上且小于250μm2的面积的细胞的峰的存在与具有250μm2以上的面积的细胞或者细胞块(团簇)的存在的比例。接着,在结束外科手术后,同样采集微量的患者血液,获取其细胞尺寸分布图,特别是确认有无存在具有150μm2以上且小于250μm2的面积的细胞的峰、以及有无存在具有250μm2以上的面积的细胞或者细胞块(团簇)。在这些细胞存在的情况下,通过回收这些细胞并进行它们的基因检查,来确认是否残留转移癌。在这些细胞不存在的情况下,也能够例如以半年1次左右的周期定期地采集血液,并比较与上次的差来确认有无转移癌的复发。
268.另外,不仅是转移癌诊断,在能够鉴定在血中流动的细胞团簇为肝脏组织片的情况下,还能够推定肝脏的疾病,另外,同样在能够鉴定为其他脏器切片的情况下,能够推定为这些脏器各脏器的疾病。
269.而且,特别是对于巨噬细胞等吞噬性白血球而言,也能够回收尺寸比通常肥大的细胞,并对该细胞中的细菌等异种细胞的基因进行检查鉴定,由此,进行短时间内的感染症诊断。或者,也能够选择性地回收因b细胞的活化而使得内部形状复杂化的细胞、尺寸增大的细胞,用下一代测序仪等对该b细胞所产生的抗体的基因信息进行解析以明确抗原,由此诊断免疫系体如何反应。
270.<3.实现上述图1所示的步骤的细胞分析装置系统1的整体图像的一例>
271.图3示出实现上述图2所示的步骤的细胞分析装置系统的整体图像的一例。在该例中,细胞分析装置系统301具备:细胞浓缩
·
尺寸分级
·
染色
·
清洗部模块310,其以血液样品等试样在从上到下与重力相匹配的方向上流动的方式构成,并导入血液样品以进行细胞的前处理;细胞
·
细胞块胶囊化部模块320;图像检测型单细胞分离
·
纯化部模块330,其进行细胞的以一个细胞为单位的识别
·
纯化;基因解析
·
表达解析部340,其对纯化出的细胞的单个细胞或者单个细胞块水平下的细胞内状态进行测量;无污染再培养部模块350,其对纯化出的细胞进行再培养;以及控制解析部模块(计算机)360,其控制系统整体的动作,并且对解析结果进行分析。
272.以下具体示出图3所示的例中的各模块的结构的一例。
273.<4.进行细胞的前处理的细胞浓缩
·
尺寸分级
·
染色
·
清洗部的结构的一例>
274.图4示出将来自癌症患者等被检体的血液样品导入以进行细胞的前处理的细胞浓缩
·
染色
·
清洗部模块310的结构的一例。在图4的a的例子中,作为细胞浓缩
·
尺寸分级
·
染色
·
清洗机构的细胞浓缩
·
尺寸分级
·
染色
·
清洗部模块400一体地配置在机架414上,在模块内具有对试样细胞样品、染色剂、清洗剂的各溶液进行保持的容器或贮藏器(401、402、403),从此处借助安装于旋转臂415的分注头404,能够将溶液向配置在转盘405上的浓缩腔室408进行导入。如图4的b所示,浓缩腔室408与在底面配置有浓缩
·
脱色过滤器406的、朝向底面具有倾斜的试样液体保持腔室407合并成为浓缩腔室408。
275.在浓缩腔室408中,首先导入血液等试样细胞样品,借助压力泵409从浓缩腔室的上表面用气体施加压力,从而使液体成分通过浓缩
·
脱色过滤器406而向置于下方的废液回收管410排出,由此,进行细胞的浓缩。接着,使用分注头404导入染色液,在使其反应一定的时间后,再次借助压力泵409将染色液从浓缩腔室408排出。接着,通过将脱色剂导入浓缩腔室408,而将过量的染色剂清洗并排出。之后,一般构成为导入兼作清洗剂的稀释液,将细胞稀释至希望的浓度,并通过在前端具备回收芯片413的回收头411将细胞导入回收管412。该方法的优点在于,能够通过有效地利用膜过滤器而高效地对有可能引起堵塞的尺寸的试样成分少的试样进行分级、染色、清洗。
276.<5.进行细胞的前处理的细胞浓缩
·
尺寸分级
·
染色
·
清洗部的结构的另一例的结构>
277.图5是具有在利用上述图4所示那样的膜过滤器进行细胞纯化时有可能频繁发生堵塞、细胞压坏的尺寸分布的试样的情况下的、具有使用微细流路系统的细胞尺寸分级功能的细胞浓缩技术的一例。图5的a是用于实现该浓缩技术的微细流路的结构500的俯视图。从流路的上游起,使不含细胞的缓冲液501以占据流路宽度的3/4以上的区域的方式流入,并使各种尺寸的细胞混合存在的试样溶液502以占据剩余的流路宽度1/4以下的区域的方式沿流动506的方向流入流路507。在该流路507中,柱阵列503在该流路的两端具有倾斜并且配置在从上游到下游中除去作为最终出口的出口508的上游位置之外的整个区域,另外,作为交变电场施加机构,在与流路506的流动正交的两侧壁配置有一对电极504,通过对在流路507中沿流动506的方向流动的细胞在与流动正交的方向上施加交变电场,能够使细胞一边以正弦波状摆动一边向下游流动。在流路507的下游配置有两个回收出口508及509,比上述柱阵列503的相邻的柱间的距离(间隙)大的粒子在正弦波电场的作用下在流路中向下游流动时被柱阵列捕获,并阶梯状地一个一个地爬上柱,最终在出口508被回收。另一方面,比柱阵列503的相邻的柱间的距离(间隙)小的粒子在正弦波电场的作用下在流路中向下游流动时也不会被柱阵列捕获,而是一边以与进入流路时相同的位置为中心上下振动一边向下游流动,因此最终在出口509被回收。在此,下游出口508的流路宽度及下游出口509的流路宽度分别设为流路宽度整体的1/4以下、流路宽度整体的3/4以上,由此,能够防止比柱阵列503的相邻的柱间的距离(间隙)小的粒子混入到比柱阵列503的相邻的柱间的距离(间隙)大的粒子被回收的出口508。另外,施加于细胞的交变电场的强度被设定为细胞的振动振幅比相邻的柱阵列的倾斜大、且为流路宽度的1/4以下。
278.图5的b示出从上表面观察的相邻的柱阵列的配置的放大图的一例。通过将圆柱型的柱以其间隔设定为想要分级的细胞尺寸来进行配置,能够控制可以通过的细胞的尺寸。
279.图5的c示出柱阵列的空间配置的另一例。通过使初期的上游侧的倾斜变小并使下游侧的倾斜变大,能够更效率良好地进行分级。
280.为了解决以下问题,即,由于膜过滤器捕获超过膜的气孔尺寸(pore size)的细胞来妨碍其通过从而进行尺寸分级这样的技术规格,使得在膜过滤器表面的气孔全部被填埋而枯竭时膜过滤器的功能消失的问题,本技术通过引导不能通过气孔尺寸的细胞再次从气孔剥离并使其阶梯状地移动到回收流路,从而能够在防止气孔发生堵塞的同时连续地进行处理,特别是在对微量细胞团簇进行选择性地回收等回收超过一定阈值的尺寸的微量细胞时尤其有效。
281.另外,如图5的d所示,通过将具有不同间隔的多个柱阵列按照相邻的柱间的距离(间隙)从宽到窄地阶梯状配置,能够同时分离并回收多个不同的多个尺寸区域的细胞。在对较大的尺寸的细胞进行回收的下游出口508,为其配置有将柱间的距离设定得较大的第一段柱阵列503,由此,比柱阵列的间隔大的细胞或者细胞块全部被引导至下游出口508。接着,利用设定得比第一段柱阵列的间隔小的第二段柱阵列513,能够将比第二段柱阵列的柱彼此的间隔大且无法通过该间隔的中间尺寸的细胞导向下游出口510。并且,比它们中任一个都小的细胞全部被导向下游出口509。在该例中,通过组合上述两种间隔的柱阵列来表示三种分级的例子,同样地,通过更多地排列按照从更大的柱彼此的间隔到较小的柱彼此的间隔的顺序配置的柱阵列,能够实现更细且更多的尺寸分级。
282.<6.进行细胞的前处理的细胞浓缩
·
尺寸分级
·
染色
·
清洗部的另一例的工作原理>
283.图6示意性地示出利用图5所示的柱阵列的回收方法的原理。首先配置成包含用于分级的细胞在内的试样的溶液的流动600作为整体的流路的上侧的一部分、与对下游的较大的细胞进行回收的下游出口之间空出充分的空间,另一方面,不含细胞的溶液的流动601占据流路的下侧的大半部分,在该区域内配置有对较大的细胞进行回收的下游出口611。在将柱阵列602相对于试样溶液的流动600倾斜配置时,比柱阵列的柱彼此的间隔大的细胞604夹在柱间而无法流动。另一方面,比柱间隔小的细胞606、608直接在流动方向607、609上流动,并在下游出口610作为比柱间隔小的细胞被回收。另一方面,因比柱间隔大而夹在柱间的细胞通过被施加与试样溶液的流动600正交的正弦波的电场而从柱沿电场方向浮游,且每次继续被下一柱间隔夹住而在倾斜配置的柱中沿着柱的配置前进(箭头605)。由此,最终被引导至下游出口611并被分级。在此,电场603带来的与试样的流动600方向正交的方向成分的细胞的正弦波状的移动的大小设为能带来比相邻的柱的间隔大的振幅的程度以上,由此,能够在倾斜配置的柱上如箭头605所示那样阶梯性地行进而在出口611被回收。
284.<7.进行细胞的前处理的细胞浓缩
·
尺寸分级
·
染色
·
清洗部中使用的微细加工技术>
285.图7是示意性地说明用于使用光固化性树脂来制作高度100μm以上的直立的柱结构的方法的图。在使用图5以及图6所示的柱阵列的细胞的尺寸分级中,为了扩大能够同时处理所分级的细胞的尺寸的区域而需要连续配置高度100μm以上的柱。为了使该柱能够正确地进行尺寸分级,重要的是柱的粗细与高度无关而相同。然而,在使用光掩模并使用su8等光固化性树脂时,由于光的衍射现象而随着从开口部远离而扩展,当高度超过100μm时,梯形的形状变得显著。为了防止这种情况,通过在光固化性树脂的底面配置全反射面,能够
从梯形形成为直立的形状。图7的a是用于实现上述概念的配置的一例。在光掩模701上设计比想要构成的柱阵列的形状小10%左右的开口702,例如,在玻璃基板705上蒸镀10nm的铬以成为全反射面704,然后蒸镀200nm的金,并在其上配置100μm左右的su8等光固化性树脂。以与该光固化性树脂密接的方式放置上述光掩模701并对其照射用于使其光固化的紫外光即可。图7的b通过模拟示出实际因衍射而没有来自底面的全反射的情况下固化的区域的形状707、以及有全反射的情况下固化的区域的形状706。线707与线706之间的线分别是反射率取0%至100%之间的值的情况下的线。另外,用于实现成为所希望的柱的直径的形状的实际开口的大小通过确认实际光固化后的柱的直径来最终决定。通过使用这样制作出的直立的光固化性树脂作为铸模并使用pdms等其他固化性树脂,能够有效地制作具有直立的柱阵列的微细流路形状。
286.<8.进行细胞的胶囊化的细胞
·
细胞块胶囊化部的结构的一例>
287.图8是说明对使海藻酸凝胶的胶囊内装有细胞的胶囊进行制作的胶囊化部800的构成机构的图。
288.图8的a示出作为胶囊粒子构建机构而进行细胞的胶囊化的方法的一例。在毛细管801中流动的含有溶胶状态的海藻酸的溶液802中的细胞803或者细胞块通过毛细管的前端,被排出到装有含有钙等的2价离子的溶液809的容器807中,由此,海藻酸凝胶化而能够制作含有细胞的胶囊810、或者不含细胞的胶囊811。在此,根据毛细管内的电极804与配置在溶液809中的电极805之间的电流的变化、以及由测量器806得到的电阻的大小的变化,能够以流速来估算通过毛细管的细胞的有无、通过的细胞或者细胞块的尺寸、以及实际通过需要的时间。另外,为了能够稳定地测量此时的各电极的电位,也将接地电极808配置在溶液809中。根据所得到的流速数据,能够对实际排出的溶液802的排出压力进行反馈控制,以设为成为最佳的海藻酸胶囊的尺寸。在此,加入到用于制作海藻酸凝胶的胶囊的溶液809中的二价离子可以是钙、镁,但优选使用具有海藻酸胶囊的内部呈中空的特性的钡。
289.图8的b示出进行细胞的胶囊化的方法的另一例。在利用微细加工而构建成的结构812中,能够将含有细胞803的溶液从含有溶胶状态的海藻酸的细胞溶液的区域816经由挤压成漏斗状的区域817向用于使其凝胶化并制作胶囊的含有二价离子的溶液区域818排出,并将所制作出的含有细胞的海藻酸胶囊810、不含有细胞的海藻酸胶囊811与液流823一起取出。采用在进行排出的挤压成漏斗状的区域817的上表面导体面813与下表面导体面815之间夹设有绝缘层814的结构,且其间的电流量的变化用测量器819来进行测定,由此,与图8的a同样地,在排出的细胞溶液中存在细胞的情况下,同样能够获取电阻值的大小和电阻值变大的时间这两个信息,通过调整含有溶胶状态的海藻酸的细胞溶液的区域816的压力,能够调整排出速度。另外,配置有用于向含有二价离子的溶液区域818供给含有二价离子的溶液的流路820,并向箭头822的方向进行供给。
290.图8的c示意性地示出图8的a以及图8的b所示的、含有溶胶状态的海藻酸的溶液在通过微细的孔时产生的电阻值829相对于时间经过828的变化的测量结果的例830。当细胞通过时,在相对于孔的尺寸而言较小的细胞中产生小的电阻值的上升831、834,在中等程度的细胞中产生中等程度的电阻值的上升833、836,在较大的细胞中产生较大的电阻值的上升832、835。在此,若更详细地确认到电阻值的上升,则由仅由相对于孔的直径的细胞的尺寸来决定的电阻值部分840、以及细胞通过孔的经过时间837构成。该细胞通过孔的经过时
间成为由细胞尺寸与细胞通过孔时的流速的组合而得到的值。因此,在将经过时间837设为t,将根据电阻值得到的细胞的直径设为r,并将流速设为v的情况下,t=r/v且流速v通过v=r/t来求出。实际上仅由电阻值840求出的细胞尺寸取决于溶液802的离子强度和孔的尺寸来决定,因此,虽然需要最初进行校准,但是一旦进行校准,只要不更换溶液和毛细管,便能唯一且再现良好地求出细胞尺寸和电阻值。在此,若以求出的v成为所希望的海藻酸胶囊尺寸的方式进行反馈控制,则能够构建稳定的胶囊。
291.图8的d是示意性地示出作为细胞
·
胶囊粒子回收机构而在图8的a中所说明的海藻酸胶囊的构建机构中增加了仅对装有细胞的海藻酸胶囊进行回收的机构的结构的一例的图。如上述图8的a的说明中所述,根据在毛细管801的内部与外部的含有二价离子的溶液之间设置的一对电极804及805之间的电阻值的变化,能够判别细胞从毛细管排出的瞬间。因此,通过在下游配置对排出的海藻酸胶囊进行回收的毛细管841,在两个毛细管801与841之间形成供一个海藻酸胶囊不断通过的程度的短距离的开放区域,在该开放区域配置电极846及对该电极846施加电荷的电源845、以及接地电极808,并在包围两个毛细管的管840中形成溶液的流动844,由此,通过在能够根据电阻值的上升确认到含有细胞的胶囊的时刻不施加电场,而在除此时刻以外的时刻施加电场,能够将未内装有细胞的海藻酸胶囊811随着全部外侧的管840的流动而排出。
292.图8的e是通过微细加工实际构建了图8的b中说明的结构的一例的显微镜照片。将含有溶胶状态的海藻酸的细胞溶液向流动方向852排出,并利用从两侧面的流路853供给的含有二价离子的溶液的流动854,能够在下游制作含有细胞的海藻酸胶囊855。
293.图8的f是实际制作出的海藻酸胶囊的显微镜照片之一。在海藻酸胶囊860中封入有一个细胞861。另外,如在图1中也说明的那样,在将封入至海藻酸凝胶的细胞等作为明视野显微镜图像进行观察时,通过将周围的溶液的折射率调整为与海藻酸凝胶相同的值,能够使得实质上海藻酸凝胶作为明视野图像变得透明,且能够仅将封入至凝胶的细胞等与正好在溶液中直接浮游的细胞同样地进行观察。为此,例如,通过将蔗糖加入要观察的水溶液中来提高折射率,能够设为与海藻酸凝胶胶囊相同的折射率。
294.图8的g是示出从孔排出含有溶胶状态的海藻酸的细胞溶液时的排出速度(粒子的生成周期)与生成的海藻酸凝胶胶囊的尺寸的关系的实验结果的一例。根据该例可知,通过控制排出的溶液的速度,能够制作稳定的粒径的海藻酸凝胶胶囊。但是,由于实际制作的凝胶的尺寸与排出速度的关系因使用的溶液的粘性、孔的尺寸、溶液中的离子强度的差异等要素而不相同,因此,作为胶囊粒子粒径筛选机构,能够根据想要与实际结构相匹配地制作的胶囊的尺寸所对应的最佳的排出流速,通过上述图8的a至图8的c中所说明的方法来对流速进行反馈控制而使其最佳化。
295.图8的h是示意性地示出内装细胞872的超顺磁体海藻酸细胞胶囊871的图,该超顺磁体海藻酸细胞胶囊871是通过在溶胶状态的海藻酸溶液中以不具有磁畴结构的方式将比磁畴结构小地进行细分化的铁、锰等强磁性体微粒进行混合而制作成的。另外,通过将成为该超顺磁体的强磁性体微粒873加入海藻酸胶囊,即使在当上述为了提高溶液的折射率而加入蔗糖等时溶液的比重变高的情况下,也能够通过增加海藻酸胶囊的比重来取得平衡。
296.<9.进行细胞的以一个细胞为单位的识别
·
纯化的图像检测型单细胞分离
·
纯化部的结构的一例>
297.图9是示出图3的进行细胞的以一个细胞为单位的识别
·
纯化的图像检测型单细胞分离
·
纯化部(细胞分选部)模块330的结构的一例的图。如图9所示,在图像检测型单细胞分离
·
纯化部(细胞分选部)模块330中,为了得到细胞的明视野像,从明视野光源901、聚光透镜902向细胞分选部903照射可见光,经由物镜904而在明视野图像检测系统单元911被获取为图像并进行解析。另外,为了得到细胞的荧光像,能够将从与各个荧光对应的荧光光源905、907、909照射出的激发光经由物镜904向细胞分选部903进行照射,并将所得到的细胞的荧光像再次经由物镜904而在荧光强度检测系统单元906、908、910分别检测到与激发光相对应的荧光。另外,也可以通过使激发光波长与荧光波长相同来进行散射光强度测量。另外,在想要观察的荧光超过本实施例的三色而为更多颜色的情况下,适当地调整光路分支系统,使多个激发光透过,并选择不与各个激发光以及用于荧光检测的荧光(辐射光)波长重叠的波长,向细胞照射光,与想要观察的荧光的种类相匹配地组合多个分色镜、多个带通滤波器即可。
298.<10.进行细胞的以一个细胞为单位的识别
·
纯化的图像检测型单细胞分离
·
纯化部的结构的另一例>
299.图10是示出图3的进行细胞的以一个细胞为单位的识别
·
纯化的图像检测型单细胞分离
·
纯化部(细胞分选部)模块330的结构的另一例的图。如图10所示,在图像检测型单细胞分离
·
纯化部(细胞分选部)模块330中,为了得到细胞的明视野像,从明视野光源1001、聚光透镜1002向细胞分选部1003照射可见光,经由物镜1004以及图像分割系统单元1008而在明视野图像检测系统单元1012被获取为图像并进行解析。另外,为了得到细胞的荧光图像,能够将从与各个荧光对应的荧光光源1005、1006、1007照射出的激发光经由物镜1004向细胞分选部1003进行照射,并将所得到的细胞的荧光像(辐射光像)再次经由物镜1004以及图像分割系统单元1008而在荧光第一图像检测系统单元1009、荧光第二图像检测系统单元1010以及荧光第三图像检测系统单元1011分别获取到与激发光相对应的荧光图像。
300.在此,也可以并用基于明视野显微镜图像、荧光显微镜图像的处理以及基于图9中所说明的荧光强度或者散射光强度的处理。另外,由检测系统得到的图像数据也可以实时地显示于监视器并供使用者观察。另外,在想要观察的荧光超过本实施例的三色而为更多颜色的情况下,适当地调整光路分支系统,使多个激发光透过,并选择不与各个激发光以及用于荧光检测的荧光(辐射光)波长重叠的波长,向细胞照射光,与想要观察的荧光的种类相匹配地组合多个分色镜、多个带通滤波器即可。
301.另外,在得到细胞的图像的情况下,任意地构成为,为了防止由于因细胞在流动中移动而在获取各帧的过程中跨越像素间地拍摄细胞的各点的像从而使得图像在移动晃动的作用下模糊,通过将对获取的图像进行照射的光源的照射时间严格地设为“照射时间=像素尺寸/细胞的流速”,能够在细胞像的各点处于同一像素内的期间完成对像的受光画面的获取,且能够在受光画面的像素的分辨率的范围内以原理上最佳的分辨率准确地记录微细结构的像。
302.<10.进行细胞的以一个细胞为单位的识别
·
纯化的图像检测型单细胞分离
·
纯化部的构成要素的组合的一例>
303.图11是示出将图9所示的进行以一个细胞为单位的识别
·
纯化的图像检测型单细
胞分离
·
纯化部模块的结构通过实际组合要素来进行构建的情况的一例的图。
304.从能够周期性地照射单色脉冲激光、高亮度led可视区域单色光源等的1ms以下的脉冲光的明视野光源1101发出的光由反射镜1102调整行进方向并被聚光透镜1103聚光于细胞分选器芯片1104的流路部分。另外,从多个单色荧光光源1109、1110照射出的荧光激发光经由分色镜1111、1106被物镜1105聚光于细胞分选器芯片1104的流路部分。为了利用从这些明视野光源以及荧光光源聚光而成的光来测量在细胞分选器芯片1104的流路内流动的细胞及细胞块,在本实施例中将它们输出至两个光路系统。一个光路系统是基于光电倍增器等高灵敏度光检测元件侧方散射光光量计1115的散射光测量系统、以及荧光强度测量系统,在该散射光测量系统中,在与明视野光源以及荧光光源正交的侧方的路径上配置聚光透镜,并对经由分色镜1113而通过了仅选择性地使明视野光源的波长通过的带通滤波器1114的光进行测量,其中,该分色镜1113测量与明视野光相同波长的光的侧方散射光强度,在该荧光强度测量系统中,由荧光光量计1118、1120进行测量,其中,该荧光光量计1118、1120由在前段组装有两个带通滤波器1117、1119的光电倍增器等高灵敏度光检测元件构成,该两个带通滤波器1117、1119对透过分色镜1113而在下一分色镜1116分支出的被荧光光源1109、1110各自的激发光激发出的荧光进行检测。另一个光路系统是用于对在位于来自明视野光源的光路上的细胞分选器芯片1104的流路内流动的细胞及细胞块进行图像观察的路径,且构成为经由使明视野光源的光透过的带通滤波器1107,用高速相机1108对由物镜1105成像的像的光线进行测量。
305.另外,对于明视野光源的照射光,也可以照射连续光,但是为了消除晃动以提高图像的空间分辨率,任意地构成为,通过与高速相机1108的快门周期同步地在快门周期的各间隔中产生快门周期的1/10以下的照射时间的脉冲光,能够防止因细胞流动而产生的晃动以获取更高的空间分辨率的像。
306.另外,在用于进行细胞分选的细胞的判别中,当然也可以并用基于由高速相机获取到的图像的处理和基于荧光或者散射光的处理的结果。
307.另外,也可以将由高速相机1108得到的图像数据显示于解析装置的监视器,并供使用者观察。另外,在想要观察的荧光为多个的情况下,适当地调整滤波器,使多个激发光透过,并且选择不与下段中的用于荧光检测的荧光波长重叠的波长,向细胞照射光,并与想要观察的荧光的种类相匹配地组合多个附加了从分色镜到滤波器、荧光检测器的结构的装置模块的结构即可。另外,在该结构中,同样通过将分色镜和滤波器最优化为想要观察的波长,也能够获取荧光下的细胞像,也能够将该荧光观察结果用作数据。
308.<12.进行细胞的以一个细胞为单位的识别
·
纯化的图像检测型单细胞分离
·
纯化部的构成要素的组合的一例>
309.图12是示出将图10所示的进行以一个细胞为单位的识别
·
纯化的图像检测型单细胞分离
·
纯化部模块的结构通过实际组合要素来进行构建的情况的一例的图。从能够周期性地照射单色脉冲激光、高亮度led可视区域单色光源等的1ms以下的脉冲光且能够分别独立控制的两个不同波长的明视野光源1201以及1203照射出的明视野可见光、以及从照射荧光色素激发光的单色荧光光源1205照射出的荧光激发光,由反射镜1202以及分色镜1204、1206调整行进方向而被聚光透镜1207聚光于细胞分选器芯片1208的流路部分。为了利用从这些明视野光源以及荧光光源聚光而成的光来测量在细胞分选器芯片1208的流路
内流动的细胞及细胞块,在本实施例中,将由物镜1209成像的明视野显微镜图像和荧光显微镜图像一起引导至图像分割系统单元1210,分离为各个单一波长的图像,将各个图像分割出一个高速相机的受光画面加以利用,同时在一个像素画面中排列显示多个波长的图像,由此,能够在一张获取图像的图像处理过程中同时处理多个波长的图像。
310.在本实施例中,构成为将不同波长的明视野可见光光源配置两个以能够拍摄两个明视野像,通过这样构成,能够在一次获取图像中同时获取详细的细胞的明视野图像和细胞在流动中的移动速度。具体而言,在第一个明视野可见光源中,为了防止由于因细胞在流动中移动而在获取各帧的过程中跨越像素间地拍摄细胞的各点的像从而使得图像在移动晃动的作用下模糊,通过将对获取的图像进行照射的明视野光源的闪光的时间严格地设为“闪光时间=像素尺寸/细胞的流速”,能够在细胞像的各点处于同一像素内的期间完成对像的受光画面的获取,且能够在受光画面的像素的分辨率的范围内准确地记录微细结构的像。
311.另一方面,通过使第二个明视野光源的发光时间比上述第一个明视野光源的发光时间充分长,能够将细胞的像作为在光源闪光所发光的时间内跨越像素间的像的伸展而记录在受光画面,且能够将其伸长长度与由上述第一个闪光光源得到的细胞的长度进行比较,并通过“细胞的流速=细胞的伸长长度/两个光源的闪光的发光时间的长度之差”来求出。也可以求出在此得到的细胞的流速,并对上述第一个明视野光源的闪光的发光最大时间进行反馈控制,另外,对于荧光像,在能够进行荧光光源的闪光的情况下,如果也能够与上述明视野光源同样地设为“闪光时间=像素尺寸/细胞的流速”,则像的晃动成为最小,且能够获取在原理上像素水平下最佳的空间分解的图像。
312.在此,在本实施例中说明了基于图像的测量法,但也可以与图9以及图11所示的方法组合来并用基于图像的处理、以及基于荧光或者散射光的处理。另外,也可以将由高速相机1211得到的图像数据显示于监视器,并供使用者观察。另外,在想要观察的荧光为多个的情况下,适当地调整滤波器,使多个激发光透过,并且选择不与下段中的用于荧光检测的荧光波长重叠的波长,向细胞照射光,并与想要观察的荧光的种类相匹配地组合多个附加了图像分割系统单元1210的分色镜、滤波器的结构即可。
313.<13.示意性地示出同时进行高速明视野显微镜图像获取和高速荧光显微镜图像获取的解析系统的结构的一例>
314.图13是示意性地示出图10以及图12所示的图像分割系统的结构以及使用该结构的图像获取系统的结构的一例的图。在此,为了能够灵活地构成或改造图像分割光学系统,能够将方形立方体如积木那样组合。
315.图13的a是示意性地示出该方形的立方体型容器1300的内部的截面的图。立方体容器1300在其全部六个面开设有能够与其他立方体连接的窗1301,在不与其他立方体连接的情况下能够形成为盖1302。从而能够在具有能够对在该立方体的中央1303上反射的方向三维地微调整的角度调整机构1305的分色镜1304与各窗1301及中央1303之间嵌入滤波器1306。
316.图13的b是示意性地示出图13的a所示的立方体的外观的图。在方形立方体的全部六个面配置有窗1301。
317.图13的c是示意性地示出使用该立方体的图像分割光学系统的机构的一例的图。
首先,在向图像分割光学系统导入图像影像之前,将由物镜得到的图像导入图像尺寸调整系统单元1311,该图像尺寸调整系统单元1311包括:可动式的遮挡板1312,其用于从光路的中心切取多余的图像区域,并将分割出的多个图像调整为能够与高速相机1314的图像成像元件1316并列排列的形状;以及透镜1313,其用于在进行尺寸调整后将图像影像变换为平行光。从该图像尺寸调整系统单元1311出来的图像影像被导入到四个组合有四个立方体1300的图像分割光学系统。例如,在将两个波长的单色光1317、1318导入到图像尺寸调整系统单元1311时,首先,作为以相同尺寸切取相同图像区域而得到的图像,被导入具有组装有(波长)高通滤波器或者(波长)低通滤波器的分色镜a的第一立方体。该分色镜选择使单色光1317透过并使单色光1318全反射的分色镜。接着,单色光1317在全反射镜b变换90度行进方向而反射单色光1317,并在组装有使单色光1318透过的(波长)低通滤波器或者(波长)高通滤波器的分色镜c进行反射,再次经过用于成像为图像的透镜1315,在图像成像元件1316获取为图像。在此,通过三维地微调整全反射镜b或者分色镜c的角度而能够自如地调整图像成像元件1316上的单色光1317的细胞图像的位置。另一方面,单色光1318能够在分色镜a反射而被导入另一个全反射镜b,变更90度角度后,透过分色镜c,经过透镜1315,在图像成像元件1316上观察到单色光1318的细胞图像。在此,调整全反射镜b的位置,以使得单色光1318的细胞图像与单色光1317的图像不会在图像成像元件1316上重叠。另外,在该实施例中,具有以下效果,即,在滤波器1306中不需要特别地装入带通滤波器等波长选择用的滤波器,但例如在对明视野像和荧光像、或者闪光时间不同的两个明视野像等像的光强度差异较大的两个波长的像进行观察的情况下,通过将nd滤波器等吸收滤波器夹在强度大的光路侧,能够调整两个同等光强度的图像并在图像成像元件1316上进行测量,能够简化每个局部的光强度的偏移的削减和动态范围的增幅最优化。
318.另外,在上述实施例中,示出了将两个波长的图像进行分割并用一个高速相机来获取的结构的一例,但通过由图像分割系统内的图像尺寸调整系统将输入图像的两肋侧的多余的区域切取到所需的最小尺寸,能够以在受光面上不重叠的尺寸将不同波长的多个图像不重叠地排列,并使用1台高速相机通过一次拍摄来获取全部波长的图像。在此,即使在多个单色光的情况下,也能够通过利用多个能够三维地微调整的角度调整机构1305进行分色镜1304的面位置的调整,从而自如地调整各图像在高速相机的受光面上的位置。另外,对于多个明视野像或者荧光像,通过将光学透镜系统组装到处于波长分离后的特定波长的像的光路上的立方体的滤波器位置而用于放大或者缩小,也能够使放大率不同的图像成像于一个高速相机受光面1316。这具有以下用途,即,特别是为了将细胞周围的状态包含在内地进行测量,针对明视野像而减小放大率,并针对用于确认细胞内的微细状况的明视野像、荧光像而增大放大率。
319.组合了该放大率不同的图像的光学系统不限定于面向影像细胞分选器的用途,也能够组装于用于对由影像细胞分选器选择性地回收到的静止的细胞试样进行同样的观察的一般的光学明视野/荧光显微镜系统来利用。
320.图13的d示意性地示出了作为图像获取相机机构而针对反射镜的组合而言使用上述图13的c的结构经过图像分割系统单元1322来观察细胞等的方式、以及对明视野图像和进行了核染色的荧光像这两个图进行观察的方式。细胞1321的图像经由物镜等光学系统并经由纵长的1/2尺寸的长方形的可动式的遮挡板1323,从而在第一分色镜1324反射荧光像,
明视野像直接透过而被导入全反射镜1325,在此,明视野像通过反射并被第二分色镜1327反射从而经由成像透镜1328而映出到图像成像元件1329的一半部分1330。另一方面,由所述第一分色镜1324反射出的荧光像被全反射镜1326反射并透过第二分色镜1327,且经由成像透镜1328而映出到图像成像元件1329的另一半部分1331。
321.图13的e是示出将本发明的结构用于吸收光谱成像技术的情况的一例的图。将光源的可见光光谱变更为连续光而不是单色光,使用该光源并用物镜获取到流过微细流路1340的细胞1341的像之后,对于实际得到的图像,用可动式的遮挡板1323仅切取一部分的区域的图像1342,并将其导入图像分割系统。在此,通过在分色镜的基础上增加带通滤波器,能够得到在细胞的可见光成像中反映了特定波长的吸收的像。例如,若用具有对核选择性地染色的光吸收性的试剂进行染色,则在偏离该吸收波长的区域中,细胞像1344可以作为通常的像来观察,但在利用了核染色试剂的吸收波长域的波长的图像1345中,核部分因吸收而变暗。这样,根据本技术,能够获取反映了多个波长的各波长下的吸收的吸收光谱成像图像。如果使用该方法,则通常细胞处于g0周期,且存在核,这明确地被图像识别为细胞内的黑球。另一方面,处于分裂期的细胞由于核消失,因此即使对细胞进行图像识别也不能够在细胞内确认到明确的球状的核。特别是,由于吸光性试剂存在多个细胞毒性低的可逆标识试剂,因此,在现有的抗体标识等标识技术中存在难以确认细胞的状态的问题,但通过本发明的双波长明视野图像比较解析技术,能够除了确认细胞的形状之外,还根据细胞内有无核来回收分裂中的细胞。一般而言,在血中流动的正常细胞大多已经最终分化,但根据本发明,通过回收在血中正进行细胞分裂的细胞,能够回收血中癌细胞、干细胞等具有分裂能力的细胞。
322.另外,在本发明中,关于所得到的多个图像,通过例如从流动而来的细胞的图像中减去预先记录的细胞未流动而来时的图像数据,能够从明视野像中仅提取细胞图像。因此,该细胞尺寸(面积)及细胞周长可以根据进行减法运算后的数据所残留的区域内的全部像素数、或者数据所残留的区域的边界的全部像素数来分别求出,且可以如图1中所说明那样根据直接得到的周长与由从细胞体积估算出的直径求出的换算周长之间的比较,仅由细胞团簇和明视野的图像来进行判定。
323.同样地,如在图1中也说明的那样,能够根据荧光像(核染色)1331得到核的荧光像,从而得到核的数量、核的面积、以及荧光强度的整体即亮度的估算值。另外,明视野像和荧光像仅在相同的场所以不同波长进行拍摄,因此两者的坐标轴一致。因此,在荧光像中,不能测量细胞的形状,但也能够利用明视野像中的坐标来估算染色后的核的细胞内的相对位置。因此,即使是具有一个核的正常离析单个细胞的鉴定、细胞团簇或者多核细胞,也能够同样地获取数据。另外,即使在上述使放大率不同的多个图像成像的系统中,同样地如果相对坐标系以同一原点(图像中心)为中心且组合使用考虑了放大率的差异的相对坐标系,则能够进行同样的处理。
324.另外,在本发明中图像尺寸调整系统单元1311以及各立方体1300以维持光学密闭性的形式被固定,另外,对于在可动式的遮挡板1323切取的入射光的像的截面积,为了将连结的模块数量的独立的图像以不与高速相机上的图像成像元件1329重合的方式进行投影,在最后进行测量的多个波长的图像获取总数中调整为(受光面的总面积/平行光导入模块)以下的面积。
325.<14.示意性地示出同时进行荧光强度测量、高速明视野显微镜图像获取、以及高速荧光显微镜图像获取的解析系统的结构的一例>
326.图14是示出在图9所示的同时进行荧光强度测量和高速明视野显微镜图像获取的解析系统的结构中加入图10所示的对多个波长的图像影像进行获取的结构后得到的具体结构的一例的图。
327.在该例中,将发出不同的可视区域的单色光的四个高亮度led闪光光源用作明视野(高速相机)的光源而得到四个波长的吸收光谱成像图像,并将375nm、488nm的激光用作荧光色素的激发光光源。将分色镜配置成波长从短波长光向长波长光阶段性地分支,与此相匹配地,用由光电倍增器等高灵敏度光检测元件构成的荧光光量计1401、1402定量地测量由375nm、488nm的激光激发出的细胞中的荧光色素的强度,并且将从四个led闪光光源得到的长波长区域的细胞影像作为各个波长的像来由图像分割系统对图像进行分割以向高速相机进行配置。由此,能够同时测量配置在微芯片保持架内的细胞分选器芯片中的细胞在各种波长下的荧光强度、以及多个波长的明视野像。
328.图14的a是示意性地示出该同时进行荧光强度测量和高速明视野显微镜图像获取的解析系统的结构的配置的一例的图。从与高速相机的帧间隔同步的四个led闪光光源等明视野光源照射出的观察用的单色光由聚光透镜聚光,而对包含细胞分选器芯片(细胞分选器芯片是将血中的靶细胞所流动的流路以及细胞分选机构组装而得到的)的细胞分选部中的细胞进行照射。上述流路中的细胞可以通过物镜对焦。在此,也可以任意地组入在图18中后述的景深改善技术。利用从两个单色激光等荧光光源照射到物镜的荧光激发光,可以由上述与流路中的细胞结合而得到的荧光标识epcam抗体、k-ras抗体、细胞角蛋白抗体、cd抗体等用于鉴定癌细胞的荧光抗体、用核染色荧光色素(dapi、hoechst33258等)染色后的核等产生荧光。在使用了立方体的图像分割光学系统中,由分色镜a使短波长的荧光分支,再由被调整为两个荧光波长中间的截止波长的分色镜c分支出两个荧光,一个荧光的荧光波长可以经由除去多余的波长的带通滤波器而直接通过由光倍增管、光电二极管等荧光强度测量系统构成的荧光光量计1401来定量地进行测量,另一个荧光的荧光波长可以在由全反射镜b变更了光路之后经由除去多余的波长的带通滤波器而直接通过由光倍增管、光电二极管等荧光强度测量系统构成的荧光光量计1402来定量地进行测量。在此,关于荧光的检测系统以两个系统为例进行了记载,但也可以是多个系统自由的组合。而且,在其后段,经过图13中示出了一例的由立方体1300的组合构成的图像分割系统,该图像分割系统用于将光学显微镜图像分支为多个波长区域并将其分别作为图像进行分割且用一个高速相机受光元件同时获取多个图像,这样能够一边进行细胞的荧光强度检测,一边利用高速相机1314同时地获取细胞的明视野像。
329.用一个高速相机受光面同时获取根据波长而分支出的多个显微镜图像的装置结构如下。由分色镜a向荧光强度测定部引导的短波长的光的分支完成后的长波长侧的光的图像数据经过全反射镜b首先被导入第一个图像分割部。在此,利用能够对反射的方向三维地微调整的带角度调整功能的分色镜e,能够将特定的波长作为截止波长,并将该波长至长波长区域、或者该波长至短波长区域进行反射而导入下一光学分支系统。在此,后段的分色镜以及滤波器包括用于使高速相机上的各波长的图像的强度在某种程度上一致的强度调整用nd滤波器、或者用于得到更清晰(sharper)的波长带域的图像的带通滤波器等。所得到
的多个分割图像能够通过在各立方体1300内配置的能对反射的方向三维地微调整的带角度调整功能的分色镜的角度调整,而调整为在高速相机的受光面不重叠。另外,全部的光路被调整为相同以使得不产生处理的光的光路差。另外,通过组入半尺寸的分色镜i、h,能够进一步地进行多个波长的分支。
330.图14的b是示出实际得到的四个分支图像的例子的图。根据波长分支而得到的四个吸收波长的带域的成像图像1344、1345、1404、1405能够作为一个图像成像元件上的图像来获得。在此,在本图中,组合了由三个同样的结构构成的图像分割部,但通过进一步组合立方体1300,能够组合所需数量的图像分割像。
331.另外,在本实施例中,示出了将多个波长的明视野像分割并获取的光学系统的例子,但通过调整进行波长分支的分色镜以及带通滤波器的结构,也能够获取多个波长的荧光图像。
332.<15.同时进行荧光强度测量、高速明视野显微镜图像获取、以及高速荧光显微镜图像获取的解析系统的光学模块部分的结构的另一例的示意性的外观>
333.图15是示意性地示出将上述图13以及图14中所述的立方体1300组合多个而得到的图像分割系统的外观的图。通过三维地配置立方体,能够高效地并行处理分支出的光。
334.<16.示意性地示出图像检测型单细胞分离
·
纯化部(细胞分选部)模块的芯片结构的一例的实施例>
335.图16是示意性地示出图9以及图10所示的本发明的细胞分析装置系统的图像检测型单细胞分离
·
纯化部(细胞分选部)模块的细胞分选部的结构的一例的图。
336.在图16的a中示出在本发明的细胞分析装置系统中也可以使用的在本发明的细胞分选部中对细胞进行分离的细胞分选器芯片的构成要素的组合的一例。在细胞分选器芯片1600中,在芯片基板上分别在上游侧(1601、1602、1603)、下游侧(1614、1615、1616)对称地配置有呈轴对称的三个流路,在上述三个流路的合流点,三个流路一边保持层流一边合流,并维持原来的状态分支为下游的三个流路。因此,试样所流动的中央的流路的上游侧1601被向下游侧中央的流路1614引导,对于两个侧鞘流(side sheath flow)也分别是:上游侧流路1602被向下游侧1615引导,从上游侧流路1603向下游侧流路1616进行引导。
337.另外,也如图16的c所示,细胞分选器芯片1600以及各流路设置在铅垂方向上,且构成为沿着重力的方向流动。三个上游侧流路的入口分别与被入口开口部的鞘液充满的贮藏器1631连接。特别是,上游中央的流路1601能够由注射器1633将含有细胞的试样液经由中央的贮藏器来连续进行导入。另外,能够从充满鞘液的注射器1634、1635向与流经上游侧的侧面的流路的流路1602和1603连接的各贮藏器中追加供给鞘液。由此,能够连续地处理大量的试样。通过在试样溶液导入注射器1633、或者鞘液导入注射器1634、1635、以及各贮藏器的壁面组装用于测量有无导电性的水位测量传感器,能够在水位成为一定以下时,经由注射器供给试样各溶液直到成为一定的高度为止。水位测量传感器能够由分别配置在想要设定的高度的水位的下限以及水位的上限的电极或电极对等构成。另外,三个贮藏器1631的上部经由分配阀1632而与作为施加用于对水面的空气压进行调整的空气压的空气压源的空气注射器1636连接。对于从空气注射器得到的加压空气,能够经过压力传感器1637并使用三个分配阀1632来更灵活地分配压力。在流速的产生以及控制中,试样贮藏器和鞘液贮藏器的三个贮藏器1631的液面的高度一致,另外,当在贮藏器上表面安装盖并使
用加压空气对液面施加压力来产生流速的情况下,为了在合流点产生理想的层流,优选为,对于从合流点起的上游侧、下游侧各自的三个流路,设为它们的流路截面的形状、合流点到溶液入口的距离一致,以使得三个流路的速度相同。另外,期望使侧鞘流的贮藏器的截面积与试样样品的贮藏器的截面积之比相等。这是因为,在各贮藏器的液面高度的变化不同的情况下,液面的高度的减少率不同,这最终会破坏合流点处的层流的产生,若要使其普遍化,则期望使得与各贮藏器结合的流路的总截面积之比与各贮藏器的截面积之比一致。
338.接着,在图16的a的中央所示的上游侧的三个流路和下游侧的三个流路这六个流路全部合流的、没有壁的三个层流合流的地点,以与流路的侧面对置的形式配置有在中央流动的细胞的观察区域1606及其下游的一对电极1607。电极典型地由凝胶电极构成。关于凝胶,使用例如以电解质成为电流载体的方式溶入了nacl的琼脂糖凝胶。为了使凝胶的前端能够与流路直接接触,对于凝胶而言,从入口1609向用于填充凝胶的宽度宽的流路1608中放入溶胶状态的琼脂糖凝胶,由于其能够朝向出口1610,因此,凝胶主要朝向出口1610,且因毛细管现象而向成为细管的电极1607伸展,没有侵入到细胞分选器流路1605中就在边界面处因表面张力而静止。使用凝胶电极的优点如下,即,通过将为了施加电场而与电源连接的铂线等电线1611、1613插入该凝胶导入点,从而在同流路接触的凝胶电极与细胞流路的鞘液的边界,即使提高到就通常的金属电极而言会在流路内产生气泡或金属电极发生溶出的电压以上的电压,也能够对流路中的液体施加高的离子电流而不会发生气泡的产生、电极的溶出。
339.接着,将试样中的细胞在细胞分选器芯片中进行回收的步骤如下。从上游流动而来的试样溶液流1601被两个侧鞘溶液的流路1602和1603夹持,一边将其配置维持在流路的中央一边进行串联,进入细胞观察区域1606。因此,确认各细胞的形状判别、荧光标识的有无等,并基于其结果在下游进行细胞分离。在回收中使用两种方法中的任一种。一种回收方法是不对想要回收的细胞施加电场而对除此以外的细胞施加电场的方法。在此,当想要回收的细胞流动而来时,直接流入下游的筛选试样回收流路1614,在想要废弃的细胞或者微粒流动而来的情况下,无论其电荷为正或负,都能够通过对相对配置的两个凝胶电极1607施加电压,从而移动到两个侧鞘流1605中的某一个而将其排除。
340.另一种回收方法是在想要回收的细胞或者细胞块到来时施加电场的方法。在该情况下,在想要回收的细胞流动而来时,通过对相对配置的两个凝胶电极1607施加电压,从而移动到两个侧鞘流1605中的某一个而被回收。另一方面,不回收的细胞可以直接流入下游的筛选试样回收流路1614而将其废弃。在此,通常细胞的表面电荷带负电,因此利用该电荷。另外,在使用海藻酸胶囊的情况下,能够更稳定地利用较强的表面电荷进行回收。
341.另外,在有效地利用外电场对细胞施加外力的情况下,期望成为试样水溶液的导电率为102μs/cm以下的离子强度的溶液组成。由此,容易利用电场使试样液中的微粒移动。具体而言,在使细胞存活的状态下进行分选时降低离子强度并维持浸透压的溶液组成是特别重要的。例如优选将糖类、高分子等不直接有助于增加离子强度的分子在细胞纯化时用作试样溶液。
342.在将细胞作为图像进行捕捉并评价的情况下,设置用ccd相机对合流后的流路部分1606进行观测的部位,将测定范围扩展至面,并利用图像识别进行细胞的识别、进行追踪,由此,进行更可靠的细胞分离。此时,重要的是图像的取入速度。在一般30帧/秒的视频
速率(video rate)的相机中,会产生图像中的细胞丢失。如果有最低200帧/秒的取入速率,则能够识别以相当大速度在流路中流动的细胞。
343.接着是图像处理法,首先是细胞识别。如上所述,细胞的移动速度因细胞而异,根据情况不同有时会存在细胞的超越。为了防止超越,上述用两个侧鞘夹持试样溶液并使细胞排列陈成一列是重要的。接着,在各细胞最初出现在图像帧时对细胞赋予编号,以下,直到从图像帧消失为止,以同一编号进行管理。即,用编号管理在连续的多帧中细胞像移动的状况。对于各帧内的细胞而言,从处于上游侧的细胞依次向下游侧转移,在图像中所识别的未被编号的特定细胞的移动速度收敛于某范围的条件下,使帧间的细胞连结。在细胞的编号中,首先将细胞像二值化,求出其重心。求出二值化后的细胞的亮度重心、面积、周长、长径、短径,并使用这些参数对各细胞进行编号。由于将各细胞像在该时刻作为图像进行自动保存对使用者而言也是有益的,因此能够实施。
344.接着,是用于细胞分离的情况,但在编号后的细胞中,仅特定细胞必须分离。分离的指标既可以是上述的亮度重心、面积、周长、长径、短径等信息,也可以与图像分开地并用荧光检测,而得到利用荧光的信息。总之,按照编号对由检测部得到的胞进行分离。具体而言,利用在图17中详述的方法来计算获取到的细胞的移动速度(v),相对于细胞移动速度(v),将检测部至筛选部的距离设为(a),并且根据施加时间(t)而将施加时序设为(a/v)至(a/v t),由此,在目标编号的细胞正好到达电极之间时对细胞进行电性地分配、分离。
345.如上所述,细胞分离纯化模块被构成在细胞分选器芯片1600中。在细胞分选器芯片基板的内部埋入微流路,在流路的各个末端设置有开口,设置有试样和所需的缓冲液(培养基)的供给口、筛选出的细胞的回收口。流路的制作可以通过使pmma等塑料流入模具的、所谓的注射成型来制作,或者也可以通过粘接多个玻璃基板来制作。细胞分选器芯片的尺寸为例如50
×
70
×
1mm,但不限定于此。为了能够用高倍率的光学显微镜观察在刻于细胞分选器芯片的内表面的槽的流路流动的细胞,在使用pmma塑料的情况下,不使用发出荧光的粘接剂,而对例如0.1mm厚的层压膜进行热压接来使用。另外,在玻璃的情况下,同样通过光学粘接0.1mm的玻璃来使用。例如,可以使用数值孔径1.4、倍率100倍的物镜来观察通过0.1mm厚的层压膜而在流路内流动的细胞。在塑料的情况下,如果使塑料采用透光性高的材质,则也能够从芯片基板的上表面侧进行观测。另外,关于本发明中假定的细胞,小的细胞为细菌,大的细胞为癌细胞团簇等。因此,作为细胞尺寸,典型地为0.5μm至200μm左右的范围,但并不严格地限定于该范围,只要有效使用本发明,则可以使用任意尺寸的细胞。若使用在基板的一面组装的流路来连续进行细胞浓缩和细胞分离,则首先成为问题的是流路宽度(截面形状)。另外,流路1605在基板一个表面于基板的厚度方向典型地为10~100μm内外的空间内实质上制作成二维平面状。根据细胞的大小,在细菌用的情况下厚度方向上为5~10μm为适当的尺寸,在动物细胞用的情况下厚度方向上为50至100μm为适当的尺寸。
346.<17.示意性地示出图像检测型单细胞分离
·
纯化部(细胞分选部)模块中的高速闪光光源的发光时序与电子快门的关系的一例>
347.图17是示意性地示出在使用能够以实际1/10000秒的间隔获取图像的高速相机时的、光源的照射时间与时序、以及图像获取的间隔的关系的工作时序图。
348.首先,在图17的a中,作为细胞流速获取机构,示出了相机的垂直同步信号1701、电子快门的打开时间1711、第一明视野像的单色光脉冲光源的发光信号的发光时间1721、第
二明视野像的单色光脉冲光源的发光信号的发光时间1731的时序信号与时间的关系。如相机的垂直同步信号1701所示,首先,以100μs的间隔进行图像获取的间隔1702在该相机中根据2μs的开始时序信号1703而开始工作。接着,在上述时序信号1703的2μs后将电子快门仅在打开时间1711期间内打开。打开时间在相机的间隔中的时间中能够在例如27μs至96μs之间自如地进行调整,但在该实施例中,设定为能够在例如60μs之间打开而获取图像。接着,在该电子快门的打开时间中,进行两个不同波长的单色光的明视野光源的发光。第一个光源在较短的发光时间1721内发光,主要用于获取细胞的微细结构,例如本例中在时序信号1703的20μs后,进行5μs的短时间的发光1722。第二个光源主要用于通过进行比第一个光源长的发光来求出细胞移动的流速,与第一发光相同,在时序信号1703的20μs后,在第一光源的发光时间上加上20μs,进行25μs的比较长时间的发光1732。由此,通过用一个高速相机的受光画面的分割区域同时获取来自两个波长不同的明视野光源的两个明视野图像,并比较测量由于来自光源的照射时间之差而使得细胞在流动方向上伸展到何种程度才被曝光,从而能够瞬时测定细胞的流速。另外,通过根据所得到的细胞的流速,使第一光源的发光时间满足“第一光源的闪光时间(1722)=像素尺寸/流速”,而使得第一光源的发光时间中被曝光的细胞的移动时间收敛于受光像素的1个像素的大小的范围,从而能够获取由移动引起的图像晃动最小的图像。
349.例如,1/10000秒相机的像素尺寸为12μm
×
12μm时,用20倍的物镜进行观察的情况下的像素分辨率为0.6μm/pixel,因此如果使用能够在细胞为12cm/s的流动时进行5μs的光源的闪火的led光源,则能够获取实际上没有晃动的图像。
350.而且,通过使用以下图像晃动抑制机构,即,利用通过第一个明视野光源与第二个明视野光源的发光的比较而得到的细胞的流速,通过反馈控制来微调整第一光源的发光时间,以满足“第一光源的闪光时间(1722)=像素尺寸/流速”的图像晃动抑制机构,能够使来自第一光源的明视野图像不断获取始终不产生由流动引起的像的晃动的最佳明视野图像。
351.图17的b是示意性地说明作为细胞形状校正机构而同时获取上述由细胞的脉冲光源获取的细胞图像、由此获取的高精细图像、以及细胞的移动速度的方法的原理的图。当在静止时存在作为直径l0的圆而被观察到的球型的试样1751时,设为其以流速v向下方向1756移动。此时,在打开电子快门成为曝光状态的情况下,若从脉冲光源以t5的时间照射明视野光源的光,则圆的形状成为以下形状,即,与光源的发光时间相应地重合而沿圆的行进方向直行的部分被拉伸而得到的形状1752,作为整体而仅在流动方向上长度成为l1。此时,在该(l
1-l0)比投影到进行拍摄的高速相机时的像素的尺寸小的情况下,作为图像,能够获取与静止的图像相同的图像。但是,若减少光源的照射时间,则对像进行拍摄的像素无法得到充足的光量,因此,优选为,在增强光源强度的同时,尽可能地选择(l
1-l0)成为与像素尺寸相同程度为止的长时间的光源照射。接着,如果从第二波长的明视野光源在比t5长的t7的时间内以与开始照射t5相同的时序进行照射,则与上述第一明视野光源的照射同样地,得到与照射时间相应地在球的移动的作用下重合的像1753,且能够求出在该流动方向上伸长而得到的长度l2至(l
2-l1)(图的1757),这是因为正好将球所流动的速度作为v则应与v(t
7-t5)一致,因此能够通过v=(l
2-l1)/(t
7-t5)来求出。在此,为了同时获取两个图像1752、1753,使用在上述图10中说明的图像分割系统单元1008即可。
352.另外,在使用上述得到的球流动的速度v来求出球的准确的尺寸(面积以及周长)
时,例如可以根据像1753按照以下说明的步骤准确地求出。即,在t7的期间,使通过照射明视野光源而得到的像1753中位于与流动正交的最大径的场所的下游侧的位置的端点(虚线)平行移动vt7的距离1758,并将此作为新的端点的位置,如果将上游侧的端点的形状设为保持不变,则能够基于曝光时间中重合的像来得到与静止时相同的像1754。
353.如果单纯地使像1753以根据流速v得到的伸长量作为流动方向的轴分量进行缩小的情况下,根据像1755可知,不是与准确的原来的静止时的像相同的形状,而是成为将像1753在流动方向上压缩的形状,从而不能求出正确的原来的轮廓形状、周长以及面积。
354.由此可知,准确地求出在细胞分选器芯片中流动的试样的流速,不仅对于以与静止状态相同的程度高精细地获取细胞的形状而言是必须的,而且对于获取准确的细胞的形状而言也是必须的。另外,在利用高速相机的图像获取中,仅通过一次图像获取而同时地获取其图像解析的细胞的移动速度,这在高精度且高吞吐量地进行工作的方面是非常重要的。在本技术中,在为了解析观察到的细胞像的像而进行获取的同时,能够严格地获取该细胞的流速,因此能够在准确的时间决定下游处的细胞分离操作时序,且能够实现高精度的细胞分离。
355.另外,在上述实施例中说明了使用明视野光源以及明视野像的例子,当然,即使使用荧光光源以及荧光像也能够构建完全相同的机构。
356.<18.示意性地示出图像检测型单细胞分离
·
纯化部(细胞分选部)模块中的用于防止图像模糊的光学系统的结构的一例的图>
357.图18是示意性地示出图像检测型单细胞分离
·
纯化部(细胞分选部)模块中的用于防止图像模糊的光学系统的结构的一例的图。通常,在使用显微镜的光学系统来观察靶粒子的情况下,仅由物镜的倍率决定对象物的像的放大率,但在该情况下,光学系统的焦深和景深取决于物镜的倍率和数值孔径,越提高物镜的倍率则光学系统的焦深和景深变得越浅。
358.当在微小流路中进行对象物的观察的情况下,在对象物为细胞时,为了使尺寸从数微米程度的微小细胞至数十微米的团簇的各种尺寸的试样流动,流路的宽度和深度需要为足以使最大尺寸的试样流动的大小。然而,为了识别图像以判别试样的种类,优选图像的分辨率高。一般为了用光学显微镜提高倍率,通常使用数值孔径更高的物镜,但若使用这样的机构,则焦深变浅,结果存在流路中的景深也变浅这样的问题。为了用图像识别型细胞分选器从更高精细的图像中识别试样,而提高对象试样的放大率,并且为了使景深为流路高度程度,首先,选择物镜的焦深以及景深为流路的高度程度的数值孔径的物镜,在该物镜的后段装入变焦透镜即可。具体而言,如图18的a所示,在物镜的后段,经由变焦透镜1802放大从物镜送来的像1801,并在高速相机等的图像获取设备1804拍摄该放大后的像1803即可。
359.图18的b是示出本实施例中使用的变焦透镜系统的光学元件的结构的一例的图。首先,从物镜入射的像1801构成为将凸透镜(聚焦透镜)1811、凹透镜(变速器)1812、以及两个凸透镜(补偿器)1813、(主透镜)1814组合来使放大率变化从而输出放大像1803。在这样构成四个透镜的情况下,不移动两端的凸透镜1811、1814的位置,而使中央的凹透镜1812移动,为了校正伴随于此产生的焦点移动而移动可动的凸透镜1813来进行调整,由此,能够在使该变焦透镜的全长一定的状态下灵活地使放大率变化。
360.图18的c是比较示出现有的光学系统中观察到的微粒的像和本发明的光学系统中
观察到的微粒的像的例子的图。具体而言,在数值孔径为0.6的倍率40倍的物镜中,可知在5μm左右像已经模糊。另一方面,通过使用数值孔径(na)为0.28的10倍的物镜并在其上组合4倍的变焦透镜光学系统,从而在作为相同程度的最终放大率而测量可拍摄的高度时,可知直到25μm左右也能够没有问题地获取像。该结果示出了以下结构的一例,即,在利用图像处理型细胞分选器系统得到与以往用40倍的物镜观察到的像相同倍率的图像的情况下,如果组合10倍的物镜和4倍的变焦透镜,则能够以最适于细胞分选的、在流路的高度方向上没有模糊的形式获取图像的结构。
361.<19.示意性地示出图像检测型单细胞分离
·
纯化部(细胞分选部)模块中的使用了线性传感器组的连续高速图像获取系统的结构的一例的图>
362.图19是示意性地示出图像检测型单细胞分离
·
纯化部(细胞分选部)模块中的作为图像获取的另一例而使用了线性传感器组的连续高速图像获取系统的结构的一例的图。
363.图19的a是示意性地说明该方法的概念的图。
364.图19的b是示意性地示出使用了线性传感器组的连续高速图像获取系统的结构的一例的图。细胞101在以下流路,即,配置成在细胞分选部的流路1902的中央沿箭头1901的方向排列成一列而流动的流路中,经过光学系统单元1903成像于图像获取板1900上的面。在板面上,沿着该细胞的流动方向配置有第一流动方向的流速检测用一维传感器阵列1905,在与流动正交的方向上配置有具有能够覆盖整个流路宽度的长度的明视野图像获取用一维传感器阵列1906。另外,也可以根据需要在上述第一图像获取用一维传感器阵列1906的下游侧配置第二图像获取用一维传感器阵列1907。在此,通过在传感器阵列1906的上部载置仅使明视野光透过的带通滤波器1908,并在传感器阵列1907的上部配置仅使荧光透过的带通滤波器1909,从而作为图像分割机构1,第一图像获取用一维传感器阵列1906能够获取明视野像,并且第二图像获取用一维传感器阵列1907能够获取荧光像。在由二维传感器构成的高速相机中,仅能够获取一定间隔下的二维图像,因此存在成为间隔之间的空隙的时间,而需要以比该时间间隔大的间隔使细胞串联地流动,但在本实施例的使用一维传感器阵列的情况下,能够得到连续而无缝隙的各传感器元件的信息。因此,如果知晓细胞的流动速度,则能够利用流速检测用一维传感器阵列等机构根据来自图像获取用一维传感器阵列的连续信号来重构得到细胞形状。
365.图19的c是示意性地示出一维传感器阵列的结构的图。通过将各光传感器元件1911一维地配置,从而在向该各元件照射光时,可连续地以强度信息的形式获取信息。该排列的一维传感器阵列可以利用于上述流速检测用一维传感器阵列1905、以及图像获取用一维传感器阵列1906、1907中的任一个。
366.在图19的d中,不是以平面而是以具有倾斜的面来配置图19的b所示的一维传感器阵列的各元件1912,通过这样配置,能够改善景深的大小。该排列的一维传感器阵列特别是能够用于上述流速检测用一维传感器阵列1905。
367.图19的e是说明配置在细胞101实际成像的图像获取板1900上的各一维传感器阵列的作用和功能的概念图。从在流速检测用一维传感器阵列1905上移动的细胞101的像中,能够获取在时刻t1如曲线图(细胞的光强度轴1922、1927以及一维传感器阵列位置的轴1923以及1928)所示那样的细胞的强度谱1924,接着能够获取在时刻t2如曲线图1927所示那样的细胞的强度分布1928。此时,根据强度分布1924移动到强度分布1928时的前端部分
位置1925至1930的移动量δx1(箭头1931)和末端部分位置1926至1931的移动量δx2(箭头1932),能够通过v=δx1/(t
2-t1)或者v=δx2/(t
2-t1)来求出移动速度v。另外,当该细胞101的像到达图像获取用一维传感器阵列1906时,能够得到由传感器阵列的位置的轴(x轴)1935、以及各传感器所测定出的光强度1934构成的曲线图所示出的一维的光强度分布1936。通过将该强度分布与上述根据流速传感器阵列得到的空间分布(x轴)1942和速度v相匹配地作为vt轴(1941),并由图像重构机构以相对于各个获取时间t的空间配置进行重构,能够重构细胞101的像作为图19的f所示的二维图像1943。
368.<20.示意性地示出对多个成像面的像进行获取的线性传感器阵列组的结构、以及对多色荧光的图像同时进行获取的线性传感器阵列组的结构的一例的图>
369.图20是示意性地示出在图像检测型单细胞分离
·
纯化部(细胞分选部)模块中的使用了线性传感器组的连续高速图像获取系统中,能够对成像面的高度不同的多个图像同时进行获取的线性传感器阵列组的结构、以及对多色荧光图像同时进行获取的线性传感器阵列组的结构的一例的图。
370.在图20的a中,作为防止像模糊的图像模糊抑制机构,示意性地示出将图19中说明的图像获取用一维传感器阵列2002、2003、2004在细胞的流动方向2001上以不同的高度平行配置在图像获取板1900上而得到的结构。图20的b是示出图20的a的剖视图的图,从图像获取板的底面2005起,以相差高度d的方式在底面2005上配置一维阵列2004,在高出高度d的位置2008配置第二个一维阵列2003,在进一步高出高度d的位置2007配置第三个一维阵列2002,由此能够实质上同时获取多个成像面的高度的像。
371.另外,图20的c以及d是示意性地示出用于将细胞像的图像按每个波长进行分支并同时获取的受光元件阵列的结构的图。如图20的c所示,作为波长光谱分离机构,平行配置与想要获取的波长数相同数量的像获取用一维传感器阵列2014,其如图20的d所示,从沿箭头2001方向流动来的细胞101的、与流动正交的截面2010的像2011以与流动正交的线状获取光线,并将其送至波长分支机构,由此,如曲线图2021所示那样的波长光谱被一维地展开。通过沿此将一维传感器阵列2014配置于图像获取板1900上的底面2005,能够由图像分割机构2以与图19的f中所说明的情况同样的步骤针对各个细胞的各波长分量同时获取细胞图像。
372.<21.同时获取高速明视野显微镜图像和高速荧光显微镜图像之后的图像处理的过程>
373.图21是示意性地示出同时获取高速明视野显微镜图像和高速荧光显微镜图像之后的图像处理的过程的图,且是示出同时获取了高速明视野显微镜图像和核荧光染色后的高速荧光显微镜图像的图像的例子的照片。
374.图21的a是说明用于实际对图像进行解析的细胞像的图像处理的过程的概念图。首先,在图像获取过程2101中获取到的细胞像101在图像分割过程2102中被两个以上的不同图像分割2017、2018细分化。接着,在分割图像处理过程2013中对每个细分化后的各微小图像调整偏移(offset),另外,重构强度的最大值及最小值以使图像的分辨率最大化。这是因为,图像越大则选择偏移以及最大值及最小值的最佳化越被平均化,从而对局部而言不能取最佳值。另外,通过以不同的多个图案进行图像分割,能够进一步改善包含使最佳化达到最优的分割在内的比例。这样,在分割图像的处理完成后,能够在图像重构过程2104中使
分割图像针对各个分割后的图像再次恢复至整体图像。另外,通过将这样得到的各个整体图像在图像处理过程2105中进行图像的二值化处理、微分处理,能够提取细胞的外围形状、细胞内的微细结构。另外,通过图像合成过程2106来合成由进行图像分割2107、2108得到的各个重构整体图像、图像处理图像,能够获取更准确的细胞图像。
375.图21的b是示出在本发明的细胞分析装置系统中用一个高速相机受光面同时获取到高速明视野显微镜图像和核荧光染色后的高速荧光显微镜图像的图像的例子的照片。如上所述,在此通过预先使两个图像的相对坐标一致,能够针对可利用荧光像来鉴定的核的位置,使用彼此的相对坐标来对照核分布在明视野像的细胞像或者细胞团簇像中的哪个部位。通过该相对坐标的对照,可知对于正常细胞而言,在光滑的细胞表面和正常尺寸的细胞中,一个核正以荧光而发光。另一方面,对于癌细胞而言,多核化是癌细胞的一个指标,但如照片所示,可知通过相对坐标的对照,在与正常细胞相比巨大化后的细胞中,多个核正在发光。另外,在正常血液中虽未存在,但在癌转移症例的血液中,通过细胞团簇以及该团簇中的各细胞的核的荧光,观察到团簇内的多个核的荧光,根据这样的多个核的荧光可知是细胞团簇。另外,根据团簇的明视野像,也能够判别是该团簇、或者是细胞和血小板等的聚集块。
376.这样,使用上述本发明的装置,通过以下的(1)~(4),不使用以往的分子生物标记物,而用“细胞的形状、群集状态、或者多核化等内部结构等的图像影像”这样的新的生物标记物来鉴定并选择性地回收血中癌细胞。即,(1)将在健康的血液中不存在的细胞团簇(块)鉴定为血中癌细胞候补并选择性地回收的方法;(2)将在健康的血液中不存在的多核细胞鉴定为血中癌细胞候补并选择性地回收的方法;(3)将在健康的血液中不存在的巨大细胞鉴定为血中癌细胞候补并选择性地回收的方法;(4)通过在上述(1)(2)或者(3)的基础上组合了与利用荧光强度测量而测量出的针对癌细胞的一个或者多个生物标记物(例如epcam抗体、k-ras抗体、细胞角蛋白抗体等)的荧光抗体的荧光强度的存在的解析,而鉴定为癌细胞并选择性地回收的方法。
377.另外,用上述方法回收到的血中癌细胞候补,接着通过组合上述微小细胞用pcr解析技术等基因解析机构来进行基因变异的测量,能够最终鉴定是否为癌细胞,并且在为癌细胞的情况下能够最终鉴定是具有何种基因变异的特征的癌细胞。关于(1),能够如图1的说明所述那样通过基于明视野图像的细胞或者细胞块的周长的评价、或者、明视野像的尺寸、以及荧光像的核的数量及分布(即,对于相邻的多个核的像,它们重心的距离相互离开例如3μm以上),来进行判别。关于(2),能够如图1的说明中所述那样通过基于明视野图像的细胞或者细胞块的周长的评价、且核的数量及分布(即,对于相邻的多个核的像,它们重心之间的距离相互离开例如3μm以内),来进行判别。关于(3),能够如图1的说明中所述那样通过基于明视野像的细胞或者细胞块的周长的评价、且细胞尺寸换算为直径而超过例如20μm,来进行判别。或者,能够组合上述(1)至(3)并将具有一个以上的符合条件的细胞判定为癌细胞。
378.另外,从图1以及图21的例子也可以得出,在利用荧光显微镜图像来测量细胞(团簇)的一块中的核数时,对于以荧光发光的核数为3以上的细胞而言,只能在移植了癌组织的情况下的血中的细胞(positive)中被发现,而在用于比较的健康的血中的细胞(control)的图像中并没有被观察到,因此,在测量到细胞(团簇)的一块中的核数为3以上
的情况下,能够判断该细胞(团簇)为癌细胞。但是,该情况也与上述同样地示出了无法对核数为2以下的细胞中的癌细胞和正常细胞进行识别,上述细胞(团簇)中的核数为3以上终究只是癌细胞团簇存在的充分条件之一。
379.根据这些结果,使用下述(1)~(3)的三个判断条件中的任一个条件或者下述这三个条件按照“和”的关系的组合(即,(1)且(2)、或者(1)且(3)、或者(2)且(3)、或者(1)且(2)且(3))作为存在血中癌细胞的判断基准,
380.(1)根据获取图像来测量细胞(团簇)的约150μm2以上的核的面积;
381.(2)根据获取图像来测量细胞(团簇)的约250μm2以上的面积;
382.(3)根据获取图像来测量细胞(团簇)的三个以上的核的存在。
383.(细胞分析方法)
384.以上,说明了本发明的细胞分析装置以及使用了该装置的系统的概要。以下,对使用本发明的装置或其一部分而能够达成的方法进行说明。
385.根据本发明,提供一种方法,其对源于被检者的细胞进行分析,其中,所述方法包括以下工序:
386.a)获取所述细胞的图像的步骤;
387.b)根据获取到的所述图像而生成所述细胞的流速数据的步骤;
388.c)基于所述流速数据而生成准确的细胞形状数据的步骤;
389.d)基于所述细胞形状数据而连续地解析细胞的信息的步骤;
390.e)根据基于所述细胞形状数据得到的细胞的信息而输出被检试样整体的细胞信息的分布的步骤;以及
391.f)根据所述细胞信息的分布而判别所述被检者的细胞中的异常的步骤。
392.细胞的图像例如可以如图1中所说明那样来获取。在一个实施方式中,如图1的c至图1的e中所说明的那样,也能够将高速明视野显微镜图像和核荧光染色后的高速荧光显微镜图像通过分割出一个超高速相机受光面而同时获取到两张图像的显微镜照片。在一个实施方式中,例如预先通过图像处理从图1的e的细胞团簇的明视野像中减去细胞未流动时所获取到的背景图像数据,由此,将仅对细胞或者细胞块的像进行提取的步骤与获取该提取到的像的边界线(细胞或者细胞块的外围线)的长度及由边界线包围的区域的面积的机构进行组合,从而即使仅使用明视野像也能够进行细胞块的判别。
393.在一个实施方式中,为了根据高速流动的细胞的获取图像而重构准确的细胞及细胞团簇的形状,能够对各细胞的流速同时进行测量而得到与该获取到的细胞的流速的信息相匹配地校正了细胞形状的信息的经准确重构的细胞形状信息,基于该结果并利用例如图1中所说明的基于细胞形状而得到的细胞尺寸、周长、内部结构等指标来进行判定。对于测量细胞的流速,能够如对上述的图像获取机构所说明那样进行。
394.在一个实施方式中,在如上述那样获取到细胞的信息之后,例如如图1的f至h中示意性地所示,能够生成通过明视野显微镜观察从血液中除去红血球成分后的白血球成分(血液中除去红血球后剩余的细胞整体)的细胞的情况下的面积的尺寸分布图。如果使用该曲线图,例如若有细胞尺寸超过150μm2时增加的情况(箭头143),则能够推定为转移癌患者的血液。
395.在一个实施方式中,如图1的i至图1的k所示,能够生成转移癌模型(哥本哈根大
鼠)的血液样品的处方前到化疗完成为止的血中的细胞尺寸分布的变化。通过使用这样的曲线图,能够根据其尺寸分布,判定是健康的模型的血液的尺寸分布还是转移癌模型的血液的尺寸分布,还能够判定有无治疗效果。
396.另外,在一个实施方式中,如图1的m所示,能够生成患有感染症的动物模型(哥本哈根大鼠)的血液的细胞尺寸分布,且根据细胞尺寸150μm2至200μm2的区域的明确的增多与细胞尺寸超过300μm2的细胞有无显著增多之间的差异,能够在血液的诊断中识别并判断转移癌和感染症的感染。
397.如上所述,关于使用本发明的细胞分析装置系统而进行的细胞分析,根据细胞分析装置的系统所进行的以图像为基准的细胞筛选技术,从细胞的图像中通过以下的(1)~(5)来确认血液中是否存在转移癌,另外,也可以不使用以往的分子生物标记物,而用“细胞的形状、群集状态、或者多核化等内部结构等的图像影像”这样的新的生物标记物来鉴定并选择性地回收血中癌细胞。即,(1)将在健康的血液中不存在的细胞团簇(块)鉴定为血中癌细胞候补的方法;(2)将在健康的血液中不存在的多核细胞鉴定为血中癌细胞候补并选择性地回收的方法;(3)将在健康的血液中不存在的巨大细胞鉴定为血中癌细胞候补并选择性地回收的方法;(4)根据血中的白血球(从血液中除去红血球成分后剩余的细胞整体)的尺寸分布图来判定具有以下尺寸分布、即该尺寸分布与健康者的特征不同且具有转移癌患者所特有的尺寸分布的方法以及对特征性的尺寸分布区域的细胞进行选择性地回收的方法;(5)通过在上述(1)(2)(3)或者(4)的基础上组合了荧光强度的检测的解析而鉴定为癌细胞并选择性地回收的方法,该荧光强度的检测表示与利用荧光强度测量而测量出的针对癌细胞的一个或者多个生物标记物(例如epcam抗体、k-ras抗体、细胞角蛋白抗体等)的抗体标识了荧光的荧光标识抗体的存在。另外,本发明提供用于使计算机执行以上所述的方法的计算机程序、保存该计算机程序的记录介质、以及执行以上所述的方法的系统。
398.即,在本发明的另一实施方式中,提供一种程序,其使计算机执行对源于被检者的细胞进行分析的方法的处理,其中,所述方法包含以下工序:
399.a)使所述计算机获取细胞的图像的步骤;
400.b)使所述计算机根据获取到的所述图像而生成所述细胞的流速数据的步骤;
401.c)使所述计算机基于所述流速数据而生成准确的细胞形状的数据的步骤;
402.d)使所述计算机基于所述细胞形状数据而连续地解析细胞的信息的步骤;
403.e)使所述计算机根据基于所述细胞形状数据得到的细胞的信息而输出被检试样整体的细胞信息的分布的步骤;以及
404.f)使所述计算机根据所述细胞信息的分布而判别所述被检者的细胞中的异常的步骤。
405.在本发明的另一实施方式中,提供一种记录介质,其保存计算机程序,该计算机程序使计算机执行对源于被检者的细胞进行分析的方法的处理,其中,所述方法包含以下工序:
406.a)使所述计算机获取细胞的图像的步骤;
407.b)使所述计算机根据获取到的所述图像而生成所述细胞的流速数据的步骤;
408.c)使所述计算机基于所述流速数据而生成准确的细胞形状的数据的步骤;
409.d)使所述计算机基于所述细胞形状数据而连续地解析细胞的信息的步骤;
410.e)使所述计算机根据基于所述细胞形状数据得到的细胞的信息而输出被检试样整体的细胞信息的分布的步骤;以及
411.f)使所述计算机根据所述细胞信息的分布而判别所述被检者的细胞中的异常的步骤。
412.在本发明的另一实施方式中,提供一种系统,其对源于被检者的细胞进行分析,其中,所述系统包含:
413.a)获取所述细胞的图像的机构;
414.b)根据获取到的所述图像而生成所述细胞的流速数据的机构;
415.c)基于所述流速数据而生成准确的细胞形状的数据的机构;
416.d)基于所述细胞形状数据而连续地解析细胞的信息的机构;
417.e)根据基于所述细胞形状数据得到的细胞的信息而输出被检试样整体的细胞信息的分布的机构;以及
418.f)根据所述细胞信息的分布而判别所述被检者的细胞中的异常的机构。
419.如上所述,通过使用本发明的细胞分析装置或其一部分的模块,能够分析源于被检者的细胞,并判定异常细胞的有无。另外,在本发明的另一实施方式中,通过使用本发明的细胞分析装置或其一部分的模块,也能够达成以下的方法。
420.即,在本发明的一个实施方式中,提供一种方法,其对源自被检体的细胞进行分析,所述方法包括以下工序:
421.(a)对源自被检体的细胞试样液所含的细胞进行处理的工序;
422.(b)将处理后的所述细胞封入胶囊中来制作胶囊粒子的工序;
423.(c)对处理后的所述细胞或封入至胶囊粒子中的所述细胞的图像进行获取的工序;以及
424.(d)对所述图像实施上述对源于被检者的细胞进行分析的方法的判别工序。
425.另外,在本发明的另一实施方式中,提供一种方法,其对源于被检者的细胞试样中的异常细胞的有无进行判定,所述方法包括以下工序:
426.(a)对源于被检者的细胞试样液所含的细胞进行处理的工序;
427.(b)将处理后的所述细胞封入胶囊中来制作胶囊粒子的工序;
428.(c)对源于所述被检者的细胞试样中的异常细胞的有无进行判定的工序,其中,所述判别包括以下步骤,即,
429.a)对处理后的所述细胞或封入至胶囊粒子中的所述细胞的图像进行获取的步骤;
430.b)根据获取到的所述图像而生成所述细胞的流速数据的步骤;
431.c)基于所述流速数据而生成准确的细胞形状数据的步骤;
432.d)基于所述细胞形状数据而连续地解析细胞的信息的步骤;
433.e)根据基于所述细胞形状数据得到的细胞的信息而输出被检试样整体的细胞信息的分布的步骤;以及
434.f)根据所述细胞信息的分布而判别所述被检者的细胞中的异常的步骤。
435.在一个实施方式中,细胞的处理可以包括连续地进行包含细胞的浓缩、细胞的尺寸分级、利用荧光抗体标识(或者在进行再培养的情况下根据需要而使用的适体等可逆荧光标识标记物)的染色、以及清洗在内的过程的工序。另外,在一个实施方式中,细胞的胶囊
封入可以包括以单个细胞或者单个细胞块为单位进行胶囊化。
436.在一个实施方式中,对于细胞的处理,例如能够从自患者采集到的血液中仅浓缩并提取细胞成分,且能够连续地分离红血球成分及其他成分并选择性地回收白血球成分(血液中除红血球成分以外的其他细胞的全量)。或者,特别是在想要选择性地回收白血球细胞块的情况下,通过将细胞尺寸的阈值设定为以体积换算计细胞尺寸超过300μm2,也能够在该前处理阶段中仅选择性地回收细胞团簇。之后,在其中添加荧光癌标记物等荧光标识剂,并在使荧光标识剂与试样细胞反应后将未反应的剩余的荧光标识剂清洗除去。
437.在一个实施方式中,对于细胞的胶囊化,例如能够以单个细胞或者单个团簇为单位封入海藻酸胶囊,且通过将细胞封入海藻酸凝胶胶囊,能够防止之后的来自外界对细胞的污染,另外,在后段的细胞检测提取部的图像检测型单细胞分离纯化部(细胞分选部)中,在借助电泳力进行选择回收时,能够不依赖于细胞的表面电荷,而借助内装有这些细胞的海藻酸胶囊的稳定的恒定表面电荷,来一边防止对胶囊内部的细胞的损伤,一边实现能够进行稳定的选择回收的附加性能的改善。
438.在一个实施方式中,对于细胞的图像的获取,能够进行基于两个光学图像的指标下的检测。首先,通过单个细胞水平下的明视野显微镜像,来确认细胞的外形、细胞内部的细胞内细胞器的形状、细胞内部的核与细胞质的尺寸之比、以及细胞块的状况,且能够一并确认与在明视野像中得到的细胞的位置对应的坐标中的基于荧光标识的荧光的发光的有无、以及它们的位置及大小。
439.如上所述,关于使用本发明的细胞分析装置系统而进行的细胞分析,根据细胞分析装置的系统所进行的以图像为基准的细胞筛选技术、以及提供给该细胞筛选技术的细胞的前处理技术,由于细胞被连续地处理,因此能够使微量细胞的由于污染、操作而导致的消失为最低限度,为了判别细胞的种类,能够使用明视野显微镜图像,并根据其形状的特征以及从二维图像得到的尺寸(体积、体积的二维图像)、以及周长,以单个细胞水平来检测并确认细胞,且确认并判定细胞是未团簇化的独立单个细胞还是团簇化的细胞群体。另外,能够以单个细胞水平来检测并确认用于判别细胞的种类的荧光标识抗体中的细胞的荧光标识的有无,并针对荧光标识后的细胞确认细胞为未团簇化的独立单个细胞,而且能够判定在细胞中是否发生凋亡。另外,本发明提供用于使计算机执行以上所述的方法的计算机程序、保存该计算机程序的记录介质、以及执行以上所述的方法的系统。
440.即,在本发明的另一实施方式中,提供一种程序,其使计算机执行对源于被检者的细胞试样中的异常细胞的有无进行判定的方法的处理,所述方法包含以下工序:
441.(a)使所述计算机对源于被检者的细胞试样液所含的细胞进行处理的工序;
442.(b)使所述计算机将处理后的所述细胞封入胶囊中来制作胶囊粒子的工序;
443.(c)使所述计算机对源于所述被检者的细胞试样中的异常细胞的有无进行判定的工序,其中,所述判别包括以下步骤,即,
444.a)使所述计算机对处理后的所述细胞或封入至胶囊粒子中的所述细胞的图像进行获取的步骤;
445.b)使所述计算机根据获取到的所述图像而生成所述细胞的流速数据的步骤;
446.c)使所述计算机基于所述流速数据而生成准确的细胞形状数据的步骤;
447.d)使所述计算机基于所述细胞形状数据而连续地解析细胞的信息的步骤;
448.e)使所述计算机根据基于所述细胞形状数据得到的细胞的信息而输出被检试样整体的细胞信息的分布的步骤;以及
449.f)使所述计算机根据所述细胞信息的分布而判别所述被检者的细胞中的异常的步骤。
450.在本发明的另一实施方式中,提供一种记录介质,其保存计算机程序,该计算机程序使计算机执行对源于被检者的细胞试样中的异常细胞的有无进行判定的方法的处理,所述方法包括以下工序:
451.(a)使所述计算机对源于被检者的细胞试样液所含的细胞进行处理的工序;
452.(b)使所述计算机将处理后的所述细胞封入胶囊中来制作胶囊粒子的工序;
453.(c)使所述计算机对源于所述被检者的细胞试样中的异常细胞的有无进行判定的工序,其中,所述判别包括以下步骤,即,
454.a)使所述计算机对处理后的所述细胞或封入至胶囊粒子中的所述细胞的图像进行获取的步骤;
455.b)使所述计算机根据获取到的所述图像而生成所述细胞的流速数据的步骤;
456.c)使所述计算机基于所述流速数据而生成准确的细胞形状数据的步骤;
457.d)使所述计算机基于所述细胞形状数据而连续地解析细胞的信息的步骤;
458.e)使所述计算机根据基于所述细胞形状数据得到的细胞的信息而输出被检试样整体的细胞信息的分布的步骤;以及
459.f)使所述计算机根据所述细胞信息的分布而判别所述被检者的细胞中的异常的步骤。
460.在本发明的另一实施方式中,提供一种系统,其对源于被检者的细胞试样中的异常细胞的有无进行判定,其中,所述系统包括:
461.(a)对源于被检者的细胞试样液所含的细胞进行处理的机构;
462.(b)将处理后的所述细胞封入胶囊中来制作胶囊粒子的机构;
463.(c)对源于所述被检者的细胞试样中的异常细胞的有无进行判定的机构,其中,所述判别包括以下机构,即,
464.a)对处理后的所述细胞或封入至胶囊粒子中的所述细胞的图像进行获取的机构;
465.b)根据获取到的所述图像而生成所述细胞的流速数据的机构;
466.c)基于所述流速数据而生成准确的细胞形状数据的机构;
467.d)基于所述细胞形状数据而连续地解析细胞的信息的机构;
468.e)根据基于所述细胞形状数据得到的细胞的信息而输出被检试样整体的细胞信息的分布的机构;以及
469.f)根据所述细胞信息的分布而判别所述被检者的细胞中的异常的机构。
470.(注释)
471.综上所述,使用本发明的优选实施方式来例示了本发明,但是可理解为本发明应当仅通过权利要求书来解释其范围。在本说明书中引用的专利、专利申请及其他文献可理解为与其内容本身具体记载于本说明书的情况同样地援引该内容作为针对本说明书的参考。本技术对在2019年8月21日向日本专利局申请的日本特愿2019-151212主张优先权,其全部内容如同构成本技术的内容的情况同样地作为参考援引于本文中。
472.产业上的可利用性
473.根据本发明,能够将血中的微量对象细胞以一个细胞为单位进行纯化,从而实现该对象细胞的准确的基因信息、表达信息的解析。
474.根据本发明,能够识别被检对象的细胞是否团簇化(是否为独立单细胞)。
475.根据本发明,能够判定在细胞中是否发生了凋亡。
476.根据本发明,能够实时地仅对作为对象的细胞或者细胞群体进行分离纯化并回收。
477.根据本发明,能够仅针对回收到的细胞,以单个细胞水平测量细胞内状态,并以单个细胞水平进行基因组解析以及表达解析。
478.根据本发明,能够仅对回收到的细胞进行再培养。
479.根据本发明,能够获取细胞的尺寸的差异、细胞内部的核与细胞质的尺寸之比等详细的细胞信息,并基于该结果来进行判别以纯化细胞。
480.根据本发明,能够回收在血中正进行细胞分裂的细胞。
481.根据本发明,能够有效地回收作为在血中循环的癌细胞的候补的多核细胞、细胞团簇。
482.根据本发明,能够用多个波长的激发光同时激发由多个波长的荧光抗体标识后的细胞,同时检测发出的多个荧光,并有效地回收靶细胞。
483.根据本发明,能够根据来自血中细胞的图像成像数据,定量地鉴定并回收癌细胞以及疾病脏器组织切片。
484.根据本发明,能够选择性地回收由血中的免疫细胞吞噬异物后的细胞、或者血中的异物,并根据其基因组解析进行感染症诊断。
485.即,本发明在获取溶液中的微粒作为图像影像,根据其形状、光的吸收特性以及荧光特性的图像影像来判别特定的符合的微粒,并将其选择性地回收的方面是有用的。
486.本发明在能够将血中的微量对象细胞以一个细胞为单位进行纯化,并进行该对象细胞的准确的基因信息、表达信息的解析等的方面是有用的。
487.另外,本发明作为用于对在血中循环的癌细胞进行识别和/或回收的技术是有用的。另外,本发明在使感染症发病的血中的微量对象细胞以一个细胞为单位进行纯化,并高速地进行该对象细胞的准确的基因信息、表达信息的解析等的方面是有用的。
488.附图标记说明
489.100:输入图像
490.101:细胞
491.111:明视野的输出图像
492.121:荧光的输出图像
493.301:细胞分析装置系统
494.310:细胞浓缩
·
尺寸分级
·
染色
·
清洗部模块
495.320:细胞
·
细胞块胶囊化部模块
496.330:图像检测型单细胞分离
·
纯化部模块
497.340:基因解析
·
表达解析部
498.350:无污染再培养部模块
499.360:控制解析部模块(计算机)
500.400:细胞浓缩
·
尺寸分级
·
染色
·
清洗部
501.401:试样细胞样品用贮藏器
502.402:染色剂用贮藏器
503.403:清洗剂用贮藏器
504.406:浓缩
·
脱色过滤器
505.500:细胞浓缩
·
尺寸分级
·
染色
·
清洗部的微细流路
506.503:柱阵列
507.504:一对电极
508.507:流路
509.800:细胞
·
细胞块胶囊化部
510.1300:立方体容器
511.1301:窗
512.1304:分色镜
513.1305:角度调整机构
514.1306:滤波器
515.1311:图像尺寸调整系统单元
516.1312:可动式遮挡板
517.1313:透镜
518.1314:高速相机
519.1315:透镜
520.1316:图像成像元件
521.1401:荧光光量计
522.1402:荧光光量计
523.1600:图像检测型单细胞分离
·
纯化部
524.1605:侧鞘流
525.1606:细胞观察区域
526.1607:凝胶电极
527.1608:流路
528.1609:入口
529.1610:出口
530.1611:电线
531.1613:电线
532.1900:图像获取板
533.1902:流路
534.1905:流速检测用一维传感器阵列
535.1906:第一图像获取用一维传感器阵列
536.1907:第二图像获取用一维传感器阵列
537.1908:带通滤波器
538.1909:带通滤波器
539.1911:光传感器元件
540.1912:一维传感器阵列元件。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。