1.本发明属于金线莲提取及应用技术领域,具体涉及一种提高金线莲水提液总 黄酮和总多糖得率的方法及应用。
背景技术:
2.金线莲为兰科植物花叶开唇兰(anoectochilus roxburghii(wall.)lindl)的干燥 全草,具有清热凉血、解毒消肿、润肺止咳、保肝等功效,在民间有“药王”、“乌 人参”、“金线虎头蕉”等别称,是民间常用的药食同源植物。其化学成分丰富, 含有多糖、黄酮、挥发油、有机酸、甾体、生物碱等多种有效成分。目前对其有 效成分的提取工艺研究较多,但大多关注单类成分得率,如金线莲总黄酮、总多 糖的单组分提取,少有以两类及以上成分的得率为指标的工艺优化探究。并且金 线莲研究主要集中在成分变化及品种差异方面,对其深加工产品的研究较少,缺 乏对其功能的挖掘,研究表明,金线莲的黄酮类成分能够抗自由基、抗氧化应激, 具有保肝、抗肿瘤,治疗糖尿病等作用,其多糖具有降血糖、降血脂,调节免疫 等功能。
3.因此,本发明以金线莲为原料,以总黄酮和总多糖综合得率为考察指标,优 化金线莲有效物质的提取工艺,评估其体外降血糖及降血脂作用及体内ccl4急 性肝损伤保护作用,并完成了金线莲保肝口服液的工艺设计与制备。
技术实现要素:
4.本发明的目的之一在于提供一种提高金线莲水提液总黄酮和总多糖得率的 方法,该方法通过优化提取工艺,同时提高总黄酮和总多糖得率。
5.本发明的目的之二在于提供上述方法在制备保肝药物以及降糖降脂药物中 的应用。
6.为了实现上述目的,本发明的技术方案概述如下:
7.一种提高金线莲水提液总黄酮和总多糖得率的方法,取金线莲干燥粉末,过 2号筛,置于具塞试管中,加水提取,其金线莲有效成分提取工艺为:液料比为21∶1ml
·
g-1
、提取温度为71℃、提取时间为88min,提取三次。
8.上述提高金线莲水提液总黄酮和总多糖得率的方法在制备保肝或者降糖降 脂药物中的应用。所述药物为片剂、颗粒剂、口服液、分散剂或胶囊剂等任何药 物剂型。
9.本发明还提供采用上述金线莲水提液来制备金线莲口服液的方法:将金线莲 水提液在室温冷却,2000
×
g离心15min,取上清液;合并上清液,浓缩至每 1ml含生药0.2g,加50%的糖浆以及0.1%的山梨酸钾(所述比例均是占整个口 服液的比例),搅拌混匀,灭菌30min,即可。
10.本发明还通过实验得知,金线莲水提液能够有效的抑制α-淀粉酶、胰脂肪 酶、α-葡萄糖苷酶、胆固醇酯酶的活性。并且通过对比发现,其抑制率:α-淀粉 酶>胰脂肪酶>α-葡萄糖苷酶>胆固醇酯酶。
11.本发明的优点:
12.本发明以金线莲总黄酮、总多糖的得率为指标,通过响应面设计优化了金线 莲有效物的提取方法,得出双成分最佳提取工艺为:液料比为21∶1ml
·
g-1
、提取 温度为71℃、提取时间为88min。因此,确定金线莲口服液的最佳工艺为:称 取金线莲干燥粉末(过2号筛)1.0g,置于具塞试管中,加21倍量水提取,提取 温度为71℃,每次88min,提取次数为3次。提取完成后,室温冷却,2000
×ꢀ
g离心15min,取上清液。合并上清液,浓缩至每1ml含生药0.2g,加糖浆(蔗 糖制备),加入山梨酸钾,搅拌混匀,灭菌30min,即可。本品为保健品口服液, 经水煎煮而得,为保证口服液在一定时间内品质不变,且稳定有效,需要加入一 定量的防腐剂。经实验,加入0.1%的山梨酸钾作防腐剂较为合适。此外,再以 1∶1的比例加入以蔗糖制备的50%糖浆,调节风味最佳。
13.通过体外降糖、降脂实验,发现金线莲水提液对于4种酶的最高抑制率:α
‑ꢀ
淀粉酶>胰脂肪酶>α-葡萄糖苷酶>胆固醇酯酶,且效果优于多糖部位和去多糖 部位,金线莲总黄酮和总多糖部位存在一定的协同增效效果。实验中金线莲提取 液各组对于ccl4引起的急性肝损伤,能够显著降低ast、alt水平,表明金线 莲提取液对于肝损伤具有直接保护作用。ccl4肝损伤病理性变化中肝脏mda水 平上升,对肝脏具有一定的细胞毒性;sod抗氧化酶水平下降,清除自由基及 ros的活力下降;tg及ldl-c的水平上升。而金线莲提取液能显著降低tg和ldl-c水平,对hdl-c的水平有显著升高作用,具有减轻肝脏的脂肪化现象, 此外,金线莲提取液能降低mda水平,提高sod水平,降低tnf-α和il-6, 对ccl4引起的肝损伤肝脏组织病理变化有明显的对抗修复作用,能够保护ccl4引起的肝脏损伤。
附图说明
14.图1是金线莲口服液制备流程;
15.图2是金线莲提取工艺单因素考察情况;
16.图3是金线莲有效物质提取各因素交互作用影响的响应面图;
17.图4是金线莲各提取部位体外降糖降脂的抑制效果;
18.图5是肝脏he染色结果;图中(a)为模型组,(b)为正常组组,(c)为 阳性组组,(d)为低剂量组,(e)为中剂量组,(f)为高剂量组(20x)。
具体实施方式
19.下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描 述而更为清楚。但下述实施例中所涉及的具体实验方法如无特殊说明,均为常规 方法或按照制造厂商说明书建议的条件实施。
20.若未特别指明,实施例中所用技术手段为本领域技术人员所熟知的常规手段。 下述实施例中的实验方法,如无特别说明,均为常规方法。如无特殊说明,所采 用的试剂及材料,均可以从市场中购买获得。
21.除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉 的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发 明中。文中所述的较佳实施方法与材料仅作示范之用。
22.一、金线莲水提液的制备
23.1材料与方法
24.1.1实验材料
25.金线莲长治市裕丰农业科技发展股份有限公司,由组培获得;sevage:试 剂三氯甲烷、正丁醇,四氯化碳(ar,98%),购自北京沿程科技有限公司。, 北京化工厂有限责任公司;葡萄糖(批号:s10s9i69833,纯度:99.5%)、α-葡 萄糖苷酶、4-硝基苯基丁酸酯(p npb),上海源叶生物科技有限公司;胰脂肪酶、 α-淀粉酶,北京沿程科技有限公司;可溶性淀粉(批号:2018122041),北京百 诺威生物科技有限公司;胆固醇酯酶,赛谱锐思(北京)科技有限公司;对硝基 苯-α-d-葡萄糖苷(批号:l210833,p npg),安徽酷尔生物工程有限公司;dns 显色剂,北京兰博利德商贸有限公司;奥利司他(批号:国药准字h 19990205), 湖南迪诺制药股份有限公司;阿卡波糖(批号:国药准字h 19990205),拜耳医 药保健有限公司.中国北京。
26.spf级km小鼠,8周龄,40-45g,购于北京维通利华实验动物技术有限公 司,生产许可证号:scxk(京)2016-0011。谷草转氨酶(ast)、谷丙转氨酶 (alt)、超氧化物歧化酶(sod),均购自南京建成生物工程研究所。甘油三酯 (tg)、高密度脂蛋白(hdl-c)、低密度脂蛋白(ldl-c)试剂盒,均购自北 京冬歌博业生物科技有限公司。丙二醛(mda)、肿瘤坏死因子(tnf-α)、白介 素-6(il-6)elisa试剂盒,均购自江苏科特生物科技有限公司。
27.1.2金线莲口服液的制法
28.称取金线莲干燥粉末(过2号筛)1.0g,置于具塞试管中,加20倍量水提取, 每次90min,提取次数为3次。提取完成后,室温冷却,2000
×
g离心15min, 取上清液。合并上清液,浓缩至每1ml含生药0.2g,加糖浆(蔗糖制备),加 入山梨酸钾,搅拌混匀,灭菌30min,即可。
29.1.3工艺考察及保肝实验
30.1.3.1金线莲有效物质提取及测定方法
31.金线莲水提液部位的制备:称取金线莲干燥粉末(过2号筛)1.0g,置于具塞 试管中,水提。单因素考察中提取时间分别为30、60、90、120、150min、液料 比为10∶1、20∶1、30∶1、40∶1、50∶1ml
·
g-1
、提取温度为40、50、60、70、80℃、 提取次数1、2、3、4次。响应面实验中采用的提取条件是提取时间为60、90、 120min、液料比为10∶1、20∶1、30∶1ml
·
g-1
、提取温度为60、70、80℃,提取 次数为3次。提取完成后,室温冷却,2000
×
g离心15min,取上清液,合并上 清液,得提取物溶液,干燥即可。
32.水提液多糖部位的制备:在水提液中加入80%乙醇,加至水提液与80%乙 醇体积比为1∶5,静置过夜,过滤,得粗多糖,将粗多糖置于20ml水中,采用sevage法除蛋白,加入等体积sevage试剂(三氯甲烷-正丁醇4∶1),振摇30min, 离心,将水相与三氯甲烷层分开,反复多次离心除蛋白,直至蛋白完全除尽(分 层处基本无变性蛋白),干燥即得。
33.水提液去多糖部位的制备:水提液去多糖后,滤液回收除去乙醇,干燥即得。
34.总黄酮参考al(no3)
3-naoh-nano2法测定:准确吸取1.0ml待测样品于10 ml比色管中,加入5%亚硝酸钠溶液0.5ml,静置6min;再加入10%硝酸铝 溶液0.5ml,静置6min;加入1mol/l氢氧化钠溶液2ml,用蒸馏水定至10. 0ml,静置10min,于510nm处测定其吸光度,以芦丁为标准品,得回归方程 为:y=0.6441x 0.0021(r2=0.9990)。总多糖采用苯酚-硫酸法测定,取待测母液, 稀释为原来的250倍,取1ml稀释后的溶液加入1ml 5%的苯酚溶液,
5.0ml 的浓硫酸,混匀,25℃水浴10min,于490nm下测定其吸光度,以葡萄糖为标 准品,得回归方程为:y=0.1981x-0.0335(r2=0.9992)。
35.根据下列公式计算总黄酮和总多糖得率:
[0036][0037]
式中:w为各物质得率,%;n为稀释倍数;c为计算得到各物质浓度,mg
·
ml-1
; v为提取物体积,ml;m为金线莲质量,g。
[0038]
1.3.1.1金线莲有效物质提取单因素实验
[0039]
精密称取金线莲药粉1.0g,分别考察提取时间(30、60、90、120、150min)、 液料比(10∶1、20∶1、30∶1、40∶1、50∶1ml
·
g-1
)、提取温度(40、50、60、70、80℃) 和提取次数(1、2、3、4次)对总黄酮和总多糖得率的影响。
[0040]
1.3.1.2金线莲有效物质提取响应面优化实验
[0041]
根据单因素实验结果,通过box-behnken中心组合法进行响应面设计,优 化金线莲有效物质提取工艺。以提取温度(a)、提取时间(b)、液料比(c)为自变 量,总黄酮和总多糖得率为响应值(y1、y2)进行回归拟合分析。
[0042]
1.3.2金线莲有效物质体外降糖实验
[0043]
1.3.2.1α-葡萄糖苷酶抑制作用
[0044]
α-葡萄糖苷酶抑制作用的测定方法如下,于405nm处测定吸光值,每个样 品3个重复,计算多糖溶液对α-葡萄糖苷酶的抑制率。
[0045][0046]
注:a
样品
=pbs 各部位溶液 α-葡萄糖苷酶 p npg溶液;a
阳性
=pbs 阿卡波糖溶液 α-葡萄糖苷 酶 p npg溶液;a
背景
=pbs 各部位溶液 p npg溶液;a
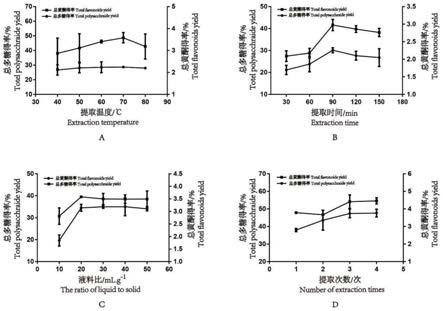
空白
=pbs α-葡萄糖苷酶 p npg溶液
[0047]
1.3.2.2α-淀粉酶抑制作用
[0048]
α-淀粉酶抑制作用的测定方法如下,于540nm处测定吸光值,每个样品3 个重复,计算多糖溶液对α-淀粉酶的抑制率。
[0049][0050]
注:a
样品
=α-淀粉酶溶液 各部位溶液 淀粉溶液 dns显色剂;a
阳性
=α-淀粉酶溶液 阿卡波糖溶 液 淀粉溶液 dns显色剂;a
背景
=各提取部位溶液 淀粉溶液 dns显色剂;a
空白
=α-淀粉酶溶液 淀粉溶液 dns显色剂
[0051]
1.3.3金线莲有效物质体外降脂实验
[0052]
1.3.3.1胰脂肪酶抑制作用
[0053]
胰脂肪酶抑制作用的测定方法如下,于405nm处测定吸光值,每个样品3 个重复,计算多糖溶液对胰脂肪酶的抑制率。
[0054]
[0055]
注:a
样品
=tris-hcl缓冲液 胰脂肪酶 各提取部位溶液 p npb溶液;a
阳性
=tris-hcl缓冲液 胰脂肪酶 奥 利司他溶液 p npb溶液;a
背景
=tris-hcl缓冲液 各提取部位溶液 p npg溶液;a
空白
=tris-hcl缓冲液 胰 脂肪酶 pnpg溶液
[0056]
1.3.3.2胆固醇酯酶抑制作用
[0057]
胆固醇酯酶抑制作用的测定方法如下,于405nm处测定吸光值,每个样品 3个重复,计算多糖溶液对胆固醇酯酶的抑制率。
[0058][0059]
注:a
样品
=磷酸缓冲溶液 各部位溶液 胆固醇酯酶 p npb溶液;a
阳性
=磷酸缓冲溶液 奥利司他 胆固醇酯 酶 p npb溶液;a
背景
=磷酸缓冲溶液 胆固醇酯酶 p npb溶液;a
空白
=磷酸缓冲溶液 胆固醇酯酶 p npb 溶液
[0060]
1.3.4动物实验方法
[0061]
1.3.4.1动物分组及给药方法
[0062]
健康spf级8周龄雄性km小鼠,60只,雄性,体重(40
±
5)g,在实验室 适应性饲养7d后用于正式实验,12h明暗交替照明,自由进食、饮水。适应性喂 养1周后,将小鼠随机分为6组,每组10只,包括正常组、模型组、阳性组和 金线莲水提液组(高2g/kg,中1g/kg,低0.5g/kg)。各给药组连续灌胃给药2 周,每日上午8点灌胃1次,正常组和模型组同时给予等量的生理盐水。
[0063]
1.3.4.2 ccl4小鼠肝损伤模型制备
[0064]
末次给药2h后,将模型组和各给药组一次性腹腔注射0.5%ccl4橄榄油溶 液10ml
·
kg-1
,对照组给予等量的橄榄油。禁食16h后,取血,脱颈椎处死小鼠, 并分离小鼠肝脏。
[0065]
1.3.4.3血清、肝匀浆上清液的制备
[0066]
血清:末次给药后,所有小鼠禁食16h,摘眼球取血,保存2ml离心管中, 静置30min后,离心15min(3000r/min,4℃),取上清,上清液转移至另一圆 底密封管中,-80℃冷冻保存,避免反复冻融。
[0067]
肝匀浆上清:剪取肝组织0.5g,0.9%氯化钠溶液漂洗,滤纸吸干,置于10ml 离心管,加入9倍0.9%氯化钠溶液,匀浆机打碎,离心30min(4 500r/min,4℃), 取上清液,分装,保存于-80℃冰箱待用,避免反复冻融。
[0068]
1.3.4.4脏器指数的测定
[0069]
取血后,脱颈椎处死小鼠,解剖后,取肝脏、肾脏、脾脏,0.9%nacl溶液 漂洗,滤纸擦干。称重,计算脏器指数。
[0070]
脏器指数(%)=脏器重量/体重
×
100%
[0071]
1.3.4.4血清和肝脏组织指标测定
[0072]
血清中ast和alt的测定:取冷冻小鼠肝匀浆上清液,复溶后按照ast、 alt试剂盒说明书,进行测定。ast测定原理为ast能使α-酮戊二酸和天门冬 氨酸转移氨基和酮基,生成谷氨酸和草酰乙酸。草酰乙酸在反应过程中可自行脱 羧呈丙酮酸。丙酮酸与2,4-二硝基苯肼反应生成2,4-二硝基苯腙,在碱性条件下 呈红棕色,于510nm比读吸光度并计算酶活力。alt测定原理为在37℃及ph7.4 条件下,作用于丙氨酸及α-酮戊二酸组成的底物,生成
min-无水乙醇ii 5min-二甲苯i 5min-二甲苯ii 5min中脱水透明,将切片从二甲 苯拿出来稍晾干,中性树胶封片。
[0087]
⑤
显微镜镜检,图像采集分析。
[0088]
⑥
染色结果:细胞核蓝色,细胞质红色。
[0089]
1.4数据处理
[0090]
采用design expert 8.0.6.1软件处理设计响应面实验和处理数据,采用prism 8.0软件及excel 2013软件进行统计分析和图表处理。数据采用表示,使 用spss 23.0进行统计分析,数据处理采用独立样本t检验,p<0.05被认为有 统计学差异。
[0091]
2结果与分析
[0092]
2.1金线莲有效物质提取单因素实验结果
[0093]
提取温度对金线莲水提液总黄酮和总多糖的影响见图2(a)。70℃时,总 黄酮得率最大为3.58%,总多糖得率最大为26.38%,大于70℃时,二者得率均 开始下降。提取时间对金线莲水提液总黄酮和总多糖的影响见图2(b)。提取时 间小于90min时,总黄酮和总多糖得率均呈上升趋势,尤其是60-90min上升趋 势明显,90min时,总黄酮得率、总多糖得率最大,分别为2.98%、27.87%。 提取液料比对金线莲水提液总黄酮和总多糖的影响见图2(c)。总黄酮、总多糖 得率随着液料比的增加,在液料比20∶1ml
·
g-1
时达到最高。提取次数对金线莲总 黄酮和总多糖的影响见图2(d)。随着提取次数的增加,总黄酮及总多糖得率均 呈上升趋势,考虑到经济和时间成本,故选取提取次数3次。
[0094]
2.2金线莲有效物质提取响应面工艺优化结果
[0095]
2.2.1响应面工艺优化设计
[0096]
确定金线莲有效物质的最佳提取工艺,以单因素实验结果为依据,采用 box-behnken的中心组合设计原理,以总黄酮和总多糖得率为考察指标,对提取 温度(a)、提取时间(b)、液料比(c)3个水平进行编码,响应面分析实验的 因素和水平见表1。
[0097]
表1响应面实验因素水平及编码
[0098][0099]
2.2.2回归方程建立与显著性检验
[0100]
设计方案及结果见表2。对实验数据进行多元回归拟合,得到金线莲总黄酮 对实验因素的二次多项方程为:
[0101]
y1=-14.90125 0.415450a 0.062392b 0.067075c-0.000117ab 0.000850ac 0.000025bc-0.002967a
2-0.000310b
2-0.003043c2,得到金线莲总多糖对实验因素 的二次多项方程为:
[0102]
y2=-239.68625 5.6641a 1.20484b 1.29123c-0.008508ab-0.002925ac 0.002367 bc-0.03399a
2-0.003629b
2-0.033015c2,r2为0.9736、0.9125,r
2adj
为0.9397、0.8000, 该模型能解释总黄酮响应值变化的93.97%,解释总多糖响应值变化的80.00%, 变异系数为2.43%、6.72%,表明该模型重现性较好,拟合程度较好。
[0103]
表2响应面实验设计及结果
[0104][0105][0106]
实验方差分析结果见表3和表4。模型p值均小于0.05,表明回归模型达到 显著水平,失拟项均不显著,表明拟合程度较好,模型建立有效。影响金线莲水 提液总黄酮得率的因素主次顺序为液料比>提取温度>提取时间。
[0107]
表3总黄酮回归模型方差分析结果
[0108][0109][0110]
注:
**
p<0.01为极显著;
*
p<0.05为显著,下同。
[0111]
表4总多糖回归模型方差分析结果
[0112][0113]
注:
**
p<0.01为极显著;
*
p<0.05为显著,下同。
[0114]
2.2.3响应面分析与验证实验
[0115]
金线莲有效物质提取工艺中提取温度、提取时间、液料比3个因素之间交互 作用对总黄酮和总多糖得率的影响如图3所示。液料比的曲线比较陡峭,表明液 料比对总多酚和总黄酮得率的影响最为显著,其次为提取温度和提取时间,表现 为曲线较平缓。
[0116]
经软件优化,总黄酮最佳提取条件为液料比为21.35∶1ml
·
g-1
、提取温度为 71.33℃、提取时间为87.99min,理论得率为3.38%;总多糖最佳提取条件为液 料比为25.97∶1ml
·
g-1
、提取温度为73.36℃、提取时间为88.48min,理论得率为 38.15%。为方便实际操作,综合考虑影响总黄酮和总多糖得率各因素以及经济成 本,将提取工艺调整为最佳提取条件为液料比为21∶1ml
·
g-1
、提取温度为71℃、 提取时间为88min,重复3次实验进行验证,最终得到总多糖和总黄酮得率分别 为36.64%、3.24%,与模型理论值相近,表明该模型能较好用于优化金线莲有效 物质的提取工艺。
[0117]
2.3金线莲有效物质体外降糖降脂实验
[0118]
2.3.1金线莲不同提取部位对α-葡萄糖苷酶及α-淀粉酶的活性的抑制效果
[0119]
在浓度为2ml
·
g-1
时金线莲各提取部位对于α-葡萄糖苷酶抑制作用较高,其 中水提液的抑制效果最好,明显优于其他的金线莲提取部位,抑制率最高可达 82.62%。此外,水提液多糖部位相比于水提液去多糖部位对于α-葡萄糖苷酶抑制 效果较好(图4,a)。金线莲各提取部位在浓度为8ml
·
g-1
时对α-淀粉酶抑制作 用较好,且金线莲水提液部位和水提液多糖部位在此浓度抑制效果接近阳性药物, 达到90.60%,水提液去多糖部位抑制率最高为87.59%(图4,b)。
[0120]
2.3.2金线莲不同提取部位对胰脂肪酶及胆固醇酯酶的活性的抑制效果
[0121]
在浓度为8ml
·
g-1
时各提取部位对胰脂肪酶达到较好的抑制效果,其中,金 线莲水提液在此浓度抑制效果明显优于阳性药物,达到87.99%,优于水提液多 糖部位和去多糖部位(图4,c)。各提取部位在浓度为8ml
·
g-1
时各提取部位对 于胆固醇酯酶抑制效果较好,金线莲水提液的抑制效果优于水提液多糖部位和去 多糖部位,在浓度为8ml
·
g-1
时,金线莲水提液的抑制率达到54.75%(图4,d)。
[0122]
2.4金线莲水提液对ccl4肝损伤小鼠的保护作用
[0123]
2.4.1小鼠一般状态及体重变化
[0124]
在对小鼠进行灌胃期间,各组小鼠状态良好,毛色光泽良好,进食正常,体 重增加明显,无死亡情况。造模后,模型组小鼠体重下降,毛色晦暗无光泽,反 应略迟钝,而其他各组小鼠毛色较模型组有所改善,也相对较活跃。
[0125]
表5实验期间小鼠体重(g)变化(n=6)
[0126][0127]
2.4.2脏器指数
[0128]
如表6所示,与对照组比较,模型组肝重指数、脾重指数有所升高,肾重指 数有显著的升高。与模型组比较,金线莲水提液高、中、低剂量组肝重指数呈显 著下降趋势,肾重指数呈下降趋势,脾重指数呈下降趋势。表明金线莲水提液具 有改善ccl4引起的肾脏和脾脏损伤,肝脏肥大的作用。
[0129]
表6各组小鼠的脏器指数(n=6)
[0130][0131]
注:与正常组组相比,“*”,代表两组间具显著差异(p<0.05),“**”代表两组间具较显著差异(p<0.01),“***”代表 两组间具极显著差异(p<0.001);
[0132]
与模型组组相比,“#”,代表两组间具显著差异(p<0.0s),“##”代表两组间具较
显著差异(p<0.01),“###”代表两组 间具极显著差异(p<0.001);以下表格同。
[0133]
2.4.3金线莲提取液对血清中alt、ast水平的影响
[0134]
研究表明,肝细胞损伤会导致细胞内alt和ast释放到血液中,引起血 清中alt和ast水平的升高,所以alt和ast是被广泛应用于检测肝细胞 损伤的血清学指标。在本实验中ccl4肝损伤模型组alt和ast水平与正常对 照组相比急剧上升地抑制ccl4引起的alt、alt水平的增加,中剂量组也存在 使其降低的趋势(表7),表明金线莲提取液对血清中ast、alt水平升高有显 著降低效果,具有一定的保肝作用。
[0135]
表7各组小鼠的血清ast、alt水平(n=6)
[0136][0137]
2.4.4金线莲提取液对肝组织中sod和mda水平的影响
[0138]
氧化损伤一直被认为是肝损伤的重要机制之一。为此我们进一步检测了肝组 织氧化损伤的重要指标mda。结果发现,与对照组相比较,模型组肝组织mda 水平显著升高,而金线莲水提液能够剂量性地降低mda水平,表明ccl4能够 引起小鼠肝脏的氧化损伤,而金线莲提取液具有改善ccl4引起的mda水平上 升的作用。sod是肝脏中抗氧化的第一道防线,能够清除肝脏中的自由基或者 ros,也可被自由基或者ros灭活。结果发现,ccl4损伤肝组织时可以显著降 低肝脏的sod的活性和水平。而金线莲提取液能够提高sod的水平(表8), 提示金线莲提取液对抗ccl4引起的肝脏氧化损伤很可能是通过提高机体的sod 抗氧化酶实现的。
[0139]
表8各组小鼠的肝脏sod、mda水平(n=6)
[0140][0141]
[0142]
2.4.5金线莲提取液对肝组织中tnf-α和il-6水平的影响
[0143]
ccl4引起的急性肝损伤,常伴随有肝脏炎症,此实验中选取代表性炎症因子 tnf-α和il-6作为测定指标。结果表明,ccl4能够显著提高肝组织炎症因子 tnf-α和il-6水平,导致肝脏炎症损伤加重。金线莲提取液各组能够显著性的降 低炎症因子水平,但中剂量组仅有降低趋势(表9)。
[0144]
表9各组小鼠的肝脏tnf-α、il-6水平(n=6)
[0145][0146]
2.4.6金线莲提取液对肝组织中tg、hdl-c和ldl-c水平的影响
[0147]
甘油三酯(tg)是脂质组成成分,体内自身合成的甘油三酯主要在肝脏, 甘油三酯的升高为心血管疾病的危险因素,血清甘油三酯是血脂分析的常规项目; 高密度脂蛋白(hdl)是一种抗动脉粥样硬化的血浆脂蛋白,是冠心病的保护因 子,hdl-c是临床检测高密度脂蛋白的有效指标;低密度脂蛋白(ldl)是一 种运载胆固醇,可被氧化为氧化低密度脂蛋白,ldl-c为期临床检测指标,偏 高则会形成动脉粥样硬化斑块,此次选取了这3个代表性指标进行检测。结果发 现,与对照组相比,ccl4损伤模型组肝组织tg和ldl-c水平显著升高,hdl-c 水平显著降低,而金线莲提取液各组均能显著降低tg和ldl-c水平,对hdl-c 的水平有显著升高作用(表10)。
[0148]
表10各组小鼠的肝脏tg、hdl-c和ldl-c水平(n=6)
[0149][0150][0151]
2.4.7小鼠肝脏组织he染色
[0152]
肝脏he染色可以直接观察肝脏组织损伤变化,结果见图5。由图可知正常 组小鼠
肝组织肝细胞形态完整,未见炎性聚集,细胞坏死等,未观察到任何病变。 而经模型组小鼠肝组织肝脏结构遭到破坏,肝细胞坏死明显,炎性细胞浸润现象 明显。而预防后的金线莲提取液组,小鼠肝组织肝细胞形态完整,炎性聚集,细 胞坏死等基本未见。结果表明,金线莲提取液提前摄入对ccl4引起的肝损伤肝 脏组织病理变化有明显的对抗修复作用。
[0153]
本研究以金线莲总黄酮、总多糖的得率为指标,通过响应面设计优化了金线 莲有效物的提取方法,得出双成分最佳提取工艺为:液料比为21∶1ml
·
g-1
、提取 温度为71℃、提取时间为88min。因此,确定金线莲口服液的最佳工艺为:称 取金线莲干燥粉末(过2号筛)1.0g,置于具塞试管中,加21倍量水提取,提取 温度为71℃,每次88min,提取次数为3次。提取完成后,室温冷却,2000
×ꢀ
g离心15min,取上清液。合并上清液,浓缩至每1ml含生药0.2g,加糖浆(蔗 糖制备),加入山梨酸钾,搅拌混匀,灭菌30min,即可。本品为保健品口服液, 经水煎煮而得,为保证口服液在一定时间内品质不变,且稳定有效,是以需要 加入一定量的防腐剂。经实验,加入0.1%的山梨酸钾作防腐剂较为合适。此外, 再以1∶1的比例加入以蔗糖制备的50%糖浆,调节风味最佳。
[0154]
通过体外降糖降脂实验,发现金线莲水提液对于4种酶的最高抑制率:α
‑ꢀ
淀粉酶>胰脂肪酶>α-葡萄糖苷酶>胆固醇酯酶,且效果优于多糖部位和去多糖部 位,金线莲总黄酮和总多糖部位存在一定的协同增效效果。alt与ast活力是 检测肝脏损伤的最敏感指标,可以在一定的范围内反映生物体内肝细胞的损伤程 度大小。各种急性病毒性肝炎、药物或酒精引起急性肝细胞损伤时,血清alt 活力最敏感,同时ast也会升高。实验中金线莲提取液各组对于降低ast、alt 水平具有显著性差异,表明金线莲提取液对于肝损伤具有直接保护作用。此外, ccl4肝损伤也会导致肝脏脂质代谢受到影响,造成氧化应激损伤,氧化应激是 肝脏疾病发生的重要原因之一。病理性变化中肝脏mda水平上升,对肝脏具有 一定的细胞毒性;sod抗氧化酶水平下降,清除自由基及ros的活力下降;tg 及ldl-c的水平上升。而金线莲提取液能显著降低tg和ldl-c水平,对hdl-c 的水平有显著升高作用,具有减轻肝脏的脂肪化现象,此外,金线莲提液能降低 mda水平,提高sod水平,降低tnf-α和il-6,对ccl4引起的肝损伤肝脏组 织病理变化有明显的对抗修复作用,能够保护ccl4引起的肝脏损伤,且低剂量 组效果较佳。
[0155]
金线莲临床日用量为3.0-9.0g生药,实验表明低剂量组保肝作用明显,因此 设定口服液规格为10ml,每日用量为30ml,每1ml含生药0.2g,每日生 药量为3.0g。
[0156]
以上所述之实施例,只是本发明的较佳实施例而已,仅仅用以解释本发明, 并非限制本发明实施范围,对于本技术领域的技术人员来说,当然可根据本说明 书中所公开的技术内容,通过置换或改变的方式轻易做出其它的实施方式,故凡 在本发明的原理上所作的变化和改进等,均应包括于本发明申请专利范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。