1.本发明涉及生物电学检测领域,具体涉及一种基于阻抗信号及荧光成像的细胞电学和结构特征检测装置及方法。
背景技术:
2.细胞电学和结构特性对于评估细胞状态、诊断血液和肿瘤疾病等具有重要意义。目前已有研究方法分别表明细胞结构特征以及细胞电学特征可以用于进行细胞分类分析,然而研究的瓶颈在于缺乏有效的单细胞表征工具同时采集大量单个细胞的电学和结构特征参数。所以合理推测电学和结构特征的综合检测,对快速准确地应用于临床诊断和治疗具有重要的意义。
3.检测单细胞电学和结构特征的常规方法按照检测参量分为电学特征方法和结构特征方法两类。其中电学特征检测方法主要包括膜片钳、电旋转和介电泳。膜片钳使用锥形玻璃微管电极吸取细胞膜形成密封连接,通过施加电流与频率的函数关系获取细胞膜电容。电旋转在两对互相垂直的电极上分别施加幅值和频率相同,相位相差90
°
的交流电压信号,通过测量细胞旋转速度随频率的变化关系(即rot频谱)获取细胞膜介电常数和细胞质电导率。介电泳计数电极上粘附细胞的数量,获取与频率之间的关系得到细胞膜比电容和细胞质电导率。这些方法可以获取细胞电学特征,但存在无法表征单细胞层面特性(介电泳),或者操纵、定位细胞复杂导致检测通量低(膜片钳和电旋转)等问题,难以采集大量单细胞数据用于实际应用。
4.结构特征检测方法除了传统的人工方法,主要包括电阻抗、光散射和光成像。电阻抗基于库尔特原理测量细胞通过小孔时引起的电脉冲变化,从而实现细胞计数和评估细胞体积大小。光散射利用细胞通过时引起光子运动方向改变形成不同角度的散射,从而获取细胞大小和细胞粒度等信息。光成像利用细胞膜及细胞核染色的细胞被不同波长激光照射发射不同波长荧光进行荧光成像,从而表征细胞及细胞核的结构特征。这些方法提高了检测通量,但侧重在细胞结构特征,没有同时获取细胞电学特征参数。
5.近年来,随着mems(micro-electromechanical systems)迅速地发展,在微流控技术的加持下,利用以上检测方法进行细胞电学和结构特征的检测,一方面,较之前的方法,主要是常规电学检测方法,明显提高了检测通量,另一方面,在获取细胞电学特征的同时可以获取细胞直径等信息,但缺乏对细胞核尤其是不规则细胞核的有效结构特征提取。综上,目前的检测方法对细胞电学和结构参数检测存在局限,限制了细胞的综合评估。
6.已公开的专利cn202010226537.5,针对细胞核的检测,首先假设细胞核为规则球形,然后利用光电倍增管pmt将荧光信号转换为电信号,进而得到细胞核的等效直径信息。实际上,细胞核通常并不是规则的球形,所以该专利cn202010226537.5并不能准确地表征细胞核结构特征
7.因此需要发展一种新型的装置及方法,高通量、准确地综合检测细胞电学和结构特性是非常有意义的。
技术实现要素:
8.为了解决上述技术问题,本发明综合利用mems加工工艺和微流控技术,发明了一种基于阻抗信号及荧光成像的细胞电学和结构特征检测装置及方法,采用荧光成像的方法,将细胞核的结构呈现出来,更直观地表现细胞核的整体轮廓信息。该方法相较于现有技术,有三方面改进目标:
9.(1)提高了单细胞电学特征检测通量。目前已有的可得到单细胞细胞电学特性的常规方法,如膜片钳和电旋转,由于细胞操纵、定位时间过长导致的检测通量低,难以采集具有统计学意义的数据用于实际应用。
10.(2)提高了单细胞结构特征的检测准确性。目前已有的可得到细胞的结构特性的常规方法,如电阻抗和光散射,仅能获取细胞的尺寸信息,而无法获取细胞核的准确信息。
11.(3)实现了细胞电学和结构特征的同时有效检测。目前已有的检测方法,如某些微流控方法,仍缺乏对细胞核结构特征的有效表征,导致综合评估细胞受限。
12.本发明的技术方案为:一种基于阻抗信号及荧光成像的细胞电学和结构特征检测方法,包括如下步骤:
13.步骤1、利用压力控制模块施加负压,吸取细胞通过微流控芯片模块上的错位十字交叉压缩通道;
14.步骤2、在压缩通道入口利用荧光成像模块采集细胞中荧光染色的细胞核图像视频;利用荧光染色的细胞核图像视频得到细胞核的结构特征;
15.步骤3、在错位十字交叉压缩通道的错位十字两端利用阻抗测量模块检测有无细胞通过时的双频阻抗幅值和相位;
16.步骤4、利用阻抗幅值和相位以及对应的计算方法得到细胞结构特征,包括细胞直径;以及细胞电学特征,包括细胞质电导率和细胞膜比电容。
17.根据本发明的另一方面,还提出一种进行细胞电学和结构特征检测的装置,微流控芯片模块、阻抗测量模块、荧光成像模块和压力控制模块;其中,
18.阻抗测量模块的两端分别与微流控芯片模块中错位十字压缩通道两端通过插入电极线相连接;
19.荧光成像模块形成的荧光成像光路位于微流控芯片模块中细胞溶液入口通道与错位十字交叉压缩通道交界处;
20.压力控制模块的压力输出端连接到微流控芯片模块的细胞溶液出口通道。
21.有益效果:
22.从以上技术方案的阐述可以看出本发明:基于阻抗信号及荧光成像的细胞电学和结构特征检测装置及方法具有以下有益效果:
23.本发明提高了单细胞电学特征检测通量。与已有方法相比,无需细胞操纵、定位,从而实现高通量检测。
24.本发明提高了单细胞结构特征的检测准确性。通过细胞核荧光成像,能够准确对细胞核形态进行呈现,与已有方法相比,提高了表征的准确性。
25.本发明实现了细胞电学和结构特征的同时有效检测。通过阻抗信号和荧光成像,可实现细胞电学和结构特征的综合评估。
附图说明
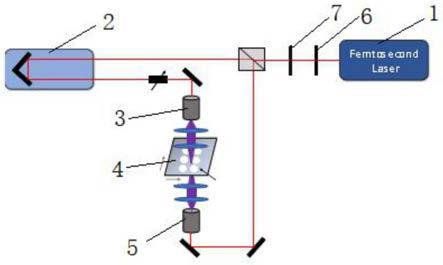
26.图1本发明的装置结构示意图;
27.图2本发明的微流控芯片模块结构示意图;
28.图3本发明的微流控芯片模块加工流程;
29.图4细胞电学和结构特征计算模型示意图;
30.图5细胞荧光图像示意图;
31.图6细胞阻抗幅值相位示意图。
具体实施方式
32.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整的描述,显然,所描述的实施例仅为本发明的一部分实施例,而不是全部的实施例,基于本发明中的实施例,本领域的普通技术人员在不付出创造性劳动的前提下所获得的所有其他实施例,都属于本发明的保护范围。
33.根据本发明的实施例,一种基于阻抗信号及荧光成像的细胞电学和结构特征检测装置,如图1所示,主要包括微流控芯片模块、阻抗测量模块、荧光成像模块和压力控制模块四部分。
34.微流控芯片模块为硬件装置中的核心模块,由绝缘承载体和绝缘衬底通过键合操作形成,结构示意图如图2所示。微流控芯片模块的绝缘承载体依次包含细胞溶液入口通道(100)、错位十字交叉压缩通道(200)以及细胞溶液出口通道(300)。具体来讲,细胞溶液入口通道(100)结构特征是横截面大于细胞尺寸以保证细胞顺利流动,同时横截面高度不易过高,防止影响细胞在位于入口通道与错位十字交叉压缩通道交界处的成像聚焦,该通道横截面高度尺寸确定为25~30μm左右(大部分细胞的直径在15-20μm)。错位十字交叉压缩通道(200)包括流动压缩通道(210)和错位十字压缩通道(221和222):错位十字压缩通道(221和222)结构特征是横截面一般为流动通道横截面积的1/3左右,长度一般与流动压缩通道的宽度相当,一方面以便形成合适的流阻防止细胞在流动通道中穿行过程中进入其中,另一方面不会发生阻抗基线(阻抗基线是指没有细胞通过压缩通道时,阻抗测量模块通过错位十字压缩通道221和222之前检测的阻抗值)过高影响阻抗检测的情况,该错位十字压缩通道截面积宽度在3-5μm左右,横截面积高度与流动通道相同,该通道长度在10-15μm左右;错位十字通道之间的流动通道(210)结构特征是横截面小于细胞横截面以便使流经的细胞发生压缩,该横截面尺寸在10-12左右(细胞的直径在15-20μm左右),长度一般为细胞在此压缩的拉伸长度的2倍左右,确定为50-60μm(细胞拉伸长度在20-30μm左右)。细胞溶液出口通道(300)结构特征与细胞溶液入口通道结构特征相同。微流控芯片的绝缘衬底采用石英载玻片,最优降低荧光背景噪声。
35.微流控芯片模块加工流程如图3所示。具体来说,首先在硅片上旋涂az 4214光刻胶,前烘、曝光、反转烘、去离子水浸泡、泛曝光、显影后形成掩膜,然后进行硅片刻蚀形成压缩通道模具部分,如图3中的(a)-(c)所示。接下来,在上述硅片上旋涂一层su 8-25,前烘、曝光、后烘、显影、坚膜形成所需的微流控模具,如图3中的(d)-(e)所示。最后将聚二甲基硅氧烷聚合物的预聚体和固化剂按照10:1混合、真空脱气后的混合物浇筑在制作好的上述模具上,固化、脱模、打孔、清洁后得到含有微流控通道的pdms与石英衬底键合,即可得到完整
的微流控芯片,如图3中的(f)-(h)所示。
36.阻抗测量模块,包括锁相放大器和数据采集卡。根据实施例需要,可以精确检测阻抗变化的有无,输出频率为100000个采样点/秒,并通过插入电极线与前述微流控芯片模块的错位十字压缩通道两端相连接。
37.荧光成像模块,包括荧光倒置显微镜、汞灯光源和高速照相机。其中汞灯光源可提供荧光激发所需的紫外光,高速照相机可以录制128*8-1920*1200分辨率、730-400000帧频的视频图像,曝光时间最低可到1μs,并使荧光倒置显微镜形成的光路位于上述微流控芯片模块中细胞溶液入口通道与错位十字交叉压缩通道交界处。
38.压力控制模块,包括压力控制器和导气软管。其中压力控制器可以输出-50kpa~50kpa之间的任意压强,并通过导气软管与前述微流控芯片模块细胞溶液出口通道相连接。
39.本实施例具体实现方法包括获取原始数据的实验操作及原始数据处理方法:
40.本实施例实验操作中首先连接微流控芯片模块、阻抗测量模块、荧光成像模块和压力控制模块。连接方法是阻抗测量模块的两端分别与微流控芯片模块中错位十字压缩通道两端通过插入电极线相连接;荧光成像模块形成的荧光成像光路位于微流控芯片模块中细胞溶液入口通道与错位十字交叉压缩通道交界处;压力控制模块的压力输出端连接到微流控芯片模块的细胞溶液出口通道。然后使用磷酸盐缓冲液pbs注满微流控芯片中的所有沟道,目的是防止通过微流控芯片的细胞溶液出口通道施加压力时在通道中产生气泡,影响细胞的流动。接下来,在微流控芯片的细胞溶液入口通道加入一定浓度的细胞悬浮液,利用压力控制模块施加负压,驱动细胞依次通过入口通道、错位十字交叉压缩通道和出口通道,首先利用荧光成像模块录制染色细胞核通过光路时的视频图像数据,同时利用阻抗测量模块检测两电极间有无细胞穿行时的阻抗数据,视频图像和阻抗数据作为实验的原始数据。
41.根据本发明的一个实施例,提出一种基于阻抗信号及荧光成像的细胞电学和结构特征检测方法,包括如下步骤:
42.步骤1、利用压力控制模块施加负压,吸取细胞通过微流控芯片模块上的错位十字交叉压缩通道;
43.步骤2、在压缩通道入口利用荧光成像模块采集细胞中荧光染色的细胞核图像视频;利用荧光染色的细胞核图像视频得到细胞核的结构特征;
44.步骤3、在错位十字交叉压缩通道的错位十字两端利用阻抗测量模块检测有无细胞通过时的双频阻抗幅值和相位;
45.步骤4、利用阻抗幅值和相位以及对应的计算方法得到细胞结构特征,包括细胞直径;以及细胞电学特征,包括细胞质电导率和细胞膜比电容。
46.其中,所述步骤2在压缩通道入口利用荧光成像模块采集细胞中荧光染色的细胞核图像视频;利用荧光染色的细胞核图像视频得到细胞核的结构特征;具体如下:视频图像数据的处理主要是获取染色细胞核有效荧光图像,也就是细胞核即将进入错位十字交叉压缩通道的荧光图像,是因为这一帧图像对应的细胞核既在一定程度上被固定保证了图像聚焦效果,又没有进入压缩通道被压缩变形影响荧光成像,如图4(a)所示。
47.首先确定录制视频图像的分辨率,如256*128像素,并确定荧光成像区域中细胞溶液入口通道和错位十字交叉压缩通道分界线的位置及距离图像右边界的距离l
p
;
48.接下来染色细胞细胞核在微通道中穿行通过,依次为细胞核的荧光图像
①
、
②
、
③……
,其中细胞核最右边界距离荧光图像右边界的距离为lb;最后通过算法条件l
b-l
p
=0获取有效荧光图像,即目标成像,获取细胞核的结构特征参数,如图5所示。
49.所述步骤4、利用阻抗幅值和相位以及对应的计算方法得到细胞结构特征,包括细胞直径;以及细胞电学特征,包括细胞质电导率和细胞膜比电容,具体如下:
50.细胞拉伸长度及细胞直径计算方法
51.利用错位十字交叉压缩通道之间有细胞通过时的阻抗幅值或相位变化,即可得到细胞拉伸长度lc(在此过程中,细胞被压缩等效为长方体结构),其计算原理如图4所示,其中ld为错位十字压缩通道的宽度,lf为错位十字压缩通道之间的流动压缩通道长度,sf为流动压缩通道的横截面积。当细胞穿行至如图4(b)所示阶段,细胞阻挡电场线增加至完全阻挡再至阻挡电场线略微减少,阻抗幅值先上升后有所下降,相位相反,先下降后有所上升;当细胞穿行至如图4(c)所示阶段,细胞阻挡电场线保持不变,故阻抗幅值、相位保持不变;当细胞穿行至如图4(d)所示阶段,与如图4(b)相似。根据以上分析,当细胞依次通过如图4(b)-(d)阶段时,阻抗幅值相位会呈现图6所示曲线,并一一对应形成细胞穿行时间t1、t2和t3。
52.在t1和t3时间段,细胞运动位移相同,均为细胞拉伸长度与错位十字压缩通道宽度之和:lc ld,在t2时间段,细胞运动位移为错位十字压缩通道之间的流动压缩通道长度与细胞拉伸长度之差:l
f-lc。
53.考虑到压缩通道长度足够小,故可认为细胞在穿行过程中保持匀速运动,即:
[0054][0055]
求解得到细胞拉伸长度为:
[0056][0057]
根据体积不变原则进一步等效计算得到细胞直径dc:
[0058][0059]
细胞质电导率和细胞膜比电容计算
[0060]
当错位十字交叉压缩通道中无细胞存在时,电极间的阻抗可用沟道电阻rc和沟道寄生电容cc的并联电路表征。此时检测阻抗为z,其中为寄生电容cc的阻抗,j为虚部单位,f为应用频率:
[0061][0062]
当细胞完全处于错位十字压缩通道之间的流动压缩通道时,如图4(c)所示,细胞膜由绝缘磷脂双分子层和膜蛋白镶嵌附着构成,而呈现电容的特性,细胞质被认为具有电阻的特性,所以细胞在流动压缩通道中的模型由电容cm和电阻r
cy
组成;同时由于细胞与通道之间存在一定的间隙,所以等效出一个漏电阻r
l
;电极之间的阻抗值去除细胞填充部分的电阻由rc′
表示,即r
c-ratio
·
rc,其中比例系数ratio可通过comsol有限元仿真得到,同
时仍与沟道寄生电容cc并联。此时检测阻抗z,其中为细胞膜电容的阻抗:
[0063][0064]
联立公式4和公式5,代入两个频率下的阻抗幅值(amp1和amp2)和相位(pha1和pha2)数据,如图6,即可求得细胞质电阻r
cy
和细胞膜电容cm。进而求得细胞质电导率σ
cp
和细胞膜比电容c
sm
:
[0065][0066]
针对阻抗检测,已有公开专利只得到了细胞直径信号,而本发明除此之外,还得到了细胞膜比电容和细胞质电导率的实现方法。
[0067]
针对荧光检测,已有公开专利利用光电倍增管将荧光信号转换为电信号以获取细胞核的等效直径信息,而本发明采用荧光成像的方法将细胞核的形态轮廓展现出来,以便更准确方便地表征细胞核的结构特征。
[0068]
至此,已经结合附图对本实施例进行了详细描述。依据以上描述,本领域技术人员应当对本发明中一种基于阻抗信号及荧光成像的细胞电学和结构特征检测装置及方法有了清楚的认识。
[0069]
本实施例中,衬底采用石英玻璃材料,本领域技术人员应当清楚,除了石英玻璃之外,衬底可以为普通玻璃、聚甲基丙烯酸甲酯(polymethyl methacrylate,简称pmma,又称作压克力、亚克力,英文acrylic,或有机玻璃)或聚二甲基硅氧烷(polydimethylsiloxane,简称pdms)片等透明材料。
[0070]
本实施例中,承载体的材料为pdms。本领域技术人员应当清楚,除了pdms之外,还可以采用玻璃、su-8、硅片等材料来形成上述承载体。
[0071]
该发明中所演示的微流控芯片结构是这种方法的基础单元,可以方便地进行细胞穿行方向上的并联和串联排布,甚至某些结构的合并,会带来不同的效果。
[0072]
该发明中微流控芯片中的通道横截面为矩形,也可以被替换成圆形或者半圆形等形状,不影响基础功能的实现。
[0073]
该发明中使用盖板加基板封接的形式形成通道,也可以在玻璃等材料内部刻蚀实现,同样可以实现需要的功能。
[0074]
该发明中使用负压驱动细胞溶液通过通道,但是也可以使用其他方式,如在细胞溶液入口通道端施加正压。
[0075]
尽管上面对本发明说明性的具体实施方式进行了描述,以便于本技术领域的技术人员理解本发明,且应该清楚,本发明不限于具体实施方式的范围,对本技术领域的普通技术人员来讲,只要各种变化在所附的权利要求限定和确定的本发明的精神和范围内,这些变化是显而易见的,一切利用本发明构思的发明创造均在保护之列。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。