1.本发明涉及医学检测技术领域,更具体地说,本发明涉及多种血清肿瘤标志物联合用于胰腺癌特异性早期诊断及疗效监测检测应用。
背景技术:
2.胰腺癌是一种早期难发现、预后差、发病率接近死亡率的恶性肿瘤。在中国,胰腺癌患者的5年生存率从2003年的11.7%逐渐下降为2015年的7.2%,为所有癌症中最低。胰腺癌在美国和欧洲的高致死率癌症中排第四位,5年总生存率也仅为9.3%,预计到2030年将升至第二位。临床上胰腺癌主要是物理诊断方法,包括超声检查、磁共振成像、内窥镜超声检查,虽然具有较高的胰腺癌诊断效率,但是有超过80%的胰腺癌患者在确诊时已是癌症晚期,失去了手术切除治疗机会。如何提高胰腺癌早期诊断的准确性、降低诊断难度,是目前提高胰腺癌患者生存率所面临的重大问题。
3.通过对胰腺癌患者血清学指标检测,寻找新的有效的生物标志物或生物标志物组合,提升对胰腺癌早期诊断的敏感性、特异性,是提高胰腺癌患者存率的有效途径。传统肿瘤标志物ca19-9是美国食品药品监督管理局唯一批准用于胰腺癌诊断的生物标志物,但是ca19-9的特异性较差,在慢性胰腺炎、梗阴性黄疸和其他癌症中均有上升。特别是在lewis阴性表型患者中无法实现ca19-9检测。传统cea肿瘤标志物为非器官特异性指标,在其他肿瘤患者中均有升高。近年来时常有科学文献报道检测mmp-11、mic-1、opn、reg4、gpc-1、lamc2等生物学指标血清水平对胰腺癌诊断、分期分型、治疗监测以及预后判定等方面的研究,同时也报道了各个指标在胰腺诊断方面存在的缺陷与不足。
技术实现要素:
4.为了克服现有技术的上述缺陷,本发明的实施例提供多种血清肿瘤标志物联合用于胰腺癌特异性早期诊断及疗效监测检测应用,通过利用患者血清学生物学指标联合检测,实现胰腺癌早期诊断(例如:病理分期为ⅰ期或ⅱ期),胰腺癌与慢性胰腺炎或胰腺良性肿瘤占位鉴别辅助诊断,胰腺癌手术切除后化疗后监床监测与预后评价等方面提出一系优选多指标组合,以提高检测敏感性、特异性、准确性,让患者获得最大的临床受益,以解决上述背景技术中提出的问题。
5.为实现上述目的,本发明提供如下技术方案:多种血清肿瘤标志物联合用于胰腺癌特异性早期诊断及疗效监测检测应用,其特征在于:基质金属蛋白酶ⅱ(mmpⅱ)、巨噬细胞抑制因子-1(mic-1)、胰腺再生蛋白ⅳ(reg4)、层粘连蛋白γ2(lamc2)、骨桥蛋白(opn)、磷脂酰肌醇蛋白聚糖1(gpc-1)、糖类抗原19-9(ca19-9)和癌胚抗原(cea)中的优选组合作为检测对象,用于制备胰腺癌早期辅助诊断和/或疗效监测和/或预后评价检测试剂盒。
6.在一个优选地实施方式中,所述优选组合包括:
7.优选组合1:mmp-ii、lamc2、mic-1、reg4、ca19-9;
8.优选组合2:ca19-9、mmp-ii、mic-1、gpc-1、opn;
9.优选组合3:gpc-1、mic-1、reg4、lamc2、opn;
10.优选组合4:ca19-9、reg4、mic-1、opn;
11.优选组合5:cea、reg4、mmp
‑ⅱ
、gpc-1。
12.在一个优选地实施方式中,所述的检测试剂检测胰腺癌患者血清和/或血浆样本。
13.在一个优选地实施方式中,所述优选组合的蛋白表达量,用于临床医学检测中胰腺癌早期辅助诊断和/或疗效监测和/或预后评价。
14.在一个优选地实施方式中,所述的试剂盒包含:
15.r1试剂:含有异硫氰酸荧光素(fitc)标记的抗mmpⅱ抗体或抗mic-1抗体或抗reg4抗体或抗lamc2抗体或抗opn抗体或抗gpc-1抗体或抗ca19-9抗体或抗cea抗体溶液,如权利要求2所述的优选组合;和/或
16.r2试剂:含有碱性磷酸酶(alp)标记的抗mmpⅱ抗体或抗mic-1抗体或抗reg4抗体或抗lamc2抗体或抗opn抗体或抗gpc-1抗体或抗ca19-9抗体或抗cea抗体溶液,如权利要求2所述的优选组合;和/或
17.m试剂:含有包被有抗fitc抗体的磁性微粒溶液;和/或
18.校准品(std):含一定浓度mmpⅱ抗原或mic-1抗原或reg4抗原或lamc2抗原或opn抗原或gpc-1抗原或ca19-9抗原或cea抗原的溶液或冻干品,如权利要求2所述的优选组合;和/或
19.质控品(qc):某一个和/或二个浓度mmpⅱ抗原或mic-1抗原或reg4抗原或lamc2抗原或opn抗原或gpc-1抗原或ca19-9抗原或cea抗原的溶液或冻干品,如权利要求2所述的优选组合。
20.在一个优选地实施方式中,所述的试剂盒采用全自动和/或半自动磁微粒化学发光免疫分析法对胰腺癌患者血清和/或血浆样本进行检测。
21.本发明的技术效果和优点:利用主要文献报道和临床上已有证验的与胰腺癌辅助诊断、疗效监测、预后评价等相关的血清学生物标志物ca19-9、mmp-ii、lamc2、mic-1、reg4、cea、gpc-1、opn,对与胰腺癌相关的不同疾病人群进行分组检测分析,优选出最佳多指标组合,再对优选出最佳多指标组合进行产品制备工艺研发,研发出适用胰腺癌早期诊断、临床辅助诊断、鉴别诊断以及疗效与预后评价的临床检测试剂盒。利用不同组合试剂盒,针对不同胰腺癌患者预期用途进行检测,确保让患者获得最大临床受益。
附图说明
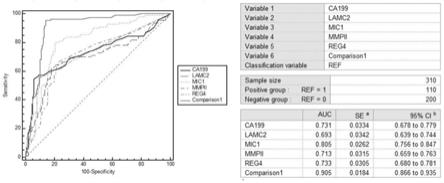
22.图1为本发明的优选组合1在胰腺癌病理分期为ⅰ期或ⅱ期人群中早期诊断的检测效率roc曲线图。
23.图2为本发明的优选组合2在胰腺癌与健康、其他良性疾病人群中辅助诊断的检测效率roc曲线图。
24.图3为本发明的优选组合3在胰腺癌、慢性胰腺炎、胰腺良性肿瘤占位人群鉴别诊断的检测效率roc曲线图。
25.图4为本发明的优选组合5在lewis阴性基因型胰腺癌与健康人群中辅助诊断的检测效率roc曲线图。
26.图5为本发明的实施例4检测结果图。
具体实施方式
27.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
28.[0029][0030]
提供以下5种优选组合,以适用胰腺癌5种不同人群的临床检测:
[0031]
优选组合1:mmp-ii、lamc2、mic-1、reg4、ca19-9,适用于胰腺癌病理分期为ⅰ期或ⅱ期人群的早期诊断;
[0032]
优选组合2:ca19-9、mmp-ii、mic-1、gpc-1、opn,适用于胰腺癌临床辅助诊断;
[0033]
优选组合3:gpc-1、mic-1、reg4、lamc2、opn,适用于胰腺癌、慢性胰腺炎、胰腺良性肿瘤占位人群的胰腺癌鉴别诊断;
[0034]
优选组合4:ca19-9、reg4、mic-1、opn,适用于胰腺癌十二指肠胰头手术切除后辅助化疗的疗效监测与预后评价;
[0035]
优选组合5:cea、reg4、mmp
‑ⅱ
、gpc-1,适用于lewis阴性基因型胰腺癌辅助诊断。
[0036]
供了5种优选组合研制开发5个不同检测试剂盒方法,包括:
[0037]
1、选择磁微粒化学发光免疫分析法;
[0038]
2、不同指标的一抗、二抗、抗原的浓度范围,以及质控品浓度范围;
[0039]
3、不同指标的cutoff值,线性范围
[0040]
实施例1:制备本发明的试剂盒
[0041]
本发明试剂盒主要组成成份及制备:
[0042]
r1试剂:
[0043]
异硫氰酸荧光素(fitc)标记的抗mmp
‑ⅱ
抗体,抗体浓度范围0.5~2.5μg/ml,牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)。
[0044]
异硫氰酸荧光素(fitc)标记的抗mic-1抗体,抗体浓度范围0.2~1.2μg/ml,牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)。
[0045]
异硫氰酸荧光素(fitc)标记的抗reg4抗体,抗体浓度范围0.2~1.2μg/ml,牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)。
[0046]
异硫氰酸荧光素(fitc)标记的抗lamc2抗体,抗体浓度范围0.5~1.5μg/ml,牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)1)异硫氰酸荧光素(fitc)标记的抗opn抗体,抗体浓度范围0.5~2.5μg/ml,牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)。
[0047]
异硫氰酸荧光素(fitc)标记的抗gpc-1抗体,抗体浓度范围0.5~1.5μg/ml,牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)。
[0048]
异硫氰酸荧光素(fitc)标记的抗ca19-9抗体,抗体浓度范围0.5~1.5μg/ml,牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)。
[0049]
异硫氰酸荧光素(fitc)标记的抗cea抗体溶液,抗体浓度范围0.2~1.2μg/ml,牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)。
[0050]
以上述试剂按组如下五种优选组合,等体系混合而成对应浓度溶液:
[0051]
优选组合1:mmp-ii、lamc2、mic-1、reg4、ca19-9;
[0052]
优选组合2:ca19-9、mmp-ii、mic-1、gpc-1、opn;
[0053]
优选组合3:gpc-1、mic-1、reg4、lamc2、opn;
[0054]
优选组合4:ca19-9、reg4、mic-1、opn;
[0055]
优选组合5:cea、reg4、mmp
‑ⅱ
、gpc-1。
[0056]
r2试剂:
[0057]
碱性磷酸酶(alp)标记的抗mmp
‑ⅱ
抗体,抗体浓度范围0.5~1.5μg/ml,牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)。
[0058]
碱性磷酸酶(alp)标记的抗mic-1抗体,抗体浓度范围0.2~0.8μg/ml,牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)。
[0059]
碱性磷酸酶(alp)标记的抗reg4抗体,抗体浓度范围0.2~0.8μg/ml,牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)。
[0060]
碱性磷酸酶(alp)标记的抗lamc2抗体,抗体浓度范围0.5~1.5μg/ml,牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)。
[0061]
碱性磷酸酶(alp)标记的抗opn抗体,抗体浓度范围0.5~1.5μg/ml,牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)。
[0062]
碱性磷酸酶(alp)标记的抗gpc-1抗体,抗体浓度范围0.5~1.5μg/ml,牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)。
[0063]
碱性磷酸酶(alp)标记的抗ca19-9抗体,抗体浓度范围0.5~1.5μg/ml,牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)。
[0064]
碱性磷酸酶(alp)标记的抗cea抗体溶液,抗体浓度范围0.2~0.8μg牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)。
[0065]
以上述试剂按组如下五种优选组合,等体系混合而成对应浓度溶液:
[0066]
优选组合1:mmp-ii、lamc2、mic-1、reg4、ca19-9;
[0067]
优选组合2:ca19-9、mmp-ii、mic-1、gpc-1、opn;
[0068]
优选组合3:gpc-1、mic-1、reg4、lamc2、opn;
[0069]
优选组合4:ca19-9、reg4、mic-1、opn;
[0070]
优选组合5:cea、reg4、mmp
‑ⅱ
、gpc-1。
[0071]
校准品(std):
[0072]
一定浓度mmp
‑ⅱ
抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),定值范围分别为0.00、0.80~0.90、2.40~2.80、7.00~8.00、20.00~25.00和60.00~80.00u/ml;
[0073]
一定浓度mic-1抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),定值范围分别为0.00、35.00~40.00、110.00~120.00、340.00~360.00、1000.00~1150.00和3000.00~3500.00u/ml;
[0074]
一定浓度reg4抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),定值范围分别为0.00、0.80~0.90、2.40~2.80、7.00~8.00、20.00~25.00和60.00~80.00u/ml;
[0075]
一定浓度lamc2抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),定值范围分别为0.00、7.00~15.00、30.00~45.00、80.00~120.00、240.00~360.00和900.00~1100.00u/ml;
[0076]
一定浓度opn抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),定值范围分别为0.00、7.00~9.00、22.00~27.00、65.00~80.00、200.00~240.00和600.00~720.00u/ml;
[0077]
一定浓度gpc-1抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),定值范围分别为0.00、7.00~9.00、22.00~27.00、65.00~80.00、200.00~240.00和600.00~720.00u/ml;
[0078]
一定浓度ca19-9抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),定值范围分别为0.00、7.00~15.00、30.00~45.00、80.00~120.00、240.00~360.00和900.00~1100.00u/ml;
[0079]
一定浓度cea抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),定值范围分别为0.00、0.80~0.90、2.40~2.80、7.00~8.00、20.00~25.00和60.00~80.00u/ml;
[0080]
以上述试剂按组如下五种优选组合,等体系混合而成对应浓度溶液或冻干品:
[0081]
优选组合1:mmp-ii、lamc2、mic-1、reg4、ca19-9;
[0082]
优选组合2:ca19-9、mmp-ii、mic-1、gpc-1、opn;
[0083]
优选组合3:gpc-1、mic-1、reg4、lamc2、opn;
[0084]
优选组合4:ca19-9、reg4、mic-1、opn;
[0085]
优选组合5:cea、reg4、mmp
‑ⅱ
、gpc-1;
[0086]
质控品(qc):
[0087]
一定浓度mmp
‑ⅱ
抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),质控的定值范围为5.60~20.40u/ml和21.00~39.00u/ml;
[0088]
一定浓度mic-1抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),质控的定值范围为700.00~1300.00u/ml和1400.00~2600.00u/ml;
[0089]
一定浓度reg4抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),质控的定值范围为5.60~20.40u/ml和21.00~39.00u/ml;
[0090]
一定浓度lamc2抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),质控的定值范围为20.00~40.00u/ml和350.00~750.00u/ml
[0091]
一定浓度opn抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),质控的定值范围为20.00~30.00u/ml和300.00~450.00u/ml;
[0092]
一定浓度gpc-1抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),质控的定值范围为20.00~30.00u/ml和300.00~450.00u/ml;
[0093]
一定浓度ca19-9抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),质控的定值范围为20.00~40.00u/ml和350.00~750.00u/ml;
[0094]
一定浓度cea抗原的tris缓冲液(浓度0.05mol/l,ph=8.0),质控的定值范围为5.60~20.40u/ml和21.00~39.00u/ml。
[0095]
以上述试剂按组如下五种优选组合,等体系混合而成对应浓度溶液或冻干品:
[0096]
优选组合1:mmp-ii、lamc2、mic-1、reg4、ca19-9;
[0097]
优选组合2:ca19-9、mmp-ii、mic-1、gpc-1、opn;
[0098]
优选组合3:gpc-1、mic-1、reg4、lamc2、opn;
[0099]
优选组合4:ca19-9、reg4、mic-1、opn;
[0100]
优选组合5:cea、reg4、mmp
‑ⅱ
、gpc-1;
[0101]
m试剂(磁微粒溶液):
[0102]
含有包被有抗fitc抗体的磁性微粒(浓度0.5mg/ml,磁微粒大小10a~40a)、牛血清白蛋白和防腐剂的tris缓冲液(浓度0.1mol/l,ph=8.0)
[0103]
实施例2:实施例1试剂盒的检测方法
[0104]
本专利试剂盒采用磁微粒化学发光免疫分析法,适用于全自动磁微粒化学发光分析仪。检测原理为将待测样本、试剂1(r1)、试剂2(r2)混合温育,r1中的异硫氰酸荧光素(fitc)和r2中的碱性磷酸酶(alp)标记的一对抗生物指标单克隆抗体与样本中生物指标抗原分子特异性结合,形成免疫复合物。该免疫复合物和磁分离试剂(m)混合温育,免疫复合物进一步被偶联在磁微粒表面的抗fitc抗体捕获,吸附到磁微粒表面。洗涤,去除未结合的抗体和杂质后加入发光底物,alp催化底物发光,测定相对发光强度(rlu)。在一定范围内rlu与抗原浓度呈正比,通过内插法就可以从标准曲线上读取待测样本中的生物指标含量。
[0105]
具体实验步骤如下:
[0106]
吸取待测物与r1试剂、r2试剂混合,r1中的异硫氰酸荧光素(fitc)和r2中的碱性
磷酸酶标记(alp)标记的一对抗体与样本中的抗原分子特异性结合,形成免疫复合物;
[0107]
上述免疫复合物与包被有抗fitc抗体的磁性微粒混合,温育,免疫复合物进一步被偶联在磁微粒表面的抗fitc抗体捕获,吸附到磁微粒表面;
[0108]
将混合物置于磁场中,洗涤,去除未结合的抗体和杂质;
[0109]
在洗涤后的磁微粒中加入发光底物,碱性磷酸酶(alp)催化底物发光,测定相对发光强度(rlu);
[0110]
校准品(std)各点浓度靶值及对应发光强度(rlu)通过四参数拟合方法:y=a (b-a)/(1 (c/x)^d)拟合出一条标准曲线;
[0111]
质控品(qc)测得发光强度(rlu)通过上述标准曲线回算浓度在靶值范围内且仪器提示曲线拟合成功,则该标准曲线可保存使用;
[0112]
样本测定相对发光强度(rlu)通过拟合的标准曲线回算出各样本中被测物浓度。
[0113]
实施例3:本发明的试剂盒对健康人群、慢性胰腺炎相关疾病、胰腺癌、消化道其他恶性肿瘤患者外周血的血清样本进行检测时,试剂盒性能指标敏感性、特异性及roc曲线分析样本。
[0114]
本专利入组临床样本来自源于中国医学科院肿瘤医院、河南省人民医院、青岛市市立医院等医院住院或门诊患者的临床检验后的剩余留存血清样,样本积体200ul~500ul,样本-80℃w保存时间2~3年。每份样本的病例信息完整、清晰,具有可追溯性。样本人群分布信息如下表:
[0115][0116]
胰腺癌早期诊断中多指标联合检测优选组合:
[0117]
胰腺癌目前最有效地治疗仍是手术切除,然而,就目前临床医学检验能力而言只有一部分胰腺癌病人可以进行手术切除治疗,因而胰腺癌的早期诊断临床意义尤为重要。本发明通过对胰腺癌临床病理分期为ⅰ期或ⅱ期的血清样本,以及正常人群血清样本,联合并行检测多种胰腺癌相关肿瘤标志物,优选出了一个最高效的多指标组合。检测方法如实施例1和实施例2所示,检测结果如下表:
[0118][0119]
各指标及多指标组合的检测效率结果如下表:
[0120]
[0121][0122]
优选组合1:mmp-ii、lamc2、mic-1、reg4、ca19-9,在胰腺癌早期人群组临床检测中大大提升了敏感性、准确性等性能,相比于单指标或其他指标组合具有显著检测效率。
[0123]
胰腺癌临床辅助检测中多指标联合检测优选组合:
[0124]
临床上胰腺癌主要是物理诊断方法,包括超声检查、磁共振成像、内窥镜超声检查,由于胰腺所处的生理位置较为隐蔽,物理诊断方法常常会受到包括操作者的经验、患者的肥胖程度和肠道内的气体等诸多因素影响。随着近年来生物信息学、蛋白质组学以及磁微粒化学发光免疫分析技术、高分辩质谱技术等发展,为通过生物标志物对胰腺癌患者进行血清学检测进行临床辅助诊断逐渐重新又受重视。本发明通过对临床上收集较为大量的胰腺癌的血清样本,以及正常人群血清样本,其他良性疾病人群血清样本,联合并行检测多种胰腺癌相关肿瘤标志物,优选出了一个最高效的多指标组合。检测方法如实施例1和实施
例2所示,检测结果如下表:
[0125][0126]
各指标及多指标组合的检测效率结果如下表:
[0127][0128][0129]
优选组合2:ca19-9、mmp-ii、mic-1、gpc-1、opn,在胰腺癌人群组临床辅助检测中提升敏感性、准确性等性能,相比于单指标或其他指标组合的检测效率具有显著性差异。
[0130]
胰腺癌与慢性胰腺炎、胰腺良性肿瘤占位人群检测中多指标联合检测优选组合。
[0131]
由于胰腺癌具有起病隐匿,恶性程度高,预后差,生存率低等特点,其临床表现缺乏特征性,患者平均生存期仅为2~3个月。传统肿瘤标志物ca19-9、cea等虽然在胰腺癌临床辅助诊断中有一定价值,但由于其特异性、敏感性不足,在慢性胰腺炎或胰腺良性肿瘤占位以及其他消化道癌症中均有比较高的阳性检出率。在胰腺癌血清学临床检测中寻找更为敏感性、特异性的生物学指标成为当前研究重点与热点,在越来越多的文献中报道了例如mic-1、mmp
‑ⅱ
、gpc-1等生物指标在胰腺癌特异性诊断临床价值以及各自的缺陷性。本发明通过对临床上收集较为大量的胰腺癌、慢性胰腺炎、胰腺良性肿瘤占位等患者的血清样本,联合并行检测多种胰腺癌相关肿瘤标志物,优选出了一个最高效的多指标组合。检测方法如实施例1和实施例2所示,检测结果如下表:
[0132][0133][0134]
各指标及多指标组合的检测效率结果如下表:
[0135][0136][0137]
优选组合3:gpc-1、mic-1、reg4、lamc2、opn,在胰腺癌、慢性胰腺炎、胰腺良性肿瘤占位临床辅助检测中提升敏感性、准确性等性能,相比于单指标或其他指标组合的检测效率具有显著性差异。
[0138]
lewis阴性基因型胰腺癌临床辅助检测中多指标联合检测优选组合:
[0139]
传统肿瘤标志物ca19-9是美国食品药品监督管理局唯一批准用于胰腺癌诊断、疗效评价等临床检测的生物标志物。糖类抗原19-9是一种肿瘤相关抗原,需要存在唾液酸化lewis(le)a血型抗原才能表达,在lewis阴性的个体无法合成ca19-9抗原,因而lewis阴性基因型的胰腺癌患者的ca19-9指标检测结果呈阴性。在不同人种人群中,lewis阴性基因型人群占比达到10%~15%,对于lewis阴性基因型胰腺癌患者需要采用其他生物标志物进行诊断或评价。本发明通过对临床上收集较为lewis阴性基因型胰腺癌的血清样本以及正常人群血清样本,联合并行检测多种胰腺癌相关肿瘤标志物,优选出了一个最高效的多指标组合。检测方法如实施例1和实施例2所示,检测结果如下表:
[0140][0141][0142]
各指标及多指标组合的检测效率结果如下表:
[0143][0144][0145]
优选组合5:cea、reg4、mmp
‑ⅱ
、gpc-1,在lewis阴性基因型胰腺癌人群组临床辅助检测中提升敏感性、准确性等性能,相比于单指标或其他指标组合的检测效率具有显著性差异。
[0146]
实施例4:本发明的试剂盒对胰腺癌患者治疗监测与预后评价时,试剂盒性能指标敏感性、特异性及roc曲线分析。
[0147]
胰腺癌是一种恶性程度很高,具有病程短、病情发展快等特点,临床常表现有腹痛、黄疸、呕吐等症状。早期胰腺癌(例如,胰腺癌病理分期ⅰ期或ⅱ期)采用胰头十二指肠切除手术是根治胰腺癌,提高患者生存率的有效治疗手段。临床治疗时对胰腺癌胰头十二指
肠手术切除后患者常规应用吉西他滨或替吉奥等化疗药物进行辅助化疗,然而不同患者对于辅助化疗获得临床治疗受益也显著不同。选用合适的血清学生物指标评价胰腺癌手术切除后辅助化疗的疗效监测与预后评价具有非常显著临床意义。本发明通过对胰腺癌病理分期ⅰ期或ⅱ期患者手术切除化疗前、化疗后、治疗1周、4周、10周等不同时间段的血清样本进行多指标检测,并根据临床护理学分册中规定qlq-c30应用及计分方法对患者不同时间段的生活质量指标进行统计分析评价。同时根据临床随访12个月将检测结果分为生存组和死亡组,对比各指标平均水平差异。优选出了一组用于胰腺癌手术切除后辅助化疗时疗效监测与预后评价的血清学生物指标组合。检测方法如实施例1和实施例2所示,检测结果如下图5。
[0148]
优选组合4:ca19-9、reg4、mic-1、opn指标有检测浓度水平在化疗前后均有显著性变化,并且在胰腺癌病理分期ⅰ期或ⅱ期手术切除后化疗辅助中12个月内生存组与死亡组中这些指标检测浓度水平也存在显著性差异。别外其他几个指标的检测浓度水平不随治疗周期进展表现出显著性变化,或者在生存组或死亡组中不存在显著性浓度差异。
[0149]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解的是,在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种等效的变化、修改、替换和变型,本发明的范围由所附权利要求及其等同范围限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
