1.本发明涉及环境生态监测领域,具体为一种基于人体条件致病菌的室内微生态环境宜居性检测方法。
背景技术:
2.现代社会的日常生活中,人们大约有三分之二的时间处于相对封闭的室内环境下,往往重复着:家庭-交通工具-办公室三点一线的生活,也意味着人们所接触的外界微生物多来自于室内环境。其中如交通枢纽、商场、农贸市场、医院、学校等公共场所人员密集,空气微生物更加复杂,室内空气中的微生物通过沉降至食物、与人体皮肤接触或和直接被吸入等多种方式与人体产生联系交互,影响人体微生物,进而也对人体健康有深远的影响。随着各种高通量组学手段的进步,对环境菌群、人体共生菌群角色的重新认识是近年来最重要的生物学发现之一:比如研究证明过于清洁的环境可能会增加儿童哮喘的患病率;共生菌群的紊乱与神经系统疾病、精神疾病、呼吸系统疾病、心血管系统疾病、胃肠道疾病、肝病、自身免疫病、代谢性疾病和癌症等有关;以及传染性病原带来的高致病风险。因此开展室内的微生态环境评价对于人体及环境微生态健康至关重要。
3.而培养法作为当前室内微生态环境的检测和评价的“金标准”,可培养检出的细菌仅占环境菌群的10%以下,可见该方法检测有局限性,且耗时长,进而需要一种于室内菌群环境中的条件致病菌含量及其多样性来检测/评价室内微生态环境的宜居程度的方法。
技术实现要素:
4.本发明目的在于提供一种基于人体条件致病菌的室内微生态环境宜居性检测方法。
5.为实现上述目的,本发明采用技术方案为:
6.一种基于人体条件致病菌的公共场所室内微生态环境宜居性检测方法,包括采集模块(1),检测模块(2)和计算模块(3)三个部分;
7.所述样品采集模块(1),收集待检测环境的菌群样品,并提取其dna;
8.所述检测模块(2),以采集模块(1)所提供的样品dna为原料,进行高通量测序完成菌群检测;
9.所述计算模块(3),利用检测模块(2)所获得的样品测序数据利用生物信息学手段对样品的菌群结构进行分析计算,得到室内微生态环境指数mibe,以此判断当前室内环境是否处存在致病风险,进而对待检测室内微生态环境的宜居性进行判断。
10.三个模块协同工作实现了对室内微生态环境的宜居性检测。
11.上述检测方法,所述的收集待测环境菌群样品,是指利用特殊材料和设计的取样拭子,在16cm2及以上的室内表面范围内,蘸取缓冲液反复摩擦50次,获取环境菌群。取样拭子的头部由纤维材料制成,不易损伤室内表面,且细菌易于洗脱。具体操作流程详见实施实例1。
12.所述的提取dna,是指一种优化的环境微生物dna提取方法,具体操作流程详见实施实例2。
13.所述高通量测序为对对收集的样品进行扩增子测序,扩增区域为16s rdna的保守区域(v1-v3区),引物为27f:5'-agagtttgatcctggctcag-3';534r:5'-attaccgcggctgctgg-3'。
14.所述获得的样品测序数据以greengenes的16s rrna全长序列数据库为依据,使用qiime、trimmomatic、flash、fastx toolkit和parallel-meta3中的一种或几种软件,对样品中所含细菌分类,进化分类中的菌属一层进行结构还原,最终获得样品中所含细菌的各个相对丰度值。
15.利用分析样品的菌群结构数据,利用公式计算获得mibe值
[0016][0017]
其中,n:待检测空间微生物群落中对人体健康有影响的细菌数量;p:微生物群落中与人类健康有关(致病菌)的i细菌的相对丰度;m:一个给定的微生物群落中的所有细菌的数量;x:i细菌的相对丰度;i为样品中某一种菌。
[0018]
所述的室内微生态环境指数mibe(microbial index of built environment),是指任何样品经过计算之后都会得到一个基于条件致病菌含量的累计值(accumulate abundance)和香浓值(shannon index)以及辛普森值(simpson index),三者综合考虑,计算即为微生态环境指数mibe,该指标包括了条件致病菌总相对含量和相关疾病风险两个层面的描述信息。
[0019]
所述的mibe中,致病菌相对含量的累计值越高(取值范围0-1之间),香浓和辛普森指数越低,该样品所代表的微生态环境指数越低;而致病菌相对含量的累计值越低,香浓和辛普森指数越高,该样品所代表的微生态环境指数越高。
[0020]
所述当mibe超过0.15时,mibe越高且微生物多样性指数越低,环境宜居性越差。
[0021]
所述待检测环境可为交通枢纽、医院、学校、体育场馆、商贸市场等公共场所。
[0022]
本发明所具有的优点:
[0023]
本发明检测方法可适用于公共场所室内环境菌群(空气或表面)中条件致病菌及其多样性的检测方法,利用此方法还可以提示人体患病风险。该方法通过对菌群结构的检测,经过生物信息分析和模型打分,实现对室内微生态宜居程度的快速判断。该方法的建立将为公共场所室内环境检测提供新的工具。
[0024]
本发明以菌群的结构和条件致病菌含量为判断指标,进而构建室内微生态环境宜居性检测方法,该方法为生物、医疗和卫生等领域的微生态研究提供全新的、客观的定量化研究方法。利用此方法可以诊断室内环境的致病菌存在状态,预警相关人体疾病的风险,还可以提示室内环境的宜居性和清洁策略等。本发明属于生物技术和医疗健康领域,可为公共场所室内环境(如机场、车站、医院等)检测提供指导。
附图说明:
[0025]
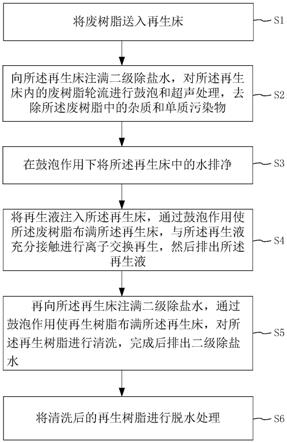
图1为本发明是实例提供的检测流程图。
[0026]
图2为利用本发明方法检测某机场环境样品中mibe指数比较。
具体实施方式:
[0027]
以下结合实例对本发明的具体实施方式做进一步说明,应当指出的是,此处所描述的具体实施方式只是为了说明和解释本发明,并不局限于本发明。
[0028]
本发明方法基于室内菌群环境中的条件致病菌含量及其多样性来评价室内微生态环境的宜居程度,该方法通过对环境菌群结构的检测和分析,评估人体条件致病菌的含量及其多样性,通过量化手段为室内微生态环境的宜居性提供检测指标,预警人体患病风险,并为室内感染管控、清洁策略提供参考。该方法操作简单、对样品无需过多预处理,检测灵敏、快速,整个处理及检测过程可在几小时以内完成,克服了传统方法不客观不灵敏的问题。该方法的建立将为日常室内环境检测和治理提供新的工具。
[0029]
实施例1:环境菌群样品采集
[0030]
1.确定用拭子采集样品过程中的指定取样位置(对于部分干净的环境样品,要≥25cm2),用标尺/模板标记16cm 2
的区域。
[0031]
2.对所有收集管进行标记。
[0032]
3.戴上橡胶手套,将一次性拭子从包装中取出,注意拭子表面不要接触其他。
[0033]
4.将拭子头部浸入到0.01mol/l nacl、0.1%tween20的混合溶液中,然后将拭子按到管内,以除去多余的液体。
[0034]
5.将拭子分别沿水平和垂直方向上在标记区域涂抹(共50次,约30-35s),进行采样。
[0035]
6.剪去拭子头,放入已标记的、2ml空管中,并将管盖盖紧。
[0036]
7.将样品放置在冰盒中,后转移至-80℃冰箱中保存。
[0037]
实施例2:提取样品的dna,进行高通量测序
[0038]
1.吸取350μl pbs溶液,加入到上述含有样品的2ml离心管中。
[0039]
2.加入350μl al缓冲液,40μl溶菌酶(10mg/ml),6μl变溶菌素(25000u),300mg玻璃微珠。充分混匀,将样品置于37℃温育1h。
[0040]
3.将离心管转移至组织研磨机中(qiagen)处理3min,条件为26hz,
[0041]
4.加入20μl蛋白酶k(qiagen试剂盒提供)至管中,振荡混匀。
[0042]
5. 56℃温育3h。
[0043]
6.将上清液转移到新管中,丢弃拭子。用ddh2o洗涤珠子2次,每次200μl。
[0044]
7.加入1/2体积的酒精,充分混匀。
[0045]
8.将dneasy离心层析柱下置2ml收集管(试剂盒提供),吸取步骤7中的混合物至离心柱,8000rpm/min离心1min,丢弃废液和收集管。
[0046]
9.将dneasy离心层析柱下置新的2ml离心管(试剂盒提供),加入500μl aw1缓冲液,8000rpm/min离心1min,丢弃废液和收集管。
[0047]
10.将dneasy离心层析柱下置新的2ml离心管(试剂盒提供),加入500μl aw2缓冲液,14000rpm/min离心3min,干燥dneasy隔膜,丢弃废液和收集管。
[0048]
11.将dneasy离心层析柱下置新的1.5ml或2ml离心管(自备),37℃静置2min,吸取50μl ae缓冲液垂直悬空加在dneasy隔膜上。37℃温育3min,14000rpm离心2min,洗脱至
ddh2o水中,即得到dna样品,待用。
[0049]
12.将上述样品中获取的各dna样品使用16s rrna扩增子测序方法鉴定群落结构,测序区域为v1-v3区,扩增区域为16s rdna v1-v3区,引物为27f:5'-agagtttgatcctggctcag-3';534r:5'-attaccgcggctgctgg-3';并利用测序平台为illumina miseq 250/300,获知样品中各dna样品的序列。
[0050]
实施例3:利用生物信息学解析群落结构
[0051]
对于下机数据以greengenes的16s rrna全长序列数据库为依据,使用软件,对样品中所含细菌分类,进化分类中的菌属一层进行结构还原,最终获得样品中所含细菌的各个相对丰度值;进一步的说使用qiime软件(quantitative insights into microbial ecology,对原始数据的编码序列(barcode)进行拆分,使用trimmomatic软件进行首次质量控制(参数设置为trimmomatic:slidingwindow:30:25minlen:25),使用flash软件进行两端序列数据的融合(参数设置为flash:-m 200
ꢀ-
m 5
ꢀ-
x 0.1),然后使用fastx toolkit软件进行二次质量控制(参数设置为fastx toolkit:-q 33
ꢀ-
q 25
ꢀ-
p 80)。最后再次使用qiime软件进行嵌合体(chimera)去除,最终形成clean reads,并进一步使用parallel-meta 3软件进行下游的otu picking,再通过公式计算获得mibe值。
[0052]
公式计算mibe:
[0053][0054]
其中,n:室内空间微生物群落中对人体健康有影响的细菌数量;p:微生物群落中与人类健康有关(致病菌)的i细菌的相对丰度;m:一个给定的微生物群落中的所有细菌的数量;x:i细菌的相对丰度。i为样品中某一种菌。
[0055]
所述当mibe超过0.15时,mibe越高且微生物多样性指数越低,环境宜居性越差。揭示有可能存在致病风险,应当及时注意清理。实施例4:利用mibe方法评价公共场所室内微生态指数以某机场候机厅环境样品为例,按照实施例1方法获得3份样品,利用实施例2高通量检测样品中所含dna样品的16s rdna保守区域序列,而后通过数据库对照获知平均每样品含有6145种菌种(以out计),其中含有潜在病原645种。而后按照实施例3记载利用软件分析对比获知所含细菌分类,进化分类中的菌属一层进行结构还原,最终获得样品中所含细菌的各个相对丰度值,进而获得优势潜在病原的相对丰度为acinetobacter lwoffii(0.253841),acinetobacter baumannii(0.0539343),pseudomonas aeruginosa(0.0102349),staphylococcus epidermidis(0.00819464),actinomyces naeslundii(0.00657315),而后通过公式计算各样品平均mibe为0.37。进而可知该环境微生态指数较高,存在一定致病风险,加之与旅客接触频繁,需要着重定时清理。而后按照上述过程对机场17个其他环境进行取样,分别计算获得各环境的mibe值(参见图2)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。