1.本说明书实施方式涉及临床试验数据处理技术领域,具体涉及一种临床试验数据处理方法、装置、计算机设备、存储介质及计算机程序产品。
背景技术:
2.近年来,随着临床试验行业的发展,线下监查模式的弊端越发凸现,越来越多的临床试验软件产品开始被使用,比如临床试验项目管理系统、电子数据采集系统、随机与供应系统、患者电子报告系统等。在临床研究项目推进时,需要同时用到至少两个临床试验软件产品。
3.在传统技术中,针对某个临床试验项目需要同时用到两个临床试验软件产品的情况,用户需要在各临床试验软件产品中分别录入一些临床试验数据。
4.然而,在各临床试验软件产品中分别录入的临床试验数据可能是相同的,则传统技术中对临床试验数据的操作存在一些重复性劳动,增加了工作人员的工作量。
技术实现要素:
5.有鉴于此,本说明书实施方式致力于提供一种临床试验数据处理方法、装置、计算机设备、存储介质及计算机程序产品,以解决传统技术中临床试验数据处理效率低的技术问题。
6.本说明书实施方式提供了一种临床试验数据处理方法,包括:接收第一客户端的数据写入请求;其中,所述数据写入请求附带有目标临床试验数据;其中,所述目标临床试验数据为第一客户端与第二客户端的共用数据;其中,所述第一客户端与所述第二客户端不同;将所述目标临床试验数据写入目标数据库;其中,所述目标数据库用于存储所述第一客户端与所述第二客户端的共用数据;在接收到所述第二客户端针对所述目标临床试验数据的第一数据读取请求的情况下,将从所述目标数据库中读取的所述目标临床试验数据提供给所述第二客户端的用户界面。
7.本说明书实施方式提供一种临床试验数据处理方法,应用于第二客户端;所述方法包括:发送第一数据读取请求至服务器;接收所述服务器返回的从目标数据库中读取的目标临床试验数据;其中,所述目标临床试验数据是服务器将第一客户端的数据写入请求所附带并写入目标数据库中的;其中,所述目标数据库存储有所述第二客户端与第一客户端的共用数据;其中,所述第一客户端与所述第二客户端不同。
8.本说明书实施方式提供一种临床试验数据处理装置,所述装置包括:写入请求接收模块,用于接收第一客户端的数据写入请求;其中,所述数据写入请求附带有目标临床试验数据;其中,所述目标临床试验数据为第一客户端与第二客户端的共用数据;其中,所述第一客户端与所述第二客户端不同;目标数据写入模块,用于将所述目标临床试验数据写入目标数据库;其中,所述目标数据库用于存储所述第一客户端与所述第二客户端的共用数据;目标数据提供模块,用于在接收到所述第二客户端针对所述目标临床试验数据的第
一数据读取请求的情况下,将从所述目标数据库中读取的所述目标临床试验数据提供给所述第二客户端的用户界面。
9.本说明书实施方式提供一种临床试验数据处理装置,应用于第二客户端;所述装置包括:读取请求发送模块,用于发送第一数据读取请求至服务器;目标数据接收模块,用于接收所述服务器返回的从目标数据库中读取的目标临床试验数据;其中,所述目标临床试验数据是服务器将第一客户端的数据写入请求所附带并写入目标数据库中的;其中,所述目标数据库存储有所述第二客户端与第一客户端的共用数据;其中,所述第一客户端与所述第二客户端不同。
10.本说明书实施方式提供一种计算设备,包括存储器和处理器,所述存储器存储有计算机程序,所述处理器执行所述计算机程序时实现上述实施方式中的方法步骤。
11.本说明书实施方式提供一种计算机可读存储介质,其上存储有计算机程序,所述计算机程序被处理器执行时实现上述实施方式中的方法步骤。
12.本说明书实施方式提供一种计算机程序产品,所述计算机程序产品中包括指令,所述指令被计算机设备的处理器执行时,使得所述计算机设备能够执行上述实施方式中的方法步骤。
13.本说明书实施方式,通过接收第一客户端的数据写入请求,将数据写入请求附带的目标临床试验数据写入存储有第一客户端与第二客户端共用数据的目标数据库;则在接收到第二客户端针对目标临床试验数据的第一数据读取请求的情况下,将从目标数据库中读取的目标临床试验数据提供给第二客户端的用户界面。用户在第一客户端进行临床试验数据的操作之后,在用到第二客户端时,可以直接从目标数据库中读取数据,不需要再次重复之前的劳动,提升临床试验数据的处理效率,减少工作人员的工作量。
附图说明
14.图1a所示为一实施方式提供的场景示例中临床试验数据处理方法的交互图;
15.图1b所示为一实施方式提供的场景示例中临床试验数据处理方法的交互图;
16.图1c所示为一实施方式提供的临床试验数据处理方法的应用环境图;
17.图2a所示为一实施方式提供的临床试验数据处理方法的流程示意图;
18.图2b所示为一实施方式提供的字段共用配置页面的示意图;
19.图3所示为一实施方式提供的临床试验数据处理方法的流程示意图;
20.图4为一实施方式提供的临床试验数据处理装置的结构框图;
21.图5为一实施方式提供的临床试验数据处理装置的结构框图;
22.图6为一实施方式提供的计算机设备的内部结构图。
具体实施方式
23.下面将结合本说明书实施方式中的附图,对本说明书实施方式中的技术方案进行清楚、完整地描述,显然,所描述的实施方式仅是本说明书一部分实施方式,而不是全部的实施方式。基于本说明书中的实施方式,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施方式,都属于本说明书保护的范围。
24.以下对本说明书中涉及的部分名词进行解释,药物的临床试验指的是在人体进行
的药物系统性研究,以确定药物的疗效和安全性。药物临床试验阶段分为i期、ii期、iii期临床试验、iv期临床试验。i期主要是涉及初步的临床药理学及人体安全性评价试验。ii期可以理解为治疗作用初步评价阶段,主要涉及初步评价药物对目标适应症患者的治疗作用和安全性,也包括为iii期临床试验研究设计和给药剂量方案的确定提供依据。iii期可以理解为治疗作用确证阶段,主要进一步验证药物对目标适应症患者的治疗作用和安全性,评价利益与风险关系,最终为药物注册申请的审查提供充分的依据。iv期主要是药物上市后的临床试验,在药物上市后,可以继续追踪在广泛使用条件下的药物的疗效和不良反应,以评价在普通或者特殊人群中使用的利益与风险关系以及改进给药剂量等。
25.在临床试验过程需要涉及到不同的对象,比如制药企业、合同研究组织(contract research organization,cro)等。临床cro主要以临床研究服务为主,包括i至iv期临床试验技术服务、临床试验数据管理和统计分析、注册申报以及上市后药物安全监测及营销服务等。制药企业可以基于不同的药物开发需求选择不同的cro公司,借此扩展数据资源,并节约时间和成本。在临床试验过程中,不同的工作人员需要用到不同的客户端,比如edc软件、iwrs软件、ctms软件、plm软件、epro软件等客户端。这些客户端可以采用应用程序(一种完成某项或多项特定工作的计算机程序)的形式实现,也可以是小程序(一种不需要下载安装即可使用的应用)的形式实现,还可以采用html5、css3、javascript等一系列的前端技术实现。这些客户端也可以采用saas平台实现(software-as-a-service,软件即服务),通过浏览器访问特定网址,浏览器展示提供服务器提供的各客户端的用户界面。通过各客户端的用户界面响应于用户操作,实现预设功能,以辅助临床试验研究工作的进行。
26.其中,edc(electronic data capture system,电子数据捕获系统),是适用于临床试验数据采集和传输等功能的平台软件。iwrs(interactive web response system,临床受试者随机入组和发药系统)临床随机和灵活发药适用于受试者随机、临床随机发药、药物管理、紧急揭盲等功能的平台软件。ctms(clinical trial management system,临床研究管理系统)用于对整个临床试验中所涉及的人员、沟通、预算、进度、费用、文档、申报等进行管理和控制的平台软件。ctms可以是一个专为药厂新药研发部门、有临床研究功能的独立的新药研究单位以及合同研究组织(cro)提供的临床研究项目管理工具。plm(product lifecycle management,生命周期管理系统)plm可以是一种应用于在单一地点的企业内部、分散在多个地点企业内部,在产品研发领域具有协作关系的企业之间的支持产品全生命周期的信息的创建、管理、分发和应用的应用解决方案。plm系统可以用于对图纸和文档进行管理。epro(electronic patient-reported outcome,基于患者报告的临床结局)可以是直接来自于患者对自身健康状况、功能状态以及治疗感受的报告,其中不包括医护人员及其他任何人员的解释。epro可以为医生的诊断治疗提供更加有力的参考,对临床治疗实践具有十分重要的意义。
27.病例报告表(case report form,crf)可以是向申办者报告的、按照试验方案要求设计的一种电子文件,用于记录每一名受试者在试验过程中的全部信息。病例报告表是收集、记录和保存临床试验资料的载体。病例报告表(case report form,crf)包括人口学属性表单、不良事件表单、合并/既往用药表单、pk样本采集表单、既往病史数据表单、献血史表单、过敏史表单、给药记录表单、凝血功能表单、尿常规表单、血常规表单等。
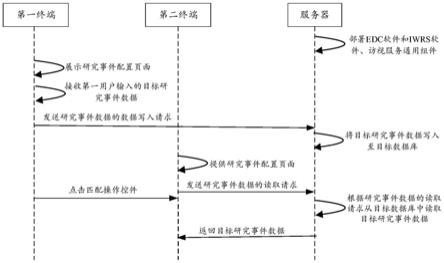
28.请参阅图1a。在一个具体的场景示例中,在启动临床试验前,平台服务器上已经预
先部署了edc软件和iwrs软件、访视服务通用组件。访视服务通用组件向edc软件和iwrs软件提供访问接口。访视服务通用组件可以提供有crf数据构建服务和通用数据挂载服务。访视服务通用组件对应有目标数据库。目标数据库中存储有edc软件和iwrs软件的共用数据。第一用户的第一终端具有edc软件的访问权限。第二用户的第二终端具有iwrs软件的访问权限。第一用户通过edc软件构建crf和采集临床试验数据。
29.具体地,在一些实施方式中,在临床试验研究项目中,在crf构建过程中需要配置研究事件数据。第一终端访问edc软件提供的研究事件配置页面,通过研究事件配置页面接收第一用户输入的目标研究事件数据,第一终端向平台服务器发送研究事件数据的数据写入请求,数据写入请求携带有目标研究事件数据。平台服务器将目标研究事件数据写入至目标数据库。在该临床试验研究项目的进展过程中,需要引入iwrs软件,iwrs软件也需要使用研究事件数据。由于已经第一用户通过edc软件在构建crf的过程中已经构建了研究事件数据,并存储在目标数据库中,因此,在同一临床试验研究项目中第二用户使用iwrs软件时,无需在iwrs软件中再次配置研究事件数据,可以直接向平台服务器发送研究事件数据的读取请求。具体地,第二终端访问iwrs软件提供的研究事件配置页面,通过研究事件配置页面向平台服务器发送研究事件数据的读取请求。平台服务器根据研究事件数据的读取请求从目标数据库中读取目标研究事件数据。平台服务器返回目标研究事件数据至第二终端。
30.在一些实施方式中,第一终端和第二终端上分别运行有浏览器。请参阅图1b。在临床试验研究项目中,在临床试验数据采集的过程中,通过第一终端的浏览器访问edc软件提供的受试者数据录入页面,通过受试者数据录入页面接收第一用户输入的目标受试者数据,第一终端向平台服务器发送受试者数据的数据写入请求,数据写入请求携带有目标受试者数据。平台服务器将目标受试者数据写入至目标数据库。在该临床试验研究项目的进展过程中,需要引入iwrs软件,iwrs软件也需要使用受试者数据。由于已经第一用户通过edc软件采集了受试者数据,并存储在目标数据库中,因此,在同一临床试验研究项目中第二用户使用iwrs软件时,无需在iwrs软件中再次采集受试者数据,可以直接向平台服务器发送受试者数据的读取请求。具体地,通过第二终端的浏览器访问iwrs软件提供的受试者数据录入页面,通过受试者数据录入页面向平台服务器发送受试者数据的读取请求。平台服务器根据受试者数据的读取请求从目标数据库中读取目标受试者数据。平台服务器返回目标受试者数据至第二终端。
31.需要说明的是,本实施方式示例性地说明通过edc软件提供的页面向目标数据库中写入受试者数据和研究事件数据,然后通过iwrs软件提供的页面从目标数据库中读取受试者数据和研究事件数据。同样的,在一些实施方式中,可以通过iwrs软件提供的页面向目标数据库中写入受试者数据和研究事件数据,然后通过edc软件提供的页面从目标数据库中读取受试者数据和研究事件数据,在此不再赘述。另外,本实施方式利用受试者数据和研究事件数据示例性地说明目标临床试验数据,目标临床试验数据也可以是本领域技术人员容易想到的其他数据。本实施方式使用edc软件、iwrs软件进行示例性地说明可以访问目标数据库的软件,同样也可以是ctms软件、plm软件、epro软件等临床试验行业中使用的其他软件。
32.请参阅图1c,本说明书实施方式提供一种临床试验数据处理系统,且本说明书提
供的临床试验数据处理方法应用于该临床试验数据处理系统。该临床试验数据处理系统可以包括由第一终端110、服务器120、第二终端130形成的硬件环境。第一终端110、第二终端130分别通过网络与服务器120进行通信。服务器120中部署有第一客户端和第二客户端。第一终端110向服务器120发送第一客户端的数据写入请求。服务器120接收第一客户端的数据写入请求;其中,数据写入请求附带有目标临床试验数据;服务器120将目标临床试验数据写入目标数据库;其中,目标数据库存储有第一客户端与第二客户端的共用数据;其中,第一客户端与第二客户端不同。第二终端130向服务器120发送第二客户端针对目标临床试验数据的第一数据读取请求。服务器120接收到第二客户端针对目标临床试验数据的第一数据读取请求,服务器120从目标数据库中读取目标临床试验数据,服务器120将读取到的目标临床试验数据提供至第二客户端的用户界面。
33.其中,第一客户端和第二客户端可以采用应用程序、小程序中的任一种形式实现,也可以采用html5、css3、javascript等一系列的前端技术实现。还也可以采用saas平台实现(software-as-a-service,软件即服务)。第一客户端和第二客户端可以是saas平台部署的实现不同功能的软件,用户可以通过第一终端或者第二终端上运行的具有浏览器功能的软件程序访问第一客户端和第二客户端。第一终端110、第二终端130可以但不限于是各种个人计算机、笔记本电脑、智能手机、平板电脑和便携式可穿戴设备。需要说明的是,在一些实施方式中,第一终端110、第二终端130可以是相互独立的终端,通过不同的终端访问服务器。在一些实施方式中,第一终端110和第二终端130可以是一台终端,某用户的用户权限可以访问服务器120上部署的edc软件、iwrs软件、ctms软件、plm软件、epro软件的至少两款软件。用户可以在该终端上登录第一客户端进行数据写入操作,用户也可以在该终端上切换至第二客户端进行数据读取操作。服务器120可以用独立的服务器或者是多个服务器组成的服务器集群来实现。随着科学技术的发展,可能会出现一些新型计算设备,比如量子计算服务器,这些新型计算设备也可以应用于本说明书的实施方式中。
34.请参阅图2a,本说明书实施方式提供一种临床试验数据处理方法。该临床试验数据处理方法包括以下步骤。
35.s210、接收第一客户端的数据写入请求。
36.其中,数据写入请求附带有目标临床试验数据。目标临床试验数据可以是被多个临床试验行业中软件共同需要的共用临床试验数据,比如被edc软件、iwrs软件、ctms软件、plm软件、epro软件中的至少两个软件共同使用的共用临床试验数据。共用临床试验数据可以是受试者基本信息数据(比如受试者姓名、身高、体重、民族等)。共用临床试验数据可以是受试者状态数据。受试者状态数据用于表征受试者在临床试验过程中的状态,比如筛选中、筛选失败、已随机、已入组、进行中、中止退出、失访、完成试验、随访中等状态。共用临床试验数据也可以是研究事件状态数据。研究事件状态数据用于表征研究事件的状态,比如各研究事件处于审核中、锁定、冻结等状态。共用临床试验数据还可以是研究事件配置数据。研究事件配置数据可以是访视的时间计划,研究事件配置数据可以包括访视窗数据,访视窗数据可以是临床研究方案规定的每次访视日期范围之内的时间段。
37.其中,研究事件可以是访视事件,也可以是不良事件等。访视事件是临床试验过程中极其重要的环节,直接关系到受试者对试验方案的依从性与试验的完整性。而受试者的依从性又直接影响试验的结果,所以研究者和研究助理需要在访视环节付出足够的时间和
精力。在临床研究行业,研究者与受试者之间因为临床试验的会面可以称为访视。访视通常是指监查,或是每次受试者应约到医院或者研究机构找研究者就诊。
38.具体地,第一客户端可以是edc、iwrs、ctms、plm、epro等临床试验行业软件的任一款软件。第一终端具有访问第一客户端的权限,第一终端向服务器发送第一客户端的数据写入请求,服务器接收到数据写入请求。在一些实施方式中,数据写入请求可以是将目标临床试验数据写入服务器的请求。示例性地,数据写入请求可以是将edc采集的受试者数据存储至服务器的写入请求。数据写入请求也可以是将访视时间计划数据存储至服务器的写入请求。
39.s220、将目标临床试验数据写入目标数据库。
40.s230、在接收到第二客户端针对目标临床试验数据的第一数据读取请求的情况下,将从目标数据库中读取的目标临床试验数据提供给第二客户端的用户界面。
41.其中,目标数据库存储有第一客户端与第二客户端的共用数据。其中,第一客户端可以是edc、iwrs、ctms、plm、epro等临床试验行业软件的任一款软件。第二客户端可以是edc、iwrs、ctms、plm、epro等临床试验行业软件的任一款软件,且第一客户端与第二客户端不同。具体地,第一终端向服务器发送第一客户端的数据写入请求,服务器接收到数据写入请求。数据写入请求携带有目标临床试验数据,服务器将目标临床试验数据写入目标数据库中。第二终端具有访问第二客户端的权限,第二终端向服务器发送第二客户端针对目标临床试验数据的第一数据读取请求,服务器接收到第一数据读取请求。服务器从目标数据库中读取目标临床试验数据,将读取的目标临床试验数据返回至第二终端,在第二客户端的用户界面显示目标临床试验数据。
42.在一些实施方式中,第一数据读取请求可以是从目标数据库中读取临床试验数据的请求。示例性地,数据写入请求可以是将edc采集的受试者数据存储至目标数据库的写入请求。相应地,第一数据读取请求可以是除edc之外的其他软件从目标数据库中读取受试者数据的请求。在一些实施方式中,数据写入请求也可以是将通过edc将访视时间计划数据存储至目标数据库的写入请求。相应地,第一数据读取请求可以是除edc之外的其他软件从目标数据库中读取访视时间计划数据的请求。
43.上述临床试验数据处理方法,通过接收第一客户端的数据写入请求,将数据写入请求附带的目标临床试验数据写入存储有第一客户端与第二客户端共用数据的目标数据库;则在接收到第二客户端针对目标临床试验数据的第一数据读取请求的情况下,将从目标数据库中读取的目标临床试验数据提供给第二客户端的用户界面。用户在第一客户端进行临床试验数据的操作之后,在用到第二客户端时,可以直接从目标数据库中读取数据,不需要再次重复之前的劳动,提升临床试验数据的处理效率,减少工作人员的工作量。
44.在一些实施方式中,在所述数据写入请求中附带有所述第一客户端独自使用临床试验数据的情况下,将所述第一客户端独自使用的临床试验数据写入所述第一客户端的独立数据库中。
45.其中,由于目标数据库用于存储第一客户端与第二客户端之间的共用数据,服务器上还可以部署于第一客户端或者第二客户端的独立数据库。相对来说,目标数据库可以理解为第一客户端或者第二客户端的共用数据库。具体地,服务器接收到第一客户端的数据写入请求,在检测到数据写入请求附带的临床试验数据为第一客户端独自使用的临床试
验数据,则可以将其写入第一客户端的独立数据库中。同样地,服务器接收到第二客户端的数据写入请求,在检测到数据写入请求附带的临床试验数据为第二客户端独自使用的临床试验数据,则可以将其写入第二客户端的独立数据库中。
46.在一些实施方式中,该临床试验数据处理方法还可以包括:在接收到第二客户端的第二数据读取请求的情况下,根据第二数据读取请求附带的数据类型,对目标数据库中的目标临床试验数据进行处理;提供格式调整后的目标临床试验数据至第二客户端的用户界面。
47.其中,在一些客户端之间的临床试验数据是相互共用的,如前文,第一客户端所涉及的目标临床试验数据可以直接写入目标数据库中,第二客户端可以直接从目标数据库中读取目标临床试验数据。然而,在一些实施方式中,第二客户端与第一客户端可能对临床试验数据具有不同的数据类型要求,比如数据范围、数据格式、数据长度等。因此,第二客户端对目标数据库中的目标临床试验数据并不能直接使用,需要对目标临床试验数据进行处理。具体地,第二终端向服务器发送第二客户端的第二数据读取请求,第二数据读取请求携带有数据类型。从目标数据库中读取目标临床试验数据,根据第二数据读取请求携带的数据类型对读取的目标临床试验数据进行处理的。服务器将处理后的目标临床试验数据返回至第二终端,第二终端可以显示第二客户端的用户界面,在第二客户端的用户界面中展示处理后的目标临床试验数据。
48.示例性地,数据类型可以是日期事件格式,第一客户端采用的日期时间格式可以是{yyyy}-{mm}-{dd}{hh}:{mm}:{ss}格式,分别代表年、月、日、时、分、秒,而第二客户端采用的日期时间格式为{dd}-{mmm}-{yyyy}格式,因此,可以按照{dd}-{mmm}-{yyyy}格式,对{yyyy}-{mm}-{dd}{hh}:{mm}:{ss}进行格式处理。
49.示例性地,若第一客户端存储至目标数据库中的目标临床试验数据是300个字符,而第二客户端所要求的数据长度为100个字符,则可以根据第二客户端的要求对目标临床试验数据进行关键词提取或者截断等处理,得到长度为100个字段,并提供至第二客户端的用户界面。
50.本实施方式中,通过根据第二数据读取请求附带的数据类型,对目标数据库中的目标临床试验数据进行处理,然后提供处理后的目标临床试验数据至第二客户端的用户界面,直接基于目标数据库中的共用数据进行处理得到满足第二客户端的临床试验数据,不需要工作人员在第二客户端执行额外的操作,降低用户操作成本,减少工作人员的工作量,提升临床试验数据的处理效率。
51.在一些实施方式中,数据写入请求附带有第一客户端的第一字段标识。将目标临床试验数据写入目标数据库,可以包括以下步骤。
52.s310、将目标临床试验数据写入至目标数据库中与第一字段标识对应的共用字段下。
53.相应地,在接收到第二客户端针对目标临床试验数据的第一数据读取请求的情况下,将从目标数据库中读取的目标临床试验数据提供给第二客户端的用户界面,可以包括以下步骤。
54.s320、在接收到第一数据读取请求的情况下,根据第一字段标识从目标数据库中读取目标临床试验数据。
55.s330、提供目标临床试验数据至第二客户端的用户界面。
56.其中,共用字段为第一客户端与第二客户端分别具有的字段。示例性地,第一客户端具有字段a和字段b,第二客户端包括字段b和字段c,则字段b为第一客户端与第二客户端的共用字段。可以在目标数据库中生成字段b。在通过第一客户端的用户界面对字段b的字段数据进行增加、修改、删除中的任一处理操作时,第二客户端的用户界面可以显示处理操作后的字段b的字段数据。同样地,在通过第二客户端的用户界面对字段b的字段数据进行增加、修改、删除中的任一处理操作时,第一客户端的用户界面可以显示处理操作后的字段b的字段数据。
57.具体地,第一终端向服务器发送第一客户端的数据写入请求,服务器接收到数据写入请求。数据写入请求携带有目标临床试验数据和第一客户端的第一字段标识,其中,第一字段标识与目标临床试验数据对应。服务器将目标临床试验数据写入目标数据库中与第一字段标识对应的共用字段下。第二终端具有访问第二客户端的权限,第二终端向服务器发送第二客户端针对目标临床试验数据的第一数据读取请求,服务器接收到第一数据读取请求。在一些实施方式中,第一数据读取请求可以携带有第一字段标识,服务器根据第一字段标识从目标数据库中读取目标临床试验数据。第二终端向服务器发送第二客户端针对目标临床试验数据的第一数据读取请求,服务器接收到第一数据读取请求。服务器根据第一字段标识从目标数据库中读取目标临床试验数据,将读取的目标临床试验数据返回至第二终端,在第二客户端的用户界面显示目标临床试验数据。
58.本实施方式中,用户在第一客户端进行临床试验数据的操作之后,在用到第二客户端时,可以直接根据数据写入请求附带的第一客户端的第一字段标识从目标数据库中读取数据,不需要再次重复之前的劳动,提升临床试验数据的处理效率,减少工作人员的工作量。
59.在一些实施方式中,第一数据读取请求携带有第二客户端的第二字段标识。在在接收到第一数据读取请求的情况下,根据第一字段标识从目标数据库中读取目标临床试验数据之前,该临床试验数据处理方法还可以包括:在接收到第一数据读取请求的情况下,根据第二字段标识在字段映射关系集合进行查询,确定与第二字段标识对应的第一字段标识。
60.其中,服务器中预先存储有字段映射关系集合。字段映射关系集合存储有第一字段标识与第二字段标识之间的对应关系。具体地,第二终端向服务器发送第一数据读取请求。第一数据读取请求携带有第二客户端的第二字段标识。服务器利用第二客户端的第二字段标识在字段映射关系集合进行查询,得到与第二字段标识对应的第一字段标识。服务器根据第一字段标识从目标数据库中读取目标临床试验数据。服务器提供目标临床试验数据至第二客户端的用户界面。
61.本实施方式中,用户在第一客户端进行临床试验数据的操作之后,在用到第二客户端时,可以根据第一数据读取请求携带的第二客户端的第二字段标识确定目标临床试验数据对应的第一字段标识,并根据第一字段标识从目标数据库中读取数据,不需要再次重复之前的劳动,提升临床试验数据的处理效率,减少工作人员的工作量。
62.在一些实施方式中,第一客户端具有第一字段。第二客户端具有第二字段。该临床试验数据处理方法还可以包括:接收字段共用配置请求;其中,字段共用配置请求携带有第
二字段、第一字段;在第二字段与第一字段之间建立字段映射关系,以生成字段映射关系集合。
63.具体地,在一些实施方式中,第一客户端已经在服务器完成部署,用户通过第一客户端已经在共享数据库中存储有共享数据。在第二客户端需要使用或者录入共享数据的情况下,第二客户端的用户界面可以提供字段共用配置页面。其中,字段共用配置页面中具有字段共用配置控件。在字段共用配置控件被触发的情况下,向服务器发送字段共用配置请求,字段共用配置请求携带有第二字段、第一字段。服务器接收到字段共用配置请求。服务器在第二字段与第一字段之间建立字段映射关系,以生成字段映射关系集合。
64.在一些实施方式中,若用户通过第二终端访问服务器,第二终端可以展示字段共用配置页面。第二终端对字段共用配置控件进行监控,在监控到字段共用配置控件被触发的情况下,第二终端向服务器发送字段共用配置请求。其中,字段共用配置请求携带有第一客户端的第一字段、第二客户端的第二字段。服务器接收到字段共用配置请求,以使服务器在第二字段与第一字段之间建立字段映射关系,以生成字段映射关系集合。
65.在一些实施方式中,请参阅图2b,字段共用配置页面中具有第一字段选择控件、第二字段选择控件。第一字段选择控件用于选择第一客户端的第一字段列表(字段a、字段b、字段c)。接收用户在第一字段列表中的字段选择操作,在第一客户端的第一字段列表中确定第一客户端中需要建立映射关系的第一字段。第二字段选择控件用于选择第二客户端的第二字段列表(字段x、字段y、字段z),接收用户在第二字段列表中的字段选择操作,在第二客户端的第二字段列表中确定第二客户端中需要建立映射关系的第二字段。
66.在一些实施方式中,服务器预先存储有第一字段与第二字段之间对应关系。第一客户端已经在服务器完成部署,用户通过第一客户端已经在共享数据库中存储有共享数据。在将第二客户端接入服务器的情况下,从服务器获取预先配置的第一字段与第二字段之间对应关系。第二客户端的用户界面可以提供字段共用配置页面,且在字段共用配置页面中展示第一字段与第二字段之间对应关系。展示出来的第一字段与第二字段之间对应关系可以作为向用户的一种推荐,用户对推荐的对应关系进行确定,则基于对应关系在第二字段与第一字段建立字段映射关系。在一些实施方式中,用户也可以对推荐的对应关心进行修改,基于修改后的对应关系建立字段映射关系。
67.本实施方式中,在第一客户端的第一字段域第二客户端的第二字段之间建立字段映射关系,以生成字段映射关系集合,为后续用户在第一客户端完成数据操作自动同步至第二客户端提供了数据基础,减少用户对第二客户端的操作,降低用户的工作量,提升临床试验数据的处理效率。
68.在一些实施方式中,目标数据库存储有第一客户端与第二客户端共同使用的受试者数据,目标数据包括目标受试者数据。在接收到第二客户端针对目标临床试验数据的第一数据读取请求的情况下,将从目标数据库中读取的目标临床试验数据提供给第二客户端的用户界面,可以包括:在接收到第二客户端针对目标受试者数据的读取请求的情况下,将从目标数据库中读取的目标受试者数据提供给第二客户端的用户界面。
69.其中,受试者数据可以是受试者基本信息数据(比如受试者姓名、身高、体重、民族等)。受试者数据可以是受试者状态数据。受试者状态数据用于表征受试者在临床试验过程中的状态,比如筛选中、筛选失败、已随机、已入组、进行中、中止退出、失访、完成试验、随访
中等状态。
70.具体地,第一终端向服务器发送第一客户端的数据写入请求,服务器接收到数据写入请求。数据写入请求携带有目标受试者数据,服务器将目标受试者数据写入目标数据库中。第二终端具有访问第二客户端的权限,第二终端向服务器发送第二客户端针对目标受试者数据的读取请求,服务器接收到针对目标受试者数据的读取请求。服务器从目标数据库中读取目标受试者数据,将读取的目标受试者数据返回至第二终端,在第二客户端的用户界面显示目标受试者数据。
71.在一些实施方式中,任一终端访问服务器上部署的第一客户端,该终端展示第一客户端的受试者数据采集页面。通过受试者数据采集页面接收用户录入的目标受试者数据,响应于受试者数据的录入操作,终端将携带有目标受试者数据的录入请求发送至服务器,以存储在目标数据库中。在该终端切换至第二客户端,针对相同的临床试验项目进行受试者数据采集时,在用户界面上给出提醒信息,以告知用户已经通过第一客户端进行目标受试者数据的录入,并从目标数据库中读取目标受试者数据,将读取的目标受试者数据提供至第二客户端的用户界面中。
72.本实施方式中,将第一客户端与第二客户端的共用受试者数据写入目标数据库中,在第二客户端使用受试者数据时,可以之间将目标数据库中的目标受试者数据进行提供,不需要再次重复执行受试者数据的录入,提升受试者数据的录入效率,减少工作人员的工作量。
73.在一些实施方式中,目标数据库存储有第一客户端与第二客户端共同使用的研究事件数据,目标临床试验数据包括目标研究事件数据。在接收到第二客户端针对目标临床试验数据的第一数据读取请求的情况下,将从目标数据库中读取的目标临床试验数据提供给第二客户端的用户界面,可以包括:在接收到第二客户端针对目标研究事件数据的读取请求的情况下,将从目标数据库中读取的目标研究事件数据提供给第二客户端的用户界面。
74.其中,研究事件数据可以是研究事件配置数据。研究事件配置数据可以是访视的时间计划,研究事件配置数据可以包括访视窗数据,访视窗数据可以是临床研究方案规定的每次访视日期范围之内的时间段。研究事件数据还可以是研究事件状态数据。研究事件状态数据用于表征研究事件的状态,比如各研究事件处于审核中、锁定、冻结等状态。
75.具体地,第一终端向服务器发送第一客户端的数据写入请求,服务器接收到数据写入请求。数据写入请求携带有目标研究事件数据,服务器将目标研究事件数据写入目标数据库中。第二终端具有访问第二客户端的权限,第二终端向服务器发送第二客户端针对目标研究事件数据的读取请求,服务器接收到针对研究事件数据的读取请求。服务器从目标数据库中读取目标研究事件数据,将读取的目标研究事件数据返回至第二终端,在第二客户端的用户界面显示目标研究事件数据。
76.在一些实施方式中,任一终端访问服务器上部署的第一客户端,该终端展示第一客户端的研究事件数据配置页面。通过研究事件数据配置页面接收用户配置的目标研究事件数据,响应于研究事件数据的配置操作,终端将携带有目标研究事件数据的配置请求发送至服务器,以存储在目标数据库中。在该终端切换至第二客户端,针对相同的临床试验项目进行研究事件数据配置时,在用户界面上给出提醒信息,以告知用户已经通过第一客户
端进行研究事件数据的配置,并从目标数据库中读取目标研究事件数据,将读取的目标研究事件数据提供至第二客户端的用户界面中。
77.本实施方式中,将第一客户端与第二客户端的共用受试者数据写入目标数据库中,在第二客户端使用研究事件数据时,可以之间将目标数据库中的目标研究事件数据进行提供,不需要再次重复执行研究事件数据的配置,提升研究事件数据的配置效率,减少工作人员的工作量。
78.本说明书实施方式提供一种临床试验数据处理方法,该临床试验数据处理方法包括以下步骤。
79.s402、接收第一客户端的数据写入请求。
80.其中,数据写入请求附带有目标临床试验数据。数据写入请求附带有第一客户端的第一字段标识。
81.s404、将目标临床试验数据写入至目标数据库中与第一字段标识对应的共用字段下。
82.其中,目标数据库存储有第一客户端与第二客户端的共用数据;其中,第一客户端与第二客户端不同。共用字段为第一客户端与第二客户端分别具有的字段。第一客户端具有第一字段;第二客户端具有第二字段。
83.s406、在接收到第二客户端针对目标临床试验数据的第一数据读取请求的情况下,根据第二字段标识在字段映射关系集合进行查询,确定与第二字段标识对应的第一字段标识。
84.其中,字段映射关系集合存储有第一字段标识与第二字段标识之间的对应关系。其中,第一数据读取请求携带有第二客户端的第二字段标识。
85.s408、根据第一字段标识从目标数据库中读取目标临床试验数据。
86.s410、提供目标临床试验数据至第二客户端的用户界面。
87.在一些实施方式中,目标数据库存储有第一客户端与第二客户端共同使用的受试者数据,目标数据包括目标受试者数据。具体地,在接收到第二客户端针对目标受试者数据的读取请求的情况下,将从目标数据库中读取的目标受试者数据提供给第二客户端的用户界面。
88.在一些实施方式中,目标数据库存储有第一客户端与第二客户端共同使用的研究事件数据,目标临床试验数据包括目标研究事件数据;在接收到第二客户端针对目标研究事件数据的读取请求的情况下,将从目标数据库中读取的目标研究事件数据提供给第二客户端的用户界面。
89.s412、在接收到第二客户端的第二数据读取请求的情况下,根据第二数据读取请求附带的数据类型,对目标数据库中的目标临床试验数据进行处理。
90.s414、提供处理后的目标临床试验数据至第二客户端的用户界面。
91.s416、接收字段共用配置请求;其中,字段共用配置请求携带有第二字段、第一字段。
92.s418、在第二字段与第一字段之间建立字段映射关系,以生成字段映射关系集合。
93.请参阅图3,本说明书实施方式提供一种临床试验数据处理方法。该临床试验数据处理方法包括以下步骤。
94.s510、发送第一数据读取请求至服务器。
95.s520、接收服务器返回的从目标数据库中读取的目标临床试验数据。
96.其中,目标临床试验数据是服务器将第一客户端的数据写入请求所附带并写入目标数据库中的;其中,目标数据库存储有第二客户端与第一客户端的共用数据;其中,第一客户端与第二客户端不同。
97.在一些实施方式中,该临床试验数据处理方法中还可以包括以下步骤:提供字段共用配置页面;在字段共用配置控件被触发的情况下,向服务器发送字段共用配置请求;其中,字段共用配置页面中具有字段共用配置控件;其中,字段共用配置请求携带有第一客户端的第一字段、第二客户端的第二字段;字段共用配置请求用于指示服务器在第二字段与第一字段之间建立字段映射关系,以生成字段映射关系集合。
98.在一些实施方式中,字段共用配置页面中具有第一字段选择控件、第二字段选择控件。该临床试验数据处理方法还可以包括:在第一字段选择控件被触发的情况下,确定需要建立映射关系的第一字段;在第二字段选择控件被触发的情况下,确定需要建立映射关系的第二字段。
99.在一些实施方式中,该临床试验数据处理方法还可以包括:获取预先配置的第一字段与第二字段之间对应关系;基于对应关系确定需要建立字段映射关系的第二字段与第一字段。
100.关于应用于第二应用程序的临床试验数据处理方法的具体限定可以参见上文中应用于服务器侧的临床试验数据处理方法的限定,在此不再赘述。
101.应该理解的是,虽然上述流程图中的各个步骤按照箭头的指示依次显示,但是这些步骤并不是必然按照箭头指示的顺序依次执行。除非本文中有明确的说明,这些步骤的执行并没有严格的顺序限制,这些步骤可以以其它的顺序执行。而且,上述流程图中的至少一部分步骤可以包括多个步骤或者多个阶段,这些步骤或者阶段并不必然是在同一时刻执行完成,而是可以在不同的时刻执行,这些步骤或者阶段的执行顺序也不必然是依次进行,而是可以与其它步骤或者其它步骤中的步骤或者阶段的至少一部分轮流或者交替地执行。
102.请参阅图4,本说明书实施方式提供了一种临床试验数据处理装置400。临床试验数据处理装置400可以包括写入请求接收模块410、目标数据写入模块420和目标数据提供模块430。
103.写入请求接收模块410,用于接收第一客户端的数据写入请求;其中,所述数据写入请求附带有目标临床试验数据;其中,所述目标临床试验数据为第一客户端与第二客户端的共用数据;其中,所述第一客户端与所述第二客户端不同。
104.目标数据写入模块420,用于将所述目标临床试验数据写入目标数据库;其中,所述目标数据库用于存储所述第一客户端与所述第二客户端的共用数据。
105.目标数据提供模块430,用于在接收到所述第二客户端针对所述目标临床试验数据的第一数据读取请求的情况下,将从所述目标数据库中读取的所述目标临床试验数据提供给所述第二客户端的用户界面。
106.请参阅图5,本说明书实施方式提供了一种临床试验数据处理装置500。临床试验数据处理装置500可以包括读取请求发送模块510、目标数据接收模块520。
107.读取请求发送模块510,用于发送第一数据读取请求至服务器。
108.目标数据接收模块520,用于接收服务器返回的从目标数据库中读取的目标临床试验数据;其中,目标临床试验数据是服务器将第一客户端的数据写入请求所附带并写入目标数据库中的;其中,目标数据库存储有第二客户端与第一客户端的共用数据;其中,第一客户端与第二客户端不同
109.关于临床试验数据处理装置的具体限定可以参见上文中对于临床试验数据处理方法的限定,在此不再赘述。上述临床试验数据处理装置中的各个模块可全部或部分通过软件、硬件及其组合来实现。上述各模块可以硬件形式内嵌于或独立于计算机设备中的处理器中,也可以以软件形式存储于计算机设备中的存储器中,以便于处理器调用执行以上各个模块对应的操作。
110.在一些实施方式中,提供了一种计算机设备,该计算机设备可以是终端,其内部结构图可以如图6所示。该计算机设备包括通过系统总线连接的处理器、存储器、通信接口、显示屏和输入装置。其中,该计算机设备的处理器用于提供计算和控制能力。该计算机设备的存储器包括非易失性存储介质、内存储器。该非易失性存储介质存储有操作系统和计算机程序。该内存储器为非易失性存储介质中的操作系统和计算机程序的运行提供环境。该计算机设备的通信接口用于与外部的终端进行有线或无线方式的通信,无线方式可通过wifi、运营商网络、nfc(近场通信)或其他技术实现。该计算机程序被处理器执行时以实现一种临床试验数据处理方法。该计算机设备的显示屏可以是液晶显示屏或者电子墨水显示屏,该计算机设备的输入装置可以是显示屏上覆盖的触摸层,也可以是计算机设备外壳上设置的按键、轨迹球或触控板,还可以是外接的键盘、触控板或鼠标等。
111.本领域技术人员可以理解,图6中示出的结构,仅仅是与本说明书所公开方案相关的部分结构的框图,并不构成对本说明书所公开方案所应用于其上的计算机设备的限定,具体地,计算机设备可以包括比图中所示更多或更少的部件,或者组合某些部件,或者具有不同的部件布置。
112.在一些实施方式中,提供了一种计算机设备,包括存储器和处理器,存储器中存储有计算机程序,该处理器执行计算机程序时实现上述实施方式中的方法步骤。
113.在一些实施方式中,提供了一种计算机可读存储介质,其上存储有计算机程序,计算机程序被处理器执行时实现上述实施方式中的方法步骤。
114.在一些实施方式中,还提供一种计算机程序产品,所述计算机程序产品中包括指令,上述指令可由计算机设备的处理器执行时实现上述实施方式中的方法步骤。
115.本领域普通技术人员可以理解实现上述实施方式方法中的全部或部分流程,是可以通过计算机程序来指令相关的硬件来完成,所述的计算机程序可存储于一非易失性计算机可读取存储介质中,该计算机程序在执行时,可包括如上述各方法的实施方式的流程。其中,本说明所提供的各实施方式中所使用的对存储器、存储、数据库或其它介质的任何引用,均可包括非易失性和易失性存储器中的至少一种。非易失性存储器可包括只读存储器(read-only memory,rom)、磁带、软盘、闪存或光存储器等。易失性存储器可包括随机存取存储器(random access memory,ram)或外部高速缓冲存储器。作为说明而非局限,ram可以是多种形式,比如静态随机存取存储器(static random access memory,sram)或动态随机存取存储器(dynamic random access memory,dram)等。
116.以上实施方式的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施
方式中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
117.以上所述仅为本说明书的较佳实施方式而已,并不用以限制本说明书,凡在本说明书的精神和原则之内,所作的任何修改、等同替换等,均应包含在本说明书的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。