1.本发明涉及生物医药技术领域,具体涉及一种富含细胞因子的条件血清的制备方法及应用。
背景技术:
2.关节炎泛指发生在人体关节及其周围组织,由炎症、感染、退化、创伤或其他因素引起的炎性疾病,临床表现为关节的红、肿、热、痛、功能障碍及关节畸形,严重者可能导致关节残疾,非常影响患者的生活质量。
3.炎性关节炎(inflammatory arthritis,ia)的病因及发病机制目前尚未完全明确,但是许多证据已经表明,一些细胞因子尤其是白细胞介素-1(il-1)在ia关节发病的慢性炎性过程中具有重要作用,白细胞介素-1受体拮抗剂(il-1ra)近年来亦被用于ia的治疗。
4.现有的富含血小板(l-1ra)i的条件血清的制备方法是用硫酸铬(crso4)包被过表面的医疗级玻璃小珠与新鲜血液混合刺激,37℃静置24小时后提取血清,即可得到富含il-1ra等抗炎因子的条件血清给患者进行回输治疗。
5.但是,现有技术获得的条件血清中il-1ra单位含量较低,且单纯的富含抗炎因子的条件血清在修复组织损伤、促进愈合、恢复功能等方面的功效不明显。
6.富血小板血浆(prp)法在受损或退化的组织部位进行注射,以试图达到修复组织损伤、及恢复功能的目的,并发症极少,是相对安全的治疗方式,但是,传统制作的血小板浓厚血浆不能同时治疗发炎和退化,因此,有进一步改善的空间。研究得知外周血液中il-1ra主要来源于白细胞层,prp在制备过程中是没有提取白细胞层,制备富血小板因子的血清,可以改善传统制作的prp所无法达到的治疗功效,其优点为血清中可同时包含生长因子与il-1ra,优化传统相关技术。与富血小板血浆技术不同,富细胞因子的血清在制备时已经活化了血小板和免疫细胞,能够在制备过程中就获得足够量的细胞因子和生长因子,使用时得到最高的生物效力。最原始的自体血清制备方法是用硫酸铬(crso4)包被过表面的医疗级玻璃小珠与新鲜血液混合刺激,37℃静置24小时后提取血清,即可得到富含大量白细胞介素1受体拮抗物、抗炎因子等多种细胞因子的血清给患者进行回输治疗。
技术实现要素:
7.鉴于此,本发明提供一种富含细胞因子的条件血清的制备方法,一方面,本发明提供一种富含il-1ra的条件血清的制备方法,可大大提高il-1ra的含量。进一步,本发明还提供一种富血小板因子条件血清及其制备方法,该条件血清同时包含富血小板因子血浆与富含il-1ra的条件血清,能够同时达到修复组织损伤、恢复功能和治疗组织发炎、退化的功效目的,且本发明在同一个血样中完成prp和il-1ra的充分富集,操作简便,节约成本。
8.本发明的目的是通过以下技术方案来实现:
9.一种富含细胞因子的条件血清的制备方法,包括如下步骤:
10.s1、将新鲜血液装入采血管,充分摇匀;
11.s2、将步骤s1装有新鲜血液的采血管放置于恒温摇床培养箱内,恒温振荡孵育,然后离心,将红细胞沉淀去除,收集上清液一;
12.s3、将上清液一用无菌滤器过滤,收集滤液一,获得富含细胞因子的条件血清一;
13.或,
14.a、将新鲜血液装入采血管,充分摇匀;
15.b、将步骤a装有新鲜血液的采血管进行低速离心使血液分层,吸取收集上清中的prp层,获得prp粗提液,剩余血液置于采血管备用,将所述prp粗提液进行冻融处理后离心,收集prp上清液,无菌过滤后,收集的滤液为富血小板因子血浆;将装有剩余血液的采血管放置于恒温摇床培养箱内,恒温振荡孵育,然后离心,将红细胞沉淀去除,收集上清液二;
16.c、将上清液二用无菌滤器过滤,收集滤液二,将步骤b所述富血小板因子血浆和所述滤液二混合,获得富含细胞因子的条件血清二。
17.步骤s1或步骤a中,所述采血管中不添加抗凝剂。
18.步骤s1中,在所述采血管中,加入无菌玻璃小珠。
19.步骤b中,装有剩余血液的采血管中加入无菌玻璃小珠,然后放置于恒温摇床培养箱内,恒温振荡孵育,然后离心,将红细胞沉淀去除,收集上清液二。步骤s1或步骤b中,无菌玻璃小珠按每3ml血液加入30-60颗的比例加入玻璃采血管中。
20.步骤s2或步骤b中,所述恒温振荡孵育的条件为35-38℃;转速为60-120r/min,振荡孵育的时间为12-24h。
21.步骤b中,所述低速离心的条件为,离心力为500
×
g~800
×
g,离心时间为7-9min。
22.步骤b中,所述冻融处理为-80℃-210℃环境下冷冻12-24h后,再解冻融化。
23.优选的,所述冻融处理为-80℃或液氮环境下冷冻12-24h后,在37℃解冻融化。
24.步骤s2或步骤b中,所述无菌过滤器为0.22μm无菌滤器。
25.本发明还提供一种如上所述的方法制备的条件血清。
26.本发明所述条件血清在用于炎性关节炎及其他由创伤、炎症、感染、退化等因素引起的炎性疾病的治疗中的应用,也属于本发明的保护范围。
27.作为本发明的又一实施方式,一种富含细胞因子的条件血清的制备方法,包括如下步骤:
28.(1)材料的准备:准备无抗凝剂的普通玻璃采血管;
29.(2)富含il-1ra条件血清的制备:将新鲜的血液装入无抗凝剂的普通玻璃采血管,充分缓慢摇匀,保证新鲜血液充分接触玻璃采血管,将装有血液的玻璃采血管放置于37℃、转速60-120r/min的恒温摇床培养箱内,进行24h的恒温振荡孵育,用离心机以2500-3500r/min的转速,离心8-10min,将多余的红细胞沉淀去除,最后使用0.22μm无菌滤器过滤上层血清,即得到富含il-1ra的条件血清。
30.作为本发明的又一实施方式,一种富含细胞因子的条件血清的制备方法,包括如下步骤:
31.(1)准备无抗凝剂的普通玻璃采血管和医疗级玻璃小珠,按每3ml血液加入30-60颗的比例加入玻璃采血管中;
32.(2)将新鲜血液装入采血管,充分缓慢摇匀,保证玻璃小珠与新鲜血液充分接触,
将装有血液和玻璃小珠的采血管放置于37℃、转速60-120r/min的恒温摇床培养箱内,进行24h的恒温振荡孵育,再用离心机以2500-3500r/min的转速,离心8-10min,将多余的红细胞沉淀去除,最后使用0.22μm无菌滤器过滤上层血清,即得到富含il-1ra的条件血清。
33.作为本发明的又一实施方式,一种富含细胞因子的条件血清的制备方法,包括如下步骤:
34.(1)准备无菌玻璃采血管;
35.(2)prp制备:将新鲜血液,600g离心8min后,吸取收集上清中的prp层(其中prp是中间部分,上清是贫血小板血浆ppp),保留剩余的血液备用,将收集的prp层在-80℃冷冻24h后,在37℃解冻后2500-3500r/min离心8-10min,进一步收集上清液prp,将收集的上清液prp使用0.22μm无菌滤器过滤,收集的滤液为富血小板因子血浆;
36.(3)富含il-1ra血清的制备:prp采集后,将步骤(2)保留的剩余血液充分缓慢摇匀,将装有血液的玻璃采血管放置于37℃、转速60-120r/min的恒温摇床培养箱内,恒温振荡孵育24h后,用离心机以2500-3500r/min离心8-10min,将多余的红细胞沉淀去除,最后使用0.22μm无菌滤器过滤上层血清,滤液为富含il-1ra血清;
37.(4)富含细胞因子的条件血清:将得到的富血小板因子血浆与富含il-1ra血清混合,得到富含细胞因子的条件血清。
38.作为本发明的又一实施方式,一种富含细胞因子的条件血清的制备方法,包括如下步骤:
39.(1)准备无菌玻璃采血管和医疗级玻璃小珠;
40.(2)prp制备:将新鲜血液装入采血管,600g离心8min后,吸取收集上清中的prp层,-80℃冷冻24h后,在37℃解冻后2500-3500r/min离心8-10min,收集上清prp,使用0.22μm无菌滤器过滤,收集的滤液为富血小板因子血浆;
41.(3)富含il-1ra条血清的制备:prp采集后,将剩余血液充分缓慢摇匀,按每3ml血液加入30-60颗的比例加入玻璃采血管中,保证玻璃小珠与新鲜血液充分接触,将装有血液和玻璃小珠的特制采血套装放置于37℃、转速60-120r/min的恒温摇床培养箱内,恒温振荡孵育24h后,用离心机以2500-3500r/min离心8~10min,将多余的红细胞沉淀去除,最后使用0.22μm无菌滤器过滤上层血清,即得到富含il-1ra血清;
42.(4)富含细胞因子的条件血清:将得到的prp与富含il-1ra血清混合,得到富含细胞因子的条件血清。
43.与现有技术相比,本发明具有如下有益效果:
44.1、本发明提供的条件血清的制备方法,可显著提高il-1ra的含量,从而增强条件血清治疗组织发炎和退化的功效;
45.2、和现有技术的静置孵育相比,本发明采用振荡培养,可增大血液与玻璃小珠的接触面积,从而使血液与玻璃小珠充分接触进行特异性刺激,产生大量细胞因子,使细胞因子充分富集;
46.3、本发明提供的富血小板因子条件血清及其制备方法,使血液中的生长因子和抗炎因子充分富集,能够同时达到修复组织损伤、促进愈合、恢复功能和治疗组织发炎、退化的功效目的,更适用于炎性关节炎及其他由创伤、炎症、感染、退化等因素引起的炎性疾病的治疗;
47.4、本发明提供的制备方法可在同一个血样中完成血小板因子和il-1ra的充分富集,操作简便,节约成本。
附图说明
48.通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
49.图1为实施例3的制备方法流程示意图;
50.图2为(实施例1和实施例3和对比例1、对比例3)不加玻璃珠的情况下比较振荡-静置,有prp-无prp的情形;
51.图3为(实施例2和实施例4和对比例2、对比例4)加玻璃珠的情况下比较振荡-静置,有prp-无prp的情形。
具体实施方式
52.下面结合实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进。这些都属于本发明的保护范围。
53.本发明的目的是通过以下技术方案来实现:
54.《第一方面》
55.本发明提供一种富含il-1ra的条件血清的制备方法,包括如下步骤:
56.步骤s1、将新鲜血液装入含无菌玻璃小珠的玻璃采血管,充分摇匀;
57.步骤s2、将装有全血的玻璃采血管放置于恒温摇床培养箱内,恒温振荡孵育,然后离心,将红细胞沉淀去除,收集上清液;
58.步骤s3、将步骤s2的上清液用无菌滤器过滤,获得的滤液即为富含il-1ra的条件血清。
59.步骤s1中无菌玻璃小珠按每3ml全血加入30-60颗的比例加入玻璃采血管中。
60.步骤s2中恒温摇床培养箱的温度为37℃、转速为60-120r/min,振荡孵育的时间为12-24h。
61.步骤s2中离心转速为2500-3500r/min,离心时间8-10min。
62.步骤s3中无菌滤器为0.22μm。
63.《第二方面》
64.本发明提供一种富血小板因子条件血清及其制备方法,包括如下步骤:
65.步骤a)将全血低速离心使血液分层;
66.步骤b)吸取prp层,进行冻融处理后离心,收集上清,无菌过滤后,收集滤液得到富血小板因子血浆;
67.步骤c)剩余血液加入无菌玻璃小珠后充分摇匀,放置于恒温摇床培养箱内,恒温振荡孵育,然后离心,将红细胞沉淀去除,收集上清,无菌过滤后即得到富含il-1ra的条件血清;
68.步骤d)将富血小板因子血浆和富含il-1ra的条件血清混合,得到富含细胞因子的
条件血清
69.步骤a)中离心力为500
×
g-800
×
g,离心时间为7-9min。
70.步骤b)中冻融处理为-80℃或液氮环境下冷冻12-24h后,在37℃解冻融化。
71.步骤b)中离心转速为2500-3500r/min,离心时间8-10min。
72.步骤b)无菌滤器为0.22μm。
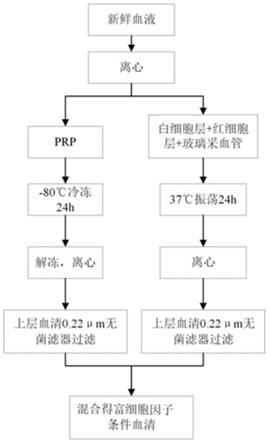
73.步骤c)中无菌玻璃小珠按每3ml全血加入30-60颗的比例加入玻璃采血管中。
74.步骤c)中恒温摇床培养箱的温度为37℃、转速为60-120r/min,振荡孵育的时间为12-24h。
75.步骤c)中离心转速为2500-3500r/min,离心时间8-10min。
76.步骤c)中无菌滤器为0.22μm。
77.实施例1
78.无抗凝剂的普通玻璃采血管 振荡培养
79.(2)材料的准备:准备无抗凝剂的普通玻璃采血管;
80.(2)富含il-1ra条件血清的制备,将新鲜的血液装入无抗凝剂的普通玻璃采血管,充分缓慢摇匀,保证新鲜血液充分接触玻璃采血管,将装有血液的玻璃采血管放置于37℃、转速120r/min的恒温摇床培养箱内,进行24h的恒温振荡孵育,用离心机以3500r/min的转速,离心10min,将多余的红细胞沉淀去除,最后使用0.22μm无菌滤器过滤上层血清,即得到富含il-1ra的条件血清。
81.实施例2
82.无抗凝剂的普通玻璃采血管 振荡培养 玻璃小珠
83.(1)准备无抗凝剂的普通玻璃采血管和医疗级玻璃小珠,按每3ml血液加入30-60颗的比例加入玻璃采血管中;
84.(2)将新鲜血液装入采血管,充分缓慢摇匀,保证玻璃小珠与新鲜血液充分接触,将装有血液和玻璃小珠的采血管放置于37℃、转速120r/min的恒温摇床培养箱内,进行24h的恒温振荡孵育,再用离心机以3500r/min的转速,离心10min,将多余的红细胞沉淀去除,最后使用0.22μm无菌滤器过滤上层血清,即得到富含il-1ra的条件血清。
85.实施例3
86.无抗凝剂的普通玻璃采血管 振荡培养 prp(流程图如图1)
87.(1)准备无菌玻璃采血管;
88.(2)prp制备:将新鲜血液,600g离心8min后,吸取收集上清中的prp层(其中prp是中间部分,上清是贫血小板血浆ppp),保留剩余的血液备用,将收集的prp层在-80℃冷冻24h后,在37℃解冻后3500r/min离心10min,进一步收集上清液prp,将收集的上清液prp使用0.22μm无菌滤器过滤,收集的滤液为富血小板因子血浆;
89.(3)富含il-1ra血清的制备:prp采集后,将步骤(2)保留的剩余血液充分缓慢摇匀,将装有血液的玻璃采血管放置于37℃、转速120r/min的恒温摇床培养箱内,恒温振荡孵育24h后,用离心机以3500r/min离心10min,将多余的红细胞沉淀去除,最后使用0.22μm无菌滤器过滤上层血清,滤液为富含il-1ra血清;
90.(4)富含细胞因子的条件血清:将得到的富血小板因子血浆与富含il-1ra血清混合,得到富含细胞因子的条件血清;
91.(5)采用elisa试剂盒对制备的富含细胞因子的条件血清进行生长因子和il-1ra含量检测。
92.实施例4
93.无抗凝剂的普通玻璃采血管 振荡培养 玻璃小珠 prp
94.(1)准备无菌玻璃采血管和医疗级玻璃小珠;
95.(2)prp制备:将新鲜血液装入采血管,600g离心8min后,吸取收集上清中的prp层,-80℃冷冻24h后,在37℃解冻后2500r/min离心8min,收集上清prp,使用0.22μm无菌滤器过滤,收集的滤液为富血小板因子血浆;
96.(3)富含il-1ra条血清的制备:prp采集后,将剩余血液充分缓慢摇匀,按每3ml血液加入30-60颗的比例加入玻璃采血管中,保证玻璃小珠与新鲜血液充分接触,将装有血液和玻璃小珠的特制采血套装放置于37℃、转速60r/min的恒温摇床培养箱内,恒温振荡孵育24h后,用离心机以2500r/min离心8~10min,将多余的红细胞沉淀去除,最后使用0.22μm无菌滤器过滤上层血清,即得到富含il-1ra血清;
97.(4)富含细胞因子的条件血清:将得到的prp与富含il-1ra血清混合,得到富含细胞因子的条件血清;
98.(5)采用elisa试剂盒对制备的富含细胞因子的条件血清进行生长因子和il-1ra含量检测。
99.实施例5
100.无抗凝剂的普通玻璃采血管 振荡培养 prp
101.(1)准备无菌玻璃采血管;
102.(2)prp制备:将新鲜血液,600g离心8min后,吸取收集上清中的prp层(其中prp是中间部分,上清是贫血小板血浆ppp),保留剩余的血液备用,将收集的prp层在-80℃冷冻24h后,在37℃解冻后3500r/min离心10min,进一步收集上清液prp,将收集的上清液prp使用0.22μm无菌滤器过滤上层血清,收集的滤液为富血小板因子血浆
103.(3)富含il-1ra血清的制备:富血小板因子血浆采集后,将步骤(2)保留的剩余血液充分缓慢摇匀,将装有血液的玻璃采血管放置于37℃、转速120r/min的恒温摇床培养箱内,恒温振荡孵育24h后,用离心机以3500r/min离心10min,将多余的红细胞沉淀去除,最后使用0.22μm无菌滤器过滤上层血清,收集滤液,得到富含il-1ra血清;
104.(4)富含细胞因子的条件血清:将得到的富血小板因子血浆与富含il-1ra血清混合,得到富含细胞因子的条件血清。
105.实施例6
106.无抗凝剂的普通玻璃采血管 振荡培养 玻璃小珠 prp
107.(1)准备无菌玻璃采血管和医疗级玻璃小珠;
108.(2)prp制备:将新鲜血液装入采血管,600g离心8min后,吸取收集上清中的prp层,-80℃冷冻24h后,在37℃解冻后~3500r/min离心10min,收集上清prp,使用0.22μm无菌滤器过滤,收集的滤液为富血小板因子血浆;
109.(3)富含il-1ra条血清的制备:prp采集后,将剩余血液充分缓慢摇匀,按每3ml血液加入30-60颗的比例加入玻璃采血管中,保证玻璃小珠与新鲜血液充分接触,将装有血液和玻璃小珠的特制采血套装放置于37℃、转速120r/min的恒温摇床培养箱内,恒温振荡孵
育24h后,用离心机以3500r/min离心8~10min,将多余的红细胞沉淀去除,最后使用0.22μm无菌滤器过滤上层血清,即得到富含il-1ra血清;
110.(4)富含细胞因子的条件血清:将得到的prp与富含il-1ra血清混合,得到富含细胞因子的条件血清;
111.(5)采用elisa试剂盒对制备的富含细胞因子的条件血清进行生长因子和il-1ra含量检测。
112.对比例1
113.无抗凝剂的普通玻璃采血管 静置培养。
114.本对比例与实施例1的区别仅在于,步骤(2)中,恒温振荡孵育替换为静置培养。
115.对比例2
116.无抗凝剂的普通玻璃采血管 静置培养 玻璃小珠。
117.本对比例与实施例2的区别仅在于,步骤(2)中,恒温振荡孵育替换为静置培养。
118.对比例3
119.无抗凝剂的普通玻璃采血管 静置培养 prp
120.本对比例与实施例3的区别仅在于,步骤(2)中,恒温振荡孵育替换为静置培养。
121.对比例4
122.无抗凝剂的普通玻璃采血管 静置培养 玻璃小珠 prp
123.本对比例与实施例4的区别仅在于,步骤(2)中,恒温振荡孵育替换为静置培养。
124.实施例5il-1ra含量测定
125.采用elisa试剂盒对实施例1-4,以及对比例1-4制备的血清中il-1ra的含量进行检测;以及采用elisa试剂盒对实施例3、4,以及对比例3-4制备的血清中prp含量进行测试。
126.图2为(实施例1和实施例3和对比例1、对比例3)不加玻璃珠的情况下比较振荡-静置,有prp-无prp的情形。
127.采血后就离心过滤得到的血清il-1ra检测值为94.58pg/ml,37℃静置24h后制备得到的血清il-1ra检测值为135.8pg/ml,37℃静置24h加prp后制备得到的血清il-1ra检测值为108.43pg/ml,单独的prp的il-1ra检测值为171.31pg/ml,即含量都非常低,接近于无。
128.37℃下120r/min摇床振荡24h后制备得到的血清il-1ra检测值为1683.13pg/ml,37℃下120r/min摇床振荡24h后加入prp制备得到的血清il-1ra检测值为1773.17pg/ml,证明摇床振荡的步骤可显著提高血清中il-1ra的含量;
129.图3为(实施例2和实施例4和对比例2、对比例4)加玻璃珠的情况下比较振荡-静置,有prp-无prp的情形。
130.同样的,采血后就离心过滤得到的血清il-1ra检测值为180.67pg/ml,单独的prp的il-1ra检测值为171.31pg/ml,即含量都非常低,接近于无。
131.现有技术加入玻璃珠后37℃静置24h制备得到的血清il-1ra检测值为4833.18pg/ml,在现有技术基础上加上120r/min摇床振荡24h后制备得到的血清il-1ra检测值为6640.64pg/ml,同样证明摇床振荡的步骤可显著提高血清中il-1ra的含量。
132.加入玻璃珠后37℃静置24h制备得到的含prp的血清il-1ra检测值为5351.19pg/ml,加入玻璃珠后37℃加上120r/min摇床振荡24h制备得到的含prp的血清il-1ra检测值为13157.65pg/ml,在玻璃珠、摇床振荡、prp三种促进因素的共同作用下,il-1ra的含量出现
巨大增长。
133.试验结果表明:
134.实施例1(无抗凝剂的普通玻璃采血管与新鲜血液混合,37℃摇床振荡24小时后,离心提取上层血清,用0.22μm无菌滤器过滤后)得到无玻璃溶解物残留的安全性更高的富含il-1ra的条件血清。
135.实施例3的方法制备的血清同时包含prp与il-1ra,能够同时达到修复组织损伤、恢复功能、治疗发炎和退化的功效的目的,且在同一个血样中完成prp和il-1ra的分离,操作简便,节约成本,使得prp和il-1ra得到充分富集;
136.实验采用elisa试剂盒检测il-1ra的含量,与用现有的含玻璃小珠的采血套装与新鲜血液混匀后37℃静置24h提取的富含细胞因子条件血清比较,富血小板因子条件血清一中,il-1ra含量由4833.2pg/ml提高到5351.2pg/ml;富血小板因子条件血清二中,il-1ra含量由6640.64pg/ml提高到13157.65pg/ml;il-1ra含量与空白对照n组和prp组比较均明显得到提高;如图2。与空白对照n血清组和单纯prp组比较,富血小板因子条件血清三中,il-1ra含量无明显变化;富血小板因子条件血清四中,il-1ra含量由1683.13pg/ml提高到1773.17pg/ml;il-1ra含量与空白对照n组和prp组比较均明显得到提高;如图3。
137.以上数据结果显示了本发明的优点,本发明制备的得到富血小板因子条件血清均可提高il-1ra的含量,其中富血小板因子条件血清二可很大程度提高il-1ra的含量;将静置的制备方法改为摇床可明显提高富血小板因子条件血清中il-1ra的含量,得到同时包含生长因子和il-1ra的富血小板因子条件血清。
138.以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。