1.本发明属于药物制剂领域,涉及一种包含固体分散体的蛋白酶抑制剂增效组合物,具体涉及一种包含利托那韦和式i所示化合物的药物组合物。本发明还提供了所述组合物的制备方法。
背景技术:
2.利托那韦,化学名为5-噻唑甲基[(αs)-α-[(1s,3s)-1-羟基-3-[(2s)-2-[3-[(2-异丙基-4-噻唑)甲基]-3-甲基脲]-3-甲基丁基酰胺]-4-苯基丁烷]苯乙基]氨基甲酸酯,其结构如下式所示,cas登记号为155213-67-5,分子式为c
37h48
n6o5s2,分子量为720.94。利托那韦是一种难溶于水的蛋白酶抑制剂,由于其强效的细胞色素p450异构体cyp3a抑制作用,也常被用作药动学增效剂。
[0003][0004]
由于利托那韦是难溶性药物,需采取合理的增溶手段,在增加其体内溶出后发挥药效。艾伯维(abbvie)公司以共聚维酮、司盘20和胶态二氧化硅为载体材料,采用先热熔挤出的方法制备固体分散体,再粉碎后与无水磷酸氢钙、胶态二氧化硅、硬脂富马酸钠等混合后进行压片包衣,制备了商品名为的利托那韦片,并于2010年经fda批准在美国上市。由于采用了固体分散体技术,所得的片剂相对于之前的自乳化胶囊和溶液剂具有携带方便,无需冷藏,无苦味等的优势。
[0005]
以利托那韦为药动学增效剂制成固定剂量的复方制剂有助于减少患者服药次数和单次服用的片数,这对于艾滋病等需终生服药的治疗方案来说具有明显的临床优势。经fda批准上市的含有利托那韦的复方片剂有洛匹那韦/利托那韦复方片(商品名)和阿扎那韦/利托那韦复方片等。其中,洛匹那韦/利托那韦复方片采用的是与单方利托那韦片类似的技术路线,即以共聚维酮、司盘20和胶态二氧化硅为载体材料,采用先热熔挤出制备固体分散体,再粉碎后与无水磷酸氢钙、胶态二氧化硅、硬脂酰富马酸钠等混合后压片的技术(参见中国发明专利申请200480024748.x)。
[0006]
asc09,化学名为(3r,3as,6ar)-六氢呋喃并[2,3-b]呋喃-3-基((2s,3r)-4-(2-((1-环戊烷基哌啶-4-基)胺基)-n-异丁基苯并[d]噻唑-6-磺酰胺基)-3-羟基-1-苯基丁烷-2-基)氨基甲酸酯水合物,其结构如式i所示,cas登记号为1000287-05-7,分子式为c
38h53
n5o7s2·
h2o,分子量为774.0,是一种hiv蛋白酶抑制剂,需与细胞色素p450异构体cyp3a抑制剂,如利托那韦合用发挥更好的体内效果。
[0007][0008]
多层片技术是复方片制备中常用的技术,多用于化学不相容或者溶出过程互相影响的多组分药物的物理隔离。多层片压制过程中,如果一层或者多层的物料可压性差,容易在较高压力下产生裂片或者裂片的趋势。裂片既可能在压片过程中发生,也可能在后续的包衣、运输以及长期存储过程中发生。在可压性差的物料层中,加入高比例的可压性良好的稀释剂有助于提高片剂的硬度。但对于剂量高的复方制剂来说,高比例稀释剂的加入会使得片重增加,导致患者产生吞咽不便的新困扰。降低压片力也有助于改善裂片的发生,但压片力的降低,也会产生脆碎度不合格等新问题。所以,对于高剂量的药物来说,很有必要在多层片压制过程中寻找到一种有效增加片剂硬度的辅料(不增加用量前提下),用以提高片剂硬度,降低多层片间裂片的发生。
[0009]
中国发明专利申请cn200480024748.x揭示了利托那韦、至少50℃玻璃化转变温度(tg)且以占剂型重量50%至85%的水溶性聚合物,hlb值在4~10的且以占剂型重量2%至20%的可药用非离子表面活性剂作为药效增强剂,特别是在增加另一种蛋白酶抑制剂洛匹那韦在血浆中的药物浓度的应用。其在说明书提及适宜的填充剂可选自乳糖、磷酸氢钙、微晶纤维素硅酸盐,尤其是二氧化硅、氧化镁、滑石粉、马铃薯淀粉或玉米淀粉、异麦芽糖(isomalt)、聚乙烯醇。该专利的说明书虽然提及“本发明的剂型可以包含几层的剂型来提供,例如层压片或多层片”,“多层剂型其优点在于可加工互不相容的两种活性组分,或者可控制活性成分的释放特性”,但未揭示多层片剂制备过程中的硬度或裂片方面的挑战。
[0010]
基于以上,当前亟需解决含利托那韦固体分散体的多层片,例如含利托那韦和asc09的多层片制备过程中出现的裂片问题。
技术实现要素:
[0011]
为了克服现有技术中利托那韦固体分散体在多层片压片过程中硬度不足,易发生裂片的缺陷,本发明的目的是提供一种药物组合物及其制备方法,其中以本发明的药物组合物制得的片剂或者片层的硬度大幅度增加,并且多层片的裂片现象大幅减少。进一步地,由于本发明所述的药物组合物的填充剂加入量较少,更有助于大剂量药物的片重和尺寸控制。本发明提供的药物组合物作为多层片能够显著提高片层硬度,进而降低多层片的裂片发生率。
[0012]
本发明的目的是通过以下技术方案实现的:
[0013]
一方面,本发明提供了一种包含利托那韦和式i所示化合物的药物组合物,其中所
述药物组合物为包括第一含药层和第二含药层的多层片;
[0014]
其中,所述第一含药层1包含:
[0015]
(a)1重量份利托那韦固体分散体;
[0016]
(b)0.1至0.2重量份多孔无水磷酸氢钙;
[0017]
(c)0.01至0.03重量份其他药学上可接受的辅料;
[0018]
所述第二含药层包含:
[0019]
(a)1重量份式i所示化合物;
[0020]
(b)0.17至1.10重量份药学上可接受的辅料;
[0021]
其中,所述利托那韦与式i所示化合物的重量比为1∶2~6;。
[0022]
任选地,所述第一含药层和第二含药层之间具有不含药物的空白层;
[0023][0024]
根据本发明所述的药物组合物,其中,在所述第一含药层中,所述利托那韦固体分散体包含利托那韦、共聚维酮、月桂山梨坦(司盘20)和胶态二氧化硅。优选地,所述利托那韦、共聚维酮、月桂山梨坦(司盘20)和胶态二氧化硅的重量比为1∶3~7∶0.5~0.8∶0.05~0.09;更优选地,所述利托那韦、共聚维酮、月桂山梨坦(司盘20)和胶态二氧化硅的重量比为1∶4~6∶0.6~0.7∶0.06~0.08。
[0025]
根据本发明所述的药物组合物,其中,在所述第一含药层中,所述利托那韦固体分散体由无定形利托那韦、不含溶剂的利托那韦晶体或利托那韦溶剂化物中的一种或者多种制备;优选地,所述利托那韦固体分散体由美国药典usp40所规定的利托那韦晶型ii制备;优选地,在所述利托那韦固体分散体中,利托那韦以非结晶态分散在利托那韦固体分散体中。
[0026]
根据本发明所述的药物组合物,其中,在所述第一含药层中,所述多孔无水磷酸氢钙为具有疏松多孔结构的无水磷酸氢钙颗粒。
[0027]
根据本发明所述的药物组合物,其中,在所述第一含药层中,所述多孔无水磷酸氢钙松密度小于0.5g/cm3,振实密度小于0.6g/cm3。
[0028]
根据本发明所述的药物组合物,其中,在所述第一含药层中,所述其他药学上可接受的辅料可以包含助流剂和/或润滑剂。其中,优选地,所述助流剂选自二氧化硅、硅酸镁铝和聚乙二醇中的一种或者多种;所述润滑剂选自硬脂富马酸钠、硬脂酸镁和滑石粉中的一种或者多种。更优选地,所述的助流剂为胶态二氧化硅,所述的润滑剂为硬脂富马酸钠。
[0029]
根据本发明所述的药物组合物,其中,在所述第二含药层中,所述式i所示化合物选自其无定形形式、不含溶剂的晶体或溶剂化物的晶体中的一种或者多种;优选地,所述式i所示化合物为含一个结晶水的晶体。
[0030]
根据本发明所述的药物组合物,其中,在所述第二含药层中,所述药学上可接受的辅料选自填充剂、崩解剂、粘合剂、助流剂和润滑剂的一种或多种。
[0031]
优选地,所述填充剂选自乳糖、甘露醇、磷酸氢钙、微晶纤维素、淀粉、预胶化淀粉、硅化微晶纤维素、乳糖淀粉复合物、乳糖纤维素复合物和甘露醇淀粉复合物中的一种或多种;更优选地,所述填充剂与式i所示化合物的重量比为0.15~0.9∶1。
[0032]
优选地,所述崩解剂选自交联羧甲基纤维素钠、交联聚乙烯吡咯烷酮、交联羧甲基淀粉钠和低取代羟丙基纤维素中的一种或多种;更优选地,所述崩解剂与式i所示化合物的重量比为0.016~0.25∶1。
[0033]
优选地,所述粘合剂选自羟丙甲纤维素、羟丙基纤维素、聚乙烯吡咯烷酮和共聚维酮的一种或多种;更优选地,所述粘合剂与式i所示化合物的重量比为0.03~0.06∶1。
[0034]
优选地,所述助流剂选自二氧化硅、硅酸镁铝和聚乙二醇的一种或多种;更优选地,所述助流剂与式i所示化合物的重量比为0.01~0.08∶1。
[0035]
优选地,所述润滑剂选自硬脂富马酸钠、硬脂酸镁和滑石粉的一种或多种;更优选地,所述润滑剂与式i所示化合物的重量比为0.01~0.06∶1。
[0036]
根据本发明所述的药物组合物,优选地,所述利托那韦与式i所示化合物的重量比为1∶3。
[0037]
根据本发明所述的药物组合物,其中,所述每片多层片含有100mg~600mg式i所示化合物;优选地,每片含有150mg~300mg式i所示化合物。
[0038]
根据本发明所述的药物组合物,还可以对其进行薄膜包衣,优选以包衣片形式给予患者服用。
[0039]
另一方面,本发明还提供了所述包含利托那韦和式i所示化合物的药物组合物的制备方法,所述制备方法包括以下步骤:
[0040]
(1)将所述重量份的利托那韦、共聚维酮和胶态二氧化硅混匀,再加入所述重量份的司盘20,热熔挤出制备所述利托那韦固体分散体;将所述利托那韦固体分散体粉碎,加入所述重量份的多孔无水磷酸氢钙和其他药学上可接受的辅料,混匀,作为第一含药层总混物料;
[0041]
(2)将所述重量份的式i所示化合物和药学上可接受的辅料混匀,作为第二含药层总混物料,或者将所述重量份的式i所示化合物和一部分药学上可接受的辅料制粒,再与剩余的药学上可接受的辅料混匀,作为第二含药层总混物料;
[0042]
(3)将所述第一含药层总混物料和第二含药层总混物料压制成双层片。
[0043]
再一方面,本发明提供的所述包含利托那韦固体分散体的药物组合物的包括以下步骤:
[0044]
(1)将所述重量份的利托那韦、共聚维酮和胶态二氧化硅混匀,再加入所述重量份的司盘20,热熔挤出制备所述利托那韦固体分散体;将所述利托那韦固体分散体粉碎,加入所述重量份的多孔无水磷酸氢钙和其他药学上可接受的辅料,混匀,作为第一含药层总混物料;
[0045]
(2)将所述重量份的式i所示化合物和药学上可接受的辅料混匀,作为第二含药层总混物料,或者将所述重量份的式i所示化合物和一部分药学上可接受的辅料制粒,再与剩余的药学上可接受的辅料混匀,作为第二含药层总混物料;
[0046]
(3)将一部分药学上可接受的辅料通过粉末直接混合、湿法制粒或干法制粒制,再与剩余的药学上可接受的辅料混匀,作为空白层总混物料。
[0047]
(4)将所述第一含药层总混物料、第二含药层总混物料和空白层总混物料压制成三层片。
[0048]
根据本发明的一个具体实施方案,所述包含利托那韦和式i所示化合物的药物组合物的制备方法包括以下步骤:
[0049]
(1)取所述重量份的利托那韦、共聚维酮和胶态二氧化硅过筛和混匀,将混合物用失重式饲料器以恒定的速度加入,取所述重量份的司盘20用蠕动泵泵至热熔挤出机液体加料口内,热熔挤出制备所述利托那韦固体分散体;将冷却后的所述利托那韦固体分散体粉碎,加入所述重量份的多孔无水磷酸氢钙(例如,)和其他药学上可接受的辅料,混匀,作为第一含药层总混物料;
[0050]
(2)取所述重量份的式i所示化合物和药学上可接受的辅料,混匀,作为第二含药层总混物料,或者取所述重量份的式i所示化合物和一部分药学上可接受的辅料制粒,再与剩余的药学上可接受的辅料混匀,作为第二含药层总混物料;优选地,所述制粒为湿法制粒或者干法制粒;
[0051]
(3)任选地,取一部分药学上可接受的辅料通过粉末直接混合、湿法制粒或干法制粒制,任选地加入另一部分药学上可接受辅料制得空白层总混物料;
[0052]
(4)将第一含药层总混物料和第二含药层总混物料压制成双层片,或将第一含药层总混物料、空白层总混物料和第二含药层总混物料压制成三层片。
[0053]
根据本发明所述的制备方法,还可以包括将所述多层片包衣的步骤。
[0054]
本发明所述的多层片可以直接给予患者服用,也可以经包衣后给予患者服用。
[0055]
本发明提供了所述的药物组合物在制备蛋白酶抑制剂(protease inhibitors,pis)类药物中的应用,包括式i所示化合物作为蛋白酶抑制剂,并且利托那韦作为药效增强剂的药效的应用,也包括式i所示化合物和利托那韦共同作为蛋白酶抑制剂协同发挥药效的应用。
[0056]
另一方面,本发明提供了所述的药物组合物在制备蛋白酶抑制剂类药物中的应用,既包括制备抗逆转录病毒(antiretroviral,arv)药物中的应用,也包括制备抗其他病毒药物或肿瘤治疗药物等中的应用。
[0057]
本发明的发明人通过长时间的摸索,意外发现多孔性无水磷酸氢钙在相对较低用量(如重量比低于20%),能显著提高片剂的硬度,更能极大缓解含有可压性差的刚性利托那韦固体分散体多片层间的裂片现象。也就是说含有多孔无水磷酸氢钙(例如)的利托那韦固体分散体片层与式i所述化合物层组成多层复方片剂能有效防止裂片现象的发生。
[0058]
本发明的突出优势在于:由于选用了多孔无水磷酸氢钙作为利托那韦层的填充剂,其相对其他无水磷酸氢钙能更有效提高利托那韦固体分散体片层的硬度。由于多孔无水磷酸氢钙(例如)的效果更好,使得达到相同硬度所需的填充剂用量大幅降低,有助于控制片剂的片重和尺寸,方便患者的吞服。此外,还使得多层片剂在压片过程中所需的压力更低,可有效避免本发明的药物组合物在压片、包衣、运输及储存过程中片层
之间裂片现象的发生。
[0059]
本发明采用多孔无水磷酸氢钙由于其独特的多孔结构,近年来其应用被逐步发现并拓展,并且超出了无水磷酸氢钙盐的普通应用,诸如其被用于液体药物的固化、提高活性菌的存活率、降低压片设备的磨损以及提高低剂量药物的混合均匀性等多个新领域。本发明的研究意外地发现,对于可压性刚性成分,特别是固体分散体粉末占比较多的片剂,比如利托那韦固体分散体压片而言,多孔无水磷酸氢钙作为填充剂具有突出的优势,即其在含利托那韦固体分散体的多层片中可以防止不同片层之间裂片的发生。
附图说明
[0060]
以下,结合附图来详细说明本发明的实施方案,其中:
[0061]
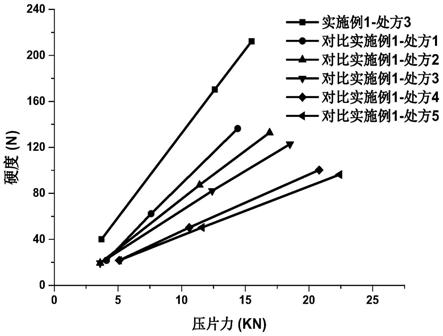
图1为按照实施例1的处方3,以及对比实施例1的处方1~5制备片剂时压片力和片剂硬度的关系;
[0062]
图2按照实施例1的处方3制备的片剂包衣后的外观。
[0063]
图3按照对比实施例1的处方3制备的片剂包衣后的外观。
具体实施方式
[0064]
为了更详细地说明本发明,下面将结合具体实施例对本发明进行进一步的详细说明,但本发明的范围并非局限于此。
[0065]
实施例1
[0066]
1.利托那韦层的处方组成:
[0067]
表1.利托那韦层的处方组成
[0068][0069]
*购自富士化学工业株式会社(fuji chemical industries co.,ltd),其制备方法可参见us5486365。
[0070]
2.利托那韦层的制备工艺:
[0071]
2.1原辅料预处理:以制剂技术的常规手段,对利托那韦原料药进行粉碎处理,使粒径及分布符合热熔挤出工艺的要求。对辅料进行过筛,去除贮存过程中可能的结块;
[0072]
2.2配料:按处方比例及批规模,称取热熔融挤出用原辅料;
[0073]
2.3混合:将配料完成的原辅料,以制剂常规手段混合均匀;
[0074]
2.4热熔融挤出:针对挤出机的不同区分别进行挤出温度的设置;待预热至设定温度后,保温至少15min,以失重式自动加料器加料的方式均匀加入混匀的原辅料,以预设的挤出速度挤出;通过调整挤出机筒不同区域的温度设置、螺杆转速和加料速度,将挤出模头温度控制在105℃~130℃之间,螺杆扭矩保持在稳定的范围内,挤出后物料呈透明状;
[0075]
2.5挤出物粉碎:以制剂技术的常规手段,对冷却后的挤出物进行粉碎;
[0076]
2.6总混:按处方比例,加入剩余的其他辅料,以制剂技术的常规混合手段对上述物料进行混合。
[0077]
3.asc09层的处方组成:
[0078]
表2.asc09层的处方组成
[0079][0080][0081]
4.asc09层的制备工艺:
[0082]
4.1原辅料预处理:以制剂技术的常规手段,对拟用于处方研究的原辅料进行过筛,去除贮存过程中可能的结块;
[0083]
4.2配料:按处方比例及批规模,称取制粒用原辅料;
[0084]
4.3混合:将配料完成的原辅料,以制剂常规手段混合均匀;
[0085]
4.4制粒:处方1采用粉末直混技术,混合后的物料直接用于压片;处方2~4物料采用干法制粒工艺,经辊压和粉碎后得到asc09颗粒;处方5物料采用湿法制粒工艺,由常规的高剪切制粒和流化床干燥制得asc09颗粒;
[0086]
4.5总混:处方2~5物料,以实际所得的颗粒重量折算,按比例加入外加的其他辅料,以制剂常规混合手段将上述物料混匀。
[0087]
5.空白层的处方和工艺:
[0088]
取等比例的硅化微晶纤维素(smcc50)和喷雾干燥直压乳糖(100),外加0.5%的硬脂富马酸钠,混匀,作为空白层辅料。
[0089]
6.压片、包衣和包装:
[0090]
如表3,在旋转式多层压片机中,按利托那韦层、空白层和asc09层的顺序进行多层片的压制。
[0091]
对压制所得的片剂,用胃溶型薄膜包衣预混剂(opadry13b150001-cn)
进行包衣,包衣增重2.5
±
0.5%(w/w)。
[0092]
取包衣后的片剂30片与1个干燥剂罐,一并装于带有安全盖的高密度聚乙烯瓶中,并用封口机铝箔封口。
[0093]
表3.实施例1的多层片的组成
[0094][0095]
对比实施例1
[0096]
1.利托那韦层的处方组成:
[0097]
取实施例1的处方3的利托那韦固体分散体粉末,670.0mg/份。在对比实施例1~5中,将实施例1的处方3中的外加辅料中的多孔无水磷酸氢钙更换成等量的常规无水磷酸氢钙或者其他填充剂。在对比实施例6中,将实施例1的处方3中的外加辅料中的多孔无水磷酸氢钙与利托那韦的固体分散体比例由0.13∶1提高至0.25∶1,并增加相应的胶态二氧化硅和硬酯富马酸钠的用量。
[0098]
对比实施例1的处方1~6所用的填充剂依次为:
①
德国布登海姆(budenheim)的a150型直压型无水磷酸氢钙;
②
美国斯百全(spectrum)的直压型(directly compress,用于直接压片)无水磷酸氢钙;
③
湖州展望公司的无水磷酸氢钙(普通级,用于制粒,也可用于直接压片);
④
法国罗盖特(roquette)公司的200sd直压型甘露醇;
⑤
德国美剂乐(meggle)公司的喷雾干燥直压型乳糖(100);
⑥
日本富士化学(fuji chemical)的多孔无水磷酸氢钙
[0099]
如表5所示,由于制备工艺不同,多孔性无水磷酸氢钙的松密度(bulk density)和振实密度(tap desntiy)小于其他类型的无水磷酸氢钙。
[0100]
表4.对比实施例1中的利托那韦层的处方组成
[0101][0102]
表5.不同来源的无水磷酸氢钙的松密度和振实密度
[0103][0104]
2.利托那韦层的制备工艺:
[0105]
1.利托那韦固体分散体的处方与实施例1的处方3完全一致;
[0106]
2.总混:按处方比例,加入已过筛处理后的外加其他辅料,以制剂技术的常规手段将上述物料混匀。
[0107]
3.asc09层的处方组成和制备工艺:
[0108]
与实施例1的处方3保持一致。
[0109]
4.空白层的处方和工艺:
[0110]
与实施例1的处方3保持一致,为双层片,只含利托那韦层和asc09层,不含空白层。
[0111]
5.压片、包衣和包装:
[0112]
与实施例1的处方3保持一致。
[0113]
效果实施例1
[0114]
因为压制成多层片后,片剂的硬度由多层因素叠加,难以横向比较。故取实施例1的处方3及其工艺制备的利托那韦层总混物料、对比实施例1~5及其工艺制备的利托那韦层总混物料,分别进行压片,比较压片压力与所得片剂硬度之间的关系。
[0115]
上述6组利托那韦层的总混物料具有完全一致的利托那韦固体分散体、外加的胶态二氧化硅,以及外加的硬酯富马酸钠。利托那韦总混物料的可压性还与利托那韦固体分散体粉碎后的粒径有关,为了便于比较,上述6组利托那韦固体分散体采用的是同一批挤出粉碎后的固体分散体粉末。其粒径测定结果如表6所示。
[0116]
表6.利托那韦固体分散体的粒径分布
[0117]
粒径范围百分比(w/w)》18目(》1.0mm)0.0%18目~35目(1.0mm~0.5mm)6.6%35目~50目(0.5mm~0.3mm)20.6%50目~70目(0.3mm~0.2mm)22.9%70目~140目(0.2mm~0.1mm)27.6%《140目(《0.1mm)22.3%
[0118]
分别取低压片力(3.6kn~5.1kn),中压片力(7.6kn~12.6kn)和高压片力(14.4kn~22.4kn)的片剂6片,测定每片实际压片力和硬度,取平均值,将压力硬度曲线进行线性回归,结果如表7和图1所示。
[0119]
由该结果可知:无水磷酸氢钙相对甘露醇和乳糖能显著改善利托那韦固体分散体片剂/片层的硬度。多孔无水磷酸氢钙能更进一步增加片剂硬度,与对比实施例中具有最高硬度的布登海姆公司的a150型无水磷酸氢钙组相比,在相等压力条件下,能提高硬度至少30%。
[0120]
效果实施例2
[0121]
按实施例1的处方1~5、对比实施例1的处方1~6的处方和工艺进行多层片的压制。因为剂量和处方不同,取最终得到硬度为200n~300n的片剂进行对比。
[0122]
压片:按实施例1的处方1~5和对比实施例1的处方6压制片剂,得到200n~300n硬度的片剂,仅需主压力25kn~40kn。所有片剂均未发现有裂片的发生。按对比实施例1的处方1~5压制得到200n~300n硬度以上的片剂,需要主压力在40kn~50kn。而且,发现随着压片的增大,特别是压力大于45kn后,对比实施例1的处方1~5均会有裂片现象的发生。
[0123]
将按实施例1的处方1~5压制的多层片、对比实施例1的处方1~5处方工艺压制的片剂(选取未发生裂片的)以常规的包衣参数进行胃溶型薄膜包衣预混剂(opadry 13b150001-cn)包衣,包衣增重2.5
±
0.5%(w/w)。结果发现,按实施例1的处方1~5压制的多层片均未发现有裂片的发生,而按对比实施例1的处方1~5则均有不同比例的裂片现象的发生。典型的包衣后的片剂外观如图2和图3所示,其中图2为实施例1处方3的片剂包衣之后的外观,图3为对比实施例1处方3片剂包衣之后的外观。
[0124]
将按对比实施例1的处方6压制的多层片以常规的包衣参数进行胃溶型薄膜包衣
预混剂(opadry 13b150001-cn)包衣,包衣增重2.5
±
0.5%(w/w)。压片和包衣结果也未发现有裂片现象的发生。按实施例1的处方3压片和包衣后的片剂的最终片重为1292mg(按包衣增重2.5%计)。按对比实施例1的处方6压片和包衣后的片剂最终片重为1377mg(按包衣增重2.5%计)。考虑到两者在压片和包衣过程中均未发现有明显的裂片或者裂片趋势,而在对比实施例1的处方6中,由于多孔无水磷酸氢钙比例提高,反而因为更庞大的片剂尺寸使得患者吞咽更加困难。
[0125]
表7.不同填充剂对利托那韦层硬度的影响
[0126][0127]
虽然以上仅描述了本发明的具体实施方式的范例,但本领域的技术人员应当理解,以上这些仅为举例说明,本发明的保护范围是由所附权利要求书限定的。本领域的技术人员在不背离本发明的原理和实质的前提下,可以对这些实施方式做出多种变更或修改,但这些变更或修改均应落入本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。