唾液酸化糖蛋白
1.优先权要求
2.本技术要求2019年4月18日提交的美国临时申请序列号62/836,016的权益。上述临时申请的全部内容以引用方式并入本文。
背景技术:
3.静脉内免疫球蛋白(ivig)由人供体的合并血浆(例如,来自至少1,000个供体的合并血浆)制备,并且虽然绝大多数由igg抗体(主要是igg1抗体)组成,但ivig也可含有痕量的其他抗体亚类。可商购获得的ivig制剂通常在所存在的抗体的fc结构域上表现出低水平的唾液酸化。具体地讲,商业ivig制剂中的抗体在fc区上表现出支链聚糖的低水平二唾液酸化。
技术实现要素:
4.本文描述了包含高度唾液酸化免疫球蛋白(hsigg)的药物组合物。hsigg在免疫球蛋白的fc区上的支链聚糖上具有非常高水平的唾液酸,例如,免疫球蛋白fc区上至少50%(60%、70%、80%、90%或更多)的支链聚糖经由支链聚糖α1,3臂和α1,6臂两者上的neuac
‑
α2,6
‑
gal末端键进行唾液酸化。
5.本文所述的药物组合物提供药学上可接受的hsigg组合物,该组合物对剪切应力是稳定的(例如,当制剂经受剪切应力,例如在运输期间搅拌时,不形成大量的亚可见颗粒),因此可以液体形式运输和处理。制剂在稀释时也是稳定的,例如,在5%右旋糖中稀释以用于静脉内施用。制剂在例如5℃下稳定至少7个月,并且在25℃下稳定至少一个月,在2℃
‑
8℃下稳定两年,并且/或者在15℃
‑
30℃下稳定两周。
6.本文描述了包含在250mm甘氨酸0.02%(w/v)聚山梨酸酯20(ph 4
‑
7)中的免疫球蛋白的液体药物组合物,其中免疫球蛋白的fc区上至少50%的支链聚糖通过neuac
‑
α2,6
‑
gal末端键进行二唾液酸化。
7.在各种实施方案中:免疫球蛋白的浓度为50mg/ml
‑
250mg/ml;免疫球蛋白的浓度为70mg/ml
‑
130mg/ml;免疫球蛋白的浓度为80mg/ml
‑
120mg/ml;免疫球蛋白的浓度为90mg/ml
‑
110mg/ml;免疫球蛋白的fc区上至少60%、70%、80%、90%或95%的支链聚糖通过neuac
‑
α2,6
‑
gal末端键进行二唾液酸化;免疫球蛋白上至少60%、70%、80%、90%或95%的支链聚糖通过neuac
‑
α2,6
‑
gal末端键进行二唾液酸化;免疫球蛋白的fab区上至少60%、70%、80%、90%或95%的支链聚糖通过neuac
‑
α2,6
‑
gal末端键进行二唾液酸化;至少90%的免疫球蛋白为igg免疫球蛋白;至少95%的免疫球蛋白为igg免疫球蛋白;5%
‑
20%的免疫球蛋白为二聚体;5%
‑
10%的免疫球蛋白为二聚体;至少80%的免疫球蛋白为单体或二聚体;至少85%的免疫球蛋白为单体或二聚体;至少90%的免疫球蛋白为单体或二聚体,5%
‑
20%的igg免疫球蛋白为二聚体;5%
‑
10%的igg免疫球蛋白为二聚体;至少80%的igg免疫球蛋白为单体或二聚体;至少85%的igg免疫球蛋白为单体或二聚体;至少90%的igg免疫球蛋白为单体或二聚体;igg免疫球蛋白的fc区上至少60%、70%、80%、90%或95%的
支链聚糖通过neuac
‑
α2,6
‑
gal末端键进行二唾液酸化;igg免疫球蛋白上至少60%、70%、80%、90%或95%的支链聚糖通过neuac
‑
α2,6
‑
gal末端键进行二唾液酸化;igg免疫球蛋白的fab区上至少60%、70%、80%、90%或95%的支链聚糖通过neuac
‑
α2,6
‑
gal末端键进行二唾液酸化;ph为4.7
‑
5.5;ph为5.1
–
5.3;在2℃
‑
8℃下以1000rpm搅拌8小时之后,该组合物具有少于1000个直径介于10微米和100微米之间的颗粒;在2℃
‑
8℃下以1000rpm搅拌8小时之后,该组合物具有少于500个直径介于10微米和100微米之间的颗粒;在2℃
‑
8℃下以1000rpm搅拌8小时之后,该组合物具有少于200个直径介于10微米和100微米之间的颗粒;在4℃下储存3、4、6、8、10、12、14、16、18、20、22或24个月之后,免疫球蛋白的fc区上至少60%、70%、80%、90%或95%的支链聚糖通过neuac
‑
α2,6
‑
gal末端键进行二唾液酸化;在4℃下储存3、4、6、8、10、12、14、16、18、20、22或24个月之后,免疫球蛋白上至少60%、70%、80%、90%或95%的支链聚糖通过neuac
‑
α2,6
‑
gal末端键进行二唾液酸化;在4℃下储存3、4、6、8、10、12、14、16、18、20、22或24个月之后,免疫球蛋白的fab区上至少60%、70%、80%、90%或95%的支链聚糖通过neuac
‑
α2,6
‑
gal末端键进行二唾液酸化;在4℃下储存3、4、6、8、10、12、14、16、18、20、22或24个月之后,5%
‑
10%的免疫球蛋白为二聚体;在4℃下储存3、4、6、8、10、12、14、16、18、20、22或24个月之后,至少85%的免疫球蛋白为单体或二聚体;在4℃下储存3、4、6、8、10、12、14、16、18、20、22或24个月之后,至少90%的免疫球蛋白为单体或二聚体;储存是在密封的美国药典1型玻璃小瓶中;储存是在密封的2r1型玻璃注射小瓶中。
8.在hsigg中,免疫球蛋白的fc区上至少50%(例如,60%、70%、80%、82%、85%、87%、90%、92%、94%、95%、97%、98%至多100%且包括100%)的支链聚糖在α1,3臂和α1,6臂两者上具有唾液酸残基(即,通过neuac
‑
α2,6
‑
gal末端键进行二唾液酸化)。在一些实施方案中,除了fc唾液酸化之外,fab区上至少50%(例如,60%、70%、80%、82%、85%、87%、90%、92%、94%、95%、97%、98%或至多100%且包括100%)的支链聚糖通过neuac
‑
α2,6
‑
gal末端键进行二唾液酸化。在一些情况下,至少85%(87%、90%、92%、94%、95%、97%、98%或至多100%且包括100%)的总支链聚糖(fc结构域和fab结构域上的聚糖的总和)通过neuac
‑
α2,6
‑
gal末端键进行二唾液酸化。在一些实施方案中,fc区上少于50%(例如,少于40%、30%、20%、15%、10%、5%、4%、3%、2%、1%)的支链聚糖通过neuac
‑
α2,6
‑
gal末端键进行单唾液酸化(例如,仅在α1,3臂或α1,6臂上唾液酸化)。免疫球蛋白是主要为igg抗体的hsigg制剂(例如,至少80重量%、85重量%、90重量%、95重量%的免疫球蛋白是各种同种型的igg抗体)。
9.如本文所用,术语“fc区”是指两个“fc多肽”的二聚体,每个“fc多肽”包含除ch1结构域之外的抗体恒定区。在一些实施方案中,“fc区”包括通过一个或多个二硫键、化学接头或肽接头连接的两个fc多肽。“fc多肽”是指iga、igd和igg的最后两个恒定区免疫球蛋白结构域,以及ige和igm的最后三个恒定区免疫球蛋白结构域,并且还可包括这些结构域的柔性铰链n
‑
末端的部分或全部。
10.如本文所用,“聚糖”是糖,其可以是糖残基的单体或聚合物,诸如至少三种糖,并且可以是直链或支链的。“聚糖”可包括天然糖残基(例如,葡萄糖、n
‑
乙酰葡糖胺、n
‑
乙酰神经氨酸、半乳糖、甘露糖、岩藻糖、己糖、阿拉伯糖、核糖、木糖等)和/或改性糖(例如,2'
‑
氟核糖、2'
‑
脱氧核糖、磷酸甘露糖、6'磺基n
‑
乙酰葡糖胺等)。术语“聚糖”包括糖残基的均聚物和杂聚物。术语“聚糖”还涵盖糖缀合物(例如多肽、糖脂、蛋白聚糖等)的聚糖组分。该术
语还涵盖游离聚糖,包括已从糖缀合物裂解或以其他方式释放的聚糖。
11.如本文所用,术语“糖蛋白类”是指含有共价连接到一个或多个糖部分(即,聚糖)的肽主链的蛋白质。糖部分可为单糖、二糖、低聚糖和/或多糖的形式。糖部分可包含糖残基的单条非支链,或者可包含一条或多条支链。糖蛋白可包含o连接的糖部分和/或n连接的糖部分。
12.ivig是从至少1,000个人供体的血浆中提取的合并的多价免疫球蛋白(包括所有四种igg同种型)的制备。批准用于美国的ivig的形式包括gammagard(baxter healthcare corporation)、gammaplex(bio products laboratory)、bivigam(biotest pharmaceuticals corporation)、carimmunenf(csl behring ag)、gamunes
‑
c(grifols therapeutics,inc.)、glebogamma did(instituto grifols,sa)和octagam(octapharma pharmazeutika produktionsges mbh)。ivig被批准用于免疫缺陷患者和其他用途的血浆蛋白替代疗法。ivig fc聚糖唾液酸化的水平在ivig制剂之间有所不同,但通常小于20%。二唾液酸化水平通常低得多。
13.如本文所用,“fc多肽的n
‑
糖基化位点”是指聚糖与之n
‑
连接的fc多肽内的氨基酸残基。在一些实施方案中,fc区包含fc多肽的二聚体,并且fc区包含两个n
‑
糖基化位点,每个fc多肽上一个。
14.如本文所用,“支链聚糖的百分比(%)”是指聚糖x相对于所存在的聚糖总摩尔数的摩尔数,其中x表示感兴趣的聚糖。
15.术语“药物有效量”或“治疗有效量”是指在治疗患有本文所述的疾病或病症的患者有效的量(例如,剂量)。本文还应当理解,“药物有效量”可解释为赋予所需治疗效果的量,以单剂量或任何剂量或途径单独服用或与其他治疗剂组合服用。
[0016]“药物制剂”和“药物产品”可包括在含有该制剂或产品以及使用说明的试剂盒中。
[0017]“药物制剂”和“药物产品”通常是指其中已经实现最终预定水平的唾液酸化并且不含工艺杂质的组合物。为此,“药物制剂”和“药物产品”基本上不含st6gal唾液酸转移酶和/或唾液酸供体(例如,胞苷5'
‑
单磷酸
‑
n
‑
乙酰神经氨酸)或其副产物(例如,胞苷5'
‑
单磷酸)。
[0018]“药物制剂”和“药物产品”通常基本上不含其中产生糖蛋白的细胞的其他组分(例如内质网或细胞质蛋白和rna,如果是重组的话)。
[0019]
所谓“纯化的”(或“分离的”)是指多核苷酸或多肽从存在于其天然环境中的其他组分中去除或分离。例如,分离的多肽是与产生其的细胞的其他组分(例如,内质网或细胞质蛋白和rna)分离的多肽。分离的多核苷酸是与其他核组分(例如,组蛋白)和/或与上游或下游核酸分离的多核苷酸。分离的多核苷酸或多肽可至少60%不含、或至少75%不含、或至少90%不含、或至少95%不含所指出的多核苷酸或多肽的天然环境中存在的其他组分。
[0020]
如本文所用,术语“唾液酸化”是指具有末端唾液酸的聚糖。术语“单唾液酸化”是指例如在α1,3臂或α1,6臂上具有一个末端唾液酸的支链聚糖。术语“二唾液酸化”是指在两个臂(例如α1,3臂和α1,6臂两者)上具有末端唾液酸的支链聚糖。
附图说明
[0021]
图1示意性地描绘了支链聚糖的示例。浅圆为gal;黑圆为man;三角形为fuc,菱形
为nana;正方形为glcnac。
[0022]
图2左图:将合并的免疫球蛋白转化成hsigg的酶促唾液酸化反应的示意图。右图:起始ivig和由ivig酶促制备的hsigg的igg fc聚糖谱。经由糖肽质谱分析得出不同igg亚类的聚糖谱。用于定量不同igg亚类的糖肽的肽序列为:igg1=eeqynstyr、igg2/3eeqfnstfr、igg3/4eeqynstfr和eeqfnstyr。
[0023]
图3描绘了已经受剪切应力的用于ivig的常规制剂中的hsigg的小瓶。
[0024]
图4描绘了已经受剪切应力的本公开制剂中的hsigg的小瓶。
具体实施方式
[0025]
免疫球蛋白在其重链恒定区中的保守位置处糖基化。例如,人igg在ch2结构域的asn297处具有单个n连接的糖基化位点。每种免疫球蛋白型在恒定区中具有不同种类的n
‑
连接的碳水化合物结构。对于人igg,核心低聚糖通常由具有不同数目的外部残基的glcnac2man3glcnac组成。各个igg之间的差异可经由半乳糖和/或半乳糖
‑
唾液酸在一个或两个末端glcnac处的连接或经由第三glcnac臂的连接(平分glcnac)而发生。
[0026]
本公开部分地涵盖包括具有fc区的合并的人免疫球蛋白的药物制剂,该fc区具有特定水平的支链聚糖,该支链聚糖在fc区中的两个支链聚糖上唾液酸化(例如,通过neuac
‑
α2,6
‑
gal末端键)。
[0027]
合并的多价人免疫球蛋白的制剂,包括ivig制剂,是高度复杂的,因为它们在几个方面是高度异质的。它们包括从数百个或超过1000个个体合并的免疫球蛋白。虽然至少约90%或95%的免疫球蛋白是igg同种型(在所有亚类中),但也存在其他同种型,包括iga和igm。ivig中的免疫球蛋白和合并的多价人免疫球蛋白的制备在特异性和糖基化模式方面均有差别。
[0028]
合并的多价免疫球蛋白的高度唾液酸化改变了存在于免疫球蛋白上的聚糖。对于一些聚糖,改变需要添加一个或多个半乳糖分子以及添加一个或多个唾液酸分子。对于其他聚糖,该改变仅需要添加一个或多个唾液酸分子。此外,虽然基本上所有igg抗体(即合并的多价免疫球蛋白制剂中的主要免疫球蛋白)在每个形成fc区的多肽上具有糖基化位点,但并非所有igg抗体都在fab结构域上具有糖基化位点。改变免疫球蛋白制剂的糖基化改变了制剂中单独免疫球蛋白的结构和活性,并且重要的是,改变了单独免疫球蛋白之间的相互作用以及免疫球蛋白制剂的整体行为。
[0029]
广泛使用的用于ivig制剂的制剂完全不适用于高度唾液酸化免疫球蛋白(hsigg)的药物制剂,这至少是因为该制剂在用于hsigg时对药物制剂正常运输中发生的剪切应力不稳定。当经受这种类型的剪切应力时,在hsigg制剂中形成亚可见颗粒。已知的是,抗体制剂中的此类亚可见颗粒可在注射部位处引起严重不良事件并导致靶免疫应答。抗体制剂中的亚可见颗粒还可激活补体系统、引起栓塞和其他阴性免疫原性反应。据发现,添加非离子表面活性剂使得hsigg制剂对剪切应力更稳定,并且大大减少了亚可见颗粒的形成。
[0030]
可用于制备hsigg的天然来源多肽包括例如从合并的人血清分离的免疫球蛋白。hsigg也可由ivig和来源于ivig的多肽制备。hsigg可如wo2014/179601中所述制备。hsigg的制备还描述于washburn等人(proc natl acad sci usa.,2015年3月17日;112(11):e1297
‑
306)中。hsigg制剂中的唾液酸化水平可在fc结构域上测量(例如,在fc结构域中的
支链聚糖的α1,3臂、α1,6臂或两者上唾液酸化的支链聚糖的数量),或总体唾液酸化上测量(例如,在多肽制备中无论在fc结构域还是fab结构域上在支链聚糖的α1,3臂、α1,6臂或两者上唾液酸化的支链聚糖的数量或百分比)。
[0031]
在一些情况下,用作制备hsigg的免疫球蛋白来源的合并血清是从特定的个体群体中分离出来的,例如产生对抗一种或多种病毒(诸如covid
‑
19、sars、副流感、流行性感冒病毒)的抗体但不具有活性感染的个体。在一些情况下,免疫球蛋白是从其中大于50%、55%、60%、75%产生针对所选病毒的抗体的个体群体分离的。
[0032]
将n连接的低聚糖链添加到内质网的内腔中的蛋白质。具体地,将初始低聚糖(通常为14
‑
糖)添加至asn
‑
x
‑
ser/thr的靶共有序列内包含的天冬酰胺残基的侧链上的氨基,其中x可以是除脯氨酸之外的任何氨基酸。该初始低聚糖的结构是大多数真核生物共有的,并且含有三个葡萄糖残基、九个甘露糖残基和两个n
‑
乙酰葡糖胺残基。该初始低聚糖链可被内质网中的特定糖苷酶修剪,从而得到由两个n
‑
乙酰葡糖胺残基和三个甘露糖残基构成的短支链核心低聚糖。分支之一在本领域中被称为“α1,3臂”,并且第二分支被称为“α1,6臂”,如图1所示。
[0033]
n
‑
聚糖可细分成被称为“高甘露糖型”、“杂合型”和“复杂型”的三个不同组,其中在所有三个组中出现共同的五糖核心(man(α1,6)
‑
(man(α1,3))
‑
man(β1,4)
‑
glcpnac(β1,4)
‑
glcpnac(β1,n)
‑
asn)。
[0034]
在内质网中进行初始加工后,多肽被转运到高尔基体,在此可进行进一步加工。如果在将聚糖完全修剪成核心五糖结构之前将聚糖转移到高尔基体,则得到“高甘露糖聚糖”。
[0035]
除此之外或另选地,可将n
‑
乙酰葡糖胺的一个或多个单糖单元添加至核心甘露糖亚基以形成“复杂聚糖”。可将半乳糖添加至n
‑
乙酰葡糖胺亚基,并且可将唾液酸亚基添加至半乳糖亚基,从而得到以唾液酸、半乳糖或n
‑
乙酰葡糖胺残基中的任一者封端的链。另外,可将岩藻糖残基添加至核心低聚糖的n
‑
乙酰葡糖胺残基。这些添加中的每一者均由特定糖基转移酶催化。
[0036]“杂合聚糖”包含高甘露糖和复杂聚糖两者的特征。例如,杂合聚糖的一个分支可主要包含或仅包含甘露糖残基,而另一个分支可包含n
‑
乙酰葡糖胺、唾液酸、半乳糖和/或岩藻糖。
[0037]
唾液酸是具有杂环结构的9碳单糖家族。它们经由连接到环的羧酸基团以及包括n
‑
乙酰基和n
‑
乙醇酰基基团在内的其他化学修饰而带有负电荷。存在于哺乳动物表达系统中产生的多肽中的两种主要类型的唾液酸残基是n
‑
乙酰神经氨酸(neuac)和n
‑
羟乙酰神经氨酸(neugc)。它们通常作为在n
‑
连接的聚糖和o
‑
连接的聚糖两者的非还原末端处附接到半乳糖(gal)残基的末端结构出现。这些唾液酸基团的糖苷键构型可为α2,3或α2,6。
[0038]
fc区在保守的n连接糖基化位点处被糖基化。例如,igg抗体的每条重链在c
h
2结构域的asn297处具有单个n连接糖基化位点。iga抗体在c
h
2和c
h
3结构域内具有n连接的糖基化位点,ige抗体在c
h
3结构域内具有n连接的糖基化位点,并且igm抗体在c
h
1、c
h
2、c
h
3和c
h
4结构域内具有n连接的糖基化位点。
[0039]
每种抗体同种型在恒定区中具有不同种类的n
‑
连接的碳水化合物结构。例如,igg在fc区的每个fc多肽中在c
h
2结构域的asn297处具有单个n连接的双分枝碳水化合物,其还
包含c1q和fcγr的结合位点。对于人igg,核心低聚糖通常由具有不同数目的外部残基的glcnac2man3glcnac组成。各个igg之间的差异可经由半乳糖和/或半乳糖
‑
唾液酸在一个或两个末端glcnac处的连接或经由第三glcnac臂的连接(平分glcnac)而发生。可使用本领域已知的任何方法评估多肽的聚糖。例如,聚糖组合物的唾液酸化(例如,在α1,3臂和/或α1,6臂上唾液酸化的支链聚糖的水平)可使用wo2014/179601中所述的方法来表征。
[0040]
除了抗体单体之外,含有hsigg的组合物还可包括抗体的二聚体和聚集体。在一些情况下,ph可用于调节组合物中的单体、二聚体和聚集体百分比,如通过尺寸排阻色谱法以重量%纯度所测量的。在一些情况下,降低ph增加了溶液中单体 二聚体的重量%。在一些情况下,降低ph增加了溶液中单体的重量%。在一些情况下,增加ph降低了溶液中的单体%。在一些情况下,聚集体的重量%小于或等于3.0重量%(例如,小于或等于2.7重量%、2.5重量%、2.3重量%、2.0重量%、1.7重量%、1.5重量%、1.3重量%、1.0重量%、0.9重量%、0.8重量%、0.7重量%、0.6重量%、0.5重量%、0.4重量%、0.3重量%、0.2重量%或0.1重量%)。在一些情况下,单体 二聚体的重量%大于或等于97.0重量%(例如,大于或等于98重量%或99重量%)。在一些情况下,单体的重量%大于或等于80重量%、83重量%、85重量%或87重量%。在一些情况下,ph小于或等于5.3(例如,小于或等于5.2、5.1、5.0、4.9、4.8、4.7、4.6、4.5、4.4、4.3、4.2、4.1或4.0)。在一些情况下,调节药物组合物的ph,使得单体的重量%改变。在一些情况下,降低药物组合物的ph,使得单体的重量%增加。在一些情况下,增加药物组合物的ph,使得二聚体的重量%增加。在一些情况下,ph使得单体重量%大于或等于90重量%(例如,大于或等于91重量%、92重量%、93重量%、94重量%、95重量%、96重量%、97重量%、98重量%或99重量%)。
[0041]
在以下实施例中进一步描述本发明,实施例不限制权利要求中描述的本发明的范围。
[0042]
实施例1:250mm甘氨酸中配制的高度唾液酸化igg
[0043]
其中超过60%的支链fc区聚糖被二唾液酸化的高度唾液酸化igg通常如wo2014/179601中所述制备。
[0044]
简而言之,将ivig暴露于使用β1,4半乳糖基转移酶1(b4
‑
galt)和α2,6
‑
唾液酸转移酶(st6
‑
gal1)的一锅顺序酶促反应。半乳糖基转移酶选择性地将半乳糖残基添加到ivig中预先存在的天冬酰胺连接的聚糖。所得的半乳糖基化聚糖用作唾液酸转移酶的底物,其选择性地添加唾液酸残基以封端连接到ivig的天冬酰胺连接的聚糖结构。因此,总体唾液酸化反应采用两个糖核苷酸(udpgal和cmp
‑
nana)。定期补充后者以相对于单唾液酸化产物增加二唾液酸化产物。该反应包括辅因子氯化锰。
[0045]
起始ivig和反应产物的对应igg
‑
fc聚糖特征图的代表性示例在图1的右图中示出。聚糖数据按igg亚类示出。来自igg3和igg4亚类的聚糖不能单独定量。如所示,对于ivig,所有未唾液酸化聚糖的总和大于80%,并且所有唾液酸化聚糖的总和小于20%。对于反应产物,所有未唾液酸化聚糖的总和小于20%,并且所有唾液酸化聚糖的总和大于80%。糖型中列出的不同聚糖的命名使用n连接的聚糖的oxford符号。
[0046]
未高度唾液酸化的ivig(包括商购的ivig)通常在甘氨酸中稳定,并且当例如在运输期间搅拌时通常不会形成亚可见颗粒。因此,在250mm甘氨酸中以109mg/ml制备初始高度唾液酸化igg(hsivig)制剂。ph为4.7
–
5.5。制剂为澄清至乳白色、无色至浅黄色的溶液。在
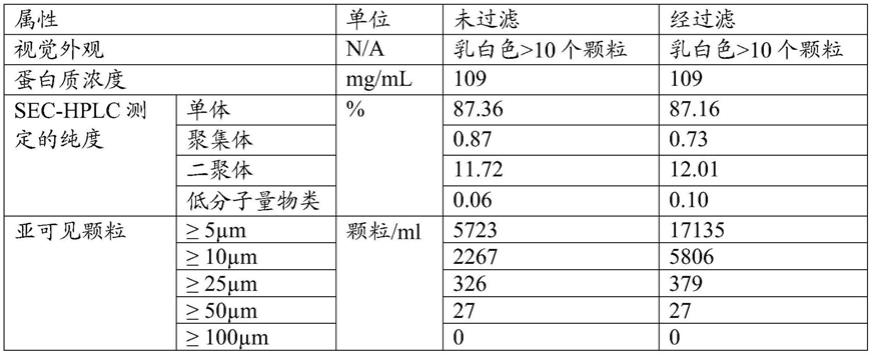
通过0.2微米pes滤膜过滤到petg容器中之后,还检查该制剂。表1提供了该高度唾液酸化的igg制剂在过滤前和过滤后的特性。仅甘氨酸的制剂似乎在过滤前和过滤后均具有可接受的产品特性。
[0047]
表1:250mm甘氨酸中hsigg的特性(ph为4.7
–
5.5)
[0048][0049]
对250mm甘氨酸(ph为4.7
–
5.5)制剂的进一步研究表明,hsigg经受搅拌应力。将过滤后的样品转移到玻璃小瓶中,在冷藏温度(2℃
‑
8℃)条件下以1000rpm摇动至多8小时。在搅拌之前以及在搅拌后4小时和8小时之后测试样品。从图3中的照片可以看出,搅拌导致形成使溶液浑浊的亚可见颗粒。据发现,250mm(ph为4.7
–
5.5)制剂即使在乘客室中通过飞机运输也变得浑浊,这表明制剂在分配给医疗保健提供者和患者期间将形成亚可见颗粒。亚可见颗粒可在注射部位处引起严重不良事件并导致靶免疫应答。亚可见颗粒还可激活补体系统、引起栓塞和其他阴性免疫原性反应。因此,重要的是设计稳定并且在搅拌时不会形成亚可见颗粒的制剂。
[0050]
实施例2:hsigg的稳定制剂
[0051]
进行了一项研究以开发对搅拌应力稳定但仍保留250mm甘氨酸制剂中存在的所需产品属性的hsivig制剂。
[0052]
发现低浓度的聚山梨酸酯20(2
‑
[2
‑
[3,4
‑
双(2
‑
羟基乙氧基)氧杂环戊烷
‑2‑
基]
‑2‑
(2
‑
羟基乙氧基)乙氧基]乙基十二酸酯;聚氧乙烯(20)脱水山梨糖醇单月桂酸酯)改善了hsigg制剂承受搅拌应力的能力,同时保持所需的产品特性。值得注意的是,该非离子表面活性剂的存在未有意义地改变抗体单体、二聚体和更高级的聚集体的相对量。
[0053]
表2:250mm甘氨酸/0.02%聚山梨酸酯20(ph4.7
–
5.5)中hsigg的特性
[0054][0055]
将过滤后的250mm甘氨酸/0.02%聚山梨酸酯20(ph 4.7
‑
5.5)制剂的样品转移到玻璃小瓶中,在冷藏温度(2
‑
8℃)条件下以1000rpm摇动至多8小时。在搅拌之前以及在搅拌后4小时和8小时之后测试样品。从图4中的照片可以看出,制剂对搅拌应力是稳定的。
[0056]
下表3提供了两种制剂在搅拌应力之前和之后的产品属性的信息。可以看出,0.02%聚山梨酸酯的添加大大改善了搅拌稳定性,但未改变单体/二聚体比率。0.02%聚山梨酸酯20的添加在暴露于搅拌应力之前或之后没有显著的蛋白质浓度或单体、二聚体、聚集体和低分子量类百分比。
[0057]
与初始制剂相比,在含聚山梨酸酯20的制剂中观察到显著更低的亚可见颗粒浓度。在暴露于搅拌应力(4小时和8小时)之后,观察到两种制剂与它们相应的无应力条件相比相当的颗粒浓度。
[0058]
表3:搅拌应力对稳定性的影响
[0059][0060]
实施例3:5%右旋糖注射液稀释的影响
[0061]
为了制备用于施用给患者的hsigg,将浓缩的hsigg制剂通过两个0.2微米pes滤膜无菌过滤到预灭菌的usp1型玻璃小瓶中,以形成药物产品。将小瓶运输到临床部位以在制造的72小时内(从过滤时间开始)给药。在临床部位,使用iv袋中的5%葡萄糖注射液usp将药物产品(100mg/ml)稀释至60mg/ml,然后给药。使用具有任选的0.2微米内联过滤器的标准注入管线和系统将稀释产品施用给患者。
[0062]
为了成功,通过这些步骤制剂必须稳定,包括在5%葡萄糖注射液(usp)中稀释。
[0063]
在本研究中,制备100mg/ml hsigg在250mm甘氨酸/0.02%聚山梨酸酯20中的溶液。将所得溶液通过两个0.2微米pes滤膜过滤到petg容器中。将转移的样品等分试样转移到玻璃小瓶中,并使用5%葡萄糖注射液usp稀释至60mg/ml hsigg。在以下条件下测试样品:
[0064]
a)在5%葡萄糖注射液usp中稀释至60mg/ml hsigg;
[0065]
b)在5%葡萄糖注射液usp中稀释至60mg/ml hsigg 在5℃下储存72小时;和
[0066]
c)在5%葡萄糖注射液usp中稀释至60mg/ml hsigg 在5℃下储存72小时 使用0.2微米pes过滤器过滤。
[0067]
在所有条件下,将初始制剂即100mg/ml hsigg在250mm甘氨酸中的溶液用作对照。该研究的结果在表4中,其中可以看出250mm甘氨酸/0.02%聚山梨酸酯20制剂在稀释时表现出良好的稳定性。
[0068]
表4:稀释时的稳定性
[0069][0070][0071]
在本研究中,制备100mg/ml(hsigg)在250mm甘氨酸/0.02%(w/v)聚山梨酸酯20中的溶液。将所得溶液通过两个0.2微米pes滤膜过滤到petg容器中。在以下条件下测试来自petg容器的样品:
[0072]
a)t零(稳定性起始);
[0073]
b)在5℃下储存1个月;
[0074]
c)在5℃和25℃下储存3个月;和
[0075]
d)在5℃下储存7个月。
[0076]
该研究的结果示于表5中,其中可以看出250mm甘氨酸/0.02%聚山梨酸酯20制剂在储存时表现出良好的稳定性。
[0077]
表5:储存时的稳定性
[0078][0079][0080]
实施例4:ph对纯度的影响
[0081]
在该研究中,评估了三种制剂:h0:100mg/ml hsigg,250mm甘氨酸,ph 5.2;h1:100mg/ml hsigg,250mm甘氨酸,ph 5.2,0.02%ps20;h2:100mg/ml hsigg,250mm甘氨酸,ph 4.2;和h3:100mg/ml hsigg,250mm甘氨酸,ph 4.2,0.02%ps20。将所得制剂通过0.2μmpes滤膜过滤到无颗粒petg容器中。然后将制剂转移到2r1型玻璃小瓶中并进行测试。
[0082][0083]
具有较低ph的样品与通过sec
‑
hplc测定的较高百分比纯度的单体相关。具有较低ph的样品与通过sec
‑
hplc测定的较高百分比纯度的单体 二聚体和较低百分比聚集体相
关。
[0084]
实施例5:聚山梨酸酯20对亚可见颗粒形成的影响
[0085]
在该研究中,检查聚山梨酸酯20对剪切应力抗性的影响。制备以下三种制剂:h0:100mg/ml m254,250mm甘氨酸,ph 5.2;h1:100mg/ml m254,250mm甘氨酸,ph 5.2,0.02%ps20;h2:100mg/ml m254,250mm甘氨酸,ph 4.2;和h3:100mg/ml m254,250mm甘氨酸,ph 4.2,0.02%ps20。将制剂通过0.2μmpes滤膜过滤到无颗粒petg容器中。然后将制剂转移到2r1型玻璃小瓶中并进行测试。
[0086][0087]
实施例6:非离子表面活性剂对剪切应力的影响
[0088]
检查其他表面活性剂保护100mg/ml hsigg制剂免受剪切应力不利影响的能力。据发现,0.02%、0.06%或0.10%的ps20与相同浓度聚山梨酸酯80(2
‑
羟基乙基2
‑
脱氧
‑
3,5
‑
双
‑
o
‑
(2
‑
羟基乙基)
‑6‑
o
‑
{2
‑
[(9e)
‑
十八碳
‑9‑
烯酰氧基]乙基}己呋喃糖苷;聚氧乙烯20脱水山梨醇单油酸酯ps80)或f68(聚氧乙烯
‑
聚氧丙烯嵌段共聚物,cas号9003
‑
11
‑
6.pubchem sid24898182)一样有效。在每种情况下,将包含2.4ml制剂和不含表面活性剂的对照物的小瓶在环境温度下以1,000rpm搅拌四小时,并且通过尺寸排阻hplc和颗粒成像分析进行视觉分析。在搅拌之后,当与静态对应物相比时,非表面活性剂样品显示出轻微的浑浊。含表面活性剂的样品是澄清的并且不含可见颗粒。se_hplc分析发现,所有包含表面活性剂的样品均显示出相当的单体百分比(88.2%
–
89.3%)。在搅拌之后,与它们的静态对应物相比,非表面活性剂样品显示出更高的颗粒浓度。由于它们显著高的颗粒浓度,搅拌的非表面活性剂样品不能进行数字过滤。与无表面活性剂样品相比,包含表面活性剂的样品具有非常低含量的亚可见颗粒。
[0089]
应当理解,虽然已结合本发明的具体实施方式描述了本发明,但是前述描述旨在说明而非限制由随附权利要求书所限定的本发明的范围。其他方面、优点和修改均在以下权利要求书的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。