安全港基因座
1.相关申请的交叉引用
2.本技术要求2021年4月23日提交的美国临时专利申请第63/179,143号、2021年1月26日提交的美国临时专利申请第63/141,926号和2020年10月26日提交的美国临时专利申请第63/105,834号的优先权和权益,所述申请的全部内容以引用的方式并入本文。
3.序列表
4.本技术含有将通过efs网提交并且据此以引用的方式整体并入本文的序列表。所述ascii副本于2021年10月15日创建,名为anb-203wo_sequencelisting并且大小是623,177字节。
背景技术:
5.尽管在癌症治疗方面进行了大量的研究工作并且取得了科学进步,但癌症仍然是一个重大的临床负担。血液和骨髓癌症是常被诊断出的癌症类型,包括多发性骨髓瘤、白血病和淋巴瘤。目前针对这些癌症的治疗选择并非对所有患者都有效,并且/或者可能有显著的不良副作用。使用现有的治疗选择来治疗其他类型的癌症也仍然具有挑战性。癌症免疫疗法是一种很有前途的解决方案,因为它们具有高度特异性,可以提高治疗效果并减轻副作用。
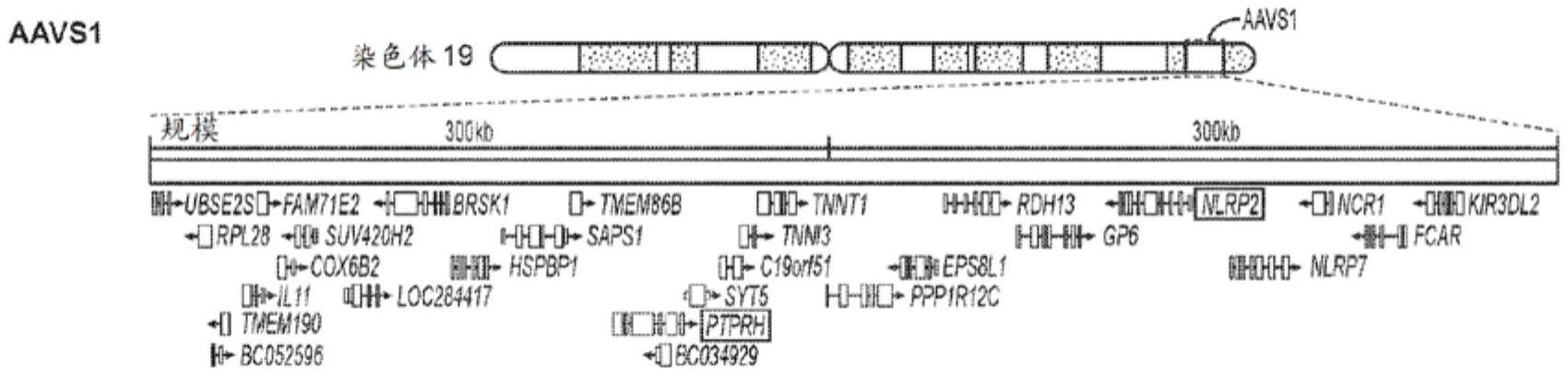
6.基因工程化免疫细胞疗法是一个不断发展的领域,在治疗包括但不限于癌症在内的疾病方面具有广阔的应用前景。通过改变编码和/或非编码基因组区域,研究人员正在鉴定细胞内有助于例如增强细胞功能、阻止细胞生长、诱导细胞死亡和肿瘤大小/体积缩小的转基因和插入位点。安全港位点(shs)的鉴定提高了基因组工程化疗法的结果。众所周知的shs包括19号染色体上的aavs1腺相关病毒插入位点、鼠rosa26基因座的人同系物,以及ccr5趋化因子受体基因,这些基因的缺失赋予hiv抗性。(参见,例如,pellenz等人,2018,其相关公开内容以引用的方式并入本文)。然而,仍然需要用于基因编辑疗法和额外的shs的改进的指南,以解决诸如低敲入(ki)效率、插入性肿瘤发生、转基因和/或相邻基因的不稳定和/或异常表达等挑战。
技术实现要素:
7.本公开尤其针对表现出高敲入效率和其转基因的稳定表达的安全港基因座。这些安全港基因座可用于改变t细胞以用于免疫疗法。这些安全港基因座可用于治疗包括癌症在内的各种疾病。
8.在一方面,本公开提供了一种工程化细胞,所述工程化细胞包含至少一个编码转基因的序列,其中所述至少一个序列插入安全港基因座内,所述安全港基因座处于表4中提供的sgrna靶基因座中的任一者或多者处;并且其中所述至少一个编码所述转基因的序列的表达可操作地连接至内源启动子。在另一方面,本公开提供了一种工程化细胞,所述工程化细胞包含至少一个编码转基因的序列,其中所述至少一个序列插入安全港基因座内,所述安全港基因座处于表4中提供的sgrna靶基因座中的任一者或多者处;并且其中所述至少
一个编码所述转基因的序列的表达可操作地连接至外源启动子。
9.在一些实施方案中,所述靶基因座选自:chr10:33130000-33140000、chr10:72290000-72300000、chr11:128340000-128350000、chr11:65425000-65427000(neat1)、chr15:92830000-92840000、chr16:11220000-11230000、chr2:87460000-87470000、chr3:186510000-186520000、chr3:59450000-59460000、chr8:127980000-128000000和chr9:7970000-7980000。在一些实施方案中,所述靶基因座选自:chr10:72290000-72300000、chr11:128340000-128350000、chr15:92830000-92840000和chr16:11220000-11230000。在一些实施方案中,所述靶基因座是chr11:128340000-128350000。在一些实施方案中,所述靶基因座是chr15:92830000-92840000。在一些实施方案中,所述靶基因座是选自以下的基因:aprt、b2m、capns1、cblb、cd2、cd3e、cd3g、cd5、edf1、ftl、pten、ptpn2、ptpn6、ptprc、ptprcap、rps23、rtraf、serf2、slc38a1、smad2、socs1、srp14、srsf9、sub1、tet2、tigit、trac和trim28。
10.在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs88、gs89、gs90、gs91、gs92、gs93、gs94、gs95、gs96、gs97、gs98、gs99、gs100、gs101、gs102、gs103、gs104、gs105、gs106、gs107、gs108、gs109、gs110、gs111、gs112、gs113、gs114、gs115、gs116、gs117、gs118、gs119或gs120。在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs91、gs92、gs93、gs94、gs95、gs96、gs100、gs101、gs102、gs103、gs104和gs105。在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs103、gs104和gs105。在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs94、gs95和gs96。在一些实施方案中,所述安全港基因座是表4中的gs94整合位点。在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs100、gs101和gs102。在一些实施方案中,所述安全港基因座是表4中的gs102整合位点。在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs91、gs92和gs93。
11.在一些实施方案中,所述外源启动子是ef1a启动子。在一些实施方案中,所述工程化细胞是干细胞、人细胞、原代细胞、造血细胞、适应性免疫细胞、先天免疫细胞、t细胞或t细胞祖细胞。在一些实施方案中,所述转基因编码重组蛋白,任选地治疗剂。在一些实施方案中,所述转基因编码嵌合抗原受体(car)。
12.在另一方面,本公开提供了一种组合物,所述组合物包含如本文所述的工程化细胞和药物赋形剂。
13.在另一方面,本公开提供了一种用于在安全港基因座处编辑细胞的指导核糖核酸(grna),其中grna包含表4中的sgrna序列中的任一者。
14.在一些实施方案中,所述grna包含seq id no:1-120中的任一者。在一些实施方案中,所述grna包含seq id no:91-96和100-105中的任一者。在一些实施方案中,所述grna包含seq id no:94或seq id no:102。在一些实施方案中,所述grna包含seq id no:94。在一些实施方案中,所述grna包含seq id no:102。在一些实施方案中,所述细胞是干细胞、人细胞、原代细胞、造血细胞、适应性免疫细胞、先天免疫细胞、t细胞或t细胞祖细胞。
15.在另一方面,本公开提供了一种编辑具有染色体dna的细胞的方法,所述方法包括在所述细胞的所述染色体dna中的安全港基因座内插入至少一个编码转基因的序列,其中
所述安全港基因座是表4中提供的sgrna靶基因座中的任一者或多者。
16.在一些实施方案中,所述靶基因座选自:chr10:33130000-33140000、chr10:72290000-72300000、chr11:128340000-128350000、chr11:65425000-65427000(neat1)、chr15:92830000-92840000、chr16:11220000-11230000、chr2:87460000-87470000、chr3:186510000-186520000、chr3:59450000-59460000、hr8:127980000-128000000和chr9:7970000-7980000。在一些实施方案中,所述靶基因座选自:chr10:72290000-72300000、chr11:128340000-128350000、chr15:92830000-92840000和chr16:11220000-11230000。在一些实施方案中,所述靶基因座是chr11:128340000-128350000。在一些实施方案中,所述靶基因座是chr15:92830000-92840000。在一些实施方案中,所述靶基因座是选自以下的基因:aprt、b2m、capns1、cblb、cd2、cd3e、cd3g、cd5、edf1、ftl、pten、ptpn2、ptpn6、ptprc、ptprcap、rps23、rtraf、serf2、slc38a1、smad2、socs1、srp14、srsf9、sub1、tet2、tigit、trac和trim28。
17.在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs88、gs89、gs90、gs91、gs92、gs93、gs94、gs95、gs96、gs97、gs98、gs99、gs100、gs101、gs102、gs103、gs104、gs105、gs106、gs107、gs108、gs109、gs110、gs111、gs112、gs113、gs114、gs115、gs116、gs117、gs118、gs119或gs120。在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs91、gs92、gs93、gs94、gs95、gs96、gs100、gs101、gs102、gs103、gs104和gs105。在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs103、gs104和gs105。在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs94、gs95和gs96。在一些实施方案中,所述安全港基因座是表4中的gs94整合位点。在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs100、gs101和gs102。在一些实施方案中,所述安全港基因座是表4中的gs102整合位点。在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs91、gs92和gs93。
18.在一些实施方案中,所述转基因编码重组蛋白,任选地治疗剂。在一些实施方案中,所述转基因编码嵌合抗原受体(car)。在一些实施方案中,所述至少一个序列包含外源启动子并且所述外源启动子可操作地连接至所述转基因。在一些实施方案中,所述外源启动子是ef1a启动子。在一些实施方案中,所述细胞是干细胞、人细胞、原代细胞、造血细胞、适应性免疫细胞、先天免疫细胞、t细胞或t细胞祖细胞。在一些实施方案中,使用同源定向修复来插入所述至少一个序列。在一些实施方案中,使用同源非依赖性靶向插入来插入所述至少一个序列。在一些实施方案中,使用一个或多个指导核糖核酸(grna)和一个或多个cas9核酸内切酶来插入所述至少一个序列。
19.在一些实施方案中,所述一个或多个grna包含seq id no:1-120中的任一者。在一些实施方案中,所述一个或多个grna包含seq id no:91-96和100-105中的任一者。在一些实施方案中,所述grna包含seq id no:94或seq id no:102。在一些实施方案中,所述grna包含seq id no:94。在一些实施方案中,所述grna包含seq id no:102。
20.在另一方面,本公开提供了一种编辑t细胞的方法,所述方法包括使t细胞与一个或多个指导核糖核酸(grna)、至少一个编码转基因的序列和一个或多个cas9核酸内切酶接触,其中所述一个或多个grna和cas9核酸内切酶促进将所述至少一个序列插入安全港基因
座内的染色体dna中,其中所述安全港基因座选自表4中的sgrna靶基因座中的任一者或多者。
21.在一些实施方案中,所述一个或多个grna包含选自表4中的sgrna序列中的任一者的序列。在一些实施方案中,所述一个或多个grna包含seq id no:1-120中的任一者。在一些实施方案中,所述一个或多个grna包含seq id no:91-96和100-105中的任一者。在一些实施方案中,所述grna包含seq id no:94或seq id no:102。在一些实施方案中,所述grna包含seq id no:94。在一些实施方案中,所述grna包含seq id no:102。
22.在一些实施方案中,所述靶基因座选自:chr10:33130000-33140000、chr10:72290000-72300000、chr11:128340000-128350000、chr11:65425000-65427000(neat1)、chr15:92830000-92840000、chr16:11220000-11230000、chr2:87460000-87470000、chr3:186510000-186520000、chr3:59450000-59460000、chr8:127980000-128000000和chr9:7970000-7980000。在一些实施方案中,所述靶基因座选自:chr10:72290000-72300000、chr11:128340000-128350000、chr15:92830000-92840000和chr16:11220000-11230000。在一些实施方案中,所述靶基因座是chr11:128340000-128350000。在一些实施方案中,所述靶基因座是chr15:92830000-92840000。在一些实施方案中,所述靶基因座是选自以下的基因:aprt、b2m、capns1、cblb、cd2、cd3e、cd3g、cd5、edf1、ftl、pten、ptpn2、ptpn6、ptprc、ptprcap、rps23、rtraf、serf2、slc38a1、smad2、socs1、srp14、srsf9、sub1、tet2、tigit、trac和trim28。
23.在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs88、gs89、gs90、gs91、gs92、gs93、gs94、gs95、gs96、gs97、gs98、gs99、gs100、gs101、gs102、gs103、gs104、gs105、gs106、gs107、gs108、gs109、gs110、gs111、gs112、gs113、gs114、gs115、gs116、gs117、gs118、gs119或gs120。在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs91、gs92、gs93、gs94、gs95、gs96、gs100、gs101、gs102、gs103、gs104和gs105。在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs103、gs104和gs105。在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs94、gs95和gs96。在一些实施方案中,所述安全港基因座是表4中的gs94整合位点。在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs100、gs101和gs102。在一些实施方案中,所述安全港基因座是表4中的gs102整合位点。在一些实施方案中,所述安全港基因座选自表4中标示的整合位点中的任一者:gs91、gs92和gs93。
24.在另一方面,本公开提供了一种获得工程化细胞或其群体的离体方法,所述方法包括(a)获得细胞;以及(b)通过在安全港基因座内插入至少一个编码转基因的序列对所述细胞进行基因修饰,其中所述安全港基因座选自表4中的sgrna靶基因座中的任一者。
25.在一些实施方案中,获得所述细胞包括:(i)从受试者收集组织样本,(ii)从所述组织样本中分离所述细胞,以及(iii)在体外培养所述细胞。在一些实施方案中,所述组织样本是血液样本。在一些实施方案中,所述细胞是干细胞、人细胞、原代细胞、造血细胞、适应性免疫细胞、先天免疫细胞、t细胞或t细胞前体(t细胞祖细胞)。在一些实施方案中,使用同源定向修复来插入所述至少一个序列。在一些实施方案中,使用同源非依赖性靶向插入来插入所述至少一个序列。
26.在一些实施方案中,步骤(b)中的所述基因修饰包括使所述细胞与一个或多个指导核糖核酸(grna)、所述至少一个序列和一个或多个cas9核酸内切酶接触,其中所述一个或多个grna和cas9核酸内切酶促进将所述至少一个序列插入所述安全港基因座内的染色体dna中。在一些实施方案中,所述一个或多个grna包含选自表4中的sgrna序列中的任一者的序列。
27.在一些实施方案中,所述转基因编码重组蛋白,任选地治疗剂。在一些实施方案中,所述转基因编码嵌合抗原受体(car)。在一些实施方案中,所述至少一个序列包含外源启动子并且所述外源启动子可操作地连接至所述转基因。在一些实施方案中,所述外源启动子是ef1a启动子。
28.在另一方面,本公开提供了一种治疗患有疾病或有患病风险的受试者的方法,所述方法包括向所述受试者施用有效量的如本文所述的工程化细胞、其群体,或如本文所述的组合物。在一些实施方案中,通过输注将所述细胞、所述其群体或所述组合物施用至所述受试者。
29.在另一方面,本公开提供了一种治疗患有疾病或有患病风险的受试者的方法,所述方法包括(a)执行上述方法中的任一种方法;以及(b)向所述受试者施用有效量的包含所述细胞或其群体的组合物。在一些实施方案中,通过过输注将所述组合物施用至所述受试者。在一些实施方案中,所述疾病是癌症。在一些实施方案中,所述疾病是血液癌症。
30.在另一方面,本公开提供了一种鉴定安全港基因座的方法,所述方法包括:(a)鉴定染色体中高于跨发育细胞状态表达的阈值水平和/或染色质可及性的阈值水平的基因或非编码区;(b)生成线性模型,所述线性模型将来自步骤(a)的所述基因或非编码区与敲入(ki)效率相关联并估计所述染色体上任何基因或编码区的ki效率;以及(c)基于阈值参数选择所述安全港基因座;其中所述安全港基因座被选择用于在细胞内插入至少一个编码转基因的序列。
31.在一些实施方案中,所述阈值参数包括以下一项或多项:转基因的稳定表达,所述基因的敲除为所述细胞的功能带来益处,在所述细胞内无已知功能,在有或无cd3/cd28刺激的情况下在体外稳定的转基因表达,如通过iguide-seq或crispr-seq所检测的可忽略不计的脱靶裂解,如通过iguide-seq或crispr-seq所检测的相对于其他基因座更少的脱靶裂解,可忽略不计的转基因非依赖性细胞毒性,可忽略不计的转基因非依赖性细胞因子表达,可忽略不计的转基因非依赖性嵌合抗原受体表达,可忽略不计的附近基因的失调或沉默,以及定位于癌相关基因之外。在一些实施方案中,所述安全港基因座处转基因的所述稳定表达在至少1、2、3、4、5、6或7天的过程中小于或等于2倍表达变化,并且其中通过由所述至少一个序列编码的报告基因的平均荧光强度来测量表达变化。在一些实施方案中,利用使用测序对转座酶可及染色质的测定(atac-seq)来测量所述染色质可及性。在一些实施方案中,使用rna测序(rna-seq)来测量跨发育细胞状态表达的水平。
32.在一些实施方案中,所述细胞是干细胞、人细胞、原代细胞、造血细胞、适应性免疫细胞、先天免疫细胞、t细胞或t细胞祖细胞。在一些实施方案中,所述线性模型具有至少30%的决定系数(r2值)。
33.在另一方面,本公开提供了如本文所述的工程化细胞、组合物、grna或方法,其中所述安全港基因座内的插入增加病变细胞的细胞毒性。
34.在另一方面,本公开提供了如本文所述的工程化细胞、组合物、grna或方法,其中相对于沿所述染色体的其他位置,所述安全港基因座处的敲入效率增加。
附图说明
35.参考以下描述和附图将更好地理解本发明的这些和其他特征、方面和优点,在附图中:
36.图1包括描绘在本公开中在一些实施方案中用于鉴定安全港基因座的方法的示意图。
37.图2a至图2c包括描绘本领域中已知的3个位居前位的安全港基因座的示意图:aavs1(图2a)、ccr5(图2b)与rosa26(图2c)。这些附图取自sadelain,m.等人(2012).safe harbours for the integration of new dna in the human genome.nature reviews cancer,12(1),51-58,其相关公开内容以引用的方式整体并入本文。
38.图3包括概述roth,t.l.等人2019.rapid discovery of synthetic dna sequences to rewrite endogenous t cell circuits.biorxiv,604561中提供的数据的示意图,所述参考文献的相关公开内容以引用的方式整体并入本文。
39.图4a至图4b包括用处理过的rna-seq数据生成的基于激活状态和细胞类型聚类的样本的热图。图4a包括用处理过的rna-seq数据生成的样本的热图。图4b包括用处理过的rna-seq数据生成的样本的热图,显示了约20k基因的集群。
40.图5a至图5b包括使用处理过的rna-seq数据生成的图。图5a包括显示来自roth,t.l.等人2019的转录物表达数据与本公开的发明人生成的转录物表达数据之间的直接相关性的图。图5b包括显示前10%表达基因的集群的热图。
41.图6包括用处理过的atac-seq数据生成的样本的热图。
42.图7a至图7b包括描绘转录起始位点(tss)处的信号富集(图7a)和峰大小分布(图7b)的图,这些图是用针对编码区的处理过的atac-seq数据生成的。
43.图8包括描绘trac基因座周围的开放染色质区域的图。
44.图9包括描绘以gfp作为报告物下编码区/基因的ki(敲入)效率的图。
45.图10包括描绘以tngfr作为报告物下编码区/基因的ki效率的图。
46.图11包括显示用于预测线性模型的90个基因的缩放ki效率对d2(第2天)rna-seq数据、d4(第4天)rna-seq数据和atac-seq数据的图。
47.图12包括显示使用ataq测序测量的位居前位的候选非编码区的染色质可及性的图。
48.图13a包括显示用于评价候选ki基因座的gfp对照的细胞计数的图。图13b包括用于评价候选ki基因座的gfp对照的pmax(gfp_高)读数。
49.图14a包括显示非靶向对照的最大游离型gfp表达(gfp_高)读数的图。图14b包括来自供体1、2和3的非靶向对照的细胞计数。
50.图15包括wt对照的细胞计数和最大gfp表达(gfp_高)读数。
51.图16包括显示当使用靶向b2m安全港基因座的sgrna5并且构建体表达由内源启动子驱动时细胞计数和最大gfp表达(gfp_高)读数的图。
52.图17包括显示当使用靶向b2m安全港基因座的sgrna5并且构建体表达由ef1a启动
子驱动时细胞计数和最大gfp表达(gfp_高)读数的图。
53.图18包括显示当使用靶向trac安全港基因座的sgrna79并且构建体表达由内源启动子驱动时细胞计数和最大gfp表达(gfp_高)读数的图。
54.图19包括显示当使用靶向trac安全港基因座的sgrna79并且构建体表达由外源启动子驱动时细胞计数和最大gfp表达(gfp_高)读数的图。
55.图20包括显示当使用sgrna79并且构建体由内源启动子驱动时所有供体和时间点之中的tcr(t细胞受体)对gfp的图。
56.图21包括显示当使用sgrna79并且构建体由外源启动子驱动时所有供体和时间点之中的tcr对gfp的图。
57.图22包括显示当使用靶向trac安全港基因座的sgrna83并且构建体表达由内源启动子驱动时细胞计数和最大gfp表达(gfp_高)读数的图。
58.图23包括显示当使用靶向trac安全港基因座的sgrna83并且构建体表达由外源启动子驱动时细胞计数和最大gfp表达(gfp_高)读数的图。
59.图24包括显示当使用sgrna83并且构建体由内源启动子驱动时所有供体和时间点之中的tcr对gfp的图。
60.图25包括显示当使用sgrna83并且构建体由外源启动子驱动时所有供体和时间点之中的tcr对gfp的图。
61.图26包括说明在重复与供体之间观察到的潜在变化源(例如,边缘效应和电穿孔误差)的图。
62.图27包括说明在重复与供体之间观察到的潜在变化源(例如,与供体之间的固有差异有关)的图。
63.图28包括说明在重复与供体之间观察到的潜在变化源(例如,与门控误差有关)的图。
64.图29包括显示用内源启动子评价的位居前位的ki基因座的gfp平均荧光强度(gfp mfi)和ki效率的图。
65.图30包括显示用ef1a启动子评价的位居前位的ki基因座的gfp平均荧光强度(gfp mfi)和ki效率的图。
66.图31a至图31c包括显示如用内源启动子和ef1a启动子评价的所有显著ki基因座(位居前位的ki基因座)的图。图31a包括显示来自ef1a启动子的表达是来自内源启动子的表达大约10倍的图。图31b显示了第3周按照gfp mfi排序的位居前位的ki基因座。图31c显示了按照gfp mfi排序的位居前位的整合基因座(第3周和第4周;供体1-3)。
67.图32a包括显示一些靶基因座及其测量的转基因表达水平的图。图32b包括显示对照情况和在gs94、gs102和trac基因座处插入时的转基因(启动受体(primer))和tcr表达的图。
68.图33a包括显示针对所指示整合位点测量的primer水平的图。图33b包括显示11号染色体上的gs94整合位点的示意图。
69.图34a包括显示与k562-cd19细胞共培养48小时后工程化t细胞的car诱导和primer表达的图。图34b包括显示与k562-cd19/msln细胞共培养48小时后工程化t细胞的细胞毒性和细胞因子分泌水平的图。
70.图35a包括显示用于评价整合位点对细胞毒性的影响的实验概览的示意图。图35b包括显示与k562 cd19 /msln 或k562cd19-/msln 细胞共培养48小时的工程化t细胞的测量细胞毒性的图。
71.图36a包括显示用于评价整合位点对细胞因子分泌的影响的实验概览的示意图。图36b包括显示与k562 cd19 /msln 细胞共培养48小时的工程化t细胞的测量细胞因子水平的图。
72.图37包括显示为确定整合位点对primer非依赖性car表达的影响而进行的体外实验的示意图。“flow”是指流式细胞术,“restim”是指对工程化t细胞的重复cd3/cd28刺激。“ep”是指电穿孔。
73.图38a和图38b包括显示当使用所指示整合位点时primer表达随时间的稳定性的图。“flow”是指流式细胞术,“restim”是指对工程化t细胞的重复cd3/cd28刺激。“ep”是指电穿孔。在图38b中,对primer表达针对使用trac整合位点时的表达作归一化。
74.图39a包括显示iguide-seq测定技术的示意图。图39b包括显示使用iguide seq测定的所指示整合位点的中靶效率的图。图39c包括来自iguide-seq分析的示意图,显示在两名供体之间gs94没有可重现的推定脱靶。
75.图40包括显示iguide-seq工作流程和数据的示意图。
76.图41包括显示通过iguide-seq和elevation预测确定的推定脱靶位点的rhamp-seq分析的图。
77.图42包括显示在gs94、gs102和trac敲入cd19/msln回路的细胞的rna-seq分析的图。两名供体中在gs94基因座处整合的细胞(y轴)与在trac或gs102基因座处整合的细胞(x轴)的基因表达的散点图。黄色点对应于ets1和fli1。蓝色是使用edger发现差异性表达的基因(倍数变化》0,fdr校正的p值《0.01,比较条件下的平均每百万计数至少为2)。
78.图43包括显示在gs94处具有cd19/msln回路ki的细胞中不存在细胞因子非依赖性生长的图。
79.图44显示了插入gs94安全港基因座的8.3kb盒的图解。
80.图45显示了包含启动受体和car的8.3kb转基因回路在k562细胞中的表达。
81.图46显示非病毒编辑产生分化程度较低的t细胞。
具体实施方式
82.本公开提供了安全港基因座和用于鉴定安全港基因座的方法,这些安全港基因座表现出高整合效率(例如,高敲入(ki)效率)、高且恒定的转基因表达水平,以及此类独立于t细胞激活/分化状态的益处。在一些实施方案中,安全港基因座还表现出对t细胞功能和/或产品制造能力的破坏极小至无。在一些实施方案中,这些基因座可用于t细胞中转基因的有效且安全的整合和表达(例如,在car t疗法中)。在一些实施方案中,本文所述的方法可用于鉴定用于将转基因插入其他类型的细胞中的安全港基因座。
83.图1示出了本公开的发明人用来鉴定安全港基因座的总体方法。在一些实施方案中,本公开提供了一种方法,所述方法包括鉴定基因组和非编码区内在治疗细胞(例如t细胞)中具有持续表达的基因,并使用ki效率作为t细胞染色质状态的函数的预测模型和计算分析来预测候选整合位点。所述方法还包括评价候选整合位点的实际ki效率、转基因的持
续转基因表达水平和对治疗细胞表型(例如,t细胞功能和/或治疗产品扩展和制造的能力)的最小破坏。在一些实施方案中,安全港基因座允许由内源启动子驱动的转基因的整合。在一些实施方案中,安全港基因座允许由外源启动子(例如ef1a启动子)驱动的转基因的整合。
84.为了便于理解本公开,下面定义了许多术语和短语。除非本文另有定义,否则本技术中使用的科学和技术术语应具有本领域普通技术人员通常所理解的含义。一般来说,本文所述的结合药理学、细胞和组织培养、分子生物学、细胞和癌症生物学、神经生物学、神经化学、病毒学、免疫学、微生物学、遗传学以及蛋白质和核酸化学的技术使用的命名法是本领域中众所周知的和常用的。如有冲突,以本说明书(包括定义)为准。
85.除非另有定义,否则本文使用的所有技术术语、符号和其他科学术语旨在具有本领域技术人员通常所理解的含义。在一些情况下,为了清楚和/或便于参考,在本文中定义了具有通常所理解的含义的术语,并且在本文中包含此类定义不应必然被解释为表示与对本领域中一般理解的内容不同。本文描述或引用的技术和程序是本领域技术人员通常熟知的且使用常规方法经常使用的,例如像在以下文献中描述的广泛使用的分子克隆方法:sambrook等人,molecular cloning:alaboratory manual第4版(2012)cold spring harbor laboratory press,cold spring harbor,ny。除非另有说明,否则在适当情况下,涉及使用市售试剂盒和试剂的程序一般根据制造商定义的方案和条件进行。
86.除非上下文另有明确指示,否则如本文所用的单数形式“一个”、“一种”和“所述”包括单数和复数个指示物。除非另有具体指示,否则术语“包括”、“诸如”等旨在传达包括但不限于。
87.除非另有具体指示,否则如本文所用的术语“包含”还具体包括“由......组成”和“大体上由......组成”的实施方案。
88.术语“约”指示并涵盖指示值和高于和低于该值的范围。在某些实施方案中,术语“约”指示指定值
±
10%、
±
5%或
±
1%。在某些实施方案中,在适用情况下,术语“约”指示指定值
±
该值的一个标准差。
89.如本文所用,术语“基因”是指遗传的基本单位,由沿染色体排列的dna区段组成,其编码特定蛋白质或蛋白质区段。基因通常包括启动子、5'非翻译区、一个或多个编码序列(外显子)、任选的内含子、3'非翻译区。基因还可包含终止子、增强子和/或沉默子。
90.如本文所用,术语“基因座”是指基因或遗传标志物所在的染色体上特定的、固定的物理位置。
91.如本文所用,术语“靶基因座”是指染色体上的基因座,其内的安全港基因座可用于插入序列。靶基因座可以由多个潜在的安全港基因座(整合位点)组成。表4中提供了靶基因座的实例,为sgrna靶基因座。表4中用于sgrna靶基因座的符号是指靶基因座的基因组区域,由靶基因座的染色体和该靶基因座的坐标范围定义。例如,chr10:33130000-33140000是指chr10(10号染色体)上从坐标33130000开始到坐标33140000结束的靶基因座。
92.术语“安全港基因座”是指基因或遗传元件可以在不破坏相邻基因的表达或调控的情况下被并入的基因座。这些安全港基因座也称为安全港位点(shs)。如本文所用,安全港基因座是指“整合位点”或“敲入位点”,在该位点上可以插入编码如本文所定义的转基因的序列。在一些实施方案中,插入发生伴随着位于整合位点的序列的置换。在一些实施方案
中,插入发生不伴随位于整合位点的序列的置换。设想的整合位点的实例提供于表4中。
93.如本文所用,术语“插入物”是指整合(插入)到安全港位点处的核苷酸序列。插入物可用于指使用例如同源定向修复(hdr)crispr/cas9基因组编辑或本领域普通技术人员已知的将核苷酸序列插入基因组区域中的其他方法被并入安全港位点的基因或遗传元件。
[0094]“crispr/cas”系统是指一类广泛用于防御外来核酸的细菌系统。crispr/cas系统广泛存在于真细菌和古细菌生物体中。crispr/cas系统包括i型、ii型和iii型亚型。野生型ii型crispr/cas系统利用rna介导的核酸酶cas9与指导和激活性rna的复合物来识别和裂解外来核酸。具有指导rna和激活性rna两者的活性的指导rna也是本领域已知的。在一些情况下,这种双重活性指导rna被称为小指导rna(sgrna)。
[0095]
cas9同系物存在于多种真细菌中,包括但不限于以下分类群的细菌:放线菌门(actinobacteria)、产水菌门(aquificae)、拟杆菌门-绿菌门(bacteroidetes-chlorobi)、衣原体-疣微菌门(chlamydiae-verrucomicrobia)、绿弯菌门(chlroflexi)、蓝藻门(cyanobacteria)、厚壁菌门(firmicutes)、变形菌门(proteobacteria)、螺旋体门(spirochaetes)和热袍菌门(thermotogae)。示例性的cas9蛋白是化脓性链球菌(streptococcus pyogenes)cas9蛋白。另外的cas9蛋白及其同系物描述于例如chylinksi等人,rna biol.2013年5月1日;10(5):726
–
737;nat.rev.microbiol.2011年6月;9(6):467-477;hou等人,proc natl acad sci u s a.2013年9月24日;110(39):15644-9;sampson等人,nature.2013年5月9日;497(7448):254-7;以及jinek等人,science.2012年8月17日;337(6096):816-21。可以优化cas9核酸酶结构域以提高宿主细胞中的活性或增强稳定性。
[0096]
如本文所用,术语“cas9”是指rna介导的核酸酶(例如,细菌或古细菌来源的,或源自它们的)。示例性的rna介导的核酸酶包括上述cas9蛋白及其同系物,并且包括但不限于cpf1(参见,例如,zetsche等人,cell,第163卷,第3期,第759-771页,2015年10月22日)。类似地,如本文所用,术语“cas9核糖核蛋白”复合物等是指cas9蛋白与crrna(例如,指导rna或小指导rna)之间的复合物、cas9蛋白与反式激活性crrna(tracrrna)之间的复合物、cas9蛋白与小指导rna之间的复合物或它们的组合(例如,含有cas9蛋白、tracrrna和crrna指导rna的复合物)。
[0097]
如本文所用,术语“t淋巴细胞”和“t细胞”可互换使用,并且是指在胸腺中已完成成熟并识别体内某些外来抗原的细胞。这些术语还指在免疫系统中具有各种作用,包括其他免疫细胞的激活和失活的主要白细胞类型。t细胞可以是任何t细胞,诸如培养的t细胞,例如原代t细胞,或源自培养的t细胞系的t细胞,例如jurkat、supt1等,或获自哺乳动物的t细胞。t细胞可以是cd3 细胞。t细胞可以是任何类型的t细胞、cd4 /cd8 双阳性t细胞、cd4 辅助性t细胞(例如th1和th2细胞)、cd8 t细胞(例如细胞毒性t细胞),外周(包括但不限于)血单核细胞(pbmc)、外周血白细胞(pbl)、肿瘤浸润性淋巴细胞(til)、记忆t细胞、幼稚t细胞、调节性t细胞、γδt细胞等。其可以是任何发育阶段的任何t细胞。其他类型的辅助性t细胞包括th3(treg)细胞、th17细胞、th9细胞或tfh细胞。其他类型的记忆t细胞包括诸如中央记忆t细胞(tcm细胞)、效应记忆t细胞(tem细胞和temra细胞)的细胞。t细胞还可以指代基因修饰的t细胞,诸如经修饰以表达t细胞受体(tcr)或嵌合抗原受体(car)的t细胞。t细胞也可以从干细胞或祖细胞(例如,前体细胞)分化而来。
[0098]“cd4 t细胞”是指在其表面上表达cd4并与细胞免疫应答相关的t细胞亚群。cd4 t细胞的特征在于刺激后分泌特性,可包括分泌细胞因子,诸如ifn-γ、tnf-α、il-2、il-4和il-10。“cd4”是一种55kd的糖蛋白,最初被定义为t淋巴细胞上的分化抗原,但也存在于包括单核细胞/巨噬细胞在内的其他细胞上。cd4抗原是免疫球蛋白超家族的成员,并被认为是mhc(主要组织相容性复合物)ii类限制性免疫应答中的关联识别元件。在t淋巴细胞上,cd4抗原限定了辅助/诱导子亚群。
[0099]“cd8 t细胞”是指在其表面上表达cd8的t细胞亚群,受mhc i类限制,并作为细胞毒性t细胞发挥作用。“cd8”分子是存在于胸腺细胞以及细胞毒性和抑制性t淋巴细胞上的分化抗原。cd8抗原是免疫球蛋白超家族的成员,并且是主要组织相容性复合物i类限制性相互作用中的关联识别元件。
[0100]
如本文所用,术语“离体”一般包括在活组织中或活组织上进行的实验或测量,优选地是在生物体外的人工环境中,优选地是与自然条件的差异极小。
[0101]
如本文所用,术语“构建体”是指分子(包括大分子或多核苷酸)的复合物。
[0102]
如本文所用,术语“整合”是指将构建体的一个或多个核苷酸稳定插入细胞基因组中,即,共价连接至细胞染色体dna中的核酸序列的过程。其也可以指整合位点处的核苷酸缺失。在插入位点处存在缺失的情况下,“整合”还可包括用一个或多个插入的核苷酸取代缺失的内源序列或核苷酸。
[0103]
如本文所用,术语“外源”是指已引入宿主细胞中且不是该细胞原生的分子或活性。例如,可以通过将编码核酸引入宿主遗传物质中,如通过整合到宿主染色体中,或作为非染色体遗传物质诸如质粒,来引入分子。因此,当与编码核酸的表达结合使用时,该术语是指将编码核酸以可表达的形式引入细胞中。术语“内源”是指在自然、未经编辑的条件下存在于宿主细胞中的分子或活性。类似地,当与编码核酸的表达结合使用时,该术语是指包含在细胞内而不是外源性地引入的编码核酸。
[0104]
如本文所用,“多核苷酸供体构建体”是指遗传地插入多核苷酸中并且对该多核苷酸而言是外源的核苷酸序列(例如dna序列)。多核苷酸供体构建体被转录成rna并任选地被翻译成多肽。多核苷酸供体构建体可包括原核序列、来自真核mrna的cdna、来自真核(例如,哺乳动物)dna的基因组dna序列,和合成dna序列。例如,多核苷酸供体构建体可以是mirna、shrna、天然多肽(即,天然存在的多肽)或其片段,或变体多肽(例如,与天然多肽具有小于100%序列同一性的天然多肽)或其片段。
[0105]
如本文所用,术语“转基因”是指已自然转移或通过多种基因工程化技术中的任何一种从一种生物体转移到另一种生物体的多核苷酸。其任选地被翻译成多肽。其任选地被翻译成重组蛋白。“重组蛋白”是一种由基因编码的蛋白质——重组dna——已在支持基因表达和信使rna翻译的系统中克隆(参见表达系统)。重组蛋白可以是治疗剂,例如治疗本文公开的疾病或病症的蛋白质。如所用,转基因可以指代编码多肽的多核苷酸。转基因还可以指代非编码序列,诸如但不限于shrna、mirna和mir。
[0106]
术语“蛋白质”、“多肽”和“肽”在本文中可互换使用。
[0107]
如本文所用,术语“可操作地连接”是指核酸序列与单个核酸片段结合,使得一种功能受另一种功能影响。例如,如果启动子能够影响编码序列或功能性rna的表达(即,编码序列或功能性rna在启动子的转录控制下),则启动子与其可操作地连接。编码序列可以在
有义和反义方向上可操作地连接至控制序列。
[0108]
如本文所用,术语“发育细胞状态”是指,例如,细胞所处的非活性、活性表达、分化、衰老等状态。发育细胞状态还可以指处于前体状态的细胞(例如,t细胞前体或t细胞祖细胞)。
[0109]
如所用,术语“编码”是指编码目标蛋白质或多肽的核酸序列。核酸序列可以是dna分子或rna分子。在优选实施方案中,分子是dna分子。在其他优选实施方案中,分子是rna分子。当作为rna分子存在时,其将包含引导宿主细胞的核糖体开始翻译的序列(例如,起始密码子,atg)和引导核糖体结束翻译的序列(例如,终止密码子)。在起始密码子与终止密码子之间是开放阅读框(orf)。此类术语是本领域普通技术人员已知的。
[0110]
术语“插入”是指操纵核苷酸序列以引入非天然序列。这是例如通过使用限制酶和连接酶来完成的,由此可以通过以下方式将通常编码目标基因的目标dna序列并入另一核酸分子中:用适当的限制酶消化这两个分子以便产生相容的重叠,接着使用连接酶将这些分子接合在一起。本领域的技术人员非常熟悉此类操纵,实例可见于sambrook等人(sambrook、fritsch和maniatis,“molecular cloning:a laboratory manual”,2nd ed.,cold spring harbor laboratory,1989),其据此以引用的方式整体并入本文,包括任何附图、图形和表格。
[0111]
如本文所用,术语“受试者”是指哺乳动物受试者。示例性受试者包括人、猴子、狗、猫、小鼠、大鼠、牛、马、骆驼、山羊、兔子、猪和绵羊。在某些实施方案中,受试者为人。在一些实施方案中,受试者患有可用本文提供的工程化细胞或其群体治疗的疾病或疾患。在一些方面,疾病或疾患为癌症。
[0112]
如本文所用,术语“启动子”是指能够控制编码序列或功能性rna的表达的核苷酸序列(例如dna序列)。启动子序列由近端和更远端的上游元件组成,后者元件通常称为增强子。启动子可以完整地源自天然基因,可以由来自天然存在的不同启动子的不同元件组成,并且/或者可包含合成的dna区段。如本文所设想的,启动子对于目标细胞而言可以是内源的或者对于目标细胞而言是外源的。本领域技术人员理解不同的启动子可以在不同的组织或细胞类型中,或在不同的发育阶段,或响应于不同的环境条件诱导基因表达。如本领域已知的,可以根据启动子的强度和/或启动子具有活性的条件来选择启动子,例如,组成型启动子、强启动子、弱启动子、诱导型/抑制型启动子、组织特异性或发育调控启动子、细胞周期依赖性启动子等。
[0113]
启动子可以是诱导型启动子(例如,热休克启动子、四环素调控启动子、类固醇调控启动子、金属调控启动子、雌激素受体调控启动子等)。启动子可以是组成型启动子(例如,cmv启动子、ubc启动子)。在一些实施方案中,启动子可以是空间限制和/或时间限制的启动子(例如,组织特异性启动子、细胞类型特异性启动子等)。参见例如美国申请第15/715,068号,其公开内容以引用的方式整体并入本文。
[0114]
如本文所设想的,基因编辑可以涉及基因(或核苷酸序列)敲入或敲除。如本文所用,术语“敲入”是指将dna序列或其片段添加到基因组中。此类待敲入的dna序列可包括一个或多个完整基因,可包括与基因或前述基因的任何部分或片段相关的调控序列。例如,可将编码重组蛋白的多核苷酸供体构建体插入携带突变基因的细胞的基因组中。在一些实施方案中,敲入策略涉及用提供的序列取代现有序列,例如用野生型拷贝取代突变等位基因。
另一方面,术语“敲除”是指基因或基因表达的消除。例如,可以通过缺失或添加导致阅读框破坏的核苷酸序列来敲除基因。再如,可通过用不相关的(例如,非编码的)序列置换基因的一部分来敲除基因。
[0115]
如本文所用,术语“非同源末端接合”或nhej是指dna链的切割或切口末端直接接合而不需要同源模板核酸的细胞过程。nhej可以导致修复位点处一个或多个核苷酸的添加、缺失、取代或它们的组合。
[0116]
如本文所用,术语“同源定向修复”或hdr是指通过从同源模板核酸聚合来修复dna链的切割或缺口末端的细胞过程。因此,原始序列被模板的序列置换。同源模板核酸可以由基因组中其他位置的同源序列(姐妹染色单体、同源染色体,或相同或不同染色体上的重复区域)提供。或者,可以引入外源模板核酸以获得靶位点处特定hdr诱导的序列的变化。通过这种方式,可以在切割位点引入特定的突变。
[0117]
术语“载体”和“质粒”可互换使用,并且如本文所用是指可用于将遗传物质引入细胞中的多核苷酸媒介物。载体可以是线状的或环状的。载体可以整合到宿主细胞的靶基因组中或者在宿主细胞中独立复制。载体可以包含例如复制起点、多克隆位点和/或选择性标志物。表达载体通常包含表达盒。载体和质粒包括但不限于整合载体、原核质粒、真核质粒、植物合成染色体、附加体、病毒载体、粘粒和人工染色体。
[0118]
如本文所用,术语“表达盒”是以重组或合成方式产生的多核苷酸构建体,其包含可操作地连接至所选多核苷酸以促进该所选多核苷酸在宿主细胞中的表达的调控序列。例如,调控序列可以促进所选多核苷酸在宿主细胞中的转录,或所选多核苷酸在宿主细胞中的转录和翻译。表达盒可以例如整合到宿主细胞的基因组中或存在于表达载体中。
[0119]
如本文所用,短语“有需要的受试者”是指表现出和/或被诊断具有如本文所述的疾病或病症的一种或多种症状或体征的受试者。
[0120]“化学治疗剂”是指可用于治疗癌症的化学化合物。化学治疗剂包括用于调节、减少、阻断或抑制可促进癌症生长的激素的影响的“抗激素剂”或“内分泌治疗剂”。
[0121]
术语“组合物”是指含有例如本文所设想的工程化细胞或蛋白质的混合物。在一些实施方案中,组合物可含有另外的组分,诸如佐剂、稳定剂、赋形剂等。术语“组合物”或“药物组合物”是指呈允许包含在其中的活性成分的生物活性对治疗受试者有效的形式的制剂,并且在药物组合物中提供的量中,其不含有对受试者具有不可接受的毒性的其它组分。
[0122]
如本文所用,术语“有效量”是指化合物(例如,本文所述的组合物、本文所述的细胞)足以实现有益或所需结果的量。有效量可以按一次或多次施用、应用或剂量施用,并且不意图限于特定的制剂或施用途径。如本文所用,术语“治疗”包括导致疾患、疾病、病症等的改善或改善其症状的任何作用,例如减轻、减少、调节、改善或消除。
[0123]
术语“调节(modulate/modulation)”是指降低或抑制,或替代地,激活或增加所叙述变量。
[0124]
术语“增加”和“活化”是指所叙述变量增加10%、20%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、100%,增加至2倍、3倍、4倍、5倍、10倍、20倍、50倍、100倍或更大。
[0125]
术语“降低”和“抑制”是指所叙述变量降低10%、20%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%,降低至1/2、1/3、1/4、1/5、1/10、1/20、1/50、1/100,或降
低更多。
[0126]
安全港基因座
[0127]
基因编辑疗法包括,例如,病毒载体整合和位点特异性整合。位点特异性整合是病毒载体随机整合的一种有前景的替代方法,因为它降低了插入诱变或插入瘤形成的风险(kolb等人trends biotechnol.2005 23:399-406;porteus等人nat biotechnol.2005 23:967-973;paques等人curr gen ther.2007 7:49-66)。然而,位点特异性整合仍然面临着诸如低敲入效率、插入瘤形成风险、相邻基因或转基因的不稳定和/或异常表达、低可及性(例如相邻基因的20kb以内)等挑战。这些挑战可以部分地通过确定和使用安全港基因座或安全港位点(shs)来解决,这些位点是可以在不破坏相邻基因的表达或调控的情况下整合基因或遗传元件的位点。
[0128]
最广泛使用的推定人安全港位点是染色体19q上的aavs1位点,该位点最初被确定为用于复发性腺相关病毒插入的位点。已在同源性的基础上鉴定出其他潜在的shs,这些位点首先是在其他物种(例如,允许的鼠rosa26基因座的人同系物)或在越来越多的在某些情况下显得非必需的人基因中鉴定出来的。这种类型的一种推定的shs是ccr5趋化因子受体基因,该基因当被破坏时赋予对人免疫缺陷病毒感染的抵抗力。在病毒整合位点作图或基因陷阱分析的基础上,已在人和其他细胞类型中鉴定出其他潜在的基因组shs,就像最初的鼠rosa26基因座一样。三个位居前位的shs、aavs1、ccr5和rosa26与许多蛋白质编码基因和调控元件非常接近。(参见来自以下的图2,sadelain,m.等人(2012).safe harbours for the integration of new dna in the human genome.nature reviews cancer,12(1),51-58,其相关公开内容以引用的方式整体并入本文)。
[0129]
人19号染色体上的aavs1(也称为ppp1r12c基因座)是一个已知的用于承载具有预期功能的转基因(例如dna转基因)的shs。它位于位置19q13.42。它具有开放的染色质结构并且具有转录能力。aavs1的规范shs基因座是chr19:55,625,241
–
55,629,351。参见pellenz等人“new human chromosomal sites with"safe harbor"potential for targeted transgene insertion.”human gene therapy vol.30,7(2019):814-828,其相关公开内容以引用的方式并入本文。下文提供了示例性aavs1靶grna和靶序列:
[0130]
●
aavs1-grna序列:ggggccactagggacaggatgttttagagcta gaaatagcaagttaaaataaggctagtccgttatcaacttgaaa aagtggcaccgagtcggtgcttttttt
[0131]
●
aavs1靶序列:ggggccactagggacaggat
[0132]
ccr5位于3号染色体的位置3p21.31,编码hiv-1的主要共受体。ccr5基因中该位点的破坏有利于hiv/aids疗法,并促进了靶向其第三外显子的锌指核酸酶的开发。ccr5的规范shs基因座是chr3:46,414,443
–
46,414,942。参见pellenz等人“new human chromosomal sites with"safe harbor"potential for targeted transgene insertion.”human gene therapy vol.30,7(2019):814-828,其相关公开内容以引用的方式并入本文。
[0133]
小鼠rosa26基因座对于基因修饰特别有用,因为它可以被高效靶向并在大多数测试细胞类型中表达。irion等人2007("identification and targeting of the rosa26 locus in human embryonic stem cells."nature biotechnology 25.12(2007):1477-1482,其相关公开内容以引用的方式并入本文)鉴定了3号染色体(位置3p25.3)中的人同系物,人rosa26。人rosa26(hrosa26)的规范shs基因座是chr3:9,415,082
–
9,414,043。参见
pellenz等人“new human chromosomal sites with"safe harbor"potential for targeted transgene insertion.”human gene therapy vol.30,7(2019):814-828,其相关公开内容以引用的方式并入本文。
[0134]
安全港位点的另外实例提供于pellenz等人“new human chromosomal sites with"safe harbor"potential for targeted transgene insertion.”human gene therapy vol.30,7(2019):814-828,其相关公开内容以引用的方式并入本文。
[0135]
本公开涉及用于鉴定具有包括但不限于转基因的高敲入效率和高表达的益处的安全港基因座的方法。当前公开的方法的应用的实例是鉴定用于将转基因(例如,嵌合抗原受体(car))插入t细胞中的安全港基因座。在一些实施方案中,本公开的安全港基因座可用于插入编码转基因的序列。在一些实施方案中,安全港位点允许转基因高表达(足以实现转基因功能性或对目标疾病的治疗)和转基因在数天、数周或数月内的稳定表达。在一些实施方案中,安全港基因座处基因的敲除为细胞的功能带来益处,或者安全港基因座处的基因在细胞内没有已知功能。在一些实施方案中,安全港基因座使得:在有或没有cd3/cd28刺激的情况下转基因在体外稳定表达,如通过iguide-seq或crispr-seq所检测脱靶裂解可忽略不计,如通过iguide-seq或crispr-seq所检测相对于其他基因座脱靶裂解减少,转基因非依赖性细胞毒性可忽略不计,转基因非依赖性细胞因子表达可忽略不计,转基因非依赖性嵌合抗原受体表达可忽略不计,附近基因的失调控或沉默可忽略不计,以及定位于癌相关基因之外。
[0136]
如所用,“附近基因”可以指代距离安全港基因座(整合位点)约100kb、约125kb、约150kb、约175kb、约200kb、约225kb、约250kb、约275kb、约300kb、约325kb、约350kb、约375kb、约400kb、约425kb、约450kb、约475kb、约500kb、约525kb、约550kb内的基因。
[0137]
在一些实施方案中,本公开设想包含一个或多个转基因的插入物。转基因可以编码治疗性蛋白质、抗体、肽、自杀基因、凋亡基因或任何其他目标基因。使用本文所述的方法鉴定的安全港基因座允许转基因整合,其导致例如增强的治疗特性。如本文所用,这些增强的治疗特性是指与相同正常细胞类型的典型免疫细胞相比,细胞的增强的治疗特性。例如,与典型的、未修饰的和/或天然存在的nk细胞相比,具有“增强的治疗特性”的nk细胞具有增强的、改善的和/或增加的治疗结果。免疫细胞的治疗特性可以包括但不限于细胞移植、运输、归巢、活力、自我更新、持久性、免疫应答控制和调控、存活和细胞毒性。免疫细胞的治疗特性还表现为:抗原靶向受体表达;hla呈递或缺乏;对瘤内微环境的耐受性;旁观者免疫细胞的诱导和免疫调节;减量下靶标特异性提高;对治疗诸如化学疗法的抗性。
[0138]
如本文所用,术语“插入物大小”是指整合(插入)到安全港位点处的核苷酸序列的长度。在一些实施方案中,插入物大小包括至少约100个、200个、300个、400个或500个碱基对。在一些实施方案中,插入物大小包括约500个核苷酸或碱基对。在一些实施方案中,插入物大小包括多达0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20kbp(千碱基对)或介于之间的大小。在一些实施方案中,插入物大小为大于0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20kbp或介于之间的大小。在一些实施方案中,插入物大小在3-15kbp的范围内或者是该范围内的任何数字。在一些实施方案中,插入物大小在1.5-8.3kbp的范围内或者是该范围内的任何数字。在一些实施方案中,插入物大小在1.5-15kbp的范围内或者是该范围内的任何数字。在一些实
sequence)等的插入物或盒。
[0141]
各种细胞类型被设想为具有本公开中的安全港位点。如本公开中所述的包含安全港位点的细胞和/或包含位于安全港位点的插入物的细胞可称为工程化细胞。所述可细胞包括但不限于真核细胞、原核细胞、动物细胞、植物细胞、真菌细胞等。任选地,细胞是哺乳动物细胞,例如人细胞。在一些实施方案中,该工程化细胞是干细胞、人细胞、原代细胞、造血细胞、适应性免疫细胞、先天免疫细胞、t细胞或t细胞祖细胞。本公开中设想的免疫细胞的非限制性实例包括t细胞、b细胞、自然杀伤(nk)细胞、nkt/inkt细胞、巨噬细胞、骨髓细胞和树突细胞。本公开中设想的干细胞的非限制性实例包括多能干细胞(psc)、胚胎干细胞(esc)、诱导型多能干细胞(ipsc)、通过核移植获得的胚胎来源的胚胎干细胞(ntes;核移植es)、雄性生殖系干细胞(gs细胞)、胚胎生殖细胞(eg细胞)、造血干细胞/祖细胞干细胞(hspc)、体干细胞(成体干细胞)、成血管细胞、神经干细胞、间充质干细胞和其他细胞(包括骨细胞、软骨细胞、肌细胞、心肌细胞、神经元、肌腱细胞、脂肪细胞、胰腺细胞、肝细胞、肾细胞、滤泡细胞等)的干细胞。在一些实施方案中,工程化细胞是t细胞、nk细胞、ipsc和hspc。在一些实施方案中,本公开中使用的工程化细胞是体外生长的人细胞系(例如,故意永生化的细胞系、癌细胞系等)。
[0142]
用于将插入物整合到安全港位点处的方法可以是病毒或非病毒递送技术。
[0143]
在一些实施方案中,通过引入包含核酸的载体,例如病毒载体,将核酸序列插入到工程化细胞的基因组中。病毒载体的实例包括但不限于腺相关病毒(aav)载体、逆转录病毒载体或慢病毒载体。在一些实施方案中,慢病毒载体是整合酶缺陷型慢病毒载体。
[0144]
在一些实施方案中,将核酸序列通过非病毒递送插入t细胞的基因组中。在非病毒递送方法中,核酸可以是裸dna,或在非病毒质粒或载体中。非病毒递送技术可以是位点特异性整合技术,如本文所述或本领域普通技术人员已知的。用于整合到安全港基因座中的位点特异性技术的实例包括但不限于使用核酸酶的同源依赖性工程化和使用cas9的同源非依赖性靶向插入。在一些实施方案中,非病毒递送方法包括电穿孔。
[0145]
在一些实施方案中,通过向工程化细胞中引入以下各项将插入物整合到安全港位点处:(a)使安全港位点中的靶区裂解而产生插入位点的靶向核酸酶;和(b)核酸序列(插入物),其中插入物通过例如hdr并入插入位点。可用于本公开的方法中的非病毒递送技术的实例提供于美国申请第16/568,116号和第16/622,843号中,其相关公开内容以引用的方式整体并入本文。
[0146]
工程化细胞在插入转基因后可以保持其未分化状态。在一些实施方案中,工程化细胞是未分化的。在一些实施方案中,工程化细胞在插入转基因后是未分化的。在一些实施方案中,工程化细胞在插入转基因后是cd45ra
和ccr7
。在一些实施方案中,工程化细胞在插入转基因后是cd45ra
ccr7
cd27
。
[0147]
car t细胞疗法
[0148]
嵌合抗原受体(car)t细胞是经过基因工程化以产生用于免疫疗法的人工t细胞受体的t细胞。嵌合抗原受体是经过工程化以赋予t细胞靶向特定蛋白质的能力的受体蛋白。通过并入例如car对淋巴细胞(例如t细胞)进行基因修饰,并将工程化细胞施用至受试者是“过继细胞疗法”的一个实例。如本文所用,术语“过继细胞疗法”是指用于输注自体或同种异体淋巴细胞(称为t细胞或b细胞)的基于细胞的免疫疗法。在这种car治疗方法中,在输注
前对细胞进行离体扩增和培养,并进行基因修饰。
[0149]
car的表达允许工程化t细胞靶向并结合特定蛋白质,例如肿瘤抗原。在car疗法中,t细胞是从受试者采集的,这些细胞可以是来自受试者自己的血液或来自将不会接受car疗法的供体的自体t细胞。分离后,利用car对t细胞进行基因修饰,离体扩增,并通过例如输注施用至受试者(即患者)。
[0150]
可以使用例如病毒技术(例如,逆转录病毒整合)或位点特异性技术将car引入t细胞中。通过转基因(例如car)的位点特异性整合,转基因可以靶向安全性港基因座。用于整合到安全港基因座中的位点特异性技术的实例包括但不限于使用核酸酶的同源依赖性工程化和使用cas9的同源非依赖性靶向插入。
[0151]
工程化的car t细胞可应用于免疫肿瘤学。例如,可以选择car来靶向特定的肿瘤抗原。可以使用car t细胞有效靶向的癌症的实例是血液癌症。在一些实施方案中,car t细胞疗法可用于治疗实体瘤。
[0152]
基因编辑
[0153]
如本文所用,术语“基因编辑”或“基因组编辑”是指使用人工操纵的核酸酶或“分子剪刀”从基因组中插入、置换或移除dna的一种基因操纵。它是阐明序列特异性基因或蛋白质的功能和作用或改变细胞行为(例如用于治疗目的)的有用工具。
[0154]
目前可用的基因组编辑工具包括锌指核酸酶(zfn)和转录激活因子样效应核酸酶(talen),以在安全港基因座(例如腺相关病毒整合位点1(aavs1)安全港基因座)处插入基因。利用phic31整合酶和bxb1整合酶的dice(双整合酶盒交换)系统是一种用于靶标整合的工具。此外,成簇规律间隔的短回文重复序列/cas9(crispr/cas9)技术可用于靶向基因插入。
[0155]
位点特异性基因编辑方法可以包括同源依赖性机制或同源非依赖性机制。
[0156]
在本文所述的方法中设想本领域已知的用于靶向插入基因序列的所有方法以在安全港基因座处插入构建体。
[0157]
crispr-cas基因编辑
[0158]
基因编辑的一个有效实例是crisp-cas方法(例如crispr-cas9)。该方法结合使用指导多核苷酸(例如指导核糖核酸或grna)和cas核酸内切酶(例如cas9核酸内切酶)。
[0159]
如本文所用,称为“cas核酸内切酶”或具有“cas核酸内切酶活性”的多肽是指由cas基因编码的crispr相关(cas)多肽,其中cas多肽是当可操作地连接至一个或多个指导多核苷酸时可以被裂解的靶dna序列(参见,例如,美国专利第8,697,359号)。该定义还包括保留指导多核苷酸依赖性核酸内切酶活性的cas核酸内切酶的变体。在本文详述的供体dna插入方法中使用的cas核酸内切酶是将双链断裂引入dna中的靶位点处(例如,靶基因座内或安全港位点处)的核酸内切酶。
[0160]
如本文所用,术语“指导多核苷酸”涉及能够与cas核酸内切酶复合并允许cas核酸内切酶识别并裂解dna靶位点的多核苷酸序列。指导多核苷酸可以是单分子或双分子。指导多核苷酸序列可以是rna序列、dna序列或它们的组合(rna-dna组合序列)。仅包含核糖核酸的指导多核苷酸也称为“指导rna”。在一些实施方案中,使用指导rna(grna)与cas核酸内切酶(例如cas9核酸内切酶)的组合将多核苷酸供体构建体插入安全港基因座处。
[0161]
指导多核苷酸包括与靶dna中的核苷酸序列互补的第一核苷酸序列结构域(也称
为可变靶向结构域或vt结构域),以及与cas核酸内切酶多肽相互作用的第二核苷酸。它可以是包含序列结构域(称为cas核酸内切酶识别结构域或cer结构域)的双分子(也称为双链指导多核苷酸)。这种双分子指导多核苷酸的cer结构域包含两个沿着互补区杂交的独立分子。两个独立分子可以是rna序列、dna序列和/或rna-dna组合序列。
[0162]
使用crispr-cas方法的基因组编辑依赖于由rna指导的cas核酸内切酶(例如cas 9核酸内切酶)诱导的位点特异性dna双链断裂(dsb)的修复。对这些dsb的同源定向修复(hdr)使得能够通过引入限定的基因组变化(包括碱基取代、序列插入和缺失)实现基因组的精确编辑。常规的基于hdr的crispr/cas9基因组编辑涉及用cas9、grna和含有与目标基因组基因座匹配的同源臂的供体dna转染细胞。
[0163]
hiti(同源非依赖性靶向插入)使用基于非同源末端接合(nhej)的同源非依赖性策略,并且该方法比hdr更有效。指导rna(grna)靶向插入位点。对于hiti,供体质粒缺乏同源臂,并且dsb修复不会通过hdr途径发生。供体多核苷酸构建体可以经工程化以包括位于待插入基因或序列侧翼的cas9裂解位点。这导致cas9在供体质粒和基因组靶序列处裂解。靶标和供体都有平端,线性化的供体dna质粒被nhej途径所用,导致整合到基因组dsb位点中。(参见,例如,suzuki,k.等人(2016)。in vivo genome editing via crispr/cas9 mediated homology-independent targeted integration.nature,540(7631),144-149,其相关公开内容整体并入本文)。
[0164]
使用crispr-cas方法进行基因编辑的方法是本领域普通技术人员已知的。(参见,例如,美国申请第us16/312,676号、第us15/303,722号和第us15/628,533号,其公开内容以引用的方式整体并入本文)。此外,核酸内切酶用于将转基因插入安全港基因座中的用途描述于例如美国申请第13/036,343号中,其公开内容以引用的方式整体并入本文。
[0165]
编码核酸内切酶的指导rna和/或mrna(或dna)可以化学连接至一个或多个增强寡核苷酸的活性、细胞分布或细胞摄取的部分或缀合物。此类部分的非限制性实例包括脂质部分(诸如胆固醇部分)、胆酸、硫醚、巯基胆固醇、脂族链(例如,十二烷二醇或十一烷基残基)、磷脂(例如二-十六烷基-外消旋-甘油或三乙基铵1,2-二-o-十六烷基-外消旋-甘油-3-h-膦酸酯)、聚胺或聚乙二醇链、金刚烷乙酸、棕榈基部分和十八胺或己基氨基-羰基-t-羟胆固醇部分。参见例如美国申请第15/715,068号,其公开内容以引用的方式整体并入本文。
[0166]
治疗应用
[0167]
对于治疗应用,将工程化细胞、其群体或其组合物以有效量施用至受试者,一般是哺乳动物,一般是人。
[0168]
可通过输注(例如,在一段时间内连续输注)或本领域普通技术人员已知的其他施用方式将工程化细胞施用至受试者。
[0169]
本文提供的工程化细胞可以作为药物组合物的一部分来施用。在一些实施方案中,本公开提供了包含本公开的指导rna的组合物。药物组合物可包含一种或多种药物赋形剂。可使用任何适合药物赋形剂,并且本领域普通技术人员能够选择适合药物赋形剂。因此,以下提供的药物赋形剂旨在说明而非限制。另外的药物赋形剂包括例如描述于以下中的那些:handbook of pharmaceutical excipients,rowe等人(编)第6版(2009),其以引用的方式整体并入。
[0170]
本文提供的工程化细胞不仅可用于基因疗法,还可用于非药物用途,诸如例如动物模型的产生以及表达目标蛋白质的重组细胞系的产生。
[0171]
本公开的工程化细胞可以是已通过在本文所述的安全港基因座处整合转基因而经修饰的任何细胞,一般是哺乳动物细胞,一般是人细胞。在一些实施方案中,工程化细胞是免疫细胞。在一些实施方案中,工程化细胞是淋巴细胞。在一些实施方案中,工程化细胞是t细胞或t细胞祖细胞。
[0172]
本公开的工程化细胞、组合物和方法可用于治疗应用,诸如car t细胞疗法和tcr t细胞疗法。在一些实施方案中,在安全港基因座内插入编码转基因的序列相对于没有插入时的情况保持tcr表达,并在保持tcr功能的同时实现转基因表达。
[0173]
本文提供了使用工程化细胞、其群体或其组合物治疗的各种疾病。此类疾病的非限制性实例包括斑秃、自身免疫性溶血性贫血、自身免疫性肝炎、癌症、皮肌炎、糖尿病(1型)、某些幼年特发性关节炎、肾小球肾炎、格雷夫斯病(graves'disease)、格瓦二氏综合征(guillain valley syndrome)、特发性血小板减少性紫癜、重症肌无力、某些心肌炎、多发性硬化症、天疱疮/类天疱疮、恶性贫血、结节性多动脉炎、多发性肌炎、原发性胆汁伴肝硬化、牛皮癣、类风湿性关节炎、硬皮病/系统性硬化症、干燥综合征、系统性红斑狼疮、某些甲状腺炎、某些葡萄膜炎、白斑病、多发性血管炎(韦格纳(wegener)));自身免疫性病症,包括但不限于肉芽肿病;造血系统肿瘤,包括但不限于急性和慢性白血病、淋巴瘤、多发性骨髓瘤和骨髓增生异常综合征;前列腺癌、乳腺癌、肺癌、结肠癌、子宫癌、皮肤癌、肝癌、骨癌、胰腺癌、卵巢癌、睾丸癌、膀胱癌、肾癌、头癌、颈癌、胃癌、宫颈癌、直肠癌、喉癌或食管实体瘤;hiv(人免疫缺陷病毒)相关病症、rsv(呼吸道合胞病毒)相关病症;ebv(爱泼斯坦-巴尔病毒(epstein-barr virus))相关病症;cmv(巨细胞病毒)相关病症;以及感染性疾病,包括但不限于腺病毒相关病症和bk多瘤病毒相关病症。
[0174]
可用本公开的工程化细胞(例如,car t细胞)、其群体或其组合物治疗的癌症包括血液癌症。在一些实施方案中,使用本文所述的工程化细胞(例如,car t细胞)、其群体或其组合物治疗的癌症是血液系统恶性肿瘤或白血病。在一些实施方案中,本文所述的工程化细胞(例如,car t细胞)、其群体或其组合物用于治疗急性成淋巴细胞性白血病(all)或弥漫性大b细胞淋巴瘤(dlbcl)。在一些实施方案中,癌症是急性骨髓性白血病(aml)、急性成淋巴细胞性白血病(all)、骨髓增生异常、骨髓增生异常综合征、急性t淋巴细胞白血病或急性早幼粒细胞白血病、慢性粒单核细胞白血病或慢性骨髓性白血病的髓母细胞危象。可使用本文所述的工程化细胞(例如,car t细胞)治疗的癌症的实例包括但不限于乳腺癌、卵巢癌、食管癌、膀胱癌或胃癌、唾液管癌、唾液管癌、肺腺癌,或侵袭性形式的子宫癌,诸如子宫浆液性子宫内膜癌。在一些其他实施方案中,癌症是脑癌、乳腺癌、宫颈癌、结肠癌、结直肠癌、子宫内膜癌、食管癌、白血病、肺癌、肝癌、黑素瘤、卵巢癌、胰腺癌、直肠癌、肾癌、胃癌、睾丸癌或子宫癌。在其他实施方案中,癌症是鳞状细胞癌、腺癌、小细胞癌、黑素瘤、成神经细胞瘤、肉瘤(例如,血管肉瘤或软骨肉瘤)、喉癌、腮腺癌、胆道癌、甲状腺癌、肢端雀斑样痣黑素瘤、光化性角化病、急性淋巴细胞性白血病、急性骨髓性白血病、腺样囊性癌、腺瘤、腺肉瘤、腺鳞癌、肛管癌、肛门癌、肛门直肠癌、星形细胞肿瘤、巴氏腺癌(bartholin gland carcinoma)、基底细胞癌、胆道癌、骨癌、骨髓癌、支气管癌、支气管腺癌、类癌、胆管癌、软骨肉瘤、脉络丛乳头状瘤/癌、慢性淋巴细胞性白血病、慢性骨髓性白血病、透明细胞癌、结缔
组织癌、囊腺瘤、消化系统癌症、十二指肠癌、内分泌系统癌症、内胚窦瘤、子宫内膜增生、子宫内膜间质肉瘤、子宫内膜样腺癌、内皮细胞癌、室管膜癌、上皮细胞癌、尤文氏肉瘤、眼和眼眶癌、女性生殖器癌、局灶性结节性增生、胆囊癌、胃窦癌、胃底癌、胃泌素瘤、成胶质细胞瘤、胰高血糖素瘤、心脏病、成血管细胞瘤、血管内皮瘤、血管瘤、肝腺瘤、肝腺瘤病、肝胆管癌、肝细胞癌、霍奇金病、回肠癌、胰岛素瘤、上皮内瘤变、上皮间鳞状细胞瘤变、肝内胆道癌、浸润性鳞状细胞癌、空肠癌、关节癌、卡波济氏肉瘤、盆腔癌、大细胞癌、大肠癌、平滑肌肉瘤、恶性雀斑样痣黑素瘤、淋巴瘤、男性生殖器癌、恶性黑素瘤、恶性间皮肿瘤、成神经管细胞瘤、髓质上皮瘤、脑膜瘤、间皮癌、转移癌、口腔癌、粘液表皮样癌、多发性骨髓瘤、肌肉癌、鼻道癌、神经系统癌、神经上皮腺癌、结节性黑素瘤、非上皮性皮肤癌、非霍奇金淋巴瘤、燕麦细胞癌、少突神经胶质癌、口腔癌、骨肉瘤、乳突浆液腺癌、阴茎癌、舌咽癌、垂体肿瘤、浆细胞瘤、假肉瘤、肺母细胞瘤、直肠癌、肾细胞癌、呼吸系统癌、视网膜母细胞瘤、横纹肌肉瘤、肉瘤、浆液性癌、鼻窦癌、皮肤癌、小细胞癌、小肠癌、平滑肌癌、软组织癌、生长抑素分泌肿瘤、脊柱癌、鳞状细胞癌、横纹肌癌、间皮下癌、浅表扩散性黑素瘤、t细胞白血病、舌癌、未分化癌、输尿管癌、尿道癌、膀胱癌、泌尿系统癌、宫颈癌、宫体癌、葡萄膜黑素瘤、阴道癌、疣状癌、血管活性肠肽瘤(vipoma)、外阴癌、高分化癌或威尔姆斯瘤(wilms tumor)。
[0175]
在一些实施方案中,本公开提供了通过向需要治疗的受试者施用包含本文所述的任何工程化细胞的组合物来治疗受试者的方法。如所使用,术语“治疗(treat/treatment)”等一般指获得所需药理和/或生理作用。该作用就完全或部分预防疾病而言是预防性的并且/或者在部分或完全治愈疾病和/或由疾病引起的副作用而言是治疗性的。如本文所用,术语“治疗”涵盖对受试者(例如,哺乳动物,例如人)的疾病的任何治疗。治疗还可指代将本文提供的工程化细胞施用至对疾病易感但尚未被诊断为罹患该疾病的受试者,包括预防疾病的发生;抑制疾病进展;或减轻疾病(即,导致疾病消退)。此外,治疗可以稳定或减少受试者(例如,患者)的不良临床症状。本文提供的细胞、其群体或其组合物可在疾病或损伤发生之前、期间或之后施用。
[0176]
在某些实施方案中,受试者患有可以通过细胞疗法治疗和/或改善的疾病、疾患和/或损伤。在一些实施方案中,需要细胞疗法的受试者是具有损伤、疾病或疾患的受试者,从而引起细胞疗法(例如,将细胞物质施用至受试者的疗法)。然而,设想有可能治疗、改善与损伤、疾病或疾患相关的至少一种症状和/或降低其严重性。在某些实施方案中,需要细胞疗法的受试者包括但不限于骨髓移植或干细胞移植候选者、已接受化学疗法或放射疗法的受试者、过度增殖性疾病或癌症(例如,造血系统)、患有或有风险发展过度增殖性疾病或癌症的受试者、患有或有风险发展肿瘤(例如,实体瘤)、病毒感染或病毒的受试者。还意图涵盖罹患或有风险罹患与感染相关的疾病的受试者。
[0177]
在一些实施方案中,本公开提供本公开的组合物连同使用说明。使用说明可以作为包装插页存在于药盒中,存在于药盒容器或其部件的标签中,或者可以呈数字形式(例如,在cd-rom上,通过互联网上的链接)。药盒可以包括一种或多种基因组靶向核酸、编码基因组靶向核酸的多核苷酸、定点多肽和/或编码定点多肽的多核苷酸。还设想了药盒内的另外组分,例如缓冲液(诸如复原缓冲液、稳定缓冲液、稀释缓冲液)和/或一种或多种对照载体。
[0178]
联合疗法
[0179]
在一些实施方案中,本公开的工程化细胞或其组合物与至少一种另外的治疗剂一起施用。任何适合的另外的治疗剂可与本文提供的工程化细胞、其群体或其组合物一起施用。在一些方面,另外的治疗剂选自放射、眼科药剂、细胞毒性剂、化学治疗剂、细胞生长抑制剂、抗激素剂、免疫刺激剂、抗血管生成剂以及它们的组合。
[0180]
在一些实施方案中,本公开的工程化细胞或其组合物与类固醇一起施用。类固醇的施用可以预防或减轻接受工程化细胞或其组合物的受试者发生自身免疫反应的风险。
[0181]
可通过任何适合方式施用另外的治疗剂。在一些实施方案中,本文所述的工程化细胞、其群体或其组合物和另外的治疗剂在相同的药物组合物中施用,例如,通过输注施用。在一些实施方案中,本文所述的工程化细胞和另外的治疗剂包含在不同的药物组合物中。
[0182]
药物组合物可包含一种或多种药物赋形剂。可使用任何适合药物赋形剂,并且本领域普通技术人员能够选择适合药物赋形剂。因此,以下提供的药物赋形剂旨在说明而非限制。另外的药物赋形剂包括例如描述于以下中的那些:handbook of pharmaceutical excipients,rowe等人(编)第6版(2009),其以引用的方式整体并入。
[0183]
本文设想了施用另外治疗剂的各种模式。在一些实施方案中,通过任何适合施用模式施用另外的治疗剂。一般来说,施用模式包括但不限于玻璃体内、视网膜下、脉络膜上、动脉内、真皮内、肌肉内、腹膜内、静脉内、经鼻、肠胃外、外用、经肺和皮下途径。
[0184]
在本文提供的工程化细胞和另外的治疗剂包含在不同的药物组合物中的实施方案中,本文提供的工程化细胞的施用可以在另外的治疗剂施用之前、同时和/或之后发生。
[0185]
另外的实施方案
[0186]
在一些方面,本文提供了工程化细胞,所述工程化细胞包含至少一个编码转基因的序列,其中所述至少一个序列插入安全港基因座内;其中所述安全港基因座处于选自以下的sgrna靶基因座中的任一者或多者处:chr10:33130000-33140000、chr10:72290000-72300000、chr11:128340000-128350000、chr11:65425000-65427000(neat1)、chr15:92830000-92840000、chr16:11220000-11230000、chr2:87460000-87470000、chr3:186510000-186520000、chr3:59450000-59460000、chr8:127980000-128000000、chr9:7970000-7980000、aprt、b2m、capns1、cblb、cd2、cd3e、cd3g、cd5、edf1、ftl、pten、ptpn2、ptpn6、ptprc、ptprcap、rps23、rtraf、serf2、slc38a1、smad2、socs1、srp14、srsf9、sub1、tet2、tigit、trac和trim28。
[0187]
在一些实施方案中,所述至少一个编码转基因的序列的表达可操作地连接至内源启动子。
[0188]
在一些实施方案中,所述至少一个编码转基因的序列的表达可操作地连接至外源启动子。
[0189]
在一些实施方案中,所述靶基因座选自:chr10:33130000-33140000、chr10:72290000-72300000、chr11:128340000-128350000、chr11:65425000-65427000(neat1)、chr15:92830000-92840000、chr16:11220000-11230000、chr2:87460000-87470000、chr3:186510000-186520000、chr3:59450000-59460000、chr8:127980000-128000000和chr9:7970000-7980000。
[0190]
在一些实施方案中,所述靶基因座是chr11:128340000-128350000或chr15:
92830000-92840000。
[0191]
在一些实施方案中,所述靶基因座是选自以下的基因:aprt、b2m、capns1、cblb、cd2、cd3e、cd3g、cd5、edf1、ftl、pten、ptpn2、ptpn6、ptprc、ptprcap、rps23、rtraf、serf2、slc38a1、smad2、socs1、srp14、srsf9、sub1、tet2、tigit、trac和trim28。
[0192]
在一些实施方案中,所述安全港基因座是表4中的gs94或gs102整合位点。
[0193]
在一些实施方案中,所述外源启动子是ef1a启动子。
[0194]
在一些实施方案中,所述工程化细胞是自然杀伤(nk)细胞、诱导型多能干细胞(ipsc)、人多能干细胞(hspc)、t细胞或t细胞祖细胞。
[0195]
在一些实施方案中,所述转基因编码重组蛋白、治疗剂或嵌合抗原受体(car)。
[0196]
在一些方面,本文提供了包含本文所述的工程化细胞和药物赋形剂的组合物。
[0197]
在一些方面,本文提供了用于在安全港基因座处编辑细胞的指导核糖核酸(grna),其中所述grna包含seq id no:1-120中的任一者。
[0198]
在一些方面,本文提供了编辑具有染色体dna的细胞的方法,所述方法包括在所述细胞的所述染色体dna中的安全港基因座内插入至少一个编码转基因的序列,其中所述安全港基因座处于选自以下的sgrna靶基因座中的任一者或多者处:chr10:33130000-33140000、chr10:72290000-72300000、chr11:128340000-128350000、chr11:65425000-65427000(neat1)、chr15:92830000-92840000、chr16:11220000-11230000、chr2:87460000-87470000、chr3:186510000-186520000、chr3:59450000-59460000、chr8:127980000-128000000、chr9:7970000-7980000、aprt、b2m、capns1、cblb、cd2、cd3e、cd3g、cd5、edf1、ftl、pten、ptpn2、ptpn6、ptprc、ptprcap、rps23、rtraf、serf2、slc38a1、smad2、socs1、srp14、srsf9、sub1、tet2、tigit、trac和trim28。
[0199]
在一些实施方案中,所述靶基因座选自:chr10:33130000-33140000、chr10:72290000-72300000、chr11:128340000-128350000、chr11:65425000-65427000(neat1)、chr15:92830000-92840000、chr16:11220000-11230000、chr2:87460000-87470000、chr3:186510000-186520000、chr3:59450000-59460000、chr8:127980000-128000000和chr9:7970000-7980000。
[0200]
在一些实施方案中,所述靶基因座是chr11:128340000-128350000或chr15:92830000-92840000。
[0201]
在一些实施方案中,所述靶基因座是选自以下的基因:aprt、b2m、capns1、cblb、cd2、cd3e、cd3g、cd5、edf1、ftl、pten、ptpn2、ptpn6、ptprc、ptprcap、rps23、rtraf、serf2、slc38a1、smad2、socs1、srp14、srsf9、sub1、tet2、tigit、trac和trim28。
[0202]
在一些实施方案中,所述转基因编码重组蛋白、治疗剂或嵌合抗原受体(car)。
[0203]
在一些实施方案中,所述至少一个序列包含外源启动子并且所述外源启动子可操作地连接至所述转基因。
[0204]
在一些实施方案中,所述细胞是t细胞或t细胞祖细胞。
[0205]
在一些实施方案中,使用同源定向修复或同源非依赖性靶向插入来插入所述至少一个序列。
[0206]
在一些实施方案中,使用一个或多个指导核糖核酸(grna)和一个或多个cas9核酸内切酶来插入所述至少一个序列,其中所述一个或多个grna包含seq id no:1-120中的任
enzymology(s.colowick和n.kaplan编,academic press,inc.);remington's pharmaceutical sciences,第18版(easton,pennsylvania:mack publishing company,1990)。
[0220]
实施例1:鉴定编码区中的敲入基因座
[0221]
这组实施例中的实验的目的是鉴定t细胞受体α恒定(trac)基因座之外的编码区中的t细胞敲入(ki)基因座。为了选择候选基因座,使用了表1中所示的标准和要求。
[0222]
表1:用于鉴定编码区内的候选敲入基因座的标准
[0223][0224]
一般来说,对编码区内候选ki基因座的要求是编码基因对t细胞功能不是必需的,或者该基因的敲除将有利于嵌合抗原受体疗法(car t)的功能。
[0225]
如表1所示,出于比较目的,用于鉴定候选ki基因座的一些数据部分来自roth,t.l.等人2019(rapid discovery of synthetic dna sequences to rewrite endogenous t cell circuits.biorxiv,604561),其相关公开内容以引用的方式整体并入本文。roth,t.l.等人论文中的数据总结显示在图3中。
[0226]
图4a和图4b显示处理过的rna-seq数据,显示基于激活状态和细胞类型的样本集群。供体4(aki4)被确定为异常值,因为其以与其他供体不同的方式聚类,并从剩余分析中
移除。将来自roth,t.l.等人论文中引用的90个基因的rna-seq实验的转录表达数据与roth,t.l.等人论文中的转录物表达数据相关。(参见图5a和图5b)。
[0227]
图6显示了atac-seq数据的处理过程,其集中在转录起始位点(tss)周围的10kb区域。同样,根据cd4和cd8细胞中的表达谱,供体4(aki4)被确定为异常值,并从剩余分析中移除。剩余atac-seq分析的结果显示在图7a至图8中。图7a中tss富集分数的数据也表明所有文库都是高质量的。trac基因座周围开放染色质区域的数据显示,信号最高的是外显子3附近,而不是外显子1(图8)。
[0228]
测定敲入效率:
[0229]
图9和图10显示了ki效率结果(使用下文描述的模型获得),这些结果来自roth,t.l.等人的论文,基于5个供体、2个grna和2个复制/grna。
[0230]
使用rna-seq和atac-seq数据建立线性模型来估计大约90个基因的ki效率。线性模型捕获了数据中33%的变化(即r2=0.33)。图11显示了ki效率对第2天(d2)rna-seq数据、第4天(d4)rna seq数据和d2 atac数据。将线性模型应用于剩余的候选基因以估计它们的ki效率。
[0231]
通过使用来自d2(第2天)的rna-seq表达数据,首先按照预测的ki效率对合并数据集中的所有基因进行排序,从而选择候选编码基因座。候选编码基因座需要在t细胞激活期间稳定表达(例如,相对于第0天(d0)的表达变化《=2倍)。基于atac-seq数据候选基因座还必须是可及的。使用该选择过程/要求,16个充分表征的编码基因(具有已知功能)被选为候选基因。这16个基因的敲除将为car t细胞(例如b2m、cd5、smad2、ptprc、cd3e)的功能带来益处。另外有12个具有高预测ki效率且没有明显必需功能(惰性编码基因)的编码基因被选为候选基因。(参见表2)。
[0232]
表2:选定的ki候选基因座
[0233][0234]
实施例2:鉴定基因沙漠中的敲入基因座
[0235]
表3总结了在非编码区或基因沙漠中选择候选基因座的标准。
[0236]
表3:用于鉴定非编码区内的候选敲入基因座的标准
[0237][0238][0239]
为了在非编码区内选择候选区域,本发明人首先查看基因组的高度可及区(10kb窗口)。最可及区与(i)注释的蛋白质编码基因(》50%可及区域)、(ii)假基因和非编码rna(约20%可及区)和(iii)增强子/调控区(约20%可及区)重叠。要求候选基因距离编码区《10kb。一些与长基因间非编码rna(lincrna)重叠但在t细胞中没有明显功能的区域也被考虑在内。
[0240]
在本领域中用于选择shs的其他标准的实例描述于例如pellenz,s.等人(2019).new human chromosomal sites with“safe harbor”potential for targeted transgene insertion.human gene therapy,30(7),814-828,其相关公开内容以引用的方式整体并入本文。
[0241]
图12是显示位居前位的候选非编码区的归一化ataq seq数据的图。
[0242]
使用上述选择过程/要求,选择了基因沙漠中的11个候选区域。总共有39个ki候选基因座,包括编码区和非编码区中的那些,将被评价为安全港基因座(预测基因座)。
[0243]
实施例3:预测基因座的实验评价
[0244]
材料
[0245]
●
从synthego订购了120个sgrna,每个区域3个sgrna,并通过下一代测序(ngs)评估编辑效率。
[0246]
■
87个靶向编码基因
[0247]
■
33个靶向基因沙漠
[0248]
●
通过genscript合成了189个构建体
[0249]
■
同源臂:各450bp
[0250]
■
egfp用作报告物
[0251]
■
载体骨架:puc57-kan骨架
[0252]
■
78个具有内源启动子
[0253]
■
111个具有ef1a-htlv启动子
[0254]
●
构建体通过genscript进行序列验证,大多数通过测序进行内部验证。sgrna序列提供于表4中,并且构建体序列提供于表5中。
[0255]
方法
[0256]
为了评价预测基因座的有效性,使用以下各项:
[0257]
(87个内源构建体 120个外源构建体)*2=414孔 对照=460
[0258]
3个供体,在3个时间点2个重复:第1周(d6=第6天)、第3周(d21=第21天)和第4周(d28=第28天)
[0259]
对照
[0260]
仅dna(无核糖核蛋白(rnp)):游离型表达(n=8)
[0261]
dna 非靶向指导物 rnp:检查使用rnp时dna递送是否更有效(n=8)
[0262]
测量pmax gfp以检查转染是否正常(n=3)。
[0263]
无电穿孔下的wt细胞
[0264]
电穿孔下的wt细胞
[0265]
对照散布在板上。
[0266]
在无rnp/hdr的情况下对细胞进行电穿孔,以检查细胞计数是否有意义。
[0267]
添加了2个供体并在1个时间点更改为3个重复:第1周(d6)
[0268]
facs小组:gfp、tcr、zombie
[0269]
每3个孔清洗一次。
[0270]
收集的次要数据包括:rna-seq数据:d0、d2和d4(以确定稳定表达);和atac-seq数据:d2(以确定活化细胞)。用于执行rna-seq和atac-seq实验的方法在roth,t.l.等人2019.(rapid discovery of synthetic dna sequences to rewrite endogenous t cell circuits.biorxiv,604561)中,其以引用的方式整体并入本文。
[0271]
使用.fcs文件对facs数据执行自动门控。对于具有内源启动子的构建体,使用了所有5个供体和所有3个时间点。对于具有ef1a启动子的构建体,使用了3个供体者(供体1-3)和2个时间点(wk3和wk4)。
[0272]
为了总结数据,删除了ki效率%(gfp高细胞%)《=10%的孔(可能是门控误差、实验误差或最小整合)。接着按照供体之中的中位表达和供体之中的中位ki效率%对基因座进行排序。
[0273]
基因座显著性是使用稳健排序聚合计算的,稳健排序聚合是用于在供体和时间点之间对基因座进行一致排序的方法。用于执行稳健排序聚合的方法在本领域中是已知的。(参见,例如,kolde,r.等人(2012).robust rank aggregation for gene list integration and meta-analysis.bioinformatics(oxford,england),28(4),573
–
580,其公开内容以引用的方式整体并入本文)。
[0274]
结果
[0275]
对照组和实验组的分析结果显示在图13a至图25中。
[0276]
pmax_gfp对照实验的结果显示供体5的细胞计数明显高于其他供体。一般来说,gfp_高读数随着时间的推移而下降,正如预期的那样。(图13a和图13b)。
[0277]
分析游离型gfp表达变化的非靶向对照的实验表明,游离型gfp表达随着时间的推移下降到小于0.05。(图14a和图14b)一些异常值归因于门控误差,这在供体3中最为严重。正如预期的那样,wt对照实验也显示出《0.05gfp_高读数(图15)。
[0278]
如图16和图17所示,当使用sgrna5靶向b2m安全港基因座时,供体之中的趋势更加一致。
[0279]
对存在内源报告物下的针对trac插入和表达的sgrna79与sgrna83之间的gfp表达趋势的比较显示,在sgrna79和sgrna83之间供体2趋势不同,而供体4趋势相同(图18和图22)。重复和供体之间观察到的变化的一些潜在原因包括:
[0280]
(1)手动处理大量板(例如,图26):
[0281]
边缘效应
[0282]
电穿孔误差
[0283]
(2)供体之间的固有差异(例如,图27):
[0284]
测定中某些孔的产量存在一致的差异(跨越数周)
[0285]
供体之间的细胞数量不同
[0286]
(3)门控误差(例如,图28):
[0287]
gfp信号中的1个峰与》2个峰
[0288]
实施例4:按照表达和ki效率对基因座进行排序
[0289]
根据报告基因gfp的平均荧光强度(mfi)和ki效率对基因座进行排序。
[0290]
图29显示具有内源启动子的所有显著基因座的gfp mfi和ki效率。b2m基因座报告了最高的gfp mfi。trac基因座位于mfi前10位。第1周报告的gfp mfi读数最高,第3周和第4周略有下降。结果还显示大多数位居前位的基因座具有超过1个sgrna。关于ki效率,socs1基因座报告了最高的ki效率。总的来说,供体之间ki效率的变化比gfp mfi更大。
[0291]
图30显示了具有外源启动子(例如ef1a启动子)的所有显著基因座的gfp mfi和ki效率。trac基因座报告了最高的gfp mfi。在第3周和第4周之间有可比较的表达。结果还显示大多数位居前位的基因座具有超过1个sgrna。关于ki效率,socs1基因座报告了最高的ki效率。总的来说,由外源启动子驱动时的ki效率变化小于由内源启动子驱动时的ki效率变化。
[0292]
图31a、图31b和图31c显示了具有内源和外源(例如,ef1a)启动子的所有显著基因座的gfp mfi和ki效率。结果表明,由ef1a启动子驱动的表达比内源启动子高约10倍(图31a)。关于ki效率,socs1基因座报告了最高的ki效率。在第3周和第4周,由外源启动子驱动时的ki效率高于由内源启动子驱动时的ki效率。
[0293]
实施例5:评价候选非编码位点中的tcr表达
[0294]
执行该实验是为了鉴定在不破坏tcr的情况下实现高转基因表达的靶基因座和整合位点。一些基因沙漠(例如基因沙漠2、3、5和6)被鉴定为具有高转基因表达(图32a)。
[0295]
为了评价和鉴定优选的敲入位点,在primer(启动受体(myc))回路盒敲入后测量tcr表达。myc表示用以促进检测表面表达的引物受体的n末端myc表位标签。简单来说,将cd3-cd28 dynabead激活的t细胞用靶向所指示位点(参见图32b和图33a)的sgrna/cas9rnp
以及引导hdr介导的整合进入所指示位点的具有同源臂的hdrt进行电穿孔。在电穿孔后第6天,用抗tcrα/β和抗myc抗体对细胞进行染色,并在attune nxt流式细胞仪上进行分析。如图32b所示,在gs94和gs102候选整合(敲入)位点tcr表达得以维持。只有2/3的在gs79(trac)基因座处具有primer回路盒敲入的细胞维持了tcr表达。这些结果表明gs94和gs102位点显示出更好的tcr刺激潜力。
[0296]
使用gs94整合位点时,显示有效敲入的细胞的百分比(基于primer的测量)为36%
±
4%,相较之下使用trac整合位点时为32%
±
5%。这些结果揭示了支持可重复的高回路盒敲入率的整合位点,包括gs94。参见图33a。
[0297]
实施例6:评价gs94回路表达和功能
[0298]
gs94是位于11号染色体远端q臂上的候选整合位点。它在ets1和fli1的启动子的180-350kb范围内(图33b),但它被认为对于整合载体基因疗法是低风险的。评价了gs94基因的回路表达和功能潜力。
[0299]
t细胞在gs79(trac)整合位点和gs94整合位点经历primer回路盒整合。将细胞与k562 c19细胞共培养48小时,接着将primer诱导的car mfi与primer mfi进行比较。
[0300]
简单来说,在电穿孔后第7天,将如上文实施例中所述产生的t细胞与k562 cd19 /msln-细胞共培养。msln(间皮素)是一种在人胰腺癌中过度表达的基因。接着在共培养开始后48小时用抗flag抗体对细胞进行染色,并在attune nxt流式细胞仪上进行分析。结果显示,在与k562 c19细胞共培养48小时后,gs94产生了优异的car诱导与高prime r表达。参见图34a。gs94导致启动抗原依赖性car表达,比其他几个候选整合位点以及trac整合位点的表达高大约两倍。此外,平均而言,启动受体表面表达水平不低于使用trac整合位点时表达水平的50%。
[0301]
细胞毒性和细胞因子分泌
[0302]
为了评价候选整合位点对细胞毒性和细胞因子分泌的影响,将在gs79(trac)整合位点和gs94整合位点经历primer回路盒整合的t细胞与k562 c19/msln细胞共培养48小时。msln是一种在人胰腺癌中过度表达的基因。以1:1的效应物:靶细胞比(1:1e:t)处理细胞。简单来说,在电穿孔后第7天,将如上文所述产生的t细胞与k562cd19 /msln-细胞共培养。共培养开始后48小时,收集上清液并通过luminex分析细胞因子水平。细胞因子量度是il-2、infg和tnf。通过测量48小时后剩余靶细胞的荧光素酶活性来分析细胞毒性。图34b中的每个数据点代表两个重复,线条代表重复的细胞毒性范围。如图34b所示,gs94整合位点在与k562 c19/msln细胞共培养48小时后导致优异的细胞毒能力和细胞因子分泌。
[0303]
引物非依赖性细胞毒性
[0304]
为了比较候选整合位点对细胞毒性与引物非依赖性细胞毒性的影响,在电穿孔后第7天,将在gs79(trac)整合位点和gs94整合位点经历primer回路盒整合的t细胞与k562 cd19 /msln 细胞或k562 cd19-/msln 细胞(“k562_msln”)共培养48小时。测试0.3、1.0和3.0的e:t细胞比。参见图35a和图35b。在共培养开始后48小时,通过测量剩余靶细胞的荧光素酶活性来分析细胞毒性。如图35b所示,gs94整合位点产生与trac整合位点等同的细胞毒性潜力,并且不存在引物非依赖性细胞毒性。
[0305]
引物非依赖性细胞因子分泌
[0306]
为了比较候选整合位点对细胞毒性与引物非依赖性细胞毒性的影响,将上文所述
的在gs79(trac)整合位点和gs94整合位点经历primer回路盒整合的t细胞与k562 cd19 /msln 细胞共培养。将仅具有靶细胞的组(e:t=0;仅靶标)与e:t细胞比为1的组进行比较。在与k562 cd19 /msln 细胞共培养48小时后,收集上清液并通过luminex分析细胞因子水平以测量il-2、infg和tnf细胞因子的分泌。参见图36a和图36b。如图36b所示,gs94整合位点导致与trac整合位点等同的细胞因子分泌,并且不存在引物非依赖性的il-2、infg或tnf分泌。
[0307]
引物非依赖性car表达
[0308]
为了评价候选整合位点对引物非依赖性car表达的影响,将在gs79(trac)整合位点、gs94整合位点、gs102整合位点经历primer回路盒整合的t细胞体外培养32天。在实验的第5、12、19和28天,对细胞进行重复cd3/cd28刺激处理。在第16天,使用流式细胞术测定评价细胞的car表达。如图37所示,通过tcr激活t细胞没有导致候选整合位点处回路盒整合的prime r非依赖性car表达。
[0309]
将如上文所述产生的t细胞在96孔板中培养,每2天更换一次t细胞生长培养基。在第5、12、19和28天,用1:1cd3/cd28 dynabead刺激t细胞。通过myc表位标签染色分析细胞的primer表达,并在所指示时间点通过flag表位标签染色分析car表达。在attune nxt流式细胞仪上进行流式分析。
[0310]
实施例7:评价数周内启动受体表达的稳定性
[0311]
为了评价候选整合位点对primer稳定(持续)表达的影响,将在图38所指示的整合位点经历primer回路盒整合的t细胞体外培养32天。简单来说,将如上文所述产生的t细胞在96孔板中培养,每2天更换一次t细胞生长培养基。在第5、12、19和28天,用1:1cd3/cd28 dynabead重复刺激刺激t细胞。在第16天和第32天使用attune nxt流式细胞仪进行流式细胞术测定。通过myc表位标签染色分析细胞的primer表达。如图38a和图38b所示,gs94整合位点导致至少4周时段内稳定的primer表达。
[0312]
实施例8:评价中靶编辑效率
[0313]
为了评价候选敲入位点的中靶编辑效率,使用iguide-seq测定。用于进行iguide-seq测定的方法示于图39a并提供于nobles等人,genome biology(2019)中,其据此以引用的方式整体并入本文。如图39b所示,gs94整合位点在评价的候选整合位点中具有最高的中靶编辑效率。如图39c所示,gs94没有导致如在两名供体中观察到的推定的脱靶编辑。
[0314]
实施例9:评价gs94敲入
[0315]
方法
[0316]
elevation预测:使用elevation-search(listgarten等人2018.prediction of off-target activities for the end-to-end design of crispr guide rnas.nat biomed engr 2,37-48中描述的算法;获自https://github.com/microsoft/elevation的软件)对来自(gs94)的潜在脱靶位点进行计算预测。使用rhamp-seq对通过elevation-search确定的所有位点进行分析。
[0317]
rhampseq:49个通过iguide或elevation预测算法确定的gs94候选脱靶位点和gs94靶位点通过rhampseq(integrated dna technologies,inc.)来表征。这种有针对性的扩增能够对同时发生在多个位点的编辑进行基于ngs的定量。用genfind v3 dna纯化系统(beckman coulter)分离至少2名供体的t细胞的基因组dna,这些供体分别用以下7种指导
物中的每一种单独处理过:gs84、gs94、gs95、gs96、gs102、gs108和gs138。使用两个单独的rhampseq扩增池来覆盖50个基因座,按照integrated dna technologies的建议对每个样本进行该程序。在miniseq上用mid output kit(300个周期)(illumina)对rhampseq文库进行测序。使用crispresso2算法(https://github.com/pinellolab/crispresso2)用于确定每个扩增基因座的插入和缺失百分比。使用卡方检验仅在gs94位点观察到统计显著性(fdr调整后的p值≤0.001)。
[0318]
rna-seq:为了评价gs94整合在转录水平上诱导的变化,在gs79(trac)、gs94和gs102整合位点处整合了cd19/msln回路。整合后第6天,使用bd facsaria基于转基因表达对1e6个经编辑的细胞进行分类。使用rneasy试剂盒(qiagen)从分选的t细胞中分离出rna。使用truseq rna文库制备试剂盒v2(illumina)将纯化的rna转化为ngs文库。在novaseq 6000或nextseq 550仪器(illumina)上对文库进行测序。使用star 2.7.3a比对器(dobin a.等人bioinformatics.2013.29:15-21)将rna-seq数据与参考人grch38转录组进行比对,并获得基因水平的读计数。使用edger(robinson md等人bioinformatics.2010.26:139-140)计算差异表达,结合两名供体的数据。与在任何其他两个基因座处整合的细胞相比,gs94位点300kb内仅有的基因ets1和fli1于在gs94整合位点处整合的细胞中无差异性表达。在fdr调整后的p值截断值为0.01时,差异性表达的基因的数量最少(全基因组《100个基因)。
[0319]
细胞因子非依赖性生长测定:为了评价具有gs94基因座ki的原代t细胞的安全性,进行了细胞因子非依赖性生长测定以评价致癌转化的可能性。简单来说,将在gs94基因座处经历cd19/msln回路盒整合的原代人t细胞解冻并恢复过夜。接着将1x106个细胞接种到24孔grex板的一个孔中,在含或不含细胞因子的培养基中培养5天。在第0、3和5天记录细胞数量和活力。作为阳性对照,在不含细胞因子的培养基中平行培养1x106个jurkat细胞。如图43所示,gs94 ki t细胞在有细胞因子的情况下培养时保持良好的活力和总细胞计数,而当在没有细胞因子的情况下培养时,gs94 ki t细胞的活力在5天内急剧下降,并且在第5天已无活细胞。在整个测定过程中,阳性对照jurkat细胞在没有细胞因子的情况下保持良好的活力和扩增。综上所述,该数据表明gs94编辑的原代人t细胞的生长、存活和扩增仍然依赖于外源细胞因子,因此不存在细胞转化的问题。
[0320]
结果
[0321]
通过iguide-seq评价靶向候选基因座(包括gs94)的crispr试剂(例如,与sgrna复合的spcas9)的特异性(图40)。靶向gs94的crispr rnp在评价的所有候选者中显示出最高百分比的iguide-seq寡核苷酸盒捕获事件,并且iguide-seq论文中的对照sgrna序列显示出与原始出版物中报告的相似的特异性,这表明测定结果符合预期。
[0322]
推定的脱靶位点取自iguide-seq输出,其已表明推定的位点是虚假的。通过计算方法(elevation软件包)预测另外的靶站点。使用rhamp-seq为每个推定的脱靶位点制备高通量测序文库,并将该方法应用于使用靶向候选靶位点的crispr rnp进行电穿孔的t细胞的dna样本。将所得ngs数据用crispresso2软件进行处理,插入和缺失(插入缺失)的频率视为crispr裂解活性的指标,这在该领域很常见。与靶向其他位点的crispr rnp处理的t细胞相比,用靶向gs94的crispr rnp电穿孔的t细胞在一组推定脱靶位点上显示的插入缺失频率并没有更高,这与靶向gs94的crispr rnp没有相应的或可检测到的脱靶活性一致,因此
是评价的一组中最具特异性的(图41)。
[0323]
gs94位点处的转基因整合对t细胞转录组调控的潜在影响是通过将大盒敲入该位点,使t细胞生长数天,对表达该盒内转基因的细胞进行分类,接着从细胞中收集rna来评价的。制备rna-seq文库并对其进行测序,对所得illumina测序数据的分析显示,与trac或gs102位点整合的细胞相比,gs94位点整合的细胞中gs94位点300kb内的任何基因的表达在生物学上或统计学上无显著差异(图42)。此外,达到统计显著性的其他基因表达差异在数量和效应量上都是最小的,这与它们在比较中是噪声一致。
[0324]
为了评估gs94处的转基因整合是否赋予转化的表型,将在gs94位点处整合的细胞在有和没有细胞因子的情况下进行体外培养。细胞在添加细胞因子的情况下保持存活和活力,但在没有细胞因子补充的情况下死亡并失去其活力(图43)。阳性对照jurkat细胞保持活力并增殖。总的来说,这指示在gs94处的转基因整合不赋予细胞因子非依赖性生长的能力,这是t细胞转化的一个标志。
[0325]
实施例10:car表达盒的体内插入
[0326]
针对经工程化表达car抗原或表达启动受体和car两者的抗原的人肿瘤细胞(诸如k562),对具有表达识别肿瘤抗原的car、或在识别肿瘤解剖结构附近的抗原的启动受体控制下表达识别肿瘤抗原的car的转基因盒的t细胞的体内功效进行评估。将肿瘤细胞(例如1e6个)皮下注射到nsg小鼠(jackson laboratories)的侧腹。每2-4天用卡尺通过尺寸测量评估肿瘤生长。当肿瘤体积达到约100立方毫米时,向小鼠静脉内注射:5e6个通过crispr介导的插入在特定位点整合car或prime-car回路盒的t细胞,或经单独的crispr rnp工程化的t细胞,或作为假注射的单独的pbs。监测肿瘤生长,当肿瘤体积达到2000立方毫米时对小鼠实施安乐死。通过眶后手术从小鼠抽取外周血,并使用流式细胞术和/或ddpcr观察工程化t细胞随时间的扩增。在安乐死时,通过流式细胞术、ddpcr和/或免疫组织化学分析脾脏、血液、肿瘤和/或其他组织中工程化t细胞的存在。结果表明,与未进行盒整合的t细胞相比,在限定的基因组基因座之一进行盒整合的工程化t细胞导致注射小鼠的肿瘤消退和清除,并且在注射小鼠的外周血和组织中可检测到工程化t细胞。
[0327]
实施例11:评价gs94中8.3kb大表达盒的非病毒插入
[0328]
接下来,使用如先前描述的材料/方法将8.3kb插入物插入t细胞中的gs94安全港基因座中。盒的图解提供于图44中。
[0329]
构建体产生
[0330]
为了产生用于敲入的质粒构建体,从twist、idt和genewiz订购合成的dna,并通过gibson assembly和golden gate assembly进行组装。质粒含有与基因组中crispr靶位点侧翼的序列同源的同源臂,长度为1.2kb或450bp。
[0331]
t细胞工程化
[0332]
使用lymphoprep(stemcell technologies)和easysep人t细胞分离试剂盒(stemcell technologies)从获自正常供体leukopaks(stemcell technologies)获得的外周血单核细胞(pbmc)富集t细胞。随后将t细胞在补充有3%人ab血清(gemini bio)和12.5ng/ml人il-7和il-15(miltenyi优质级)的texmacs培养基(miltenyi 130-197-196)中用cd3/cd28 dynabead以1:1珠细胞比(thermofisher,40203d)激活,在37℃、5% co2下培养48小时,然后电穿孔。
integration of new dna in the human genome.nature reviews cancer,12(1),51-58.
[0346]
irion,s.,luche,h.,gadue,p.,fehling,h.j.,kennedy,m.,&keller,g.(2007).identification and targeting of the rosa26 locus in human embryonic stem cells.nature biotechnology,25(12),1477-1482.
[0347]
pellenz,s.,phelps,m.,tang,w.,hovde,b.t.,sinit,r.b.,fu,w.,...&monnat jr,r.j.(2019).new human chromosomal sites with“safe harbor”potential for targeted transgene insertion.human gene therapy,30(7),814-828.
[0348]
roth,t.l.,li,p.j.,nies,j.f.,yu,r.,nguyen,m.l.,lee,y.,...&nguyen,d.n.(2019).rapid discovery of synthetic dna sequences to rewrite endogenous t cell circuits.biorxiv,604561.
[0349]
表4:用于评价预测基因座的sgrna序列
[0350]
[0351]
[0352]
[0353]
[0354]
[0355]
[0356]
[0357]
[0358][0359]
表5:用于评价预测基因座的构建体
[0360]
[0361]
[0362]
[0363]
[0364]
[0365]
[0366]
[0367]
[0368]
[0369]
[0370]
[0371]
[0372]
[0373]
[0374]
[0375]
[0376]
[0377]
[0378]
[0379]
[0380]
[0381]
[0382]
[0383]
[0384]
[0385]
[0386]
[0387]
[0388]
[0389]
[0390]
[0391]
[0392]
[0393]
[0394]
[0395]
[0396]
[0397]
[0398]
[0399]
[0400]
[0401]
[0402]
[0403]
[0404]
[0405]
[0406]
[0407]
[0408]
[0409]
[0410]
[0411]
[0412]
[0413]
[0414]
[0415]
[0416]
[0417]
[0418]
[0419]
[0420]
[0421]
[0422]
[0423]
[0424]
[0425]
[0426]
[0427]
[0428]
[0429]
[0430]
[0431]
[0432]
[0433]
[0434]
[0435]
[0436]
[0437]
[0438]
[0439]
[0440]
[0441]
[0442]
[0443]
[0444]
[0445]
[0446]
[0447]
[0448]
[0449]
[0450]
[0451]
[0452]
[0453]
[0454]
[0455]
[0456]
[0457]
[0458]
[0459]
[0460]
[0461]
[0462]
[0463]
[0464]
[0465]
[0466]
[0467]
[0468]
[0469]
[0470]
[0471]
[0472]
[0473]
[0474]
[0475]
[0476]
[0477]
[0478]
[0479]
[0480]
[0481]
[0482]
[0483]
[0484]
[0485]
[0486]
[0487]
[0488]
[0489]
[0490]
[0491]
[0492]
[0493]
[0494]
[0495]
[0496]
[0497]
[0498]
[0499]
[0500]
[0501]
[0502]
[0503]
[0504]
[0505]
[0506]
[0507]
[0508]
[0509]
[0510]
[0511]
[0512]
[0513]
[0514]
[0515]
[0516]
[0517]
[0518]
[0519]
[0520]
[0521]
[0522]
[0523]
[0524]
[0525]
[0526]
[0527]
[0528]
[0529]
[0530]
[0531]
[0532]
[0533]
[0534]
[0535]
[0536]
[0537]
[0538]
[0539]
[0540]
[0541]
[0542]
[0543]
[0544]
[0545]
[0546]
[0547]
[0548]
[0549]
[0550]
[0551]
[0552]
[0553]
[0554]
[0555]
[0556]
[0557]
[0558]
[0559]
[0560]
[0561]
[0562]
[0563]
[0564]
[0565]
[0566]
[0567]
[0568]
[0569]
[0570]
[0571]
[0572]
[0573]
[0574]
[0575]
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
![5α-羟基-6β-[2-(1H-咪唑-4-基)乙基氨基]胆甾烷-3β-醇的前药及包含其的用于癌症治疗的药物组合物的制作方法](/upload/img/20230806/5fabyoipu.jpg)