生产硫酸化多糖的方法和生产paps的方法
技术领域
1.本发明涉及一种使用表达atp硫酸化酶和aps激酶(腺苷酰硫酸激酶)的棒状杆菌属细菌,从廉价原材料例如葡萄糖和腺嘌呤生产3
’‑
磷酸腺苷5
’‑
磷酰硫酸(在后文中被称为paps)的方法,以及一种使用所述棒状杆菌属(corynebacterium)细菌和表达各种不同硫酸化酶的属于原核生物的微生物生产硫酸化多糖的方法。
背景技术:
2.paps是一种广泛存在于从微生物到高等生物中的辅酶,并在体内起到硫酸基团的供体的作用。在高等生物中,paps为糖胺聚糖例如硫酸软骨素和硫酸乙酰肝素的生物合成所需。已知硫酸化的体内代谢物具有各种不同的生理功能,并且paps本身有望用作生发剂(ptl 1)、具有保湿效果的皮肤外用制剂(ptl 2)等。
3.作为生产paps的方法,已知的有使用源自于纯化酵母的atp硫酸化酶、源自于青霉的aps激酶和源自于大肠埃希氏杆菌(escherichia coli)的焦磷酸酶,并使用atp作为原材料的方法(npl 1);使用源自于嗜热细菌的热稳定性atp硫酸化酶、源自于酵母的aps激酶和焦磷酸酶,并与上述方法中相同使用atp作为原材料的方法(ptl 3);使用源自于热稳定细菌的atp硫酸化酶、源自于铜绿假单胞菌(pseudomonas aeruginosa)的aps激酶和多聚磷酸激酶,并使用腺苷5
’‑
单磷酸(在后文中被称为amp)作为原材料的方法(ptl 4);等等。
4.同时,已知一种使用产氨棒状杆菌(corynebacterium ammoniagenes)的突变菌株工业生产atp的方法,其中将该细菌细胞的膜用二甲苯或表面活性剂处理以赋予其通透性,并使用廉价原材料例如葡萄糖和腺嘌呤(npl 2)。
5.paps是一种非常不稳定的化合物。即使在使用粗酶的方法中,也通过制备用大肠埃希氏杆菌作为宿主重组表达的源自于热稳定细菌的aps激酶和atp硫酸化酶的粗酶,然后在反应前进行热处理从而抑制源自于大肠埃希氏杆菌的污染酶的活性,来生产paps(ptl 4)。
6.ptl8公开了paps在大肠埃希氏杆菌的粗酶溶液中被降解。大肠埃希氏杆菌具有一些与paps的降解相关的酶,并且可以通过缺失此类酶的基因来抑制paps的降解。
7.作为一种硫酸化多糖的肝素是一种重要的抗凝剂,被用于治疗血栓栓塞和弥散性血管内凝血综合征,以及在人工透析期间和体外循环中预防凝血等。在工业上,大部分肝素从猪的肠黏膜提取并纯化。自2008年因猪源性肝素被杂质污染而造成的致死事故以来,已进行了非动物来源的生产受控/质量受控的肝素的研究和开发。
8.作为一个具体实例,在一种方法中对发酵生产和纯化的作为某些革兰氏阴性微生物的一种荚膜多糖的n-乙酰肝素原(在后文中被称为肝素原(heparosan))进行化学n-脱乙酰化和n-硫酸化,然后进行酶促差向异构化和硫酸化,以产生具有与源自于猪的肝素相同的结构和抗凝活性的肝素(ptl 5至7,和npl 3和4)。
9.已知硫酸软骨素是另一种有用的硫酸化多糖,它已被用作治疗关节疼痛的药物和用于保护角膜表面层的滴眼液。已使用了从各种不同动物组织提取和纯化的硫酸软骨素,
但最近报道了一种利用源自于大肠埃希氏杆菌的荚膜多糖作为原材料,以与肝素相同的方式使用硫酸化酶的方法(npl 5和6)。
10.在利用源自于微生物荚膜的多糖作为原材料,使用纯化的酶进行硫酸化的方法中,paps在硫酸化酶的反应中充当硫酸基团的供体并作为辅酶被需要。在上述使用源自于微生物荚膜的荚膜多糖作为原材料生产硫酸化多糖的方法中,通过向底物多糖转移paps的硫酸基团产生3
’‑
磷酸腺苷5
’‑
磷酸(在后文中被称为pap),对硝基苯基硫酸酯的硫酸基团被酶法转移到所述pap从而再生paps,并且所述多糖的酶法硫酸化反应继续进行(ptl 6和npl 3)。
11.[引文表]
[0012]
[专利文献]
[0013]
[ptl 1]wo2012/057336
[0014]
[ptl 2]jp-a-2012-201665
[0015]
[ptl 3]jp-a-h5-137588
[0016]
[ptl 4]日本专利号4505011
[0017]
[ptl 5]日本专利号5830464
[0018]
[ptl 6]美国专利号8771995
[0019]
[ptl 7]wo2018/048973
[0020]
[ptl 8]wo2020/013346
[0021]
[非专利文献]
[0022]
[npl 1]glycobiology vol.21,no.6,pp.771-780,2011
[0023]
[npl 2]biosci.biotechnol.biochem.65(3),644-650,2001
[0024]
[npl 3]carbohydrate polymers 122(2015)399-407
[0025]
[npl 4]advanced drug delivery reviews 97(2016)237-249
[0026]
[npl 5]metabolic engineering 27(2015)92-100
[0027]
[npl 6]biotechnology and bioengineering 115(2018)1561-1570
技术实现要素:
[0028]
[技术问题]
[0029]
在npl 1以及ptl 1和2中描述的用于生产paps的常规方法各自使用了相对昂贵的核苷酸例如atp和amp作为原材料,并使用通过培养细菌,然后分离细菌细胞,通过超声等破碎细菌细胞和离心制备的酶或粗酶。因此,不容易在工业规模上执行那些方法。
[0030]
另一方面,如上所述,为了生产paps,已知一种使用纯化的酶或粗酶并利用atp或amp作为原材料的方法,但使用微生物本身生产paps的实例是未知的。此外,如上所述,paps是一种非常不稳定的化合物,并且在现有技术中,在使用粗酶的情况下,要进行复杂的步骤例如通过热处理抑制污染酶的活性。
[0031]
鉴于上述情况,难以预测可以通过与用于工业生产atp的方法相似的方法,简单地通过在作为宿主的棒状杆菌属细菌中表达atp硫酸化酶和aps激酶来生产paps。这是因为与大肠埃希氏杆菌的情况相同,棒状杆菌属也具有一些与paps的降解相关的酶。
[0032]
此外,如上所述,用于酶法硫酸化多糖的常规方法使用了多种硫酸化酶,它们从通
过培养表达硫酸化酶的微生物,然后收集并超声等而制备的细胞裂解液纯化。这些方法不容易在工业规模上实施。此外,需要昂贵的paps和对硝基苯基硫酸酯作为原材料。
[0033]
因此,本发明的一个目的是提供一种通过将利用微生物或其处理物的代谢活性的paps生产/再生系统与表达硫酸化酶的微生物或其处理物或提取物在混合廉价原材料例如硫酸镁后进行反应来容易地生产硫酸化多糖的方法。本发明的另一个目的是提供一种从廉价原材料生产paps的实用方法。
[0034]
[技术解决方案]
[0035]
本发明的发明人基于下述发现(1)和(2),完成了本发明。
[0036]
(1)通过培养其中通过使用具有atp生产能力的棒状杆菌属细菌作为宿主的重组dna技术增强了atp硫酸化酶和aps激酶活性的菌株,使用表面活性剂等赋予其膜通透性,并添加原材料例如葡萄糖和腺嘌呤,与现有技术的方法相比,可以更容易且廉价地生产paps。
[0037]
(2)通过使用(1)中描述的具有增强的atp硫酸化酶和aps激酶活性的菌株作为负责paps生产/再生反应的微生物细菌细胞,赋予表达差向异构酶和/或硫酸化酶的属于原核生物的微生物以膜通透性,并执行混合反应,可以在不进行酶纯化或paps添加的情况下,使用细菌细胞和廉价原材料例如硫酸镁来生产硫酸化多糖。
[0038]
也就是说,本发明如下所述。
[0039]
1.一种生产硫酸化多糖的方法,所述方法包括下述步骤(1-1)和(1-2):
[0040]
(1-1)制备棒状杆菌属细菌的转化体(a)或所述转化体(a)的处理物,所述转化体(a)至少包含以可表达的方式引入到其中的编码atp硫酸化酶的基因和编码aps激酶的基因;和
[0041]
(1-2)使用含有atp或atp源、硫酸根离子源和所述转化体(a)或其处理物的反应溶液进行生产paps的反应。
[0042]
2.根据1所述的生产硫酸化多糖的方法,所述方法还包括下述步骤(2-1)和(2-2):
[0043]
(2-1)制备属于原核生物的微生物的转化体(b)或所述转化体(b)的处理物或提取物,所述转化体(b)至少包含以可表达的方式引入到其中的编码c5-差向异构酶的基因;和
[0044]
(2-2)通过在n-磺基肝素原存在下将所述转化体(b)或其处理物或提取物并入到所述反应溶液中,进行c5-差向异构化。
[0045]
3.根据1或2所述的生产硫酸化多糖的方法,其包括通过包含以可表达的方式引入到其中的编码磺基转移酶的基因的转化体或所述转化体的处理物或提取物进行硫酸化。
[0046]
4.根据3所述的生产硫酸化多糖的方法,所述方法还包括下述步骤(3-1)和(3-2):
[0047]
(3-1)制备属于原核生物的微生物的转化体(c)或所述转化体(c)的处理物或提取物,所述转化体(c)至少包含以可表达的方式引入到其中的编码2-o-磺基转移酶的基因;和
[0048]
(3-2)通过在n-磺基肝素原存在下将所述转化体(c)或其处理物或提取物并入到所述反应溶液中,进行2-o-硫酸化。
[0049]
5.根据3或4所述的生产硫酸化多糖的方法,所述方法还包括下述步骤(3
’‑
1)至(3
’‑
3):
[0050]
(3
’‑
1)制备属于原核生物的微生物的转化体(b)或所述转化体(b)的处理物或提取物,所述转化体(b)至少包含以可表达的方式引入到其中的编码c5-差向异构酶的基因;
[0051]
(3
’‑
2)制备属于原核生物的微生物的转化体(c)或所述转化体(c)的处理物或提
取物,所述转化体(c)至少包含以可表达的方式引入到其中的编码2-o-磺基转移酶的基因;和
[0052]
(3
’‑
3)通过在n-磺基肝素原存在下将所述转化体(b)或其处理物或提取物和转化体(c)或其处理物或提取物并入到所述反应溶液中,进行c5-差向异构化和2-o-硫酸化。
[0053]
6.根据3至5中的任一项所述的生产硫酸化多糖的方法,所述方法还包括下述步骤(4-1)和(4-2):
[0054]
(4-1)制备属于原核生物的微生物的转化体(d)或所述转化体(d)的处理物或提取物,所述转化体(d)至少包含以可表达的方式引入到其中的编码6-o-磺基转移酶的基因;和
[0055]
(4-2)通过在n-磺基肝素原存在下将所述转化体(d)或其处理物或提取物并入到所述反应溶液中,进行6-o-硫酸化。
[0056]
7.根据3至6中的任一项所述的生产硫酸化多糖的方法,所述方法还包括下述步骤(5-1)和(5-2):
[0057]
(5-1)制备属于原核生物的微生物的转化体(e)或所述转化体(e)的处理物或提取物,所述转化体(e)至少包含以可表达的方式引入到其中的编码3-o-磺基转移酶的基因;和
[0058]
(5-2)通过在n-磺基肝素原存在下将所述转化体(e)或其处理物或提取物并入到所述反应溶液中,进行3-o-硫酸化。
[0059]
8.一种生产硫酸化多糖的方法,所述方法包括通过在atp或atp源、硫酸根离子源和n-磺基肝素原存在下在反应溶液中并入下述物质来产生硫酸化多糖:
[0060]
棒状杆菌属细菌的转化体(a)或所述转化体(a)的处理物,所述转化体(a)至少包含以可表达的方式引入到其中的编码atp硫酸化酶的基因和编码aps激酶的基因,和
[0061]
选自下述的至少一者:
[0062]
属于原核生物的微生物的转化体(b)或所述转化体(b)的处理物或提取物,所述转化体(b)至少包含以可表达的方式引入到其中的编码c5-差向异构酶的基因,
[0063]
属于原核生物的微生物的转化体(c)或所述转化体(c)的处理物或提取物,所述转化体(c)至少包含以可表达的方式引入到其中的编码2-o-磺基转移酶的基因,
[0064]
属于原核生物的微生物的转化体(d)或所述转化体(d)的处理物或提取物,所述转化体(d)至少包含以可表达的方式引入到其中的编码6-o-磺基转移酶的基因,和
[0065]
属于原核生物的微生物的转化体(e)或所述转化体(e)的处理物或提取物,所述转化体(e)至少包含以可表达的方式引入到其中的编码3-o-磺基转移酶的基因。
[0066]
9.根据7所述的生产硫酸化多糖的方法,所述方法还包括通过在所述atp或atp源、硫酸根离子源和n-磺基肝素原存在下,在所述反应溶液中并入所述转化体(a)或其处理物和所述转化体(b)至(e)或其处理物或提取物来产生硫酸化多糖。
[0067]
10.根据1至9中的任一项所述的生产硫酸化多糖的方法,其用于生产肝素。
[0068]
11.一种生产paps的方法,所述方法包括下述步骤(i)和(ii):
[0069]
(i)制备棒状杆菌属细菌的转化体或所述转化体的处理物,所述转化体至少包含以可表达的方式引入到其中的编码atp硫酸化酶的基因和编码aps激酶的基因;和
[0070]
(ii)使用含有atp或atp源、硫酸根离子源和在步骤(i)中制备的所述转化体或其处理物的反应溶液,进行生产paps的反应。
[0071]
[有利效果]
thermoaminogenes)(有效棒状杆菌(corynebacterium efficiens))和力士棒状杆菌(corynebacterium herculis)。
[0087]
棒状杆菌属菌株的实例包括产氨棒状杆菌(停滞棒状杆菌(corynebacterium stationis))atcc 6871和atcc 6872、嗜乙酰乙酸棒状杆菌atcc 13870、醋谷棒状杆菌atcc 15806、解烷棒状杆菌atcc 21511、帚石南棒状杆菌atcc 15991、钝齿棒状杆菌as1.542、谷氨酸棒状杆菌atcc 13020、atcc 13032、atcc 13060、atcc 13869和ferm bp-734、百合棒状杆菌atcc 15990、栖糖蜜棒状杆菌atcc17965、有效棒状杆菌(热产氨棒状杆菌)aj12340(ferm bp-1539)、力士棒状杆atcc 13868、散枝短杆菌(brevibacterium divaricatum)(谷氨酸棒状杆菌)atcc 14020、黄色短杆菌(brevibacterium flavum)(谷氨酸棒状杆菌)atcc 13826、atcc 14067和aj12418(ferm bp-2205)以及乳糖发酵短杆菌(brevibacterium lactofermentum)(谷氨酸棒状杆菌)atcc 13869。
[0088]
属于棒状杆菌属的细菌还包括传统上分类为短杆菌属,但现在被整合到棒状杆菌属中的细菌(int.j.syst.bacteriol.,41,255(1991))。此外,停滞棒状杆菌也包括传统上被分类为产氨棒状杆菌,但现在通过16s rrna核苷酸分析等被重新分类为停滞棒状杆菌的细菌[int.j syst.evol.microbiol.,60,874-879(2010)]。
[0089]
这些菌株可以从例如美国典型培养物保藏中心(american type culture collection)(地址:12301parklawn drive,rockville,maryland20852,p.o.box 1549,manassas,va 20108,united states of america)获得。也就是说,每个菌株被提供有登记号,并且可以使用该登记号获得所述菌株(参见https://www.atcc.org/)。对应于每个菌株的登记号描述在美国典型培养物保藏中心的目录中。此外,这些菌株可以从例如保藏有每种菌株的保藏库获得。所述棒状杆菌属细菌可以是野生型菌株、其突变菌株或人工重组体。
[0090]
在本发明中,将编码atp硫酸化酶的基因和编码aps激酶的基因以可表达的方式引入到所述棒状杆菌属细菌中。
[0091]
atp硫酸化酶通过下述反应式从硫酸根产生腺苷5
’‑
磷酰硫酸(aps)。
[0092]
[化学反应式1]
[0093]
atp so
42-→
aps ppi
[0094]
(在上式中,atp代表腺苷5
’‑
三磷酸)
[0095]
所述atp硫酸化酶的一种情况是met3。对atp硫酸化酶的来源没有特别限制,其实例包括源自于酿酒酵母(saccharomyces cerevisiae)、白假丝酵母(candida albicans)、粟酒裂殖酵母(shizosaccharomyces pombe)、解脂耶氏酵母(yarrowia lipolytica)、粗糙脉孢菌(neurospora crassa)、产黄青霉(penicillium chrysogenum)、乳酸克鲁维酵母(kluyveromyces lactis)、藤仓镰孢菌(fusarium fujikuroi)、米曲霉(aspergillus oryzae)或棉囊阿舒氏酵母(ashbya gossypii)的atp硫酸化酶,其中源自于酿酒酵母的atp硫酸化酶是优选的。
[0096]
编码atp硫酸化酶的基因的实例包括seq id no:22中示出的核苷酸序列。其实例还包括编码具有atp硫酸化酶活性的多肽,并包含与seq id no:22中示出的核苷酸序列具有优选地80%或更高、更优选地90%或更高、甚至更优选地95%或更高、特别优选地98%或更高同一性的核苷酸序列的dna;和编码具有atp硫酸化酶活性的多肽,并包含在严紧条件下与seq id no:22中示出的核苷酸序列杂交或与上述核苷酸序列互补的核苷酸序列的
67699]、[miwa,k.等,产谷氨酸细菌中的隐含质粒(cryptic plasmids in glutamic acid-producing bacteria),agric.biol.chem.48:2901-2903(1984)]和[yamaguchi,r.等,乳糖发酵短杆菌质粒pam330的完整核苷酸序列的确定及其遗传信息的分析(determination of the complete nucleotide sequence of the brevibacterium lactofermentum plasmid pam330 and the analysis of its genetic information),nucleic acids symp.ser.16:265-267(1985)];源自于谷氨酸棒状杆菌atcc 3058的phm1519[miwa,k.等,产谷氨酸细菌中的隐含质粒(cryptic plasmids in glutamic acid-producing bacteria),agric.biol.chem.48:2901-2903(1984)]和pcry30[kurusu,y.等,棒状杆菌中质粒分配功能的鉴定(identification of plasmid partition function in coryneform bacteria),appl.environ.microbiol.57:759-764(1991)];源自于谷氨酸棒状杆菌t250的pcg4[jp-a-s57-183799]和[katsumata,r.等,产谷氨酸细菌用质粒dna的原生质体转化(protoplast transformation of glutamate-producing bacteria with plasmid dna),j.bacteriol.,159:306-311(1984)]、pag1、pag3、pag14和pag50[jp-a-s62-166890]以及pek0、pec5和pekex1[eikmanns,b.j.等,用于克隆、受控基因表达和启动子探测的谷氨酸棒状杆菌/大肠埃希氏杆菌穿梭载体家族(a family of corynebacterium glutamicum/escherichia coli shuttle vectors for cloning,controlled gene expression,and promoter probing),gene,102:93-98(1991)],等等。
[0108]
启动子可以是源自于宿主的启动子或异源启动子。其实例包括源自于谷氨酸棒状杆菌r的甘油醛3-磷酸脱氢酶a基因(gapa)的启动子pgapa、苹果酸脱氢酶基因(mdh)的启动子pmdh、乳酸脱氢酶a基因(ldha)的启动子pldha等。
[0109]
终止子的实例包括大肠埃希氏杆菌rrna操纵子的rrnb t1t2终止子、大肠埃希氏杆菌的trpa终止子、乳糖发酵短杆菌的trp终止子等。
[0110]
作为本发明的一个方面,与paps的降解相关的酶的基因表达未被弱化。所述与paps的降解相关的酶的基因的实例包括cysq基因和cp01850基因。作为所述转化体(a)的一种情况,选自cysq基因和cp01850基因的至少一个基因的表达未被弱化。
[0111]
《《转化体(b):c5-差向异构化》》
[0112]
在根据本发明的生产硫酸化多糖的方法中,n-磺基肝素原的c5-差向异构化使用属于原核生物的微生物的转化体(b)或所述转化体(b)的处理物或提取物来进行,所述转化体(b)至少包含以可表达的方式引入到其中的编码c5-差向异构酶的基因。
[0113]
对c5-差向异构酶没有特别限制,只要它可以催化葡萄糖醛酸(glcua)残基向艾杜糖醛酸(idoa)残基的异构化即可。所述c5-差向异构酶可以源自于任何动物、植物、微生物等。例如,可以使用人类c5-差向异构酶作为所述c5-差向异构酶。
[0114]
编码c5-差向异构酶的基因的实例包括seq id no:24中示出的核苷酸序列。其实例还包括编码具有c5-差向异构酶活性的多肽,并包含与seq id no:24中示出的核苷酸序列具有优选地80%或更高、更优选地90%或更高、甚至更优选地95%或更高、特别优选地98%或更高同一性的核苷酸序列的dna;和编码具有c5-差向异构酶活性的多肽,并包含在严紧条件下与seq id no:24中示出的核苷酸序列杂交或与上述核苷酸序列互补的核苷酸序列的dna。
[0115]
转化体中的c5-差向异构酶活性通过所述转化体的细胞提取液中c5-差向异构酶
活性值的提高来检查。c5-差向异构酶活性可以通过文献中描述的方法来测量[babu p.等,使用氢/氘交换质谱法测量硫酸乙酰肝素c-5差向异构酶活性的一种快速、非放射性测定法(a rapid,nonradioactive assay for measuring heparan sulfate c-5epimerase activity using hydrogen/deuterium exchange-mass spectrometry),methods.mol.biol.1229:209-219(2015)]。
[0116]
在下文中,将描述表达磺基转移酶的转化体。在本发明的生产硫酸化多糖的方法中,硫酸化使用包含以可表达的方式引入到其中的编码磺基转移酶的基因的转化体或所述转化体的处理物或提取物来进行。在本发明中,对磺基转移酶没有特别限制,只要它将硫酸基团转移到多糖以产生硫酸化多糖即可。所述磺基转移酶的实例包括2-o-磺基转移酶(2-ost)、6-o-磺基转移酶(6-ost)和3-o-磺基转移酶(3-ost)。
[0117]
《《转化体(c):2-o-硫酸化》》
[0118]
在本发明的生产硫酸化多糖的方法中,2-o-硫酸化使用属于原核生物的微生物的转化体(c)或所述转化体(c)的处理物或提取物来进行,所述转化体(c)至少包含以可表达的方式引入到其中的编码2-o-磺基转移酶(2-ost)的基因。
[0119]
对所述2-ost没有特别限制,只要它可以催化idoa残基在o-2位置处的硫酸化即可。此外,所述2-ost可以源自于任何动物、植物、微生物等。例如,可以使用源自于仓鼠的2-ost作为所述2-ost。
[0120]
编码2-ost的基因的实例包括seq id no:19中示出的核苷酸序列。其实例还包括编码具有2-ost活性的多肽,并包含与seq id no:19中示出的核苷酸序列具有优选地80%或更高、更优选地90%或更高、甚至更优选地95%或更高、特别优选地98%或更高同一性的核苷酸序列的dna;和编码具有2-ost活性的多肽,并包含在严紧条件下与seq id no:19中示出的核苷酸序列杂交或与上述核苷酸序列互补的核苷酸序列的dna。
[0121]
转化体中的2-ost活性通过所述转化体的细胞提取液中2-ost活性值的提高来检查。2-ost活性可以通过文献中描述的方法来检查[zhang j.等,用于生产生物工程肝素的表达2-o-磺基转移酶和c5-差向异构酶的重组大肠埃希氏杆菌菌株的高细胞密度培养(high cell density cultivation of recombinant escherichia coli strains expressing2-o-sulfotransferase and c5-epimerase for the production of bioengineered heparin),appl.biochem.biotechnol.175(6):2986-2995(2015)]。
[0122]
《《转化体(d):6-o-硫酸化》》
[0123]
在本发明的生产硫酸化多糖的方法中,6-o-硫酸化使用属于原核生物的微生物的转化体(d)或所述转化体(d)的处理物或提取物来进行,所述转化体(d)至少包含以可表达的方式引入到其中的编码6-o-磺基转移酶(6-ost)的基因。
[0124]
对所述6-ost没有特别限制,只要它可以催化n-硫酸化葡萄糖胺(glcns)残基在o-6位置处的硫酸化即可。所述6-ost可以源自于任何动物、植物、微生物等。6-ost的实例包括源自于仓鼠的6-ost-1和源自于小鼠的6-ost-3。
[0125]
编码6-ost的基因的实例包括seq id no:25中示出的核苷酸序列。其实例还包括编码具有6-ost活性的多肽,并包含与seq id no:25中示出的核苷酸序列具有优选地80%或更高、更优选地90%或更高、甚至更优选地95%或更高、特别优选地98%或更高同一性的核苷酸序列的dna;和编码具有6-ost活性的多肽,并包含在严紧条件下与seq id no:25中
示出的核苷酸序列杂交或与上述核苷酸序列互补的核苷酸序列的dna。
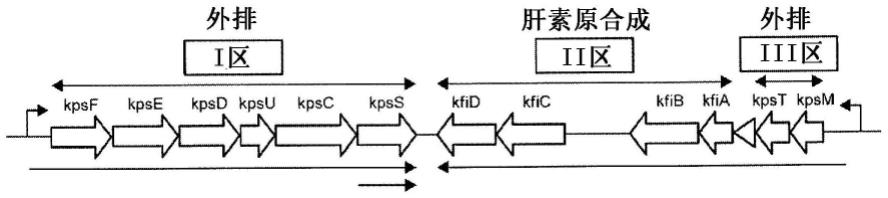
[0126]
转化体中的6-ost活性通过所述转化体的细胞提取液中6-ost活性值的提高来检查。6-ost活性可以通过文献中描述的方法来检查[zhang j.等,用于生产生物工程肝素的表达6-o-磺基转移酶的重组大肠埃希氏杆菌菌株的高细胞密度培养(high cell density cultivation of a recombinant escherichia coli strain expressing a 6-o-sulfotransferase for the production of bioengineered heparin),j.appl.microbiol.118(1):92-98(2015)]。
[0127]
《《转化体(e):3-o-硫酸化》》
[0128]
在本发明的生产硫酸化多糖的方法中,3-o-硫酸化使用属于原核生物的微生物的转化体(e)或所述转化体(e)的处理物或提取物来进行,所述转化体(e)至少包含以可表达的方式引入到其中的编码3-o-磺基转移酶(3-ost)的基因。
[0129]
对所述3-ost没有特别限制,只要它可以催化n-硫酸化/6-o-硫酸化葡萄糖胺残基在o-3位置处的硫酸化即可。所述3-ost可以源自于任何动物、植物、微生物等。例如,可以使用源自于小鼠的3-ost-1作为所述3-ost。
[0130]
编码3-ost的基因的实例包括seq id no:26中示出的核苷酸序列。其实例还包括编码具有3-ost活性的多肽,并包含与seq id no:26中示出的核苷酸序列具有优选地80%或更高、更优选地90%或更高、甚至更优选地95%或更高、特别优选地98%或更高同一性的核苷酸序列的dna;和编码具有3-ost活性的多肽,并包含在严紧条件下与seq id no:26中示出的核苷酸序列杂交或与上述核苷酸序列互补的核苷酸序列的dna。
[0131]
转化体中的3-ost活性通过所述转化体的细胞提取液中3-ost活性值的提高来检查。3-ost活性可以通过文献中描述的方法来检查[jin w.等,提高大鼠脑的肝素生物合成关键酶3-o-磺基转移酶1的可溶性异源表达(increased soluble heterologous expression of a rat brain3-o-sulfotransferase 1-a key enzyme for heparin biosynthesis),protein expr.purif.151:23-29(2018)]。
[0132]
《《属于原核生物的微生物》》
[0133]
对在本发明中用作转化体的宿主的属于原核生物的微生物没有特别限制,只要它可以表达本发明的预定基因即可。其实例包括细菌例如属于埃希氏杆菌属、沙雷氏菌属、芽孢杆菌属、棒状杆菌属、微杆菌属和假单胞菌属的微生物,并且优选地使用埃希氏杆菌属的细菌。
[0134]
对在本发明中使用的属于埃希氏杆菌属的细菌没有特别限制,其实例包括按照微生物学领域专家所知的分类方法分类为埃希氏杆菌属的细菌。属于埃希氏杆菌属的细菌的实例包括在文献中描述的细菌[backmann,bj 1996,大肠埃希氏杆菌k-12的一些突变衍生菌株的衍生和基因型(derivations and genotypes of some mutant derivatives of escherichia coli k-12),p.2460-2488,表1,在f.d.neidhardt主编的《大肠埃希氏杆菌和沙门氏菌的细胞和分子生物学》(escherichia coli and salmonella cellular and molecular biology)第二版中,american society for microbiology press,washington,dc]。
[0135]
属于埃希氏杆菌属的细菌的实例包括大肠埃希氏杆菌。大肠埃希氏杆菌的实例包括大肠埃希氏杆菌k-12菌株例如w3110菌株(atcc27325)和mg1655菌株(atcc 47076)、大肠
埃希氏杆菌k5菌株(atcc23506)、大肠埃希氏杆菌b菌株例如bl21(de3)菌株、大肠埃希氏杆菌nissle 1917菌株(dsm 6601)及其衍生菌株。
[0136]
这些菌株可以从例如美国典型培养物保藏中心(american type culture collection)(地址:12301parklawn drive,rockville,maryland20852,p.o.box 1549,manassas,va 20108,united states of america)获得。也就是说,每个菌株被提供有登记号,并且可以使用该登记号获得所述菌株(参见https://www.atcc.org/)。对应于每个菌株的登记号描述在美国典型培养物保藏中心的目录中。此外,bl21(de3)菌株可以从例如life technologies(产品号c6000-03)获得。
[0137]
出于以可表达的方式引入基因的目的,可以使用可以在宿主中自主复制的载体作为用于属于原核生物的微生物的转化的载体。所述载体优选为多拷贝载体。此外,为了选择转化体,所述载体优选地具有标志物例如抗生素抗性基因或文献中描述的其他基因[karl friehs,质粒拷贝数和质粒稳定性(plasmid copy number and plasmid stability),adv biochem engin/biotechnol 86:47-82(2004)]。此外,为了表达插入的基因,所述载体可以具有启动子或终止子。载体的实例包括源自于细菌质粒的载体、源自于酵母质粒的载体、源自于噬菌体的载体、粘粒、噬菌粒等。
[0138]
能够在大肠埃希氏杆菌属的细菌中自主复制的载体的具体实例包括puc19、puc18、phsg299、phsg399、phsg398、pbr322和pstv29(都来自于takara bio inc.)、pacyc184和pmw219(nippon gene)、ptrc99a(pharmacia)、pprok载体(clontech)、pkk233-2(clontech)、pet载体(novagen)、pqe载体(qiagen)和广宿主范围载体rsf1010。
[0139]
启动子可以是源自于宿主的启动子或异源启动子。所述启动子可以是待引入的基因的固有启动子或其他基因的启动子。
[0140]
终止子的实例包括t7终止子、t4终止子、fd噬菌体终止子、tet终止子和trpa终止子。
[0141]
在上述转化体(b)至(e)中,被引入到属于原核生物的微生物中的两个或更多个基因可以被引入到一个转化体中。更具体来说,例如,编码c5-差向异构酶的基因和编码2-o-磺基转移酶的基因可以被引入到一个属于原核生物的微生物中,以形成一个转化体。
[0142]
《《转化体的处理物》》
[0143]
在本发明中,转化体的处理物是指其中细菌细胞的细胞质膜可通透的物体。在本发明中,当细胞质膜被称为物质可通透时,意味着各种不同的小(离子等)和大(蛋白质等)分子通过扩散穿过细胞膜,并因此可以自由进入和离开细胞膜。在本发明中,转化体的处理物优选为由于赋予细胞膜通透性的处理而失去生长能力的静止细菌细胞。
[0144]
转化体的处理物的实例包括作为转化体的细菌细胞的表面活性剂处理物、所述细菌细胞的溶剂处理物、所述细菌细胞的酶处理物、含有活细菌细胞的保留了与作为酶源的所述细菌细胞的培养物相同的功能的处理物例如所述细菌细胞的固定化产物、所述细菌细胞的超声处理物和所述细菌细胞的机械研磨处理物。
[0145]
使细胞质膜物质可通透的方法的实例包括化学处理和机械处理。在本发明的生产方法中,对使所述转化体的细胞质膜变得物质可通透的时间没有特别限制,只要本发明的效果得以表现即可。使每个转化体的细胞质膜变得物质可通透可以预先进行,或者它可以在通过将反应中使用的转化体彼此接触以进行反应时进行。
[0146]
所述化学处理的实例包括使用表面活性剂的方法、使用有机溶剂的方法和使用酶的方法。作为表面活性剂,优选的是非离子型表面活性剂,因为它对蛋白质等的作用更加温和(当与离子型表面活性剂相比时)。所述表面活性剂的实例包括洋地黄皂苷、皂苷、triton x100、triton x114、吐温20、吐温80、n,n-双(3-d-葡糖酰胺丙基)胆酰胺[bigchap]、n,n-双(3-d-葡糖酰胺丙基)脱氧胆酰胺[脱氧-bigchap]、nikkolbl-9ex[聚氧乙烯(9)月桂基醚]、辛酰基-n-甲基葡糖酰胺[mega-8]、苯扎氯铵等。
[0147]
所述有机溶剂的实例包括苯、甲苯、二甲苯、其他醇类等。所述酶的实例包括溶菌酶、消色肽酶(achromopeptidase)等。
[0148]
使用上述物质的处理的条件例如浓度、温度、时间等随着细胞类型而变,并且需要设置适合的条件以进行所需分析,但通常的处理浓度为10至1000微克/ml,更通常为20-200微克/ml,温度为2℃至37℃,时间为1至30分钟。
[0149]
所述机械处理的实例包括超声处理和机械研磨处理。
[0150]
《《转化体的提取物》》
[0151]
在本发明中,转化体的提取物的实例包括从作为转化体的细菌细胞获得的粗酶提取物、从如上所述(例如化学或机械)处理的细菌细胞获得的纯化的酶、通过培养上述转化体获得的培养物或其处理物的浓缩物和所述培养物的干燥产物。转化体的提取物的实例还包括通过离心或过滤所述培养物获得的细菌细胞、干燥的细菌细胞和冷冻干燥的细菌细胞。
[0152]
《《转化方法和培养转化体的方法》》
[0153]
可以无限制地使用已知的转化方法。此类已知方法的实例包括氯化钙/氯化铷法、磷酸钙法、deae-葡聚糖介导的转染、电脉冲法等。其中,电脉冲法适合于棒状杆菌,并且电脉冲法可以通过已知方法进行[kurusu,y.等,通过营养缺陷互补用于棒状杆菌的电穿孔转化系统(electroporation-transformation system for coryneform bacteria by auxotrophic complementation),agric biol.chem.54:443-447(1990)]。
[0154]
优选地,在每个反应之前通过使用常用于培养微生物的培养基培养来生长所述转化体。作为培养基,通常可以使用天然培养基或含有碳源、氮源、无机盐和其他营养物质的合成培养基。
[0155]
所述碳源可以是atp源。所述碳源的实例包括碳水化合物或糖醇例如葡萄糖、果糖、蔗糖、甘露糖、麦芽糖、甘露糖醇、木糖、阿拉伯糖、半乳糖、淀粉、糖蜜、山梨糖醇和甘油;有机酸例如乙酸、柠檬酸、乳酸、富马酸、马来酸和葡萄糖酸;以及醇类例如乙醇和丙醇。作为碳源,可以单独使用一种,也可以混合两种或更多种。一般来说,这些碳源在培养基中的浓度为约0.1至10(w/v%)就已足够。
[0156]
所述氮源的实例包括无机或有机铵化合物例如氯化铵、硫酸铵、硝酸铵和乙酸铵、尿素、氨水、硝酸钠、硝酸钾等。此外,也可以使用玉米浆、肉提取物、蛋白胨、nz-胺、蛋白质水解物、含氮有机化合物例如氨基酸等。作为氮源,可以单独使用一种,也可以混合并使用两种或更多种。培养基中氮源的浓度随着所使用的氮化合物而变,但通常为约0.1至10(w/v%)。
[0157]
所述无机盐的实例除了硫酸根离子源例如硫酸镁、硫酸锰、硫酸锌和硫酸钴之外,还包括磷酸二氢钾、磷酸氢二钾、硝酸亚铁、氯化钠、碳酸钙等。作为无机盐,可以单独使用
一种,也可以混合并使用两种或更多种。培养基中无机盐的浓度随着所使用的无机盐而变,但通常为约0.01至1(w/v%)。
[0158]
所述营养物质的实例包括肉提取物、蛋白胨、多聚蛋白胨、酵母提取物、干酵母、玉米浆、脱脂奶粉、脱脂大豆盐酸盐水解物、动植物或微生物细菌细胞的提取物及其分解产物等,并且其浓度通常为约0.1至10(w/v%)。此外,必要时可添加维生素。维生素的实例包括生物素、硫胺素(维生素b1)、吡哆醇(维生素b6)、泛酸、肌醇、烟酸等。培养基的ph优选为约6至8。
[0159]
用于微生物的培养基的优选实例包括a培养基[inui,m.等,在缺氧条件下乳酸和琥珀酸生产过程中谷氨酸棒状杆菌的代谢分析(metabolic analysis of corynebacterium glutamicum during lactate and succinate productions under oxygen deprivation conditions),j.mol.microbiol.biotechnol.7:182-196(2004)]、bt培养基[omumasaba,c.a.等,具有相反的atp依赖性调控的谷氨酸棒状杆菌甘油醛3-磷酸脱氢酶同工型(corynebacterium glutamicum glyceraldehyde-3-phosphate dehydrogenase isoforms with opposite,atp-dependent regulation),j.mol.microbiol.biotechnol.8:91-103(2004)]等。作为具体培养条件,例如培养温度为约15℃至45℃,培养时间为约1至7天。
[0160]
《生产硫酸化多糖的方法》
[0161]
根据本发明的生产硫酸化多糖的方法的一种情况是一种生产硫酸化多糖的方法,所述方法包括通过在atp或atp源、硫酸根离子源和n-磺基肝素原存在下,在反应溶液中并入所述转化体(a)或其处理物和选自转化体(b)至(e)或其处理物或提取物中的至少一者,来产生硫酸化多糖。
[0162]
作为根据本发明的生产硫酸化多糖的方法的一种情况,其实例包括一种生产硫酸化多糖的方法,所述方法包括通过在atp或atp源、硫酸根离子源和n-磺基肝素原存在下使用含有所述转化体(a)或其处理物和所述转化体(b)至(e)或其处理物或提取物的反应溶液,来产生硫酸化多糖。
[0163]
此外,根据本发明的生产硫酸化多糖的方法的一种情况是一种生产硫酸化多糖的方法,所述方法包括通过在paps和n-磺基肝素原存在下将选自所述转化体(b)至(e)或其处理物或提取物中的至少一者并入到所述反应溶液中,来产生硫酸化多糖。
[0164]
在本发明的生产方法中,每种转化体可以在一开始就添加到所述反应溶液,可以顺序添加,或者可以在一开始并随后顺序添加。一开始向所述反应溶液添加每种转化体的情况的具体实例包括下述情况,其中通过在atp或atp源、硫酸根离子源和n-磺基肝素原存在下一开始向所述反应溶液添加所述转化体(a)或其处理物和所述转化体(b)至(e)或其处理物或提取物来产生硫酸化多糖。
[0165]
在本发明的使用转化体(a)或其处理物和转化体(b)至(e)或其处理物或提取物的生产硫酸化多糖的方法可以进行下述过程:1)使用所述转化体(a)或其处理物进行paps的供应/再生,2)使用所述转化体(b)或其处理物或提取物进行c5-差向异构化,3)使用所述转化体(c)或其处理物或提取物进行2-o-硫酸化,4)使用所述进行转化体(d)或其处理物或提取物6-o-硫酸化,和5)使用所述转化体(e)或其处理物或提取物进行3-o-硫酸化。
[0166]
在下文中会分开描述每个步骤,但对2)c5-差向异构化、3)2-o-硫酸化、4)6-o-硫
酸化和5)3-o-硫酸化的顺序没有特别限制,只要可以获得所需硫酸化多糖即可。
[0167]
此外,在下文中会分开描述1)paps的供应/再生、2)c5-差向异构化、3)2-o-硫酸化、4)6-o-硫酸化和5)3-o-硫酸化的每个反应,但这些反应中的两者或更多者可以同时进行。例如,这些反应可以使用含有所有所述转化体(a)或其处理物和转化体(b)至(e)或其处理物或提取物的反应溶液同时进行。
[0168]
通过本发明的生产硫酸化多糖的方法生产的硫酸化多糖的实例包括肝素。
[0169]
《《paps的供应/再生》》
[0170]
本发明的生产硫酸化多糖的方法的特征在于包括下述步骤(1-1)和(1-2):
[0171]
(1-1)制备棒状杆菌属细菌的转化体(a)或所述转化体(a)的处理物,所述转化体(a)至少包含以可表达的方式引入到其中的编码atp硫酸化酶的基因和编码aps激酶的基因;和
[0172]
(1-2)使用含有atp或atp源、硫酸根离子源和所述转化体(a)或其处理物的反应溶液进行生产paps的反应。
[0173]
由所述转化体(a)或其处理物表达的atp硫酸化酶和aps激酶与atp或atp源和硫酸根离子源在所述转化体(a)或其处理物中反应,从而产生paps。所述paps在硫酸化多糖的生产中起到硫酸基团的供体的作用。此外,由所述转化体(a)或其处理物产生的paps被用于所述生产硫酸化多糖的方法中,从而获得pap。paps可以通过所述转化体(a)或其处理物从该pap产生。因此,通过将转化体(a)或其处理物并入到所述反应溶液中,可以供应/再生paps。
[0174]
《《c5-差向异构化》》
[0175]
本发明的生产硫酸化多糖的方法优选地包括下述步骤(2-1)和(2-2):
[0176]
(2-1)制备属于原核生物的微生物的转化体(b)或所述转化体(b)的处理物或提取物,所述转化体(b)至少包含以可表达的方式引入到其中的编码c5-差向异构酶的基因;和
[0177]
(2-2)通过在n-磺基肝素原存在下将所述转化体(b)或其处理物或提取物并入到所述反应溶液中,进行c5-差向异构化。
[0178]
在步骤(2-2)中,n-磺基肝素原的c5-差向异构化通过表达c5-差向异构酶的所述转化体(b)或其处理物或提取物来进行。
[0179]
《《2-o-硫酸化》》
[0180]
本发明的生产硫酸化多糖的方法优选地包括下述步骤(3-1)和(3-2):
[0181]
(3-1)制备属于原核生物的微生物的转化体(c)或所述转化体(c)的处理物或提取物,所述转化体(c)至少包含以可表达的方式引入到其中的编码2-o-磺基转移酶的基因;和
[0182]
(3-2)通过在n-磺基肝素原存在下将所述转化体(c)或其处理物或提取物并入到所述反应溶液中,进行2-o-硫酸化。
[0183]
在步骤(3-2)中,n-磺基肝素原的2-o-硫酸化通过表达2-o-磺基转移酶的所述转化体(c)或其处理物或提取物,使用由所述转化体(a)或其处理物产生的paps作为硫酸基团的供体来进行。
[0184]
当所述反应溶液中存在步骤(2-2)中产生的硫酸化多糖时,进行在所述步骤中产生的硫酸化多糖的2-o-硫酸化。例如,当存在具有c5-差向异构化的n-磺基肝素原时,进行所述具有c5-差向异构化的n-磺基肝素原的2-o-硫酸化。
[0185]
上述c5-差向异构化和2-o-硫酸化可以同时进行。也就是说,本发明的生产硫酸化
多糖的方法的一种情况优选地包括下述步骤(3
’‑
1)至(3
’‑
3):
[0186]
(3
’‑
1)制备属于原核生物的微生物的转化体(b)或所述转化体(b)的处理物或提取物,所述转化体(b)至少包含以可表达的方式引入到其中的编码c5-差向异构酶的基因;
[0187]
(3
’‑
2)制备属于原核生物的微生物的转化体(c)或所述转化体(c)的处理物或提取物,所述转化体(c)至少包含以可表达的方式引入到其中的编码2-o-磺基转移酶的基因;和
[0188]
(3
’‑
3)通过在n-磺基肝素原存在下将所述转化体(b)或其处理物或提取物和转化体(c)或其处理物或提取物并入到所述反应溶液中,进行c5-差向异构化和2-o-硫酸化。
[0189]
《《6-o-硫酸化》》
[0190]
本发明的生产硫酸化多糖的方法优选地包括下述步骤(4-1)和(4-2):
[0191]
(4-1)制备属于原核生物的微生物的转化体(d)或所述转化体(d)的处理物或提取物,所述转化体(d)至少包含以可表达的方式引入到其中的编码6-o-磺基转移酶的基因;和
[0192]
(4-2)通过在n-磺基肝素原存在下将所述转化体(d)或其处理物或提取物并入到所述反应溶液中,进行6-o-硫酸化。
[0193]
在步骤(4-2)中,n-磺基肝素原的6-o-硫酸化通过表达6-o-磺基转移酶的所述转化体(d)或其处理物或提取物,使用由所述转化体(a)或其处理物产生的paps作为硫酸基团的供体来进行。
[0194]
当在所述反应溶液中存在步骤(2-2)、(3-2)或(3
’‑
3)中产生的硫酸化多糖时,进行在所述步骤中产生的硫酸化多糖的6-o-硫酸化。
[0195]
例如,当存在具有c5-差向异构化的n-磺基肝素原时,进行所述具有c5-差向异构化的n-磺基肝素原的6-o-硫酸化。当存在具有2-o-硫酸化的n-磺基肝素原时,进行所述具有2-o-硫酸化的n-磺基肝素原的6-o-硫酸化。
[0196]
当存在具有c5-差向异构化和2-o-硫酸化的n-磺基肝素原时,进行所述具有c5-差向异构化和2-o-硫酸化的n-磺基肝素原的6-o-硫酸化。
[0197]
《《3-o-硫酸化》》
[0198]
本发明的生产硫酸化多糖的方法优选地包括下述步骤(5-1)和(5-2):
[0199]
(5-1)制备属于原核生物的微生物的转化体(e)或所述转化体(e)的处理物或提取物,所述转化体(e)至少包含以可表达的方式引入到其中的编码3-o-磺基转移酶的基因;和
[0200]
(5-2)通过在n-磺基肝素原存在下将所述转化体(e)或其处理物或提取物并入到所述反应溶液中,进行3-o-硫酸化。
[0201]
在步骤(5-2)中,n-磺基肝素原的3-o-硫酸化通过表达3-o-磺基转移酶的所述转化体(e)或其处理物或提取物,使用由所述转化体(a)或其处理物产生的paps作为硫酸基团的供体来进行。
[0202]
当所述反应溶液中存在步骤(2-2)、(3-2)、(3
’‑
3)或(4-2)中产生的硫酸化多糖时,进行在所述步骤中产生的硫酸化多糖的3-o-硫酸化。
[0203]
例如,当存在具有c5-差向异构化的n-磺基肝素原时,进行所述具有c5-差向异构化的n-磺基肝素原的3-o-硫酸化。当存在具有2-o-硫酸化的n-磺基肝素原时,进行所述具有2-o-硫酸化的n-磺基肝素原的3-o-硫酸化。当存在具有6-o-硫酸化的n-磺基肝素原时,进行所述具有6-o-硫酸化的n-磺基肝素原的3-o-硫酸化。
[0204]
当存在具有c5-差向异构化和2-o-硫酸化的n-磺基肝素原时,进行所述具有c5-差向异构化和2-o-硫酸化的n-磺基肝素原的3-o-硫酸化。当存在具有c5-差向异构化和6-o-硫酸化的n-磺基肝素原时,进行所述具有c5-差向异构化和6-o-硫酸化的n-磺基肝素原的3-o-硫酸化。当存在具有2-o-硫酸化和6-o-硫酸化的n-磺基肝素原时,进行所述具有2-o-硫酸化和6-o-硫酸化的n-磺基肝素原的3-o-硫酸化。
[0205]
当存在具有c5-差向异构化、2-o-硫酸化和6-o-硫酸化的n-磺基肝素原时,进行所述具有c5-差向异构化、2-o-硫酸化和6-o-硫酸化的n-磺基肝素原的3-o-硫酸化。
[0206]
《《反应条件》》
[0207]
下面将描述上述1)paps的供应/再生、2)c5-差向异构化、3)2-o-硫酸化、4)6-o-硫酸化和5)3-o-硫酸化的反应条件。
[0208]
所述反应溶液的ph优选为约6至8。在反应期间,优选地使用氨水溶液、氢氧化钠水溶液、氢氧化钾等,使用ph控制器将反应溶液的ph控制到接近中性、特别是约7,来进行所述反应。
[0209]
反应温度、即反应期间转化体的存活温度,优选为20℃至50℃,更优选为25℃至47℃。反应时间优选为约1至7天,更优选为约1至3天。培养可以是分批类型、分批补料类型和连续类型中的任一者。其中,分批类型是优选的。
[0210]
通气条件反应可以在还原条件或微需氧条件下进行。还原条件由反应溶液的氧化还原电位定义。反应溶液的氧化还原电位优选为约-200mv至-500mv,更优选为-250mv至-500mv。
[0211]
反应溶液的还原状态可以使用刃天青指示剂容易地估计,并且可以使用氧化还原电位计精确测量。作为制备还原条件下的反应溶液的方法,可以无限制地使用已知方法。
[0212]
具体来说,通过对蒸馏水等进行热处理或减压处理以除去溶解的气体,可以得到用于还原条件下的反应溶液的水性溶液。此外,可以添加适合的还原剂(例如硫代羟基乙酸、抗坏血酸、盐酸胱氨酸、巯基乙酸、硫代乙酸、谷胱甘肽、硫化钠等)来制备用于还原条件下的反应溶液的水性溶液。这些方法的适当组合也是制备用于还原条件下的反应溶液的水性溶液的有效方法。
[0213]
在反应期间维持还原条件的情况下,希望尽可能多地阻止来自于反应体系外部的氧气的混合,并且这种方法的具体实例包括用惰性气体例如氮气或二氧化碳气体封闭反应体系的方法。
[0214]
在反应期间维持微需氧条件的情况下,可以在将通气速率设定到0.5vvm等的低值或更低的值,并将搅拌速度设定到500rpm等的低值或更低的值的条件下进行反应。在某些情况下,反应可以与下述状态相组合进行,在所述状态下在反应开始后的适当时间停止通气,并在搅拌速度为100rpm或更低的条件下提高厌氧状态的程度。
[0215]
《《硫酸化多糖的收集》》
[0216]
通过如上所述的培养在反应溶液中产生硫酸化多糖。所述硫酸化多糖可以通过回收所述反应溶液来收集,并且此外,所述硫酸化多糖可以通过已知方法从所述反应溶液分离。此类已知方法的实例包括蒸馏法、膜渗透法、有机溶剂萃取法等。
[0217]
《《n-磺基肝素原的制备》》
[0218]
在本发明的生产硫酸化多糖的方法中使用的n-磺基肝素原通过对肝素原进行脱
乙酰化、解聚和n-硫酸化来获得。肝素原的生产和从肝素原生产n-磺基肝素原可以通过已知方法来进行(例如wo2018/048973)。
[0219]
生产肝素原的方法的实例包括一种方法,所述方法包括将具有下述(a1)的遗传修饰并具有肝素原生产能力的属于原核生物的微生物在培养基中培养以在所述培养基中产生肝素原,和从所述培养基收集肝素原:
[0220]
(a1)提高kpss基因的表达水平的遗传修饰。
[0221]
除了(a1)之外,所述属于原核生物的微生物可以进一步具有下述遗传修饰(a2)和(a3)中的至少一者:
[0222]
(a2)提高选自kfia、kfib、kfic和kfid基因中的至少一个基因的表达水平的遗传修饰,和
[0223]
(a3)引起yhbj基因的功能丧失的遗传修饰。
[0224]
所述kpss基因是i区、ii区和iii区的基因群中由i区编码的基因。kpss参与肝素原合成的起始。在肝素原生产中,kpss与kpsc一起在向内膜中的磷脂酰甘油添加多个kdo连接物中发挥作用。
[0225]
作为kpss基因,源自于埃希氏杆菌属的kpss基因是优选的。其具体实例包括大肠埃希氏杆菌k5菌株的kpss基因。大肠埃希氏杆菌k5菌株的kpss基因的核苷酸序列和由所述基因编码的蛋白质的氨基酸序列可以从公共数据库获得。大肠埃希氏杆菌k5菌株的kpss基因被登记为genbank登记号caa52659.1。
[0226]
kpss基因的实例包括具有seq id no:27中示出的核苷酸序列的dna,或具有当在属于原核生物的微生物中表达水平提高时提高所述微生物的肝素原生产能力的特性、具有与seq id no:27中示出的核苷酸序列具有90%或更高同一性的核苷酸序列并具有肝素原生产能力的dna。
[0227]
kfia、kfib、kfic和kfid是i区、ii区和iii区的基因群中由ii区编码的基因。如图2中所示,kfia、kfib、kfic和kfid参与肝素原的合成,并发挥添加糖并由此合成肝素原的作用。
[0228]
作为kfia、kfib、kfic或kfid基因,源自于埃希氏杆菌属的kfia、kfib、kfic或kfid基因是优选的。其具体实例包括大肠埃希氏杆菌k5菌株的kfia、kfib、kfic或kfid基因。大肠埃希氏杆菌k5菌株的kfia、kfib、kfic或kfid基因的核苷酸序列和由所述基因编码的蛋白质的氨基酸序列可以从公共数据库获得。所述kfia被登记为genbank登记号caa54711.1;所述kfib被登记为genbank登记号cae55824.1;所述kfic被登记为genbank登记号caa54709.1;并且所述kfid被登记为genbank登记号caa54708.1。
[0229]
kfia基因的实例包括具有seq id no:28中示出的核苷酸序列的dna,或具有当在属于原核生物的微生物中表达水平提高时提高所述微生物的肝素原生产能力的特性、具有与seq id no:28中示出的核苷酸序列具有90%或更高同一性的核苷酸序列并具有肝素原生产能力的dna。
[0230]
kfib基因的实例包括具有seq id no:29中示出的核苷酸序列的dna,或具有当在属于原核生物的微生物中表达水平提高时提高所述微生物的肝素原生产能力的特性、具有与seq id no:29中示出的核苷酸序列具有90%或更高同一性的核苷酸序列并具有肝素原生产能力的dna。
[0231]
kfic基因的实例包括具有seq id no:30中示出的核苷酸序列的dna,或具有当在属于原核生物的微生物中表达水平提高时提高所述微生物的肝素原生产能力的特性、具有与seq id no:30中示出的核苷酸序列具有90%或更高同一性的核苷酸序列并具有肝素原生产能力的dna。
[0232]
kfid基因的实例包括具有seq id no:31中示出的核苷酸序列的dna,或具有当在属于原核生物的微生物中表达水平提高时提高所述微生物的肝素原生产能力的特性、具有与seq id no:31中示出的核苷酸序列具有90%或更高同一性的核苷酸序列并具有肝素原生产能力的dna。
[0233]
图3示出了肝素原生物合成途径的示意图。glms是作为肝素原前体的udp-n-乙酰葡萄糖胺的供应途径中的第一个酶,并且是催化从果糖-6-磷酸到葡萄糖胺-6-磷酸的反应的酶。yhbj是负向控制glms的酶。
[0234]
作为yhbj基因,源自于埃希氏杆菌属的yhbj基因是优选的。其具体实例包括大肠埃希氏杆菌k-12菌株的yhbj基因。大肠埃希氏杆菌k-12菌株的yhbj基因的核苷酸序列和由所述基因编码的蛋白质的氨基酸序列可以从公共数据库获得。大肠埃希氏杆菌k-12菌株的yhbj基因被登记为genbank登记号bae77249.1。
[0235]
yhbj基因实例包括具有seq id no:32中示出的核苷酸序列的dna,或具有当在属于原核生物的微生物中表达水平降低时提高所述微生物的肝素原生产能力的特性、具有与seq id no:32中示出的核苷酸序列具有90%或更高同一性的核苷酸序列并具有肝素原生产能力的dna。
[0236]
上述(a1)至(a3)中的各个基因可以从公共数据库,通过例如使用上述各个基因的核苷酸序列进行blast搜索或fasta搜索容易地获得。此外,各个基因的同源物可以使用微生物例如细菌的染色体作为模板并使用在这些已知基因序列的基础上产生的寡核苷酸作为引物,通过例如pcr来获得。
[0237]
上述(a1)至(a3)中的各个基因可以是所述基因的变体,只要由所述基因编码的蛋白质的原始功能(例如活性或性质)得以维持即可。可以检查由所述基因的变体编码的蛋白质是否维持其原始功能;具体来说,例如当所述原始功能是提高肝素原生产能力时,通过将所述基因的变体引入到具有肝素原生产能力的属于原核生物的微生物中。
[0238]
上述(a1)至(a3)中的各个基因的变体可以根据定点突变方法,通过修饰基因的编码区使得在编码蛋白质的特定位置处的氨基酸残基被替换、缺失、插入或添加来获得。此外,上述(a1)至(a3)中的各个基因的变体也可以通过例如突变处理来获得。
[0239]
只要它们的原始功能得以维持,上述(a1)至(a3)中的各个基因可以是具有其中一个或几个位置处的一个或几个氨基酸被替换、缺失、插入或添加的氨基酸序列的蛋白质的编码基因。例如,在编码的蛋白质中,其n-端和/或c-端可以被延长或缩短。短语“一个或几个”根据蛋白质的三维结构中氨基酸残基的位置和类型而不同。其具体实例包括1至50个、1至40个、1至30个,并且它优选为1至20个,更优选为1至10个,甚至更优选为1至5个,特别优选为1至3个。
[0240]
如上所述的一个或几个氨基酸的替换、缺失、插入或添加是维持蛋白质功能正常的保守突变。保守突变的代表是保守替换。保守替换是下述突变:在替换位点是芳香族氨基酸的情况下,发生在phe、trp和tyr之间的替换;在替换位点是疏水氨基酸的情况下,发生在
leu、ile和val之间的替换;在替换位点是极性氨基酸的情况下,发生在gln和asn之间的替换;在替换位点是碱性氨基酸的情况下,发生在lys、arg和his之间的替换;在替换位点是酸性氨基酸的情况下,发生在asp和glu之间的替换;以及在替换位点是具有羟基的氨基酸的情况下,发生在ser和thr之间的替换。被认为是保守替换的替换的具体实例包括用ser或thr替换ala,用gln、his或lys替换arg,用glu、gln、lys、his或asp替换asn,用asn、glu或gln替换asp,用ser或ala替换cys,用asn、glu、lys、his、asp或arg替换gln,用gly、asn、gln、lys或asp替换glu,用pro替换gly,用asn、lys、gln、arg或tyr替换his,用leu、met、val或phe替换ile,用ile、met、val或phe替换leu,用asn、glu、gln、his或arg替换lys,用ile、leu、val或phe替换met,用trp、tyr、met、ile或leu替换phe,用thr或ala替换ser,用ser或ala替换thr,用phe或tyr替换trp,用his、phe或trp替换tyr,以及用met、ile或leu替换val。此外,如上所述的氨基酸替换、缺失、插入、添加及其倒置等,包括由天然存在的突变(突变体或变体)例如基于基因所源自的生物体中的个体差异或种差异的突变所导致的替换、缺失、插入和添加、倒置等。
[0241]
此外,只要它们的原始功能得以维持,上述(a1)至(a3)中的各个基因可以是与所述整个氨基酸序列具有80%或更高、优选地90%或更高、更优选地95%或更高、甚至更优选地97%或更高、特别优选地99%或更高同一性的蛋白质的编码基因。
[0242]
此外,只要它们的原始功能得以维持,上述(a1)至(a3)中的各个基因可以是在严紧条件下与可以从已知基因序列制备的探针、例如与整个或一部分所述核苷酸序列互补的序列杂交的dna。术语“严紧条件”是指形成所谓的特异性杂交体并且不形成非特异性杂交体的条件。其实例包括彼此具有较高水平同一性的dna,例如彼此具有80%或更高、优选地90%或更高、更优选地95%或更高、甚至更优选地97%或更高、特别优选地99%或更高同一性的dna彼此杂交,并且彼此具有较低水平同一性的dna彼此不杂交的条件;或在正常southern杂交中用于清洗的条件,其中清洗在对应于60℃、1x ssc和0.1%sds,优选地60℃、0.1x ssc和0.1%sds,更优选地68℃、0.1x ssc和0.1%sds的盐浓度和温度下进行一次,优选地两次到三次。
[0243]
用于上述杂交的探针可以是各个基因的互补序列的一部分。这种探针可以使用基于已知基因序列产生的寡核苷酸作为引物并使用含有上述(a1)至(a3)中的各个基因的dna片段作为模板,通过pcr来产生。例如,具有约300bp的长度的dna片段可以用作探针。在使用具有约300bp的长度的dna片段作为探针的情况下,在杂交中用于清洗的条件的实例包括50℃、2x ssc和0.1%sds的条件。
[0244]
此外,由于密码子简并性取决于宿主有所不同,因此上述(a1)至(a3)中的各个基因可以是通过将任何密码子用等同密码子替换而获得的基因,只要它们的原始功能得以维持即可。例如,表1至3中的基因可以被修饰,使得它们根据所使用的宿主的密码子使用频率而具有最佳密码子。
[0245]
突变处理的实例包括:用羟胺等体外处理具有上述(a1)至(a3)中的各个基因的核苷酸序列的dna分子的方法;用x-射线、紫外线或诱变剂例如n-甲基-n
’‑
硝基-n-亚硝基胍(ntg)、甲磺酸乙酯(ems)和甲磺酸甲酯(mms)等处理带有上述(a1)至(a3)中的各个基因的微生物的方法。
[0246]
《《提高基因表达的遗传修饰》》
[0247]
短语“基因表达的提高”意味着与未修饰的菌株相比基因的表达提高。提高基因表达的一种情况的实例包括其中与未修饰的菌株相比基因的表达优选地提高1.5倍或更多,更优选地提高2倍或更多,甚至更优选地提高3倍或更多的情况。
[0248]
此外,短语“基因表达被提高”不仅意味着在原本表达靶基因的菌株中所述靶基因表达的提高,而且意味着在原本不表达靶基因的菌株中所述靶基因被表达。也就是说,短语“基因表达被提高”包括例如将靶基因引入到不具有所述靶基因的菌株中并在其中表达所述靶基因的情况。此外,短语“基因表达被提高”也指短语“基因表达被增强”和“基因表达被升高”。
[0249]
基因表达的提高可以通过例如增加所述基因的拷贝数来实现。增加基因的拷贝数可以通过将所述基因引入到宿主的染色体中来实现。基因在染色体中的引入可以使用例如同源重组来进行(miller i,j.h.《分子遗传学实验》(experiments in molecular genetics),1972,cold spring harbor laboratory)。可以引入基因的仅仅一个拷贝,或者可以引入其两个或更多个拷贝。
[0250]
例如,可以通过靶向在染色体上具有多个拷贝的序列进行同源重组,将基因的多个拷贝引入到染色体中。在染色体上具有多个拷贝的序列的实例包括重复dna序列(重复dna)和存在于转座子的两个末端处的反向重复序列。
[0251]
或者,同源重组可以靶向染色体上的适合序列例如对靶物质的生产来说非必需的基因来进行。同源重组可以通过例如使用线性dna的方法、使用含有温度敏感性复制原点的质粒的方法、使用能够接合转移的质粒的方法、使用不具有在宿主中起作用的复制原点的自杀质粒的方法或使用噬菌体的转导方法来进行。此外,也可以使用转座子或mini-mu将基因随机引入到染色体中(jp-a-h2-109985)。
[0252]
可以通过使用具有与所述基因的全部或一部分互补的序列的探针的southern杂交,使用在所述基因的序列的基础上产生的引物的pcr等,来检查靶基因是否已被引入到染色体中。
[0253]
此外,也可以通过将含有基因的载体引入到宿主中,来增加所述基因的拷贝数。例如,可以通过将含有靶基因的dna片段连接到在宿主中起作用的载体以构建所述基因的表达载体,并用所述表达载体转化所述宿主,来增加所述基因的拷贝数。通过例如使用具有靶基因的微生物的基因组dna作为模板的pcr,可以获得含有所述靶基因的dna片段。转化方法没有特别限制,并且可以使用常规已知的方法。
[0254]
作为载体,可以使用可以在宿主细胞中自主复制的载体。所述载体优选为多拷贝载体。此外,所述载体优选地具有标志物例如抗生素抗性基因或文献中描述的其他基因[karl friehs,“质粒拷贝数和质粒稳定性”(plasmid copy number and plasmid stability),adv biochem engin/biotechnol 86:47-82(2004)],以便选择转化体。此外,所述载体可以具有启动子或终止子,以便表达插入的基因。所述载体的实例包括源自于细菌质粒的载体、源自于酵母质粒的载体、源自于噬菌体的载体、粘粒、噬菌粒等。
[0255]
能够在肠杆菌科细菌例如大肠埃希氏杆菌中自主复制的载体的具体实例包括puc19、puc18、phsg299、phsg399、phsg398、pbr322和pstv29(都来自于takara bio inc.)、pacyc184和pmw219(nippon gene)、ptrc99a(pharmacia)、pprok载体(clontech)、pkk233-2(clontech)、pet载体(novagen)、pqe载体(qiagen)和广宿主范围载体rsf1010。
[0256]
在引入基因的情况下,所述基因保留在具有本发明的遗传修饰的属于原核生物的微生物中就已足够。具体来说,所述基因被引入,使得它在本发明的细菌中起作用的启动子序列的控制下表达就已足够。启动子可以是源自于宿主的启动子或异源启动子。所述启动子可以是待引入基因的固有启动子或其他基因的启动子。作为启动子,可以使用例如后文中描述的较强启动子。
[0257]
用于终止转录的终止子可以被配置在基因的下游。对终止子没有特别限制,只要它在本发明的细菌中起作用即可。所述终止子可以是源自于宿主的终止子或异源终止子。所述终止子可以是特异性针对待引入基因的终止子,或者可以是其他基因的终止子。终止子的具体实例包括t7终止子、t4终止子、fd噬菌体终止子、tet终止子和trpa终止子。
[0258]
可以在各种不同微生物中使用的载体、启动子和终止子被详细描述在例如“微生物学、基因工程基础讲义8”(basic lecture 8on microbiology,gene engineering),kyoritsu shuppan,1987中,并且可以使用它们。
[0259]
此外,在引入两个或更多个基因的情况下,各个基因以可表达方式保留在本发明的细菌中就已足够。例如,各个基因可以都保留在单一表达载体上,或者可以全都保留在染色体上。此外,各个基因可以分开地保留在多个表达载体上,或者可以分开地保留在单一或多个表达载体上以及染色体上。此外,两个或更多个基因可以形成操纵子并被引入。“其中引入两个或更多个基因的情况”的实例包括引入分别编码两种或更多种酶的基因的情况、引入分别编码形成单个酶的两个或更多个亚基的基因的情况及其组合。
[0260]
对待引入的基因没有特别限制,只要它编码在宿主中起作用的蛋白质即可。所述待引入的基因可以是源自于宿主的基因或异源基因。所述待引入的基因可以例如使用在所述基因的核苷酸序列的基础上设计的引物并使用具有所述基因的生物体的基因组dna或带有所述基因的质粒等作为模板,通过pcr来获得。此外,所述待引入的基因可以例如在所述基因的核苷酸序列的基础上全合成[gene,60(1),115-127(1987)]。
[0261]
此外,基因表达的提高可以通过提高基因的转录效率来实现。提高基因的转录效率可以通过例如将染色体上的基因启动子用较强启动子代替来实现。所述“较强启动子”是指与天然存在的野生型启动子相比增强基因转录的启动子。
[0262]
所述“较强启动子”的实例包括已知的高表达启动子,例如uspa启动子、t7启动子、trp启动子、lac启动子、thr启动子、tac启动子、trc启动子、tet启动子、arabad启动子、rpoh启动子、pr启动子和pl启动子。
[0263]
此外,作为较强启动子,可以使用各种不同的报告基因获得高活性类型的常规启动子。例如,通过使启动子区中的-35和-10区更接近于共有序列,可以提高启动子的活性(wo2000/18935)。
[0264]
高活性类型启动子的实例包括各种不同的tac样启动子(katashkina ji等,俄罗斯联邦专利申请2006134574)和pnlp8启动子(国际wo2010/027045)。用于评估启动子强度的方法和强启动子的实例被描述在已知文献中[“生物技术中的原核启动子”(prokaryotic promoters in biotechnology),biotechnol.annu.rev.,1,105-128(1995)等]。
[0265]
此外,基因表达水平的提高可以通过提高基因的翻译效率来实现。基因翻译效率的提高可以通过例如将染色体上所述基因的shine-dalgarno(sd)序列(也被称为核糖体结合位点(rbs))用较强sd序列代替来实现。
[0266]
所述“较强sd序列”是指与天然存在的野生型sd序列相比提高mrna翻译的sd序列。较强sd序列的实例包括来自于噬菌体t7的基因10的rbs[olins p.o.等,gene,1988,73,227-235]。此外,已知在rbs与起始密码子之间的间隔区中、特别是紧靠起始密码子上游的序列(5
’‑
utr)中几个核苷酸的替换、插入或缺失显著影响mrna的稳定性和翻译效率,因此可以通过修饰它们来提高基因的翻译效率。
[0267]
在本发明中,影响基因表达的位点例如启动子、sd序列和rbs与起始密码子之间的间隔区,也被合称为“表达控制区”。表达控制区可以使用基因搜索软件例如启动子搜索载体或genetyx来确定。这些表达控制区的修饰可以通过例如使用温度敏感性载体的方法或red驱动的整合方法(wo2005/010175)来进行。
[0268]
基因翻译效率的提高也可以通过例如密码子修饰来实现。具体来说,例如在进行基因的异源表达等的情况下,可以通过将所述基因中存在的稀有密码子用更频繁使用的同义密码子代替,来提高所述基因的翻译效率。
[0269]
密码子替换可以通过例如定点突变方法来进行,其中将靶突变引入到dna中的靶位点中。定点突变方法的实例包括使用pcr的方法[higuchi,r.,61,《pcr技术》(pcr technology),erlich,h.a.主编,stockton press(1989);carter,p.,meth.in enzymol.,154,382(1987)]和使用噬菌体的方法[kramer,w.和frits,h.j.,meth.in enzymol.,154,350(1987);kunkel,t.a.等,meth.in enzymol.,154,367(1987)]。或者,可以全合成其中密码子已被替换的基因片段。各种不同生物体中的密码子使用频率被描述在“密码子使用数据库”(codon usage database)[http://www.kazusa.or.jp/codon;nakamura,y.等,nucl.acids res.,28,292(2000)]中。
[0270]
此外,基因的表达也可以通过扩增提高基因表达的调控物或通过缺失或弱化降低基因表达的调控物来提高。如上所述的此类用于提高基因表达的技术可以单独使用,或者可以以任何组合使用。
[0271]
可以例如通过检查基因转录量的提高或通过检查从所述基因表达的蛋白质的量的提高,来检查基因表达的提高。此外,可以例如通过检测从基因表达的蛋白质的活性的提高,来检查基因表达的提高。
[0272]
检查基因转录量的提高可以通过将从所述基因转录的mrna的量与未修饰的菌株例如野生菌株或亲本菌株进行比较来进行。用于评估mrna的量的方法的实例包括northern杂交、rt-pcr等[sambrook,j.等,《分子克隆实验指南》(molecular cloning a laboratory manual)第三版,cold spring harbor laboratory press,cold spring harbor(usa),2001]。mrna量的提高是指例如与未修饰的菌株相比,mrna的量优选地提高1.5倍或更多,更优选地提高2倍或更多,甚至更优选地提高3倍或更多的情况。
[0273]
蛋白质的量的提高可以通过例如使用抗体的western印迹来检查。蛋白质的量的提高是指例如与未修饰的菌株相比,蛋白质的量优选地提高1.5倍或更多,更优选地提高2倍或更多,甚至更优选地提高3倍或更多的情况。
[0274]
蛋白质活性的提高可以通过例如测量所述蛋白质的活性来检查。蛋白质活性的提高是指例如与未修饰的菌株相比,蛋白质的活性优选地提高1.5倍或更多,更优选地提高2倍或更多,甚至更优选地提高3倍或更多的情况。
[0275]
上述用于提高基因表达的技术可用于增强上述基因(a1)和(a2)中的每一者的表
达。
[0276]
提高kpss基因表达的遗传修饰优选是kpss基因的表达控制区的修饰和增加拷贝数的遗传修饰中的至少一者。kpsfeducs基因作为生产肝素原的基因群存在,但正如后面将在实施例中描述的,本发明的发明人发现,通过提高它们之中仅仅kpss基因的表达,获得了特别提高肝素原生产的效果。因此,作为提高kpss基因表达的遗传修饰,用于提高kpss基因的拷贝数的遗传修饰是特别优选的。
[0277]
提高选自kfia、kfib、kfic和kfid基因的至少一个基因的表达的遗传修饰,优选是选自kfia、kfib、kfic和kfid基因的至少一个基因的表达控制区的修饰和增加所述基因的拷贝数中的至少一者。如图1中所示,kfia、kfib、kfic和kfid基因构成操纵子。增强由kfia、kfib、kfic和kfid基因构成的整个操纵子的遗传修饰是优选的,并且kfia、kfib、kfic和kfid基因的表达控制区的修饰是更加优选的。
[0278]
《《引起基因功能丧失的遗传修饰》》
[0279]
上述(a3)的引起yhbj基因的功能丧失的遗传修饰,包括其中通过修饰编码作为宿主的属于原核生物的微生物的基因组dna中对应于yhbj的部分的dna,使由所述对应于yhbj的部分编码的蛋白质的功能降低或完全停止的遗传修饰。
[0280]
在本发明的方法中,对添加到编码所述对应于yhbj的部分的dna的修饰的形式没有特别限制,只要由所述对应于yhbj的部分编码的蛋白质的功能被降低或完全停止即可,并且可以适合地使用已知的方法。
[0281]
降低或完全停止由所述对应于yhbj的部分编码的蛋白质的功能的形式的实例包括下述修饰(i)至(iii)中的任一者:
[0282]
(i)除去编码所述对应于yhbj的部分的dna的全部或一部分,
[0283]
(ii)对编码所述对应于yhbj的部分的dna做出一个或几个替换、缺失或添加,和
[0284]
(iii)将编码所述对应于yhbj的部分的dna用与修饰前的dna序列具有低于80%同一性的dna序列代替。
[0285]
yhbj基因的功能丧失的实例包括其中与未修饰的菌株相比,yhbj基因的活性优选为20%或更低,更优选地10%或更低,甚至更优选地5%或更低的情况。yhbj的活性可以通过用northern印迹法、western印迹法等检查glms的表达水平来检查[kalamorz f.等,(2007),“大肠埃希氏杆菌中葡萄糖胺-6-磷酸合酶glms表达的反馈控制依赖于小rna glmz并涉及新蛋白yhbj”(feedback control of glucosamine-6-phosphate synthase glms expression depends on the small rna glmz and involves the novel protein yhbj in escherichia coli),mol microbiol.65(6):1518-33]。
[0286]
在本发明的生产硫酸化多糖的方法中,可以将通过已知方法化学修饰肝素原而获得的n-磺基肝素原用于反应溶液,其中肝素原通过上述生产肝素原的方法获得。
[0287]
《生产paps的方法》
[0288]
本发明的生产paps的方法的特征在于通过将atp源、硫酸根离子源、上述转化体(a)或其处理物并入到反应溶液中来进行paps生产反应。也就是说,本发明的生产paps的方法包括下述步骤(i)和(ii):
[0289]
(i)制备棒状杆菌属细菌的转化体或所述转化体的处理物,所述转化体至少包含以可表达的方式引入到其中的编码atp硫酸化酶的基因和编码aps激酶的基因,其中所述转
化体的细胞质膜是物质可通透的;和
[0290]
(ii)使用含有atp源、硫酸根离子源和在步骤(i)中制备的转化体或其处理物的反应溶液,进行生产paps的反应。
[0291]
根据本发明的生产paps的方法,可以使用表达atp硫酸化酶和aps激酶的棒状杆菌属细菌的转化体或其处理物,通过细菌细胞反应来生产paps。
[0292]
实施例
[0293]
下面示出了实施例,但本发明不限于下述实施例。
[0294]
[实施例1]
[0295]
产氨棒状杆菌de3质粒的构建
[0296]
如下所述构建了用于在产氨棒状杆菌野生菌株atcc 6872的染色体上插入在gltd-purta之间含有t7 rna聚合酶基因的λde3的质粒。设计了用于扩增gltd侧的两种引物[gltd-purt_1(seq id no:1)和gltd-purt_2bx(seq id no:2)]和用于扩增purt侧的两种引物[gltd-purt_3bx](seq id no:3)和gltd-purt_4(seq id no:4)]。
[0297]
此时,为了进行用于连接在第一pcr中扩增的gltd侧翼片段和purt侧翼片段的第二pcr(融合pcr),将与用于扩增purt侧翼片段的5’引物(gltd-purt_4;seq id no:4)的3’侧上约25个碱基的序列互补的序列添加到用于扩增gltd侧翼片段的3’引物(gltd-purt_2bx;seq id no:2)的5’侧上。此外,将用于融合克隆的序列添加到用于扩增gltd侧翼片段的5’引物(gltd-purt_1)和用于扩增purt侧翼片段的3’引物(gltd-purt_4)的5’侧。此外,将bglii和xhoi识别序列添加到gltd侧和purt侧上的连接部分,以插入λde3。
[0298]
按照saito等人描述的方法[biochim.biophys.acta 72,619(1963)]制备作为产氨棒状杆菌的野生型菌株的产氨棒状杆菌atcc 6872菌株(在后文中被称为atcc 6872)的染色体dna。
[0299]
使用所述染色体dna作为模板进行用于扩增gltd侧翼片段和purt侧翼片段的第一pcr,从而获得gltd侧翼上约0.8kb的dna片段和purt侧翼上约0.8kb的dna片段。接下来进行第二pcr以连接这些gltd侧翼片段和purt侧翼片段,从而获得约1.6kb的dna片段(gltd-bx-purt)。
[0300]
将在具有卡那霉素抗性基因的大肠埃希氏杆菌载体phsg299[gene,61,63,(1987)]的psti切割位点处含有包含枯草芽孢杆菌(bacillus subtilis)的左旋蔗糖酶基因sacb的2.6kb psti dna片段[mol.microbiol.,6,1195(1992)]的质粒pesb30,用bamhi切割。然后,使用融合克隆试剂盒(takara bio inc.)连接如上获得的gltd-bx-purt片段。使用所述反应产物,按照常规方法[《分子克隆实验指南》(molecular cloning:a laboratory manual),第3版,2001,cold spring harbor laboratory press]转化大肠埃希氏杆菌dh5α[由toyobo co.,ltd.制造]。
[0301]
将得到的菌株在含有20微克/ml卡那霉素的lb琼脂培养基[所述培养基在1l水中含有10g细菌胰蛋白胨(由difco制造)、5g酵母提取物(由difco制造)、10g氯化钠和16g细菌琼脂(由difco制造),并将其ph调节到ph 7.0]上培养,并选择转化的菌株。在通过菌落pcr选择靶克隆后,将所述转化的菌株接种在含有20微克/ml卡那霉素的lb培养基中(除了不含琼脂之外,所述培养基具有与lb琼脂培养基相同的组成)并培养过夜,从而使用qiaprep spin miniprep试剂盒(qiagen)从得到的培养液制备质粒。核苷酸序列分析确认了所述质
粒具有其中约1.6kb的gltd-bx-purt片段被插入到pesb30中的结构。
[0302]
随后,使用从大肠埃希氏杆菌bl21(de3)提取的染色体dna作为模板并使用引物de3-for_xho(seq id no:5)和de3-rev_bgl(seq id no:6),通过pcr扩增4.5kb的λde3片段。将xhoi识别序列添加到de3-for_xho,并将bglii识别序列添加到de3-rev_bgl。将该片段和具有其中约1.6kb的gltd-bx-purt片段被插入到pesb30中的结构的质粒用xhoi和bglii消化,然后用dna连接试剂盒(takara bio inc.)连接。
[0303]
以与上述相同的方式转化大肠埃希氏杆菌dh5α,将由此获得的菌株在含有20微克/ml卡那霉素的lb琼脂培养基上培养,并选择转化的菌株。将所述转化的菌株接种到含有20微克/ml卡那霉素的lb培养基中并培养过夜,从而使用质粒qiaprep spin miniprep试剂盒(qiagen)从得到的培养液制备质粒。核苷酸序列分析确认所述质粒具有其中4.5kb的λde3片段被插入到pesb30上约1.6kb的gltd-purt之间的结构。该质粒被命名为pc-de3。
[0304]
[实施例2]
[0305]
产氨棒状杆菌的λde3插入菌株的构建
[0306]
按照rest等人的方法[appl.microbiol.biotech.,52,541(1999)]通过电穿孔将pc-de3引入到atcc 6872菌株中,并选择卡那霉素抗性菌株。当通过southern杂交[《分子克隆实验指南》(molecular cloning:a laboratory manual)第3版,2001,cold spring harbor laboratory press]检查从卡那霉素抗性菌株之一获得的染色体的结构时,确认了pc-de3通过campbell型同源重组被整合到染色体中。
[0307]
将所述转化的菌株(单个重组体)施加到suc琼脂培养基[所述培养基在1l水中含有100g蔗糖、7g肉提取物、10g蛋白胨、3g氯化钠、5g酵母提取物(由difco制造)和15g细菌琼脂(由difco制造),并将其ph调节到ph 7.2],在30℃培养1天,并选择生长的克隆。其中存在sacb基因的菌株不能在这种培养基上生长,因为它将蔗糖转变成自杀性物质[j.bacteriol.,174,5462(1991)]。另一方面,其中sacb基因通过染色体上邻近存在的λde3插入型与野生型之间的第二次同源重组而被缺失的菌株,可以在这种培养基上生长而不产生自杀性物质。在这种同源重组期间,野生型结构或其中λde3片段已被插入到gltd-purt之间的菌株与sacb一起被除去。此时,在野生型结构与sacb一起被除去的菌株中,发生了基因替换为λde3插入型。
[0308]
使用由此获得的第二重组体,使用引物de3-for_xho和de3-rev_bgl,通过菌落pcr获得了其中λde3被插入到atcc 6872的gltd-purt之间的菌株。这个菌株被命名为atcc 6872(de3)。
[0309]
[实施例3]
[0310]
具有用于表达met3-met14的dna片段的质粒的构建
[0311]
将质粒pcs299p[appl.microbiol.biotech.,63,592(2004)]用bamhi消化。使用pcet_fw2(seq id no:7)和pcet_rv2(seq id no:8)并使用pet21b作为模板进行pcr,以获得含有laci-pt7的dna片段。将这些片段通过qiaquick pcr纯化试剂盒(qiagen)进行纯化,并使用融合克隆试剂盒(takara bio inc.)连接。使用所述反应产物,按照常规方法转化大肠埃希氏杆菌dh5α(由toyobo co.,ltd.制造),在含有20微克/ml卡那霉素的lb琼脂培养基上培养,并选择转化的菌株。在通过菌落pcr选择靶克隆后,将所述转化的菌株接种在含有20微克/ml卡那霉素的lb培养基中并培养过夜,从而使用qiaprep spin miniprep试剂盒
(qiagen)从得到的培养液制备质粒。核苷酸序列分析确认了所述质粒是具有其中源自于pet21b的约1.9kb的laci-pt7 dna片段被插入到pcs299p中的结构的质粒。该质粒被命名为pcet212。
[0312]
随后,构建了其中源自于酿酒酵母的met3和met14被插入到pcet212的t7启动子下游的质粒。设计了用于从酿酒酵母s288c菌株(在后文中被称为s288c)的染色体dna扩增met3的两种引物(met3_1(seq id no:9)和met3_2(seq id no:10))和用于扩增met14的两种引物(met14_3(seq id no:11)和met14_4(seq id no:12))。
[0313]
此时,为了进行连接在第一pcr中扩增的met3片段和met14片段的第二pcr(融合pcr),将与用于扩增met14的5’引物(met14_3;seq id no:11)的5’侧上约15个碱基的序列互补的序列添加到用于扩增met3的3’引物(met3_2;seq id no:10)的5’侧,并将与met3_3的5’侧上约15个碱基的序列互补的序列添加到met14_3的5’侧。此外,将用于融合克隆的序列添加到用于扩增met3的5’引物(met3_1)和用于扩增met13的3’引物(met14_4)的5’侧。使用s288c菌株的染色体dna作为模板进行用于扩增met3和met14的第一pcr,由此获得约1.5kb的met3的dna片段和约0.6kb的下游区域中的dna片段。接下来,进行第二pcr以连接这些met3片段和met14片段,由此获得约2.1kb的dna片段(met3-met14)。将该dna片段使用qiaquick pcr纯化试剂盒(qiagen)进行纯化,然后使用融合克隆试剂盒(takara bio inc.)连接到用ndei和xhoi消化的pcet212。使用所述反应产物,按照常规方法转化大肠埃希氏杆菌dh5α(由toyobo co.,ltd.制造)。将由此得到的菌株在含有20微克/ml卡那霉素的lb琼脂培养基上培养,并选择转化的菌株。在通过菌落pcr选择靶克隆后,将所述转化的菌株接种到含有20微克/ml卡那霉素的lb培养基中并培养过夜,从而使用qiaprep spin miniprep试剂盒(qiagen)从所述得到的培养液制备质粒。核苷酸序列分析确认所述质粒具有其中约2.1kb的met3-met14片段被插入到pcet212中的结构。该质粒被命名为psc-3-13。通过将psc-3-13转化到atcc6872(de3)中,获得了产氨棒状杆菌的产paps的atcc 6872(de3)/psc-3-13菌株。
[0314]
[实施例4]
[0315]
具有用于表达伴侣蛋白的dna片段的质粒的构建
[0316]
使用gro_f(seq id no:13)和gro_r(seq id no:14)并使用大肠埃希氏杆菌bl21(de3)菌株的染色体dna作为模板进行pcr,由此获得含有groes-groel的dna片段。接下来,使用pkd46[datsenko,k.a.,warner,b.l.,proceedings of the national academy of science of the united states of america,vol.97.6640-6645(2000)]作为模板并使用arac_parab_f(seq id no:15)和arac_parab_r(seq id no:16)进行pcr,从而获得了含有arac_parab的dna片段。使用pcdf-smori-f(seq id no:17)和pcdf-smori-r(seq id no:18)并使用pcdf-duet1(novagen)作为模板进行pcr,从而获得含有链霉素抗性基因和colddf复制原点的dna片段。将这些片段通过qiaquick pcr纯化试剂盒(qiagen)进行纯化并使用融合克隆试剂盒(takara bio inc.)连接。使用所述反应产物,按照常规方法转化大肠埃希氏杆菌dh5α(由toyobo co.,ltd.制造),在含有50微克/ml链霉素的lb琼脂培养基上培养,并选择转化的菌株。在通过菌落pcr选择靶克隆后,将所述转化的菌株接种在含有50微克/ml链霉素的lb培养基中并培养过夜,从而使用qiaprep spin miniprep试剂盒(qiagen)从得到的培养液制备质粒。核苷酸序列分析确认了所述质粒具有其中源自于
pkd46的约1.2kb的arac-parab dna片段和源自于bl21(de3)的约2.0kb的groes-groel dna片段被插入到pcdf-duet1中的结构。所述质粒被命名为pgro(sm)。
[0317]
[实施例5]
[0318]
表达c5-差向异构酶、2ost、6ost-3和3ost-1的大肠埃希氏杆菌的克隆
[0319]
按照文献中描述的方法[biochemical and biophysical research communications第339卷,第2期,13 2006年1月,597-602页],将人类c5-差向异构酶的催化结构域区域(e53-n609)克隆到pmal-c2x载体(new england biolabs)中以构建mbp-c5。将所述mbp-c5与pgro7(takara bio inc.)一起转化到origami-b(de3)(novagen)中,从而构建了表达c5-差向异构酶的大肠埃希氏杆菌origami-b(de3)/mbp-c5_pgro7菌株。
[0320]
seq id no:19示出了2-o-磺基转移酶同工型1的催化结构域(r51-n356)的核苷酸序列,其源自于中华仓鼠,并被密码子优化以在大肠埃希氏杆菌中表达。使用上述人工合成的序列作为模板和seq id no:20和21作为引物进行pcr。通过不依赖连接的克隆方法[methods mol biol.2009;498:105-115]将该pcr片段克隆到pet-his6-mbp-tev-lic(addgene)中,以构建h-mbp-2ost。将h-mbp-2ost与pgro(sm)一起转化到origami-b(de3)(novagen)中,从而构建了表达2ost的大肠埃希氏杆菌的origami-b(de3)/h-mbp-2ost_pgro(sm)菌株。
[0321]
通过文献中描述的方法[chemistry&biology第14卷,第9期,212007年9月,986-993页],将源自于小鼠的6-o-磺基转移酶同工型3的催化结构域(p120-l424)克隆到pmal-c2x载体(new england biolabs)中以构建mbp-6ost3。将mbp-6ost3与pgro7(takara bio inc.)一起转化到origami-b(de3)(novagen)中,从而构建了表达6ost-3的大肠埃希氏杆菌的origami-b(de3)/mbp-6ost3_pgro7菌株。
[0322]
通过文献中描述的方法[j biol chem.2004年6月11日;279(24):25789-97]将源自于小鼠的3-o-磺基转移酶的催化结构域(g48-h311)克隆到pet28a载体(novagen)中,以构建his-3ost1。将his-3ost1与pgro(sm)一起转化到bl21-codonplus(de3)-ril(agilent technologies)中,从而构建了表达3ost1的大肠埃希氏杆菌的ril/his-3ost1_pgro(sm)菌株。
[0323]
[实施例6]
[0324]
n-磺基肝素原和2-o-硫酸化n-磺基肝素原的制备
[0325]
按照专利文献[wo2018/048973a1]中描述的方法,使用大肠埃希氏杆菌k5菌株或nissle菌株通过发酵生产肝素原。根据所述文献,将所述得到的肝素原化学去乙酰化并解聚,然后化学n-硫酸化。随后,通过乙醇沉淀进行分级以获得n-磺基肝素原。按照同一文献,通过酶反应对得到的n-磺基肝素原进行糖醛酸残基中c5位的差向异构化和2-o位的硫酸化,然后通过乙醇沉淀进行分级,从而获得2-o-硫酸化的n-磺基肝素原。
[0326]
[实施例7]
[0327]
atcc 6872(de3)/psc-3-13的培养
[0328]
将实施例3中获得的atcc 6872(de3)/psc-3-13菌株接种在含有50微克/ml卡那霉素的by-葡萄糖琼脂培养基[所述培养基在1l水中含有10g葡萄糖、20g普通肉汤培养基(由kyokuto pharmaceutical industrial co.,ltd.制造)、5g酵母提取物(由difco制造)和20g细菌琼脂(由difco制造)]中,并在30℃培养过夜。
[0329]
将两个平板的细菌细胞接种在2l erlenmeyer摇瓶中的350ml一级种子培养基中[所述培养基含有葡萄糖50g/l、高多聚蛋白胨(nihon pharmaceutical co.,ltd.)10g/l、酵母提取物(asahi)10g/l、kh2po41g/l、k2hpo
4 1g/l、(nh4)2so
4 0.5g/l、尿素0.5g/l、l-胱氨酸0.03g/l、mgso
4-7h2o 1g/l、cacl
2-2h2o 0.1g/l、znso
4-7h2o 0.01g/l、feso
4-7h2o 0.01g/l、mnso
4-5h2o 0.02g/l、d-泛酸钙0.01g/l、生物素40微克/l、盐酸硫胺素0.005g/l和烟酸0.005g/l,用氢氧化钠将其ph调节到ph 7.2,并在使用压热釜在122℃灭菌20分钟后向其分开地添加l-半胱氨酸0.1g/l、硫代硫酸钠1g/l和卡那霉素0.1g/l],并以220rpm的搅拌速度在30℃培养24小时。
[0330]
在6l培养罐中的1700ml二级种子培养基中[所述培养基含有葡萄糖100g/l、果糖4g/l、酵母提取物(由asahi制造)10g/l、kh2po41.25g/l、k2hpo
4 1g/l、单水谷氨酸钠2.1g/l、l-胱氨酸0.02g/l、mgso
4-7h2o 1.25g/l、cacl
2-2h2o 0.1g/l、cuso
4-5h2o 0.002g/l、znso
4-7h2o 0.01g/l、feso
4-7h2o 0.02g/l、mnso
4-5h2o 0.02g/l、d-泛酸钙0.015g/l、生物素40微克/l、烟酸0.005g/l和adeka nol lg-109(由adeka制造)1ml/l,用氢氧化钠将其ph调整到7.2,在单独添加尿素至3.2g/l后将其在压热釜中在122℃灭菌20分钟,并向其分开地添加盐酸硫胺素0.1g/l、l-半胱氨酸0.3g/l、硫代硫酸钠2.5g/l和卡那霉素0.2g/l],接种300ml上述培养溶液,并在30℃、650rpm的搅拌速度和2l/min的通气速率的培养条件下培养24小时,同时用18%氨水将其ph调节到6.8。
[0331]
在6l培养罐中的1700ml主培养基中[所述培养基含有kh2po410g/l、k2hpo
4 10g/l、单水谷氨酸钠1g/l、l-胱氨酸0.02g/l、cacl
2-2h2o 0.1g/l、cuso
4-5h2o 0.005g/l、znso
4-7h2o 0.01g/l、feso
4-7h2o 0.02g/l、生物素150微克/l、烟酸0.005g/l、尿素2g/l和adeka nol lg-109(由adeka制造)1ml/l,并在压热釜中122℃灭菌20分钟后分开地向其添加葡萄糖125g/l、果糖25g/l、mgso
4-7h2o10g/l、mnso
4-5h2o 0.02g/l、d-泛酸钙0.015g/l、盐酸硫胺素0.005g/l、l-半胱氨酸0.15g/l、硫代硫酸钠2.5g/l和卡那霉素0.2g/l],接种300ml上述培养溶液,并在30℃和2l/min的通气速率的培养条件下培养25小时,同时在650rpm至900rpm之间调节搅拌速度以使溶解氧的量不下降到低于1ppm,同时用18%氨水将其ph调节到6.8。
[0332]
在此期间添加iptg,使得在从培养开始起6小时后终浓度变为1mm,并在从培养开始起10小时后进一步添加生物素100微克/l、烟酸0.015g/l、d-泛酸钙0.015g/l和盐酸硫胺素0.005g/l。在培养完成后,通过离心机将培养溶液分离成细菌细胞和培养上清液,由此获得沉淀物作为湿细菌细胞,并在-80℃下冷冻。
[0333]
[实施例8]
[0334]
origami-b(de3)/mbp-c5_pgro7、origami-b(de3)/h-mbp-2ost_pgro(sm)、origami-b(de3)/mbp-6ost3_pgro7和ril/his-3ost1_pgro(sm)的培养
[0335]
将在实施例5中获得的origami-b(de3)/mbp-c5_pgro7菌株接种在含有5ml tb培养基并含有50微克/ml氨苄青霉素、20微克/ml氯霉素、15微克/ml四环素和15微克/ml卡那霉素的大试管中,并在30℃培养16小时。将1.2%培养溶液接种在含有500ml tb培养基并含有50微克/ml氨苄青霉素、20微克/ml氯霉素、15微克/ml四环素和15微克/ml卡那霉素的带挡板erlenmeyer摇瓶中,并在37℃振摇培养6小时。随后向其添加终浓度为1mm的iptg和终浓度为4mm的阿拉伯糖,并将培养在28℃进行20小时。随后,将所述培养溶液离心,由此获得
沉淀物作为湿细菌细胞,并在-80℃下冷冻。
[0336]
将在实施例5中获得的origami-b(de3)/h-mbp-2ost_pgro(sm)菌株接种在含有5ml tb培养基并含有50微克/ml氨苄青霉素、50微克/ml链霉素、15微克/ml四环素和15微克/ml卡那霉素的大试管中,并在30℃培养16小时。将1.2%培养溶液接种在含有500ml tb培养基并含有50微克/ml氨苄青霉素、50微克/ml链霉素、15微克/ml四环素和15微克/ml卡那霉素的带挡板erlenmeyer摇瓶中,并在30℃振摇培养12小时。随后向其添加终浓度为1mm的iptg和终浓度为4mm的阿拉伯糖,并将培养在28℃进行20小时。随后,将所述培养溶液离心,由此获得沉淀物作为湿细菌细胞,并在-80℃下冷冻。
[0337]
将在实施例5中获得的origami-b(de3)/mbp-6ost3_pgro7菌株接种在含有5ml tb培养基并含有50微克/ml氨苄青霉素、20微克/ml氯霉素、15微克/ml四环素和15微克/ml卡那霉素的大试管中,并在30℃培养16小时。将1.2%培养溶液接种在含有500ml tb培养基并含有50微克/ml氨苄青霉素、20微克/ml氯霉素、15微克/ml四环素和15微克/ml卡那霉素的带挡板erlenmeyer摇瓶中,并在37℃振摇培养4小时。随后向其添加终浓度为1mm的iptg和终浓度为4mm的阿拉伯糖,并将培养在28℃进行20小时。随后,将所述培养溶液离心,由此获得沉淀物作为湿细菌细胞,并在-80℃下冷冻。
[0338]
将在实施例5中获得的ril/his-3ost1_pgro(sm)菌株接种在含有5ml tb培养基并含有50微克/ml链霉素、15微克/ml卡那霉素的大试管中,并在30℃培养16小时。将1.2%培养溶液接种在含有500ml tb培养基并含有50微克/ml链霉素和15微克/ml卡那霉素的带挡板erlenmeyer摇瓶中,并在37℃振摇培养4小时。随后向其添加终浓度为1mm的iptg和终浓度为4mm的阿拉伯糖,并将培养在28℃进行20小时。随后,将所述培养溶液离心,由此获得沉淀物作为湿细菌细胞,并在-80℃下冷冻。
[0339]
[实施例9]
[0340]
使用atcc 6872(de3)/psc-3-13、origami-b(de3)/mbp-c5_pgro7和origami-b(de3)/h-mbp-2ost_pgro(sm)在n-磺基肝素原的2-o位处的硫酸化反应的测试
[0341]
将在实施例7和8中获得的atcc 6872(de3)/psc-3-13、origami-b(de3)/mbp-c5_pgro7和origami-b(de3)/h-mbp-2ost_pgro(sm)中的每一者的冷冻的细菌细胞悬浮在蒸馏水中使得所述冷冻细菌细胞的重量为333g/l,以制备细菌细胞悬液。将由此获得的30ml atcc 6872(de3)/psc-3-13细菌细胞悬液、6ml origami-b(de3)/mbp-c5_pgro7细菌细胞悬液和6ml origami-b(de3)/h-mbp-2ost_pgro(sm)细菌细胞悬液添加到250ml生物反应器中的18ml反应溶液[含有葡萄糖60g/l、kh2po
4 8.75g/l、k2hpo
4 15g/l、mgso
4-7h2o 20g/l、d-泛酸钙0.3g/l、烟酸0.2g/l、腺嘌呤4.05g/l、苯扎氯铵1.25g/l、adeka nol lg-109(由adeka制造)1ml/l和n-磺基肝素原1g/l(在实施例6中生产)的水性溶液],并在37℃、500rpm的搅拌速度和0.75ml/min的通气速率的培养条件下反应22小时,同时用2.8%氨水溶液将其ph调节到6.5。在此期间,在反应开始后6小时进一步添加葡萄糖60g/l、mgso
4-7h2o 5.0g/l和腺嘌呤2.7g/l。
[0342]
在反应期间适当时候进行取样,以获得反应溶液。将得到的反应溶液适当稀释,然后离心,使用由shimadzu corporation制造的hplc,通过用uv检测器测量在254nm处的吸收值来检测并定量paps。结果示出在图4中。此外,按照专利文献[wo2018/048973a1]通过酶消化进行不饱和二糖的产生并通过hplc进行分析。
[0343]
也就是说,将得到的反应溶液离心,并将得到的上清液加热并在80℃维持10分钟以变性蛋白质。将所述蛋白质变性后的溶液离心,使用3k分子量过滤装置(由merck制造)通过超滤对得到的上清液进行脱盐。将脱盐后的溶液提供到含有0.5u/ml的每种肝素酶i、ii和iii(由sigma制造,但也可以使用其他肝素酶)的肝素酶反应溶液[由50mm乙酸铵和2mm氯化钙构成],并在35℃进行2小时的酶消化。在酶消化后,通过将所述溶液在95℃维持15分钟,将肝素酶灭活。
[0344]
通过使用shimadzu hplc和强阴离子交换柱(spherisorb-sax层析柱,4.0x 250mm,5微米,由waters制造)对肝素酶灭活后的溶液进行流动相a[含有1.8mm磷酸二氢钠的水性溶液,用磷酸将其ph调节到ph 3.0]和流动相b[含有1.8mm磷酸二氢钠和1m高氯酸钠的水性溶液,使用磷酸将其ph调节到ph 3.0]的梯度洗脱模式分析,来进行不饱和二糖分析。
[0345]
不饱和二糖通过使用uv检测器在232nm处测量吸光度来检测。通过与不饱和二糖标准试剂(由iduron制造)进行比较来检查δ-ua-glcns和δ-ua,2s-glcns的保留时间。通过获得δ-ua,2s-glcns相对于检测到的δ-ua-glcns和δ-ua,2s-glcns的总面积的面积比,来检查2-o-硫酸化。结果示出在图5中。
[0346]
[实施例10]
[0347]
使用atcc 6872(de3)/psc-3-13和origami-b(de3)/mbp-6ost3_pgro7在2-o-硫酸化n-磺基肝素原的6-o位处的硫酸化反应的测试
[0348]
将在实施例7和8中获得的atcc 6872(de3)/psc-3-13和origami-b(de3)/mbp-6ost3_pgro7中的每一者的冷冻的细菌细胞悬浮在蒸馏水中使得所述冷冻细菌细胞的重量为333g/l,以制备细菌细胞悬液。将由此获得的30ml atcc 6872(de3)/psc-3-13细菌细胞悬液和6ml origami-b(de3)/mbp-6ost3_pgro7细菌细胞悬液以及6ml蒸馏水添加到250ml生物反应器中的18ml反应溶液[含有葡萄糖60g/l、kh2po
4 8.75g/l、k2hpo
4 15g/l、mgso
4-7h2o 20g/l、d-泛酸钙0.3g/l、烟酸0.2g/l、腺嘌呤4.05g/l、苯扎氯铵1.25g/l、adeka nol lg-109(由adeka制造)1ml/l和2-o-硫酸化n-磺基肝素原0.5g/l(在实施例6中生产)的水性溶液],并在32℃、500rpm的搅拌速度和0.75ml/min的通气速率的培养条件下反应22小时,同时用2n氢氧化钾水溶液将其ph调节到7.4。
[0349]
在此期间,在反应开始后6小时进一步添加葡萄糖60g/l、mgso
4-7h2o 5.0g/l和腺嘌呤2.7g/l。在反应期间适当时候进行取样,以获得反应溶液。使用与实施例9中相同的方法进行paps的检测和定量。结果示出在图6中。
[0350]
此外,通过与实施例9中相同的方法分析反应后糖链中包含的硫酸化组成。通过与不饱和二糖标准试剂(由iduron制造)进行比较来检查δ-ua,2s-glcns和δ-ua,2s-glcn,6s的保留时间。通过获得δ-ua,2s-glcn,6s相对于检测到的δ-ua,2s-glcns和δ-ua,2s-glcn,6s的总面积的面积比,来检查6-o-硫酸化。结果示出在图7中。
[0351]
[实施例11]
[0352]
使用atcc 6872(de3)/psc-3-13、origami-b(de3)/mbp-6ost3_pgro7和ril/his-3ost1_pgro(sm)在2-o-硫酸化n-磺基肝素原的6-o位和3-o位处的硫酸化反应的测试
[0353]
反应在实施例10中描述的条件下进行22小时。在此期间,在反应开始后3小时,将在实施例8中获得的il/his-3ost1_pgro(sm)的冷冻细菌细胞悬浮在蒸馏水中,使得所述冷
冻细菌细胞的重量变为333g/l,并添加6ml所述制备的细菌细胞悬液。在反应期间适当时候进行取样,以获得反应溶液。使用与实施例9中相同的方法进行paps的检测和定量。结果示出在图8中。
[0354]
在所述反应完成后,将反应溶液离心,将得到的上清液适当稀释,然后使用biophen(商标)anti-iia测量试剂盒(由hyphen biomed制造)测量anti-iia活性,以检查3-o-硫酸化。此外,也测量在实施例10的反应后溶液的anti-iia活性,作为未添加ril/his-3ost1_pgro(sm)的阴性对照。使用biophen(商标)ufh校准品(由hyphen biomed制造)制作校准曲线。结果示出在表1中。
[0355]
[表1]
[0356]
表1.anti-iia活性的测量结果
[0357]
ril/his-3ost1_pgro(sm)的添加anti-iia活性(iu/ml-上清液)添加375未添加-36
[0358]
[实施例12]
[0359]
将在实施例7中获得的atcc 6872(de3)/psc-3-13的冷冻细菌细胞悬浮在蒸馏水中,使得所述冷冻细菌细胞的重量变成333g/l,以制备细菌细胞悬液。将由此获得的30ml细菌细胞悬液添加到250ml生物反应器中的30ml反应溶液[含有葡萄糖60g/l、kh2po
4 8.75g/l、k2hpo
4 15g/l、mgso
4-7h2o 20g/l、d-泛酸钙0.3g/l、烟酸0.2g/l、腺嘌呤4.05g/l、苯扎氯铵0.625g/l、adeka nol lg-109(由adeka制造)1ml/l的水性溶液],并在32℃、500rpm的搅拌速度和0.75ml/min的通气速率的培养条件下反应22小时,同时用2n氢氧化钾水溶液将其ph调节到7.4。
[0360]
在此期间,在反应开始后6小时进一步添加葡萄糖60g/l、kh2po
4 2.19g/l、k2hpo
4 3.75g/l、mgso
4-7h2o 5.0g/l和腺嘌呤2.7g/l。在反应期间适当时候进行取样,以获得反应溶液。
[0361]
将得到的反应溶液适当稀释,然后离心,使用由shimadzu corporation制造的hplc,通过用uv检测器测量在254nm处的吸收值来检测并定量paps。结果示出在图9中。
[0362]
如上所述,将能够产生和再生paps的棒状杆菌属细菌和表达硫酸化酶的属于原核生物的微生物添加到原材料例如葡萄糖、腺嘌呤和硫酸镁并与其反应,从而从多糖高效地产生硫酸化多糖。
[0363]
尽管本发明已参考其具体实施方式进行了详细描述,但对于本领域技术人员来说,显然可以在其中做出各种不同的改变和修改而不背离其精神和范围。本文中引用的所有参考文献整体并入本文。本技术是基于2020年4月3日提交的国际申请号pct/jp2020/015388,其全部内容通过参考并入本文。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。