用于促进药物的组织递送的装置、系统及方法
1.相关申请的交叉引用
2.本技术要求于2020年5月29日提交的第63/031,767号美国临时申请的权益,所述美国临时申请以引用的方式并入本文中。
3.关于联邦资助的研究或开发的声明
4.本发明在政府支持下在由美国国家卫生研究院(national institutes of health)授予的授权号r01ai143844下进行。美国政府拥有本发明的某些权利。
背景技术:
5.本发明一般涉及向有需要人员施用治疗剂及预防剂的装置和方法的领域,且更具体地说涉及将治疗剂、疫苗、核酸等引入到生物组织中和/或穿过组织屏障的方法和装置,特别是当药物的作用位点位于细胞内时。
6.已研究出了许多制剂和装置,用于将药物、核酸、生物试剂(例如疫苗和治疗蛋白)递送通过皮肤并递送到细胞中。哺乳动物皮肤的角质层是一道有效屏障,特别是对于大于500道尔顿的分子,即使在使用穿透促进剂、超声波、电穿孔或微针时也是如此。使用超声波和电穿孔的常规装置通常需要昂贵的技术,并且在所有情况下都需要接入例如ac电源插座或电池等持续性电源。
7.细胞质膜是另一道有效屏障,特别是对于通常不被主动运输过程吸收的分子,即使在使用纳米颗粒、脂质、聚合物和其它制剂时也是如此。这对于基于遗传材料(例如dna和rna)的药物尤其重要。基于dna的药物的作用位点通常在细胞核内。基于rna的药物的作用位点通常在细胞胞质溶胶内。
8.因此,迫切需要一种用于真皮和细胞内药物递送的低廉装置,所述装置不需要例如超声波发生器和持续性电源(例如ac电源插座或电池)等辅助技术并且不需要可能产生不良副作用的化学制剂。
技术实现要素:
9.提供基于电穿孔的药物递送装置和方法,其可克服与向患者施用药物的常规装置和方法相关联的一个或多个前述问题。
10.在一个方面中,提供一种装置以用于将药物施用到患者的生物组织中或穿过所述生物组织。在实施例中,所述装置包含:(i)压电脉冲发生器;以及(ii)电耦合到所述压电脉冲发生器的微针电极阵列,其中所述装置在所述微针电极插入到所述生物组织中之后被配置成产生一个或多个电脉冲并将通过所述压电脉冲发生器产生的所述一个或多个电脉冲递送通过所述微针电极,所述电脉冲能有效地对所述生物组织中的细胞进行电穿孔,且被配置成使得能够将药物递送到被电穿孔细胞中。在一些实施例中,所述装置包含药物且被配置成将所述药物释放到所述生物组织。在一些其它实施例中,所述药物不作为所述装置的一部分而提供,并且从单独供应源向所述生物组织施用所述药物。药物可以是分子大于500道尔顿的治疗剂或预防剂,例如包含核酸的那些药物。在一些实施例中,所述药物是疫
苗,例如rna疫苗。
11.在另一方面中,提供一种用于将药物递送到生物组织中或穿过所述生物组织的方法。在实施例中,所述方法包含:(i)将所述装置定位成邻近于生物组织中的靶组织位点,所述装置包含电耦合到压电脉冲发生器的微针电极阵列;(ii)将所述微针电极插入到所述靶组织位点中;(iii)激活所述装置以将一个或多个电脉冲递送通过所述微针电极并递送到所述靶组织位点中,所述电脉冲能有效地对所述靶组织位点处的细胞进行电穿孔;(iv)以及将所述药物递送到所述靶组织位点的组织中。在一些实施例中,所述生物组织是哺乳动物皮肤或黏膜。在一些实施例中,所述靶组织位点包括真皮或表皮。在一些实施例中,先向所述靶组织位点施用所述药物再递送所述电脉冲,或在向所述靶组织位点施用所述药物的同时递送所述电脉冲。在一些实施例中,从或通过所述微针电极向所述靶组织位点施用所述药物。在一些其它实施例中,从所述装置的另一部分或从单独供应源向所述生物组织施用所述药物。
附图说明
12.图1a是根据本公开的一个实施例的药物递送系统的外壳和压电脉冲发生器的平面视图。
13.图1b是根据本公开的一个实施例的压电脉冲发生器的分解视图。
14.图2a和2b是根据本公开的实施例的微针电极阵列及其相关联金属板位于药筒壳体内时(图2a)或不具有药筒壳体时(图2b)的透视图。
15.图3是根据本公开的实施例的药物递送系统的透视图,所述药物递送系统包括(i)包含压电脉冲发生器的外壳和(ii)包括微针电极阵列的药筒。
16.图4是根据本公开的一个实施例的具有实心微针电极阵列的药筒的示意图。
17.图5是根据本公开的另一实施例的具有中空微针电极阵列的药筒的示意图。
18.图6a-6d是根据本公开的一些实施例的微针电极阵列的电连接件的示意图。
19.图7a-7f是根据本公开的一个实施例的电穿孔器的示意图。
20.图8a-8c是根据本公开的一个实施例的用于电穿孔的压电脉冲发生器的代表性电输出分布的曲线图。
21.图9是示出使用微针电极阵列(mea)或钳形电极的电穿孔之后大鼠皮肤中的gfp表达的曲线图。
22.图10a-10b是示出小鼠接种sars-cov-2dna疫苗之后的体液免疫应答(图10a)和病毒中和(图10b)的曲线图。
23.图11a-11d描绘根据本公开的实施例的施用电脉冲期间的电压和电流的测量。示出用于测量电穿孔期间的电压(图11a)和电流(图11b)的电路的示意性说明。图11c和11d分别是电压和电流用商用台式电穿孔器进行脉冲调制之后的代表性曲线图。
24.图12是示出由如本文中所描述的电穿孔装置的一个实施例产生的皮肤中电场强度分布的计算机模拟结果。
具体实施方式
25.已开发出向患者施用药物的一种新型且改进的电穿孔装置和方法。所述方法和装
置特别适用于递送大于500da的药物,例如包括核酸或其它生物试剂的那些药物。
26.如本文中所使用,术语“峰值电压”是指电极施加到生物组织时在电极两端达到的最大电压降;术语“峰-峰电压”是指电极施加到生物组织时峰值正电压与峰值负电压之间的电压差;术语“峰值静态电压”是指电极直接施加到示波器引线上时电极两端达到的最大电压降;术语“峰-峰静态电压”是指电极直接施加到示波器引线上时峰值正电压与峰值负电压之间的电压差;术语“峰值电流”是指通过生物组织的最大电流;术语“标称电场强度”是指电极两端的电压除以相反带电电极之间的间距;术语“初始脉冲长度”是指电极施加到生物组织时,从脉冲开始到电压首次返回到脉冲开始之前的电压的时间之间经过的时间;并且术语“总脉冲长度”是指电极施加到生物组织时,从脉冲开始到电压不再达到绝对值大于峰值电压绝对值的10%时的时间之间经过的时间。
27.装置和方法
28.所述装置包含:压电脉冲发生器;以及电耦合到所述压电脉冲发生器的微针电极阵列,其中所述装置在所述微针电极插入到所述生物组织中之后被配置成产生电脉冲并将所述电脉冲递送通过所述微针电极,所述电脉冲能有效地对所述生物组织中的细胞进行电穿孔,且被配置成使得能够将药物递送到被电穿孔细胞中。在优选实施例中,装置的大小和形状设定为可手持且可手动操作,优选地用同一只手。在一些实施例中,装置进一步包含微针电极阵列从其延伸的基部。基部和电极阵列可为药筒的一部分,所述药筒被配置成可释放地耦合到包含压电脉冲发生器的外壳。
29.在一些实施例中,装置进一步包含待施用的药物,并且包含用于储存药物和将药物释放到生物组织位点的任何合适构件。在一些实施例中,药物呈微针电极上的包衣的形式。在一些实施例中,药物储存于装置中的一个或多个储集器中,例如储存于药筒中,和/或微针电极的至少一部分各自包含中空孔和与一个或多个储集器流体连通的导管,使得微针电极的中空孔实现微针电极插入到生物组织中之前、之后或同时的药物从储集器传递并传递到生物组织中。在另一变化形式中,药筒主体包含邻近于微针电极的孔口,其可为实心的(即,无中空孔),其中孔口与储集器流体连通且实现通过生物组织与药筒主体的接合部处的孔口从储集器释放药物,其中药物可流入微针电极形成的穿刺位置中。在另一实施例中,微针可具有凹槽或其它非平面表面特征,其为沿着微针表面的流体流动提供路径(即,与实现微针内部的流体流动的中空孔形成对照),由此促进药物递送到生物组织中。
30.在一些实施例中,所述药物与所述装置分开提供。例如,可通过常规方式向生物组织的靶组织位点施用装置,所述常规方式例如皮下注射针、喷射注射、电离子透入疗法或单独的微针装置。用于施用药物的微针可为电穿孔装置的一部分或可为单独装置。
31.在实施例中,本文中所提供的用于将药物递送到生物组织中或穿过所述生物组织的方法包含:(i)将电穿孔器装置定位在生物组织中的靶组织位点处;将微针电极插入到靶组织位点中;以及(ii)激活所述装置以将一个或多个电脉冲递送通过微针电极并递送到靶组织位点中,所述电脉冲能有效地对靶组织位点处的细胞进行电穿孔;以及(iii)将药物递送到靶组织位点的组织中。可在以下情况向靶组织位点施用药物:在递送电脉冲之前,在递送电脉冲之后,在递送电脉冲的同时,或其一些组合。可从或通过微针电极或从单独的递送构件向靶组织位点施用药物。
32.所述方法可包含手动向电穿孔器装置施加力以有效地用微针电极阵列穿透组织
表面,接着手动按压装置上的按钮或开关,所述按钮或开关触发到压电器件上的机械力,由此产生能有效地诱导细胞内的孔道形成的电脉冲。按下相同的按钮或开关或者不同的按钮或开关可致动药物例如从机载储集器释放。
33.在优选实施例中,电穿孔器装置没有储存的电能(例如,没有电池)并且没有到能源的有线或无线连接(例如,没有插入电源插座中)。产生装置的电极两端的电压的能量由装置使用者的机械动作提供。例如,与手动按压装置上的按钮或开关相关联的能量提供产生电极两端的电压的能量。压电组件可将使用者输入的机械能转换成产生电压的电能。
34.有利的是,所述装置和方法提供了一种超低成本(《2美元,例如不到约1美元)的手持式无电池电穿孔系统,所述系统对于一次性使用来说足够低廉并且如果需要的话对于重复使用来说足够稳定。在一些实施例中,提供包含所述装置和药物/微针电极阵列药筒组成的泡罩包装的系统或套件。另外,本发明的装置是易于携带的且适用于手持式操作。例如,所述装置的重量可能不到300克(优选地不到150克,优选地不到100克,优选地不到50克),大小可能不到100cm3,优选地不到50cm3,优选地不到20cm3,并且除了压电晶体之外不需要电池或电源,而所述装置又可通过使用者的机械输入供电。
35.所述装置和方法可应用于患者的任何合适生物组织。也就是说,可将电脉冲和药物递送到患者身体的可物理接近部位处或附近的细胞。患者可为人类或其它哺乳动物。电脉冲和药物可递送到皮肤中的细胞、身体上皮层中的细胞或身体内部的可例如通过腹腔镜或由于手术治疗而接近的细胞。在一些实施例中,生物组织包括哺乳动物皮肤。在一些优选实施例中,靶组织位点包括真皮或表皮。在一些其它实施例中,生物组织包括黏膜。在一些实施例中,靶组织位点可在嘴、鼻、眼、胃肠道或阴道中。
36.在特定方法中,所述方法有利地使用微针电极来向皮肤进行靶向递送,与递送至肌肉中的疫苗相比,这已被证明为dna、rna和其它疫苗提供更大的免疫原性。微针较短,在一些实施例中,可能只有650μm长,这可能将电场集中在表皮中,也可能将电场集中在真皮中。表皮尤其富含抗原呈递细胞,因此是理想的递送位置。另外,向表皮进行递送有益地使电场免于刺激下方真皮、皮下或肌肉组织更深处的感觉和运动神经。
37.所述装置和方法可用于施用任何合适的药物,具体地说,其中电穿孔可促进药物的细胞摄取的药物。药物可基本上为本领域中已知的或所研发出的任何治疗剂或预防剂。在实施例中,药物为小分子、生物制剂或疫苗。非限制性实例包含治疗蛋白(例如抗体、酶、生长因子、激素、干扰素、白介素、工程蛋白和疫苗)、rna(例如信使rna(mrna)、包含短干扰rna(sirna)和微小rna(mirna)的rna干扰(rnai)、反义rna(asrna)或短发夹rna(shrna)或rna适体)、dna(例如质粒、寡核苷酸、dna适体、dna核酶)、抗癌药物、抗菌药物、(例如,蛋白质合成、细胞壁合成、酶活性、生化途径)抑制剂、影响细胞内或细胞间信号传递的药物、影响基因调节的药物。所述装置和方法可用于递送两种或更多种不同药物。在优选实施例中,药物包括核酸。在优选实施例中,药物是疫苗。在各种实施例中,药物是rna或dna疫苗,例如mrna疫苗。疫苗可被选择为针对多种病毒、细菌或其它病原体(包含但不限于sars-cov-2、埃博拉、流感等)中的任一者有效。疫苗可由编码一种或多种抗原的mrna和/或dna构成,或可为针对疾病的多种变异体有效的疫苗。
38.如上文所提及,装置包含压电脉冲发生器;以及电耦合到压电脉冲发生器的微针电极阵列。压电脉冲发生器和所耦合的微针电极阵列在本文中有时被称为“epatch”装置或
电穿孔装置。微针电极阵列在本文中有时被称为“微针电极阵列”或mea。压电脉冲发生器可包含能有效地从压电晶体产生合适的电脉冲的任何机构。在一些实施例中,压电脉冲发生器包含(i)压电晶体,(ii)被配置成撞击压电晶体的表面的弹簧锁锤机构,所述弹簧锁锤机构能有效地产生所述电脉冲,以及(iii)用于将电脉冲传导到微针电极的电连接件。
39.装置可包含任何合适的压电晶体。在一些实施例中,压电晶体包括锆钛酸铅(pzt)。其可包含本领域中已知的各种掺杂剂。在一些实施例中,压电晶体包含锆钛酸铅、氮化硅、钛酸钡、石英、氧化锌和/或钨酸钠。压电晶体是一种表现出大幅度压电效应的材料,即产生电场且由此产生脉冲形式的具有短时间常数的较大电压输出。这可能通过施加在晶体表面上的机械力、压力或压缩而发生,因此产生暂时变形,从而形成电荷,所述电荷接着以电脉冲形式释放。
40.所述装置可包含用于压电晶体的壳体,其包含用于将脉冲中继到微针电极的电连接件。所述壳体可包含从壳体延伸的下部电极和侧部电极。所述装置可包含药筒,所述药筒包含微针电极阵列且包含用于与下部电极配对接合的第一托座和用于与侧部电极配对接合的第二托座,第一托座和第二托座与微针电极电连通。
41.所述装置可包含拨动开关,所述拨动开关具有被配置成释放由弹簧减压驱动的锤的楔形控制闩锁。销钉(例如金属销钉)可安置于锤与压电晶体之间。在一个实施例中,所述装置可如下操作:在微针电极插入到皮肤、黏膜或其它生物组织中之后,使用者对拨动开关(例如,拇指拨动开关)施加力,所述力压缩下部弹簧并且将楔形物推向锁定在闩锁中的锤。当使用者一直推动时,楔形物迫使锤离开闩锁,所述锤随后撞击挨着晶体的销钉以聚集所述力。电压输出可接着被引导到装置上的电极。上部弹簧可接着减压以将锤和闩锁复位到原始锁定状态中。使用者可按需要重复操作以产生额外脉冲,从而提供对组织的有效电穿孔以将药物递送到细胞中。
42.微针电极以能有效地穿透到靶组织中(例如,穿过角质层)且实现利用压电晶体所产生的电脉冲对细胞进行电穿孔的方式设定大小、成形和在阵列中间隔开。微针是机械上稳定的,以防止在微针插入或拔出过程中折断或以其它方式损坏微针电极。微针电极可由不锈钢、镍、铁或其它金属或合金或其它适当导电的生物兼容性材料制成。微针电极可包含平直或锥形的主体,其可为圆柱形或正方形形状,并且可包含锥形尖端部分。微针电极可使用本领域中已知的任何合适方法来制造,所述方法例如光刻蚀刻技术、3d打印、微模制和激光切割。微针电极可为实心的,具有从基部延伸到尖端的中空孔,或可在微针的侧部中具有一个或多个凹槽。
43.在一些实施例中,微针电极从一系列金属板延伸,所述金属板被配置成将电脉冲从压电脉冲发生器传导到微针电极。在一些实施例中,微针电极的线性阵列从每个金属板的一侧延伸。应理解,在板上,一些微针电极可为正且一些微针电极可为负。板上的所有微针电极可能不彼此连接。连接可能在电极当中为选择性的,并且可能存在多种连接/电极分组。在一些实施例中,板彼此平行且彼此间隔开。在一些实施例中,板固定在绝缘保持器中,例如由聚合材料制成的绝缘保持器。例如,绝缘保持器可为具有一系列槽的药筒主体,板可利用从药筒主体的表面延伸的微针电极固定到所述槽中。
44.在一些实施例中,具有相同极性(即,阴极或阳极)的两个或更多个微针是同一段导电材料(例如,金属)的一部分,所述同一段导电材料例如由单段材料形成并且切割、蚀刻
或以其它方式进行处理以实现微针阵列几何形状。材料可为片材并且微针可与片材在同一平面中,或它们可以与片材的平面成非零角度,例如约90度。
45.在一些实施例中,微针电极可包括非导电微针阵列,其中导电材料(例如,金属)图案化在微针阵列的表面上,其方式为使得所有阳极进行电连接且所有阴极进行电连接,但阳极和阴极在微针阵列上彼此电绝缘。
46.在一些实施例中,微针电极由导电材料制成且连接到不导电的基板(即,微针电极和基板包括微针阵列)。微针电极通过将导电材料图案化在基板的一个或多个表面上和/或通过位于除微针阵列以外的epatch的部分中的电连接件而彼此电连接,这可能涉及经由微针阵列表面和/或基板中的通孔电连接到微针电极的导线。
47.在一些实施例中,具有相同极性的微针电极都在微针阵列上彼此电连接,或者在其它情况下,微针电极并非都在微针阵列上彼此电连接,而是通过不在微针阵列上而是位于epatch装置中其它位置的电连接件彼此连接。
48.在一些实施例中,通过small第8期第1081-1091页(2012年)中so choi、yc kim、jw lee、jh park、mr prausnitz、mg allen的“使用微针电极阵列通过电穿孔进行的细胞内蛋白质递送和基因转染(intracellular protein delivery and gene transfection by electroporation using a microneedle electrode array)”中所描述的方法制备微针电极阵列,所述方法以引用的方式并入本文中。
49.在一些实施例中,微针电极阵列被布置成插入到1mm2至10cm2的组织区域中。
50.微针电极阵列可具有任何合适数目个微针电极。在一些实施例中,阵列具有2至10,000个微针电极,例如50至5000个、100至1000个或20至200个微针电极。还设想装置中每阵列有其它数目个微针。微针电极可布置成各种图案。阴极和阳极可处于交替的行中,可呈棋盘图案或可布置成其它图案。
51.在一些实施例中,微针电极具有10μm至2mm的长度。在一些实施例中,微针电极具有介于50μm与1.5mm之间或介于100μm至1mm之间的长度。在一些优选实施例中,长度在10μm至1mm的范围内,例如在650μm或750μm的范围内。在一些实施例中,微针可具有50μm至600μm的基部宽度或直径。还设想其它微针电极尺寸。
52.在一些实施例中,具有微针电极阵列的药筒被配置为可更换和可一次性使用的,并且压电脉冲发生器被配置成可与一系列此类药筒一起重复使用。
53.本文中所描述的装置的电穿孔部分提供能够增强分子递送到细胞中的电脉冲。使用压电晶体作为电脉冲源通过高压、短时恒定脉冲(例如,微秒)诱导膜渗透,据信这会在电脉冲期间在微针电极所产生的电场中诱导某些细胞的细胞膜中的暂时变化,所述细胞包含与微针电极接触或在微针电极附近的细胞,从而允许分子进入细胞并产生预期效果。
54.在一些优选实施例中,压电脉冲发生器产生双极振荡脉冲,与常规的单极或指数衰减或方波脉冲相比,所述双极振荡脉冲可更有效地对细胞进行电穿孔。
55.需要间距较小的微针电极来实现微秒脉冲有效地用以对生物组织中的细胞进行电穿孔所需的高场强度。由于压电脉冲具有微秒持续时间,因此有效电穿孔得益于场强度》500v/cm。为了实现这种高场强度,微针电极需要以较小间距适当间隔开,例如彼此(即,与阵列中最接近的相邻电极)间隔开小于1mm。这一紧密间距允许数百伏的压电脉冲,以实现极大的所需场强度。相比而言,如果在一些实施例中使用间距为多种毫米或厘米的常规钳
形电极,则可能需要大得多的电压来实现这一场强度,本发明装置和方法的微针电极阵列在阵列中的间距介于0.1mm与10mm之间,优选地介于0.2mm与5mm之间,且更优选地介于0.3mm与2mm之间。在一些实施例中,间距在0.5mm至1.5mm的范围内。
56.常规电穿孔器产生毫秒脉冲。相比而言,本发明的装置和方法通常产生约几微秒的较短脉冲,例如小于100μs,例如约10μs。随着脉冲长度变得更短,电场就需要变得更高。更大电压和电极之间的更短间距实现更大电场强度。常规的电穿孔器使用较长的中等电压脉冲;然而,这些电压脉冲可能常常会导致烧伤和/或在皮肤留下印记。本公开中的系统的短持续时间脉冲提供增强的安全特性的额外优点。场强度可能不是恒定的,具体取决于微针阵列中的位置。然而,一般来说,可使用电压除以电极间距来确定场强度。因此,当电极间距较小时,可仅使用微秒脉冲来产生足以对组织进行电穿孔的电场,如本文中所描述。
57.在一些实施例中,装置被配置成产生介于100v/cm与30,000v/cm之间、优选地介于200v/cm与10,000v/cm之间且更优选地介于300v/cm与5,000v/cm之间的标称电场强度。例如,标称电场强度可在500v/cm至3,500v/cm的范围内。
58.在一些实施例中,一个或多个电脉冲的峰值电压绝对值介于10v与10,000v之间,优选地介于50v与5,000v之间,且更优选地介于100v与1,000v之间。例如,峰值电压绝对值可在200v至500v的范围内。在一些实施例中,一个或多个电脉冲的峰值静态电压绝对值介于100v与35,000v之间,优选地介于1,000v与30,000v之间。例如,峰值静态电压绝对值在15,000v至27,500v的范围内。
59.在一些实施例中,一个或多个电脉冲的峰-峰电压绝对值介于20v与20,000v之间,优选地介于100v与10,000v之间,且更优选地介于200v与2,000v之间。例如,峰-峰电压绝对值可在400v至1,000v的范围内。在一些实施例中,一个或多个电脉冲的峰-峰静态电压绝对值介于200v与70,000v之间,优选地介于2,000v与60,000v之间,且更优选地介于25,000v与50,000v之间。
60.在一些实施例中,一个或多个电脉冲的峰值电压绝对值与峰-峰电压绝对值之间的比率介于0.1与10之间,优选地介于0.3与5之间,且更优选地介于0.5与2之间。
61.在一些实施例中,一个或多个电脉冲的峰值静态电压绝对值与峰值电压绝对值之间的比率大于2,或大于5,或大于10,或大于100。
62.在一些实施例中,一个或多个电脉冲的峰值电流绝对值介于1a与1,000a之间,更优选地介于5a与500a之间,且更优选地介于10a与100a之间。例如,峰值电流绝对值可在20a至50a的范围内。
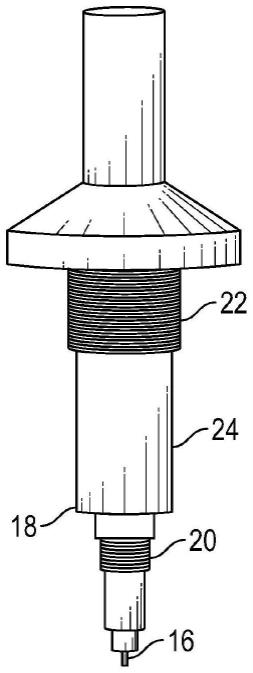
63.在一些实施例中,一个或多个电脉冲各自的初始脉冲长度介于1μs与1,000μs之间,优选地介于3μs与100μs之间,且更优选地介于5μs与50μs之间。例如,初始脉冲长度可在10μs至30μs的范围内。
64.在一些实施例中,一个或多个电脉冲各自的总脉冲长度介于5μs与5,000μs之间,优选地介于10μs与1,000μs之间,且更优选地介于20μs与500μs之间。例如,总脉冲长度可在30μs至200μs的范围内。
65.在一些实施例中,一个或多个电脉冲各自的初始脉冲长度与总脉冲长度之间的比率介于1.5与100之间,优选地介于2与50之间,且更优选地介于3与20之间。
66.除非被标识为静态电压(即,峰值静态电压、峰-峰静态电压),否则前述脉冲值是
指生物组织(例如皮肤)中的脉冲。应注意,类似的常规压电装置被设计成在空气中产生火花。相比而言,本文中所描述的压电装置与微针电极耦合,并且用于将电流传递通过导电介质(即,无火花)。
67.在本发明装置和方法的优选实施例中,是双极振荡脉冲而非单极脉冲用于进行电穿孔,通常呈常规地用于进行电穿孔的指数衰减或方波脉冲的形式。这一双极振荡脉冲可能是由包含压电晶体的外壳中的弹簧冲击引起的压电晶体的压缩和延伸的自然结果。与常规的单极脉冲相比,双极振荡脉冲不仅能够产生对细胞膜的介质击穿,还可在细胞膜中产生声波处理运动,从而诱导更有效的细胞穿孔。此外,振荡脉冲可通过避免在很长一段时间内使细胞膜极化超过临界电位来提供更好的细胞活力,从而防止细胞膜的不可逆破裂。
68.在图7a-7b中描绘电穿孔装置的一个实施例。所述系统包含手动拨动开关、压电晶体、包围晶体的外壳、铜线和mea。
69.在实施例中,微针电极以正方形或矩形布置而布置在基部上,其中行或列可交替地充当正电极和负电极。交替地,正电极和负电极可呈棋盘图案。在实施例中,药筒包括微针阵列。例如圆形布置等其它布置是可能的;微针可以任何合适的形状进行布置。
70.在一个实施例中,mea具有54个微针电极的阵列,长度为650μm,在将电场集中到表皮的多行相反带电电极之间的间距为0.9mm。电穿孔需要约103v/cm的强电场,其中较短脉冲需要较大场强度。这意味着以更小间距间隔开的电极可在较低电压下进行电穿孔。紧密的电极间距还降低了电场穿透皮肤的深度,这有助于表皮靶向并减少神经刺激。
71.脉冲长度(或衰减常数)为约数微秒(例如,1-1000微秒),并且可能为约数纳秒(例如,1-1000纳秒),具体取决于所利用的压电晶体。例如,可通过选择晶体制造过程中利用的不同掺杂剂、选择不同掺杂剂和不同压电材料以及所属领域中已知的其它方法来控制脉冲长度。脉冲长度可在1ns至1ms的范围内,优选地在1至100μs的范围内。
72.尽管对于非振荡脉冲,初始脉冲长度和总脉冲长度相同,但本文中所描述的装置和方法的脉冲可为振荡的,使得初始脉冲长度和总脉冲长度可不同。此外,尽管常规的电穿孔器产生大体上单极脉冲,但本文中所描述的装置和方法优选地使用双极脉冲,其中每个脉冲在正值与负值之间交替。
73.图1a-1b描绘本文中所描述的电穿孔装置的外壳和压电脉冲发生器的一个实例。此处,可压缩使用者拨动开关2,由此压缩上部弹簧4,从而使得弹簧4更靠近锤6。当始终推动拨动开关2时,所附接楔形物126将锤6推送出其闩锁,且上部弹簧4减压。当按压拨动开关2时,此弹簧4还进行压缩以储存弹性势能。一旦楔形物126将锤6推动出其闩锁,此弹簧4减压以使锤6突出。可由金属材料制成的锤6突出到与压电晶体12接触的金属销钉10上,以诱发机械变形并产生电脉冲。当拨动开关2进行压缩时,此弹簧8(下部压缩弹簧)也在锤6下方和周围进行压缩。在闩锁释放阶段之后,当锤6突出到金属销钉10上并由此突出到晶体12上时,这一弹簧8减压,从而使拨动开关2、锤6和上部压缩弹簧4复位。此销钉10搁置在压电晶体12之上,并在锤6突出后与其接触。金属销钉10将力集中在晶体12上。当锤6撞击金属销钉10时,晶体12产生电脉冲。所述装置还包括具有电极触点的晶体壳体14。此壳体14容纳压电晶体12,并具有从底部延伸以形成第一电连接件16的销钉并且还具有延伸至侧部18上的第二电连接件的导电片。从晶体壳体14突出的金属片充当电连接件,这里是下部电连接件16。从侧部机构壳体24突出的金属片还充当电极,此处是侧部电极18。螺纹可用于将任选的壳
体旋拧在顶部上。可使用下部螺纹20和上部螺纹22两者。弹簧锁锤机构壳体24容纳机构的元件。楔形物片126附接到拨动开关2,用于将锤6推出闩锁并使其突出到金属销钉10和晶体12上。
74.图2a-2b描绘微针电极阵列及用于其的保持器或药筒的一个实施例。图2a示出微针电极壳体(药筒壳体)30,其充当一系列六个金属板36的外壳,如图2a和图2b两者所示,这些金属板具有从板36的一个边缘表面34延伸的线性微针电极阵列,所述边缘表面与壳体30的表面32相邻。导线接头26、28直接或间接连接到壳体内的金属板36且从壳体30延伸以用于连接到压电脉冲发生器。第一导线38和第二导线40连接金属导电板36以将电脉冲从压电脉冲发生器传输到微针电极。导线38、40可分别充当例如正电连接件和负电连接件。
75.图3描绘装置的一个实施例,所述装置包含:(i)包含压电脉冲发生器的外壳,以及(ii)包括微针电极阵列的药筒。压电脉冲发生器42可类似于图1a-1b中所示的压电脉冲发生器。如图3中所示,装置进一步包含从药筒48延伸的微针电极阵列50。药筒包含此处描绘为槽的电极插入点56和58,以与来自压电脉冲发生器42的电连接件配合从而与金属导体52、54电连接,所述金属导体又电连接到微针电极50。装置可进一步包含任选的支撑手柄44,其可辅助使用者按下压电脉冲发生器42上的拨动开关。支撑手柄44可包含带螺纹孔口46,以与压电脉冲发生器42的外壳上的螺纹匹配。
76.图4-5示出微针电极阵列和壳体/药筒的两个实施例。如图4中所示,装置(例如,药筒)的末端部分包含实心微针电极62的阵列。微针62连接到/容纳于壳体60内。此处,药物64包被在微针电极62中的一个或多个的表面上。如图5中所示,装置66(例如,药筒)的末端部分包含中空微针电极68的阵列和含流体药物制剂74的多个储集器72。在其它实施例(未示出)中,药筒可具有向中空微针电极供应药物的单个共享储集器。导管70在储集器72与中空微针电极68的孔之间提供流体连通。储集器74可用于在释放之前储存流体药物制剂74,且可包含比可含于实心微针上的包衣中更多的药物。
77.图6a-6d示出微针阵列的电连接件的四个实施例。如图6a中所示,导电微针电极200连接到以电气方式不导电基板202。基板202的上部表面(即,基板202与微针电极200连接的同一侧部)上的电连接件204(例如,导线)选择性地提供相同极性的微针电极200之间的电连接。
78.如图6b中所示,导电微针电极200连接到以电气方式不导电基板202。基板202的下部表面(即,基板202与微针电极200连接的同一侧部)上的电连接件206(例如,导线)选择性地提供相同极性的微针电极200之间的电连接。
79.如图6c中所示,导电微针电极200连接到以电气方式不导电基板202。电连接件208从基板202的上部表面(即,基板202与微针电极200连接的同一侧部)延伸到基板202的下部表面。电连接件210选择性地提供相同极性的微针电极200之间的电连接。
80.如图6d中所示,以电气方式不导电微针214连接到以电气方式不导电基板202。导电材料212至少部分地覆盖微针214的表面以形成微针电极。基板202的上部表面(即,基板202与微针214连接的同一侧部)上的电连接件216(例如,导线)选择性地提供形成相同极性的电极的导电材料212之间的电连接。
81.装置和方法的应用
82.本文中所描述的方法用于借助于电穿孔向患者施用药剂,通常为药物。如本文中
所使用,术语“电穿孔”包含所属领域中已知的相关现象,例如电融合,并且可包含病毒、病毒样颗粒、脂质体和含脂质双层膜的任何其它颗粒物体。患者可为有需要的人类或其它哺乳动物。
83.所述方法可有利地用于使用电穿孔将大分子药物递送到患者的身体组织中,而无需使用电池、电容器或其它常规电力储存装置,并且无需使用来自外部电源(例如,未插入电源插座)的电。然而,多种药物,包含小分子、蛋白质、基于核酸的化合物和生物制剂,可能有助于它们的递送。药物范围包含生物制剂,可能包括以核酸或蛋白质的形式以合成方式合成或从相关来源天然获得的抗原(衍生自或模拟外来物质以在引入时诱导免疫应答的物质);质粒或线性形式的核酸,例如dna、rna或其它多核苷酸化合物;肽(氨基酸序列);病毒载体或病毒;任何类型的疫苗;基因疗法,例如治疗癌症的car-t细胞疗法;免疫疗法;化学或生物合成的蛋白质;和/或这些的任何组合,或载药颗粒,例如脂质纳米颗粒、聚合物纳米颗粒。
84.在一些实施例中,电场集中到皮肤,尤其是表皮,其中集中到表皮意味着大多数经历电穿孔条件的细胞位于表皮而不是真皮或更深的组织中。限制电场穿透到更深的组织以及有活力表皮中的细胞密度远大于真皮中的细胞密度这一事实促进了这种集中。将电场和所引起的电穿孔靶向到皮肤且尤其表皮提高免疫原性并使得减少副作用。与基本上无细胞的真皮不同,表皮密集地分布着细胞,包含角质形成细胞以及有效的抗原呈递细胞,例如树突状细胞(包含朗格罕氏细胞)。与im注射相比,将抗原靶向到这些表皮细胞已被证明可改进免疫应答。尽管真皮电穿孔的价值较低,但表皮细胞中产生的抗原扩散到真皮上层是有益的,因为真皮树突状细胞和丰富血管系统的存在实现到淋巴结的引流,这也增强了免疫原性。此外,将电场集中到表皮可减少神经刺激,从而使电穿孔更容易耐受。特别值得关注的是对皮肤下的运动神经和肌肉细胞的刺激,这可能导致在其它情况下因皮肤或肌肉电穿孔而报告的剧烈抽搐。实际上,这在本文中所公开的实例中示出,其中利用钳形电极的常规电穿孔在施加每个脉冲后在电穿孔位点引起强烈的肌肉收缩。动物被麻醉,这表明肌肉细胞和/或运动神经中的动作电位受到直接刺激。当用mea进行电穿孔时,这些收缩是不可见的,mea使电场集中在表面,远离肌肉。
85.电场集中方法与其它方法有一些不同之处。其它方法建议使用比现有微针电极长得多的穿透电极。这些其它穿透电极完全穿过表皮和真皮,并穿透到真皮下组织,通常更深。因为本发明的微针电极穿透到表皮和可能的真皮的一部分,因此微针电极不完全穿过真皮并且不接触真皮下方的组织。因为当对这些微针电极进行脉冲调制时产生的电场在相反带电电极之间的组织中最强,因此比微针电极的穿透深度更深的组织接收的电场较弱,不太可能引起电穿孔。
86.对组织进行电穿孔的另一方法涉及使用接触皮肤表面但不穿透到皮肤中的表面电极。它们可能涉及处理皮肤表面以促进接触,例如应用导电凝胶或其它材料或者使用砂纸或其它方法至少部分地去除角质层。在这种情况下,电场穿透皮肤的深度与电极之间的间距类似。典型系统中的这一间距至少为毫米或更大。因此,电场不会集中在真皮,当然也不会集中在表皮,而是会到达真皮下方的组织。可能具有以非常小间距间隔的表面电极(例如,小于1mm),从而更好地限制真皮下组织对电场的暴露。然而,与穿透式微针电极阵列相比,它们在皮肤中产生更不均匀的电场强度。
87.通过参考以下非限制性实例可进一步理解本发明。
88.实例
89.进行实验以将本文中所描述的装置和方法与市售装置和方法进行比较。
90.以下实例中描述的微针电极阵列(mea)是通过组装6行不锈钢微针(电极)而制成的,长度为650μm,横截面为200μm
×
50μm,逐渐变细成尖锐顶端,安装在聚乳酸制成的3d打印绝缘保持器中。具有相同电极性的每行电极由9个微针组成,每个微针在每行内以0.8mm的间距分离开(即,具有相同极性的微针电极),并且各行以0.9mm的间距分离开(即,具有相反极性的微针电极的分离)。图7e(右侧)是根据一个实施例的电极行的放大图。此紧密间距用以实现使用微秒脉冲进行电穿孔所需的较大电场强度。压电脉冲发生器使用导线针对正接头和负接头连接到mea(参见例如图7d)。在使用中,将mea压抵在皮肤上,使得微针穿过皮肤的角质层屏障进入有活力表皮和浅层真皮,之后按压拇指拨动开关以施用脉冲(图7a)。图7a示出电穿孔器80在激活之前通过手82保持在某一位置。电穿孔器80包括具有拨动开关84的外壳86,所述拨动开关可例如通过使用者的拇指激活。电穿孔器80进一步包括mea药筒88。图7b是被称为epatch的包括压电脉冲发生器和金属mea的电穿孔器90的分解视图。压电脉冲发生器包括容纳压电晶体94的晶体外壳96。包括微针100的mea药筒102经由铜导线98连接到压电脉冲发生器。电穿孔器90进一步包括手拨动开关92。图7c示出一行微针电极(左侧)和单个电极120(右侧),图7d是示出mea的一个实施例中的电极配置的图式,图7e是mea相对于指形件132的区段的放大图。在图7e中,mea药筒130保持微针134。图7f是用于可经由槽112连接到保持器110的微针电极的板的聚合保持器/壳体110的平面视图。
91.本文中的实例显示,包括压电脉冲发生器和金属mea的方法和系统可使用微秒脉冲选择性地将分子递送到表皮中的细胞中,而没有明显损伤皮肤的迹象。相比而言,使用来自常规电穿孔装置的毫秒脉冲的电穿孔可能会在每个微针电极穿透皮肤的位点处表现出明显损伤。本发明的方法和系统可递送dna疫苗并产生稳定的体液免疫应答和病毒中和,与不进行电穿孔的皮内(id)或肌内(im)注射相比,显示出至少10倍的剂量节省。
92.实例1—使用压电脉冲发生器和微针电极阵列的动物中电穿孔研究
93.动物和质粒
94.所有动物实验均按照埃默里大学和佐治亚理工学院的机构动物护理及使用委员会(iacuc)指南执行。使用成年雌性wistar大鼠(250-300g)和5-6周大的雌性balb/c小鼠。动物在动物护理设施中保持12h/12h的光照/黑暗周期,自由进食和饮水,并在实验前至少适应7天。使用高表达报告质粒gwiz-gfp。利用融合克隆技术将无跨膜结构域的sars-cov-2表面糖蛋白的dna克隆到pcaggs载体中。
95.压电脉冲发生器和微针电极阵列的设计
96.包括压电脉冲发生器和电耦合的mea的装置在本文中被称为“epatch”。电脉冲由源自普通家用压电炉打火机的装置产生(图7b)。3d打印圆柱形室,用于容纳从商用打火机中收集的压电晶体。室有一根导线连接到压电晶体并通过其基部离开所述室。顶部附接有手拨动开关,以提供与常规打火机在被向下按压时相同的力。通过3d打印机利用聚(乳酸)3d打印保持器。
97.通过将6行实心金属微针组装在绝缘保持器中来制造mea。每行具有9个微针,每个微针的顶端到顶端间距为0.79mm。具有相反电极性的微针被定位成彼此相邻,各行之间的
距离为0.90mm。通过示波器(根据图11a-11b中所示的电路)测量来自epatch装置的脉冲分布。
98.用于电穿孔的电场的数值模拟
99.使用商用建模软件通过数值建模分析电场强度分布。用于皮肤中电场的数值模拟的参数如下表1所示。
100.皮肤解剖结构大鼠小鼠抵抗性(s/m)角质层20μm10μm0.0005表皮和真皮650μm150μm0.2皮下层1300μm300μm0.05
101.表1
102.为了简化模型,不考虑电穿孔期间透化组织的电导率变化,从而在脉冲开始施加于先前未处理皮肤时捕捉峰值电场强度。电场模拟在静电模式下进行,其中将多行金属针电极交替设定为静态高电位和静态低电位,使得相邻行之间的电压满足目标电压值。使用皮肤参数设定针尖区段之间的介质,以模拟微针穿透皮肤时的情况。在实例5和7中给出使用这一模型的结果。
103.经由共聚焦显微术区分无活力细胞和电穿孔细胞
104.为了研究电穿孔对皮肤中细胞活力和细胞通透性的影响,使用细胞不透性探针、sytox green来标识电穿孔引起的瞬时细胞膜通透性摄取。sytox green在电穿孔之前包被在微针上,并用作电穿孔引起的瞬时通透性的指示物。另一种细胞不透性探针、溴化乙锭(eb)用作电穿孔引起的无活力细胞的指示物。balb/c小鼠皮肤用作组织模型。
105.在麻醉下,用刮刀去除背部真皮毛发,然后涂抹脱毛剂等待3分钟。用湿纱布清洁皮肤以去除脱毛剂。脱毛后三天,用异氟醚麻醉小鼠,将mea按压到皮肤中,并施加5个或20个压电脉冲。对皮肤进行电穿孔10分钟后,用二氧化碳对小鼠实施安乐死。收集皮肤并将其浸入含eb(50μg/ml)的磷酸盐缓冲盐水(pbs)中,在4℃下孵育并摇晃持续1.5h。用新鲜pbs洗涤皮肤3次,并使用激光扫描共聚焦显微镜(20倍物镜)(未示出)成像。分别使用488nm和514nm的氩激光依次激发sytox green和eb。在共聚焦显微镜下,无活力细胞具有来自eb的红色荧光,而电穿孔细胞具有来自sytox green(未示出)的绿色荧光。
106.gfp表达的实时成像和皮肤的组织学检查
107.在dna递送研究前一天,在麻醉下准备大鼠,方法是使用修剪器去除其背部皮肤上的毛发,之后涂抹脱毛膏等待4分钟并用水擦拭干净。通过异氟醚蒸发器在装有5%异氟醚的o2诱导室中对动物进行麻醉,然后给它们戴上标准的啮齿动物面罩并使其在手术过程中保持全身麻醉。
108.将二十微升含gfp质粒的pbs(2.5μg/μl)注入id,以在皮肤中形成可见的水泡。在注射dna 1min后,用mea或钳形电极将电穿孔脉冲施加到注射位点。epatch装置产生指定数目的微秒脉冲(1个、5个、10个、20个脉冲)以研究脉冲数对基因表达的影响。具有可编程脉冲电压的商用台式电穿孔器也用于研究毫秒脉冲电压对基因表达的影响。通过ivis光谱ct体内成像系统在不同日子里监测皮肤中gfp的荧光强度。
109.对于组织学检查研究,通过epatch装置用20个脉冲对小鼠体内皮肤进行电穿孔,并在电穿孔后立即在立体显微镜下成像,3h后再次成像。在电穿孔后12小时收集皮肤之后,
将组织包埋在tissue-plus o.c.t.包埋剂中,并在-20℃下冷冻过夜,之后使用冷冻切片机以20μm的厚度进行切片。通过激光扫描共聚焦显微镜(未示出)对组织切片进行成像。对于h&e染色,将组织在10%福尔马林缓冲液中固定过夜,然后通过自动组织脱水系统进行脱水。将脱水组织包埋在石蜡中,用旋转切片机以5μm的厚度进行切片,并进行染色。通过倒置显微镜(未示出)对组织进行成像。
110.小鼠免疫研究
111.对于小鼠免疫研究,已证实在大鼠中使用的相同电穿孔参数同样会在小鼠皮肤中产生强烈的gfp表达。balb/c小鼠被随机分成五组(每组n=5只小鼠),接受注射10μl含sars-cov-2s蛋白dna疫苗的pbs溶液:(i)10μg dna疫苗进行im注射,(ii)100μg dna疫苗进行im注射,(iii)10μg dna疫苗进行id注射,(iv)10μg dna疫苗进行id注射,之后通过epatch装置进行20次脉冲,以及(v)pbs进行id注射,作为阴性对照。在手术过程中用异氟醚对小鼠进行麻醉。每只动物在4周后经由与第一次给药相同的程序接受第二次给药。第7周,通过眼眶血窦穿刺抽取血液,分离血清。
112.用于sars-cov-2刺突蛋白抗体分析的elisa
113.使用酶联免疫吸附测定(elisa)测量小鼠血清中抗sars-cov-2刺突表面蛋白的igg滴度。用纯化的刺突蛋白包被elisa板,然后用5%的牛血清白蛋白进行封闭。将血清样品用含0.1%吐温20(pbst)的pbs稀释80倍,之后加入elisa板中,在室温(20-25℃)下孵育1h,然后用pbst洗涤三次。加入辣根过氧化酶缀合的山羊抗小鼠抗体并孵育1h。再次洗涤板,接着加入3,3
′
,5,5
′‑
四甲基联苯胺底物进行显色。通过商用停止溶液终止反应。通过elisa板读取器在450nm处读取吸光率。记录光密度(od)值并将其用作小鼠中的相对抗体表达水平。
114.假病毒中和测定
115.中和测定中使用sars-cov-2刺突蛋白假型病毒。通过将293t细胞与env缺陷型hiv-1骨架质粒dna和表达全长sars-cov-2刺突蛋白流动建立方案的dna质粒共转染,产生假病毒。假病毒在293t细胞中产生并进行自我包装。收集分泌到293t细胞上清液中的假病毒。
116.为了分析血清中和活性,将表达血管紧张素转化酶2(ace2)的293t细胞接种在96孔板中并生长过夜。用杜尔贝科改良伊格尔培养基(dulbecco's modified eagle medium)将小鼠血清样品稀释100倍、300倍和900倍。将每个稀释样品(50μl)与等体积的病毒悬浮液(50μl)混合,然后在37℃下孵育1h。然后,将含血清假病毒混合物的样品一式三份地加入到接种有表达ace2的293t细胞的96孔板中的槽孔中,这些细胞生长至50%汇合度。感染后六小时,将悬浮液以1500x g离心5分钟,取出上清液并用含5%胎牛血清的dmem替换。48小时后,裂解每个槽孔中的细胞并确定荧光素酶活性。免疫血清的中和活性通过以下公式确定:[(仅假病毒)-(假病毒 血清)]/[仅假病毒]
×
100%。
[0117]
实例2-初步猪皮肤测试
[0118]
首先,使用猪皮肤进行初步荧光研究用于将传统的微针注射平台与由可操作地耦合到微针电极阵列的压电脉冲发生器组成的递送系统进行比较。具体地说,sytox green用于监测表达。一种红色染料,溴化乙锭,也用于指示因注射而被杀伤的细胞。使用传统的微针平台对猪皮肤进行注射,并对细胞进行成像(未示出)。也使用具有压电脉冲发生器和微
针电极阵列的新递送系统对猪皮肤进行注射。在0个脉冲、5个脉冲和10个脉冲(未示出)时拍摄图像。与常规的微针平台相比,使用新递送系统不仅表达显著更高,也没有由于注射而导致的细胞活力的显著损失。
[0119]
实例3-表皮中的基因转染
[0120]
为了评估基因转染到表皮的靶向性,在dna递送后1天进行组织学分析。利用mea的电穿孔使用来自“epatch”装置的微秒脉冲,所述装置由压电脉冲发生器和金属mea组成,或使用来自商用台式电穿孔器(btx electro cell manipulator 600,harvard apparatus,cambridge,ma)的毫秒脉冲产生强绿色荧光,所述强绿色荧光当从皮肤表面正面观察时在暴露于mea的皮肤表面中以及整个有活力表皮中明显,当作为冷冻组织切片观察时,真皮或角质层中几乎没有gfp表达的迹象。图像显示,经转染的细胞几乎只在角质层之下的表皮层内被标识(未示出)。相比而言,当使用钳形电极进行电穿孔时,gfp荧光强度较小(与图9中所示的定量结果一致)。此外,尽管经转染的细胞大多在表皮中,但可看到gfp在深真皮层,尤其是毛囊中转染的迹象。这些发现证实了mea将电穿孔集中到表皮的能力。
[0121]
实例4-对高压脉冲和电场的分析
[0122]
使用高压探针和示波器,确定了epatch通过无皮肤穿透的空气火花的电压输出。图8a-8c示出用于电穿孔的压电脉冲发生器的代表性电输出分布。通过将电极引线直接连接到示波器探针(a,电压分布)并通过在猪皮肤中体外进行脉冲调制(图8b,电压分布;图8c,电流分布)来激活压电脉冲发生器。在图8a中,示出多个复制电压分布(n=20)。输出产生的脉冲峰值正静态电压和峰值负静态电压分别为24.4
±
1.3kv和7.0
±
0.8kv(图8a)。给定0.9mm的电极间距,这对应于1200kv/cm的峰值正静止场强度,其高于空气的介电强度(即,约30kv/cm)。10.6
±
0.7μs后达到峰值正静态电压,随后的振荡电压输出在约100μs内衰减(图8a)。这种极高的静态电压是由极高的电阻抗和电流不足引起的。
[0123]
当使用mea作为电极体外施加到猪皮肤时,峰值正电压输出和峰值负电压输出分别为283
±
49v和-345
±
54v(图8b)。使用图11a中所示的装置进行电压测量。达到峰值电压的时间为12.6
±
1.1μs。此处,由于与连接到示波器相比,皮肤的阻抗更低,因此电压要低得多,这允许电流在整个脉冲持续时间内能通过。电脉冲呈双极振荡衰减波形的形式,这是压电脉冲的特性。为了进行比较分析,还使用通常用于实验室转染的商用台架电穿孔器产生电脉冲,并将其体外耦合到猪皮肤中的mea。此脉冲发生器产生31
±
3v或100
±
5v的单极指数衰减脉冲,脉冲持续时间(即,指数衰减时间常数)分别为59.2
±
7.8ms或55.4
±
2.3ms(图11c)。这些毫秒单极脉冲更典型地用于常规电穿孔,与epatch产生的微秒振荡脉冲形成对比。
[0124]
还测量在来自epatch装置的脉冲期间通过皮肤的电流,这显示出与电压波形在形状上类似的振荡衰减波形,并获得24.8
±
1.1a的峰值正电流(图8c)。使用图11b中所示的装置进行电流测量。对于商用台式电穿孔器,当施加32
±
3v和105
±
4v的脉冲时,通过皮肤的最高电流分别为0.28
±
0.03a和1.33
±
0.16a(图11d)。表观电阻抗(即,表征为峰值电压除以峰值电流)在epatch脉冲调制期间为11.4ω,在常规电穿孔器的脉冲调制期间为114ω或78.9ω(分别为32v或105v)。与来自常规脉冲发生器的毫秒脉冲相比,使用来自epatch的微秒脉冲测得的表观电阻抗要低得多,这可能是由于皮肤和其它组织暴露于具有较高频率分量的复杂波形的电场中已知会发生阻抗降低。
[0125]
为了更好地理解使用mea施加脉冲时皮肤中的电场分布,如图12所示,对电穿孔期间皮肤中的电场强度进行了建模。图12示出通过计算机模拟确定的皮肤中的电场强度分布。当使用(a)mea或(b)钳形电极施加300v脉冲时,与来自epatch的脉冲相似,示出了峰值电场强度。从mea上方(左上方)和侧视图(底部和右侧)显示场强度分布。真皮-表皮接合处用虚线指示。比例尺是1mm。
[0126]
对于mea,电场强度在每个微针电极周围最高,特别是在顶端附近,其中已知电极曲率会增大电场强度(图12)。相同极性的电极之间的电场强度最弱。电场也没有深入穿透到电极下方的组织中,因此在数百微米的长度比例内下降。以此方式,电场集中于表皮和真皮上层,其含丰富的抗原呈递细胞(例如表皮朗格罕氏细胞和真皮树突状细胞)并具有到淋巴结的有效引流,所有这些都可能增强疫苗免疫原性。
[0127]
可逆电穿孔的阈值取决于暴露于电场的持续时间。对于毫秒长脉冲,电穿孔阈值预计为约400-600v/cm的量级,而对于微秒脉冲持续时间,阈值增大到1.0-1.5kv/cm。当使用压电电穿孔器施加300v的脉冲时,紧邻电极的组织中的最高电场强度为15kv/cm,但大部分组织体验的场强度为2-3kv/cm,这高于成功电穿孔所需的阈值,但仍低到足以避免广泛的细胞杀伤。以此方式,可预期邻近于电极的高度集中的细胞死亡以及在相同极性的电极之间没有发生电穿孔的较小区域,但大部分组织体验预期会引起可逆电穿孔的场强度。
[0128]
这些发现进一步与在相同电压(300v)下使用常规钳形电极产生的皮肤中场强度进行了比较;已发现钳形电极的较大间距(即,3.9mm)相比于mea产生弱得多的电场强度。电场强度仅在电极之间的一部分空间中超过1kv/cm,仅在电极的极边缘处超过1.5kv/cm。
[0129]
还研究了在使用钳形电极或mea施加来自常规电穿孔器的代表性脉冲(30v和100v)期间皮肤中的场强度。利用钳形电极的30v脉冲产生非常低的场强度,大部分低于300v/cm,这没有达到毫秒脉冲的预期电穿孔阈值。利用以小间距间隔的mea施加30v的脉冲使紧邻电极的组织达到400-600v/cm,但大部分组织体验弱得多的电场。当使用100v的脉冲时,钳形电极达到预期在一些组织中进行电穿孔的场强度,并且mea产生强到足以在大部分组织中进行电穿孔的电场。
[0130]
实例5—epatch的稳定报告基因转染
[0131]
为了评估epatch装置对质粒递送和转染的影响,将编码绿色荧光蛋白(gfp)的dna质粒体内递送到大鼠皮肤。通过gfp荧光随时间的体内成像来测量基因表达水平。
[0132]
测试了使用epatch的高场强度微秒脉冲的效果,并且已发现单个脉冲能够产生可见的gfp表达(图9)。图9示出在递送gfp报告质粒后的不同天数内,gfp荧光在皮肤中的辐射效率,递送方式为使用给出约300v的1-20个脉冲的epatch(其波形如图8b中所示)或在具有衰减时间常数(tau=49-57ms)的受控峰值电压(10-100v)下使用常规指数衰减电穿孔脉冲发生器进行电穿孔。使用微针电极阵列(mea)或钳形电极施加脉冲。数据表示平均值
±
标准偏差(每种情况下n=5-6次重复)。(***p《0.001)。
[0133]
更多的脉冲使gfp表达增加至10个脉冲(p=0.001);增加至20个脉冲不会进一步增加gfp表达(p》0.05)。电穿孔后三天,gfp表达随时间减少(p=0.002)。5天后,无法检测到gfp荧光,可能是由于皮肤中的gfp蛋白质降解。
[0134]
作为阴性对照,在没有电穿孔的情况下将gfp质粒id注射到皮肤中,这导致几乎检测不到的gfp转染(图9)。与单独id注射相比,epatch使gfp表达增加416倍(p《0.001)。
[0135]
为了更好地解释这些结果,实行利用在电穿孔期间存在的细胞不可透的绿色标记化合物(sytox green)以标识通透细胞的额外实验,随后添加红色活力染剂以标识无活力细胞。通过显微镜对皮肤的检查表明,在微针刺穿皮肤的位点处存在细胞活力的丧失,与电穿孔无关,如红色荧光细胞(未示出)的存在所指示。这可能是由于微针的机械穿刺造成的损坏。来自epatch的5个或10个电穿孔脉冲的施加似乎没有增加细胞活力损失,但随着绿色标记化合物在每次微针穿透的位点处被摄取到无活力核心周围的有活力细胞中,确实导致细胞透性增加。皮肤表面的显微镜检查仅示出在每次微针电极穿透的位点处的皮肤损伤的微弱和短暂迹象,如下文所论述。
[0136]
接下来测试使用mea与商用电穿孔器耦合的中等场强度毫秒脉冲的效果。在这些条件下进行电穿孔产生gfp表达,其在30v时达到峰值(p=0.02)(图9)。30v下的峰值gfp表达与epatch利用10个脉冲产生的峰值没有显著差异(p=0.055),而其它电压下的gfp表达显著更低(p《0.05)。与epatch类似,通过使用毫秒脉冲电穿孔而转染的细胞在电穿孔后3天内gfp荧光也有所衰减(p=0.008)。
[0137]
gfp表达对电压的依赖性可通过10v下电穿孔程度相比于30v下电穿孔程度较低来解释,从而导致转染较少。超过30v,在长时间暴露于高电场强度的毫秒内,不可逆电穿孔和组织加热导致的细胞活力的损失增加,从而可能抵消了到细胞中的dna递送的增加。递送绿色标记化合物和施加红色活力染剂后的额外皮肤成像(未示出)支持了这种解释。随着电压增加,细胞活力的损失增加,微针电极放置位点处的组织加热也增加,达到最高50℃的峰值。皮肤表面的显微镜检查显示,每次微针电极穿透的位点的变色持续至少两天,这与使用毫秒脉冲在较高电压下观察到的广泛细胞死亡一致(未示出)。
[0138]
为了解决当前的皮肤电穿孔方法,使用钳形电极(有3.9mm间距)代替mea。当利用微秒压电脉冲发生器进行脉冲调制时,单个脉冲不会导致可检测到的gfp表达,但施加10个、20个或30个脉冲会产生与脉冲数无关的gfp表现(p》0.05)。利用来自商用电穿孔器的毫秒脉冲使用钳形电极,在60v下发现可检测到的gfp表达,当电压增加到100v时所述gfp表达也略有增加(p》0.05)。借助于epatch或商用电穿孔器,利用钳形电极的gfp表达与使用mea时的gfp表达相比显著降低(p《0.001)。
[0139]
总而言之,这些结果表明(i)epatch可实现高水平的dna转染和表达,(ii)使用mea会产生足够高的电场强度以使来自压电脉冲发生器的微秒脉冲有效,以及(iii)使常规电穿孔器能够相比于钳形电极在低得多的电压下有效,以及(iv)微秒脉冲调制最小化了在使用毫秒脉冲时似乎会损伤组织的组织加热。
[0140]
实例6—小鼠接种sars-cov-2dna疫苗之后的稳定免疫应答和病毒中和
[0141]
在确认epatch可显著增强体内基因表达后,在两种不同剂量(10μg和100μg dna)下评估epatch、无电穿孔的id注射和无电穿孔的im注射(包含im疫苗接种)递送的sars-cov-2dna疫苗的免疫原性。im疫苗接种产生在100μg剂量下高于10μg剂量下的体液免疫应答,如通过抗原特异性igg滴度(p=0.04)和病毒中和测定(p《0.001)所测得(图10a-10b)。具体地说,在第0周和第4周使小鼠免疫;在第7周提取血液样品。小鼠血清中针对sars-cov-2刺突表面蛋白的igg滴度表达为450nm处的吸光度(图10a)。igg针对假病毒的中和在不同血清稀释度下进行分析,并表达为针对每种稀释度的中和百分比(图10b)。作为对照,通过pbs使小鼠免疫。im_10μg和im_100μg:分别利用10μg和100μg dna疫苗进行im注射使小鼠免
疫。id_10μg:利用10μgdna疫苗进行id注射使小鼠免疫。id_10μg_epatch:利用10μgdna疫苗通过id注射,接着通过epatch使用20个脉冲进行电穿孔,从而使小鼠免疫。每组n=5只小鼠。(*p《0.05,**p《0.01,***p《0.001)。
[0142]
id注射10μg dna疫苗产生的结果与相同剂量的im疫苗接种产生的结果类似(p》0.05)。当利用epatch的电穿孔进行id疫苗接种时,在相同的dna剂量下,免疫应答显著高于无电穿孔的id或im疫苗接种(分别为p=0.01和0.004)。此外,利用10μg dna的epatch疫苗接种与利用100μg dna的im疫苗接种没有显著差异(p=0.47),表明epatch疫苗接种至少可节省10倍的剂量。最后,值得注意的是,在血清稀释100倍的情况下,对于低剂量epatch和高剂量im注射组,发现针对sars-cov-2假病毒的90%的抗体中和,而对于无电穿孔的低剂量im和id注射组,仅发现20%的中和(图10b)。总之,这项研究表明,与单独的im或id注射相比,epatch显著改善了对sars-cov-2的免疫应答。
[0143]
临床和组织学检查表明,使用epatch的疫苗接种的耐受非常好。当用放大镜(未示出)观察时,电穿孔后立即对皮肤表面进行的成像显示出微针穿刺和/或集中电穿孔的迹象。3小时后的后续成像显示没有疫苗接种过程的残留迹象。epatch疫苗接种后12小时的皮肤组织学检查未显示炎症标志物。相比而言,高电压(100v)毫秒脉冲调制引起电穿孔后12h皮肤中可见的炎症细胞广泛浸润。疫苗接种后数周内对动物进行的临床检查未产生显著发现。这些数据表明,epatch疫苗接种只对皮肤造成轻微、短暂的影响,不会产生安全信号。
[0144]
总的来说,本公开的递送系统和方法能够提供受益于两项创新的组合的dna疫苗接种方法:用于电穿孔的基于压电的电源和产生靶向到表皮的较大电场的mea。这种呈epatch形式的组合被证明可使用简单、超低成本的系统进行dna疫苗接种,从而扩大针对covid-19和未来大流行病的疫苗接种范围和速度。
[0145]
本公开的递送系统和方法能够提供比无电穿孔的常规注射高几个数量级的表达水平。
[0146]
所属领域的技术人员通过前述具体描述将显而易见本文中所描述的方法和系统的修改和变化。此类修改和变化旨在落入所附权利要求书的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。