1.本发明涉及一种血管新生装置等。
背景技术:
2.近年来,正在对移植含细胞或组织的(例如,细胞或组织包埋)装置(在本说明书中,也将它们一起简称为“含细胞装置”“细胞包埋装置”等)的治疗方法进行研究。细胞包埋装置是指,含有活细胞或生物组织等,并通过对患者供给与代谢功能相关的激素或蛋白质等生理活性物质来代替患有疾病的人或动物的器官等、或者通过对有害物质进行解毒,从而预防和/或治疗患者的疾病的装置。细胞包埋装置能够利用免疫隔离层而从生物体的防御机制中保护活细胞或生物组织,因此与活体器官移植相比,不需要给药免疫抑制剂,因此不用担心由免疫抑制剂造成的副作用、手术为微创,就这些点而言,具有可解决器官捐献者不足的能力,十分优异。
3.细胞或组织包埋装置具有各种各样的形状,作为所述包埋装置的一个实例,可列举出使用了以高分子聚合物包裹活细胞或生物组织而成的微胶囊型或大胶囊型的制剂(例如,细胞制剂)的包埋装置。这些细胞或组织包埋装置的特征在于,通过高分子聚合物所具有的牢固的交联结构,从生物体的防御机制中保护其中所含有的细胞或组织,进一步利用高分子聚合物所具有的分子透过性能,对生物体供给由细胞或组织分泌的激素等。
4.作为这种细胞包埋装置,例如专利文献1中公开了一种具有水性凝胶作为免疫隔离层的细胞或组织包埋装置,所述水性凝胶含有具有活性羰基的改性聚乙烯醇类树脂(a)及交联剂(b)作为成分。此外,专利文献2中公开了一种具有水性凝胶作为免疫隔离层的细胞或组织包埋装置,所述水性凝胶包含间同立构规整度以三单元组(triad)表示为32~40%的聚乙烯醇树脂(a)作为成分。现有技术文献专利文献
5.专利文献1:wo2018/155621专利文献2:wo2018/155622
技术实现要素:
本发明要解决的技术问题
6.本发明的目的在于提供一种新型的血管新生装置等。
7.根据本技术的发明人的研究,如上所述的细胞包埋装置有时难以将充分的氧或营养素送达至装置内的活细胞或生物组织等。若未对活细胞等供给充分的氧或营养素,则活细胞等会发生中央坏死,细胞包埋装置的功能可能会大幅下降。尤其是移植至血管少的皮下时容易发生这种问题,在皮下越厚的大型动物中,皮下的氧及营养不足可能会越严重。
8.在这种情况下,本技术的发明人反复进行了认真研究,结果发现,通过在细胞包埋
装置的移植部位预先使血管新生可解决上述问题等,并经过进一步研究完成了本发明。
9.即,本发明涉及以下的发明等。(1)一种血管新生装置(用于血管新生的装置、用于促进血管新生的装置),其为用于使含细胞或组织的装置(例如,细胞或组织的包埋装置)的移植部位(在移植前)进行血管新生(促进移植部位的血管新生)的装置,其含有血管新生成分(血管新生促进成分)及聚合物。(2)一种血管新生装置(用于血管新生的装置、用于促进血管新生的装置),其为用于与含细胞或组织的装置(例如,细胞或组织包埋装置)组合使用的装置,其含有血管新生成分(血管新生促进成分)及聚合物。(3)一种组合装置(装置、套件、组合装置),其包含含有血管新生成分(血管新生促进成分)及聚合物的血管新生装置[用于血管新生的装置、用于促进血管新生的装置、用于使含细胞或组织的装置(例如,细胞或组织包埋装置)的移植部位(在移植前)进行血管新生的装置]、与含细胞或组织的装置(例如,细胞或组织包埋装置)[用于移植到利用所述血管新生装置进行了血管新生的移植部位的含细胞或组织的装置(例如,细胞或组织包埋装置)]。(4)根据(1)~(3)中任一项所述的装置,其中,血管新生成分含有间充质干细胞。(5)根据(1)~(4)中任一项所述的装置,其中,血管新生成分含有脂肪间充质干细胞。(6)根据(1)~(5)中任一项所述的装置,其中,聚合物含有聚乙烯醇类树脂(a)。(7)根据(1)~(6)中任一项所述的装置,其中,聚合物含有选自具有活性羰基的改性聚乙烯醇类树脂(a1)、间同立构规整度以三单元组表示为32~40%的聚乙烯醇类树脂(a2)、及皂化度为97摩尔%以上的聚乙烯醇类树脂(a3)中的至少一种以上的聚乙烯醇类树脂(a)。(8)根据(1)~(7)中任一项所述的装置,其中,聚合物含有选自具有活性羰基的改性聚乙烯醇类树脂(a1)、及间同立构规整度以三单元组表示为32~40%的聚乙烯醇类树脂(a2)中的至少一种以上的聚乙烯醇类树脂(a)。(9)根据(7)或(8)所述的装置,其中,聚乙烯醇类树脂(a1)含有双丙酮丙烯酰胺改性聚乙烯醇。(10)根据(9)所述的装置,其中,双丙酮丙烯酰胺改性聚乙烯醇含有0.5~15摩尔%的双丙酮丙烯酰胺单元。(11)
根据(7)~(10)中任一项所述的装置,其中,聚乙烯醇类树脂(a2)满足皂化度为90摩尔%以上及聚合度为100~10000。(12)根据(7)~(11)中任一项所述的装置,其中,聚乙烯醇类树脂(a2)为以特戊酸乙烯酯为聚合成分的聚合物的皂化物,且含有特戊酸乙烯酯单元。(13)根据(1)~(12)中任一项所述的装置,其中,聚合物形成了水性凝胶。(14)根据(1)~(13)中任一项所述的装置,其中,聚合物形成了具有0.1kpa以上(例如,0.5~100kpa)(20℃)的应力的水性凝胶。(15)根据(1)~(14)中任一项所述的装置,其中,聚合物形成了浸渍于水中1个月前后的体积变化率为10%以上的水性凝胶。(16)根据(1)~(15)中任一项所述的装置,其中,聚合物形成具有0.3kpa以上(例如,0.3~90kpa)(20℃)的应力、且浸渍于水中1个月前后的体积变化率为20%以上(例如,20~90%)的水性凝胶。(17)根据(13)~(16)中任一项所述的装置,其中,水性凝胶进一步含有交联剂。(18)根据(13)~(17)中任一项所述的装置,其中,水性凝胶含有选自酰肼化合物及氨基脲化合物中的至少一种交联剂。(19)根据(1)~(18)中任一项所述的装置,其中,血管新生装置进一步含有细胞培养成分。(20)根据(19)所述的装置,其中,细胞培养成分含有选自乙酸缓冲液及磷酸缓冲液中的至少一种缓冲液。(21)根据(1)~(20)中任一项所述的装置,其中,血管新生成分存在于聚合物的内部。(22)根据(1)~(21)中任一项所述的装置,其中,血管新生成分溶解或分散于聚合物。(23)根据(1)~(22)中任一项所述的装置,其中,聚合物构成支架和/或防粘连层。(24)根据(1)~(23)中任一项所述的装置,其用于皮下。(25)根据(1)~(24)中任一项所述的装置,其中,含细胞或组织的装置(例如,细胞或组织包埋装置)具有含有聚乙烯醇类树脂(a)的免疫隔离层。
(26)根据(1)~(25)中任一项所述的装置,其中,含细胞或组织的装置(例如,细胞或组织包埋装置)具有免疫隔离层,所述免疫隔离层含有选自具有活性羰基的改性聚乙烯醇类树脂(a1)、间同立构规整度以三单元组表示为32~40%的聚乙烯醇类树脂(a2)、及皂化度为97摩尔%以上的聚乙烯醇类树脂(a3)中的至少一种以上的聚乙烯醇类树脂(a)。(27)一种移植方法(人及非人类动物中的方法),其中,在移除已移植的(1)~(26)中任一项所述的血管新生装置后,在移植部位(移除部位)移植含细胞或组织的装置(例如,细胞或组织包埋装置)。(28)一种疾病或症状(与细胞或组织对应的疾病或症状)的预防和/或治疗(改善)方法(人及非人类动物中的方法),其中,在移除已移植的(1)~(26)中任一项所述的血管新生装置后,在移植部位(移除部位)移植含细胞或组织的装置(例如,细胞或组织包埋装置)。(29)根据(27)或(28)所述的方法,其包括移植血管新生装置的(血管新生)工序。(30)根据(27)~(29)中任一项所述的方法,其中,不造成出血、炎症和/或血管(新生的血管)的破损地进行移除(在移植部位没有出血、炎症和/或血管的破损)。(31)根据(27)~(30)中任一项所述的方法,其中,移植部位为皮下。发明效果
[0010]
本发明能够提供一种新型的血管新生装置。这种血管新生装置能够适宜地利用于各种血管新生用途,尤其是能够适宜地用作用于与含细胞或组织的装置(例如,细胞或组织包埋装置)组合使用的装置,具体而言,能够适宜地用作在细胞包埋装置的移植部位预先使血管新生的装置。
[0011]
本发明的其他形态的血管新生装置可效率良好地进行血管新生。
[0012]
本发明的其他形态的血管新生装置在移除后,可形成新生有血管(尤其是布满血管)的空间(移植袋)。这种新生有血管的袋也可形成于皮下这种血管较少的部位,因此特别有用。因此,例如,容易使血管在移植细胞包埋装置的部位效率良好地新生,可使细胞包埋装置的功能大幅提高。以这种形态使用血管新生装置时,不需要在血管新生前移植活细胞或生物组织等,因此可效率良好地抑制或防止中央坏死。
[0013]
本发明的其他形态能够提供一种可效率良好地移除的血管新生装置。例如,这种血管新生装置对周围组织的粘连少,随着移除而损伤所形成的血管床或周围组织的情况少。因此,可防止或抑制移植部位的出血、炎症(炎症的产生)或浸出液。如此,其他形态的血管新生装置可兼顾血管新生与易移除度,极其有用。
[0014]
根据本技术的发明人的研究,即使血管新生,出血或浸出液也似乎容易使细胞包埋装置的功能表达降低。因此,通过使用这种其他形态的血管新生装置,可防止或者抑制出血、炎症或浸出液,同时可使另行移植的细胞包埋装置进一步效率良好地发挥功能。
附图说明
[0015]
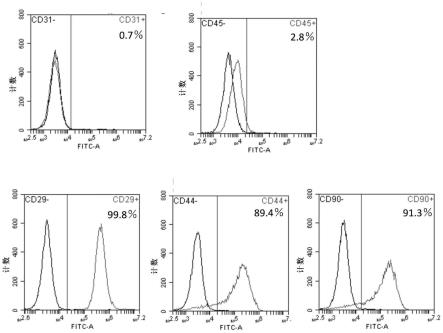
图1为利用各标记物对所分离的adsc进行标记后,用流式细胞仪进行分析的结果。
具体实施方式
[0016]
<血管新生装置>本发明的血管新生装置至少含有血管新生成分及聚合物。
[0017]
[血管新生成分]血管新生成分(促进血管新生的成分)为有助于(促进)血管新生的成分即可,例如可列举出细胞生长因子[例如,血管内皮细胞生长因子(vegf)、成纤维细胞生长因子(fgf)、血小板源性生长因子(pdgf)]、胎盘生长因子(placental growth factor;plgf)、细胞(例如,分泌细胞生长因子的细胞)等。
[0018]
作为细胞,例如可列举出干细胞类{例如,间充质干细胞(msc)[例如,脂肪间充质干细胞(adsc)、骨髓间充质干细胞(bmsc)、胎盘间充质干细胞、脐带间充质干细胞等]等}等。
[0019]
其中,优选间充质干细胞,特别优选adsc。
[0020]
另外,血管新生成分没有特别限定,例如,优选来自哺乳动物(例如,人、猴、猪、大鼠、小鼠、狗、猫等)。
[0021]
此外,血管新生成分可以直接(例如,以细胞的状态)含有,也可以在进行椭球体化或担载于支撑体后含有。从能够省略复杂的操作、或防止血管新生成分(msc等)的活性降低这一角度出发,可优选以细胞的状态(未进行椭球体化等)含有。
[0022]
血管新生成分可利用包含基因重组体的市售品,也可从包含血管新生成分的对象(哺乳动物等)中分离并加以利用。
[0023]
血管新生成分可使用公知或惯用的技术进行分离。例如,可以下述方式分离msc(adsc)。
[0024]
采集雄性7~8周龄的lewis大鼠(japan slc,inc.)的腹部及腹股沟部皮下脂肪,并用磷酸缓冲液清洗。将在此基础上进行了细切的脂肪组织在包含1mg/ml ii型胶原酶(sigma-aldrich)与1mmol/l cacl2·
2h2o的hank’s缓冲液中、于37℃以100rpm振荡20分钟,同时进行酶处理。针对未消化的脂肪组织,进一步追加实施20分钟的酶处理。然后,使消化后的细胞
·
组织悬液通过70μm的尼龙网布,将去除残留组织后的滤液于20℃以350g离心分离5分钟,分离为包含干细胞的沉淀部分与包含较多脂质的成熟脂肪细胞部分。用hank’s缓冲液清洗沉淀部分后,以成为5
×
106个细胞/ml的方式用包含100单位/ml青霉素-100μg/ml链霉素(thermo fisher scientific)的含血清adsc培养基(adsc-1,kohjin bio corporation.)进行混悬,并转移10ml至t75烧瓶(培养面积75cm2)中,以湿度95%、37℃、5%co2进行初代培养。在培养第1天、第2天及第4天更换培养基,去除非粘合细胞。将培养至烧瓶内的细胞达到50~80%汇合的第一代细胞从烧瓶中剥离并进行单细胞化,然后进行冷冻保存。单细胞化的工序以下述方式进行:从烧瓶中去除培养基后,用磷酸缓冲液(phosphate buffer solution:pbs)进行清洗,加入3ml的0.05%胰蛋白酶-edta(thermo fisher scientific),于37℃处理3分钟,从烧瓶表面剥离细胞。将adsc以1
×
106个细胞/ml混悬于细胞冷冻保存溶液cellbanker 1plus(nippon zenyaku kogyo co.,ltd.),并于-80
℃冷冻后,在液氮中保存。将冷冻细胞解冻后,以3.3
×
104个细胞/ml混悬于包含100单位/ml青霉素-100μg/ml链霉素的含血清adsc培养基。转移10ml至t75烧瓶中,并将以湿度95%、37℃、5%co2培养至达到50~80%汇合的第二代细胞从烧瓶中剥离并进行单细胞化(剥离方法与冷冻保存时的胰蛋白酶-edta处理相同)。
[0025]
例如,可通过与针对细胞表面标记物的荧光标记抗体进行反应,然后使用流式细胞仪调查各标记物的阳性率来确认分离后得到的细胞是否为目标细胞。
[0026]
以下示出典型例的结果。用0.05%胰蛋白酶-edta剥离并回收细胞,并用pbs清洗后,使1
×
105个细胞(混悬于包含100μl的0.5%牛血清白蛋白与2mmol/l edta的pbs)与cd29-fitc、cd44-fitc、cd45-fitc、cd90-fitc抗体(bd biosciences)及cd31-fitc抗体(gene tex)反应,并利用流式细胞仪(bd accuri
tm c6,bd biosciences)进行分析。结果确认到:从lewis大鼠脂肪组织中分离的第二代adsc在99.8%的细胞中表达作为adsc的阳性标记物的cd29、在89.4%的细胞中表达cd44、在91.3%的细胞中表达cd90。另一方面,作为adsc的阴性标记物的cd31的表达率则止于0.7%、cd45的表达率止于2.8%(图1)。
[0027]
血管新生成分可单独使用或组合使用两种以上。
[0028]
[聚合物]血管新生装置含有聚合物。如后文所述,这种聚合物可在血管新生装置中形成水性凝胶(水凝胶),也可溶解或分散血管新生成分。此外,聚合物可在血管新生装置中构成支架(支撑架)和/或防粘连层(作为支架(支撑架)和/或防粘连层发挥功能)。
[0029]
作为这种聚合物,可根据血管新生装置中的存在部位
·
存在形态等进行选择,例如,可列举出结构蛋白类(例如,胶原蛋白、弹性蛋白、角蛋白等)、明胶、糖胺聚糖类(例如,透明质酸、硫酸软骨素、硫酸角质素、硫酸皮肤素、硫酸类肝素、肝素等)、蛋白聚糖、细胞粘合分子类(例如,纤连蛋白、层粘连蛋白、纤维蛋白原、玻连蛋白等)、纤维蛋白、丝心蛋白、丝胶蛋白、海藻酸、壳聚糖、琼脂糖、纤维素、纤维素衍生物类(例如,纤维素纳米纤维、羧甲基纤维素、羟丙基纤维素等)、合成多肽、聚乳酸、聚乙醇酸、聚己内酯、聚乙二醇、聚丙二醇、2-甲基丙烯酰氧基乙基磷酰胆碱、聚(甲基)丙烯酸、聚丙烯酰胺、聚-n-异丙基丙烯酰胺、糊精、有机硅(silicone)、聚氨酯、氟树脂类(例如,聚四氟乙烯、全氟烷氧基烷烃等)、聚乙烯醇类树脂等。
[0030]
聚合物可以为亲水性聚合物(或水溶性聚合物)。另外,这种亲水性(水溶性)聚合物在血管新生装置中多通过交联等而变成水不溶性(例如,形成凝胶)。
[0031]
聚合物可单独使用或组合使用两种以上。
[0032]
其中,可特别优选使用聚乙烯醇类树脂。因此,聚合物可至少包含聚乙烯醇类树脂。
[0033]
以下,对聚乙烯醇类树脂进行详细说明。
[0034]
(聚乙烯醇类树脂(a))聚乙烯醇类树脂通常可以为至少以乙烯酯类单体为聚合成分的聚合物的皂化物。这种聚乙烯醇类树脂具有乙烯醇单元即可,也可以具有乙烯酯单元(或来自乙烯酯类单体的单元,例如乙酸乙烯酯单元、特戊酸乙烯酯单元等后述的来自脂肪酸乙烯酯的单元)或其
他单元(例如,后述的来自具有活性羰基的不饱和单体的单元、来自其他不饱和单体的单元)。
[0035]
聚乙烯醇类树脂的4质量%水溶液粘度(20℃)没有特别限制,例如可以为1mpa
·
s以上、2mpa
·
s以上、3mpa
·
s以上、5mpa
·
s以上等,可以为800mpa
·
s以下、500mpa
·
s以下、300mpa
·
s以下、200mpa
·
s以下、150mpa
·
s以下、100mpa
·
s以下、80mpa
·
s以下等。
[0036]
作为代表例,可优选使用4质量%水溶液粘度为3~300mpa
·
s左右的聚乙烯醇类树脂。
[0037]
另外,聚乙烯醇类树脂的4质量%水溶液粘度例如可按照jis k6726测定。
[0038]
聚乙烯醇类树脂可根据其种类或组成等进行选择,没有特别限定,可以为完全皂化聚乙烯醇类树脂(例如,皂化度为97摩尔%以上等),也可以为部分皂化聚乙烯醇类树脂(例如,皂化度小于97摩尔%)。
[0039]
另外,皂化度(平均皂化度)例如可按照jis k6726测定。
[0040]
作为聚乙烯醇类树脂(a),可特别优选使用选自具有活性羰基的改性聚乙烯醇类树脂(a1)、间同立构规整度以三单元组表示为32~40%的聚乙烯醇类树脂(a2)、及皂化度为97摩尔%以上的聚乙烯醇类树脂(a3)中的至少一种(尤其是选自树脂(a1)及(a2)中的至少一种)。
[0041]
以下,对这些树脂进行详细说明。
[0042]
(具有活性羰基的改性聚乙烯醇类树脂(a1))作为具有活性羰基的改性聚乙烯醇树脂(a1)(在本说明书中,也简称为“改性pva类树脂”),例如,可使用将脂肪酸乙烯酯与具有活性羰基的不饱和单体共聚并将所得到的共聚物皂化而制备的共聚改性pva、或者使液状双烯酮或双烯酮气体等具有活性羰基的化合物与利用公知的方法制备的pva或改性pva类树脂直接接触而得到的后改性pva,但从pva类树脂的稳定性或安全性、凝胶化工序中的操作性出发,优选共聚改性pva。
[0043]
作为制备上述共聚改性pva时所使用的上述脂肪酸乙烯酯,没有特别限定,例如可列举出甲酸乙烯酯、乙酸乙烯酯、丙酸乙烯酯、特戊酸乙烯酯等,其中,在工业上优选乙酸乙烯酯。这些脂肪酸乙烯酯可利用以往公知的本体聚合、溶液聚合、悬浮聚合、乳液聚合等各种聚合方法制备,其中,在工业上优选使用甲醇等醇溶剂的溶液聚合。
[0044]
此外,作为具有活性羰基的不饱和单体,没有特别限定,例如可列举出双丙酮丙烯酰胺、双丙酮甲基丙烯酰胺、双丙酮丙烯酸酯、双丙酮甲基丙烯酸酯、乙酰乙酰氧基丙烯酰胺、乙酰乙酰氧基甲基丙烯酰胺等。这些不饱和单体可单独使用,也可同时使用2种以上。其中,在工业上优选双丙酮丙烯酰胺,作为共聚改性pva,优选双丙酮丙烯酰胺改性pva。
[0045]
在本发明中,可在不阻碍本发明的效果的范围内,在脂肪酸乙烯酯与具有活性羰基的不饱和单体的共聚中使用可与脂肪酸乙烯酯或具有活性羰基的不饱和单体共聚的其他不饱和单体。
[0046]
作为其他不饱和单体,例如可列举出选自以下单体中的一种以上等:含羧基不饱和单体[例如,(甲基)丙烯酸、马来酸、马来酸酐、富马酸、巴豆酸、衣康酸、十一烯酸等]、不饱和二元酸单烷基酯类(例如,马来酸单甲酯、衣康酸单甲酯等)、含酰胺基不饱和单体(例如,丙烯酰胺、二甲基丙烯酰胺、二甲氨基乙基丙烯酰胺、二乙基丙烯酰胺、二甲氨基丙基丙烯酰胺、异丙基丙烯酰胺、n-羟甲基丙烯酰胺、n-乙烯基乙酰胺等)、卤代乙烯类(例如,氯乙
烯、氟乙烯等)、具有缩水甘油基的不饱和单体(例如,烯丙基缩水甘油醚、甲基丙烯酸缩水甘油酯等)、含内酰胺基的不饱和单体{例如,n-乙烯基吡咯烷酮类[例如,n-乙烯基-2-吡咯烷酮、n-乙烯基-烷基吡咯烷酮(例如,n-乙烯基-3-丙基-2-吡咯烷酮、n-乙烯基-5-甲基-2-吡咯烷酮、n-乙烯基-5-乙基-2-吡咯烷酮、n-乙烯基-5,5-二甲基-2-吡咯烷酮、n-乙烯基-3,5-二甲基-2-吡咯烷酮等n-乙烯基-单或二c
1-4
烷基吡咯烷酮)等]、n-烯丙基吡咯烷酮类(例如,n-烯丙基-2-吡咯烷酮等)、n-乙烯基哌啶酮类[例如,n-乙烯基-2-哌啶酮、n-乙烯基-烷基哌啶酮(例如,n-乙烯基-6-甲基-2-哌啶酮、n-乙烯基-6-乙基-2-哌啶酮等n-乙烯基-单或二c
1-4
烷基哌啶酮)等]、n-乙烯基己内酰胺类[例如,n-乙烯基-ε-己内酰胺、n-乙烯基-烷基己内酰胺(例如,n-乙烯基-7-甲基-2-己内酰胺、n-乙烯基-7-乙基-2-己内酰胺等n-乙烯基-单或二c
1-4
烷基己内酰胺等)]}、烷基乙烯基醚类[例如,c
1-20
烷基乙烯基醚(例如,甲基乙烯基醚、正丙基乙烯基醚、异丙基乙烯基醚、正丁基乙烯基醚、异丁基乙烯基醚、叔丁基乙烯基醚、月桂基乙烯基醚(lauryl vinyl ether)、十二烷基乙烯基醚、十八烷基乙烯基醚等)]、腈类(例如,丙烯腈、甲基丙烯腈等)、含羟基不饱和单体[例如,c
1-20
单烷基烯丙醇(例如,烯丙醇、异丙烯基烯丙醇等)、c
1-20
二烷基烯丙醇(例如,二甲基烯丙醇等)、羟基c
1-20
烷基乙烯基醚(例如,羟基乙基乙烯基醚、羟基丁基乙烯基醚等)]、含乙酰基不饱和单体[例如,c
1-20
烷基烯丙基乙酸酯(例如,烯丙基乙酸酯、梨醇酯、异丙烯基烯丙基乙酸酯等)等]、(甲基)丙烯酸酯类{例如,(甲基)丙烯酸烷基酯[例如,(甲基)丙烯酸甲酯、(甲基)丙烯酸乙酯、丙烯酸2-乙基己酯、丙烯酸正丁酯等(甲基)丙烯酸c
1-20
烷基酯]等}、乙烯基硅烷类(例如,三甲氧基乙烯基硅烷、三丁基乙烯基硅烷、二苯甲基乙烯基硅烷等)、聚氧化烯(甲基)丙烯酸酯类[例如,聚氧乙烯(甲基)丙烯酸酯、聚氧丙烯(甲基)丙烯酸酯等]、聚氧化烯(甲基)丙烯酰胺类[例如,聚氧乙烯(甲基)丙烯酰胺、聚氧丙烯(甲基)丙烯酰胺等]、聚氧化烯乙烯基醚类(例如,聚氧乙烯乙烯基醚、聚氧丙烯乙烯基醚等)、聚氧化烯烷基乙烯基醚类(例如,聚氧乙烯烯丙醚、聚氧丙烯烯丙醚、聚氧乙烯丁基乙烯基醚、聚氧丙烯丁基乙烯基醚等)、α-烯烃类(例如,乙烯、丙烯、正丁烯、1-己烯等)、丁烯类(例如,3,4-二羟基-1-丁烯、3,4-二酰氧基-1-丁烯、3-酰氧基-4-羟基-1-丁烯、4-酰氧基-3-羟基-1-丁烯、3,4-二酰氧基-2-甲基-1-丁烯等)、戊烯类(例如,4,5-二羟基-1-戊烯、4,5-二酰氧基-1-戊烯、4,5-二羟基-3-甲基-1-戊烯、4,5-二酰氧基-3-甲基-1-戊烯等)、己烯类(例如,5,6-二羟基-1-己烯、5,6-二酰氧基-1-己烯等)、胺类不饱和单体[例如,n,n-二甲基烯丙基胺、n-烯丙基哌嗪、3-哌啶基丙烯酸乙酯、2-乙烯基吡啶、4-乙烯基吡啶、2-甲基-6-乙烯基吡啶、5-乙基-2-乙烯基吡啶、5-丁烯基吡啶、4-戊烯基吡啶、2-(4-吡啶基)烯丙醇等]、具有季铵化合物的不饱和单体(例如,丙烯酰氧乙基三甲基氯化铵、(3-丙烯酰胺丙基)三甲基氯化铵、n,n-二甲基氨基丙基丙烯酰胺甲基苯磺酸季盐等)、芳香族类不饱和单体(例如,苯乙烯等)、含有磺酸基的不饱和单体(例如,2-丙烯酰胺-2-甲基丙磺酸或其碱金属盐、铵盐或有机胺盐;2-丙烯酰胺-1-甲基丙磺酸或其碱金属盐、铵盐或有机胺盐;2-甲基丙烯酰胺-2-甲基丙磺酸或其碱金属盐、铵盐或有机胺盐;乙烯基磺酸或其碱金属盐、铵盐或有机胺盐;烯丙基磺酸或其碱金属盐、铵盐或有机胺盐;甲基丙烯磺酸或其碱金属盐、铵盐或有机胺盐等)、(烯丙氧基)丙二醇、2,3-二乙酰氧基-1-烯丙氧基丙烷、2-乙酰氧基-1-烯丙氧基-3-羟基丙烷、3-乙酰氧基-1-烯丙氧基-3-羟基丙烷、3-乙酰氧基-1-烯丙氧基-2-羟基丙烷、甘油单乙烯基醚、甘油单异丙烯基醚、丙烯酰吗啉、乙烯基碳酸乙烯酯、乙烯基咪唑、乙烯基咔唑等。
[0047]
其他不饱和单体的含量没有特别限定,例如,相对于100摩尔的乙烯酯类单体为10摩尔以下即可。
[0048]
此外,在不阻碍本发明的效果的范围内,可使用公知的方法,通过缩醛化、氨基甲酸酯化、醚化、接枝化、磷酸酯化、乙酰乙酰基化、阳离子化等反应对所得到的共聚改性pva进行后改性。
[0049]
制备上述共聚改性pva时使用的聚合催化剂没有特别限定,但通常使用偶氮化合物或过氧化物。此外,进行聚合时,以防止脂肪族乙烯酯的水解为目的,可添加酒石酸、柠檬酸、乙酸等有机酸。此外,对于聚合的终止没有特别限定,但可使用聚合终止剂。聚合终止剂没有特别限定,例如可列举出间二硝基苯等。
[0050]
在本发明中,进行脂肪族乙烯酯与具有活性羰基的不饱和单体的共聚时,聚合容器的形状、聚合搅拌机的种类、以及聚合温度或聚合容器内的压力等均可使用公知的方法。
[0051]
在本发明中,脂肪族乙烯酯与具有活性羰基的不饱和单体的共聚物的皂化方法没有特别限定,可遵循以往公知的方法,例如可适用使用了以往公知的氢氧化钠、氢氧化钾、甲醇钠等碱性催化剂或盐酸、硫酸、对甲苯磺酸等酸性催化剂的醇解或水解反应。作为在皂化反应中使用的溶剂,可列举出甲醇、乙醇等醇类;乙酸甲酯等酯类;丙酮、甲基乙基酮等酮类;苯、甲苯等芳香族烃类;四氢呋喃等,这些溶剂可单独使用或组合使用两种以上。此外,皂化温度、时间等没有特别限制。此外,皂化物的干燥、粉碎、清洗方法也没有特别限制,可使用公知的方法。
[0052]
在使用具有活性羰基的不饱和单体(例如,双丙酮丙烯酰胺)改性pva作为改性pva类树脂时,相对于具有活性羰基的不饱和单体(例如,双丙酮丙烯酰胺)改性pva的全量(单体的总量),具有活性羰基的不饱和单体(例如,双丙酮丙烯酰胺)单元的含量例如为0.5~20摩尔%,优选为0.5~15摩尔%,更优选为1~12摩尔%,进一步优选为2~10摩尔%(例如,3~8摩尔%)。具有活性羰基的不饱和单体(例如,双丙酮丙烯酰胺)单元的含量为0.5摩尔%以上时,与交联剂的反应位点多,能够得到作为血管新生装置的充分的强度(应力),此外,从提高在水中的溶解性等的角度出发,优选为20摩尔%以下。
[0053]
改性pva类树脂的皂化度没有特别限制,但优选为80摩尔%以上(例如,80~99.9摩尔%),更优选为88摩尔%以上(例如,88~99.9摩尔%),进一步优选为95摩尔%以上(例如,95~99.9摩尔%)。
[0054]
此外,改性pva类树脂的粘度可设为各种值,但以改性pva类树脂的4质量%水溶液粘度(20℃)计,优选为2~500mpa
·
s,更优选为3~300mpa
·
s,进一步优选为5~200mpa
·
s(例如,5~80mpa
·
s)。另外,上述皂化度、4质量%水溶液粘度可以为按照jis k-6726测定的值。
[0055]
(间同立构规整度以三单元组表示为32~40%的聚乙烯醇类树脂(a2))作为聚乙烯醇树脂(a),还可优选使用间同立构规整度以三单元组表示为32~40%的聚乙烯醇类树脂(a2)(在本说明书中,也简称为“高间同立构pva类树脂”)。高间同立构pva类树脂的间同立构规整度以三单元组表示优选为32~40%,更优
选为33~39%,特别优选为34~38%。若间同立构规整度为32%以上,则容易变成水性凝胶,若为40%以下,则容易制备水性凝胶。另外,三单元组表示的间同立构规整度可通过将高间同立构pva类树脂溶解于氘代dmso(二甲基亚砜),并根据由质子nmr测定得到的羟基的峰求出。
[0056]
只要三单元组表示的间同立构规整度为32~40%,则高间同立构pva类树脂的制法没有特别限定,可通过将使用以往公知的方法得到的乙烯酯类聚合物皂化的方法容易地得到。即,高间同立构pva类树脂为乙烯酯聚合物的皂化物。作为乙烯酯类聚合物的制备方法,只要为将乙烯酯类单体聚合的方法,则没有特别限定,可遵循以往公知的方法。进行聚合时,聚合容器的形状、聚合搅拌机的种类以及聚合温度或聚合容器内的压力等均使用公知的方法即可。聚合方法可以为以往公知的本体聚合、溶液聚合、悬浮聚合、乳液聚合等各种聚合方法。考虑到聚合度的控制或在聚合后进行的皂化反应等,优选将醇作为溶剂的溶液聚合或者将水或水及醇作为分散介质的悬浮聚合,但并不限定于此。
[0057]
作为乙烯酯类单体,例如可列举出脂肪酸乙烯酯、非脂肪酸乙烯酯(例如,甲酸乙烯酯、芳香族羧酸乙烯酯等)等乙烯酯等,但从得到间同立构规整度高的pva等角度出发,可列举出c
3-15
脂肪酸乙烯酯[例如,丙酸乙烯酯、丁酸乙烯酯、特戊酸乙烯酯等直链或支链的c
3-15
脂肪酸乙烯酯,优选c
3-10
脂肪酸乙烯酯(例如,直链或支链的c
3-10
脂肪酸乙烯酯等)等]、具有取代基(例如,卤素基团)的c
3-15
脂肪酸乙烯酯[例如,三氟乙酸乙烯酯、三氯乙酸乙烯酯等]、甲酸乙烯酯等。这些乙烯酯可单独使用一种或组合使用两种以上。
[0058]
作为高间同立构pva类树脂的制法的一个实例,具体而言,可列举出:对具有大体积侧链的丙酸乙烯酯、丁酸乙烯酯、特戊酸乙烯酯等乙烯酯进行均聚或共聚后,利用碱催化剂而进行皂化的方法;或者对甲酸乙烯酯、三氟乙酸乙烯酯、三氯乙酸乙烯酯等高极性的乙烯酯进行均聚或共聚后,利用碱催化剂而进行皂化的方法。其中,优选使用在对特戊酸乙烯酯进行聚合后利用碱催化剂而进行皂化的方法。下述实施例中记载了以三单元组表示的间同立构规整度为37.1%的制备例。例如,可通过下述方式使以三单元组表示的间同立构规整度小于37.1%:在聚合特戊酸乙烯酯时,使乙酸乙烯酯共存来得到特戊酸乙烯酯与乙酸乙烯酯的共聚物;或者提高聚合温度。此外,例如可通过降低上述制备例的聚合温度而使以三单元组表示的间同立构规整度大于37.1%。在任意一种情况下,所得到的高间同立构pva类树脂的以三单元组表示的间同立构规整度均能够通过将高间同立构pva类树脂溶解于氘代dmso,并根据由质子nmr测定得到的羟基的峰而求出,因此可适当地选择以三单元组表示的间同立构规整度在32~40%的范围内的物质并将其用于本发明。
[0059]
此外,除了上述乙烯酯以外,在不阻碍本发明效果的范围内,乙烯酯聚合物也可含有可与乙烯酯共聚的其他不饱和单体。作为其他不饱和单体,例如可列举出选自以下单体中的一种以上等:含羧基不饱和单体[例如,(甲基)丙烯酸、马来酸、马来酸酐、富马酸、巴豆酸、衣康酸、十一烯酸等]、不饱和二元酸单烷基酯类(例如,马来酸单甲酯、衣康酸单甲酯等)、含酰胺基不饱和单体(例如,丙烯酰胺、二甲基丙烯酰胺、二甲氨基乙基丙烯酰胺、二乙基丙烯酰胺、二甲氨基丙基丙烯酰胺、异丙基丙烯酰胺、n-羟甲基丙烯酰胺、n-乙烯基乙酰胺等)、卤代乙烯类(例如,氯乙
烯、氟乙烯等)、具有缩水甘油基的不饱和单体(例如,烯丙基缩水甘油醚、甲基丙烯酸缩水甘油酯等)、含内酰胺基的不饱和单体{例如,n-乙烯基吡咯烷酮类[例如,n-乙烯基-2-吡咯烷酮、n-乙烯基-烷基吡咯烷酮(例如,n-乙烯基-3-丙基-2-吡咯烷酮、n-乙烯基-5-甲基-2-吡咯烷酮、n-乙烯基-5-乙基-2-吡咯烷酮、n-乙烯基-5,5-二甲基-2-吡咯烷酮、n-乙烯基-3,5-二甲基-2-吡咯烷酮等的n-乙烯基-单或二c
1-4
烷基吡咯烷酮)等]、n-烯丙基吡咯烷酮类(例如,n-烯丙基-2-吡咯烷酮等)、n-乙烯基哌啶酮类[例如,n-乙烯基-2-哌啶酮、n-乙烯基-烷基哌啶酮(例如,n-乙烯基-6-甲基-2-哌啶酮、n-乙烯基-6-乙基-2-哌啶酮等的n-乙烯基-单或二c
1-4
烷基哌啶酮)等]、n-乙烯基己内酰胺类[例如,n-乙烯基-ε-己内酰胺、n-乙烯基-烷基己内酰胺(例如,n-乙烯基-7-甲基-2-己内酰胺、n-乙烯基-7-乙基-2-己内酰胺等的n-乙烯基-单或二c
1-4
烷基己内酰胺等)]}、烷基乙烯基醚类[例如,c
1-20
烷基乙烯基醚(例如,甲基乙烯基醚、正丙基乙烯基醚、异丙基乙烯基醚、正丁基乙烯基醚、异丁基乙烯基醚、叔丁基乙烯基醚、月桂基乙烯基醚、十二烷基乙烯基醚、十八烷基乙烯基醚等)]、腈类(例如,丙烯腈、甲基丙烯腈等)、含羟基不饱和单体[例如,c
1-20
单烷基烯丙醇(例如,烯丙醇、异丙烯基烯丙醇等)、c
1-20
二烷基烯丙醇(例如,二甲基烯丙醇等)、羟基c
1-20
烷基乙烯基醚(例如,羟基乙基乙烯基醚、羟基丁基乙烯基醚等)]、含乙酰基不饱和单体[例如,c
1-20
烷基烯丙基乙酸酯(例如,烯丙基乙酸酯、梨醇酯、异丙烯基烯丙基乙酸酯等)等]、(甲基)丙烯酸酯类{例如,(甲基)丙烯酸烷基酯[例如,(甲基)丙烯酸甲酯、(甲基)丙烯酸乙酯、丙烯酸2-乙基己酯、丙烯酸正丁酯等的(甲基)丙烯酸c
1-20
烷基酯]等}、乙烯基硅烷类(例如,三甲氧基乙烯基硅烷、三丁基乙烯基硅烷、二苯甲基乙烯基硅烷等)、聚氧化烯(甲基)丙烯酸酯类[例如,聚氧乙烯(甲基)丙烯酸酯、聚氧丙烯(甲基)丙烯酸酯等]、聚氧化烯(甲基)丙烯酰胺类[例如,聚氧乙烯(甲基)丙烯酰胺、聚氧丙烯(甲基)丙烯酰胺等]、聚氧化烯乙烯基醚类(例如,聚氧乙烯乙烯基醚、聚氧丙烯乙烯基醚等)、聚氧化烯烷基乙烯基醚类(例如,聚氧乙烯烯丙醚、聚氧丙烯烯丙醚、聚氧乙烯丁基乙烯基醚、聚氧丙烯丁基乙烯基醚等)、α-烯烃类(例如,乙烯、丙烯、正丁烯、1-己烯等)、丁烯类(例如,3,4-二羟基-1-丁烯、3,4-二酰氧基-1-丁烯、3-酰氧基-4-羟基-1-丁烯、4-酰氧基-3-羟基-1-丁烯、3,4-二酰氧基-2-甲基-1-丁烯等)、戊烯类(例如,4,5-二羟基-1-戊烯、4,5-二酰氧基-1-戊烯、4,5-二羟基-3-甲基-1-戊烯、4,5-二酰氧基-3-甲基-1-戊烯等)、己烯类(例如,5,6-二羟基-1-己烯、5,6-二酰氧基-1-己烯等)、胺类不饱和单体[例如,n,n-二甲基烯丙基胺、n-烯丙基哌嗪、3-哌啶基丙烯酸乙酯、2-乙烯基吡啶、4-乙烯基吡啶、2-甲基-6-乙烯基吡啶、5-乙基-2-乙烯基吡啶、5-丁烯基吡啶、4-戊烯基吡啶、2-(4-吡啶基)烯丙醇等]、具有季铵化合物的不饱和单体(例如,丙烯酰氧乙基三甲基氯化铵、(3-丙烯酰胺丙基)三甲基氯化铵、n,n-二甲基氨基丙基丙烯酰胺甲基苯磺酸季盐等)、芳香族类不饱和单体(例如,苯乙烯等)、含有磺酸基的不饱和单体(例如,2-丙烯酰胺-2-甲基丙磺酸或其碱金属盐、铵盐或有机胺盐;2-丙烯酰胺-1-甲基丙磺酸或其碱金属盐、铵盐或有机胺盐;2-甲基丙烯酰胺-2-甲基丙磺酸或其碱金属盐、铵盐或有机胺盐;乙烯基磺酸或其碱金属盐、铵盐或有机胺盐;烯丙基磺酸或其碱金属盐、铵盐或有机胺盐;甲基丙烯磺酸或其碱金属盐、铵盐或有机胺盐等)、(烯丙氧基)丙二醇、2,3-二乙酰氧基-1-烯丙氧基丙烷、2-乙酰氧基-1-烯丙氧基-3-羟基丙烷、3-乙酰氧基-1-烯丙氧基-3-羟基丙烷、3-乙酰氧基-1-烯丙氧基-2-羟基丙烷、甘油单乙烯基醚、甘油单异丙烯基醚、丙烯酰吗啉、乙烯基碳酸乙烯酯、乙烯基咪唑、乙烯基咔唑等。
其他不饱和单体的含量没有特别限定,例如,相对于100摩尔的乙烯酯类单体为10摩尔以下即可。
[0060]
此外,进行聚合时可使用聚合催化剂。作为聚合催化剂,没有特别限定,通常可使用偶氮类化合物或过氧化物。此外,进行聚合时,以防止脂肪酸乙烯酯的水解为目的,可添加酒石酸、柠檬酸、乙酸等有机酸。
[0061]
此外,对于聚合的终止没有特别限定,但可使用聚合终止剂。聚合终止剂没有特别限定,例如可列举出间二硝基苯等。
[0062]
聚合温度没有特别限定,使用公知的聚合温度即可,但从容易得到间同立构规整度高的pva类树脂等角度出发,例如为-50~200℃,优选为-50~150℃,进一步优选为0~120℃等。
[0063]
可通过所述方式得到乙烯酯聚合物。所得到的聚合物的皂化反应方法没有特别限定,可遵循以往公知的方法,例如可适用使用了以往公知的氢氧化钠、氢氧化钾、甲醇钠等碱性催化剂或盐酸、硫酸、对甲苯磺酸等酸性催化剂的醇解或水解反应。另外,在皂化反应的前后,通常聚合物的间同立构规整度几乎不变。作为在皂化反应中使用的溶剂,可列举出甲醇、乙醇等醇类;乙酸甲酯、乙酸乙酯等酯类;丙酮、甲基乙基酮等酮类;苯、甲苯等芳香族烃类;四氢呋喃等,这些溶剂可单独使用或组合使用两种以上。此外,皂化温度、时间等没有特别限制。此外,皂化物的干燥、粉碎、清洗方法也没有特别限制,可使用公知的方法。
[0064]
由此得到乙烯酯聚合物的皂化物,即得到本发明的高间同立构pva类树脂。此外,在不阻碍本发明的效果的范围内,可使用公知的方法,通过缩醛化、氨基甲酸酯化、醚化、接枝化、磷酸酯化、乙酰乙酰基化、阳离子化等反应对所得到的高间同立构pva类树脂进行后改性。
[0065]
高间同立构pva类树脂的皂化度优选为90~99.9摩尔%,更优选为98~99.9摩尔%,进一步优选为99~99.9摩尔%。另外,高间同立构pva类树脂的皂化度例如可通过在氘代dmso溶液中测定质子nmr而求出。
[0066]
高间同立构pva类树脂的聚合度优选为100~10000,更优选为500~8000,进一步优选为1000~5000,从较容易操作这一点出发,特别优选为1000~3000。若聚合度为100以上,则树脂强度(应力)高,容易制备具有形状保持性(shape-retainability)的水性凝胶。若聚合度为10000以下,则水溶液容易处理。另外,聚合度为皂化前的树脂在jis k6725中记载的苯溶液中且在30℃下的聚乙酸乙烯酯换算的聚合度。
[0067]
(皂化度为97摩尔%以上的聚乙烯醇类树脂(a3))如上所述,聚乙烯醇类树脂(a)中还可使用皂化度为97摩尔%以上的聚乙烯醇类树脂(a3)(在本说明书中,也简称为“完全皂化pva类树脂”)。
[0068]
完全皂化pva类树脂的皂化度优选为97摩尔%以上(例如,97~99.9摩尔%),更优选为98摩尔%以上(例如,98~99.9摩尔%),特别优选为98.5摩尔%以上(例如,98.5~99.9摩尔%)。
[0069]
完全皂化pva类树脂的聚合度例如为100~10000,更优选为500~9000,进一步优选为1000~8000,特别优选为1500~5000。
[0070]
[交联剂]血管新生装置可进一步含有交联剂。交联剂没有特别限定,可根据聚合物的种类等选择。例如,使用上述改性pva树脂(a1)作为聚合物时,优选具有与改性pva类树脂(a1)的羰基具有反应性的官能团(例如,肼基等)的交联剂等。
[0071]
作为交联剂,例如可列举出酰肼化合物等、氨基脲化合物等。其中,可优选列举出在分子内具有2个以上选自下述式(1)~(3)所示的组中的官能团的酰肼化合物、氨基脲化合物等。它们可单独使用一种或同时使用两种以上。-nh-nh2ꢀꢀ
(1)-co-nh-nh2ꢀꢀ
(2)-nh-co-nh-nh2ꢀꢀ
(3)
[0072]
作为酰肼化合物的具体实例,例如可列举出碳酰肼、二羧酸酰肼[脂肪族二羧酸酰肼(例如,草酸二酰肼、丙二酸二酰肼、琥珀酸二酰肼、戊二酸二酰肼、己二酸二酰肼、庚二酸二酰肼、辛二酸二酰肼、壬二酸二酰肼、癸二酸二酰肼、十二烷二酸二酰肼、十六烷二酸二酰肼等)、芳香族二羧酸酰肼(例如,对苯二甲酸二酰肼、间苯二甲酸二酰肼、2,6-萘甲酸二酰肼、4,4
’‑
双苯二酰肼等)、脂环族二羧酸酰肼(例如,1,4-环己烷二羧酸二酰肼等)、含羟基二羧酸二酰肼(例如,酒石酸二酰肼、苹果酸二酰肼等)、亚氨基二乙酸二酰肼、衣康酸二酰肼等]、1,3-双(肼基羰基乙基)-5-异丙基乙内酰脲、7,11-十八烷二烯-1,18-二羰酰肼、三(2-肼基羰基乙基)异氰脲酸酯、柠檬酸三酰肼、丁烷三羰酰肼、1,2,3-苯三酰肼、乙二胺四乙酸四酰肼、1,4,5,8-萘甲酸四酰肼、次氮基乙酸三酰肼、环己烷三羧酸三酰肼、均苯四甲酸四酰肼等。此外,作为氨基脲化合物,例如可列举出n,n
’‑
六亚甲基双氨基脲、缩二脲基三(六亚甲基氨基脲)(biuretry tri(hexamethylene semicarbazide))等。此外,可使用这些酰肼化合物、氨基脲化合物与丙酮、甲基乙基酮等低沸点酮类反应而成的衍生物等。
[0073]
在上述交联剂中,从毒性低、在水中的溶解性高等角度出发,可优选使用二羧酸酰肼、聚丙烯酰肼等,更优选使用己二酸二酰肼、聚丙烯酰肼等,特别优选使用聚丙烯酰肼。
[0074]
交联剂可使用上述交联剂中的一种或组合使用上述交联剂中的两种以上。相对于100质量份的聚合物(例如,改性pva类树脂),交联剂的添加量优选为1~30质量份,更优选为2~25质量份,进一步优选为3~20质量份(例如,4~15质量份)。若为1质量份以上,则交联密度变高,能够得到作为血管新生装置的充分的强度(应力),另一方面,从能够抑制无助于反应的交联剂的残留等角度出发,优选为30质量份以下。
[0075]
在使用聚丙烯酰肼作为交联剂时,分子量范围没有特别限定,但聚丙烯酰肼的重均分子量(mw)优选为约3000~6000000,优选为约5000~1000000,进一步优选为约8000~800000(例如,约10000~300000、约1000~200000、约10000~100000)。
[0076]
在使用聚丙烯酰肼作为交联剂时,聚丙烯酰肼的酰肼化率没有特别限定,但优选为30%以上,更优选为50%以上,进一步优选为70%以上,特别优选为80%以上。
[0077]
聚丙烯酰肼的分子量、酰肼化率在不阻碍本发明的效果的范围内进行适当调节即
可,例如在分子量小的情况下提高酰肼化率,在分子量大的情况下降低酰肼化率等。
[0078]
[细胞培养成分]血管新生装置可含有细胞培养成分。作为细胞培养成分,没有特别限定,例如可列举出碱金属、碱土金属、卤素及葡萄糖等,其中,优选使用含有na、k、cl、ca、葡萄糖等的乙酸或磷酸缓冲液等。
[0079]
细胞培养成分含有na时,优选将na浓度调节为20~150meq/l,更优选调节为80~140meq/l。含有k时,优选将k浓度调节为2.5~130meq/l,更优选调节为3.5~40meq/l。含有cl时,优选将cl浓度调节15~170meq/l,更优选调节为100~150meq/l。含有ca时,优选将ca浓度调节为0.5~5meq/l,更优选调节为1~3meq/l。含有葡萄糖时,优选将葡萄糖浓度调节为1~11mm,更优选调节为3~7mm。
[0080]
作为细胞培养成分,没有特别限定,例如可列举出公知的细胞培养基(例如,hbss(hank’s平衡盐溶液)等)、市售的保存液(例如,euro-collins溶液、cellbanker、uw液(university of wisconsin solution)等)、细胞保护成分(例如,二甲基亚砜(dmso)、血清白蛋白等)、阻止杂菌混入的成分(例如,抗生素等)、维持细胞活性的成分(例如,烟酰胺等维生素类等)等,优选公知的细胞培养基等。
[0081]
这些细胞培养成分可单独使用一种或同时使用两种以上。
[0082]
此外,细胞培养成分可与其他成分(例如,缓释性赋予剂、等渗剂、ph调节剂等)组合使用。
[0083]
血管新生装置可以进一步含有除此以外的成分。例如,血管新生装置也可包含作为促进或调控活细胞增殖的物质的细胞生长因子、作为由细胞产生的活性物质的细胞因子、其他生理活性物质、促进血管新生装置中的血流的血流促进物质、神经营养因子等。
[0084]
这些成分可单独使用一种或同时使用两种以上。
[0085]
作为细胞生长因子,例如可列举出表皮细胞生长因子(egf)、肝细胞生长因子(hgf)、胰岛素等。作为细胞因子,例如可列举出造血因子(例如,白细胞介素类、趋化因子类、集落刺激因子等)、肿瘤坏死因子、干扰素类等。
[0086]
作为其他生理活性物质,例如可列举出氨基酸(例如,甘氨酸、苯丙氨酸、赖氨酸、天冬氨酸、谷氨酸等)、维生素类(例如,生物素、泛酸、维生素d等)、血清白蛋白、抗生素等。
[0087]
作为血流促进物质,例如可列举出瓜氨酸或其盐、辣椒碱(capsaicin)、辣椒素(capsaicinoid)类。
[0088]
作为神经营养因子,例如可列举出ngf(nerve growth factor;神经生长因子)、bdnf(brain-derived neurotrophic factor;脑源性神经营养因子)、nt-3(neurotrophin-3;神经营养因子-3)、nt-4(neurotrophin-4;神经营养因子-4)、gdnf(glial-cell derived neurotrophic factor;胶质细胞源性神经营养因子)、神经秩蛋白(neurturin)、自分泌神经营养因子(artemin)、外周营养因子(persephin)等。
[0089]
另外,这些成分的添加量没有特别限定。
[0090]
[凝胶]在血管新生装置中,聚合物[在聚合物中包含除聚合物以外的成分(例如,血管新
生成分、细胞培养成分等)时为包含该成分的聚合物]尤其可形成凝胶[尤其是水性凝胶(水凝胶)]。这种凝胶可以为根据聚合物的种类,例如通过后述的交联剂等而进行了交联(凝胶交联)的凝胶,可由凝胶形成性的聚合物(例如,上述聚乙烯醇类树脂(a2))形成凝胶。
[0091]
在凝胶中,聚合物浓度例如可以为0.3~20%,优选为0.5~10%,更优选为1~8%(例如,3~8%)。从将血管新生装置移植至动物后,能够在体内长期保持装置形状等角度出发,优选为这种范围。
[0092]
此外,在凝胶(或血管新生装置)中使用交联剂时,交联剂的含量可根据交联剂的种类或所期望的强度等适当选择,例如,相对于100质量份的聚合物,可以为0.5质量份以上,优选为1质量份以上,进一步优选为3质量以上等,可以为20质量份以下,优选为18质量份以下,进一步优选为15质量份以下等。
[0093]
使凝胶中含有血管新生成分时,凝胶(或血管新生装置)中包含的活细胞数相对于包封于凝胶前的血管新生成分(例如,msc)的活细胞整体的比例例如可以为60~100%,优选为70~100%,更优选为80~100%。活细胞数例如可通过利用荧光素二乙酸盐试剂的细胞质染色及利用碘化丙啶的细胞核染色来进行测定(有时也缩写为fda/pi测定)。
[0094]
凝胶通常具有规定的强度(应力)。这种强度可以为在移植或移除时不容易崩解的程度的应力。凝胶的强度因聚合物的种类(例如,聚乙烯醇类树脂的种类、4%水溶液粘度、皂化度、改性度、间同立构规整度等)、交联剂的种类、添加量、及凝胶的固体成分浓度而不同,因此不能一概而论,例如,应力(20℃)可以为0.1kpa以上(例如,0.3kpa以上)左右,可以为0.4kpa以上[例如,0.5kpa以上(例如,0.5~100kpa)],优选为0.55kpa以上[例如,0.6kpa以上(例如,0.6~95kpa)],更优选为0.65kpa以上(例如,0.7~90kpa),进一步优选为0.7kpa以上(例如,0.7~85kpa)。应力(20℃)的上限值没有特别限定,但从移植、留置或移除时不易损伤血管床或周围组织等角度出发,优选不过大,例如,可以为100kpa、95kpa、90kpa、85kpa、80kpa、75kpa、70kpa、65kpa、60kpa、55kpa、50kpa、45kpa、40kpa、35kpa、30kpa、25kpa、20kpa、15kpa、12kpa、10kpa、9kpa、8kpa等。另外,只要供于移植的凝胶充分满足如上所述的应力(20℃)即可,也可以移植后或留置后(移植或留置规定期间后、移除时)的凝胶充分满足如上所述的应力(20℃)(凝胶中可得以保持)。
[0095]
凝胶的应力例如可使用shimadzu corporation制造的小型台式试验机eztest ez-sx并按照其使用说明书进行测定(具体而言,可利用后述的实施例的方法等测定)。
[0096]
凝胶(尤其是水性凝胶)的形状没有特别限制,例如可列举出片状、板状、盘状、棒状、管状、珠状等。
[0097]
凝胶(尤其是水性凝胶)的尺寸可根据移植(血管新生)部位或其尺寸等适当选择,没有特别限定,例如,厚度优选为0.1~10mm,更优选为0.2~5mm,进一步优选为0.5~2mm,特别优选为0.7~1.5mm。
[0098]
[存在形态等]血管新生装置含有血管新生成分及聚合物(以及其他成分)。作为这些成分的存在形态,没有特别限定,通常血管新生成分多存在于聚合物的内部(从血管新生装置外看为内
侧)。
[0099]
作为这种形态,例如可列举出血管新生成分存在(例如,溶解或分散)于聚合物中的形态、聚合物存在于血管新生成分的外侧的形态等,特别优选血管新生成分存在于聚合物中(进而存在于由聚合物形成的凝胶中)。
[0100]
血管新生成分的溶解或分散状态例如可通过使用了显微镜的目视观察、利用了来自荧光素酶转基因大鼠的血管新生成分(msc等)的发光成像系统等来确认。发光成像系统是指,可用超高灵敏度制冷相机捕捉生物体内看不到的非常微弱的发光或荧光并进行半定量的试验体系,可以将导入了具有较多600nm以上的波长的光的来自萤火虫的荧光素酶基因的血管新生成分(例如,来自动物的msc等)移植至健康动物,并向其体内给予作为荧光素酶的基质的萤光素,由此产生发光反应,并在体内(in vivo)经时观察同一个体中的活体反应。
[0101]
若为这种存在形态,则易于使血管新生成分比较均匀地存在(或易于抑制血管新生成分的凝集),因此,可能是因为能够效率良好地对各细胞供给氧或营养素,故而容易效率良好地进行血管新生(容易充分发挥功能而不使血管新生成分的活性降低)。
[0102]
此外,血管新生装置可以具有支架(支架功能),尤其可以在支架中含有血管新生成分。这种支架具有将所含有的血管新生成分(msc等)固定于移植部位的作用、与作为血管新生成分(msc等)在该移植部位发挥功能的支撑架的作用。
[0103]
通过将血管新生成分(msc等)充分固定,能够防止或抑制血管新生成分(msc等)的扩散,容易在目标部位效率良好地进行血管新生。
[0104]
此外,通过使支架功能(作为支撑架的作用)充足,可效率良好地发挥血管新生成分所带来的血管新生促进功能(例如,血管新生成分为msc等时,可效率良好地进行血管新生所需要的生长因子等的分泌)。
[0105]
另外,对于固定功能,例如,可利用上述发光成像系统等来确认。
[0106]
对于作为支架(支撑架)的功能,例如,可通过实施与移植了血管新生装置的部位的vwf(von willebrand factor(血管性血友病因子))相关的免疫染色来确认。具体而言,摘除血管新生装置周围的皮下组织,用4%多聚甲醛固定一晚后,用石蜡包埋并制作薄切切片。可使抗vwf抗体(ab7356;merckmillipore m)作为一次抗体反应30分钟,使envision system-hrp(dako)作为二次抗体反应30分钟,并用二氨基联苯胺(dab)(dako)使其显色后,实施阳性细胞数的计数,由此进行评价。
[0107]
支架优选不易与周围组织粘连,即优选具有防粘连性能。另外,防粘连性能例如是指,将装置留置于移植部位时防止或抑制装置与周围组织的粘连的功能。
[0108]
若支架具有防粘连性能,则血管新生后的血管新生装置的摘出变得容易,同时容易防止因周围组织或新生血管的伤痕(损伤、破损)导致的出血、炎症或浸出液。
[0109]
支架通常可以由聚合物、尤其可以由上述聚合物构成。具体而言,作为支架的材质,没有特别限定,例如可列举出结构蛋白质类(例如,胶原蛋白、弹性蛋白、角蛋白等)、明胶、糖胺聚糖类(例如,透明质酸、硫酸软骨素、硫酸角质素、硫酸皮肤素、硫酸类肝素、肝素等)、蛋白聚糖、细胞粘合分子类(例如,纤连蛋白、层粘连蛋白、纤维蛋白原、玻连蛋白等)、纤维蛋白、丝心蛋白、丝胶蛋白、海藻酸、壳聚糖、琼脂糖、纤维素、纤维素衍生物类(例如,纤维素纳米纤维、羧甲基纤维素、羟丙基纤维素等)、合成多肽、聚乳酸、聚乙醇酸、聚己内酯、
聚乙二醇、聚丙二醇、2-甲基丙烯酰氧基乙基磷酰胆碱、聚(甲基)丙烯酸、聚丙烯酰胺、聚-n-异丙基丙烯酰胺、聚乙烯醇类树脂等。
[0110]
这些材质(聚合物)可单独构成支架,或者也可组合这些材质(聚合物)中的2种以上而构成支架。
[0111]
其中,支架尤其可以由聚乙烯醇类树脂(其中,上述聚乙烯醇类树脂(a1)~(a3)中的至少一种、尤其是(a1)及(a2)中的至少一种)构成(尤其是利用由聚乙烯醇类树脂形成的凝胶构成)。
[0112]
这种聚乙烯醇类树脂容易效率良好地发挥如上所述的优异的支架功能或防粘连性能,可优选使用。
[0113]
可以在支架的周围(外侧、外层)进一步设置防粘连层(具有防粘连性能的层)。防粘连层可以由聚合物、尤其可以由上述聚合物构成。具体而言,作为防粘连层的材质,没有特别限定,例如可列举出糊精、透明质酸、海藻酸、纤维素、纤维素衍生物类(例如,纤维素纳米纤维、羧甲基纤维素、羟丙基纤维素等)、有机硅、聚氨酯、氟树脂类(例如,聚四氟乙烯、全氟烷氧基烷烃等)、聚乙烯醇类树脂等。
[0114]
这些材质可单独构成防粘连层,或者也可组合这些材质中的2种以上而构成防粘连层。
[0115]
其中,防粘连层尤其可以由聚乙烯醇类树脂(其中,上述聚乙烯醇类树脂(a1)~(a3)中的至少一种、尤其是(a1)及(a2)中的至少一种)构成(尤其是利用由聚乙烯醇类树脂形成的凝胶构成)。
[0116]
这种聚乙烯醇类树脂容易效率良好地发挥如上所述的防粘连性能,可优选使用。
[0117]
防粘连层可以与支架一体化,也可以由与构成支架的聚合物相同或不同的聚合物、尤其是由同系统(优选相同)的聚合物(或由聚合物形成的凝胶)构成。
[0118]
如上所述,作为代表例,血管新生成分存在于聚合物的内部(从血管新生装置外观察为聚合物的内部或内侧)。
[0119]
若以与支架(功能)或防粘连层(防粘连功能)的关系例示这种存在形态,则例如可列举出在由聚合物构成的支架[或具有支架功能(以及防粘连功能)的聚合物(尤其是形成了凝胶的聚合物)]和/或防粘连层[或由聚合物(尤其是形成了凝胶的聚合物)构成,并具有防粘连功能的层]中包含血管新生成分的情况等。
[0120]
代表性的血管新生装置中,至少在由聚合物(尤其是形成了凝胶的聚合物)构成的支架中包含血管新生成分的情况较多。当这种血管新生装置进一步具有防粘连层时,防粘连层可以包含血管新生成分,也可以不包含血管新生成分。
[0121]
血管新生装置可以含有支撑基材。特别是为了简化凝胶(例如,构成支架的凝胶)的补强和/或操作性,可与作为补强材料而有用的支撑基材进行组合。
[0122]
例如,在将凝胶(尤其是水性凝胶)制成薄膜片状时,为了简化其补强及操作性,可固定在树脂制筛网片等基材(补强材料)上来进行凝胶化
[0123]
支撑基材的原料不受限定,例如可列举出高分子[例如,pet(聚对苯二甲酸乙二醇酯)、pe(聚乙烯)、pp(聚丙烯)、teflon(注册商标)等]、金属等,优选该原料不在生物体内分解、变质,但也可以在经过一定期间后在生物体内分解。
[0124]
为了使应透过的氧、无机有机营养成分、各种激素中被设想为最大的、直径为5nm左右的分子(例如,包含胰岛素等激素的生理活性物质)透过,而不使应阻止透过的免疫相关细胞或免疫相关物质中被设想为最小的、直径为50nm左右的分子(例如抗体、补体等)透过,筛网片的筛网(网眼)尺寸通常为5~100nm,优选为10~50nm,更优选为20~30nm。
[0125]
在血管新生装置中,血管新生成分的含量没有特别限定,例如优选为1
×
100~1
×
105个(例如,细胞数)/mm2,更优选为5
×
100~5
×
104个(例如,细胞数)/mm2,特别优选为1
×
101~1
×
104个(例如,细胞数)/mm2。通过设为这种含量,易于进一步效率良好地兼顾充分的血管新生功能与对出血、炎症或浸出(渗出)液的抑制或防止。
[0126]
优选血管新生装置(或构成血管新生装置的凝胶)在留置于体内期间仅略有收缩。体积的收缩率(体积变化率)没有特别限定,以留置1个月(留置前后)计优选收缩10%以上[例如,20%以上(例如,20~90%)],更优选收缩25%以上[例如,30%以上(例如,30~80%)],特别优选收缩35%以上[例如,40%以上(例如,40~70%)]。另外,留置可以在规定温度(例如,37℃)下进行。此外,就体积变化率而言,留置(留置于体内)可以视作在水中的留置(浸渍前后)。即,就体积变化率而言,留置1个月可以为在水中留置(浸渍)1个月。体积变化率可利用下述式求出。体积变化率(%)=留置[在水中留置(浸渍)1个月时间]后的体积
÷
留置[在水中留置(浸渍)]前的体积
×
100
[0127]
若为上述收缩率,则血管新生装置与周围组织容易分离,因此容易移除。此外,不易损伤血管新生成分(msc等),同时在移除后另行移植时,容易形成待移植的细胞包埋装置用的移植袋。特别是通过与所述应力组合来调整收缩率(体积变化率),可效率(平衡)良好地兼顾留置与移除的容易度。
[0128]
另外,这种收缩率可根据装置的构成材料或物性(聚合物的种类或凝胶的强度等)、留置时间等的选择而调整。
[0129]
[制造方法]血管新生装置可通过使血管新生成分及聚合物(以及其他成分)共存(存在)来制造。
[0130]
具体而言,可根据各成分的种类
·
形态
·
存在形态等,利用惯用的方法制造。
[0131]
例如,优选使包含聚合物(以及其他成分)的混合液凝胶化。
[0132]
以此方式由聚合物形成凝胶时,作为凝胶的成型(形成)方法,例如可列举出在进行凝胶化前将包含聚合物[例如,聚乙烯醇类树脂、以及根据需要而含有的血管新生成分(msc等)、交联剂、细胞培养成分等]的混合液[尤其是水溶液(可以为溶胶状态)]注入至目标形状的模具中的方法、使用刀等将得到的凝胶加工成目标形状的方法等。
[0133]
另外,通常包含聚合物[例如,聚乙烯醇类树脂、以及根据需要而含有的血管新生成分(msc等)、交联剂、细胞培养成分等]的混合液(尤其是水溶液)在达到凝胶状态之前会经过溶胶状态。可认为这样的溶胶状态作为本发明的凝胶等价物也在本发明的范围内。
[0134]
混合液[尤其是水溶液(可以为溶胶状态)]的固体成分浓度例如为0.3~20质
量%,优选为0.5~10质量%,更优选为1~8质量%。从移植血管新生装置后,能够在体内长期维持装置形状、保持防粘连性能等角度出发,优选为所述范围。
[0135]
另外,混合液的制备中,可以同时混合各成分,也可以预先制备含有聚合物(以及根据需要而含有的交联剂、细胞培养成分)的混合液(例如,聚乙烯醇类树脂的水溶液),并混合血管新生成分而进行制备。
[0136]
此外,其他成分可以与血管新生成分(msc等)和/或细胞培养成分一起混合或另行混合。
[0137]
尤其在制备包含聚乙烯醇类树脂的水溶液时,制备方法没有特别限定,例如,可以将该树脂分散于室温的水中,一边搅拌一边升温至80℃以上,利用完全溶解后进行冷却的以往公知的pva的溶解方法进行制备。
[0138]
交联剂可以制成水溶液来使用。此时,作为交联剂的水溶液的制备方法,没有特别限定,例如能够通过下述方法进行制备:将该交联剂分散于室温的水中,在室温下搅拌溶解来进行制备的方法;在加热下(例如,在60℃下加热10分钟等)搅拌溶解,然后在室温下放置的方法。
[0139]
此外,期望利用压热处理、uv、γ射线或过滤器处理等以往公知的方法对聚乙烯醇类树脂的水溶液或交联剂的水溶液进行灭菌处理,在与血管新生成分混合时或在之后的血管新生装置的制造中,期望在不混入杂菌的环境下进行操作、保管。
[0140]
在血管新生装置的制作中,可放置聚乙烯醇类树脂的水溶液或交联剂(根据需要混合有msc和/或细胞培养成分的状态)的混合物(或其水溶液)。放置温度可以为适合保存血管新生成分(msc等)的温度。
[0141]
制备凝胶时的放置时间(用于凝胶化的时间、凝胶化时间)可根据聚合物(聚乙烯醇类树脂等)的浓度、交联剂的量、放置温度等进行适当选择,常温下通常为1小时~1周左右。从将血管新生装置留置在体内时不易崩解等角度出发,优选为1小时以上。
[0142]
在血管新生装置的制作中使用改性pva类树脂时,若在改性pva类树脂及交联剂(以及根据需要混合有msc和/或细胞培养成分)的混合液中添加ph缓冲液等而降低体系中的ph,则存在凝胶化时间缩短的倾向,若提高ph,则存在凝胶化时间变长的倾向,由此可通过改变ph来控制凝胶化时间。
[0143]
以下,示出使用了支撑基材的血管新生装置的制造例。将含有细胞培养成分的聚合物混合液或其凝胶(例如,含聚乙烯醇类树脂的水溶液或水性凝胶)放置在基材或基板(载玻片等)上,在其上覆盖pet筛网(例如,sanplatec co.,ltd.制造,商品名称:pet筛网片(名称tn120)等)等支撑基材,在该支撑基材上放置使血管新生成分(msc等)溶解或分散(混悬)于聚合物混合液或其凝胶(例如,含聚乙烯醇类树脂的水溶液或水性凝胶)中而得到的混合液(溶解或分散液(悬液)),使用凝胶加样吸嘴(gel loading tip)等,在支撑基材上扩散该混合液,进一步以夹持该混合液的方式在其上覆盖支撑基材(pet筛网等),进一步在支撑基材(pet筛网等)上放置含有细胞培养成分的聚合物混合液或其凝胶(例如,含聚乙烯醇类树脂的水溶液或水性凝胶),在上面覆盖基材或基板(载玻片等)而进行构建,从构建而成的结构中分离(去除)基材或基板(载玻片等),由此得到一个形态的血管新生装置。
[0144]
[用途等]
本发明的装置可用于血管新生(促进血管新生)。
[0145]
具体而言,本发明的装置能够通过移植(留置)到包括人在内的动物的体内而在该移植(留置)部位使血管新生。
[0146]
移植部位没有特别限定,例如,可列举出皮下、筋膜下、内脏表面(肝表面、脾表面等)、腹膜(大网膜等)内、腹腔内等。移植部位特别优选为皮下。
[0147]
皮下的血管大多较少,根据本发明的装置,即使在这种血管少的部位也可效率良好地使血管新生。
[0148]
血管新生装置的移植(留置)方法没有特别限定,可遵循惯用或以往公知的方法。例如,移植用机器也可以为公知的机器。
[0149]
另外,血管新生装置[以及后述的细胞包埋装置](或移植)的对象(移植对象)可以为人及非人类动物(例如,狗、猫等哺乳类)中的任意一种。另外,非人类动物可以为玩赏动物。优选的对象为人。
[0150]
血管新生装置的留置期间因移植部位等而不同,但例如优选在移植部位留置1周以上,更优选留置10天~2个月,特别优选留置10天~1个月。
[0151]
若为这种留置期间,则容易获得充分的血管新生效果。此外,容易效率良好地兼顾这种充分的血管新生效果与防止或抑制出血、炎症或浸出液的效果。
[0152]
移植后的血管新生装置通常在经过规定的留置期间后移除(从移植部位移除)。本发明中也包括这种移除方法。
[0153]
通常,这种移除多以不造成出血、炎症、血管(新生的血管)的破损等的方式进行。这种出血、炎症或血管的破损导致在移除部位积存血液或浸出液。
[0154]
本发明中,通过如上所述的血管新生装置(例如,使用上文中例示的聚乙烯醇类树脂(a1)~(a3)中的至少一种)的选择(以及留置期间的选择等)等,可能由于同不易产生与移植部位的粘连相互作用,多数情况下能够效率良好地移除而不造成出血、炎症、血管的破损。
[0155]
在移除后的移植部位形成移植袋。如后文所述,可以继续向这种移植袋中移植细胞包埋装置。
[0156]
本发明中还包含移植(留置)细胞包埋装置的方法。这种细胞包埋装置的移植可以与血管新生装置的移植(留置)同时进行(重叠),也可以不同时进行(不重复)。同时进行时,可将血管新生装置移植到细胞包埋装置的附近(周围),或者以使血管新生装置与细胞包埋装置邻接的方式移植。
[0157]
特别是,细胞包埋装置可以在移除血管新生装置后,移植(留置)于移除了血管新生装置的部位(移植部位、移植袋)。
[0158]
换言之,本发明的血管新生装置是用于与细胞包埋装置组合使用的装置,尤其可用作用于使细胞包埋装置的移植部位进行血管新生(在移植前使血管新生)的装置。
[0159]
如上所述,根据本发明的血管新生装置,能够在移植部位使血管新生,因此容易效率良好地发挥细胞包埋装置的功能。这种方法中,由于不需要在血管新生前移植活细胞或生物组织等,因此容易效率良好地抑制或防止中央坏死、容易表现出细胞包埋装置的功能。此外,即使必须更换细胞包
埋装置也可简单地进行。
[0160]
特别是如上所述,本发明的一个方案的血管新生装置多数情况下不易发生粘连,能够移除而不造成出血、炎症或血管的破损,通过移植至这种移除部位,容易进一步效率良好地使含细胞装置(细胞包埋装置)发挥功能。
[0161]
也可以认为通过利用这种移除部位,能够效率良好地将细胞包埋装置移植至未发生出血、炎症或血管的破损的移植部位。
[0162]
根据本技术的发明人的研究,若造成出血、炎症或血管的破损,则容易在所移植的细胞包埋装置的周围与新生的血管床之间积存血液或浸出液。根据本发明,可能由于能够进行移植(留置)而不造成这种现象,因此能够使新生血管有效地作用于细胞包埋装置,可效率良好地表现出细胞包埋装置的功能。
[0163]
另外,移植部位的出血、炎症或血管的破损例如能够在移除(摘出)血管新生装置前后或移植细胞包埋装置前通过目视确认。
[0164]
作为含细胞装置(细胞包埋装置),除了细胞或组织本身以外,还可列举出包埋细胞或组织的装置(以下,有时称为细胞包埋装置)等。作为细胞包埋装置,没有特别限定,例如可使用所述专利文献1或2中记载的细胞包埋装置等。以下,进行具体说明。
[0165]
细胞包埋装置中包含(例如,被包埋(包封))的生物组合物(细胞或组织)没有特别限定,可根据装置的使用目的适当选择。
[0166]
作为上述生物组合物,例如可使用来自外胚层、中胚层或内胚层的分化细胞或干细胞等。
[0167]
作为分化细胞,例如可使用表皮细胞、平滑肌细胞、骨细胞、骨髓细胞、软骨细胞、骨格肌成肌细胞、胰腺实质细胞、胰岛细胞、胰腺内分泌细胞、胰腺外分泌细胞、胰管细胞、肝脏细胞(例如,肝细胞)、甲状腺细胞、甲状旁腺细胞、肾上腺细胞、垂体细胞、脾细胞、松果体细胞、肾脏细胞(肾细胞)、脾脏细胞、前叶细胞、生长激素分泌细胞、产生多巴胺的细胞、血细胞、心肌细胞、骨格肌细胞、成骨细胞、神经细胞、色素细胞、脂肪细胞等。上述细胞不仅可以为从生物体中分离的细胞,也可以为后文所述的由干细胞分化诱导的细胞。
[0168]
对于干细胞(ips细胞等)等可被分化诱导的细胞,可以将被分化诱导的细胞移植或放入装置,并在移植后在生物体内将其分化诱导,也可以将已分化诱导的细胞移植或放入装置中使用。
[0169]
此外,作为干细胞,可使用组织干细胞(例如,表皮干细胞、毛囊干细胞、胰腺干细胞
·
胰腺前驱细胞、肝干细胞、神经干细胞、视网膜干细胞、造血干细胞等)、胚胎干细胞(es细胞)、ips细胞(诱导性多功能干细胞)等,但并不限定于此。
[0170]
这些细胞优选为来自人、猴、猪、大鼠、小鼠、狗、猫等哺乳动物,且产生和/或分泌对患者等生物体有用的激素或蛋白质等生理活性物质的细胞,细胞种类的选择可根据移植的患者等生物体的疾病种类来决定。此外,在这些细胞为除人细胞以外的细胞的情况下,其可以为为了治疗目的而导入了人基因的细胞。另外,对生物体有用的激素可例示出胰岛素、促甲状腺激素、甲状腺激素、甲状旁腺激素、生长激素、甲状腺素、糖皮质激素、胰高血糖素、雌二醇或睾酮等。对生物体有用的蛋白质具体而言可例示出凝血因子、补体、白蛋白、球蛋白、各种酶(代谢酶或淀粉酶、蛋白酶或脂肪酶等消化酶)。作为其他生理活性物质的实例,
例如可列举出多巴胺等神经递质等。
[0171]
具体而言,优选胰腺细胞(胰岛细胞)、肝细胞、产生多巴胺的细胞及这些细胞的干细胞
·
前驱细胞,更优选胰腺细胞(胰岛细胞)及胰前驱(干)细胞。
[0172]
细胞包埋装置中使用的生物组合物可以为确定为实验室用的细胞或生物组织、或者由生物组织分离的细胞等中的任一种,优选为已分化的非分裂细胞。另外,该分离方法没有特别限定,可遵循以往公知的方法。此外,期望由生物组织分离的细胞去除了病原性病毒等病原体。
[0173]
在细胞包埋装置中,生物组合物的含量可根据生物组合物的种类进行适当变更。
[0174]
剂量由医生考虑患者的年龄、性别、症状、副作用等而确定,因此不能一概而论,通常成人每人可在体内移植约1~10个装置。例如在针对糖尿病患者的情况下,相对于患者的每1kg体重,通常能够移植含有1000~1000000ieq(胰岛当量的国际单位:将直径为150μm的胰岛的体积定义为1ieq)的胰岛的装置,优选移植含有5000~400000ieq的胰岛的装置,更优选移植含有10000~20000ieq的胰岛的装置。
[0175]
装置的形状没有特别限定,但优选为与血管新生装置相同的形状。包括圆盘状、球状、圆柱状、椭球状等,优选为圆盘状。
[0176]
细胞包埋装置(细胞包埋装置的装置部)的材料没有特别限定,可使用高分子(聚合物)或金属、陶瓷等。
[0177]
特别是细胞包埋装置例如可以具有含有聚合物[例如,聚乙烯醇类树脂(a)]的免疫隔离层。换言之,在细胞包埋装置中,聚合物(形成了凝胶的聚合物)可以构成免疫隔离层(或具有免疫隔离功能)。
[0178]
另外,免疫隔离层(免疫隔离功能)例如是指,使葡萄糖;胰岛素、促甲状腺激素、甲状腺激素、甲状旁腺激素、生长激素、甲状腺素、糖皮质激素、胰高血糖素、雌二醇或睾酮等激素;凝血因子、白蛋白、球蛋白、各种酶(代谢酶或淀粉酶、蛋白酶或脂肪酶等消化酶)等蛋白质;多巴胺等神经递质等透过,而不使例如抗体、补体或白细胞等免疫类的蛋白质透过的层(功能)。
[0179]
细胞包埋装置例如可以为生物人工脏器等。
[0180]
特别是在细胞包埋装置中,生物组合物可以以与所述血管新生装置同样的形态包含于装置中。例如,细胞包埋装置可以含有聚合物,该聚合物可以含有交联剂或细胞培养成分,尤其可以形成凝胶(水性凝胶),该凝胶具有所述规定的强度。
[0181]
优选的形态也与所述相同,例如,可优选使用聚合物中的聚乙烯醇类树脂,尤其是选自具有活性羰基的改性聚乙烯醇类树脂(a1)、间同立构规整度以三单元组表示为32~40%的聚乙烯醇类树脂(a2)、及皂化度为97摩尔%以上的聚乙烯醇类树脂(a3)中的至少一种以上的聚乙烯醇类树脂(a)。
[0182]
如上所述,树脂(a1)或(a2)作为构成血管新生装置(支架等)的聚合物是优选的,如专利文献1或2中所记载,令人意外的是,即使是完全不同的用途,这种聚合物作为构成细胞包埋装置(免疫隔离层)的聚合物也是优选的。
[0183]
此外,细胞包埋装置可以包含与所述相同的支撑基材。
[0184]
如上所述,本发明中还包括移植方法(细胞包埋装置的移植方法)。如上所述,这种移植方法中,在移除血管新生装置后的移植部位(移除部位)移植细胞包埋装置。根据这种
移植方法,可对应于生物组合物(细胞或组织)来预防或改善各种疾病或症状。因此,本发明中还包括这种疾病或症状的预防和/或治疗(改善)方法。
[0185]
这种方法中,在移除血管新生装置后移植细胞包埋装置,但该方法当然也可包括在进行这种移植之前移植(留置)血管新生装置的工序(血管新生工序)。
[0186]
作为症状或疾病,例如可列举出内分泌疾病(例如,甲状腺疾病、甲状旁腺疾病、肾上腺疾病、垂体疾病、松果体疾病等)、代谢疾病(例如,鸟胺酸氨甲酰基转移酶缺乏症、高氨血症、高胆固醇血症、高胱氨酸尿症、糖原病、先天性葡萄糖醛酸转移酶缺乏症等、威尔逊病)、糖尿病(例如,i型糖尿病、ii型糖尿病、胰源性糖尿病等)、神经退行性疾病(例如,帕金森病、阿尔茨海默氏症、肌萎缩侧索硬化症、脊髓小脑变性症等)、血友病、骨病(例如,骨质疏松症)、癌症(例如,白血病等)等。
[0187]
另外,细胞包埋装置的移植(留置)期间没有特别限定,例如可以为10天以上、1个月以上、2个月以上、3个月以上、6个月以上、1年以上等。
[0188]
如上所述,本发明的血管新生装置可优选与细胞包埋装置组合使用。因此,本发明中还包含含有所述血管新生装置与细胞包埋装置的组合装置(套件、装置、组合装置)。实施例
[0189]
接着,列举实施例对本发明进行进一步具体的说明,但本发明并不受这些实施例的任何限定,在本发明的技术构思内,本领域技术人员能够进行多种变形。另外,只要没有特别指定,则实例中的“份”及“%”表示“质量份”及“质量%”。
[0190]
[改性pva类树脂的分析]按照jis k 6726(1994),求出4%水溶液粘度、皂化度。以dmso-d6为溶剂来测定1h-nmr,并根据归属的峰的积分值计算出双丙酮丙烯酰胺单元含量(改性度)。
[0191]
[高间同立构pva类树脂的分析]以dmso-d6为溶剂来测定1h-nmr,并根据归属的峰的积分值计算出间同立构规整度、皂化度。另外,三单元组表示的间同立构规整度(%)是指根据4~5ppm的3个羟基质子(由低磁场侧起为全同立构[i]、杂同立构[h]、间同立构[s])的比率并基于下述计算公式求出的值。三单元组表示的间同立构规整度(%)=[s]/([i] [h] [s])
×
100关于聚合度,测定在jis k 6726(1977)中记载的苯溶液中、在30℃下的聚乙酸乙烯酯换算的聚合度。
[0192]
[完全皂化pva类树脂的分析]按照jis k 6726(1994),求出聚合度、皂化度。
[0193]
[聚丙烯酰肼的分析]重均分子量通过在下述条件下测定的尺寸排阻色谱求出。条件:溶剂:50mm磷酸二氢钠水溶液聚合物浓度:1mg/ml
流量:1.0ml/分钟柱温:40℃色谱柱:shodex ohpack sb-803hq、shodex ohpack sb-805hq标准:普鲁兰多糖检测器:ri酰肼化率通过使用了硫代硫酸钠标准溶液的i2的返滴定法求出。详细的实验操作如下所述。实验操作:1.制备了i2/meoh溶液。2.使用0.1m硫代硫酸钠标准溶液滴定i2/meoh溶液(本测定为0.047m)。3.精确称量各聚合物样本,溶解于20ml的离子交换水中。4.在3的溶液中加入2.0ml的0.047m i2/meoh溶液。5.使用0.1m硫代硫酸钠标准溶液进行碘的返滴定。
[0194]
[水性凝胶的分析]水性凝胶的应力使用eztest ez-sx(shimadzu corporation制造),按照其使用说明书进行测定。具体而言,对直径34mm
×
高度17mm的水性凝胶使用直径为20mm的圆柱夹具,求出20%挤压时的应力(20℃)。
[0195]
此外,在装有100ml纯水的塑料容器中浸渍凝胶,并放入37℃的培养箱中。1个月后从纯水中取出凝胶,并用游标卡尺测定浸渍前后的体积。使用所得到的测定值,根据下述公式求出体积变化率。体积变化率(%)=浸渍后的体积(mm3)
÷
浸渍前的体积(mm3)
×
100
[0196]
[血管新生装置的评价]在血管新生后将胰岛装置移植于大鼠的皮下,并使用该胰岛装置的功能进行评价。具体而言,对于移植了胰岛装置的链脲佐菌素诱发糖尿病大鼠,经时性测定血糖值并确认治愈效果。将血糖值为200mg/dl以下的判定为
○
(糖尿病得到治愈),将血糖值大于200mg/dl的判定为
×
(糖尿病状态)。
[0197]
[改性pva类树脂的制备][合成例1]在装有搅拌机、温度计、滴液漏斗及回流冷凝器的烧瓶中,加入2000份的乙酸乙烯酯、143份的甲醇、3.7份的双丙酮丙烯酰胺,在进行体系内的氮气置换后,将内温升温至60℃。升温后,添加将0.16份的2,2-偶氮二异丁腈溶解于100份的甲醇而得到的溶液,引发聚合。边在烧瓶内继续进行氮气流通,边在引发聚合后立刻以一定速度滴加将70.1份的双丙酮丙烯酰胺溶解于46.7份的甲醇而得到的溶液,在引发聚合210分钟后的时间点添加作为聚合终止剂的间二硝基苯,停止聚合。聚合结束时的收率为47.1%。边向所得到的反应混合物中加入甲醇蒸气,边蒸馏去除残留的乙酸乙烯酯,得到双丙酮丙烯酰胺-乙酸乙烯酯共聚物的35%甲醇溶液。在500份的该溶液中加入70份的甲醇、1份的离子交换水及29.3份的氢氧化钠的4%甲醇溶液,充分混合,以45℃进行皂化反应。粉碎所得到的凝胶状物质,使用甲醇充分清洗后进行干燥,得到d-pva1。4%水溶液粘度为53.4mpa
·
s、皂化度为98.4摩尔%、
双丙酮丙烯酰胺单元为3.4摩尔%。
[0198]
[合成例2~4]除了变更聚合时的乙酸乙烯酯、双丙酮丙烯酰胺的加入量、甲醇及引发剂的加入量等聚合条件、以及皂化时的条件以外,以与合成例1相同的方法,得到表1所示的d-pva2~4。另外,可使用以往公知的合成方法(例如日本特开2015-78324号公报中记载的合成方法等)进行双丙酮丙烯酰胺改性pva的合成。
[0199]
[表1]表1
[0200]
[高间同立构pva类树脂(hs-pva)的制备][合成例5]在装有搅拌机、温度计、滴液漏斗及回流冷凝器的烧瓶中,加入800份的特戊酸乙烯酯、190份的甲醇,在进行体系内的氮气置换后,将夹套加热至80℃,在产生回流的时间点添加将0.07份的2,2
’‑
偶氮双(2,4-二甲基戊腈)溶解于10份的甲醇而得到的溶液,引发聚合,在6小时后添加作为聚合终止剂的间二硝基苯,停止聚合。聚合收率为58%。从所得到的反应物中去除甲醇、特戊酸乙烯酯后,加入丙酮,溶解聚特戊酸乙烯酯,得到40%丙酮溶液。在250份的该40%丙酮溶液中加入110份的氢氧化钾的25%甲醇溶液,充分混合,以50℃进行2小时皂化反应。粉碎所得到的凝胶状物质,在150份的丙酮、340份的氢氧化钾的25%甲醇溶液中进一步以50℃进行4小时皂化反应。在反应后使用乙酸进行中和,进行固液分离,使用甲醇、水清洗并干燥后,得到30g的hs-pva1。所得到的hs-pva1的皂化前的聚合度为1450、皂化度为99.9摩尔%。此外,以三单元组表示的间同立构规整度为37.1%。
[0201]
[合成例6]除了将800份的特戊酸乙烯酯变更为685份的特戊酸乙烯酯、并追加115份的乙酸乙烯酯以外,以与合成例5相同的方式制备hs-pva2。另外,摩尔比(特戊酸乙烯酯/乙酸乙烯酯)为80/20。所得到的hs-pva2的皂化前的聚合度为1510、皂化度为99.9摩尔%。此外,以三单元组表示的间同立构规整度为35.7%。
[0202]
[合成例7]在装有搅拌机、温度计、滴液漏斗及回流冷凝器的烧瓶中,加入2000份的特戊酸乙烯酯、38份的甲醇,在进行体系内的氮气置换后,将夹套加热至80℃,在产生回流的时间点添加将0.03份的2,2
’‑
偶氮双(2,4-二甲基戊腈)溶解于2份的甲醇而得到的溶液,引发聚合,在3小时后添加作为聚合终止剂的间二硝基苯,停止聚合。聚合收率为17%。从所得到的反应物中去除甲醇、特戊酸乙烯酯后,加入丙酮,溶解聚特戊酸乙烯
酯,得到25%丙酮溶液。在200份的该25%丙酮溶液中加入54份的氢氧化钾的25%甲醇溶液,充分混合,以50℃进行2小时皂化反应。粉碎所得到的凝胶状物质,在150份的丙酮、168份的氢氧化钾的25%甲醇溶液中进一步以50℃进行4小时皂化反应。在反应后使用乙酸进行中和,进行固液分离,使用甲醇、水清洗并干燥后,得到17g的hs-pva3。所得到的hs-pv3的皂化前的聚合度为4440、皂化度为99.8摩尔%。此外,以三单元组表示的间同立构规整度为36.7%。
[0203]
[合成例8]除了将2000份的特戊酸乙烯酯变更为1600份的特戊酸乙烯酯、并追加268份的乙酸乙烯酯以外,以与合成例7相同的方式制备hs-pva4。另外,摩尔比(特戊酸乙烯酯/乙酸乙烯酯)为80/20。所得到的hs-pva4的皂化前的聚合度为4530、皂化度为99.9摩尔%。此外,以三单元组表示的间同立构规整度为35.5%。
[0204]
将合成例5~8中制备的高间同立构pva类树脂的物性值总结于表2。
[0205]
[表2]表2
[0206]
[聚丙烯酰肼(apa)的制备][合成例9]在混合有20份的重均分子量为约40000的聚丙烯酰胺与40份的离子交换水的水溶液中加入16份的肼一水合物,以80℃反应15小时。向所得到的混合液中加入乙醇,对所得到的沉淀物进行过滤、清洗、干燥,得到apa1。重均分子量为约53000、酰肼化率为88%。
[0207]
[合成例10]除了使用重均分子量为约15000的聚丙烯酰胺以外,以与合成例12相同的方式进行反应,得到apa2。重均分子量为约22000、酰肼化率为80%。
[0208]
[合成例11]除了使用重均分子量为约65000的聚丙烯酰胺以外,以与合成例12相同的方式进行反应,得到apa3。重均分子量为约88000、酰肼化率为90%。
[0209]
将合成例9~11中制备的聚丙烯酰肼的物性值总结于表3。
[0210]
[表3]表3
[0211]
[adsc的制备]采集雄性7~8周龄的lewis大鼠(japan slc,inc.)的腹部及腹股沟部皮下脂肪,并用磷酸缓冲液(phosphate buffer solution:pbs)清洗。将进行了细切的脂肪组织在包含1mg/ml ii型胶原酶(sigma-aldrich)与1mmol/l cacl2·
2h2o的hank’s缓冲液中、于37℃以100rpm振荡20分钟,同时进行酶处理。针对未消化的脂肪组织,进一步进行20分钟的酶处理。使消化后的细胞
·
组织悬液通过70μm的尼龙网布,将去除残留组织后的滤液于20℃以350g离心分离5分钟,分离为包含干细胞的沉淀部分与包含较多脂质的成熟脂肪细胞部分。用hank’s缓冲液清洗沉淀部分后,以成为5
×
106个细胞/ml的方式,用包含100单位/ml青霉素-100μg/ml链霉素(thermo fisher scientific)的含血清adsc培养基(adsc-1,kohjin bio corporation.)进行混悬,并转移10ml至t75烧瓶(培养面积75cm2)中,以湿度95%、37℃、5%co2进行初代培养。在培养第1天、第2天及第4天更换培养基,去除非粘合细胞。将培养至烧瓶内的细胞达到50~80%汇合的第一代细胞从烧瓶中剥离并进行单细胞化,然后进行冷冻保存。单细胞化的工序以下述方式进行:从烧瓶中去除培养基后,用pbs清洗,加入3ml的0.05%胰蛋白酶-edta(thermo fisher scientific),于37℃处理3分钟,从烧瓶表面剥离细胞。将adsc以1
×
106个细胞/ml混悬于细胞冷冻保存溶液cellbanker 1plus(nippon zenyaku kogyo co.,ltd.),并于-80℃冷冻后,在液氮中保存。将冷冻细胞解冻后,以3.3
×
104个细胞/ml混悬于包含100单位/ml青霉素-100μg/ml链霉素的含血清adsc培养基。转移10ml至t75烧瓶中,并将以湿度95%、37℃、5%co2培养至达到50~80%汇合的第二代细胞从烧瓶中剥离并进行单细胞化(剥离方法与冷冻保存时的胰蛋白酶-edta处理相同),用于adsc装置。
[0212]
[实施例1](血管新生装置的制作)将包含8.0g含有6.25%的d-pva1(合成例1中得到的聚合物)的水溶液、1.0ml含有5.0%的apa1(合成例9中得到的交联剂(聚丙烯酰肼))的水溶液、及1.0ml的10倍浓度hank’s缓冲液的混合液于37℃进行加温,将进行凝胶化直至表现出可纺性的凝胶用于装置制作。将凝胶注入有机硅模具(直径32mm、厚度1mm),并于37℃静置约10分钟。在凝胶上放置pet筛网(直径30mm),使adsc(5
×
105个细胞)与凝胶的混合物在筛网表面均匀扩散,并于37℃静置约10分钟后,覆盖筛网,然后用凝胶填充模具的内部。以4℃、5%co2使其进行16小时凝胶化。另外,在凝胶(水凝胶)中,d-pva浓度为5.0%、apa1的浓度为0.5%、对应于上述组成的应力为5.2kpa、体积变化率为约50%。此外,在凝胶中,adsc的比例为7.0
×
102个细胞/mm2。
[0213]
(血管新生装置的移植
·
留置工序)将上述血管新生装置留置于大鼠的皮下4周。留置装置前的皮下组织中未观察到出血或浸出液,仅观察到肉眼勉强可确认的程度的轻度的新生血管,但在留置血管新生装置4周后,在皮下组织中观察到了肉眼能够明确辨认的新生血管。此外,虽然留置部位的新生血管明显增加,但由于装置表面与皮下组织的粘连稀
疏,因此极其容易剥离,在移除装置后也根本未在移除部位的皮下观察到出血或浸出液。因此,此后也极其容易在相同部位进行各种移植(例如,后文所述的插入胰岛包埋装置)。进一步,留置4周后的血管新生装置的体积减少至50%左右。另外,虽对5只大鼠进行了上述移植
·
留置工序,但均显示相同的结果(充分的血管新生、移除装置后没有出血
·
浸出液)。
[0214]
(用于胰岛包埋装置的胰岛细胞的制备)将11~14周龄的雄性lewis大鼠(japan slc,inc.)用于胰岛分离。在37℃下,对从大鼠总胆管注入了溶解有0.8mg/ml胶原酶v型(collagenase type v)(sigma-aldrich制造)的冷hank’s缓冲液(hbss)的胰脏进行12分钟消化,从胰腺组织中分离胰岛。使用histropaque-1119(sigma-aldrich制造)与淋巴细胞分离液(lymphoprep)(axis-shield,norway)进行浓度梯度离心,回收胰岛。将胰岛在含有5.5mmol/l葡萄糖与10%胎牛血清(fetal bovine serum:fbs)的rpmi1640培养基中,在37℃、5%co2下培养整夜。
[0215]
(溶胶状态的改性pva类树脂及交联剂的水溶液的制备)在25ml离心管中加入8.0g合成例1中制备的d-pva1的6.25%水溶液,向其中加入1.0ml的10倍浓度hbss(hank’s平衡盐溶液),对离心管进行上下振荡并搅拌。然后,使用离心机(kubotacorporation.制造,商品名称:混合高速冷冻离心机6200)进行快速离心(spin down),在37℃下静置10分钟。向其中加入1.0ml作为交联剂的合成例9中制备的apa1的5%水溶液,将离心管上下振荡15次。用离心机快速离心后再次将离心管上下振荡15次。然后,以25℃、3000rpm离心1分钟,在37℃下静置。适当检查所得到的溶胶状态的水溶液的粘度,在溶胶形成液滴的时间达到3~4秒而被判断为胰岛包埋的最适状态后,将离心管从恒温槽中取出,在冰上静置1分钟。然后,以25℃、3000rpm离心1分钟,得到改性pva类树脂为5%、交联剂为0.5%的溶胶。另外,在凝胶(水凝胶)中,d-pva1的浓度为5.0%、apa1的浓度为0.5%、对应于上述组成的应力为5.2kpa。
[0216]
(胰岛包埋装置的制作)在载玻片上放置160μl置于上述皿上的上述已制备的溶胶。在其上覆盖pet筛网(sanplatec co.,ltd.制造,商品名称:pet筛网片(名称tn120)),使从上述制备的胰岛细胞中尽可能去除了培养基成分的物质在50μl的溶胶中混悬,使所得到的悬液在上述pet筛网上扩散,以夹持胰岛细胞的悬液的方式进一步在其上覆盖pet筛网。进一步在pet筛网上放置140μl的溶胶,在其上覆盖载玻片。将通过上述方式构建的溶胶留置在湿箱中,在4℃下静置48小时,得到胰岛包埋装置(水性凝胶)。
[0217]
(胰岛包埋装置的保存工序)从载玻片上取下以上述方式构建的胰岛包埋装置,在6孔板中以5ml/孔的比例浸渍在保存培养基(将葡萄糖浓度调节至5.5mm、且含有10%fbs的rpmi1640培养基)中,在4℃下保存16小时左右。
[0218]
(移植工序)对进行了所述血管新生的大鼠注入链脲佐菌素,诱发糖尿病。在该大鼠的皮下留
置上述保存后的胰岛包埋装置(水性凝胶)而进行移植。
[0219]
(糖尿病治愈评价)在上述移植后,经时测定血糖值,确认治愈效果。另外,将血糖值为200mg/dl以下的判定为
○
(糖尿病得到治愈),将大于200mg/dl的判定为
×
(糖尿病状态)。
[0220]
[比较例1]除了未进行血管新生装置的移植
·
留置以外,进行与实施例1相同的操作,在链脲佐菌素诱发糖尿病大鼠中留置胰岛包埋装置(水性凝胶)后,进行糖尿病治愈评价。另外,对5只大鼠进行糖尿病治愈评价。
[0221]
总结实施例1及比较例1中进行的糖尿病治愈评价的结果并示于下述表4。另外,“移植前血糖值”是指,实施例1中,移除血管新生装置并移植胰岛装置前的血糖值。
[0222]
[表4]表4
[0223]
由上述结果可知,根据实施例1的血管新生装置,即使在皮下也能够实现充分的血管新生。
[0224]
而且,虽能够如此实现充分的血管新生,却也未观察到装置移除造成皮下的出血或浸出液,能够效率良好地进行进一步的移植,能够效率良好地发挥或实现移植装置所带来的功能(实施例1中为糖尿病得到治愈)。
[0225]
另外,本技术的发明人确认了:若在利用其他装置进行充分的血管新生后进行移除,会观察到出血或浸出液,此外,即使在将该装置移除后以与上述相同的方式移植胰岛装置并进行相同的评价,也无法充分获得糖尿病治愈效果。由此可知,对移植装置所带来的功能的发挥而言,不会随着血管新生装置的移除而产生出血或浸出液也是重要的。
[0226]
<其他凝胶的制备>如上所述,由于使用了包含合成例中得到的聚合物的水性凝胶的装置作为血管新生装置有效地发挥功能,因此进一步制备了这种可用于装置的水性凝胶。
[0227]
[实施例2](改性pva类树脂的水性凝胶的制备及应力测定)混合16.0g合成例1中制备的d-pva1的6.25%水溶液、2.0ml合成例10中制备的apa2的10%水溶液、2.0ml的10倍浓度hbss(hank’s平衡盐溶液),并将其填充于直径为34mm
的圆柱容器内后,在37℃下静置30分钟,进一步在4℃下静置48小时,由此制备直径34mm
×
高度17mm的水性凝胶。所得到的凝胶的pva浓度为5.0%、交联剂浓度为0.5%、20℃下的应力为5.3kpa、体积变化率为45.5%。
[0228]
[实施例3~17]如下述表5所示,适当变更改性pva类树脂或交联剂的种类、浓度、凝胶化时间等,除此以外,以与实施例1相同的方式制备水性凝胶,求出应力、体积变化率。对于hbss,添加10倍浓度hbss使得其为凝胶的总质量的10质量%。另外,在表中,“adh”为己二酸二酰肼。
[0229]
[表5]表5
[0230]
[实施例18](高间同立构pva类树脂的水性凝胶的制备及应力测定)使合成例6的hs-pva1在密闭容器中以160℃溶解于离子交换水,冷却至90℃从而制备hs-pva的6.25%水溶液。将16.0g所述水溶液冷却至40℃后,添加2.0ml的10倍浓度hbss(hank’s平衡盐溶液)与2.0ml离子交换水,充分混合。将所得到的溶胶填充于直径为34mm的圆柱状容器,于4℃使其凝胶化3小时,由此制备直径34mm
×
高度17mm的水性凝胶。所得到的水溶液的pva浓度为5.0%、20℃下的应力为0.8kpa、体积变化率为60.3%。
[0231]
[实施例19~24]如表6所示,适当变更高间同立构pva类树脂的种类、浓度、凝胶化时间等,除此以外,以与实施例18相同的方式制备水性凝胶,求出应力、体积变化率。对于hbss,添加10倍浓度hbss使得其为凝胶的总质量的10质量%。
[0232]
[表6]表6
[0233]
[实施例25](完全皂化pva类树脂的水性凝胶的制备及应力测定)向16.0g完全皂化pva类树脂1(聚合度1700、皂化度99.4摩尔%)的12.5%水溶液中添加2.0ml的10倍浓度hbss(hank’s平衡盐溶液)与2.0ml离子交换水,充分混合。将所得到的水溶液于-20℃冷冻5小时后,反复进行3次于4℃解冻19小时的操作,制备水性凝胶。所得到的水溶液的pva浓度为10.0%、20℃下的应力为7.2kpa、体积变化率为69.2%。
[0234]
[实施例26~30]如表7所示,适当变更完全皂化pva类树脂的种类、浓度、冷冻融解次数等,除此以外,以与实施例23相同的方式制备水性凝胶,求出应力、体积变化率。对于hbss,添加10倍浓度hbss使得其为凝胶的总质量的10质量%。
[0235]
[表7]表7
[0236]
[实施例31~34]如下述表8所示,适当变更pva类树脂(改性pva类树脂、高间同立构pva类树脂)的种类、交联剂的种类、浓度、凝胶化时间等,除此以外,以与实施例1或实施例18相同的方式制备水性凝胶,求出应力、体积变化率。对于hbss,添加10倍浓度hbss使得其为凝胶的总质量的10质量%。
[0237]
[表8]表8
[0238]
使用上述实施例中得到的凝胶,以与实施例1相同的方式进行血管新生装置的制作、留置(移植),结果与实施例1相同,确认到了血管新生。此外,移除也容易,未观察到出血或浸出液。进一步,能够效率良好地发挥或实现移植装置所带来的功能。
[0239]
以下,示出所得到的结果的一个实例。即,将糖尿病治愈评价的结果示于下述表9,该糖尿病治愈评价除了在实施例1中使用实施例31~34中得到的装置作为血管新生装置以外,以与实施例1相同的方式进行。另外,由于在实施例1中,5只大鼠均得到了相同的结果(观察到了倾向),因此将对1只大鼠进行糖尿病治愈评价而得到的结果作为糖尿病治愈评价的结果。
[0240]
[表9]表9工业实用性
[0241]
根据本发明,能够提供一种血管新生装置。这种装置例如可用作用于充分调动另行移植的细胞或组织包埋装置原本所具有的性能的血管新生装置。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。