本公开内容涉及可用于靶向支链氨基酸转氨酶(BCAT)来治疗氨基酸代谢的遗传病症的方法和组合物。
背景技术
支链有机酸尿和/或有机酸血症是由涉及支链氨基酸(BCAA)-亮氨酸、异亮氨酸和缬氨酸的分解代谢的特异性酶的异常而引起的一组病症。有机酸血症是影响全世界约150,000名患者的罕见病亚群。患有有机酸血症的患者在线粒体中过度产生代谢物,这导致底物分子的毒性积累。一些毒性分子通过变构抑制关键酶而负面地影响正常代谢途径。对细胞代谢的影响导致神经发育病状和发育不良病状,如果不进行治疗,则可能导致死亡。枫糖尿病(MSUD)、异戊酸血症(IVA)、丙酸尿症(PA)和甲基丙二酸尿症(MMA)代表了最常见的异常有机酸血症。然而,导致代谢中间体积累的BCAA代谢途径的任何突变也将被视为有机酸血症。MMA、PA和IVA存在严重的脱水、白细胞减少和血小板减少,这可以模拟败血症。这些病症可以通过新生儿遗传筛查,并通过气相色谱质谱或串联MS-MS鉴定血浆和尿液中的酰基肉碱和其它有机酸化合物来诊断。
BCAA在它们的分解代谢中包括对于所有三种而言均是共同的第一步,涉及BCAA转氨酶(BCAT)和支链α-酮酸脱氢酶(BCKD)。它们的进一步代谢采用不同的途径,产生不同的终产物(例如,葡萄糖和/或酮体)。然而,三种BCAA的分解代谢的通量产生步骤(涉及BCKD)发生在共同步骤之一的事实表明,这些下游产物的产生不是单独调节的,因此可能不会起到重要的单独作用。BCAA的分解代谢受到变构和共价机制的高度调节。BCKD被磷酸化抑制并被去磷酸化激活。支链酮酸(BCKA)(特别是异α-酮异己酸)对激酶的变构抑制既用作促进过量的这些氨基酸的分解代谢的机制,也用于维持这些饮食必需氨基酸的低浓度。已经鉴定了BCAT的细胞溶质型和线粒体型同工酶。
底物水平降低目前用于治疗各种罕见病患者。然而,目前没有可用于有机酸血症,例如MSUD、MMA、PA和IVA的治疗。因此,仍然需要可用于治疗这些疾病及其它氨基酸代谢遗传病症的疗法。
技术实现要素:
在一些实施方案中,本文提供了治疗有机酸血症的方法,其包括施用治疗有效量的本文所述的BCAT2抑制剂化合物。
在一些实施方案中,本文提供了减少毒性支链氨基酸(BCAA)代谢物的方法,其包括施用治疗有效量的本文所述的BCAT2抑制剂化合物。
在一些实施方案中,本文提供了减少患有有机酸血症的患者的细胞的毒性负荷负担的方法,其包括施用治疗有效量的本文所述的BCAT2抑制剂。
在一些实施方案中,本文所述的化合物是具有式(I)的结构的化合物或其药物可接受的盐:
其中
Z可以是CH2、CF2、O或键;
J1、J2、J3和J4中的每一个可以独立地是CH或N;
X1是N或CR5A;
X2是N或CR5B;
R1可以是C1-C6烷基、-NR3S(O)R4、-NR3SO2R4、-NR3C(O)R4、-C(O)(CH2)mNR3R4、C6-C10芳基、5-10元杂芳基或(5-10元杂芳基)-C1-C6烷基;
R2可以是-NR6R7、C1-C6烷基、C3-C8环烃基、C6-C10芳基或5-10元杂芳基,其中每个芳基或杂芳基可以任选地被一个、两个或三个取代基R2’取代,所述取代基R2’独立地选自卤素、-CN、-NO2、C1-C6烷基、C1-C6烷氧基、卤代C1-C6烷基、卤代C1-C6烷氧基、C2-C6烯基、C2-C6炔基、-C(O)NR6R7、-C(O)R6、-NR6R7、-NR6C(O)R7、-OH、-S-(卤代C1-C6烷基)、C6-C10芳基和5-10元杂环基;或者两个R2’取代基与它们连接的原子一起可以形成各自任选地被卤素取代的5元杂环基或C3-C8环烃基;
R3可以是H或C1-C6烷基;
R4可以是H、C1-C6烷基、C2-C6烯基、C6-C10芳基或5-10元杂芳基,其中每个芳基或杂芳基可以任选地被一个、两个或三个取代基R4’取代,所述取代基R4’独立地选自卤素、-CN、-NO2、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、C2-C6烯基、C3-C8环烃基、C6-C10芳基、-(CH2)qNR8C(O)R9、-C(O)NR8R9、-C(O)OR9、-C(O)R9和5-10元杂环基;
R5A可以是H、卤素、-CN、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、-(CH2)rOH、-C(O)NR8R9、-NR8COR9、5-10元杂芳基、-C(O)R8或-C(O)OR8;
R5B是H、卤素、-CN、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、-(CH2)rOH、-C(O)NR8R9、-NR8COR9、5-10元杂芳基、-C(O)R8或-C(O)OR8;
或者R5A和R5B与它们连接的原子一起可以形成任选地被氧基取代的6元杂环基环;
R6和R7可以独立地是H、C1-C6烷基或C3-C8环烃基;
每个R8可以独立地是H、C1-C6烷基或C3-C8环烃基;
每个R9可以独立地是H、C1-C6烷基、C2-C6烯基或C3-C8环烃基;
m可以是0或1;
q可以是0或1;以及
r可以是0或1。
在一些实施方案中,R5A不是氢。
在一些实施方案中,R5B不是氢或-C(O)NR8R9。
在一些实施方案中,R2不是未取代的芳基或未取代的杂芳基。在一些实施方案中,R2不是被一个-S-C1-C6烷基取代的C6-C10芳基。在一些实施方案中,R2不是被一个C1-C6烷基取代的5-10元杂芳基。
在一些实施方案中,式(I)的化合物不选自:
及其药物可接受的盐和立体异构体。
在一些实施方案中,Z可以是CH2。在其它实施方案中,Z可以是CF2。在又一个实施方案中,Z可以是O。在又另一个实施方案中,Z可以是键。
在一些实施方案中,J1可以是CH。在其它实施方案中,J1可以是N。
在一些实施方案中,J2可以是CH。在其它实施方案中,J2可以是N。
在一些实施方案中,J3是CH。在其它实施方案中,J3可以是N。
在一些实施方案中,J4可以是CH。在其它实施方案中,J4可以是N。
在一些实施方案中,X1可以是N。在其它实施方案中,X1可以是CR5A。
在一些实施方案中,X2可以是N。在其它实施方案中,X2可以是CR5B。
在一些实施方案中,J2可以是N并且X1可以是N。在其它实施方案中,J2可以是N并且J3可以是N。在又一个实施方案中,J2可以是N并且J4可以是N。在又另一个实施方案中,J2可以是N并且X2可以是N。在一些实施方案中,J2、J3和J4中的每一个可以是CH;X1可以是CR5A;并且X2可以是CR5B。
在一些实施方案中,R1可以是NR3C(O)R4。在其它实施方案中,R1可以是-C(O)(CH2)mNR3R4。
在一些实施方案中,R3可以是氢。在其它实施方案中,R3可以是C1-6烷基。
在一些实施方案中,R4可以是各自任选地被一个、两个或三个取代基R4’取代的C6-10芳基或5-10元杂芳基。在一些实施方案中,R4可以选自各自可以任选地被一个、两个或三个取代基R4’取代的苯基、噻吩、噁唑、异噁唑、噻唑、呋喃和吡咯,其中每个R4可以独立地选自-F、-Cl、-Br、-CN、-NO2、-CF3、-CH3、-CH(CH3)2、-C(O)CH3、-C(O)OCH3、苯基、环丙基和吗啉基。
在一些实施方案中,m可以是0。在其它实施方案中,m可以是1。
在一些实施方案中,R2可以是各自任选地被一个、两个或三个取代基R2’取代的C6-10芳基或5-10元杂芳基。在一些实施方案中,R2可以选自各自可以任选地被一个、两个或三个取代基R2’取代的苯基、吡啶、嘧啶、哒嗪、吡嗪、咪唑或噻吩,其中每个R2’可以独立地选自-F、-Cl、-Br、-CN、NO2、-CH3、-CF2H、-C≡CH、-C(O)H、-CONH2、-C(O)NHCH3、-OH、-OCH3、-OCF3、-SCF3、-NH2、-NHC(O)CH3和吗啉。
在一些实施方案中,X2可以是CR5B并且R5B可以是-C(O)NR8R9。在其它实施方案中,X2可以是CR5B并且R5B可以是卤素、-CN、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、-(CH2)rOH、-NR8COR9、5-10元杂芳基、-C(O)R8或-C(O)OR8。在又一个实施方案中,X2可以是CR5B并且R5B可以是-NR8COR9。在一些实施方案中,X2可以是CR5B并且R5B可以是-C(O)OR8。在一些实施方案中,X2可以是CR5B并且R5B可以是-CF3、-COCH3、-CH2OH、-CN或四唑。
在一些实施方案中,R8可以是氢。在其它实施方案中,R8可以是-C1-6烷基。
在一些实施方案中,R9可以是氢。在其它实施方案中,R9可以是-C1-6烷基。
在一些实施方案中,本文提供的化合物是具有式(Ia)的结构的式(I)的化合物或其药物可接受的盐:
其中
R1可以是C1-C6烷基、-NR3S(O)R4、-NR3SO2R4、-NR3C(O)R4、-C(O)(CH2)mNR3R4、C6-C10芳基或5-10元杂芳基;
R2可以是C1-C6烷基、C6-C10芳基或5-10元杂芳基;
R4可以是C6-C10芳基或5-10元杂芳基;
R5B可以是-C(O)NR8R9;以及
R8和R9独立地是H、C1-C6烷基或C3-C8环烃基。
在一些实施方案中,本文提供了式(Ia)的化合物或其药物可接受的盐,其中:
R1可以是-NR3SO2R4或-NR3C(O)R4;
R2可以是芳基或5-10元杂芳基;
R3可以是H或C1-C6烷基;
R4可以是C6-C10芳基或5-10元杂芳基;
R5B可以是-C(O)NR8R9;以及
R8和R9可以独立地是H或C1-C6烷基。
在一些实施方案中,本文提供了式(Ia)的化合物或其药物可接受的盐,其中:
R1可以是-NR3C(O)R4;
R2可以是C6-C10芳基或5-10元杂芳基;
R3可以是H或甲基;
R4可以是C6-C10芳基或5-10元杂芳基;
R5B可以是-C(O)NR8R9;以及
R8和R9可以独立地是H或C1-C6烷基。
在一些实施方案中,本文提供了式(Ia)的化合物或其药物可接受的盐,其中:
R1可以是-NR3C(O)R4;
R2可以是C6-C10芳基或5-10元杂芳基;
R3可以是H或甲基;
R4可以是C6-C10芳基或5-10元杂芳基;
R5可以是-C(O)NR8R9;以及
R8和R9可以独立地是H或甲基。
在一些实施方案中,本公开内容的化合物可以是
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(2-(甲硫基)苯基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-苯基-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-2-(吡啶-3-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-2-(吡啶-4-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(噻吩-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(噻吩-3-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(2-甲基噻唑-4-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(噻唑-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(1H-吡唑-3-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-氰基噻吩-2-甲酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-氯噻吩-2-甲酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-甲基噻吩-2-甲酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴-N-甲基噻吩-2-甲酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-((5-溴噻吩)-2-磺酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
2-溴-N-(3-(5-(甲基氨基甲酰基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-1-基)环己基)噻唑-5-甲酰胺、
1-(3-(5-溴-1-甲基-1H-吡咯-2-甲酰氨基)环己基)-N-甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(4-溴-1H-吡咯-2-甲酰氨基)环己基)-N-甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
3-氯-N-(3-(5-(甲基氨基甲酰基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-1-基)环己基)异噁唑-5-甲酰胺、
5-溴-N-(3-(2-(吡啶-2-基)-1H-苯并[d]咪唑-1-基)环己基)噻吩-2-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N,N-二甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-环丙基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、以及
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-异丙基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺;或其药物可接受的盐。
在其它实施方案中,本文提供了具有式(II)的结构的式(I)的化合物:
或其药物可接受的盐,其中
R2可以是C6-C10芳基或5-10元杂芳基,其中每个芳基或杂芳基可以任选地被一个、两个或三个取代基R2’取代,所述取代基R2’独立地选自卤素、-CN、-NO2、C1-C6烷基、C1-C6烷氧基、卤代C1-C6烷基、卤代C1-C6烷氧基、C2-C6烯基、C2-C6炔基、-C(O)NR6R7、-C(O)R6、-NR6R7、-NR6C(O)R7、-OH、-S-(卤代C1-C6烷基)、C6-C10芳基和5-10元杂环基;或者两个R2’取代基与它们连接的原子一起可以形成各自任选地被卤素取代的5元杂环基或C3-C8环烃基;
R4可以是任选地被一个、两个或三个取代基R4’取代的5-10元杂芳基,所述取代基R4’独立地选自卤素、-CN、-NO2、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、C2-C6烯基、C3-C8环烃基、C6-C10芳基、-(CH2)qNR8C(O)R9、-C(O)NR8R9、-C(O)OR9、-C(O)R9和5-10元杂环基;以及
R5B可以是-C(O)NR8R9。
在一些实施方案中,R2可以是任选地被一个、两个或三个取代基R2’取代的苯基,所述取代基R2’独立地选自卤素、-CN、-NO2和C1-C6烷基。在其它实施方案中,R2是任选地被一个、两个或三个取代基R2’取代的5-10元杂芳基,所述取代基R2’独立地选自卤素、-CN、-NO2和C1-C6烷基。
在一些实施方案中,R4可以是任选地被卤素或苯基取代的噻吩。
在其它实施方案中,本文提供的化合物可以是具有式(III)的结构的式(I)的化合物:
或其药物可接受的盐
其中
每个J3和J4独立地是CH或N;
X1可以是N或CR5A;
X2可以是N或CR5B;
其中J3、J4、X1和X2中的一个、两个、三个或四个是N;
R2可以是C6-C10芳基或5-10元杂芳基,其中每个芳基或杂芳基可以任选地被一个、两个或三个取代基R2’取代,所述取代基R2’独立地选自卤素、-CN、-NO2、C1-C6烷基、C1-C6烷氧基、卤代C1-C6烷基、卤代C1-C6烷氧基、C2-C6烯基、C2-C6炔基、-C(O)NR6R7、-C(O)R6、-NR6R7、-NR6C(O)R7、-OH、-S-(卤代C1-C6烷基)、C6-C10芳基和5-10元杂环基;或者两个R2’取代基与它们连接的原子一起形成各自任选地被卤素取代的5元杂环基或C3-C8环烃基;以及
R4可以是H、C1-C6烷基、C2-C6烯基、C6-C10芳基或5-10元杂芳基,其中每个芳基或杂芳基可以任选地被一个、两个或三个取代基R4’取代,所述取代基R4’独立地选自卤素、-CN、-NO2、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、C2-C6烯基、C3-C8环烃基、C6-C10芳基、-(CH2)qNR8C(O)R9、-C(O)NR8R9、-C(O)OR9、-C(O)R9和5-10元杂环基。
在一些实施方案中,R2可以是任选地被一个、两个或三个取代基R2’取代的苯基,所述取代基R2’独立地选自卤素、-CN、-NO2和C1-C6烷基。在其它实施方案中,R2是任选地被一个、两个或三个取代基R2’取代的5-10元杂芳基,所述取代基R2’独立地选自卤素、-CN、-NO2和C1-C6烷基。
在一些实施方案中,R4可以是任选地被卤素或苯基取代的噻吩。
在一些实施方案中,X2可以是CR5B;R5B可以选自氢、-卤素、-C(O)NR8R9、-NR8COR9或-C(O)OR8;以及R8和R9可以各自独立地是H或C1-C6烷基。
在其它实施方案中,本文提供的化合物可以是具有式(IV)的结构的式(I)的化合物:
或其药物可接受的盐,其中
R1是C1-C6烷基、-NR3C(O)R4、-C(O)(CH2)mNR3R4、C6-C10芳基、5-10元杂芳基或(5-10元杂芳基)-C1-C6烷基;以及
R2是-NR6R7、C1-C6烷基、C3-C8环烃基、C6-C10芳基或5-10元杂芳基,其中每个芳基或杂芳基被一个、两个或三个取代基R2’取代,所述取代基R2’独立地选自卤素、-CN、-NO2、C1-C6烷氧基、卤代C1-C6烷基、卤代C1-C6烷氧基、C2-C6烯基、C2-C6炔基、-C(O)NR6R7、-C(O)R6、-NR6R7、-NR6C(O)R7、-OH、C6-C10芳基和5-10元杂环基;或者两个R2’取代基与它们连接的原子一起形成各自任选地被卤素取代的5元杂环基或C3-C8环烃基。
在又一个实施方案中,本文提供了具有式(V)的结构的式(I)的化合物:
或其药物可接受的盐
其中
R5A是卤素、-CN、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、-(CH2)rOH、-C(O)NR8R9、-NR8COR9、5-10元杂芳基、-C(O)R8或-C(O)OR8;
R5B是H、卤素、-CN、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、-(CH2)rOH、-C(O)NR8R9、-NR8COR9、5-10元杂芳基、-C(O)R8或-C(O)OR8;以及
或者R5A和R5B与它们连接的原子一起可以形成任选地被氧基取代的6元杂环基环。
在又一个实施方案中,本文提供了具有式(VI)的结构的式(I)的化合物:
或其药物可接受的盐。
在又另一个实施方案中,本文提供了具有式(VII)的结构的式(I)的化合物或其药物可接受的盐:
在有另一个实施方案中,本文提供了选自以下的化合物:
及其药物可接受的盐。
在一些实施方案中,与BCAT1相比,本文公开的化合物选择性地抑制BCAT2。
在一些实施方案中,本文所述的方法减轻和/或改善患者的有机酸血症的症状。
在一些实施方案中,有机酸血症选自所有形式的甲基丙二酸血症(MMA)、所有形式的丙酸血症(PA)、异戊酸血症、1型戊二酸尿症(GA1)、β-酮硫解酶缺乏症(BKT)、3-甲基巴豆酰基-CoA羧化酶缺乏症(3-MCC)、3-羟基-3-甲基戊二酰基-CoA裂解酶缺乏症(HMG)、3-甲基戊烯二酸血症或3-甲基戊二酰基-CoA水合酶缺乏症(MGA)、D-2-羟基-戊二酸尿症(D2-HGA)、异丁酰基-CoA脱氢酶缺乏3-羟基异丁酸尿症(ICBD)、L-2-羟基-戊二酸尿症(L2HGA)、丙二酰基-CoA脱羧酶缺乏症也称为丙二酸血症(MA)、多羧化酶缺乏症(MCD,全羧化酶合成酶)和3-羟基异丁酰基-CoA水解酶缺乏症(HIBCH)。
在一些实施方案中,本文所述的方法引起毒性支链氨基酸(BCAA)代谢物水平的降低。在一些实施方案中,毒性代谢物选自丙酸、2-甲基柠檬酸、3-羟基丙酸、丙酰基-CoA、甲基丙二酸、甲基丙二酰基-CoA和异戊酸。在一些实施方案中,毒性代谢物变构地抑制酶。
在一些实施方案中,本文所述的方法引起循环支链氨基酸(BCAA)水平的增加。在一些实施方案中,支链氨基酸是选自亮氨酸、异亮氨酸和缬氨酸中的一种或多种。
在一些实施方案中,本文所述的方法调节通过BCAA途径的代谢通量。在一些实施方案中,在治疗之前和/或之后发生代谢通量的降低。在一些实施方案中,本文所述的方法抑制和/或降低通过BCAA途径的BCAT2介导的通量。
在一些实施方案中,当降低或抑制亮氨酸的代谢时发生BCAT2-介导的通量的降低。在一些实施方案中,BCAA代谢途径中的一种或多种酶降低和/或抑制亮氨酸的代谢,所述酶选自支链α-酮酸脱氢酶(BCKDH)、异戊酰基CoA脱氢酶(IVD)、3-甲基巴豆酰基-CoA羧化酶(3MCC)、3-甲基戊二酸-CoA水合酶(3MGA)、3-羟基-3-甲基戊二酰基-CoA裂解酶(HMGL)、乙酰基-CoA羧化酶(AC)和丙二酰基-CoA脱羧酶(MA)。
在一些实施方案中,当降低和/或抑制异亮氨酸的代谢时发生BCAT2-介导的通量的降低。在一些实施方案中,BCAA代谢途径中的一种或多种酶降低和/或抑制异亮氨酸的代谢,所述酶选自BCKDH、甲基丁酰基CoA脱氢酶(SBCAD)、水合酶、2-甲基-3-羟基异丁酸脱氢酶(MHBD)、乙酰乙酰基-CoA硫解酶(T2)、AC、MA、丙酰基-CoA羧化酶(PCC)、甲基丙二酰基-CoA变位酶(MUT)和琥珀酰基-CoA连接酶(SUCLA)。
在一些实施方案中,当降低和/或抑制缬氨酸的代谢时发生BCAT2-介导的通量的降低。在一些实施方案中,BCAA代谢途径中的一种或多种酶降低和/或抑制缬氨酸的代谢,所述酶选自BCKDH、异丁酰基-CoA脱氢酶(IBDH)、水合酶、3-羟基异丁酰基-CoA脱酰酶(水解酶)(HIBDA)、3-羟基异丁酸脱氢酶(HIBDH)、甲基丙二酸半醛脱氢酶(MMSDH)、PCC、MUT和SUCLA。
在一些实施方案中,本文所述的方法可以进一步包括施用氨基酸转运蛋白抑制剂,任选地施用SLC6A19抑制剂。在一些具体实施方案中,与不施用氨基酸转运蛋白抑制剂的治疗相比,支链氨基酸的水平降低。
在又一个实施方案中,本文描述了用于鉴定治疗有机酸血症的候选化合物的方法,所述方法包括:
获得具有直接或间接结合BCAT2的能力的测试化合物;
测定BCAT2的功能调节;以及
如果检测到BCAT2活性降低、低活性或基本上无活性,则将测试化合物分类为候选化合物。
在一些实施方案中,使用基于细胞的测定法来测定BCAT2的功能调节。在一些实施方案中,如果测量到支链氨基酸的增加,则将测试化合物分类为候选化合物。在一些实施方案中,如果测量到丙酰肉碱的降低,则将测试化合物分类为候选化合物。
在其它实施方案中,使用无细胞的测定法来测定BCAT2的功能调节。在一些实施方案中,无细胞的测定法是酶偶联荧光测定法。在一些实施方案中,如果测量到L-谷氨酸的降低,则将测试化合物分类为候选化合物。在一些实施方案中,如果测量到α-酮戊二酸的降低,则将测试化合物分类为候选化合物。
在另一个实施方案中,本文提供了用于制备治疗有机酸血症的药剂的方法,所述方法包括:
鉴定候选化合物,其包括:
获得具有直接或间接结合BCAT2的能力的测试化合物;
(ii)测定BCAT2的功能调节;以及
(iii)如果检测到BCAT2活性降低、低活性或基本上无活性,则将测试化合物分类为候选化合物;以及
配制用于治疗有机酸血症的候选化合物。
在一些实施方案中,使用基于细胞的测定法来测定BCAT2的功能调节。在一些实施方案中,如果测量到支链氨基酸的增加,则将测试化合物分类为候选化合物。在一些实施方案中,如果测量到丙酰肉碱的降低,则将测试化合物分类为候选化合物。
在其它实施方案中,使用无细胞的测定法来测定BCAT2的功能调节。在一些实施方案中,无细胞的测定法是酶偶联荧光测定法。在一些实施方案中,如果测量到L-谷氨酸的降低,则将测试化合物分类为候选化合物。在一些实施方案中,如果测量到α-酮戊二酸的降低,则将测试化合物分类为候选化合物。
在一些实施方案中,有机酸血症可以选自所有形式的甲基丙二酸血症(MMA)、所有形式的丙酸血症(PA)、异戊酸血症、1型戊二酸尿症(GA1)、β-酮硫解酶缺乏症(BKT)、3-甲基巴豆酰基-CoA羧化酶缺乏症(3-MCC)、3-羟基-3-甲基戊二酰基-CoA裂解酶缺乏症(HMG)、3-甲基戊烯二酸血症或3-甲基戊二酰基-CoA水合酶缺乏症(MGA)、D-2-羟基戊二酸尿症(D2-HGA)、异丁酰基-CoA脱氢酶缺乏3-羟基异丁酸尿症(ICBD)、L-2-羟基-戊二酸尿症(L2HGA)、丙二酰基-CoA脱羧酶缺乏症也称为丙二酸血症(MA)、多羧化酶缺乏症(MCD,全羧化酶合成酶)和3-羟基异丁酰基-CoA水解酶缺乏症(HIBCH)。
在以下所附的描述中阐述本公开内容的细节。尽管与本文所述的方法和材料类似或等同的方法和材料可用于本公开内容的实践或测试,但现在描述示例性方法和材料。根据说明书和权利要求书,本公开内容的其它特征、目的和优点将是显而易见的。在说明书和所附权利要求书中,单数形式也包括复数,除非上下文另外明确规定。除非另外定义,否则本文使用的所有技术术语和科学术语具有与本公开内容所属领域的普通技术人员通常理解的相同含义。
附图说明
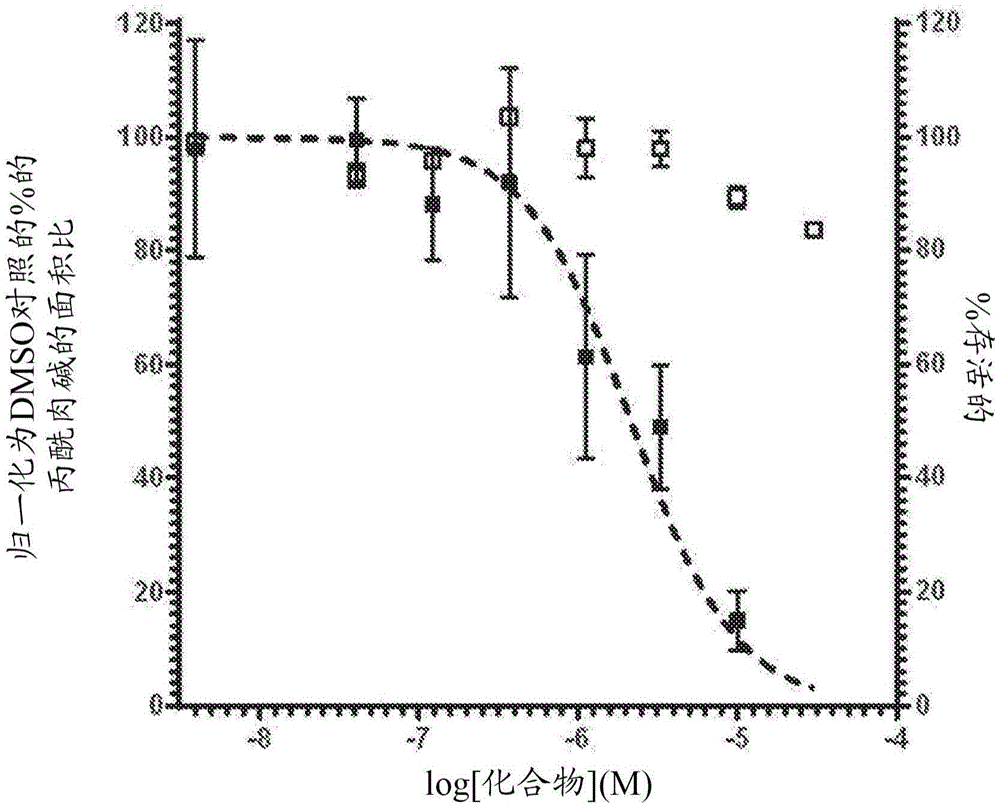
图1描绘了BCAT2抑制剂(式Ia化合物)对通过BCAA途径的通量和对下游代谢物(丙酰肉碱)的影响。结果表明,在增加浓度的BCAT2抑制剂化合物的存在下,丙酰肉碱水平被抑制,而且对细胞活力影响很小。
图2描绘了用各种剂量的BCAT2抑制剂化合物(30、100和300mg/kg,PO)处理6小时并在血浆收集前1小时接受氨基酸混合物的口服喂食的小鼠的血浆中的氨基酸水平。每个条表示平均值±S.E.M。(N=8-9/组)。与媒介物对照相比,*P<0.05、**P<0.01、***P<0.001。在每组直方图内,最左边的条描绘了媒介物血浆水平;左起第二个条描绘了30mg/kg血浆水平的BCAT2抑制剂化合物;左起第三个条描绘了100mg/kg血浆水平的BCAT2抑制剂化合物;并且最右边的条描绘了300mg/kg血浆水平的BCAT2抑制剂化合物。在图2中,条件的顺序是(左至右):媒介物、30mg.kg BCAT、100mg.kg BCAT和300mg.kg BCAT。
图3A至图3D描绘了(A)在9天BCAT2抑制剂化合物治疗(200mg/kg,PO,一天一次)和3天恢复阶段期间的体重监测。在研究期间小鼠能够自由地获取食物和水。第一次给药后5天,将一半动物的饮食转换为富含前体的食物。将另一半动物的饮食保持与正常饮食相同。在(B)第0天、(C)第9天和(D)第12天测量体重。每个条表示平均值±S.E.M。点代表各个值。对于图3B至图3D,在每组直方图中,左边的条代表媒介物给药,并且右边的条代表BCAT2抑制剂化合物给药。
图4A至图4B显示第9天小鼠的缬氨酸、异亮氨酸、亮氨酸和丝氨酸的血浆水平。用媒介物或BCAT2抑制剂化合物(200mg/kg,PO,一天一次)处理小鼠9天,并且在研究期间小鼠能够自由地获取食物和水。第一次给药后5天,将一半动物的饮食转换为富含前体的食物(B)。将另一半动物的饮食保持与正常饮食相同(A)。每个条表示平均值±S.E.M。点代表各个值。N=8/组。与媒介物对照相比,*P<0.05、**P<0.01。对于每组直方图,左边的条代表媒介物剂量,并且右边的条代表BCAT2抑制剂化合物剂量。
图5A至图5B描绘了给予正常饮食或富含前体的饮食的小鼠的第9天样品中的血浆(5A)和尿液(5B)氨基酸水平。图5A至图5B显示喂食富含前体的饮食导致BCAA的超负荷,使得这些氨基酸的肾排泄增加。在每组直方图中,左边的条代表正常饮食,并且右边的条代表富含前体的饮食。
具体实施方式
在一些实施方案中,本文提供了式(I)、(Ia)、(II)、(III)、(IV)、(V)、(VI)、(VII)的化合物及其它化合物。本文公开的化合物是BCAT2抑制剂。
本公开内容部分地基于以下发现:支链氨基酸(BCAA)代谢途径中的靶标的抑制可以用于鉴定将成功地降低患有有机酸血症的患者的底物毒性负荷的抑制剂。本公开内容还提供通过向有需要的患者施用本文公开的BCAT2抑制剂化合物降低毒性代谢物和/或底物分子的水平来治疗有机酸血症的方法。本公开内容部分地提供了通过向有需要的患者施用BCAT2抑制剂和氨基酸转运蛋白抑制剂(包括SLC6A19抑制剂)来治疗有机酸血症的方法。
在本公开内容的一些实施方案中,接受BCAT抑制剂化合物(例如,BCAT2抑制剂化合物)的患者还接受氨基酸转运蛋白抑制剂,包括SLC6A19(例如,氨基酸转运蛋白B0AT1)抑制剂,以便治疗和/或预防高氨基酸血症。在各种实施方案中,施用氨基酸转运蛋白抑制剂(包括SLC6A19抑制剂)降低了经受BCAT2抑制剂化合物治疗的患者的氨基酸负荷。
在一个方面,本公开内容提供了用于鉴定候选化合物是否可用于治疗有机酸血症的方法,其包含用于治疗有机酸血症的候选化合物,所述方法包括:(a)获得具有直接或间接结合BCAT(例如,BCAT2)的能力的测试化合物;(b)测定BCAT(例如,BCAT2)的功能调节;以及(c)如果检测到BCAT(例如,BCAT2)活性降低、低活性或基本上无活性,则将测试化合物分类为候选化合物。
在另一方面,本公开内容提供了用于制备治疗有机酸血症的药剂的方法,所述方法包括:(a)鉴定候选化合物,其包括:(i)获得具有直接或间接结合BCAT(例如,BCAT2)的能力的测试化合物;(ii)测定BCAT(例如,BCAT2)的功能调节;以及(iii)如果检测到BCAT(例如,BCAT2)活性降低、低活性或基本上无活性,则将测试化合物分类为候选化合物;以及(b)配制用于治疗有机酸血症的候选化合物。
在另一方面,本公开内容提供了用于治疗或预防有机酸血症的方法,其包括向有需要的个体施用有效量的本文公开的化合物。
在另一方面,本公开内容提供了用于治疗或预防有机酸血症的方法,其包括向有需要的个体施用有效量的选自表1的化合物。
在另一方面,本公开内容提供了用于降低支链氨基酸(BCAA)代谢物的方法,其包括向有需要的个体施用有效量的本文公开的化合物。
在另一方面,本公开内容提供了用于降低支链氨基酸(BCAA)代谢物的方法,其包括向有需要的个体施用有效量的选自表1的化合物。
在另一方面,本公开内容提供了减少患有有机酸血症的患者的细胞的毒性负荷负担的方法,其包括向有需要的个体施用有效量的本文公开的化合物。
在另一方面,本公开内容提供了减少患有有机酸血症的患者的细胞的毒性负荷负担的方法,其包括向有需要的个体施用有效量的选自表1的化合物。
表1.
在本公开内容的另一方面,化合物可以选自化合物106至化合物306及药物可接受的盐,如以上提供。
在一些实施方案中,本公开内容的方法还包括施用额外的治疗剂。在各种实施方案中,额外的治疗剂是氨基酸转运蛋白抑制剂,包括SLC6A19抑制剂。
在其它实施方案中,本公开内容提供了式(I)、(II)、(III)、(IV)、(V)、(VI)、(VII)的化合物或其中公开的任何化合物或其药物可接受的盐单独或与额外的治疗剂组合在制备可用于治疗或预防一种或多种有机酸血症的药物中的用途。
支链氨基酸代谢途径
不希望受任一种理论的束缚,目前认为抑制BCAA途径中的BCAT2步骤将导致循环中支链氨基酸的全身累积,从而防止在患有BCAA途径突变的患者(例如,具有一种或多种有机酸血症的患者)中不能处理的毒性代谢物的形成。因此,推测底物减少疗法将引起患者细胞的毒性负荷负担的降低,并且在减轻其症状方面具有革新性作用。根据FDA的罕用药计划,可以开发新的抑制剂作为罕见的有机酸血症患者的治疗剂。
支链氨基酸(BCAA)是亮氨酸、异亮氨酸和缬氨酸。它们共享共同的膜转运系统和酶用于它们的转氨作用和不可逆氧化作用。它们可以是生糖的(缬氨酸)、生酮的(亮氨酸和异亮氨酸)或两者兼有(异亮氨酸),因为它们的终产物琥珀酰基-CoA和/或乙酰基-CoA可以进入克雷布斯循环用于能量产生和糖异生,或者作为用于通过乙酰基-CoA和乙酰乙酸酯的脂肪生成和酮体产生的前体。特别地,亮氨酸在代谢中起重要作用,并参与多种信号传导途径。它是雷帕霉素复合物1的哺乳动物靶标和增强翻译延伸和蛋白质合成的下游靶标的有效刺激物。此外,亮氨酸可以经由与泛素-蛋白酶体和自噬-溶酶体系统的相互作用而作为肌肉蛋白分解的抑制剂。此外,亮氨酸刺激胰腺β-细胞分泌作为代谢燃料以及谷氨酸脱氢酶的变构激活剂的胰岛素。最后,它还在中枢神经系统食物摄取调节回路和进食行为中起作用。
酶BCAT(例如,线粒体型BCAT同工酶,或“BCATm”或“BCAT2”;或者细胞溶质型BCAT同工酶,或“BCATc”或“BCAT1”)经由依赖于磷酸吡哆醛的可逆转氨作用催化支链氨基酸分解代谢途径中的第一步。该第一步之后是由单一线粒体型支链α-酮酸脱氢酶(BCKDH)复合物对各自的酮酸进行不可逆的氧化脱羧和偶联硫酯化,以形成辅酶A衍生物。BCAA和支链α-酮酸(BCKA)的氧化主要在使BCAA参与氧化代谢的BCKD步骤中被严格调控。BCAA代谢途径的下一步是通过异戊酰基-CoA脱氢酶(亮氨酸代谢)或α-甲基-支链脱氢酶(异亮氨酸和缬氨酸代谢)使活化的酮酸脱氢。在这前三个步骤之后,每种BCAA的代谢分化(diverge)并最终产生乙酰基-CoA和/或丙酰基-CoA。末端缬氨酸代谢是独特的,因为在相应硫酯水解后形成游离酸,3-羟基异丁酸。3-羟基异丁酸被脱氢,然后被再酰化以完成代谢。
在各种实施方案中,本公开内容设想了向有需要的患者施用BCAT2抑制剂化合物的方法,所述方法引起对通过线粒体BCAA途径的代谢通量的调节(例如,在治疗之前或之后)。在各种实施方案中,本公开内容设想了向有需要的患者施用BCAT2抑制剂化合物的方法,所述方法引起对通过线粒体BCAA途径的代谢通量的降低(例如,在治疗之前或之后)。在各种实施方案中,本公开内容设想了向有需要的患者施用BCAT2抑制剂化合物的方法,所述方法引起对通过线粒体BCAA途径的分解代谢通量的调节(例如,在治疗之前或之后)。更具体地,在一些实施方案中设想了本公开内容的方法抑制和/或降低通过线粒体BCAA途径的BCAT2介导的通量。
例如,关于亮氨酸,当降低和/或抑制亮氨酸的代谢时可以发生BCAT2介导的通量的降低。在各种实施方案中,BCAA代谢途径中的一种或多种酶降低和/或抑制亮氨酸的代谢,所述酶选自支链α-酮酸脱氢酶(BCKDH)、异戊酰基CoA脱氢酶(IVD)、3-甲基巴豆酰基-CoA羧化酶(3MCC)、3-甲基戊二酸-CoA水合酶(3MGA)、3-羟基-3-甲基戊二酰基-CoA裂解酶(HMGL)、乙酰基-CoA羧化酶(AC)和丙二酰基-CoA脱羧酶(MA)。
在其它实施方案中,关于异亮氨酸,当降低和/或抑制异亮氨酸的代谢时发生BCAT2介导的通量的降低。在一些实施方案中,BCAA代谢途径中的一种或多种酶降低和/或抑制异亮氨酸的代谢,所述酶选自BCKDH、甲基丁酰基CoA脱氢酶(SBCAD)、水合酶、2-甲基-3-羟基异丁酸脱氢酶(MHBD)、乙酰乙酰基-CoA硫解酶(T2)、AC、MA、丙酰基-CoA羧化酶(PCC)、甲基丙二酰基-CoA变位酶(MUT)和琥珀酰基-CoA连接酶(SUCLA)。
在其它实施方案中,关于缬氨酸,当降低和/或抑制缬氨酸的代谢时发生BCAT2介导的通量的降低。在一些实施方案中,BCAA代谢途径中的一种或多种酶降低和/或抑制缬氨酸的代谢,所述酶选自BCKDH、异丁酰基-CoA脱氢酶(IBDH)、水合酶、3-羟基异丁酰基-CoA脱酰酶(水解酶)(HIBDA)、3-羟基异丁酸脱氢酶(HIBDH)、甲基丙二酸半醛脱氢酶(MMSDH)、PCC、MUT和SUCLA。
治疗有机酸血症的方法
在各个方面,本公开内容提供了用于治疗一种或多种有机酸血症的方法。在这些方面,“本公开内容的药剂”包括可用于单一疗法和组合疗法(例如,作为额外的治疗剂)的化合物。通常,单一疗法包括使用式I的化合物或其药物可接受的盐,而组合疗法包括式I的化合物或其药物可接受的盐与额外的治疗剂的组合,所述额外的治疗剂包括例如氨基酸转运蛋白的抑制剂,包括SLC6A19抑制剂。
在一些实施方案中,本公开内容设想,与不施用氨基酸转运蛋白的抑制剂(包括SLC6A19抑制剂)的治疗相比,施用额外的治疗剂(例如氨基酸转运蛋白的抑制剂,包括SLC6A19抑制剂)降低了支链氨基酸的升高的水平。在各种实施方案中,施用氨基酸转运蛋白抑制剂,包括SLC6A19抑制剂(例如,单独或与本文所述的BCAT2抑制剂化合物组合)可以减少由根据本公开内容的方法的BCAT2抑制而引起的高氨基酸血症。
如本文所用,有机酸血症的特征在于一组遗传性代谢病症,其破坏正常的氨基酸代谢,特别是支链氨基酸代谢,引起通常不存在的酸的积聚。
在一些实施方案中,有机酸血症选自所有形式的甲基丙二酸血症(MMA)、所有形式的丙酸血症(PA)、异戊酸血症、1型戊二酸尿症(GA1)、β-酮硫解酶缺乏症(BKT)、3-甲基巴豆酰基-CoA羧化酶缺乏症(3-MCC)、3-羟基-3-甲基戊二酰基-CoA裂解酶缺乏症(HMG)、3-甲基戊烯二酸血症或3-甲基戊二酰基-CoA水合酶缺乏症(MGA)、D-2-羟基戊二酸尿症(D2-HGA)、异丁酰基-CoA脱氢酶缺乏3-羟基异丁酸尿症(ICBD)、L-2-羟基-戊二酸尿症(L2HGA)、丙二酰基-CoA脱羧酶缺乏症也称为丙二酸血症(MA)、多羧化酶缺乏症(MCD,全羧化酶合成酶)和3-羟基异丁酰基-CoA水解酶缺乏症(HIBCH)。
在各种实施方案中,有机酸血症是甲基丙二酸血症或丙酸血症。
对BCAA分解代谢途径的一种或多种组分的突变可以引起一种或多种有机酸血症。例如,在整个BCAA途径中起作用的各种酶或组分可以发生突变,导致有机酸血症的表现。在一些实施方案中,亮氨酸的BCAA代谢途径包括可以发生突变的酶或组分,包括一种或多种的支链α-酮酸脱氢酶(BCKDH)、异戊酰基CoA脱氢酶(IVD)、3-甲基巴豆酰基-CoA羧化酶(3MCC)、3-甲基戊烯二酸-CoA水合酶(3MGA)、3-羟基-3-甲基戊二酰基-CoA裂解酶(HMGL)、乙酰基-CoA羧化酶(AC)和丙二酰基-CoA脱羧酶(MA)。在一些实施方案中,异亮氨酸的BCAA代谢途径包括可以发生突变的酶或组分,包括一种或多种的BCKDH、甲基丁酰基CoA脱氢酶(SBCAD)、水合酶、2-甲基-3-羟基异丁酸脱氢酶(MHBD)、乙酰乙酰基-CoA硫解酶(T2)、AC、MA、丙酰基-CoA羧化酶(PCC)、甲基丙二酰基-CoA变位酶(MUT)和琥珀酰基-CoA连接酶(SUCLA)。在其它实施方案中,缬氨酸的BCAA代谢途径包括可以发生突变的酶或组分,包括一种或多种的BCKDH、异丁酰基-CoA脱氢酶(IBDH)、水合酶、3-羟基异丁酰基-CoA脱酰酶(水解酶)(HIBDA)、3-羟基异丁酸脱氢酶(HIBDH)、甲基丙二酸半醛脱氢酶(MMSDH)、PCC、MUT和SUCLA。
支链氨基酸代谢途径的病症还描述于Manoli和Venditti的Disorders of branched chain amino acid metabolism,Translational Science of Rare Diseases 1(2016)91-110和Schiff等人,J.M.Saudubray等人(编辑)的Branched-chain Organic Acidurias Inborn Metabolic Diseases,Springer Verlag Berlin(279-294)2016,两者通过援引据此整体并入。
在一些实施方案中,有机酸血症选自一种或多种的枫糖尿病:Ia型;枫糖尿病:Ib型;枫糖尿病:II型;枫糖尿病:轻度变体型;异戊酸血症;3-甲基巴豆酰基-CoA羧化酶缺乏症;3-甲基巴豆酰基-CoA羧化酶2缺乏症;3-甲基戊烯二酸尿症I型;3-甲基戊烯二酸尿症II型:巴氏综合征;3-甲基戊烯二酸尿症III型:Costeff综合征;3-甲基戊烯二酸尿症IV型:“未分类”;3-甲基戊烯二酸尿症V型;3-甲基戊烯二酸尿症VI型:失聪、脑病、Leigh样综合征;3-甲基戊烯二酸尿症VII型:白内障、神经系统受累和中性粒细胞减少症;3-羟基-3-甲基戊二酰基-CoA裂解酶缺乏症;2-甲基-3-羟基丁酰基-CoA脱氢酶缺乏症;线粒体短链烯酰基-CoA水合酶-1缺乏症;甲基丁酰基-CoA脱氢酶缺乏症;线粒体乙酰乙酰基-CoA硫解酶缺乏症;异丁酰基-CoA脱氢酶缺乏症;3-羟基异丁酰基-CoA脱酰酶缺乏症;3-羟基异丁酸尿症;甲基丙二酸半醛脱氢酶缺乏症;丙酸血症、甲基丙二酸血症:Mut亚型;甲基丙二酸血症:钴胺素A;甲基丙二酸血症:钴胺素B;和甲基丙二酸血症:钴胺素D。
在各种实施方案中,本公开内容的方法设想降低由BCAA代谢途径产生的毒性底物代谢物的水平。毒性底物代谢物可以包括但不限于丙酸、2-甲基柠檬酸、3-羟基丙酸、丙酰基-CoA、甲基丙二酸、甲基丙二酰基-CoA和异戊酸。
甲基丙二酸血症
甲基丙二酸血症(“MMA”)是由线粒体定域酶甲基丙二酰基-CoA变位酶(MUT)的缺陷而引起的常染色体隐性病症。MMA的估计发病率为25,000至48,000分之一。MUT是催化L-甲基丙二酰基-CoA转化为琥珀酰基-CoA的酶。该反应是代谢由肠道菌群产生的支链氨基酸、奇数链脂肪酸、胆固醇和丙酸酯所需的几种酶促反应之一。MUT缺陷是单纯型MMA最常见的原因,其特征在于甲基丙二酸和其它毒性代谢物的积累。MMA与代谢不稳定、癫痫发作、胰腺炎、中风和肾衰竭有关,并且即使当患者被适当地处理时,它也可能是致命的,这强调了对该疾病的新疗法的需求。目前的MMA治疗包括但不限于饮食限制、肝移植、联合的肝和肾移植以及肝定向基因疗法。
MUT酶需要腺苷钴胺素(Ado-Cbl)作为辅酶。因此,甲基丙二酸代谢不可避免地与维生素B12(钴胺素),其适当的摄入和正确的摄取、转运和细胞内代谢有关。cblA、cblB和cblD的变体2形式互补组与Ado-Cbl合成独特的过程有关。cblC、cblD、cblF、cblJ互补组也与有缺陷的甲基钴胺素合成有关。合并型MMA和同型半胱氨酸尿症(钴胺素C(cblC)型)是钴胺素代谢的最常见病症。CblC通常在新生儿期出现神经退化、发育不良、血细胞减少和多系统病理,包括肾和肝功能障碍。
丙酸血症
相关病症丙酸血症(“PA”)是由丙酰基CoA羧化酶α亚基(PCCA)或丙酰基CoA羧化酶β亚基(PCCB)的丙酰基CoA羧化酶(“PCC”)缺陷引起的常染色体隐性病症。PCC在受到PCCA或PCCB缺陷影响的个体中是无活性的。患有PA的患者不能代谢由肠道菌群产生的支链氨基酸、奇数链脂肪酸、胆固醇和丙酸酯。该情况导致被称为有机酸的特定酸如丙酸、2-甲基柠檬酸和3-羟基丙酸的异常积聚。因此,被称为丙酰基CoA的物质及其它潜在有害化合物可以在体内积累至毒性水平。这种积累损害脑、神经系统和心脏,引起与PA相关的严重健康问题。PA与代谢不稳定、癫痫发作、胰腺炎、中风和发展高氨血症的倾向有关。PA治疗包括但不限于饮食限制、肝移植以及肝定向基因疗法。如MMA,即使当患者被适当地处理时,PA也可能是致命的。
枫糖尿病
枫糖尿病(“MSUD”)是罕见的遗传性病症,其特征在于分解(代谢)三种支链氨基酸所需的某些酶(例如,支链α-酮酸脱氢酶复合物)的缺乏。在经典的重型MSUD中,BCAA的血浆浓度在出生的几个小时内开始升高。如果未治疗,通常在生命的最初24-48小时内开始出现症状。典型MSUD与嗜睡和/或易怒、进行性脑病、角弓反张和昏迷有关。中度MSUD与代谢性脑病伴应激反应、厌食症和生长不良有关。间歇型MSUD与正常的早期发育、与应激反应有关的发作性危险有关。III型,E3缺乏型MSUD与Leigh型脑病、乳酸酸中毒有关,并且通常是致命的。
本公开内容的化合物
在各个方面,本公开内容提供了候选化合物的鉴定和用途。在提供候选化合物的鉴定和用途的实施方案中,候选化合物可以是化学品、分子、化合物、生物(例如抗体或肽)、药物、前药、细胞疗法、低分子量合成化合物或小分子药物。在一些实施方案中,候选化合物选自本领域已知的化合物库。在一些实施方案中,候选化合物可用于治疗有机酸血症和/或预防有机酸血症。
在一些实施方案中,本文提供了式(I)的化合物或其药物可接受的盐:
其中
Z可以是CH2、CF2、O或键;
J1、J2、J3和J4中的每一个可以独立地是CH或N;
X1可以是N或CR5A;
X2可以是N或CR5B;
R1可以是C1-C6烷基、-NR3S(O)R4、-NR3SO2R4、-NR3C(O)R4、-C(O)(CH2)mNR3R4、C6-C10芳基、5-10元杂芳基或(5-10元杂芳基)-C1-C6烷基;
R2可以是-NR6R7、C1-C6烷基、C3-C8环烃基、C6-C10芳基或5-10元杂芳基,其中每个芳基或杂芳基任选地被一个、两个或三个取代基R2’取代,所述取代基R2’独立地选自卤素、-CN、-NO2、C1-C6烷基、C1-C6烷氧基、卤代C1-C6烷基、卤代C1-C6烷氧基、C2-C6烯基、C2-C6炔基、-C(O)NR6R7、-C(O)R6、-NR6R7、-NR6C(O)R7、-OH、-S-(卤代C1-C6烷基)、C6-C10芳基和5-10元杂环基;或者两个R2’取代基与它们连接的原子一起形成各自任选地被卤素取代的5元杂环基或C3-C8环烃基;
R3可以是H或C1-C6烷基;
R4可以是H、C1-C6烷基、C2-C6烯基、C6-C10芳基或5-10元杂芳基,其中每个芳基或杂芳基任选地被一个、两个或三个取代基R4’取代,所述取代基R4’独立地选自卤素、-CN、-NO2、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、C2-C6烯基、C3-C8环烃基、C6-C10芳基、-(CH2)qNR8C(O)R9、-C(O)NR8R9、-C(O)OR9、-C(O)R9和5-10元杂环基;
R5A可以是H、卤素、-CN、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、-(CH2)rOH、-C(O)NR8R9、-NR8COR9、5-10元杂芳基、-C(O)R8或-C(O)OR8;
R5B可以是H、卤素、-CN、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、-(CH2)rOH、-C(O)NR8R9、-NR8COR9、5-10元杂芳基、-C(O)R8或-C(O)OR8;
或者R5A和R5B与它们连接的原子一起可以形成任选地被氧基取代的6元杂环基环;
R6和R7可以独立地是H、C1-C6烷基或C3-C8环烃基;
每个R8可以独立地是H、C1-C6烷基或C3-C8环烃基;
每个R9可以独立地是H、C1-C6烷基、C2-C6烯基或C3-C8环烃基;
m可以是0或1;
q可以是0或1;以及
r可以是0或1。
在一些实施方案中,R5A不是氢。
在一些实施方案中,R5B不是氢或-C(O)NR8R9。
在一些实施方案中,R2不是未取代的芳基或未取代的杂芳基。在一些实施方案中,R2不是被一个-S-C1-C6烷基取代的芳基。在一些实施方案中,R2不是被一个C1-C6烷基取代的5-10元杂芳基。
在一些实施方案中,式(I)的化合物不选自:
及其药物可接受的盐和立体异构体。
在一些实施方案中,Z可以是CH2。在其它实施方案中,Z可以是CF2。在又一个实施方案中,Z可以是O。在又另一个实施方案中,Z可以是键。
在一些实施方案中,J1可以是CH。在其它实施方案中,J1可以是N。
在一些实施方案中,J2可以是CH。在其它实施方案中,J2可以是N。
在一些实施方案中,J3是CH。在其它实施方案中,J3可以是N。
在一些实施方案中,J4可以是CH。在其它实施方案中,J4可以是N。
在一些实施方案中,X1可以是N。在其它实施方案中,X1可以是CR5A。
在一些实施方案中,X2可以是N。在其它实施方案中,X2可以是CR5B。
在一些实施方案中,J2可以是N并且X1可以是N。在其它实施方案中,J2可以是N并且J3可以是N。在又一个实施方案中,J2可以是N并且J4可以是N。在又另一个实施方案中,J2可以是N并且X2可以是N。在一些实施方案中,J2、J3和J4中的每一个可以是CH;X1可以是CR5A;并且X2可以是CR5B。
在一些实施方案中,R1可以是NR3C(O)R4。在其它实施方案中,R1可以是-C(O)(CH2)mNR3R4。
在一些实施方案中,R3可以是氢。在其它实施方案中,R3可以是C1-6烷基。
在一些实施方案中,R4可以是各自任选地被一个、两个或三个取代基R4’取代的C6-10芳基或5-10元杂芳基。在一些实施方案中,R4可以选自各自可以任选地被一个、两个或三个取代基R4’取代的苯基、噻吩、噁唑、异噁唑、噻唑、呋喃和吡咯,其中每个R4可以独立地选自-F、-Cl、-Br、-CN、-NO2、-CF3、-CH3、-CH(CH3)2、-C(O)CH3、-C(O)OCH3、苯基、环丙基和吗啉基。
在一些实施方案中,m可以是0。在其它实施方案中,m可以是1。
在一些实施方案中,R2可以是各自任选地被一个、两个或三个取代基R2’取代的C6-10芳基或5-10元杂芳基。在一些实施方案中,R2可以选自各自可以任选地被一个、两个或三个取代基R2’取代的苯基、吡啶、嘧啶、哒嗪、吡嗪、咪唑或噻吩,其中每个R2’可以独立地选自-F、-Cl、-Br、-CN、NO2、-CH3、-CF2H、-C≡CH、-C(O)H、-CONH2、-C(O)NHCH3、-OH、-OCH3、-OCF3、-SCF3、-NH2、-NHC(O)CH3和吗啉。
在一些实施方案中,X2可以是CR5B并且R5B可以是-C(O)NR8R9。在其它实施方案中,X2可以是CR5B并且R5B可以是卤素、-CN、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、-(CH2)rOH、-NR8COR9、5-10元杂芳基、-C(O)R8或-C(O)OR8。在又一个实施方案中,X2可以是CR5B并且R5B可以是-NR8COR9。在一些实施方案中,X2可以是CR5B并且R5B可以是-C(O)OR8。在一些实施方案中,X2可以是CR5B并且R5B可以是-CF3、-COCH3、-CH2OH、-CN或四唑。
在一些实施方案中,R8可以是氢。在其它实施方案中,R8可以是-C1-6烷基。
在一些实施方案中,R9可以是氢。在其它实施方案中,R9可以是-C1-6烷基。
在一些实施方案中,本文提供了具有式(Ia)的结构的式(I)的化合物或其药物可接受的盐:
其中
R1可以是C1-C6烷基、-NR3S(O)R4、-NR3SO2R4、-NR3C(O)R4、-C(O)(CH2)mNR3R4、C6-C10芳基或5-10元杂芳基;
R2可以是C1-C6烷基、C6-C10芳基或5-10元杂芳基;
R4可以是C6-C10芳基或5-10元杂芳基;
R5B可以是-C(O)NR8R9;以及
R8和R9独立地是H、C1-C6烷基或C3-C8环烃基。
在一些实施方案中,本文提供了式(Ia)的化合物或其药物可接受的盐,其中:
R1可以是-NR3SO2R4或-NR3C(O)R4;
R2可以是芳基或5-10元杂芳基;
R3可以是H或C1-C6烷基;
R4可以是C6-C10芳基或5-10元杂芳基;
R5B可以是-C(O)NR8R9;以及
R8和R9可以独立地是H或C1-C6烷基。
在一些实施方案中,本文提供了式(Ia)的化合物或其药物可接受的盐,其中:
R1是-NR3C(O)R4;
R2是C6-C10芳基或5-10元杂芳基;
R3是H或甲基;
R4是C6-C10芳基或5-10元杂芳基;
R5B是-C(O)NR8R9;以及
R8和R9独立地是H或C1-C6烷基。
在一些实施方案中,本文提供了式(Ia)的化合物或其药物可接受的盐,其中:
R1是-NR3C(O)R4;
R2是C6-C10芳基或5-10元杂芳基;
R3是H或甲基;
R4是C6-C10芳基或5-10元杂芳基;
R5是-C(O)NR8R9;以及
R8和R9独立地是H或甲基。
在一些实施方案中,本公开内容的化合物可以是
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(2-(甲硫基)苯基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-苯基-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-2-(吡啶-3-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-2-(吡啶-4-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(噻吩-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(噻吩-3-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(2-甲基噻唑-4-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(噻唑-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(1H-吡唑-3-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-氰基噻吩-2-甲酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-氯噻吩-2-甲酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-甲基噻吩-2-甲酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴-N-甲基噻吩-2-甲酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-((5-溴噻吩)-2-磺酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
2-溴-N-(3-(5-(甲基氨基甲酰基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-1-基)环己基)噻唑-5-甲酰胺、
1-(3-(5-溴-1-甲基-1H-吡咯-2-甲酰氨基)环己基)-N-甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(4-溴-1H-吡咯-2-甲酰氨基)环己基)-N-甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
3-氯-N-(3-(5-(甲基氨基甲酰基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-1-基)环己基)异噁唑-5-甲酰胺、
5-溴-N-(3-(2-(吡啶-2-基)-1H-苯并[d]咪唑-1-基)环己基)噻吩-2-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N,N-二甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-环丙基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺、以及
1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-异丙基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺;或其药物可接受的盐。
在其它实施方案中,本文提供了具有式(II)的结构的式(I)的化合物:
或其药物可接受的盐,其中
R2可以是C6-C10芳基或5-10元杂芳基,其中每个芳基或杂芳基可以任选地被一个、两个或三个取代基R2’取代,所述取代基R2’独立地选自卤素、-CN、-NO2、C1-C6烷基、C1-C6烷氧基、卤代C1-C6烷基、卤代C1-C6烷氧基、C2-C6烯基、C2-C6炔基、-C(O)NR6R7、-C(O)R6、-NR6R7、-NR6C(O)R7、-OH、-S-(卤代C1-C6烷基)、C6-C10芳基和5-10元杂环基;或者两个R2’取代基与它们连接的原子一起可以形成各自任选地被卤素取代的5元杂环基或C3-C8环烃基;
R4可以是任选地被一个、两个或三个取代基R4’取代的5-10元杂芳基,所述取代基R4’独立地选自卤素、-CN、-NO2、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、C2-C6烯基、C3-C8环烃基、C6-C10芳基、-(CH2)qNR8C(O)R9、-C(O)NR8R9、-C(O)OR9、-C(O)R9和5-10元杂环基;以及
R5B可以是-C(O)NR8R9。
在一些实施方案中,R2可以是任选地被一个、两个或三个取代基R2’取代的苯基,所述取代基R2’独立地选自卤素、-CN、-NO2和C1-C6烷基。在其它实施方案中,R2是任选地被一个、两个或三个取代基R2’取代的5-10元杂芳基,所述取代基R2’独立地选自卤素、-CN、-NO2和C1-C6烷基。
在一些实施方案中,R4可以是任选地被卤素或苯基取代的噻吩。
在其它实施方案中,本文提供了具有式(III)的结构的式(I)的化合物:
或其药物可接受的盐
其中
每个J3和J4独立地是CH或N;
X1是N或CR5A;
X2是N或CR5B;
其中J3、J4、X1和X2中的一个、两个、三个或四个是N;
R2是C6-C10芳基或5-10元杂芳基,其中每个芳基或杂芳基任选地被一个、两个或三个取代基R2’取代,所述取代基R2’独立地选自卤素、-CN、-NO2、C1-C6烷基、C1-C6烷氧基、卤代C1-C6烷基、卤代C1-C6烷氧基、C2-C6烯基、C2-C6炔基、-C(O)NR6R7、-C(O)R6、-NR6R7、-NR6C(O)R7、-OH、-S-(卤代C1-C6烷基)、C6-C10芳基和5-10元杂环基;或者两个R2’取代基与它们连接的原子一起形成各自任选地被卤素取代的5元杂环基或C3-C8环烃基;以及
R4是H、C1-C6烷基、C2-C6烯基、C6-C10芳基或5-10元杂芳基,其中每个芳基或杂芳基任选地被一个、两个或三个取代基R4’取代,所述取代基R4’独立地选自卤素、-CN、-NO2、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、C2-C6烯基、C3-C8环烃基、C6-C10芳基、-(CH2)qNR8C(O)R9、-C(O)NR8R9、-C(O)OR9、-C(O)R9和5-10元杂环基。
在一些实施方案中,R2可以是任选地被一个、两个或三个取代基R2’取代的苯基,所述取代基R2’独立地选自卤素、-CN、-NO2和C1-C6烷基。在其它实施方案中,R2是任选地被一个、两个或三个取代基R2’取代的5-10元杂芳基,所述取代基R2’独立地选自卤素、-CN、-NO2和C1-C6烷基。
在一些实施方案中,R4可以是任选地被卤素或苯基取代的噻吩。
在一些实施方案中,X2可以是CR5B;R5B可以选自氢、-卤素、-C(O)NR8R9、-NR8COR9或-C(O)OR8;以及R8和R9可以各自独立地是H或C1-C6烷基。
在其它实施方案中,本文提供了具有式(IV)的结构的式(I)的化合物:
或其药物可接受的盐,其中
R1是C1-C6烷基、-NR3C(O)R4、-C(O)(CH2)mNR3R4、C6-C10芳基、5-10元杂芳基或(5-10元杂芳基)-C1-C6烷基;以及
R2是-NR6R7、C1-C6烷基、C3-C8环烃基、C6-C10芳基或5-10元杂芳基,其中每个芳基或杂芳基被一个、两个或三个取代基R2’取代,所述取代基R2’独立地选自卤素、-CN、-NO2、C1-C6烷氧基、卤代C1-C6烷基、卤代C1-C6烷氧基、C2-C6烯基、C2-C6炔基、-C(O)NR6R7、-C(O)R6、-NR6R7、-NR6C(O)R7、-OH、C6-C10芳基和5-10元杂环基;或者两个R2’取代基与它们连接的原子一起形成各自任选地被卤素取代的5元杂环基或C3-C8环烃基。
在又一个实施方案中,本文提供了具有式(V)的结构的式(I)的化合物:
或其药物可接受的盐
其中
R5A是卤素、-CN、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、-(CH2)rOH、-C(O)NR8R9、-NR8COR9、5-10元杂芳基、-C(O)R8或-C(O)OR8;
R5B是H、卤素、-CN、C1-C6烷基、卤代C1-C6烷基、C1-C6烷氧基、-(CH2)rOH、-C(O)NR8R9、-NR8COR9、5-10元杂芳基、-C(O)R8或-C(O)OR8;以及
或者R5A和R5B与它们连接的原子一起形成任选地被氧基取代的6元杂环基环。
在又一个实施方案中,本文提供了具有式(VI)的结构的式(I)的化合物:
或其药物可接受的盐。
在又其他实施方案中,本文提供了具有式(VII)的结构的式(I)的化合物或其药物可接受的盐:
在又其他实施方案中,本文提供了选自如上所述的化合物106至化合物306及其药物可接受的盐的化合物。
可以为游离碱的形式的本公开内容的化合物可以以药物可接受的盐的形式从反应混合物中分离。药物可接受的盐还可以通过用有机酸或无机酸处理本文公开的化合物的游离碱获得,所述有机酸或无机酸例如是氯化氢、溴化氢、碘化氢、硫酸、磷酸、乙酸、丙酸、乙醇酸、马来酸、丙二酸、甲磺酸、富马酸、琥珀酸、酒石酸、柠檬酸、苯甲酸和抗坏血酸。
当本文公开的化合物具有至少一个手性中心时,其可作为单独的对映体和非对映体存在或作为此类异构体的混合物(包括外消旋体)存在。通过应用多种本领域从业者所熟知的方法来实现分离单独的异构体或选择性合成单独的异构体。除非另外指出,否则所有此类异构体及其混合物均包括在本文公开的化合物的范围内。此外,本文公开的化合物可以以一种或多种结晶形式或无定形形式存在。除非另外指出,否则所有此类形式(包括任何多晶形式)均包括在本文公开的化合物的范围内。此外,本文公开的一些化合物可以与水形成溶剂化物(即,水合物)或者与常见有机溶剂形成溶剂化物。除非另外指出,否则此类溶剂化物包括在本文公开的化合物的范围内。
技术人员应认识到,本文描述的一些结构可以是化合物的共振形式或互变异构体,其可以由其他化学结构清楚地表示,即使在动力学上亦如此;技术人员认识到,此类结构仅可以表示此类化合物很小一部分的样品。尽管本文并未表示出此类共振形式或互变异构体,但认为此类化合物在所述结构的范围内。
同位素可以存在于所述化合物中。化合物结构中表示的每种化学元素可以包括所述元素的任何同位素。同位素可以是碳、氯、氟、氢、碘、氮、氧、磷、硫和锝的同位素,包括11C、13C、14C、36Cl、18F、2H、3H、123I、125I、13N、15N、15O、17O、18O、31P、32P、35S和99mTc。例如,在化合物结构中,氢原子可以明确地公开或理解为存在于该化合物中。氢原子可以存在于化合物的任何位置处,氢原子可以是氢的任何同位素,包括但不限于氢-1(氕)和氢-2(氘)。因此,除非上下文另外明确规定,否则本文提及的化合物涵盖所有可能的同位素形式。
化学合成方法
包括在本公开内容中的化合物可以通过有机化学领域中熟知的方法制备。参见,例如,March,Advanced Organic Chemistry,4th Edition,John Wiley&Sons,2001。在合成顺序期间,可能必需和/或期望保护任何有关分子上的敏感基团或反应性基团。这通过常规的保护基团来实现,例如在Greene and Wutts,Protective Groups in Organic Synthesis,3rd Edition,John Wiley&Sons,1999中描述的那些。任选地在方便的后续阶段使用本领域熟知的方法去除保护基团。
如果需要,任选地使用常规技术分离和纯化反应产物,但不限于过滤、蒸馏、结晶、色谱法等。这样的材料任选地使用常规手段表征,包括物理常数和光谱数据的测量。
化合物的合成方法由以下一般方案表示。详细的合成方法可以发现于实施例部分。
化合物的其它合成方法由以下一般方案表示。详细的合成方法可以发现于实施例部分。
鉴定候选化合物的方法
本公开内容部分地提供了用于鉴定候选化合物是否可用于治疗有机酸血症的方法,其包含用于治疗有机酸血症的候选化合物,所述方法包括:(a)获得具有直接或间接结合BCAT(例如,BCAT2)的能力的测试化合物;(b)测定BCAT(例如,BCAT2)的功能调节;以及(c)如果检测到BCAT(例如,BCAT2)活性降低、低活性或基本上无活性,则将测试化合物分类为候选化合物。
在各种实施方案中,本公开内容设想使用各种测定法来分类候选化合物以用于BCAT2的功能调节。例如,可以使用基于细胞的测定法来测定BCAT2的功能调节。在一些实施方案中,如果测量到支链氨基酸的增加,则将测试化合物分类为候选化合物。在一些实施方案中,如果测量到丙酰肉碱的降低,则将测试化合物分类为候选化合物。
在其它实施方案中,使用无细胞的测定法来测定BCAT2的功能调节。在各种实施方案中,无细胞的测定法是酶偶联荧光测定法。例如,本公开内容预期使用一种测定法,所述测定法通过将hBCATm活性与两种另外的酶(L-谷氨酸氧化酶(L-GOx)和辣根过氧化物酶(HRP))偶联来监测由支链氨基酸和α-酮戊二酸产生L-谷氨酸。具体地,L-GOx分解代谢L-谷氨酸以产生α-酮戊二酸和HRP,后者被HRP利用并导致由氧化还原敏感染料Amplex Red形成荧光试卤灵。在一些实施方案中,如果测量到L-谷氨酸的降低,则将测试化合物分类为候选化合物。在其它实施方案中,如果测量到α-酮戊二酸的降低,则将测试化合物分类为候选化合物。
用于制备本公开内容的药剂的方法
本公开内容提供了用于制备治疗有机酸血症的药剂的方法,所述方法包括:(a)鉴定候选化合物,其包括:(i)获得具有直接或间接结合BCAT(例如,BCAT2)的能力的测试化合物;(ii)测定BCAT(例如,BCAT2)的功能调节;以及(iii)如果检测到BCAT(例如,BCAT2)活性降低、低活性或基本上无活性,则将测试化合物分类为候选化合物;以及(b)配制用于治疗有机酸血症的候选化合物。
药物可接受的盐和赋形剂
本文所述的任何药剂可以具有可与无机酸或有机酸反应的足够碱性的官能团,或者可与无机碱或有机碱反应的羧基基团,以形成药物可接受的盐。药物可接受的酸加成盐由药物可接受的酸形成,如本领域熟知。这样的盐包括在Journal of Pharmaceutical Science,66,2-19(1977)和The Handbook of Pharmaceutical Salts;Properties,Selection,and Use.P.H.Stahl和C.G.Wermuth(编辑),Verlag,Zurich(Switzerland)2002中列出的药物可接受的盐,上述文献通过援引据此整体并入。
药物可接受的盐包括,作为非限制性实例,硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐、乳酸盐、水杨酸盐、酸式柠檬酸盐、酒石酸盐、油酸盐、鞣酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡糖酸盐、葡糖醛酸盐、糖酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐、樟脑磺酸盐、双羟萘酸盐、苯乙酸盐、三氟乙酸盐、丙烯酸盐、氯苯甲酸盐、二硝基苯甲酸盐、羟基苯甲酸盐、甲氧基苯甲酸盐、甲基苯甲酸盐、邻乙酰氧基苯甲酸盐、萘-2-苯甲酸盐、异丁酸盐、苯基丁酸盐、α-羟基丁酸盐、丁炔-1,4--二甲酸盐、己炔-1,4-二甲酸盐、癸酸盐、辛酸盐、肉桂酸盐、乙醇酸盐、庚酸盐、马尿酸盐、苹果酸盐、羟基马来酸盐、丙二酸盐、扁桃酸盐、甲磺酸盐、烟酸盐、邻苯二甲酸盐、对苯二甲酸盐、丙炔酸盐、丙酸盐、苯基丙酸盐、癸二酸盐、辛二酸盐、对溴苯磺酸盐、氯苯磺酸盐、乙基磺酸盐、2-羟乙基磺酸盐、甲基磺酸盐、萘-1-磺酸盐、萘-2-磺酸盐、萘-1,5-磺酸盐、二甲苯磺酸盐和酒石酸盐。
术语“药物可接受的盐”还指具有酸性官能团(例如羧酸官能团)和碱的本公开内容的化合物的盐。合适的碱包括但不限于碱金属(例如钠、钾和锂)的氢氧化物;碱土金属(例如钙和镁)的氢氧化物;其它金属(例如铝和锌)的氢氧化物;氨和有机胺,例如未取代的或羟基取代的单烷基胺、二烷基胺或三烷基胺,二环己基胺;三丁基胺;吡啶;N-甲胺、N-乙胺;二乙胺;三乙胺;单-、双-或三-(2-OH-低级烷基胺),例如单-、双-或三-(2-羟乙基)胺、2-羟基-叔丁基胺或三-(羟甲基)甲胺;N,N-二-低级烷基-N-(羟基-低级烷基)-胺,例如N,N-二甲基-N-(2-羟乙基)胺或三-(2-羟乙基)胺;N-甲基-D-葡糖胺;以及氨基酸,例如精氨酸、赖氨酸等。
在一些实施方案中,本公开内容的药剂呈药物可接受的盐形式或是药物可接受的盐。在一些实施方案中,药物可接受的盐是钠盐。
此外,本文所述的任何药剂可以作为包含药物可接受的载体或媒介物的组合物的组分施用于个体。此类组合物可以任选地包含适量的药物可接受的赋形剂以提供适当的施用形式。
药物赋形剂可以是液体,例如水和油,包括石油、动物、植物或合成来源的那些,例如花生油、大豆油、矿物油、芝麻油等。药物赋形剂可以是盐水、阿拉伯胶、明胶、淀粉糊、滑石、角蛋白、胶态二氧化硅、尿素等。此外,可以使用助剂、稳定剂、增稠剂、润滑剂和着色剂。在一个实施方案中,药物可接受的赋形剂在施用于个体时是无菌的。当静脉内施用本文所述的任何药剂时,水是有用的赋形剂。盐水溶液和右旋糖水溶液和甘油溶液也可以用作液体赋形剂,特别是用于可注射溶液。合适的药物赋形剂还包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂奶粉、甘油、丙二醇、乙二醇、水、乙醇等。如果需要,本文所述的任何药剂还可以包括少量的湿润剂或乳化剂,或pH缓冲剂。
制剂、施用和给药
本文所述的任何药剂可以口服施用。此类药剂还可以通过任何其它方便的途径施用,例如通过静脉内输注或推注,通过上皮或粘膜皮肤内衬(例如,口腔粘膜、直肠和肠道粘膜等)吸收,并且可以与其它生物活性剂一起施用。施用可以是全身的或局部的。各种递送系统是已知的,例如包封在脂质体、微粒、微胶囊、胶囊等中,并且可用于施用。
在具体实施方案中,可能需要局部施用于需要治疗的区域。
在另一个实施方案中,可以在囊泡中,特别是在脂质体中递送(参见Langer,1990,Science 249:1527-1533;Treat等人,in Liposomes in the Therapy of Infectious Disease and Cancer,Lopez-Berestein and Fidler(eds.),Liss,New York,pp.353-365(1989))。在又一个实施方案中,可以在控制释放系统中递送。在一个实施方案中,可以使用缓慢释放的眼内装置。在一些实施方案中,该装置由局部递送的可溶蚀或非可溶蚀液体、凝胶、聚合物等组成。
在另一个实施方案中,可以使用聚合物材料(参见Medical Applications of Controlled Release,Langer and Wise(eds.),CRC Pres.,Boca Raton,Florida(1974);Controlled Drug Bioavailability,Drug Product Design and Performance,Smolen和Ball(编著),Wiley,New York(1984);Ranger和Peppas,1983,J.Macromol.Sci.Rev.Macromol.Chem.23:61;还参见Levy等人,1985,Science 228:190;During等人,1989,Ann.Neurol.25:351;Howard等人,1989,J.Neurosurg.71:105)。在另一个实施方案中,可以将控制释放系统置于待治疗的靶区域(例如,视网膜)附近,因此仅需要全身剂量的一部分(参见,例如,Goodson,in Medical Applications of Controlled Release,supra,vol.2,pp.115-138(1984))。可以使用在Langer的综述(1990,Science 249:1527-1533)中讨论的其它控制释放系统。
本文所述的任何药剂的施用可以独立地为每日一次至四次,或每月一次至四次,或每年一次至六次,或每两年、三年、四年或五年一次。施用可以持续一天或一个月、两个月、三个月、六个月、一年、两年、三年,并且甚至可以是个体的一生。在许多情况下,慢性、长期的施用将是适用的。剂量可以作为单剂施用或分成多剂施用。通常,期望的剂量应以设定的时间间隔施用,持续长时间,通常为至少超过几周或几个月,尽管可能需要几个月或几年或更多的更长的施用时间。
利用本文所述的任何药剂的剂量方案可以根据多种因素选择,所述因素包括个体的类型、物种、年龄、体重、性别和医学状况;待治疗的病症的严重程度;施用途径;个体的肾或肝功能;个体的药物基因组组成;以及所使用的本公开内容的具体化合物。本文所述的任何药剂可以以单一日剂量施用,或者总日剂量可以每目两次、三次或四次以分剂量施用。此外,本文所述的任何药剂可以连续施用,而不是在整个剂量方案中间歇施用。
个体和/或动物
在一些实施方案中,个体和/或动物是哺乳动物,例如人、小鼠、大鼠、豚鼠、狗、猫、马、牛、猪、兔、绵羊或非人灵长类动物(例如猴、黑猩猩或狒狒)。在其它实施方案中,个体和/或动物是非哺乳动物,例如斑马鱼。在一些实施方案中,个体和/或动物可以包含荧光标记的细胞(具有例如GFP)。在一些实施方案中,个体和/或动物是包含荧光细胞的转基因动物。在一些实施方案中,个体和/或动物是人。在一些实施方案中,人是儿童。在其它实施方案中,人是成人。在其它实施方案中,人是老年人。在其它实施方案中,人可以是指患者。
在某些实施方案中,人的年龄为约0个月至约6个月大、约6至约12个月大、约6至约18个月大、约18至约36个月大、约1至约5岁大、约5至约10岁大、约10至约15岁大、约15至约20岁大、约20至约25岁大、约25至约30岁大、约30至约35岁大、约35至约40岁大、约40至约45岁大、约45至约50岁大、约50至约55岁大、约55至约60岁大、约60至约65岁大、约65至约70岁大、约70至约75岁大、约75至约80岁大、约80至约85岁大、约85至约90岁大、约90至约95岁大或约95至约100岁大。
在其它实施方案中,个体是非人动物,因此本公开内容涉及兽医用途。在具体实施方案中,非人动物是家养宠物。在其它具体实施方案中,非人动物是家畜动物。
试剂盒
本公开内容提供了可以简化本文所述的任何药剂的施用的试剂盒。本公开内容的示例性试剂盒包含单位剂型的本文所述的任何药剂。在一个实施方案中,单位剂型是容器,例如预填充注射器,其可以是无菌的,含有本文所述的任何药剂和药物可接受的载体、稀释剂、赋形剂或媒介物。试剂盒可以进一步包括标签或印刷的说明书,其指示本文所述的任何药剂的使用。试剂盒还可以包括开睑器、局部麻醉剂和用于眼表面的清洁剂。试剂盒还可以包括本文所述的一种或多种附加药剂。
在一个实施方案中,试剂盒包括含有有效量的本公开内容的药剂(包括,例如,式I、Ia、II、III、IV、V、VI或VII的化合物或其药物可接受的盐,或本文公开的任何化合物)和有效量的其它治疗剂(例如本文描述的那些)的容器。
定义
以下定义与本文公开的公开内容结合使用。除非另外定义,否则本文使用的所有技术术语和科学术语具有与本公开内容所属领域的技术人员通常理解的相同含义。
“有效量”当与本公开内容的药剂,例如BCAT2抑制剂(例如,式I、Ia、II、III、IV、V、VI或VII的化合物或其药物可接受的盐,或本文公开的任何化合物)结合使用时是有效降低BCAA代谢物和/或底物分子的毒性负荷的量,如本文所述。
如果药剂在有机酸血症的发病速率和/或症状方面提供了可测量的治疗、预防或降低,则药剂“可用于治疗有机酸血症”。
如本文所用,“一个/种(a)”、“一个/种(an)”或“所述(the)”可以意指一个/种或多于一个/种。此外,术语“约”当与所提及的数字指示一起使用时意指所提及的数字指示加上或减去所提及的数字指示的至多10%。例如,语言“约50”涵盖45至55的范围。
如本文所提及,除非另外指明,否则所有组成百分比均按总组合物的重量计。如本文所用,词语“包括”及其变体旨在是非限制性的,使得在列表中陈述的项目不排除也可用于该技术的材料、组合物、装置和方法的其它类似项目。类似地,术语“可以”和“可能”及其变型旨在是非限制性的,使得对实施方案可以或可能包括某些元件或特征的陈述不排除不包括那些元件或特征的本技术的其它实施方案。
尽管在本文中使用开放式术语“包含”作为诸如包括、含有或具有的术语的同义词来描述和要求保护本公开内容,但本公开内容或其实施方案可以替代地使用诸如“由......组成”或“基本上由......组成”的替代性术语来描述。
“溶剂化物”是指通过溶剂与EPI、代谢物或其盐的相互作用形成的化合物。适合的溶剂化物是药物可接受的溶剂化合物,包括水合物。
如本文所用,“Ca至Cb”或“Ca-b”(其中“a”和“b”为整数)是指指定基团中碳原子的数量。即,该基团可以含有“a”至“b”个(包括a和b)碳原子。因此,例如,“C1至C4烷基”或“C1-4烷基”基团是指具有1个至4个碳的所有烷基基团,即CH3-、CH3CH2-、CH3CH2CH2-、(CH3)2CH-、CH3CH2CH2CH2-、CH3CH2CH(CH3)-和(CH3)3C-。
如本文所用的术语“卤素”或“卤代”意指元素周期表中第7栏的放射稳定性原子中的任一种,例如氟、氯、溴或碘,优选为氟和氯。
“烷基”是指直链或支链的烃链基团,所述烃链基团仅由碳原子和氢原子组成,不含有不饱和度,具有一个至十个碳原子(例如,(C1-10)烷基或C1-10烷基)。每当在本文中出现时,诸如“1至10”的数值范围是指给定范围内的每一个整数--例如,“1个至10个碳原子”意指烷基基团可以由1个碳原子、2个碳原子、3个碳原子等,直至并且包括10个碳原子组成,然而所述定义还旨在涵盖未具体标出数值范围的术语“烷基”的出现。典型的烷基基团包括但绝不限于,甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、异丁基、叔丁基、戊基、异戊基、新戊基、己基、庚基、辛基、壬基和癸基。烷基部分可以通过单键连接到分子的其余部分,例如甲基(Me)、乙基(Et)、正丙基(Pr)、1-甲基乙基(异丙基)、正丁基、正戊基、1,1-二甲基乙基(叔丁基)和3-甲基己基。除非在说明书中另外具体说明,否则烷基基团任选被一个或多个取代基取代,所述取代基独立地是烷基、杂烷基、烯基、炔基、环烃基、杂环烃基、芳基、芳基烷基、杂芳基、杂芳基烷基、羟基、卤素、氰基、三氟甲基、三氟甲氧基、硝基、三甲基硅烷基、-ORa、-SRa、-OC(O)-Ra、-N(Ra)2、-C(O)Ra、-C(O)ORa、-OC(O)N(Ra)2、-C(O)N(Ra)2、-N(Ra)C(O)ORa、-N(Ra)C(O)Ra、-N(Ra)C(O)N(Ra)2、N(Ra)C(NRa)N(Ra)2、-N(Ra)S(O)tRa(其中t是1或2)、-S(O)tORa(其中t是1或2)、-S(O)tN(Ra)2(其中t是1或2)或PO3(Ra)2,其中每个Ra独立地是氢、烷基、氟烷基、碳环基、碳环基烷基、芳基、芳烷基、杂环烃基、杂环烃基烷基、杂芳基或杂芳基烷基。
“环烃基”是指仅含有碳和氢并且可以是饱和的或部分不饱和的单环或多环基团。环烃基包括具有3个至10个环原子的基团(即(C3-10)环烃基或C3-10环烃基)。每当在本文中出现时,诸如“3至10”的数值范围是指给定范围内的每一个整数--例如,“3个至10个碳原子”意指环烃基基团可以由3个碳原子等,直至并且包括10个碳原子组成。环烃基的说明性实例包括但不限于以下部分:环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、环庚基、环辛基、环壬基、环癸基、降冰片基等。除非在说明书中另外具体说明,否则环烃基基团任选被一个或多个取代基取代,所述取代基独立地是:烷基、杂烷基、烯基、炔基、环烃基、杂环烃基、芳基、芳基烷基、杂芳基、杂芳基烷基、羟基、卤素、氰基、三氟甲基、三氟甲氧基、硝基、三甲基硅烷基、=O、-ORa、-SRa、-OC(O)-Ra、-N(Ra)2、-C(O)Ra、-C(O)ORa、-OC(O)N(Ra)2、-C(O)N(Ra)2、-N(Ra)C(O)ORa、-N(Ra)C(O)Ra、-N(Ra)C(O)N(Ra)2、N(Ra)C(NRa)N(Ra)2、-N(Ra)S(O)tRa(其中t是1或2)、-S(O)tORa(其中t是1或2)、-S(O)tN(Ra)2(其中t是1或2)或PO3(Ra)2,其中每个Ra独立地是氢、烷基、氟烷基、碳环基、碳环基烷基、芳基、芳烷基、杂环烃基、杂环烃基烷基、杂芳基或杂芳基烷基。
如本文所用,“卤代烷基”是指在链中具有1个至12个碳原子的直链或支链烷基基团,其被卤素取代一个或多个氢。卤代烷基的实例包括但不限于-CF3、-CHF2、-CH2F、-CH2CF3、-CH2CHF2、-CH2CH2F、-CH2CH2Cl、-CH2CF2CF3以及鉴于本领域普通技术和本文提供的教导将被认为与前述实例中的任一个等同的其它基团。
如本文所用,“烷氧基”是指式-OR,其中R为上述定义的烷基,例如“C1-9烷氧基”,包括但不限于甲氧基、乙氧基、正丙氧基、1-甲基乙氧基(异丙氧基)、正丁氧基、异丁氧基、仲丁氧基和叔丁氧基等。
如本文所用,“芳基”是指在环骨架中仅含有碳的芳香族环或环系统(即,共用两个相邻碳原子的两个或更多个稠合环)。当芳基为环系统时,系统中的每个环为芳香族。芳基基团可以具有6个至18个碳原子,然而本定义还涵盖了存在未指定数值范围的术语“芳基”。在一些实施方案中,芳基基团具有6个至10个碳原子。可以将芳基基团指定为“C6-10芳基”、“C6或C10芳基”或相似指定。芳基基团的实例包括但不限于,苯基、萘基、薁基和蒽基。
如本文所用,“芳氧基”和“芳硫基”是指RO-和RS-,其中R为以上定义的芳基,例如“C6-10芳氧基”或“C6-10芳硫基”等,包括但不限于苯氧基。
“芳烷基”或“芳基烷基”是经由亚烷基基团连接的作为取代基的芳基基团,如“C7-14芳烷基”等,包括但不限于苄基、2-苯乙基、3-苯丙基和萘基烷基。在一些情况下,亚烷基基团是低级亚烷基基团(即,C1-4亚烷基基团)。
如本文所用,“杂芳基”是指在环骨架中含有一个或多个杂原子(即,除了碳以外的元素,包括但不限于,氮、氧和硫)的芳香族环或环系统(即,共用两个相邻原子的两个或更多个稠合环)。当杂芳基是环系统时,该系统中的每个环为芳香族。杂芳基基团可以具有5个至18个环成员(即,构成环骨架的原子数目,包括碳原子和杂原子),然而本定义还涵盖了存在未指定数值范围的术语“杂芳基”。在一些实施方案中,杂芳基基团具有5个至10个环成员或5个至7个环成员。可以将杂芳基基团指定为“5元至7元杂芳基”、“5元至10元杂芳基”或相似指定。在各种实施方案中,杂芳基含有1个至4个杂原子、1个至3个杂原子、1个至2个杂原子或者1个杂原子。例如,在各种实施方案中,杂芳基含有1个至4个氮原子、1个至3个氮原子、1个至2个氮原子、2个氮原子和1个硫或氧原子、1个氮原子和1个硫或氧原子、或者1个硫或氧原子。杂芳基的实例包括但不限于吖庚因基(azepinyl)、吖啶基、苯并咪唑基、苯并吲哚基、1,3-苯并二氧杂环戊烯基、苯并呋喃基、苯并噁唑基、苯并[d]噻唑基、苯并噻二唑基、苯并[b][1,4]二氧杂环庚烷基、苯并[b][1,4]噁嗪基、1,4-苯并二氧杂环己烷基、苯并萘并呋喃基、苯并噁唑基、苯并二氧杂环戊烯基、苯并二氧杂环己烯基、苯并噁唑基、苯并吡喃基、苯并吡喃酮基、苯并呋喃基、苯并呋喃酮基、苯并呋咱基、苯并噻唑基、苯并噻吩基(苯并噻吩基)、苯并噻吩并[3,2-d]嘧啶基、苯并三唑基、苯并[4,6]咪唑并[1,2-a]吡啶基、咔唑基、噌啉基、环戊二烯并[d]嘧啶基、6,7-二氢-5H-环戊二烯并[4,5]噻吩并[2,3-d]嘧啶基、5,6-二氢苯并[h]喹唑啉基、5,6-二氢苯并[h]噌啉基、6,7-二氢-5H-苯并[6,7]环庚并[1,2-c]哒嗪基、二苯并呋喃基、二苯并噻吩基、呋喃基、呋咱基、呋喃酮基、呋喃并[3,2-c]吡啶基、5,6,7,8,9,10-六氢环辛[d]嘧啶基、5,6,7,8,9,10-六氢环辛[d]哒嗪基、5,6,7,8,9,10-六氢环辛[d]吡啶基、异噻唑基、咪唑基、吲唑基、吲哚基、吲唑基、异吲哚基、二氢吲哚基、异二氢吲哚基、异喹啉基、吲嗪基、异噁唑基、5,8-桥亚甲基(methano)-5,6,7,8-四氢喹唑啉基、萘啶基、1,6-萘啶酮基、噁二唑基、2-氧代吖庚因基、噁唑基、环氧乙烷基、5,6,6a,7,8,9,10,10a-八氢苯并[h]喹唑啉基、1-苯基-1H-吡咯基、吩嗪基、吩噻嗪基、吩嗪基、酞嗪基、蝶啶基、嘌呤基、吡喃基、吡咯基、吡唑基、吡唑并[3,4-d]嘧啶基、吡啶基、吡啶并[3,2-d]嘧啶基、吡啶并[3,4-d]嘧啶基、吡嗪基、嘧啶基、哒嗪基、吡咯基、喹唑啉基、喹喔啉基、喹啉基、异喹啉基、四氢喹啉基、5,6,7,8-四氢喹唑啉基、5,6,7,8-四氢苯并[4,5]噻吩并[2,3-d]嘧啶基、6,7,8,9-四氢-5H-环庚[4,5]噻吩并[2,3-d]嘧啶基、5,6,7,8-四氢吡啶并[4,5-c]哒嗪基、噻唑基、噻二唑基、噻吡喃基、三唑基、四唑基、三嗪基、噻吩并[2,3-d]嘧啶基、噻吩并[3,2-d]嘧啶基、噻吩并[2,3-c]吡啶基和噻吩基(即噻吩基)。除非在说明书中另外具体说明,否则杂芳基部分任选被一个或多个取代基取代,所述取代基独立地是:烷基、杂烷基、烯基、炔基、环烃基、杂环烃基、芳基、芳基烷基、杂芳基、杂芳基烷基、羟基、卤素、氰基、硝基、氧代、硫代、三甲基硅烷基、-ORa、-SRa、-OC(O)-Ra、-N(Ra)2、-C(O)Ra、-C(O)ORa、-OC(O)N(Ra)2、-C(O)N(Ra)2、-N(Ra)C(O)ORa、-N(Ra)C(O)Ra、-N(Ra)C(O)N(Ra)2、N(Ra)C(NRa)N(Ra)2、-N(Ra)S(O)tRa(其中t是1或2)、-S(O)tORa(其中t是1或2)、-S(O)tN(Ra)2(其中t是1或2)或PO3(Ra)2,其中每个Ra独立地是氢、烷基、氟烷基、碳环基、碳环基烷基、芳基、芳烷基、杂环烃基、杂环烃基烷基、杂芳基或杂芳基烷基。
取代的杂芳基还包括被一个或多个氧化物(-O-)取代基取代的环系,例如,吡啶基N-氧化物。
如本文所用,“杂烷基”是指在链骨架中含有一个或多个杂原子(即,除了碳以外的元素,包括但不限于,氮、氧和硫)的直烃链或支化烃链。杂烷基基团可以具有1个至20个碳原子,然而本定义还涵盖了存在未指定数值范围的术语“杂烷基”。杂烷基基团也可以是具有1个至9个碳原子的中等大小的杂烷基。杂烷基基团也可以是具有1个至4个碳原子的低级杂烷基。在各种实施方案中,杂烷基可以具有1个至4个杂原子、1个至3个杂原子、1个或2个杂原子或者1个杂原子。可以将化合物的杂烷基基团指定为“C1-4杂烷基”或类似的指定。杂烷基基团可以含有一个或多个杂原子。仅通过实例,“C1-4杂烷基”表示在杂烷基链中有一个至四个碳原子且在链的骨架中额外地有一个或多个杂原子。
如本文所用,“碳环基”意指在环系统骨架中仅含有碳原子的非芳香族环或环系统。当碳环基为环系统时,两个或更多个环以稠合、桥接或螺连接方式接合在一起。碳环基可以具有任何饱和度,条件是环系统中的至少一个环是非芳香族。因此,碳环基包括环烷基、环烯基和环炔基。碳环基基团可以具有3个至20个碳原子,然而本定义还涵盖了存在未指定数值范围的术语“碳环基”。碳环基基团也可以是具有3个至10个碳原子的中等大小的碳环基。碳环基基团也可以是具有3个至6个碳原子的碳环基。可以将碳环基基团指定为“C3-6碳环基”或相似指定。碳环基环的实例包括但不限于,环丙基、环丁基、环戊基、环己基、环己烯基、2,3-二氢-茚、二环[2.2.2]辛基(octanyl)、金刚烷基和螺[4.4]壬基(nonanyl)。
“(碳环基)烷基”是经由亚烷基基团连接的作为取代基的碳环基基团,例如“C4-10(碳环基)烷基”等,包括但不限于,环丙基甲基、环丁基甲基、环丙基乙基、环丙基丁基、环丁基乙基、环丙基异丙基、环戊基甲基、环戊基乙基、环己基甲基、环己基乙基、环庚基甲基等。在一些情况下,亚烷基基团是低级亚烷基基团。
如本文所用,“杂环基”意指在环骨架中含有至少一个杂原子的非芳香族环或环系统。杂环基可以以稠合、桥接或螺连接的方式接合在一起。杂环基可以具有任何饱和度,条件是环系统中的至少一个环是非芳香族。杂原子可以存在于环系统中的非芳香族环或芳香族环中。杂环基基团可以具有3个至20个环成员(即,构成环骨架的原子数目,包括碳原子和杂原子),然而本定义还涵盖了存在未指定数值范围的术语“杂环基”。杂环基基团也可以是具有3个至10个环成员的中等大小的杂环基。杂环基基团也可以是具有3个至6个环成员的杂环基。可以将杂环基基团指定为“3元至6元杂环基”或相似指定。
在各种实施方案中,杂环基含有1个至4个杂原子、1个至3个杂原子、1个至2个杂原子或者1个杂原子。例如,在各种实施方案中,杂环基含有1个至4个氮原子、1个至3个氮原子、1个至2个氮原子、2个氮原子和1个硫或氧原子、1个氮原子和1个硫或氧原子、或者1个硫或氧原子。在优选的六元单环杂环基中,杂原子是选自O、N或S中的一个直至三个,并且在优选的五元单环杂环基中,杂原子是选自O、N或S中的一个或两个杂原子。杂环基环的实例包括但不限于,吖庚因基(azepinyl)、吖啶基、咔唑基、噌啉基、二氧戊环基、咪唑啉基、咪唑烷基、吗啉基、环氧乙烷基、氧杂环庚烷基、硫杂环庚烷基、哌啶基、哌嗪基、二氧代哌嗪基、吡咯烷基、吡咯烷酮基(pyrrolidonyl)、吡咯烷二酮基(pyrrolidionyl)、4-哌啶酮基、吡唑啉基、吡唑烷基、1,3-二噁英基、1,3-二氧杂环己基、1,4-二噁英基、1,4-二氧杂环己基、1,3-氧硫杂环己基、1,4-氧硫杂环己二烯基、1,4-氧硫杂环己基、2H-1,2-噁嗪基、三氧杂环己基、六氢-1,3,5-三嗪基、1,3-二氧杂环戊烯基、1,3-二氧戊环基、1,3-二硫杂环戊二烯基、1,3-二硫戊环基、异噁唑啉基、异噁唑烷基、噁唑啉基、噁唑烷基、噁唑烷酮基、噻唑啉基、噻唑烷基、1,3-氧硫杂环戊基、二氢吲哚基、异二氢吲哚基、四氢呋喃基、四氢吡喃基、四氢噻吩基(tetrahydrothiophenyl)、四氢噻喃基、四氢-1,4-噻嗪基、硫代吗啉基、二氢苯并呋喃基、苯并咪唑烷基和四氢喹啉。
“(杂环基)烷基”是经由亚烷基基团连接的作为取代基的杂环基基团。实例包括但不限于,咪唑啉基甲基和二氢吲哚基乙基。
如本文所用,“酰基”是指-C(=O)R,其中如本文所定义,R是氢、C1-6烷基、C2-6烯基、C2-6炔基、C3-7碳环基、芳基、5元至10元杂芳基和5元至10元杂环基。非限制性实例包括甲酰基、乙酰基、丙酰基、苯甲酰基和丙烯酰基。
“O-羧基”基团是指“-OC(=O)R”基团,其中如本文所定义,R选自氢、C1-6烷基、C2-6烯基、C2-6炔基、C3-7碳环基、芳基、5元至10元杂芳基和5元至10元杂环基。
“C-羧基”基团是指“-C(=O)OR”基团,其中如本文所定义,R选自氢、C1-6烷基、C2-6烯基、C2-6炔基、C3-7碳环基、芳基、5元至10元杂芳基和5元至10元杂环基。非限制性实例包括羧基(即,-C(=O)OH)。
“氰基”基团是指“-CN”基团。
“氰酰基”基团是指“-OCN”基团。
“异氰酰基”基团是指“-NCO”基团。
“硫氰酰基”是指“-SCN”基团。
“异硫氰酰基”基团是指“-NCS”基团。
“亚磺酰基”基团是指“-S(=O)R”基团,其中如本文所定义,R选自氢、C1-6烷基、C2-6烯基、C2-6炔基、C3-7碳环基、C6-10芳基、5元至10元杂芳基和5元至10元杂环基。
“磺酰基”基团是指“-SO2R”基团,其中如本文所定义,R选自氢、C1-6烷基、C2-6烯基、C2-6炔基、C3-7碳环基、C6-10芳基、5元至10元杂芳基和5元至10元杂环基。
“S-亚磺酰氨基”基团是指“-SO2NRARB”基团,其中如本文所定义,RA和RB各自独立地选自氢、C1-6烷基、C2-6烯基、C2-6炔基、C3-7碳环基、C6-10芳基、5元至10元杂芳基和5元至10元杂环基。
“N-亚磺酰氨基”基团是指“-N(RA)SO2RB”基团,其中如本文所定义,RA和RB各自独立地选自氢、C1-6烷基、C2-6烯基、C2-6炔基、C3-7碳环基、C6-10芳基、5元至10元杂芳基和5元至10元杂环基。
“O-氨基甲酰基”基团是指“-OC(=O)NRARB”基团,其中如本文所定义,RA和RB各自独立地选自氢、C1-6烷基、C2-6烯基、C2-6炔基、C3-7碳环基、C6-10芳基、5元至10元杂芳基和5元至10元杂环基。
“N-氨基甲酰基”基团是指“-N(RA)OC(=O)RB”基团,其中如本文所定义,RA和RB各自独立地选自氢、C1-6烷基、C2-6烯基、C2-6炔基、C3-7碳环基、C6-10芳基、5元至10元杂芳基和5元至10元杂环基。
“O-硫代氨基甲酰基”基团是指“-OC(=S)NRARB”基团,其中如本文所定义,RA和RB各自独立地选自氢、C1-6烷基、C2-6烯基、C2-6炔基、C3-7碳环基、C6-10芳基、5元至10元杂芳基和5元至10元杂环基。
“N-硫代氨基甲酰基”基团是指“-N(RA)OC(=S)RB”基团,其中如本文所定义,RA和RB各自独立地选自氢、C1-6烷基、C2-6烯基、C2-6炔基、C3-7碳环基、C6-10芳基、5元至10元杂芳基和5元至10元杂环基。
“C-酰氨基”基团是指“-C(=O)NRARB”基团,其中如本文所定义,RA和RB各自独立地选自氢、C1-6烷基、C2-6烯基、C2-6炔基、C3-7碳环基、C6-10芳基、5元至10元杂芳基和5元至10元杂环基。
“N-酰氨基”基团是指“-N(RA)C(=O)RB”基团,其中如本文所定义,RA和RB各自独立地选自氢、C1-6烷基、C2-6烯基、C2-6炔基、C3-7碳环基、C6-10芳基、5元至10元杂芳基和5元至10元杂环基。
“氨基”基团是指“-NRARB”基团,其中如本文所定义,RA和RB各自独立地选自氢、C1-6烷基、C2-6烯基、C2-6炔基、C3-7碳环基、C6-10芳基、5元至10元杂芳基和5元至10元杂环基。
“氨基烷基”基团是指经由亚烷基基团连接的氨基基团。
“烷氧基烷基”基团是指经由亚烷基基团连接的烷氧基基团,例如“C2-8烷氧基烷基”等。
应理解,根据上下文,某些基团(radical)命名惯例可以包括单基团或双基团。例如,当取代基与分子的其余部分需要两个连接点时,应理解,该取代基是双基团。例如,认定为需要两个连接点的烷基的取代基包括双基团,例如-CH2-、-CH2CH2-、-CH2CH(CH3)CH2-等。其他的基团命名惯例清楚地表明该基团是双基团,例如“亚烷基”或“亚烯基”。
当认为两个R基团与“它们连接的原子一起”形成环(例如,碳环基、杂环基、芳基或杂芳基环)时,其意指该原子和所述两个R基团的集合单元(collective unit)是所述的环。当单独提及时,所述环不再另外受到各个R基团的定义限制。例如,当存在以下子结构时:
并且R1和R2定义为选自氢和烷基,或者R1和R2与它们连接的氮一起形成杂环基,其意指R1和R2可以选自氢或烷基,或者可选地,所述子结构具有结构:
其中环A是含有所述氮的杂环基环。
类似地,当认为两个“相邻”R基团与“它们连接的原子一起”形成环时,其意指原子、介于中间的键和两个R基团的集合单元是所述的环。例如,当存在以下子结构时:
并且R1和R2定义为选自氢和烷基,或者R1和R2与它们连接的原子一起形成芳基或碳环基,其意指R1和R2可以选自氢或烷基,或者可选地,所述子结构具有结构:
其中A是芳基环或者含有所述双键的碳环基。
每当将取代基描述为双基团(即,针对分子的其余部分具有两个连接点)时,除非另外说明,否则应理解为取代基可以以任何定向构型进行连接。因此,例如,被描述为-AE-或者的取代基包括被定向使得在分子的最左边连接点处连接A的取代基,以及其中在分子的最右边连接点连接A的情况。
本公开内容可以通过以下非限制性实施例来进一步说明。
实施例
实施例1:BCAT2和BCAT1体外抑制
本实施例评价本公开内容的化合物,式(I)的BCAT2抑制剂化合物,如下所示:
是否可以抑制下游代谢物丙酰肉碱的水平(发现在丙酸血症患者中丙酰肉碱的水平升高),通过分析来自用本公开内容的化合物的剂量响应处理的丙酸血症患者的人成纤维细胞中的条件培养基中的丙酰肉碱水平。
将来自丙酸血症患者(Coriell#GM00371)的原代人成纤维细胞以10,000个细胞/孔在96孔板中的完全培养基(EMEM,15%FBS)中进行铺板,并在37℃、5%CO2下孵育过夜。化合物最初在DMSO中连续稀释,然后稀释到无血清EMEM培养基中。然后在添加含有稀释的化合物的培养基之前,用D-PBS洗涤细胞,然后在37℃、5%CO2下孵育过夜。
在化合物处理24小时后从细胞中去除条件培养基,并用在MS级甲醇中稀释的D3-丙酰肉碱内标稀释2次。将板密封并将样品在-80DGC下冷冻超过30分钟,然后在室温解冻并在4000rpm下离心10分钟。然后通过LC-LC/MS使用TSQ Vantage使用具有95%(0.1%甲酸水溶液) 5%水的流动相A以及95%MeOH 5%(0.1%甲酸水溶液)的流动相B的Kinetex 2.6μm联苯2.1x50mm柱分析样品的丙酰肉碱。
还通过向细胞孔中添加等体积的D-PBS和Cell Titer-Glo试剂,并按照制造商检测亮度信号的建议,用Cell Titer-Glo试剂(Promega)测定细胞活力。
实验结果描绘于图1中,显示BCAT2抑制剂(式Ia的化合物),如下所示:
对通过BCAA途径的通量和对下游代谢物丙酰肉碱的影响。结果表明,在增加浓度的BCAT2抑制剂的存在下,丙酰肉碱水平被抑制,而且对细胞活力影响很小。这表明BCAT2减少了通过BCAA途径的通量。
还评价了所选择的本公开内容的化合物的BCAT1抑制活性。通常使用DMSO作为媒介物将化合物制备为至多10mM储备溶液。使用Echo-550(Labcyte)声学分配器产生10点剂量响应曲线。化合物源板(384孔,纯白色测定板,Corning#3570)通过连续稀释化合物储备溶液以产生在DMSO中的1mM、0.1mM和0.01mM的溶液至Echo认证的LDV板中来制备。然后Echo将100%DMSO储备溶液连续点样到源剂量响应板中以产生半对数倍稀释方案。将100%DMSO添加至点样剂量响应板以使最终体积达到5μL,产生333x储备板。然后将120nL的剂量响应储备板点样到测定板中。然后将10μL的测定缓冲液(含有0.05%吐温20的50mM Tris)添加到板中,在测定板中产生4x工作浓度。最终测定测试浓度范围为3μM至0.0001μM,最终DMSO浓度为0.3%。
首先将BCAT1酶储备液在测定缓冲液中稀释至0.24μg/mL的4x工作浓度(最终测定浓度为0.06ug/ml)。然后将10μL的4x BCAT1溶液添加至预先制备的含有测试化合物或对照的测定板中,并在室温下避光孵育10分钟或60分钟。在化合物孵育期之后,将20μL的测定缓冲液加2x底物添加至所有孔中(底物的最终测定浓度为300μM L-亮氨酸和250μM α-酮戊二酸)。然后将酶反应在室温孵育10分钟。孵育10分钟之后,添加5μL的0.6N HCl停止酶促反应,孵育1分钟。然后添加5μL的1M Tris(pH 8.0)以中和pH。然后将12.5μL的淬灭的测定体积转移到白色384孔板中并添加12.5μL的谷氨酸检测试剂(根据Promega谷氨酸Glo试剂盒说明书制备检测试剂)。然后将板在室温孵育30分钟,避光。在谷氨酸检测孵育期之后,在BMG Novostar上读取亮度,并且测量相对光单位并导出用于分析。
BCAT1酶活性的化合物调节测定如下。在ActivityBase中使用4-参数拟合方程计算IC50值。将数据归一化为比较剂VS558CSA的最大抑制(在10μM)。导出相对光单位用于分析,并且使用以下公式计算每个孔的%抑制值:
以下提供了本公开内容的其它化合物的BCAT2抑制活性以及BCAT1抑制数据。
实施例2:BCAT2体内抑制
本实施例评价了与用以下所示的BCAT2抑制剂化合物进行急性和重复治疗相关的药效学:
化学品
根据实施例3合成支链氨基转移酶2(BCAT2)抑制剂化合物。
羟丙基甲基纤维素(HPMC)、支链氨基酸L-半胱氨酸、L-组氨酸、L-异亮氨酸、L-亮氨酸、L-赖氨酸、L-甲硫氨酸、L-苯丙氨酸、L-苏氨酸、L-色氨酸、L-酪氨酸和L-缬氨酸购自Sigma-Aldrich(St.Louis,MO)。所有其它试剂均是从常见来源获得的,并且它们是试剂级或更好的。
动物
将雄性C57黑色/6J小鼠(6-7周,Jackson Laboratories,Bar Harbor,ME)用于所有体内实验。将动物在温度和湿度受控的房间中保持12小时光/暗逆向循环,自由地获取食物和水。在实验之前,动物经历7天的适应期。涉及小鼠的所有程序由亚利桑那州大学的机构动物护理和使用委员会批准,并根据实验室动物护理原则(National Institutes of Health Publication 85-23,于1985年修订)进行。
血浆、尿液和组织匀浆提取物的生物分析
将所有生物样品储存在-80℃直至分析。使用含有D8-缬氨酸的乙腈(ACN)作为内标,通过基于蛋白质沉淀的方法提取小鼠血浆和尿液中的支链氨基酸(缬氨酸、亮氨酸、异亮氨酸)和丝氨酸,并在联接至Agilent 6490 QQQ MS的Agilent 1290 Infinite II separation HPLC上通过液相色谱质谱(LC-MS/MS)进行分析。特别地,用含有5μg/ml D8-缬氨酸的180μL乙腈沉淀20μL的小鼠血浆。将样品剧烈涡旋并离心以去除沉淀的蛋白质。将2μL的上清液进样到Phenomenex Gemini C18柱(4.6mm x 150mm、5μm粒度)进行分离,以10分钟内2%ACN至50%ACN的线性梯度,然后用2%ACN的平衡7分钟。亮氨酸/异亮氨酸的氨基酸转变为132.1至86.1,丝氨酸的氨基酸转变为106.1至60.1,缬氨酸的氨基酸转变为118.1至72.1。
用固相萃取(SPE)法提取小鼠血浆中的丙酰肉碱,并在Thermo Scientific TSQ vantage上进行LC-MS/MS分析。将样品进样到维持在室温的Kinetex联苯柱(2.1x50mm,2.6μm)。用0.095%甲酸的水溶液(A)和0.0005%甲酸的MeOH溶液(B)组成的线性梯度洗脱分析物。
药效学研究:用BCAT2抑制剂急性治疗
将动物禁食过夜,然后口服施用作为混悬剂的媒介物(0.5%HPMC K100 0.1吐温80、pH=10.0)或指定剂量的化合物(30、100、300mg/kg),持续6小时。化合物给药之后,动物能够自由地获取食物和水。然后,每只小鼠接受口服喂食1.5g/10mL/Kg的氨基酸混合物在0.5%HPMC/0.1%吐温80,pH 7中制备所述氨基酸混合物,并且所述氨基酸混合物由114mg L-半胱氨酸、114mg L-组氨酸、468mg L-异亮氨酸、939mg L-亮氨酸、486mg L-赖氨酸、39mg L-甲硫氨酸、75mg L-苯丙氨酸、264mg L-苏氨酸、15mg L-色氨酸、21mg L-酪氨酸和468mg L-缬氨酸组成。在氨基酸攻击(challenge)后1小时,使用K2-EDTA包被的管通过心脏内穿刺采集血样。离心后收集血浆并储存在-80℃直至分析。
图2中描述的结果显示BCAT2抑制剂化合物可以阻断支链氨基酸(BCAA)进入其分解代谢途径。如图2所示,BCAT2抑制剂化合物以剂量依赖性方式相对于媒介物对照升高了血浆中的缬氨酸(Val)、异亮氨酸(Ile)和亮氨酸(Leu)的水平。该实验证明BCAT2抑制剂化合物在急性动物模型中有效地提高了BCAA的水平。
药效学研究:用BCAT2抑制剂化合物重复治疗
将动物基于成对匹配的体重进行分组并且接受媒介物(0.5%HPMC K100 0.1Tween 80,pH=10.0)或每日剂量的化合物(200mg/kg,PO),持续9天。从第1天到第5天,向所有动物提供正常饮食。在第6天,对于半数的动物,将饮食转换为富含前体的食物(富含700%异亮氨酸、缬氨酸和苏氨酸,TD.140829;Envigo);另外半数仍然喂食正常饮食。在第9天,在最后一次给药后4小时收集血液、膀胱尿液以及组织样品(肝、脑、心脏、肌肉和肾)。保留每个治疗/饮食组中的三只小鼠进行3天恢复期观察。在第12天,收集血液、膀胱尿液以及组织样品(肝、脑、心脏、肌肉和肾)。在整个研究过程(第1天至第12天)中,小鼠能够自由地获取食物和水。每天测量体重并且记录毒性体征的任何异常行为。
图3A至图3D显示了在研究过程中监测小鼠体重的结果。考虑到体重可能是对研究重复给药后生物样品中的BCAA和PC水平的干扰因素,将小鼠在第0天基于成对匹配的体重进行分组,并在整个研究过程中监测体重的变化。图3A显示在研究期间没有观察到体重的显著减轻。在治疗前(第0天)测量的体重和在两个收集日(第9天和第12天)测量的体重显示各组之间没有显著差异(图3B、图3C和图3D)。此外,在研究期间没有观察到反映毒性的明显异常行为。在图3B、图3C和图3D的每一组中,左边的条是媒介物并且右边的条是BCAT。
图4A至图4B描述了在小鼠中用BCAT2抑制剂化合物重复治疗后BCAA的血浆水平。如图4A所示,重复给药BCAT2抑制剂化合物(200mg/kg,PO)9天显著增加了喂食正常饮食的小鼠中的Val和Leu的血浆水平,但未增加Ile和Ser的血浆水平。在每一组中,左边的条是媒介物并且右边的条是BCAT。
分解代谢状态的变化或蛋白质摄入的增加通常导致丙酸血症患者的丙酸酯途径的通量增加。为了复制这种状态并测试BCAT2抑制剂化合物是否可以阻断BCAA进入丙酸酯途径,在重复给药研究中使用饮食挑战。在化合物治疗5天后,将小鼠转换成包含增加水平的异亮氨酸、缬氨酸和苏氨酸的富含前体的饮食。数据显示在第9天收集的小鼠血浆中的BCCA水平在化合物治疗与媒介物治疗之间没有显著变化(图4B),但在第9天样品中观察到亮氨酸的血浆水平轻微但明显的降低。
图5A至图5B描绘了给予正常饮食或富含前体的饮食的小鼠的第9天样品中的血浆(5A)和尿液(5B)氨基酸水平。图5A至图5B显示喂食富含前体的饮食导致BCAA的超负荷,使得这些氨基酸的肾排泄增加。
实施例3:体外3-HIB测定
细胞铺板:在细胞培养罩中使用Combi分配器将细胞(Coriell Institute GM00371细胞)以10,000细胞/0.1mL的伊格尔氏最低必需培养基(EMEM)/15%FBS(Gibco 16000-044)铺板(96孔透明底无菌板;Greiner 655098),并在37℃和5%CO2下孵育过夜。
化合物稀释:将化合物在96孔圆形聚苯乙烯板中制备成在DMSO中的33.3X中间稀释液。对于30μM的最终最大值,用30μL的10mM的DMSO溶液开始。10-12 1∶3连续稀释液从左至右制备(20μL 40μL DMSO)。在EMEM中通过取7.5μL 33.3X并转移至复制的96孔圆形聚苯乙烯板,然后添加242.5μL EMEM来制备10X第二稀释液。通过取50μL 10X稀释液并转移至复制的96孔聚丙烯检测板(Costar 3956)并添加450μL EMEM来制备在EMEM中的1X最终稀释液。通过取20μL 10mM参考化合物A并添加40μL DMSO至3.3mM的浓度来制备用于最大化合物抑制的对照。向7.5μL的3.3mM参考化合物A溶液中添加242.5μL EMEM以制备100μM溶液。随后的参考化合物A溶液用EMEM稀释以达到10μM的最终浓度。参考化合物A的结构是:
通过取7.5μL参考化合物B和242.5μL EMEM以制备300μM溶液来制备用于最大化合物毒性的对照。将50μL的该100μM参考化合物B溶液与450μL EMEM合并以达到30μM的浓度。参考化合物B的结构是:
通过用242.5μL EMEM稀释7.5μL并取50μL随后的溶液并用450μL EMEM稀释来制备DMSO对照。
化合物处理:从细胞中吸出培养基,添加100μL的D-PBS(ThermoFisher 14190144),然后去除。将100μL的稀释的化合物添加到该位置的细胞中,并将细胞在37℃和5%CO2下孵育24小时。
条件培养基的收集:对于3HIB MS检测:从细胞中去除20μL条件培养基并转移至标记的复制的96孔聚丙烯测定板(VWR 62408-946)。将板热密封并储存在-80℃。
活力测定:向保留在板中的细胞添加25μL D-PBS和25μL Cell titer glo试剂(Promega G7572)。将板置于摇床上2分钟,在室温在黑暗中孵育,然后在Clariostar微板读数器上读数。
3HIB衍生化(通用SOP):收集的用于3HIB MS检测的培养基在以下条件下衍生化。缓冲液:将0.1M 1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)溶解在0.1M 2-(N-吗啉基)乙磺酸(MES)中,调节至pH 5.6。缓冲液制备:每500mL HPLC级H2O称量10.6g MES(Sigma#M-5287)。在4℃储存;0.1M EDC:每100mL MES称量1.971g EDC(#E-1769)。用~40滴的1N NaOH调节pH至5.6,并储存在4℃。缓冲液具有短的半衰期,应在两周内使用。
衍生化:向20μL样品中添加60μL 5uM 3HIB-4C13内标,随后添加含20μL EDC的MES和100μL MES。将板密封并在50℃孵育w小时,然后在6℃以4000rpm离心10分钟。然后进行LC-MS分析并使用标准方法处理数据。
实施例3:BCAT2抑制剂化合物的合成
化合物合成
使用的所有溶剂和试剂均由商业来源获得。在Varian Mercury 400 Plus上记录1H NMR谱。化学位移以百万分率(ppm,δ单位)表示。偶合常数(J)以赫兹(Hz)为单位。分裂模式描述了明显的多重性并且被命名为s(单峰)、d(双峰)、t(三重峰)、q(四重峰)、dd(双双重峰)、dt(双三重峰)、m(多重峰)、br(宽峰)。除非另外说明,最终化合物的分析纯度≥95%。使用与Thermo Finnigan LCQ质谱仪联接的Agilent 1100 HPLC系统检查最终化合物的纯度。通过电喷雾电离(ESI)进行所有质谱。使用两种不同的HPLC条件来分析化合物纯度:LC-MS方法A:在Phenomenex Luna 3μ C8(2)100A 30×3.00mm柱上,在2.7分钟内10-98%AcCN-H2O(0.1%TFA),在98%AcCN保持0.38分钟,流速0.9mL/min。LC-MS方法B:在Kinetex 2.6μ C18 100A 30×2.10mm柱上,在3.0分钟内10-95%AcCN-H2O(0.1%甲酸),流速0.5mL/min。高分辨率质谱(HRMS)在以W模式正离子化操作的Waters qTOF Premiere质谱仪上完成,分辨力为约15000。使用Waters Nanoacquity LC完成流动注射。HRMS可接受的误差为3mDa或5ppm,但大多数分析在0.5mDa内观察,因为同位素与所提出的结构吻合良好。用于生物测试的最终化合物的纯化在Gilson GX-281系统上进行,所述系统具有Phenomenex Luna 5μ C8(2)100×21.20mm 100A柱,运行梯度为5-95%MeCN/H2O( 0.1%TFA或0.1%甲酸),历时15-20分钟,流速为22mL/min。
(3-((4-(甲基氨基甲酰基)-2-硝基苯基)氨基)环己基)氨基甲酸叔丁酯(3)。
向4-氟-3-硝基苯甲酸(1.00g,5.40mmol)的乙腈(40mL)溶液中添加HATU(2.054g,5.40mmol)和DIPEA(1.03mL,5.94mmol)。将反应物在室温搅拌15分钟,随后添加甲胺(HCl盐,0.401g,5.94mmol)和DIPEA(1.03mL,5.94mmol)。将反应物继续搅拌3小时,然后真空浓缩。将残余物溶解在水中并用乙酸乙酯萃取。将有机层用水洗涤,经Na2SO4干燥,并真空浓缩,得到为粗产物的4-氟-N-甲基-3-硝基苯甲酰胺。将该粗产物溶解在乙醇(40mL)中,随后添加(3-氨基环己基)氨基甲酸叔丁酯(1.10g,5.13mmol,非对映异构体的外消旋混合物)和DIPEA(1.03mL,5.94mmol)。将反应物在85℃搅拌6小时,然后浓缩,并将残余物溶解在乙酸乙酯中并用水洗涤。将有机层经Na2SO4干燥并真空浓缩,得到为粗产物的标题化合物,纯度>95%(非对映异构体的混合物)。LC-MS(ESI)m/z[M 1] =392.7,Rt=2.13min(HPLC方法A)。
(3-(5-(甲基氨基甲酰基)-2-(2-(甲硫基)苯基)-1H-苯并[d]咪唑-1-基)环己基)氨基甲酸叔丁酯(4)
向4-氟-N-甲基-3-硝基苯甲酰胺(69mg,0.35mmol)的1,4-二氧杂环己烷(4mL)溶液中添加1,1-二甲基乙基(3-氨基环己基)氨基甲酸酯(54mg,0.25mmol)和DIPEA(87μL,0.5mmol)。将反应物在80℃搅拌24小时,然后冷却至室温并添加2-(甲硫基)苯甲醛(38mg,0.25mmol)、连二亚硫酸钠(131mg,0.75mmol)和水(1.0mL)。将反应物在80℃搅拌24小时,然后真空浓缩。将残余物通过制备型HPLC纯化,得到标题化合物4(48.9mg,39.5%产率)。LC-MS(ESI)m/z[M 1] =495.2;Rt=1.97min(HPLC方法A)。
顺式1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺(8b)。
向粗物质3(5.4mmol)的1,4-二氧杂环己烷(40mL)溶液中添加吡啶甲醛(0.579g,5.40mmol)、连二亚硫酸钠(Na2S2O4)(5.64g,32.4mmol)和水(10mL)。将反应物在80℃搅拌18小时,然后真空浓缩,随后用乙酸乙酯萃取。将乙酸乙酯层经Na2SO4干燥和真空浓缩。将残余物通过色谱(硅胶柱,在298nm下UV检测,洗脱剂系统:0-8%CH3OH-CH2Cl2,历时40min,流速为60mL/min)纯化,得到为非对映异构体的混合物的中间体(3-(5-(甲基氨基甲酰基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-1-基)环己基)氨基甲酸叔丁酯(1.5g,从4-氟-3-硝基苯甲酸开始,3步产率62%)。LC-MS(ESI)m/z[M 1] =450.0;Rt=1.78min(HPLC方法A)。
向以上中间体(1.5g,3.34mmol)的DCM(30mL)溶液中逐滴添加TFA(2.57mL,33.4mmol)。将反应物在室温下搅拌18小时。将反应物真空浓缩,并将所得残余物溶解在乙腈(30mL)中,得到溶液A。在单独的小瓶中,将5-溴噻吩-2-甲酸(0.691g,3.34mmol)、HATU(1.269g,3.34mmol)和DIPEA(1.276mL,7.34mmol)在乙腈(30mL)中的反应物在室温搅拌30min。向该反应物中添加溶液A。将生成物在室温搅拌4小时,然后真空浓缩。使残余物在乙酸乙酯与水之间分层。将水层用乙酸乙酯萃取两次,并将合并的乙酸乙酯溶液用饱和NaHCO3溶液洗涤,随后用盐水洗涤,然后经Na2SO4干燥并浓缩,得到粗产物。将粗产物首先通过硅胶色谱(ISCO系统,在298nm下检测,用0-8%CH3OH-CH2Cl2洗脱,历时50min,流速为85mL/min)纯化,得到反式异构体(800mg)以及顺式和反式异构体的混合物(857mg)。顺式和反式异构体的合并产率为1.65g(2步产率92%)。将857mg的顺式和反式混合物通过制备型HPLC系统(柱:Phenomenex Gemini C18 110A,Ax1A,100x30.00mm,5μ柱;流速:40mL/min;UV检测:254nm;梯度:20-55%AcCN-H2O(0.2%甲酸作为改性剂),历时20min)进一步纯化,得到纯的顺式异构体产物(8b,305mg)。MS(ESI)m/z[M 1] =538.1和540.1;Rt=2.24min(HPLC方法B);1H NMR NMR(400MHz,DMSO-d6)δ8.79-8.75(m,1H),8.51-8.44(m,2H),8.23(s,1H),8.16(dd,1H,J=7.7,1.4Hz),8.06-8.00(m,1H),7.91-7.81(m,2H),7.59-7.54(m,2H),7.24(dd,1H,J=3.9,0.8Hz),5.57-5.47(m,1H),3.92-3.80(m,1H),2.81(d,3H,J=4.3Hz),2.49-2.34(m,1H),2.32-2.19(m,1H),2.17-2.09(m,1H),2.01-1.83(m,3H),1.54-1.38(m,2H)。HRMS(M H) [C25H24BrN5O2S H]的计算值:538.0812;实测值:538.0815。对于反式-异构体,LC-MS(ESI)m/z[M 1] =538.0和540.1;Rt=2.10min(HPLC方法B);1H NMR NMR(400MHz,DMSO-d6)δ8.43-8.42(m,1H),8.19(d,1H,J=4.0Hz),8.15(s,1H),8.05-8.01(m,2H),7.95(d,1H,J=9.2Hz),7.89(dd,1H,J=8.0,1.2Hz),7.75(dd,1H,J=8.8,1.2Hz),7.67(d,1H,J=8.0Hz),7.38-7.35(m,1H),7.28(d,1H,J=4.0Hz),5.55-5.49(m,1H),4.26(s,1H),2.76(d,3H,J=4.4),2.44-2.42(m,1H),2.38-2.28(m,2H),1.93-1.92(m,2H),1.90-1.83(m,1H),1.77-1.74(m,1H),1.67-1.63(m.1H)。HRMS(M H) [C25H24BrN5O2S H]的计算值:538.0812;实测值:538.0814。
顺式1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(2-(甲硫基)苯基)-1H-苯并[d]咪唑-5-甲酰胺(1)。
使用4作为起始原料,类似于8b的合成制备为白色固体的标题化合物,14%总产率。LC-MS(ESI)m/z[M 1] =583.1;1H NMR NMR(400MHz,DMSO-d6)δ8.50-8.38(m,2H),8.19(s,1H),7.86-7.78(m,2H),7.62-7.48(m,3H),7.40(d,1H,J=7.1Hz),7.36-7.29(m,1H),7.24(dd,1H,J=3.9,0.7Hz),3.96-3.86(m,1H),3.72-3.60(m,1H),2.81(d,3H,J=4.3Hz),2.42(s,3H),2.36-2,00(m,3H),1.99-1.74(m,3H),1.48-1.17(m,2H)。HRMS(M H) [C27H27BrN4O2S2 H]的计算值:583.0837;实测值:583.0842。
顺式1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-苯基-1H-苯并[d]咪唑-5-甲酰胺(8a)。
类似于8b的合成制备为白色固体的标题化合物,12.5%总产率。LC-MS(ESI)m/z[M 1] =537.3;1H NMR NMR(400MHz,CD OD)δ8.27-8.25(m,1H),8.14(d,1H,J=8.8Hz),8.03(dd,1H,J=8.8,1.2Hz),7.83-7.71(m,5H),7.48(dd,1H,J=3.9,0.8Hz),7.13(d,1H,J=3.9Hz),4.70-4.60(m,1H),3.97-3.88(m,1H),2.98(s,3H),2.52-2.33(m,3H),2.17-1.99(m,3H),1.64-1.45(m,2H)。HRMS(M H) [C26H25BrN4O2S H]的计算值:537.0960;实测值:537.0961。
顺式1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺(8c)。
类似于8b的合成制备为白色固体的标题化合物,4.0%总产率。LC-MS(ESI)m/z[M 1] =524.4和526.5;1H NMR NMR(400MHz,DMSO-d)δ8.78(dd,1H,J=5.9,0.8Hz),8.47(d,1H,J=7.8Hz),8.29(s,1H),8.16(d,1H,J=7.8Hz),8.05-8.01(m,2H),7.88(s,2H),7.58-7.55(m,2H),7.31(s,1H),7.23(d,1H,J=4.3Hz),5.55-5.49(m,1H),3.85-3.69(m,1H),2.47-2.39(m,1H),2.36-2.25(m,1H),2.13-2.10(m,1H),1.96-1.88(m,3H),1.48-1.44(m,2H)。HRMS(M H) [C24H22BrN5O2S H]的计算值:524.0756;实测值:524.0757。
顺式1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-2-(吡啶-3-基)-1H-苯并[d]咪唑-5-甲酰胺(8d)。
类似于8b的合成制备为白色固体的标题化合物,4.6%五步总产率(从4-氟-3-硝基-苯甲酸)。LC-MS(ESI)m/z[M 1] =524.6和526.1;H NMR NMR(400MHz,DMSO-d6)δ8.88(d,1H,J=2.4Hz),8.79(d,1H,J=4.2Hz),8.45(d,1H,J=7.8Hz),8.29(s,1H),8.12(m,1H),8.03(s,1H),7.88(s,2H),7.66(d,1H,J=5.1Hz),7.64(d,1H,J=5.8Hz),7.55(d,1H,J=3.9Hz),7.32(m,1H),7.24(d,1H,J=3.9Hz),4.38(m,1H),3.82(m,1H),1.98-1.95(m,1H),2.38-2.35(m,1H),2.48-2.42(m,1H),1.90-1.83(m,2H),1.42-1.44(m,2H)。HRMS(M H) [C24H22BrN5O2S H]的计算值:524.0756;实测值:524.0753。
顺式1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-2-(吡啶-4-基)-1H-苯并[d]咪唑-5-甲酰胺(8e)。
类似于8b的合成制备为白色固体的标题化合物,4.0%五步总产率(从4-氟-3-硝基-苯甲酸)。LC-MS(ESI)m/z[M 1] =524.6和526.1;H NMR NMR(400MHz,DMSO-d6)δ8.82(d,2H,J=5.5Hz),8.45(d,1H,J=8.4Hz),8.30(s,1H),8.03(m,1H),7.88(s,2H),7.74(d,2H,J=5.5Hz),7.55(d,1H,J=3.5Hz),7.33(m,1H),7.24(d,1H,J=3.2Hz),4.44(m,1H),3.88(m,1H),2.42-2.39(m,1H),2.36-2.33(m,1H),2.22-2.12(m,1H),1.99-1.96(m,1H),1.99-1.96(m,2H),1.43(m,2H)。HRMS(M H) [C24H22BrN5O2S H]的计算值:524.0756;实测值:524.0757。
顺式N-(3-氨基环己基)-5-溴噻吩-2-甲酰胺(6,TFA盐)。
向5-溴噻吩-2-甲酸(19.27g,93mmol)的DCM(200mL)溶液中添加HOBt(16.29g,106mmol)、EDCI(20.40g,106mmol)和三乙胺(29.7mL,213mmol)。将混合物在室温下搅拌30分钟。然后添加(3-氨基环己基)氨基甲酸叔丁酯(19.0g,89mmol)。将反应在室温下搅拌过夜。过滤沉淀,用DCM洗涤,得到为白色固体的顺式-化合物顺式-3-(5-溴噻吩-2-甲酰胺基)环己基)氨基甲酸叔丁酯(两种顺式异构体的混合物,12.0g,29.8mmol,33.6%产率)(滤液主要含有反式异构体)。LC-MS(ESI)m/z=405.0(M H) ;1H NMR(300MHz,DMSO-d6)δ8.37(d,J=7.78Hz,1H),7.62(d,J=3.99Hz,1H),7.26(d,J=3.99Hz,1H),6.85(d,J=7.78Hz,1H),3.7(m,1H),3.26(m,1H),1.93(d,J=11.58Hz,1H),1.73(m,3H),1.38(br.s.,9H),1.31-1.14(m,4H)。向上述Boc保护的中间体顺式-3-(5-溴噻吩-2-甲酰胺基)环己基)氨基甲酸叔丁酯(12.0g,29.8mmol)的DCM(100mL)溶液中添加TFA(22.10mL,298mmol)。将混合物在室温下搅拌4小时,然后真空浓缩,得到棕色粘稠油状物。将该油状物用二异丙基醚研磨,得到为米色粉末的标题化合物6(12.0g,97%产率)。LC-MS(ESI)m/z=304.9(M H) 。
顺式5-溴-N-3-((4-(甲基氨基甲酰基)-2-硝基苯基)氨基)环己基)噻吩-2-甲酰胺(7)。
向4-氟-N-甲基-3-硝基苯甲酰胺(4.99g,25.2mmol)的乙醇(100mL)溶液中添加化合物6(TFA盐,10.0g,23.97mmol),然后添加DIEA(8.71mL,52.7mmol)。将所得物在85℃下加热6小时,然后在室温下过夜。使反应真空浓缩,并且将残余物用水和乙酸乙酯(200mL)处理。过滤形成的黄色油状物并用二异丙醚洗涤,得到为黄色粉末的标题化合物7(8.8g,76%产率)。LC-MS:Rt=3.07min,MS(ESI)m/z=482.8(M H) ;1H NMR(300MHz,DMSO-d6)δ8.63(s,5H),8.45(m,2H),8.10(d,J=7.78Hz,1H),7.98(d,J=8.73Hz,1H),7.62(d,J=3.80Hz,1H),7.25(m,2H),3.91(m,1H),3.87(m,1),2.77(d,J=3.99Hz,3H),2.22(m,1H),2.02(m,1H),1.9-1.79(m,2H),1.47(m,2H),1.31(m,2H)。
顺式1-3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(噻吩-2-基)-1H-苯并[d]咪唑-5-甲酰胺(8f)。
将化合物7(241mg,0.5mmol)、噻吩-2-甲醛(72.9mg,0.650mmol)和连二亚硫酸钠(0.261g,1.500mmol)混合在1,4-二氧杂环己烷(4mL)和H2O(2mL)中。将反应混合物在微波辐射下在130℃下加热1小时。然后将反应混合物真空浓缩。向残余物中添加水,并且用乙酸乙酯(2×50mL)萃取水相。将有机相用水洗涤,然后经Na2SO4干燥和真空浓缩。将残余物在硅胶柱上进行色谱,用CH2Cl2/MeOH=94/6(v/v)洗脱,得到为黄色固体的标题化合物8f,29.4%产率(80mg)。LC-MS(ESI)m/z=544.8(M H) ;1H NMR(300MHz,DMSO-d6)δ8.49(m,2H),8.19(br s,1H),7.96-7.75(m,3H),7.60(br s,2H),7.3(m,2H),4.79(br s,1H),3.94(br s,1H),2.83(br s,3H),2.46-2.22(m,2H),2.16(m,1H),1.94(m,3H),1.54(m,2H);HRMS(M H) [C24H23BrN4O2S2 H]的计算值:543.0524;实测值:543.0547。
顺式1-3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(噻吩-3-基)-1H-苯并[d]咪唑-5-甲酰胺(8g)。
类似于8f的合成制备为黄色固体的标题化合物,33.1%产率。LC-MS(ESI)m/z=544.8(M H) ;1H NMR(300MHz,DMSO-d6)δ8.49(m,2H),8.20(s,1H),8.05(br s,1H),7.83(br s,3H),7.59(m,1H),7.50(d,J=4.18Hz,1H),7.26(m,1H),4.59(br s,1H),3.88(br s,1H)2.83(m,3H),2.43-2.26(m,2H),2.12(m,1H),2.05-1.80(m,3H),1.48(m,2H);HRMS(M H) [C24H23BrN4O2S2 H]的计算值:543.0524;实测值:543.0543。
顺式1-3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(2-甲基噻唑-4-基)-1H-苯并[d]咪唑-5-甲酰胺(8h)。
向化合物7(241mg,0.5mmol)的1,4-二氧杂环己烷(10mL)和水(1mL)的溶液中添加2-甲基噻唑-4-甲醛(95mg,0.750mmol)和连二亚硫酸钠(261mg,1.500mmol)。将所得物在85℃下加热24小时,然后冷却至室温。使反应真空浓缩,并且将残余物用水和乙酸乙酯(20mL)处理。将形成的灰白色固体滤出,并且用二异丙醚洗涤,干燥后,得到为灰白色粉末的标题化合物8h(160mg,57.3%产率)。LC-MS(ESI)m/z=559.8(M H) ;1H NMR(300MHz,DMSO-d6)δ8.48(m,2H),8.26(s,1H),8.19(s,1H),7.83(m,2H),7.6(d,J=3.99Hz,1H),7.27(d,J=3.99Hz,1H),5.47(m,1H),3.91(m,1H),2.82(m,6H),2.47-2.17(m,2H),2.10(d,J=10.82Hz,1H),1.94(d,J=7.59Hz,3H),1.5(m,2H)。
顺式1-3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(噻唑-2-基)-1H-苯并[d]咪唑-5-甲酰胺(8i)。
类似于8h的合成制备为奶白色粉末的标题化合物,25.7%产率。LC-MS(ESI)m/z=545.8(M H) ;1H NMR(300MHz,DMSO-d6)δ8.52(m,2H),8.25(s,1H),8.17(d,J=3.23Hz,1H),8.04(d,J=3.23Hz,1H),7.89(q,J=8.73Hz,2H),7.60(d,J=3.99Hz,1H),7.27(d,J=3.99Hz,1H),6.11(br s,1H),3.97(br s,1H),2.83(d,J=4.37Hz,3H),2.22-2.48(m,2H),2.15(d,J=11.58Hz,1H),1.96(d,J=8.54Hz,3H),1.53(m,2H)。
顺式1-3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(1H-吡唑-3-基)-1H-苯并[d]咪唑-5-甲酰胺(8j)。
类似于8h的合成制备为黄色固体的标题化合物,70.2%产率。LC-MS(ESI)m/z=528.9(M H) ;1H NMR(300MHz,DMSO-d6)δ8.55(d,J=6.64Hz,2H),8.21(br s,1H),8.07(br s,1H),7.98(d,J=8.54Hz,1H),7.88(d,J=8.16Hz,1H),7.60(d,J=3.99Hz,1H),7.27(d,J=3.99Hz,1H),7.04(br s,1H),5.76(br s,1H),3.95(br s,1H),2.84(d,J=3.99Hz,3H),2.25-2.47(m,2H),2.18(m,1H),1.95(m,3H),1.52(m,2H)。
顺式1-3-(5-氰基噻吩-2-甲酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺(9Aa)。
使用5-氰基噻吩-2-甲酸代替5-溴噻吩-2-甲酸,类似于8b的合成制备为白色固体的标题化合物。LC-MS(ESI)m/z[M 1] 471.2;1H NMR(400MHz,DMSO-d6)δ8.81-8.77(m,2H),8.30(s,1H),8.18(d,1H,J=6.8Hz),8.03(m,2H),7.95(d,1H,J=4.0Hz),7.88(s,2H),7.82(d,1H,J=3.6Hz),7.56(m,1H),7.32(m,1H),5.55(m,1H),3.89(m,1H),2.31(m,2H),2.26(m,1H),1.91(m,3H),1.49(m,2H)。HRMS(M H) [C25H22N6O2S H]的计算值:471.1603;实测值:471.1608。
顺式1-(3-(5-氯噻吩-2-甲酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺(9Ab)。
使用5-氯噻吩-2-甲酸代替5-溴噻吩-2-甲酸,类似于8b的合成制备为白色固体的标题化合物。LC-MS(ESI)m/z[M 1] =480.2和482.1;1H NMR(400MHz,DMSO-d6)δ8.78(d,1H,J=4.4Hz),8.49(d,1H,J=8.0Hz),8.30(s,1H),8.18(d,1H,J=7.6Hz),8.05-8.02(m,2H),7.87(s,2H),7.61(d,1H,J=3.6Hz),7.58-7.55(m,1H),7.32(br,1H),7.14(d,1H,J=4.0Hz),5.54(m,1H),3.88(m,1H),2.31(m,2H),2.13(m,1H),1.89-1.91(m,3H),1.46(m,2H)。HRMS(M H) [C24H22ClN5O2S H]的计算值:480.1261;实测值:480.1263。
顺式1-(3-(5-甲基噻吩-2-甲酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺(9Ac)。
使用5-甲基噻吩-2-甲酸代替5-溴噻吩-2-甲酸,类似于8b的合成制备为白色固体的标题化合物。LC-MS(ESI)m/z[M 1] =460.2;1H NMR(400MHz,DMSO-d6)δ8.78(d,1H,J=4.8Hz),8.30(s,1H),8.25(d,1H,J=9.6Hz),8.17(d,1H,J=7.6Hz),8.04(m,2H),7.89(s,2H),7.60-7.57(m,1H),7.52(d,1H,J=3.6Hz),7.34(br,1H),6.80(d,1H,J=4.0Hz),5.52(m,1H),3.86(m,1H),2.30-2.21(m,2H),2.13(m,1H),1.96(m,1H),1.89(m,2H),1.46(m,2H)。HRMS(M H) [C25H25N5O2S H]的计算值:460.1807;实测值:460.1808。
顺式1-(3-(5-溴-N-甲基噻吩-2-甲酰氨基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺(9Ad)。
向4-氟-3-硝基苯甲腈(0.717g,4.31mmol)的乙醇(20mL)溶液中添加顺式N-(-3-氨基环己基)-5-溴噻吩-2-甲酰胺(TFA盐,1.5g,3.60mmol),然后添加DIEA(1.307mL,7.91mmol)。将反应混合物在85℃下加热6小时,然后在室温下过夜。真空去除乙醇,然后添加水,随后添加乙酸乙酯(200mL)。收集形成的黄色固体并用二异丙醚研磨,得到为黄色粉末的标题化合物i(顺式异构体的混合物)(1.25g,77%产率)。LC-MS(ESI)m/z=448.8(M H) ;1H NMR(300MHz,DMSO-d6)δ8.52(d,J=1.90Hz,1H),8.43(d,J=7.59Hz,1H),8.23(d,J=7.97Hz,1H),7.85(dd,J=9.11,1.71Hz,1H),7.62(d,J=3.99Hz,1H),7.22-7.39(m,2H),3.90(br s,2H),2.18(m,1H),1.98(d,J=9.87Hz,1H),1.74-1.92(m,2H),1.20-1.59(m,4H)。使用化合物i和吡啶甲醛作为起始材料,类似于8h制备为乳白色固体的化合物ii(顺式异构体的混合物),43.4%产率。LC-MS(ESI)m/z=507.9(M H) ;1H NMR(300MHz,DMSO-d6)δ8.81(d,J=4.18Hz,1H),8.50(d,J=7.78Hz,1H),8.32(d,J=1.14Hz,1H),8.21(d,J=7.97Hz,1H),7.98-8.14(m,2H),7.74(dd,J=8.64,1.42Hz,1H),7.53-7.68(m,2H),7.27(d,J=3.99Hz,1H),5.58(t,J=12.24Hz,1H),3.90(br s,1H),2.40(q,J=12.08Hz,1H),2.27(d,J=8.92Hz,1H),2.16(m,1H),1.82-2.08(m,3H),1.35-1.61(m,2H)。向化合物ii(950mg,1.876mmol)的DMF(20mL)溶液中添加氢化钠(90mg,3.75mmol),然后添加碘甲烷(293mg,2.064mmol)。将反应混合物在室温下搅拌4小时,然后减压浓缩。使残余物在水与乙酸乙酯(20mL)之间分层。将有机层用水洗涤两次,然后经无水Na2SO4干燥并减压浓缩。将残余物用二异丙基醚/CH2Cl2研磨,并且将所得沉淀过滤并干燥,得到为灰白色固体的化合物iii(顺式异构体的混合物)(910mg,93%产率)。LC-MS(ESI)m/z=521.9(M H) 。将化合物iii(894mg,1.718mmol)在硫酸(2000mg,20.39mmol)和水(37.1mg,2.061mmol)中的混合物在室温下搅拌1小时,然后用水和乙酸乙酯(20mL)稀释。用NaOH(1N)中和混合物。将有机层用水洗涤两次,然后经无水Na2SO4干燥并减压浓缩。将残余物通过在硅胶柱上通过色谱法纯化,用CH2Cl2/MeOH(95/5v/v)洗脱,得到为白色固体的期望化合物9Ad(顺式异构体的混合物)(200mg,21.62%产率)。LC-MS(ESI)m/z=540.0(M H) ;1H NMR(300MHz,CDCl3)δ8.74(d,J=4.36Hz,1H),8.28(m,2H),7.92(m,2H),7.76(d,J=8.54Hz,1H),7.44(ddd,J=7.54,4.89,1.04Hz,1H),7.14(d,J=3.80Hz,1H),7.03(d,J=3.80Hz,1H),5.77(m,1H),4.54(br s,1H),3.15(s,3H),2.60(q,J=12.08Hz,1H),2.3(m,2H),2.11(m,2H),1.93(m,1H),1.48-1.85(m,2H)。HRMS(M H) [C25H24BrN5O2S H]的计算值:538.0912;实测值:538.0934。
顺式1,3-(5-溴噻吩-2-磺酰胺基)环己基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺(9Ae)。
使用5-溴噻吩-2-磺酰氯代替5-溴噻吩-2-甲酸,类似于8b制备标题化合物,43.3%产率(13.4mg)。LC-MS(ESI)m/z[M 1] =560.1和562.1;1H NMR(400MHz,DMSO-d6)δ8.72(d,1H,J=4.4Hz),8.29(s,1H),8.19(d,1H,J=7.2Hz),8.16(d,1H,J=8.0Hz),8.04(m,2H),7.85(s,2H),7.58(m,1H),7.45(d,1H,J=4.0Hz),7.33(br,1H),7.30(d,1H,J=4.4),5.34(m,1H),3.23(m,1H),2.26-2.21(m,2H),2.03(m,1H),1.83-1.79(m,3H),1.41(m,2H)。HRMS(M H) [C23H22BrN5O3S2 H]的计算值:560.0426;实测值560.0423。
顺式-2-溴-N-(3-(5-(甲基氨基甲酰基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-1-基)环己基)噻唑-5-甲酰胺(9Ba)。
使用2-溴噻唑-5-甲酸代替5-溴噻吩-2-甲酸,类似于8b制备标题化合物,32%产率(63mg)。LC-MS(ESI)m/z=540.8(M H) ;1H NMR(300MHz,DMSO-d6)δ8.79(d,J=4.18Hz,1H),8.73(d,J=7.78Hz,1H),8.49(d,J=4.55Hz,1H),8.27(s,1H),8.2(m,2H),8.05(td,J=7.73Hz,1.61Hz,1H),7.87(m,2H),7.58(td,J=6.17,0.95Hz,1H),5.56(t,J=12.15Hz,1H),3.9(m,1H),2.83(d,J=4.37Hz,3H),2.23-2.47(m,2H),2.17(d,J=11.20Hz,1H),1.83-2.06(m,3H),1.57(m,2H);HRMS(M H) [C24H23BrN6O2S H]的计算值:539.0865;实测值:539.0856。
顺式1-(3-(5-溴-1-甲基-1H-吡咯-2-甲酰氨基)环己基)-N-甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺(9Bb)。
使用5-溴-1-甲基-1H-吡咯-2-甲酸代替5-溴噻吩-2-甲酸,类似于8b制备为奶白色固体的标题化合物,30.7%产率。LC-MS(ESI)m/z=536.9(M H) ;1H NMR(300MHz,DMSO-d6)δ8.80(d,J=4.18Hz,1H),8.48(d,J=4.36Hz,1H),8.22(m,2H),8.04(m,2H),7.87(m,2H),7.58(m,1H),6.82(d,J=3.99Hz,1H),6.22(d,J=3.99Hz,1H),5.57(br.s.,1H),3.87(m,1H),3.8(s,3H),2.84(d,J=4.18Hz,3H),2.43(m,1H),2.26(d,J=10.06Hz,1H),2.10(d,J=11.20Hz,1H),1.99-1.89(m,3H),1.46(m,2H)。HRMS(M H) [C26H27BrN6O2 H]的计算值:535.1457;实测值:535.1448。
顺式-1-(3-(4-溴-1H-吡咯-2-甲酰氨基)环己基)-N-甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺(9Bc)。
使用4-溴-1H-吡咯-2-甲酸代替5-溴噻吩-2-甲酸,类似于8b制备为白色固体的标题化合物,7.4%产率。LC-MS(ESI)m/z=523.0(M H) ;1H NMR(300MHz,DMSO-d6)δ11.79(br s,1H),8.80(br s,1H),8.49(br s,1H),8.26(br s,1H),8.20(d,J=7.78Hz,1H),8.04(m,2H),7.89(m,2H),7.59(br s,1H),6.95(br s,1H),6.86(br s,1H),5.55(br s,1H),3.90(br s,1H),2.84(br s,3H),2.41-2.13(m,3H),1.92(m,3H),1.46(m,2H)。HRMS(M H) [C25H25BrN6O2 H]的计算值:521.1301;实测值:521.1252。
顺式-3-氯-N-(3-(5-(甲基氨基甲酰基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-1-基)环己基)异噁唑-5-甲酰胺(9Bd)。
使用3-氯异噁唑-5-甲酸代替5-溴噻吩-2-甲酸,类似于8b制备为白色固体的标题化合物,66.4%产率。LC-MS(ESI)m/z=479.1(M H) ;1H NMR(300MHz,DMSO-d6)δ9.07(d,J=7.97Hz,1H),8.79(d,J=4.36Hz,1H),8.48(d,J=4.36Hz,1H),8.27(s,1H),8.20(d,J=7.97Hz,1H),8.04(td,J=7.69,1.52Hz,1H),7.87(m,2H),7.58(dd,J=6.93,5.41Hz,1H),7.36(s,1H),5.57(t,J=11.96Hz,1H),3.97(br s,1H),2.84(d,J=4.37Hz,3H),2.56(m,1H),2.19-2.36(m,1H),2.15(m,1H),1.99-1.9(m,3H),1.38-1.65(m,2H)。HRMS(M H) [C24H23ClN6O3 H]的计算值:479.1598;实测值:479.1573。
顺式5-溴-N-(3-(2-(吡啶-2-基)-1H-苯并[d]咪唑-1-基)环己基)噻吩-2-甲酰胺(10a)。
使用顺式5-溴-N-3-((2-硝基苯基)氨基)环己基)噻吩-2-甲酰胺和吡啶甲醛作为起始材料,类似于8f制备为黄色固体的标题化合物,16.6%产率(40mg)。LC-MS(ESI)m/z=483.0(M H) ;1H NMR(300MHz,DMSO-d6)δ8.78(d,J=4.37Hz,1H),8.50(d,J=7.78Hz,1H),8.19(d,J=7.78Hz,1H),8.03(t,J=7.02Hz,1H),7.85(d,J=7.78Hz,1H),7.75(d,J=7.40Hz,1H),7.57(m,2H),7.3(m,3H),5.58(m,1H),3.89(br s,1H),2.38-2.47(m,1H),2.30(d,J=8.92Hz,1H),2.12(d,J=11.39Hz,1H),1.94(m,3H),1.48(m,H)。HRMS(M H) [C23H21BrN4OS H]的计算值:481.0698;实测值:481.0633。
顺式1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N,N-二甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺(10b)。
使用4-氟-3-硝基苯甲酸甲酯作为起始材料(代替从4-氟-3-硝基苯甲酸转化的4-氟-N-甲基-3-硝基苯甲酰胺),类似于8b制备对应的甲酯(化合物iv),30%产率(400mg)。将甲酯皂化,得到为粗样品的相应的酸v。MS(ESI)m/z[M 1] =524.9和526.9。将以上粗酸(60mg,0.114mmol)添加到HATU(43.4mg,0.114mmol)、DIEA(40uL,0.228mmol)和二甲胺(HCl盐,13.97mg,0.171mmol)的DMF(2mL)溶液中并在室温搅拌1小时。将反应物真空浓缩并将残余物通过HPLC纯化,得到标题化合物10b(两种顺式异构体的混合物),15.6%产率(11.9mg)。LC-MS(ESI)m/z[M 1] =552.2和554.2;1H NMR(400MHz,DMSO-d6)δ8.78(d,1H,J=4.4),8.47(d,1H,J=8.0Hz),8.17(d,1H,J=8.0Hz),8.03(t,1H,J=7.2Hz),7.89(d,1H,J=8.2Hz),7.76(s,1H),7.57(m,2H),7.37(d,1H,J=8.0Hz),7.24(d,1H,J=4.0),5.55(m,1H),3.90-3.80(m,1H),2.98(s,6H),235-2.25(m,2H),2.10-2.18(m,1H),1.94-2.00(m,1H),1.86-1.94(m,2H),1.52-1.41(m,2H)。HRMS(M H) [C26H26BrN5O2S H]的计算值:552.1069;实测值:552.1074。
顺式1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-环丙基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺(10c)。
使用环丙胺代替二甲胺,类似于10b制备标题化合物,14.7%产率(12.7mg)。LC-MS(ESI)m/z[M 1] =564.3和566.3;1H NMR(400MHz,DMSO-d6)δ8.78(d,1H,J=5.2),8.45-8.49(m,2H),8.25(s,1H),8.17(d,1H,J=8.0),8.04(t,1H,J=7.2Hz),7.87(d,1H,J=8.4Hz),7.83-7.81(m,1H),7.61-7.55(m,2H),7.25(d,1H,J=4.4),5.60-5.49(m,1H),4.00-3.80(m,1H),2.91-2.82(m,1H),2.44-2.33(m,1H),2.32-2.20(m,1H),2.18-2.08(m,1H),2.00-1.82(m,3H),1.53-1.40(m,2H),0.73-0.66(m,2H),0.64-0.55(m,2H)。HRMS(M H) [C27H26BrN5O2S H]的计算值:564.1069;实测值:564.1071。
顺式1-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-异丙基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺(10d)。
使用异丙胺代替二甲胺,类似于10b制备标题化合物,15.7%产率(12.2mg)。LC-MS(ESI)m/z[M 1] =568.2;1H NMR(400MHz,DMSO-d6)δ8.79(d,1H,J=4.7),8.50(d,1H,J=3.9),8.31(s,1H),8.26(d,1H,J=7.9),8.17(d,1H,J=7.9),8.10-8.02(m,1H),7.91-7.82(m,2H),7.60-7.54(m,2H),7.26(d,1H,J=4.3),5.60-5.49(m,1H),4.17-4.05(m,1H),3.90-3.75(m,1H),2.48-2.35(m,1H),2.34-2.20(m,1H),2.18-2.09(m,1H),2.00-1.84(m,3H),1.54-1.40(m,2H),1.18(d,6H,J=6.6)。HRMS(M H) [C27H28BrN5O2S H]的计算值:566.1225;实测值:566.1229。
3-((1S,3R)-3-(5-氯噻吩-2-甲酰氨基)环己基)-2-(3-氟吡啶-2-基)-N-甲基-3H-咪唑[4,5-c]吡啶-6-甲酰胺
步骤1:4-氟-N-甲基-3-硝基苯甲酰胺的合成
向在冰水浴中冷却的4-氟-3-硝基苯甲酸(3.0g,16.21mmol,1.0当量)和1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(3.74g,19.51mmol,1.2当量)的溶液中添加甲胺溶液(12.15ml的在THF中的2.0M溶液,24.31mmol,1.5当量)。将反应物温热至室温并搅拌18小时。真空蒸发溶剂,并用乙酸乙酯(200ml)稀释残余物。将有机层用饱和碳酸氢钠溶液(2x150ml)、0.5N盐酸溶液(150ml)和盐水(150ml)洗涤,经硫酸镁干燥,并且真空蒸发溶剂,得到为黄色固体的4-氟-N-甲基-3-硝基苯甲酰胺(2.10g,65%产率)。1H NMR(300MHz,DMSO-d6)δ8.80(d(宽峰),J=4.5Hz,1H),8.61(dd,J=7.5,2.3Hz,1H),8.25(m,1H),7.71(dd,J=11.1,8.7Hz,1H),2.81(d,J=4.5,3H)。
步骤2:顺式-环己烷-1,3-二基)二氨基甲酸苄酯叔丁酯的合成
向Boc-顺式-3-氨基环己烷甲酸(8.77g,36.05mmol,1.0当量)和三乙胺(5.53ml,39.65mmol,1.1当量)的甲苯(150ml)溶液中添加叠氮磷酸二苯酯(7.79ml,36.05mmol,1.0当量)。将反应混合物在回流下加热3小时,然后将温度冷却至80℃。添加苄醇(4.69ml,45.06mmol,1.25当量)和三乙胺(5.53ml,39.65mmol,1.1当量),并将反应物在80℃搅拌20小时。将反应物冷却至室温并用水(100ml)稀释。用乙酸乙酯(3×100ml)萃取水层,用盐水(100ml)洗涤合并的有机层,经硫酸镁干燥,真空蒸发溶剂。用己烷研磨粗产物,得到为无色固体的顺式-(环己烷-1,3-二基)二氨基甲酸苄酯叔丁酯(7.81g,62%产率)。1H NMR(300MHz,CDCl3)δ7.28-7.40(m,5H),5.08(s,2H),4.60(s(宽峰),1H),4.36(s(宽峰),1H),3.53(m(宽峰),2H),2.28(m,1H),1.97(m,2H),1.76(m,1H),1.64(m,1H),1.43(s,9H),0.97(m,3H)。
步骤3:顺式-3-氨基环己基)氨基甲酸叔丁酯的合成
向在帕尔加氢烧瓶中的钯/碳(10wt.%,1.19g,1.12mmol,0.05当量)的乙醇(50ml)溶液中缓慢添加N-[顺式-3-(苄氧基羰基氨基)环己基]氨基甲酸叔丁酯(2)(7.81g,22.4mmol,1.0当量)的乙醇(200mL)溶液。将反应混合物在30psi的氢气压力下氢化3小时。将反应混合物通过硅藻土过滤并真空蒸发溶剂,得到为无色固体的顺式-3-氨基环己基)氨基甲酸叔丁酯(4.70g,97%产率)。1H NMR(300MHz,CD3OD)δ3.36(m(宽峰),1H),2.76(m(宽峰),1H),2.08(m(宽峰),1H),1.74-1.91(m,3H),1.44(s,9H),1.36(m,1H),1.06(m,3H)。
步骤4:顺式-3-(((4-(甲基氨基甲酰基)-2-硝基苯基)氨基)环己基)氨基甲酸叔丁酯的合成
向N-[顺式-3-氨基环己基]氨基甲酸叔丁酯(2.27g,10.59mmol,1.0当量)和N,N-二异丙基乙胺(2.28ml,12.71mmol,1.2当量)的乙醇(30ml)溶液中添加4-氟-N-甲基-3-硝基-苯甲酰胺(2.10g,10.59mmol,1.0当量)的乙醇(20ml)。将反应物回流20小时。真空蒸发溶剂,并用水(250ml)稀释残余物。将水层用乙酸乙酯(4x250ml)萃取,经硫酸镁干燥并真空蒸发溶剂,得到为黄色固体的顺式-3-(((4-(甲基氨基甲酰基)-2-硝基苯基)氨基)环己基)氨基甲酸叔丁酯(4.24g,100%产率)。1H NMR(600MHz,DMSO-d6)δ8.62(d,J=2.1Hz,1H),8.47(q,J=4.3Hz,1H),8.07(d,J=7.9Hz,1H),7.97(dd,J=9.1,2.1Hz,1H),7.22(d,J=9.1,1H),6.87(d,J=7.9,1H),3.77(m,1H),3.43(m,1H),2.77(d,J=4.3,3H),2.12(m,1H),1.96(m,1H),1.80(m,1H),1.75(m,1H),1.42(m,1H),1.39(s,9H),1.24(m,1H),1.11(m,1H)。
步骤5:(顺式-3-((2-氨基-4-(甲基氨基甲酰基)苯基)氨基)环己基)氨基甲酸叔丁酯的合成
向在帕尔加氢烧瓶中的钯/碳(10wt.%,1.15g,10.8mmol,1.0当量)的乙醇(50ml)溶液中缓慢添加N-[顺式-3-(苄氧基羰基氨基)环己基]氨基甲酸叔丁酯(7.81g,10.8mmol,1.0当量)的乙醇(200mL)溶液。将反应混合物在40psi的氢气压力下氢化1小时。将反应混合物通过硅藻土过滤并真空蒸发溶剂,得到为无色固体的(顺式-3-((2-氨基-4-(甲基氨基甲酰基)苯基)氨基)环己基)氨基甲酸叔丁酯(3.92g,100%产率)。1H NMR(300MHz,CDCl3)δ7.32(d,J=1.7Hz,1H),7.17(dd,J=8.4,1.7Hz,1H),6.66(d,J=8.4Hz,1H),6.29(s(宽峰),1H),4.55(s(宽峰),1H),3.55(s(宽峰),1H),3.37(m,1H),3.00(m,1H),2.97(d,J=4.5Hz,3H),2.41(m(宽峰),1H),2.04(m(宽峰),2H),1.84(m(宽峰),1H),1.45(s,9H),1.09(m,3H)。
步骤6:(顺式-3-(5-(甲基氨基甲酰基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-1-基)环己基)氨基甲酸叔丁酯的合成
向N-[顺式-3-[2-氨基-4-(甲基氨基甲酰基)苯胺基]环己基]氨基甲酸叔丁酯(3.92g,10.8mmol,1.0当量)和2-吡啶甲醛(1.24ml,12.96mmol,1.2当量)的N,N-二甲基甲酰胺(70ml)和水(3ml)的溶液中添加过氧单硫酸钾(4.32g,7.02mmol,0.65当量)。将反应物搅拌3小时。将水(30ml)添加至反应混合物中并用1N氢氧化钠溶液将pH调节至9,搅拌30分钟。将混合物用乙酸乙酯(4×100ml)萃取,用盐水(150ml)洗涤,经硫酸镁干燥,并真空蒸发溶剂。将粗物质通过二氧化硅色谱(用0至5%甲醇的二氯甲烷溶液洗脱)纯化,得到为无色固体的(顺式-3-(5-(甲基氨基甲酰基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-1-基)环己基)氨基甲酸叔丁酯(4.46g,92%产率)。1H NMR(300MHz,CDCl3)δ8.73(d,J=4.9Hz,1H),8.29(d,J=8.1Hz,1H),8.21(s,1H),7.90(m,2H),7.69(d,J=8.5Hz,1H),7.43(dd,J=7.2,4.9Hz,1H),6.43(d(宽峰),J=4.9Hz,1H),5.69m(宽峰),1H),4.65(s(宽峰),1H),3.63(m(宽峰),1H),3.06(d,J=4.9Hz,3H),2.39m(宽峰),1H),1.94-2.26(m,5H),1.569m,1H),1.42(s,9H),1.29(m,1H)。
步骤7:1-(顺式-3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺的合成
向(顺式-3-(5-(甲基氨基甲酰基)-2-(吡啶-2-基)-1H-苯并[d]咪唑-1-基)环己基)氨基甲酸叔丁酯(6)(4.46g,9.92mmol,1.0当量)的二氯甲烷(80ml)溶液中添加三氟乙酸(7.59mL,99.21mmol,10.0当量)。将反应物搅拌2小时。真空蒸发溶剂,得到N-甲基-2-(2-吡啶基)-1-[顺式-3-氨基环己基]苯并咪唑-5-甲酰胺三氟乙酸盐,其直接使用。将5-溴噻吩-2-甲酸(3.08g,14.88mmol,1.5当量)的N,N-二甲基甲酰胺(100ml)溶液在冰浴中冷却至0℃。添加(1-[双(二甲基氨基)亚甲基]-1H-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐(5.66g,14.88mmol,1.5当量)和N,N-二异丙基乙胺(10.69ml,59.53mmol,6.0当量)并搅拌30分钟。添加N-甲基-2-(2-吡啶基)-1-[顺式-3-氨基环己基]苯并咪唑-5-甲酰胺三氟乙酸盐(4.60g,9.92mmol)的N,N-二甲基甲酰胺(50ml)溶液。将反应物温热至室温并搅拌20小时。将反应混合物倒入饱和碳酸氢钠溶液(200ml)中。将混合物用乙酸乙酯(4×100ml)萃取,用盐水(200ml)洗涤,经硫酸镁干燥,并真空蒸发溶剂。将粗物质通过二氧化硅色谱(用0至5%甲醇的二氯甲烷溶液洗脱)纯化,得到为灰白色固体的1-(顺式-3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺(3.68g,69%产率)。1H NMR(600MHz,DMSO-d6)δ8.80(d,J=4.6Hz,1H),8.52(d,J=7.8Hz,1H),8.49(q,J=4.4Hz,1H),8.26(s,1H),8.21(d,J=7.8Hz,1H),8.05(dd,J=7.8,1.2Hz,1H),7.91(d,J=8.5Hz,1H),7.85(d,J=8.5Hz,1H),7.59(m,2H),7.27(d,J=4.0Hz,1H),5.56(m,1H),3.89(m,1H),2.84(d,J=4.4Hz,3H),2.43(m,1H),2.29(m,1H),2.14(m,1H),1.98(m,1H),1.93(m,2H),1.48(m,2H)。
1-(5-(5-溴噻吩-2-甲酰氨基)四氢-2H-吡喃-3-基)-6-氟-N-甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺(234)
5-乙氧基-2H-吡喃-3(6H)-酮的制备
向1000ml圆底烧瓶中放入氧杂环己烷-3,5-二酮(10.00g,87.64mmol,1.00当量)和0.28mL的浓H2SO4的300mL乙醇溶液。将其在室温搅拌2小时。所需产物可以通过LC-MS检测。粗产物6E无需进一步纯化直接用于下一步骤。
5-氨基-2H-吡喃-3(6H)-酮的制备
向1000mL圆底烧瓶中放入约5-乙氧基-2,6-二氢吡喃-3-酮(9.20g,64.72mmol,1.00当量)的300mL乙醇溶液,在0℃下缓慢引入NH3气体,持续3小时。所需产物可以通过LC-MS检测([M H] :114.1)。将其浓缩并将残余物在硅胶柱上用40%乙酸乙酯/石油醚纯化,得到为白色固体的5-氨基-2,6-二氢吡喃-3-酮(6.6g,90.2%)。
5-氨基四氢-2H-吡喃-3-醇的制备
向500ml压力罐中放入5-氨基-2,6-二氢吡喃-3-酮(6.60g,58.35mmol,1.00当量)、雷尼Ni(8.00g)的250mL乙醇溶液,将混合物用氮气吹扫3次,然后在100℃在50atm下用H2气体搅拌2天。所需产物可以通过LCMS检测。将反应混合物冷却至室温。过滤后,将滤液真空浓缩,得到为无色油状物的5-氨基氧杂环己烷-3-醇(5.1g,74.6%)。LC-MS:([M H] ):118.1。
5-羟基四氢-2H-吡喃-3-甲酸苄酯的制备
向100mL圆底烧瓶中放入5-氨基氧杂环己烷-3-醇(4.00g,34.15mmol,1.00当量)、氯甲酸苄酯(6.99g,40.97mmol,1.20当量)、三乙胺(10.37g,102.44mmol,3.00当量)的40mL四氢呋喃溶液,将其在室温搅拌4小时。所需产物可以通过LC-MS检测。减压浓缩溶液。将其浓缩并将残余物在硅胶柱上用40%乙酸乙酯/石油醚纯化,得到为无色油状物的N-(5-羟基氧杂环己烷-3-基)氨基甲酸苄酯(3.8g,44.3%)。LC-MS:([M H] ):252.1.
5-氧代四氢-2H-吡喃-3-甲酸苄酯的制备
向100ml圆底烧瓶中放入N-(5-羟基氧杂环己烷-3-基)氨基甲酸苄酯(3.80g,15.12mmol,1.00当量)、戴斯马丁高碘烷(19.24g,45.37mmol,3.00当量)的40mL二氯甲烷溶液。将反应混合物在室温搅拌2小时,所需产物可以通过LCMS检测。将残余物用100mL的NaHCO3溶液稀释并用3x100mL的二氯甲烷萃取,将合并的有机层经无水Na2SO4干燥并过滤并浓缩,将粗产物在硅胶柱上用含50%的乙酸乙酯的石油醚纯化,得到为无色油状物的N-(5-氧代氧杂环己烷-3-基)氨基甲酸苄酯(1.9g,50.4%)。LC-MS:([M H] ):250.1.
5-氧代四氢-2H-吡喃-3-甲酸苄酯的制备
向100ml圆底烧瓶中放入N-(5-氧代氧杂环己烷-3-基)氨基甲酸苄酯(1.80g,7.22mmol,1.00当量)、氨基甲酸叔丁酯(2.54g,21.66mmol,3.00当量)、三乙基硅烷(2.519g,21.66mmol,3.00当量)、2,2,2-三氟乙酸(1.647g,14.44mmol,2.00当量)的50mL乙腈溶液。将反应混合物在N2下在38℃搅拌2天,并且所需产物可以通过LC-MS检测。通过过滤将固体滤出,并将滤液减压浓缩。将混合物浓缩并通过反相色谱(用含70%乙腈的水(0.1%NH4HCO3)洗脱)纯化,得到为白色固体的N-[5-[(叔丁氧基羰基)氨基]氧杂环己烷-3-基]氨基甲酸苄酯(210mg,8.3%)。该手性HPLC数据表明结构是顺式-反式混合物,并且比率是1:1。LC-MS:([M H] ):368.2.
5-氧代四氢-2H-吡喃-3-甲酸苄酯的制备
向50mL圆底烧瓶中添加N-[5-[(叔丁氧基羰基)氨基]氧杂环己烷-3-基]氨基甲酸苄酯(160.0mg,0.46mmol,1.00当量)、Pd/C(9.72mg,0.09mmol,0.20当量)的15mL异丙醇溶液,将其在H2气氛下在室温搅拌4小时。过滤后,将滤液真空浓缩,得到为白色固体的N-(5-氨基氧杂环己烷-3-基)氨基甲酸叔丁酯(59mg,59.7%)。1H-NMR-PH-ICA-002-015-7:1H NMR(300MHz,DMSO-d6)δ6.86(d,J=8.1Hz,1H),3.67-3.65(m,2H),2.88-2.60(m,3H),2.07-1.58(m,3H),1.38(s,9H),1.18-0.74(m,2H)。LC-MS:[M H] :217.2.
1-(5-(5-溴噻吩-2-甲酰氨基)四氢-2H-吡喃-3-基)-6-氟-N-甲基-2-(吡啶-2-基)-1H-苯并/d]咪唑-5-甲酰胺的制备
1-(5-(5-溴噻吩-2-甲酰氨基)四氢-2H-吡喃-3-基)-6-氟-N-甲基-2-(吡啶-2-基)-1H-苯并[d]咪唑-5-甲酰胺(243)可以由5-氧代四氢-2H-吡喃-3-甲酸苄酯以类似于化合物286和287所述的方式制备。
3-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-苯基-1H-吲哚-6-甲酰胺(283)
(3-(6-(甲基氨基甲酰基)-1H-吲哚-3-基)环己基)氨基甲酸苄酯的制备
将(3-氧代环己基)氨基甲酸苄酯(1030.38mg,4.17mmol)添加至N-甲基-1H-吲哚-6-甲酰胺(500mg,2.87mmol)的DCM(10mL)溶液中。将溶液冷却至10℃,然后逐滴添加三氟乙酸(0.66mL,8.61mmol),随后逐滴添加三乙基硅烷(1.83mL,11.48mmol)。将反应混合物升温至室温并且保持搅拌。将混合物倒入NaHCO3饱和溶液中并用乙酸乙酯(AcOEt)萃取3次。将合并的有机相用盐水洗涤,经MgSO4干燥并蒸发。在硅胶上使用AcOEt/己烷50/50作为洗脱剂纯化粗产物,得到1g的所需产物(86%)。MS:406.34[M H] 。
(3-(2-溴-6-(甲基氨基甲酰基)-1H-吲哚-3-基)环己基)氨基甲酸苄酯和(3-(2-溴-1-羟基-6-(甲基氨基甲酰基)-1H-吲哚-3-基)环己基)氨基甲酸苄酯的制备
将三溴吡啶(1025.34mg,3.21mmol)一次添加至N-[3-[6-(甲基氨基甲酰基)-1H-吲哚-3-基]环己基]氨基甲酸苄酯(1000mg,2.47mmol)的THF(5mL)/氯仿(5mL)溶液的冷溶液(冰浴)中。移除浴,并将反应物在室温保持2小时。将混合物用10mL的1M NaHSO3溶液、10ml的1N HCl、水洗涤,经MgSO4干燥并蒸发。UPLC显示预期产物以及MW 500的副产物,推测是预期化合物的氧化衍生物。通过HPLC使用乙腈/水(0.1%甲酸)作为洗脱剂纯化2种化合物,得到:390mg的(3-(2-溴-6-(甲基氨基甲酰基)-1H-吲哚-3-基)环己基)氨基甲酸苄酯(33%)和209mg的(3-(2-溴-1-羟基-6-(甲基氨基甲酰基)-1H-吲哚-3-基)环己基)氨基甲酸苄酯(17%)。
(3-(6-(甲基氨基甲酰基)-2-苯基-1H-吲哚-3-基)环己基)氨基甲酸苄酯的制备
向N-[3-[2-溴-6-(甲基氨基甲酰基)-1H-吲哚-3-基]环己基]氨基甲酸苄酯(145mg,0.3000mmol)、苯基硼酸(43.8mg,0.3600mmol)、四(三苯基膦)钯(0)(34.59mg,0.0300mmol)的DMF(1mL)溶液中添加碳酸钾(124.12mg,0.9000mmol)的水(0.1000mL)溶液。将混合物脱气并置于氩气下。使反应在80℃进行过夜。将混合物倒入饱和氯化钠溶液中并用乙酸乙酯萃取3次。将合并的有机相用水洗涤,经MgSO4干燥并蒸发。在硅胶上使用CH3OH/CH2Cl2 0至5%作为洗脱剂纯化粗产物,得到162mg的所需产物(112%)。产物不是纯的,但原样用于下一步骤。MS:482.41[M H]
3-(3-氨基环己基)-N-甲基-2-苯基-1H-吲哚-6-甲酰胺的制备
向N-[3-[6-(甲基氨基甲酰基)-2-苯基-1H-吲哚-3-基]环己基]氨基甲酸苄酯(46mg,0.1000mmol)的甲醇(10mL)溶液中添加钯(16.94mg,0.1000mmol)。将混合物在Parr仪器中在50psi H2气氛下在RT氢化2小时。将混合物经MgSO4过滤并蒸发,得到37mg的白色固体(111%)(在UPLC中具有相同质量的2个峰:90/10)。MS:348.38
3-(3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-苯基-1H-吲哚-6-甲酰胺(283)的制备
将3-(3-氨基环己基)-N-甲基-2-苯基-1H-吲哚-6-甲酰胺(37mg,0.1100mmol)、5-溴噻吩-2-甲酸(33.07mg,0.1600mmol)、HATU(80.98mg,0.2100mmol)、N,N-二异丙基乙胺(0.06mL,0.3200mmol)和DMF(2mL)合并并在室温搅拌5小时。将混合物倒入碳酸氢钠饱和溶液中并用乙酸乙酯萃取3次。将合并的有机相用水洗涤,经MgSO4干燥并蒸发。将粗产物在HPLC上使用乙腈/水(甲酸0.1%)20至100%纯化,得到30mg的所需产物(53%)。MS:538.28[M H] .
化合物290和304以类似于化合物283的方式制备。
3-((1S,3R)-3-(5-氯噻吩-2-甲酰氨基)环己基)-2-(3-氟吡啶-2-基)-N-甲基-3H-咪唑并[4,5-c]吡啶-6-甲酰胺(286)
((1R,3S)-3-(6-氯-2-(3-氟吡啶-2-基)-3H-咪唑并[4,5-c]吡啶-3-基)环己基)氨基甲酸叔丁酯的制备
将N-[外消旋-(1R,3S)-3-[(3-氨基-2-氯-4-吡啶基)氨基]环己基]氨基甲酸叔丁酯(507mg,1.49mmol)、3-氟-2-甲酰吡啶(186.08mg,1.49mmol)和oxone(594.38mg,0.97mmol)的DMF/水(10ml/1ml)中的混合物在60℃加热16小时。将反应混合物冷却至室温,然后用乙酸乙酯(30ml)稀释,用水(10ml)和盐水(10ml)洗涤。将有机层经硫酸钠干燥,真空蒸发,获得粗产物。将粗产物用硅胶色谱(洗脱剂,0-100%乙酸乙酯/己烷)纯化,得到((1R,3S)-3-(6-氯-2-(3-氟吡啶-2-基)-3H-咪唑并[4,5-c]吡啶-3-基)环己基)氨基甲酸叔丁酯(529mg,79.7%)。
((1R,3S)-3-(6-氰基-2-(3-氟吡啶-2-基)-3H-咪唑并[4,5-c]吡啶-3-基)环己基)氨基甲酸叔丁酯的制备
将N-[外消旋-(1R,3S)-3-[6-氯-2-(3-氟-2-吡啶基)咪唑并[4,5-c]吡啶-3-基]环己基]氨基甲酸叔丁酯(529mg,1.19mmol)、氰化锌(696.42mg,5.93mmol)、烯丙基氯化钯二聚物(43.41mg,0.12mmol)和2-二环己基膦基-2,4,6-三异丙基联苯(XPhos)(113.11mg,0.24mmol)在DMA(7ml)中的混合物在微波照射下在150℃加热200分钟。将反应溶液冷却至室温,用乙酸乙酯(50ml)稀释,用饱和碳酸氢钠(50ml)洗涤。将水溶液用乙酸乙酯(20mL x 2)萃取。将合并的有机层用盐水(30ml)洗涤,经硫酸钠干燥,过滤并真空蒸发,得到粗产物(含有DMA)。将粗产物用硅胶(12g,洗脱剂,0-100%乙酸乙酯/己烷)纯化,得到所需化合物N-[外消旋-(1R,3S)-3-[6-氰基-2-(3-氟-2-吡啶-3-基)咪唑并[4,5-c]吡啶-3-基]环己基]氨基甲酸叔丁酯(190mg,0.4353mmol,36.7%产率)。
5-氯-N-((1R,3S)-3-(6-氰基-2-(3-氟吡啶-2-基)-3H-咪唑并[4,5-c]吡啶-3-基)环己基)噻吩-2-甲酰胺的制备
将N-[外消旋-(1R,3S)-3-[6-氰基-2-(3-氟-2-吡啶基)咪唑并[4,5-c]吡啶-3-基]环己基]氨基甲酸叔丁酯(190mg,0.44mmol)和2,2,2-三氟乙酸(1mL,13.07mmol)在DCM(3mL)中的混合物在室温摇动1小时。通过减压蒸发和高真空泵去除反应溶剂。粗产物2-(3-氟-2-吡啶基)-3-[外消旋-(1S,3R)-3-氨基环己基]咪唑并[4,5-c]吡啶-6-甲腈(140mg,0.4162mmol,95.6%产率)无需进一步纯化用于下一步骤。
将2-(3-氟-2-吡啶基)-3-[外消旋-(1S,3R)-3-氨基环己基]咪唑并[4,5-c]吡啶-6-甲腈(140mg,0.4200mmol)、5-氯噻吩-2-甲酸(81.21mg,0.5mmol)、HATU(237.38mg,0.62mmol)和DIEA(0.23mL,1.25mmol)在DMF(2mL)中的混合物在室温搅拌4小时。将反应溶液用乙酸乙酯(10ml)稀释,用饱和碳酸氢钠(5ml)洗涤。将水溶液用乙酸乙酯(10mL)萃取。将合并的有机层用盐水(5ml)萃取,经硫酸钠干燥,过滤并真空蒸发,得到粗产物。将粗产物用硅胶色谱(12g,0-100%EA/Hex)纯化,获得所需产物5-氯-N-[外消旋-(1R,3S)-3-[6-氰基-2-(3-氟-2-吡啶基)咪唑并[4,5-c]吡啶-3-基]环己基]噻吩-2-甲酰胺(126mg,0.2620mmol,62.9%产率)。
3-((1S,3R)-3-(5-氯噻吩-2-甲酰氨基)环己基)-2-(3-氟吡啶-2-基)-3H-咪唑并[4,5-c]吡啶-6-甲酸的制备
将5-氯-N-[外消旋-(1R,3S)-3-[6-氰基-2-(3-氟-2-吡啶基)咪唑并[4,5-c]吡啶-3-基]环己基]噻吩-2-甲酰胺(126mg,0.26mmol)的12N HCl(3ml)溶液在80℃加热4小时。将反应溶液冷却至室温,缓慢添加过量的碳酸钾以中和溶液。然后添加乙酸乙酯以多次萃取溶液。将有机层经硫酸镁干燥,真空蒸发,获得所需产物2-(3-氟-2-吡啶基)-3-[外消旋-(1S,3R)-3-[(5-氯噻吩-2-羰基)氨基]环己基]咪唑并[4,5-c]吡啶-6-甲酸(7,85mg,0.17mmol,64.9%产率),无需进一步纯化。
3-((1S,3R)-3-(5-氯噻吩-2-甲酰氨基)环己基)-2-(3-氟吡啶-2-基)-N-甲基-3H-咪唑并[4,5-c]吡啶-6-甲酰胺(286)的制备
将2-(3-氟-2-吡啶基)-3-[外消旋-(1S,3R)-3-[(5-氯噻吩-2-羰基)氨基]环己基]咪唑并[4,5-c]吡啶-6-甲酸(85mg,0.17mmol)、HATU(96.97mg,0.2600mmol)、DIEA(0.05mL,0.2600mmol)和甲胺(0.17mL,0.34mmol,2.0M在THF中)在DMF(2ml)中的混合物在室温搅拌3小时。将粗产物用制备型-HPLC(30-100%ACN)纯化,得到所需产物2-(3-氟-2-吡啶基)-N-甲基-3-[外消旋-(1S,3R)-3-[(5-氯噻吩-2-羰基)氨基]环己基]咪唑并[4,5-c]吡啶-6-甲酰胺286(41mg,0.0799mmol,47%产率)。
3-((1R,3S)-3-(5-溴噻吩-2-甲酰氨基)环己基)-N-甲基-2-(吡啶-2-基)-3H-咪唑并[4,5-c]吡啶-6-甲酰胺(287)
步骤1:化合物287a的合成
向250mL三颈烧瓶中放入顺式-3-[(叔丁氧基羰基)氨基]环己烷甲酸(10.0g,41.1mmol)、三乙胺(9.0mL,64.50mmol)和二苯基膦酰基叠氮化物(10.0mL,46.35mmol)的250mL甲苯溶液,将得到的混合物在室温搅拌3小时。向其中添加苄醇(8.50mL,82.00mmol),并将混合物在100℃搅拌4小时,所需产物通过LCMS检测,并且耗尽起始材料酸。将反应混合物冷却,然后浓缩,将残余物在硅胶上用30%的乙酸乙酯/石油醚纯化,得到为白色固体的((1R,3S)-环己烷-1,3-二基)二氨基甲酸苄酯叔丁酯(287a)(11.2g,78.2%)。LC-MSm/z:[M-100 H] :249.2。
步骤2:化合物287b的合成
向250mL圆底烧瓶中放入((1R,3S)-环己烷-1,3-二基)二氨基甲酸苄酯叔丁酯(8.0g,233.78mmol,1.00当量)、Pd/C(800.0mg)的200mL乙酸乙酯溶液,将其在H2气氛下在室温搅拌过夜,通过TLC检测。过滤后,将滤液真空浓缩,得到为淡黄色油状物的((1S,3R)-3-氨基环己基)氨基甲酸叔丁酯(287b)(4.45g,90.4%)。
步骤3:化合物287c的合成
向500ml三颈圆底烧瓶中放入2-氯-5-氟吡啶(10.00g,76.00mmol,1.00当量)和25mL的50%过氧化氢的200mL 2,2,2-三氟乙酸溶液。将得到的混合物在70℃下搅拌直至TLC显示起始材料耗尽。将反应混合物真空浓缩并与2×40mL的甲苯共蒸发。将残余物用40mL的水和200mL的二氯甲烷稀释,并将溶液的pH值用28%氢氧化铵溶液调节至8。将水层用3x200mL的二氯甲烷萃取,将合并的有机层经无水Na2SO4干燥并过滤并浓缩,将粗产物在硅胶柱上用含10%的甲醇的二氯甲烷纯化,得到为黄色固体的2-氯-5-氟吡啶-1-氧化物(287c)(8.10g,71.2%)。
步骤4:化合物287d的合成
向500ml三颈圆底烧瓶中放入2-氯-5-氟吡啶1-氧化物(8.10g,54.90mmol,1.00当量)的110mL浓硫酸溶液。然后向其中在0℃分几批添加23.90g的硝酸钾。将反应混合物在120℃下搅拌2小时,通过TLC监测,TLC显示起始材料耗尽。然后将反应混合物用400mL的水/冰淬灭。用28%氢氧化铵溶液将溶液的pH值调节至8,同时在冰浴中将温度保持在15℃以下。通过过滤收集沉淀的淡黄色晶体,用2×50mL的水洗涤并干燥,得到为淡黄色固体的2-氯-5-氟-4-硝基吡啶1-氧化物(287d)(6.60g,62.4%)。粗产物6E无需进一步纯化直接用于下一步骤。
步骤5:化合物287e的合成
向100ml三颈圆底烧瓶中放入2-氯-5-氟-4-硝基吡啶1-氧化物(287d)(6.60g,34.28mmol,1.00当量)、((1S,3R)-3-氨基环己基)氨基甲酸叔丁酯(287b)(7.36g,34.28mmol,1.00当量)的20mL的1-甲基吡咯烷-2-酮溶液。将反应混合物在90℃搅拌4小时,将溶液冷却,然后用100mL的冰/水淬灭。通过过滤收集沉淀的黄色晶体,用2×50mL的冰/水洗涤并干燥,得到为黄色固体的5-(((1R,3S)-3-((叔丁氧基羰基)氨基)环己基)氨基)-2-氯-4-硝基吡啶1-氧化物(287e)(11.65g,87.9%)。LC-MS(ESI)m/z[M H] :387.2,389.2.
步骤6:化合物287f的合成
向100ml三颈烧瓶中放入5-(((1R,3S)-3-((叔丁氧基羰基)氨基)环己基)氨基)-2-氯-4-硝基吡啶1-氧化物(287e)(11.60g,29.99mmol,1.00当量)、Fe(5.02g,89.96mmol,3.00当量)、NH4Cl(4.81g,89.96mmol,3.00当量)的20mL乙醇和20mL水的溶液。将反应混合物在N2下90℃搅拌2小时。通过过滤将固体滤出,并将滤液减压浓缩。将混合物浓缩并通过反相色谱(用含65%的乙腈的水(0.1%甲酸)洗脱)纯化,得到为淡黄色固体的N-[(1S,3R)-3-[(4-氨基-6-氯吡啶-3-基)氨基]环己基]氨基甲酸叔丁酯(287f)(4.45g,43.5%)。1H NMR(300MHz,DMSO-d6)δ7.45(s,1H),7.12(s,1H),6.86(d,J=8.0Hz,1H),6.66(s,1H),5.06(s,1H),3.33(d,J=13.9Hz,2H),2.07(d,J=9.7Hz,1H),1.93(d,J=12.2Hz,1H),1.74(t,J=14.8Hz,2H),1.38(s,9H),1.05(m,3H)。LC-MS(ESI)m/z[M H] :341.2,343.2。
步骤7:化合物287g的合成
向50ml圆底烧瓶中放入N-[(1S,3R)-3-[(4-氨基-6-氯吡啶-3-基)氨基]环己基]氨基甲酸叔丁酯(2.45g,7.19mmol,1.00当量)、吡啶甲酸(0.88g,7.19mmol,1.00当量)、N-乙基-N-异丙基丙烷-2-胺(2.79g,21.56mmol,3.00当量)的15mL N,N-二甲基甲酰胺溶液,在0℃向其中添加O-(7-氮杂苯并三唑-1-基)-N,N,N′,N′-四甲基脲鎓六氟磷酸盐(3.28g,8.63mmol,1.20当量)并在室温搅拌过夜。将溶液减压浓缩并通过反相色谱(用含60%的乙腈的水(0.1%甲酸)洗脱)纯化,得到为紫色固体的N-[(1S,3R)-3-[[6-氯-4-(吡啶-2-酰胺基)吡啶-3-基]氨基]环己基]氨基甲酸叔丁酯(1.40g,43.7%)。LC-MS(ESI)m/z[M H] :446.2,448.2。
步骤8:化合物287h的合成
向50ml圆底烧瓶中放入N-[(1S,3R)-3-[[6-氯-4-(吡啶-2-酰胺基)吡啶-3-基]氨基]环己基]氨基甲酸叔丁酯(1.40g,3.14mmol,1.00当量)、4-甲基苯磺酸(5.41g,31.39mmol,10当量)的12mL 1-甲基吡啶烷-2-酮溶液,将其在130℃搅拌过夜。将混合物浓缩并通过反相色谱(用含55%的乙腈的水(0.1%甲酸)洗脱)纯化,得到为淡黄色固体的(1S,3R)-3-[6-氯-2-(吡啶-2-基)咪唑并[4,5-c]吡啶-3-基]环己-1-胺(287h)(650mg,63.2%)。LC-MS(ESI)m/z[M H] :328.1,330.1。
步骤9:化合物287i的合成
向50ml圆底烧瓶中放入(1S,3R)-3-[6-氯-2-(吡啶-2-基)咪唑并[4,5-c]吡啶-3-基]环己-1-胺(650.0mg,1.98mmol,1.00当量)、二碳酸二叔丁酯(519.3mg,2.38mmol,1.20当量)、N-乙基-N-异丙基丙-2-胺(768.8mg,5.95mmol,3.00当量)的10mL二氯甲烷溶液,将其在室温搅拌3小时。真空浓缩溶液。将得到的残余物通过反相色谱(用含60%的乙腈的水(0.1%甲酸)洗脱)纯化,得到为黄色固体的((1S,3R)-3-(6-氯-2-(吡啶-2-基)-3H-咪唑并[4,5-c]吡啶-3-基)环己基)氨基甲酸叔丁酯(287i)(356mg,41.9%)。LC-MS(ESI)m/z[M H] :428.1,430.1。
步骤10:化合物287j的合成
向30ml压力罐中放入N-[(1S,3R)-3-[6-氯-2-(吡啶-2-基)咪唑并[4,5-c]吡啶-3-基]环己基]-氨基甲酸叔丁酯(350.00mg,0.82mmol,1.00当量)、Pd(dppf)Cl2(777.99mg,1.06mmol,1.30当量)、三甲胺(248.29mg,2.45mmol,3.00当量)的8mL甲醇和4mL(甲基亚磺酰基)甲烷溶液。将混合物用氮气吹扫3次,然后在100℃用一氧化碳加压至30atm过夜。将反应混合物冷却至室温。将混合物浓缩并通过反相色谱(用含58%的乙腈的水(0.1%甲酸)洗脱)纯化,得到为黄色固体的3-[(1R,3S)-3-[(叔丁氧基羰基)氨基]环己基]-2-(吡啶-2-基)咪唑并[4,5-c]吡啶-6-甲酸甲酯(158mg,42.8%)。LC-MS(ESI)m/z[M H] :452.2,RT=0.70min,
步骤11:化合物287k的合成
向50ml圆底烧瓶中放入3-[(1R,3S)-3-[(叔丁氧基羰基)氨基]环己基]-2-(吡啶-2-基)咪唑并[4,5-c]吡啶-6-甲酸甲酯(158.00mg,0.35mmol,1.00当量)的20mL的4M HCl(g)的1,4-二氧杂环己烷溶液。将其在室温搅拌3小时。将溶液浓缩,得到120mg黄色固体。粗产物无需进一步纯化直接用于下一步骤。LC-MS(ESI)m/z[M H] :352.2。
步骤12:化合物2871的合成
向25ml圆底烧瓶中放入5-溴噻吩-2-甲酸(120.0mg,0.58mmol,1.20当量)、3-[(1R,3S)氨基环己基]2(吡啶基)咪唑并[4,5c]吡啶6甲酸甲酯(169.7mg,0.48mmol,1.00当量)、N-乙基-N-异丙基丙-2-胺(187.3mg,1.45mmol,3.00当量)的5mL N,N-二甲基甲酰胺溶液,在0℃向其中逐滴添加O-(7-氮杂苯并三唑-1-基)-N,N,N′,N′-四甲基脲鎓六氟磷酸盐(220.4mg,0.58mmol,1.20当量)的5.00mLN,N-二甲基甲酰胺溶液,将其在室温搅拌4小时。将混合物通过反相色谱(用含52%的乙腈的水(0.1%甲酸)洗脱)纯化,得到为白色固体的3-[(1R,3S)-3-(5-溴噻吩-2-酰胺基)环己基]-2-(吡啶-2-基)咪唑并[4,5-c]吡啶-6甲酸甲酯2871(103.3mg,56.1%)。1H NMR(300MHz,DMSO-d6)δ9.37(d,J=1.0Hz,1H),8.85-8.84(m,1H),8.52(d,J=7.8Hz,1H),8.43(d,J=0.9Hz,1H),8.28-8.13(m,1H),8.11-8.08(m,1H),7.68-7.64(m,1H),7.60(d,J=4.0Hz,1H),7.28(d,J=4.0Hz,1H),5.62(t,J=12.4Hz,1H),3.92(s,4H),2.37(d,J=11.8Hz,2H),2.08(d,J=12.0Hz,2H),1.94(d,J=12.3Hz,2H),1.54(t,J=9.5Hz,2H)。LC-MS(ESI)m/z[M H] :542.0。
步骤13:化合物287m的合成
向50ml圆底烧瓶中放入3-[(1R,3S)-3-(5-溴噻吩-2-酰胺基)环己基]-2-(吡啶-2-基)咪唑并[4,5-c]吡啶-6-甲酸甲酯(90.0mg,0.17mmol,1.00当量)、LiOH.H2O(34.9mg,084mmol,5.00当量)的5mL甲醇和5mL水的溶液,将其在室温搅拌2小时。将混合物浓缩并通过反相色谱(用含60%的乙腈的水(0.1%甲酸)洗脱)纯化,得到为白色固体的3-[(1R,3S)-3-(5-溴噻吩-2-酰胺基)环己基]-2-(吡啶-2-基)咪唑并[4,5-c]吡啶-6-甲酸287m(59.4mg,67.8%)。1H NMR(300MHz,DMSO-d6)δ9.35(d,J=1.0Hz,1H),8.85-8.84(m,1H),8.51(d,J=7.8Hz,1H),8.40(d,J=0.8Hz,1H),8.26-8.13(m,1H),8.10-8.07(m,1H),7.68-7.64(m,1H),7.59(d,J=4.0Hz,1H),7.28(d,J=4.0Hz,1H),5.63(s,1H),3.92(s,1H),2.77-2.71(m,1H),2.42-2.26(m,2H),2.08(d,J=11.9Hz,1H),1.94(d,J=10.3Hz,2H),1.52(d,J=9.5Hz,2H)。LC-MS(ESI)m/z[M H] :528.2。
步骤14:化合物287的合成
向50ml圆底烧瓶中放入3-[(1R,3S)-3-(5-溴噻吩-2-酰胺基)环己基]-2-(吡啶-2-基)咪唑并[4,5-c]吡啶-6-甲酸(55.0mg,0.11mmol,1.00当量)、甲胺盐酸盐(6.9mg,0.095mmol,1.00当量)、O-(7-氮杂苯并三唑-1-基)-N,N,N′,N′-四甲基脲鎓六氟磷酸盐(43.3mg,0.11mmol,1.2当量)、N-乙基-N-异丙基丙-2-胺(36.8mg,0.29mmol,3.00当量)的3mL N,N-二甲基甲酰胺溶液。将混合物在室温搅拌2小时并通过反相色谱(用含60%的乙腈的水(0.1%甲酸)洗脱)纯化,得到为白色固体的甲基3-[(1R,3S)-3-(5-溴噻吩-2-酰胺基)环己基]-N-甲基-2-(吡啶-2-基)咪唑并[4,5-c]吡啶-6-甲酰胺287(53.2mg,94.0%)。1H NMR(300MHz,DMSO-d6)δ9.24(s,1H),8.89-8.79(m,1H),8.68(d,J=5.1Hz,1H),8.51(d,J=7.8Hz,1H),8.34(s,1H),8.27(d,J=7.9Hz,1H),8.13-8.07(m,1H),7.68-7.63(m,1H),7.59(d,J=4.0Hz,1H),7.28(d,J=4.0Hz,1H),5.60(d,J=12.4Hz,1H),3.90(s,2H),2.97-2.81(m,3H),2.27(d,J=3.7Hz,2H),2.09(d,J=11.7Hz,1H),1.94(d,J=9.3Hz,2H),1.51(d,J=7.7Hz,2H)。LC-MS(ESI)m/z[M H] :541.1。
其他化合物
本文公开的其他化合物以类似于上述方法的方式制备。下表提供了本文公开的所选化合物的质谱数据。
下表提供了本文所公开的所选化合物的1H-NMR数据。
等同物
本领域技术人员应仅使用常规实验即可了解或能够判断本文具体描述的具体实施方案的许多等同物。此类等同物旨在包括在所附权利要求的范围内。
援引加入
本文所参考的所有专利和出版物通过援引据此整体并入。
本文用于企业家、创业者技术爱好者查询,结果仅供参考。