具有聚集诱导发光特性的tp荧光标记探针及其制备方法与可视化标记策略
技术领域
1.本发明涉及一种病原体标记成像技术领域,尤其涉及活梅毒螺旋体标记技术。
背景技术:
2.梅毒螺旋体(treponema pallidum,tp)是一种非典型革兰氏阴性菌(gram-negative bacteriμm,g-),可通过性行为、血液、母婴等传播,引起心血管/骨/神经/胎传梅毒等。梅毒已连续多年位居我国甲乙类法定报告传染病病种的第3位,早已成为威胁全球健康的公共卫生问题。但人们对tp的研究相对较少。现有的对于tp的检测技术包括基于蛋白标志物的免疫分析方法(梅毒血清学试验、免疫组化/荧光)、基于基因组水平的聚合酶链式反应(pcr)、基于病原体的镜检(暗视野显微镜)及兔子感染实验等。现行技术的检测结果由于存在假阴/阳性、血清固定、主观判读、抗体非特异染色,荧光染料易淬灭、光漂白,无法实时跟踪等问题使其在梅毒的精确检测、指导临床治疗中受到局限;且tp与宿主细胞相互作用的可视化研究还相对缺乏,许多有机分子由于其平面的共轭结构使其在稀溶液中发光很强,但在高浓度溶液中或在聚集(纳米粒子、胶束、固体薄膜或粉末)状态下荧光变弱甚至完全消失,聚集导致猝灭(aggregation-caused quenching,acq)荧光现象,另外还有光漂白、不利于长时间成像的问题。因此开发可靠、实时地对活tp的动态示踪成像技术具有重要的临床意义。
技术实现要素:
3.本发明提供一种具有聚集诱导发光特性的tp荧光标记探针及其制备方法与可视化标记策略,以解决现有技术中不能对活tp的示踪成像,缺乏tp与宿主细胞相互作用的可视化研究的问题。
4.为了达到上述目的本发明采用如下技术方案:
5.本发明提供一种具有聚集诱导发光(aggregation-induced emission,aie)特性的tp荧光标记探针,其结构式如下所示:
[0006][0007]
本发明还提供一种所述的具有聚集诱导发光特性的tp荧光标记探针的制备方法,步骤包括:将化合物1于干燥的ch2cl2中溶解,冰浴情况下用bbr3处理反应,得化合物2;将化合物2、dbco-nhs和4-二甲氨基吡啶溶于thf溶液中,加热搅拌,得到终产物dbco-tpe;
[0008]
所述化合物1结构如式(ⅰ)所示:
[0009][0010]
所述化合物2结构如式(ⅱ)所示:
[0011][0012]
优选地,详细步骤包括:将化合物1于干燥的ch2cl2中溶解,冰浴情况下用bbr3处理反应2h,加水猝灭反应并用ch2cl2萃取、干燥、柱色谱提纯得化合物2,将化合物2、dbco-nhs和4-二甲氨基吡啶溶于thf溶液中,并加热至40℃搅拌24h,除去溶剂并进行柱层析得到终产物二苯基环辛炔-四苯乙烯dbco-tpe。
[0013]
本发明还提供一种使用所述具有聚集诱导发光特性的tp荧光标记探针标记的活tp的重悬培养基,所述重悬培养基是tpcm-2培养基,其成分包括:不含谷胱甘肽的
cmrl1066、丙酮酸钠、刃天青、吗啉基丙磺酸、碳酸氢钠、谷酰胺、葡萄糖、组氨酸、二硫苏糖醇、灭活胎牛血清。
[0014]
更优地,按tpcm-2培养基体积为100ml计,所述tpcm-2培养基成分包括:0.7mm丙酮酸钠、质量分数0.1%刃天青、1m吗啉基丙磺酸、质量分数7.5%碳酸氢钠、200mm谷酰胺、17.6mm葡萄糖、0.52mm组氨酸、0.52mm二硫苏糖醇、体积分数5-20%灭活胎牛血清、不含谷胱甘肽的cmrl1066余量。
[0015]
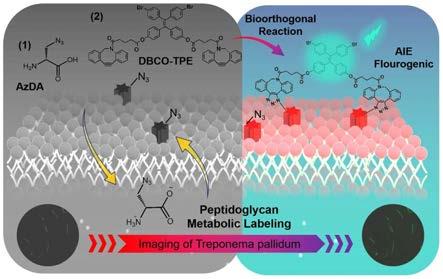
本发明还提供一种使用所述具有聚集诱导发光特性的tp荧光标记探针的活tp可视化标记策略,步骤包括:先将tp与叠氮-d-丙氨酸孵育,使叠氮-d-丙氨酸通过肽聚糖代谢掺入到tp的肽聚糖骨架中;再将tp和dbco-tpe孵育,通过荧光标记探针二苯基环辛炔-四苯乙烯dbco-tpe与叠氮-d-丙氨酸发生点击化学反应,实现对活tp的荧光标记。
[0016]
更优地,详细步骤包括:于1.5ml ep管中将1ml 107条/ml tp菌液与终浓度250μm叠氮-d-丙氨酸于三气培养箱孵育48h;然后14000g离心5min沉淀tp,去除未利用的azda,再1ml pbs清洗离心,用终浓度10μm二苯基环辛炔-四苯乙烯dbco-tpe与上述所得tp于34℃三气培养箱孵育15min,高速离心沉淀tp,1ml pbs清洗离心,用500μl tpcm-2培养基重悬,实现对tp可视化标记。
[0017]
本发明还提供具有聚集诱导发光(aggregation-induced emission,aie)特性的tp荧光标记探针在制备用于活tp的示踪成像的药物中的应用。
[0018]
本发明还提供具有聚集诱导发光(aggregation-induced emission,aie)特性的tp荧光标记探针在制备用于活tp的示踪成像的试剂盒中的应用。
[0019]
本发明的优点包括:利用肽聚糖代谢,通过生物正交反应,实现tp的可视化活体标记;另外,aie探针具有聚集诱导发光特性,可解决传统荧光染料聚集诱导淬灭、光漂白、不利于长时间成像等问题。
附图说明
[0020]
此处所说明的附图用来提供对本发明的进一步理解,构成本技术的一部分,并不构成对本发明的不当限定,在附图中:
[0021]
图1是具有聚集诱导发光特性的荧光探针实现活tp标记的策略示意图。
[0022]
图2是dbco-tpe的质谱图。
[0023]
图3是dbco-tpe的紫外吸收光谱图;
[0024]
图4是在不同水/dmf比例介质中的dbco-tpe溶液的荧光强度图。
[0025]
图5是tp的暗视野显微镜结果图。
[0026]
图6是dbco-tpe与梅毒螺旋体孵育后的死活染色实验图。
[0027]
图7是dbco-tpe对细胞的cck8毒性结果图。
[0028]
图8是dbco-tpe标记活梅毒螺旋体的实验结果图。
[0029]
图9是dbco-tpe标记的梅毒螺旋体与抗体的共定位共聚焦成像图。
[0030]
图10是叠氮肽聚糖验证的考马斯亮蓝染色和荧光染色结果图。
[0031]
图11是梅毒螺旋体的叠氮肽聚糖的傅里叶变换红光吸收光谱图。
[0032]
图12是标记后的活梅毒螺旋体与巨噬细胞相互作用的共聚焦成像图。
[0033]
图13是标记后的活梅毒螺旋体与sf1ep细胞相互作用的共聚焦成像图。
具体实施方式
[0034]
下面将结合附图以及具体实施例来详细说明本发明,在此以本发明的示意性实施例及说明用来解释本发明,但并不作为对本发明的限定。
[0035]
下列实施例中未注明具体实验条件的实验方法,通常按照常规实验条件或按照制造厂商所建议的实验条件。
[0036]
实施例1
[0037]
化合物1的结构如式(ⅰ)所示:
[0038][0039]
本实施例所提供的生物正交荧光标记探针dbco-tpe的合成步骤:将化合物1(110.0mg,0.2mmol)于干燥的ch2cl2(10ml)中溶解,冰浴情况下用bbr3(377μl,4mmol)处理反应2h,加水猝灭反应并用ch2cl2萃取、干燥、柱色谱提纯得化合物2(50.1mg,48.1%),化合物2的结构如式(ⅱ)所示:
[0040][0041]
化合物2核磁氢谱表征数据:1hnmr(500m,d6-dmso):δ=2.99(s,2h),3.16(d,j=5hz,1h),4.40(d,j=5.0hz,2h),5.74(d,j=15.0hz,2h),6.05(s,1h),6.38(s,1h),6.44(d,j=10.0hz,1h),7.42(d,j=10.0hz,1h),7.49(d,j=10.0hz,2h),8.38(d,j=15.0hz,2h),8.74(t,j=5.0hz,1h),11.23(s,1h)。
[0042]
将化合物2(7.5mg,0.015mmol)、dbco-nhs(12mg,0.029mmol)和4-二甲氨基吡啶(dmap,1.83mg,0.015mmol)溶于thf溶液中,并加热至40℃搅拌24h,除去溶剂并进行柱层析得到终产物具有聚集诱导发光特性的tp荧光标记探针dbco-tpe(4.9mg,33.4%)。反应过程如下所示:
[0043][0044]
dbco-tpe的质谱图如图2所示,其dbco-tpe的分子质量m理论值为1122.95,在表征过程中被离子源轰击失去一个溴br原子后的碎片峰,即由图中可以发现dbco-tpe有主要的质荷比峰为966.0028。
[0045]
实施例2
[0046]
对实施例1得到的荧光标记探针dbco-tpe的紫外吸收,及其在水与dmf混合介质中聚集诱导发光特性进行分析:配制浓度为5μmol/l的荧光标记探针dbco-tpe溶液,测试记录该荧光标记探针的吸收光谱;结果如图3所示。dbco-tpe具有310nm和350nm的两个典型吸收峰,分别对应特征官能团苯环和环辛炔。综合质谱数据可知,所合成的dbco-tpe已初步成功。
[0047]
配制在不同水/dmf比例(0、10%、20%、30%、40%、50%、60%、70%、80%、90%)的dbco-tpe溶液,测试其荧光强度,其结果如图4所示。图4中从下往上的曲线对应的含水量依次为0、10%、20%、30%、40%、50%、60%、70%、80%、90%,由图4可以看出,含水量0-40%的dbco-tpe溶液吸光度弱,其对应的曲线大部分重合,随着水与dmf的比例增加,使得脂溶性染料dbco-tpe在混合溶剂中不断聚集,荧光强度随着水占比增加而不断增强,如含水量50%、60%、70%、80%、90%分别对应的曲线所示;说明dbco-tpe依然具有良好的聚集诱导发光性能。
[0048]
实施例3:
[0049]
本发明所应用到的病原体tp的获得方式如下:选取体重为2.5-3kg的雄性健康新西兰大白兔,喂养不含抗生素的饲料。消毒双侧睾丸皮肤,将浓度为1
×
107条/ml标准nichol株接种至兔子的双侧睾丸内,每个睾丸接种500μl,注意避免扎及血管。接种完成后,将新西兰兔饲养于16-20℃环境,接种1周后每三天抽取兔耳缘静脉血进行tppa梅毒血清学监测,以判断兔子是否感染成功及tp在体内的活动度,同时观察是否发生睾丸炎等。当tppa滴度上升至1:640时,安乐死新西兰兔,剪取兔睾丸组织置于生理盐水中。后续将双侧睾丸
组织置于无菌培养皿中,剪去周围多余的结缔组织和脂肪组织。用无菌镊子夹住睾丸一端,用手术刀纵向切划使其展开,再横向切割,最终放入装有25ml生理盐水的50ml离心管中振荡30min,收集悬浮液于15ml离心管1000g离心10min后,收集上清液,2000g离心10min,滤掉杂质,再14000g离心5min沉淀tp,最后用适量的含15%甘油的tpcm-2冻存液进行重悬,如图5所示,在暗视野显微镜下快速计数,冻存存于-80℃冰箱中梯度降温再转移至液氮长期保存,以备后续实验使用。
[0050]
实施例4
[0051]
将实施例1得到的荧光标记探针dbco-tpe对tp的毒性进行评估:取107条/ml菌液,加入不同终浓度(0、0.625μm、1.25μm、2.5μm、5μm、10μm)的dbco-tpe并孵育1h,应用live/dead baclight bacterial viability kits(l7007,thermo fisher scientific)检测tp活力,于1ml菌液中加入3μl预混染料(syto9 pi,绿色syto-9标记所有菌,红色pi标记死菌),室温避光孵育15min,取10μl制作玻片于共聚焦显微镜下观察,其结果如图6所示。荧光标记探针dbco-tpe对tp的活力并没有影响,荧光标记探针dbco-tpe对tp的安全性高。
[0052]
实施例5
[0053]
将实施例1得到的荧光标记探针dbco-tpe对细胞的毒性进行评估:96孔板铺104个huvec细胞,待其贴壁后,加入不同终浓度(0、0.625μm、1.25μm、2.5μm、5μm、10μm)的dbco-tpe孵育1h,换液,每孔加入含10%(v/v)的cell counting kit-8(cck 8)试剂盒培养液孵育2h,用酶标仪测定孔中混合液在450nm的吸光度,其结果如图7所示,荧光标记探针dbco-tpe对细胞活力无明显影响,说明其对细胞相容性较好且无明显细胞毒性。
[0054]
实施例6
[0055]
将实施例1得到的荧光标记探针dbco-tpe对tp进行成像分析:首先,于1.5ml ep管中将1ml 107条/ml tp菌液与叠氮-d-丙氨酸azda(终浓度250μm)于三气培养箱孵育48h。然后14000g离心5min沉淀tp,去除未利用的azda,再1ml pbs清洗离心,用终浓度10μm dbco-tpe与所得tp于34℃三气培养箱孵育15min,高速离心沉淀tp,1ml pbs清洗离心,用500μl tpcm-2培养基重悬,取10μl悬液制作玻片,分别进行暗视野显微镜及激光共聚焦显微成像。如图8所示,在暗视野显微镜和共聚焦显微镜成像结果中,可以观察出梅毒螺旋体tp呈现螺旋状,并形态完整,说明dbco-tpe能够对其进行标记。
[0056]
按tpcm-2培养基体积为100ml计,tpcm-2培养基成分包括0.7mm丙酮酸钠、质量分数0.1%刃天青、1m吗啉基丙磺酸、质量分数7.5%碳酸氢钠、200mm谷酰胺、17.6mm葡萄糖、0.52mm组氨酸、0.52mm二硫苏糖醇、体积分数5-20%灭活胎牛血清、不含谷胱甘肽的cmrl1066余量。
[0057]
实施例7
[0058]
将实施例6标记好的tp 14000g离心5min以沉淀tp,用质量分数为4%的多聚甲醛(pfa)室温固定10min,pbstb(pbs 质量分数为1%的bsa 质量分数为0.1%的tween20)清洗离心,用兔抗tp一抗(ab20923)37℃孵育1h离心,pbstb清洗离心,然后用羊抗兔带cy5荧光的二抗(ab6564)37℃避光孵育1h,pbstb清洗离心,用500μl pbs重悬,取10μl于共聚焦显微镜下观察,其结果如图9所示,荧光标记探针dbco-tpe标记tp可与商品化抗体标记tp实现很好的共定位,证明了荧光标记探针dbco-tpe标记的特异性。
[0059]
实施例8
[0060]
设置添加azda的tp-pg azda组和不添加azda的tp-pg组,两个实验组除了在实施例3所获得的tp菌液中加/不加azda的区别外,其余处理相同。tp-pg azda组的处理为:往实施例3所获得的tp菌液中加azda,孵育2d,14000g离心5min沉淀tp,pbs清洗去除未利用的azda,将菌体重悬于消化buffer中(25mm nacl,50mm tris,2mm edta ph7.9),加入溶菌酶(终浓度1mg/ml),37℃搅拌3d,每隔24h补加终浓度为1mg/ml的溶菌酶。3d后,10000r离心1min取上清,经3k超滤管超滤浓缩(10000r/min
×
15min
×
5times),吸出浓缩液冻干,得到tp的肽聚糖(pg)组分。
[0061]
将tp-pg azda/tp-pg(5mg/ml)分别与dbco-tpe(10μm)常温下混合搅拌反应1h,加入loading buffer煮沸后行wb,经电泳后考马斯亮蓝染色显示条带。另外,样本行电泳、转膜、封闭、洗涤后应用bio-rad alexa 488去激发成像,结果如图10所示。tp-pg azda(pg azda)与tp-pg(pg)组经考马斯亮蓝染色后有相似的蛋白条带,但仅有tp-pg azda组被激发出荧光条带,染料本身不会有条带。
[0062]
取适量tp-pg azda/tp-pg进行冻干,得到粉状样品进行傅立叶变换红外光谱仪分析,扫描范围为400-4000cm-1
,结果如图11所示。在波长2100cm-1
处,tp-pg azda组出现特征性的叠氮基团吸收峰。综上所述,azda可代谢于梅毒螺旋体的肽聚糖表面,用于基于肽聚糖代谢原理实现梅毒螺旋体的可视化标记成像示踪。
[0063]
实施例9
[0064]
将实施例6中标记好的tp与巨噬细胞相互作用,探讨tp与溶酶体的共定位情况:设置不添加tp空白实验组和添加实施例6中标记好的tp的tp实验组。两个实验组除添加/不添加tp的区别外,其余处理相同。tp实验组的处理为:将标记好的tp加入事先铺好的100ng/ml pma诱导的105个巨噬细胞中孵育24h。然后,去除细胞培养液,加入配制好的并37℃预温育的lyso-trackerred染色工作液,与巨噬细胞37℃共孵育30分钟。去除染液,pbs洗3遍,4%pfa室温固定10min,pbstb洗3遍,核染料hoechst33342于孵箱37℃染色30min,pbstb洗3遍,加入pbs于共聚焦显微镜下观察,其结果如图12所示,tp与巨噬细胞作用24h后,仍有部分tp未被巨噬细胞吞噬,表明该标记方法可以实现对活梅毒螺旋体进行标记。
[0065]
实施例10
[0066]
将实施例6中标记好的tp与sf1ep细胞相互作用,探讨tp对其粘附情况:设置不添加tp空白实验组和添加实施例6中标记好的tp的tp实验组。两个实验组除添加/不添加tp的区别外,其余处理相同。tp实验组的处理为:将标记好的tp加入事先铺好的105个sf1ep细胞中孵育24h。4%pfa室温固定10min,pbstb洗3遍,加入鬼笔环肽染色液,37℃温育30分钟。去除染液,pbstb洗3遍,核染料hoechst33342于孵箱37℃染色30min,pbstb洗3遍,加入pbs于共聚焦显微镜下观察,其结果如图13所示,利用标记的tp可以有效地观察tp粘附于sf1ep细胞表面。
[0067]
本发明优点包括:基于肽聚糖代谢,通过具有聚集诱导发光(aggregation-induced emission,aie)特性的荧光标记探针进行生物正交反应实现对活tp的示踪成像。
[0068]
以上对本发明实施例所提供的技术方案进行了详细介绍,本文中应用了具体个例对本发明实施例的原理以及实施方式进行了阐述,以上实施例的说明只适用于帮助理解本发明实施例的原理;同时,对于本领域的一般技术人员,依据本发明实施例,在具体实施方式以及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本发明的限制。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。