1.本发明涉及医学数据处理相关技术领域,特别是一种肿瘤局部控制预测模型的构建方法、预测方法及电子设备。
背景技术:
2.随着放疗技术的进步,立体定向放疗(sbrt)在因各种内科合并症而无法耐受手术治疗和不愿意手术治疗的早期原发性肺癌患者中得到了进一步的运用,并且可以用于晚期原发性肺癌或者转移性肺癌的根治性或者新辅助或者辅助性治疗。这种精确的方式使用高剂量消融肿瘤和低剂量保护周围组织。肺癌患者经过sbrt后肿瘤局部控制率可观,正常组织的毒性小,但是也有部分患者肿瘤局部控制不佳。计算机断层扫描(ct)、18f
‑
氟脱氧葡萄糖/正电子发射断层扫描(pet
‑
ct)或活检是检测肿瘤复发的重要诊断工具,但是不能提前预测肿瘤局部状态或不能获得整个肿瘤的信息。最大标准化摄取值(suvmax)可以用于预测sbrt后的局部复发,但是其预后价值尚不确定。另外的现有技术以影响肿瘤局部控制的临床和剂量学因素建立肿瘤局部控制率模型来计算肺癌患者sbrt后局部控制的可能性。然而,由于这些模型没有综合考虑反应肿瘤异质性的特征,所以导致局部控制率模型的预测效果结果差异较大,而且与临床数据中的局部控制率不具有统一性,难以辨别各个模型在肺癌的立体定向放疗中的适用性。
技术实现要素:
3.基于此,有必要针对现有技术对于立体定向放疗的肺癌患者治疗后的肿瘤局部控制预测不准确的技术问题,提供一种肿瘤局部控制预测模型的构建方法、预测方法及电子设备。
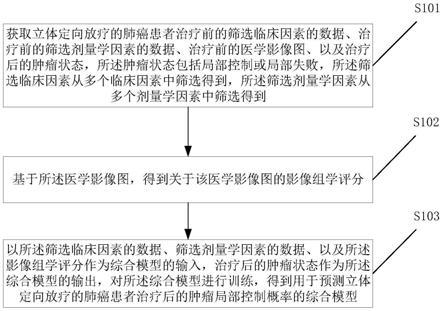
4.本发明提供一种肿瘤局部控制预测模型的构建方法,包括:
5.获取立体定向放疗的肺癌患者治疗前的筛选临床因素的数据、治疗前的筛选剂量学因素的数据、治疗前的医学影像图、以及治疗后的肿瘤状态,所述肿瘤状态包括局部控制或局部失败,所述筛选临床因素从多个临床因素中筛选得到,所述筛选剂量学因素从多个剂量学因素中筛选得到;
6.基于所述医学影像图,得到关于该医学影像图的影像组学评分;
7.以所述筛选临床因素的数据、筛选剂量学因素的数据、以及所述影像组学评分作为综合模型的输入,治疗后的肿瘤状态作为所述综合模型的输出,对所述综合模型进行训练,得到用于预测立体定向放疗的肺癌患者治疗后的肿瘤局部控制概率的综合模型。
8.进一步地,还包括:
9.获取立体定向放疗的肺癌患者治疗前的医学影像图、以及治疗后的肿瘤状态,所述肿瘤状态包括局部控制或局部失败;
10.从所述医学影像图中提取多个筛选影像组学特征的数据,所述筛选影像组学特征从多个影像学特征中筛选得到,且所述筛选影像学特征的组间相关系数大于等于预设影像
相关系数阈值;
11.所述影像组学模型为偏置值与多个筛选影像组学特征的数据的加权值之和,以所述筛选影像组学特征的数据作为影像组学模型的输入,治疗后的肿瘤状态作为所述影像组学模型的输出,对所述影像组学模型采用对数几率回归进行训练;
12.训练后,得到所述影像组学模型的偏置值以及每一所述影像学特征的权重;
13.所述基于所述医学影像图,得到关于该医学影像图的影像组学评分,具体包括:
14.从所述医学影像图中提取多个筛选影像组学特征的数据;
15.基于每个所述筛选影像组学特征的权重,计算该医学影像图的影像组学评分为多个所述筛选影像组学特征的数据的加权值和偏置值之和,所述偏置值和每个所述筛选影像组学特征的权重从预先训练的影像组学模型中获取。
16.更进一步地,还包括:
17.获取每一医学影像图的多个兴趣区域勾画图,每一医学影像图的多个兴趣区域勾画图为不同医生在同一医学影像图中勾画的感兴趣区域,将由同一医生勾画的兴趣区域勾画图作为一组图像组,计算每一影像组学特征在多组图像组之间的组间相关系数,将组间相关系数大于等于预设影像相关系数阈值作为第一影像学特征;
18.对符合正态分布和方差齐性检验的第一影像学特征进行独立样本t检验,对其余第一影像学特征进行秩和检验,保留差异性指标为显著性差异的第一影像学特征作为第二影像学特征;
19.执行最小绝对收缩和选择算法对第二影像学特征进行降维和选择,得到第三影像学特征;
20.利用逐步回归算法从第三影像学特征中剔除引起多重共线性的第三影像学特征,得到筛选影像组学特征。
21.更进一步地,所述筛选影像组学特征包括:低低低小波系数转换
‑
灰度区域大小矩阵
‑
短欲补偿特征、低高高小波系数转换
‑
灰度共生矩阵
‑
联合均值特征、低高高小波系数转换
‑
邻域灰度差矩阵特征
‑
复杂度特征、平方根
‑
灰度共生矩阵
‑
差值熵特征。
22.进一步地,还包括:
23.获取患者的多个临床因素的数据和多个剂量学因素的数据;
24.对每个临床因素的数据和每个剂量学因素的数据分别进行对数几率回归单因素分析;
25.将单因素分析中差异性指标为显著性差异的临床因素的和剂量学因素的进行多因素对数几率回归分析,通过逐步回归筛选算法,对临床因素和剂量学因素进行筛选,得到筛选临床因素和筛选剂量学因素。
26.进一步地,所述筛选临床因素数据为临床分期数据、血小板数据,所述筛选剂量学因素数据为肿瘤总体积内最小剂量。
27.再进一步地,所述对所述综合模型进行训练,具体包括:
28.对所述综合模型采用对数几率回归算法进行训练。
29.本发明提供一种电子设备,包括:
30.至少一个处理器;以及,
31.与至少一个所述处理器通信连接的存储器;其中,
32.所述存储器存储有可被至少一个所述处理器执行的指令,所述指令被至少一个所述处理器执行,以使至少一个所述处理器能够执行如前所述的肿瘤局部控制预测模型的构建方法。
33.本发明提供一种肺癌患者治疗后肿瘤局部控制预测方法,采用如前所述的肿瘤局部控制预测模型的构建方法构建综合模型,所述方法包括:
34.获取立体定向放疗的待预测肺癌患者治疗前的筛选临床因素的数据、筛选剂量学因素的数据、以及治疗前的医学影像图;
35.基于所述医学影像图,得到关于该医学影像图的影像组学评分;
36.将待预测肺癌患者治疗前的筛选临床因素的数据、筛选剂量学因素的数据、以及治疗前的医学影像图的影像组学评分输入所述综合模型,得到待预测肺癌患者的治疗后肿瘤状态,所述肿瘤状态包括局部控制或局部失败。
37.本发明提供一种电子设备,包括:
38.至少一个处理器;以及,
39.与至少一个所述处理器通信连接的存储器;其中,
40.所述存储器存储有可被至少一个所述处理器执行的指令,所述指令被至少一个所述处理器执行,以使至少一个所述处理器能够执行如前所述的肺癌患者治疗后肿瘤局部控制预测方法。
41.本发明综合考虑肿瘤全部特征,纳入影像组学特征、临床因素和剂量学因素建立预测原发性和转移性肺癌患者sbrt治疗后1年的局部控制模型,大大提高了肺癌患者sbrt治疗后1年的局部控制预测准确率。
附图说明
42.图1为本发明一种肿瘤局部控制预测模型的构建方法的工作流程图;
43.图2为本发明一实施例提取和选择影像组学特征流程示意图;
44.图3a为影像组学特征wavelet
‑
lll_glszm_smallareaemphasis在训练集的局部控制与局部失败两组患者中的数据特点,整体分布,组间差异和相应的p值;
45.图3b为影像组学特征wavelet
‑
lhh_glcm_jointaverage在训练集的局部控制与局部失败两组患者中的数据特点,整体分布,组间差异和相应的p值;
46.图3c为影像组学特征wavelet
‑
lhh_ngtdm_complexity在训练集的局部控制与局部失败两组患者中的数据特点,整体分布,组间差异和相应的p值;
47.图3d为影像组学特征squareroot_glcm_differenceentropy在训练集的局部控制与局部失败两组患者中的数据特点,整体分布,组间差异和相应的p值;
48.图3e为影像组学评分在训练集的局部控制与局部失败两组患者中的数据特点,整体分布,组间差异和相应的p值;
49.图3f为影像组学评分在验证集的局部控制与局部失败两组患者中的数据特点,整体分布,组间差异和相应的p值;
50.图4a为影像组学模型、临床模型和综合模型在训练组的受试者工作特征曲线roc及roc曲线下面积(auc);
51.图4b为影像组学模型、临床模型和综合模型在验证组的受试者工作特征曲线roc
及roc曲线下面积(auc);
52.图4c为影像组学模型、临床模型和综合模型在训练组和验证组的roc曲线下面积(auc)比较;
53.图5为预测局部控制的综合模型中的各个特征的作用示意图;
54.图6a为评估肺癌患者局部控制的综合诺谟图;
55.图6b为训练组的诺谟图校准曲线;
56.图6c为验证组的诺谟图校准曲线;
57.图6d为训练组每个模型的决策曲线;
58.图6e为验证组每个模型的决策曲线;
59.图7为本发明一种电子设备的硬件结构示意图;
60.图8为本发明一实施例一种肺癌患者治疗后肿瘤局部控制预测方法的工作流程图;
61.图9为本发明一种电子设备的硬件结构示意图。
具体实施方式
62.下面结合附图和具体实施例对本发明做进一步详细的说明。
63.实施例一
64.如图1所示为本发明一种肿瘤局部控制预测模型的构建方法的工作流程图,包括:
65.步骤s101,获取立体定向放疗的肺癌患者治疗前的筛选临床因素的数据、治疗前的筛选剂量学因素的数据、治疗前的医学影像图、以及治疗后的肿瘤状态,所述肿瘤状态包括局部控制或局部失败,所述筛选临床因素从多个临床因素中筛选得到,所述筛选剂量学因素从多个剂量学因素中筛选得到;
66.步骤s102,基于所述医学影像图,得到关于该医学影像图的影像组学评分;
67.步骤s103,以所述筛选临床因素的数据、筛选剂量学因素的数据、以及所述影像组学评分作为综合模型的输入,治疗后的肿瘤状态作为所述综合模型的输出,对所述综合模型进行训练,得到用于预测立体定向放疗的肺癌患者治疗后的肿瘤局部控制概率的综合模型。
68.具体来说,sbrt治疗后第一年每隔3个月检查ct,之后每半年检查ct,局部控制是指胸部ct片示肿瘤完全消退或放疗结束时虽有残留至少3个月后复查胸部ct示肿块无增大或有缩小并维持6个月以上。局部失败是指通过肺穿刺或支气管纤维镜下活检,病理组织学确诊或者通过胸部ct诊断;特点为治疗后病灶消失,以后又在原部位出现占位病灶,或治疗后的多次ct检查,原纤维化的基础上出现密度增高、血管增强强化、体积持续增大的肿块影像。
69.具体来说,步骤s101获取立体定向放疗的肺癌患者治疗前的筛选临床因素的数据、治疗前的筛选剂量学因素的数据、治疗前的医学影像图、以及治疗后的肿瘤状态作为模型训练数据。治疗后的肿瘤状态优选为原发性和转移性肺癌患者sbrt治疗后1年的局部控制或者局部失败。然后步骤s102对医学影像图计算影像组学评分。医学影像图包括但不限于计算机断层扫描(ct)、18f
‑
氟脱氧葡萄糖/正电子发射断层扫描(pet
‑
ct)。优选地,医学影像图为ct图像。影像组学是指从传统医学图像中全面提取肿瘤特征,以帮助决策和预测
不同疾病的治疗效果和预后,包括肺癌、食管癌和前列腺癌。最后,步骤s103对训练数据进行训练,得到综合模型。该综合模型以所述筛选临床因素的数据、筛选剂量学因素的数据、以及所述影像组学评分作为综合模型的输入,以治疗后的肿瘤状态作为所述综合模型的输出。该综合模型即作为肿瘤局部控制预测模型。
70.本发明通过影像组学特征凸显了肿瘤的异质性,影像组学是应用生物信息学方法从医学图像中高通量地提取与肿瘤特征密切相关的定量影像学特征,可非侵入性地获得肉眼不可见的额外信息来预测潜在的肿瘤生物学行为包括组织形态、细胞分子、基因遗传等各个层次,即影像组学参数可揭示肿瘤的异质性,在肿瘤的诊疗的研究具有独特优势。
71.研究表明肺癌患者进行sbrt后的肿瘤局部控制状态受到多因素影响,主要包括临床因素(如肿瘤直径大小,分期,组织学等)和剂量学因素(如覆盖95%靶区的处方剂量、整个计划中最大剂量等)。本发明结合临床和剂量学因素综合评价可以增加个性化估计的价值,并且突出了多元分析的必要性,使得评价更加稳健和准确。并且当中涉及的变量来自临床可用数据,无需额外费用,这将增加的该评价的临床效用。
72.本发明综合考虑肿瘤全部特征,纳入影像组学特征、临床因素和剂量学因素建立预测原发性和转移性肺癌患者sbrt治疗后1年的局部控制模型,大大提高了肺癌患者sbrt治疗后1年的局部控制预测准确率。
73.在其中一个实施例中,还包括:
74.获取立体定向放疗的肺癌患者治疗前的医学影像图、以及治疗后的肿瘤状态,所述肿瘤状态包括局部控制或局部失败;
75.从所述医学影像图中提取多个筛选影像组学特征的数据,所述筛选影像组学特征从多个影像学特征中筛选得到,且所述筛选影像学特征的组间相关系数大于等于预设影像相关系数阈值;
76.所述影像组学模型为偏置值与多个筛选影像组学特征的数据的加权值之和,以所述筛选影像组学特征的数据作为影像组学模型的输入,治疗后的肿瘤状态作为所述影像组学模型的输出,对所述影像组学模型采用对数几率回归进行训练;
77.训练后,得到所述影像组学模型的偏置值以及每一所述影像学特征的权重;
78.所述基于所述医学影像图,得到关于该医学影像图的影像组学评分,具体包括:
79.从所述医学影像图中提取多个筛选影像组学特征的数据;
80.基于每个所述筛选影像组学特征的权重,计算该医学影像图的影像组学评分为多个所述筛选影像组学特征的数据的加权值和偏置值之和,所述偏置值和每个所述筛选影像组学特征的权重从预先训练的影像组学模型中获取。
81.具体来说,首先从所述医学影像图中提取多个筛选影像组学特征的数据。从图像中提取影像组学特征可以采用现有的图像提取肿瘤方式提取。
82.影像组学模型优选为逻辑回归模型。影像组学模型的模型形式为其中,n为筛选影像组学特征的数量,w
i
为第i个筛选影像组
83.学特征的权重,b为偏置值,k
i
为第i个筛选影像组学特征的数据。
84.影像组学模型以筛选影像组学特征的权重作为参数进行训练,通过肿瘤状态对影像组学模型中的权重进行参数优化,得到最终的影像组学模型。训练后的影像组学模型的
参数即包括了每个筛选影像组学特征的权重。通过计算多个所述筛选影像组学特征的数据的加权值,则得到影像组学评分。由于影像组学评分是基于影像组学模型得到,因此,影像组学评分能够满足影像组学模型,使得与临床因素和剂量学因素结合训练得到的综合模型,既满足影像组学特征,又满足临床因素和剂量学因素。本实施例所选择的筛选影像组学特征,其组间相关系数大于等于预设影像相关系数阈值,因此该影像组学特征稳定。
85.在其中一个实施例中,还包括:
86.获取每一医学影像图的多个兴趣区域勾画图,每一医学影像图的多个兴趣区域勾画图为不同医生在同一医学影像图中勾画的感兴趣区域,将由同一医生勾画的兴趣区域勾画图作为一组图像组,计算每一影像组学特征在多组图像组之间的组间相关系数,将组间相关系数大于等于预设影像相关系数阈值作为第一影像学特征;
87.对符合正态分布和方差齐性检验的第一影像学特征进行独立样本t检验,对其余第一影像学特征进行秩和检验,保留差异性指标为显著性差异的第一影像学特征作为第二影像学特征;
88.执行最小绝对收缩和选择算法对第二影像学特征进行降维和选择,得到第三影像学特征;
89.利用逐步回归算法从第三影像学特征中剔除引起多重共线性的第三影像学特征,得到筛选影像组学特征。
90.具体来说,为了进一步增强影像组学特征的鲁棒性,由多名(例如两名)高年资放疗科医生勾画多例(例如30例)患者的感兴趣区域,通过计算组间相关系数(icc)来评估特征在两组图像中的相关性,icc大于0.75的特征被认为是稳定的和被选择进行分析。而为了防止过拟合,采用多种方法进行影像组学特征降维,通过符合正态分布和方差齐性检验的特征进行独立样本t检验,否则进行秩和检验即单因素检验,选择保留p值<0.05的特征,其中p值为差异性指标,p值<0.05即差异性指标为显著性差异。p值是在给定的自由度下,通过计算出统计量值,结合t分布,u分布或者z分布得到的概率,通过p值判断差异性是否达到显著水平。再使用r语言中的“glmnet”软件包执行lasso算法对特征进行降维和选择,最后利用逐步回归筛选并剔除引起多重共线性的特征。最终得到筛选影像组学特征。多重共线性是指线性回归模型中的解释变量之间由于存在精确相关关系或高度相关关系而使模型估计失真或难以估计准确。所以剔除引起多重共线性的特征可以准确区分每个解释变量的单独影响,可以使解释变量的显著性检验有意义,可以增加模型预测功能的准确性和稳定性。
91.本实施例所选择的影像组学特征稳定,且具有显著性差异。同时剔除了引起多重共线性的特征,可以准确区分每个解释变量的单独影响,可以使解释变量的显著性检验有意义,可以增加模型预测功能的准确性和稳定性。
92.在其中一个实施例中,所述筛选影像组学特征包括:低低低小波系数转换
‑
灰度区域大小矩阵
‑
短欲补偿特征、低高高小波系数转换
‑
灰度共生矩阵
‑
联合均值特征、低高高小波系数转换
‑
邻域灰度差矩阵特征
‑
复杂度特征、平方根
‑
灰度共生矩阵
‑
差值熵特征。
93.具体来说,低低低小波系数转换
‑
灰度区域大小矩阵
‑
短欲补偿特征为wavelet
‑
lll_glszm_smallareaemphasis,低高高小波系数转换
‑
灰度共生矩阵
‑
联合均值特征为wavelet
‑
lhh_glcm_jointaverage,低高高小波系数转换
‑
邻域灰度差矩阵特征
‑
复杂度特
征为wavelet
‑
lhh_ngtdm_complexity,平方根
‑
灰度共生矩阵
‑
差值熵特征为squareroot_glcm_differenceentropy。
94.在其中一个实施例中,还包括:
95.获取患者的多个临床因素的数据和多个剂量学因素的数据;
96.对每个临床因素的数据和每个剂量学因素的数据分别进行对数几率回归单因素分析;
97.将单因素分析中差异性指标为显著性差异的临床因素的和剂量学因素的进行多因素对数几率回归分析,通过逐步回归筛选算法,对临床因素和剂量学因素进行筛选,得到筛选临床因素和筛选剂量学因素。
98.具体来说,患者的临床因素和剂量学因素有多个。临床因素数据包括性别、年龄、吸烟史、bmi指数、kps评分、肿瘤位置、临床分期、病理类型、肿瘤等效直径、肉眼肿瘤体积(gtv)、计划靶体积(ptv)、有无化疗、治疗前淋巴细胞、中性粒细胞、血小板、中性粒细胞与淋巴细胞比值(nlr)、血小板与淋巴细胞比值(plr)、血红蛋白、固定器类型、是否进行4dct扫描,肿瘤原发部位;剂量学因素数据包括覆盖95%靶区的处方剂量(d
95
)、整个计划中最大剂量(d
max
)、计划靶区内最小剂量(ptv
min
)、平均剂量(ptv
mean
)、最大剂量(ptv
max
)、剂量不均匀性(ptv
min
/ptv
max
)、肿瘤总体积内最小剂量(gtv
min
)、平均剂量(gtv
mean
)、最大剂量(gtv
max
)、剂量不均匀性(gtv
min
/gtv
max
)。从中需要筛选出合适的临床和剂量学因素。具体可以使用r语言分析影响肺癌患者sbrt治疗后1年肿瘤局部控制的临床和剂量学因素,logistic单因素分析中p<0.05的因素纳入多因素logistic回归分析,以p值作为差异性指标,p<0.05为显著性差异,通过逐步回归法筛选变量。
99.在其中一个实施例中,所述筛选临床因素数据为临床分期数据、血小板数据,所述筛选剂量学因素数据为肿瘤总体积内最小剂量。
100.在其中一个实施例中,所述对所述综合模型进行训练,具体包括:
101.对所述综合模型采用对数几率回归算法进行训练。
102.表1在训练组和验证组中,应用lr、dt、svm建立影像组学模型的详细性能
103.[0104][0105]
lr:对数几率回归(logistic回归,又称逻辑回归),dt:决策树,svm:支持向量机;准确性、灵敏性和特异性以百分比表示。
[0106]
如上表所示,当利用决策树、支持向量机建立影像组学模型时,存在的或多或少的问题,如利用dt分类法建立的影像组学模型的分类能力没有统计学意义,模型的auc低于0.5,或者将这些特征输入svm分类器中,得到的模型性能较差,特异性较低;与上述方法相比,lr方法建立的模型表现出了最佳的性能和准确度,因此将用于后续建模。
[0107]
本实施例采用对数几率回归算法,提高性能和准确度。
[0108]
作为本发明的肿瘤局部控制预测模型构建,具体包括:
[0109]
(1)病例收集
[0110]
按照指南和建议收集符合条件的原发性和转移性肺癌接受立体定向放疗(sbrt)治疗的患者,以7:3的比例随机将患者分为训练组和验证组;收集患者的临床和剂量学因素资料和肿瘤局部控制情况;临床因素数据包括性别、年龄、吸烟史、bmi指数、kps评分、肿瘤位置、临床分期、病理类型、肿瘤等效直径、肉眼肿瘤体积(gtv)、计划靶体积(ptv)、有无化疗、治疗前淋巴细胞、中性粒细胞、血小板、中性粒细胞与淋巴细胞比值(nlr)、血小板与淋巴细胞比值(plr)、血红蛋白、固定器类型、是否进行4dct扫描,肿瘤原发部位;剂量学因素数据包括覆盖95%靶区的处方剂量(d95)、整个计划中最大剂量(d
max
)、计划靶区内最小剂量(ptv
min
)、计划靶区内平均剂量(ptv
mean
)、计划靶区内最大剂量(ptv
max
)、计划靶区内剂量不均匀性(ptv
min
/ptv
max
)、肿瘤总体积内最小剂量(gtv
min
)、肿瘤总体积内平均剂量(gtv
mean
)、肿瘤总体积内最大剂量(gtv
max
)、肿瘤总体积内剂量不均匀性(gtv
min
/gtv
max
)。其中,剂量均为生物有效剂量(beds),采用α/β比值为10gy的线性二次模型计算beds,bed=n
×
d
×
[1 d/(α/β)],n=治疗次数,d=分次剂量;并且利用受试者工作特征曲线(roc)方法计算剂量的最佳截取点。
[0111]
(2)筛选临床和剂量学因素
[0112]
使用r语言分析影响肺癌患者sbrt治疗后1年肿瘤局部控制的临床和剂量学因素,将logistic单因素分析中p<0.05的因素纳入多因素logistic回归分析,通过逐步回归法筛选变量,以p值作为差异性指标,p<0.05为显著性差异,得到筛选临床因素和筛选剂量学因素。
[0113]
(3)获得肿瘤ct图像和提取影像组学特征
[0114]
收集患者医学影像图,具体为ct平扫图像,并由超过10年经验的放疗科医生手动勾画肿瘤感兴趣区域(roi),利用python软件平台进行影像组学特征提取。图像预处理包括original、log、wavelet、square、squareroot、logarithm;影像组学特征的种类包括一阶特征,形状特征,纹理特征。并对原始数据采用z
‑
score标准化。
[0115]
(4)选择影像组学特征
[0116]
首先通过r语言的“irr”包计算组间相关系数(icc)选择稳定的影像组学特征,将一致性大于等于0.75的影像组学特征保留;接着通过独立样本t检验或mann
‑
whitney u检验对特征进行单因素检验,将p值<0.05的影像组学特征保留;再使用r语言的“glmnet”包套索分析(lasso)对特征进行降维分析;最后利用逐步回归筛选特征,得到筛选影像组学特征。
[0117]
(5)选择最合适的分类器
[0118]
使用逻辑回归(lr)、决策树(dt)、支持向量机(svm)创建影像组学评分,决策树和支持向量机分别用r语言的“rpart”软件包和“e1071”软件包实现,根据模型的性能选择分类器用于后续模型建立。
[0119]
(6)建立模型
[0120]
根据最佳分类器建立三个模型,分别是由影像组学评分建立的影像组学模型,临床和剂量学因素建立的临床模型,影像组学评分结合临床和剂量学因素的综合模型。
[0121]
(7)模型评价
[0122]
根据模型的受试者工作特征曲线(roc)的曲线下面积(auc)、p值、准确性、敏感性、特异性和delong检验对各个模型进行比较确定预测局部控制的最佳模型。经过对比,可以确定影像组学评分结合临床和剂量学因素的综合模型的效果优于比单独模型包括临床因素模型和影像组学模型。因此,选择综合模型作为肿瘤局部控制预测模型。
[0123]
(8)临床应用
[0124]
利用r语言的“rms”包构建诺谟图进而预测肺癌患者的局部控制;使用hosmer
‑
lemeshow检验和校正曲线判别诺谟图的校准能力,决策曲线计算临床最大净受益。
[0125]
作为本发明一个构建肿瘤局部控制预测模型的例子,以129个肺癌肿瘤病灶进行建立肿瘤局部控制预测模型过程为例:
[0126]
1 材料和方法
[0127]
1.1 患者的选择
[0128]
采集2012
‑
2018年汕头大学医学院附属肿瘤医院诊断为原发性和转移性肺癌接受sbrt治疗的患者(n=134),排除照射部位为胸壁、纵隔、锥体的患者(n=4),排除失访的患者(n=18),排除未完成照射的患者(n=1)最后可得111个患者,18个重复病灶,129个肿瘤病灶;以7:3的比例随机将患者分为训练组和验证组;使用真空负压袋或头颈肩热塑面罩固定患者,采用仰卧位在患者平静呼吸下通过四维ct(4dct)或三维ct(3dct)扫描肿瘤;4dct的内靶体积(itv
4d
)由10个呼吸期的肿瘤总体积(gtvs)确定,3dct的内靶体积(itv
3d
)由呼气末和吸气末两个呼吸时相的gtv决定或者用模拟机透视观察肿瘤运动幅度描绘,计划靶体积(ptv)通过itv在各个方向外扩5mm实现;在每次进行治疗前用锥束ct(cbct)进行图像引导和肿瘤定位。
[0129]
1.2定期随访
[0130]
第一年每隔3个月检查ct,之后每半年检查ct,局部复发通过肺穿刺或支气管纤维镜下活检,病理组织学确诊或者通过胸部ct诊断;特点为治疗后病灶消失,以后又在原部位出现占位病灶,或治疗后的多次ct检查,原纤维化的基础上出现密度增高、血管增强强化、体积持续增大的肿块影像。
[0131]
sbrt治疗后第一年每隔3个月检查ct,之后每半年检查ct,局部控制是指胸部ct片
示肿瘤完全消退或放疗结束时虽有残留至少3个月后复查胸部ct示肿块无增大或有缩小并维持6个月以上。局部失败是指通过肺穿刺或支气管纤维镜下活检,病理组织学确诊或者通过胸部ct诊断;特点为治疗后病灶消失,以后又在原部位出现占位病灶,或治疗后的多次ct检查,原纤维化的基础上出现密度增高、血管增强强化、体积持续增大的肿块影像。
[0132]
1.3收集数据
[0133]
收集患者的临床和剂量学因素资料和肿瘤局部控制情况;计算剂量学因素的bed及最佳截取点。
[0134]
1.4筛选临床和剂量学因素
[0135]
使用r语言分析影响肺癌患者sbrt治疗后1年肿瘤局部控制的临床和剂量学因素,首先进行logistic单因素分析,接着将单因素中p<0.05的因素纳入进行多因素logistic回归分析,最后通过逐步回归法筛选变量,以p值作为差异性指标,p<0.05为显著性差异,得出最终进入模型的变量,即筛选临床因素和筛选剂量学因素。
[0136]
1.5获得肿瘤ct图像和提取影像组学特征
[0137]
收集患者sbrt治疗前的ct平扫图像并由超过10年经验的放疗科医生手动勾画肿瘤感兴趣区域(roi),利用python软件平台进行影像组学特征提取。为了确定最佳的影像组学特征,图像预处理包括original,log,wavelet,square,squareroot,logarithm;特征种类包括一阶特征,形状特征,纹理特征包括灰度共生矩阵特征(glcm)、灰度游程长度矩阵(glrlm)、灰度尺寸区域矩阵(glszm)、邻域灰度差矩阵(ngtdm)、灰度相关矩阵(gldm);并给予原始数据z
‑
score标准化。
[0138]
1.6选择重要稳定的影像组学特征
[0139]
为了进一步增强影像组学特征的鲁棒性,由两名高年资放疗科医生勾画30例患者的感兴趣区域,通过计算组间相关系数(icc)来评估特征在两组图像中的相关性,icc大于0.75的影像组学特征被认为是稳定特征,选择icc大于0.75的影像组学特征进行后续分析。为了防止过拟合,采用多种方法进行影像组学特征降维,将符合正态分布和方差齐性检验的影像组学特征进行独立样本t检验,其他影像组学特征进行秩和检验即单因素检验,保留p值<0.05的影像组学特征;再使用r语言中的“glmnet”软件包执行lasso算法对p值>0.05的影像组学特征进行降维和选择,最后利用逐步回归筛选并剔除引起多重共线性的影像组学特征,得到筛选影像组学特征。
[0140]
1.7选择最合适的分类器
[0141]
根据选择的影像组学特征分别使用逻辑回归(lr)、决策树(dt)、支持向量机(svm)创建影像组学评分,决策树和支持向量机分别用r语言的“rpart”软件包和“e1071”软件包实现,根据模型的性能即模型的受试者工作特征曲线(roc)的曲线下面积(auc)、p值、准确性、敏感性、特异性选择分类器用于后续模型建立。
[0142]
1.8建立模型
[0143]
根据最佳分类器建立三个模型,分别是由影像组学评分建立的影像组学模型,临床和剂量学因素建立的临床模型,影像组学评分结合临床和剂量学因素的综合模型。
[0144]
1.9模型评价
[0145]
根据模型的受试者工作特征曲线(roc)的曲线下面积(auc)、p值、准确性、敏感性、特异性和delong检验对影像组学模型、临床模型和组合模型进行比较,以确定预测局部控
制的最佳模型。
[0146]
1.10临床应用
[0147]
为了给临床医生提供一个易于使用的工具,利用r语言的“rms”包构建由影像组学评分、临床和剂量学因素组合的诺谟图进而可视化地预测肺癌患者的局部控制;使用hosmer
‑
lemeshow检验和校正曲线判别诺谟图的拟合程度和校准能力,决策曲线分析法计算影像组学模型、临床模型和组合模型的临床最大净受益。
[0148]
2结果
[0149]
2.1患者基本特征与局部复发情况
[0150]
111例原发性和继发性肺癌患者的129个肿瘤进行sbrt治疗,训练组和验证组分别为89个和40个肿瘤,病人的基本情况见表2;93例男性(72.1%),平均年龄62岁,大多数肿瘤(82.9%)为周围型,少数肿瘤(18.6%)采用放化疗联合治疗,中位处方剂量为48gy(范围:18~70gy),中位放疗次数为4次(范围:1~12次),中位治疗时间为8天(范围:1~38天),sbrt治疗1年后,91例肿瘤局部控制,38例局部失败;d
95
的最佳临界点为80.43gy;训练组和验证组患者的临床基线基本平衡表明病人分组是合理的。
[0151]
表2在总体人群、训练组和验证组中肺癌患者的临床和剂量特征
[0152]
[0153]
[0154]
[0155][0156]
gtv:肉眼肿瘤体积,ptv:计划靶体积,nlr:中性粒细胞与淋巴细胞比值,plr:血小板与淋巴细胞比值,d95:覆盖95%靶区的处方剂量,dmax:整个计划中最大剂量,ptvmin:计划靶区内最小剂量,ptvmean:计划靶区内平均剂量,ptvmax:计划靶区内最大剂量,ptvmin/ptvmax:计划靶区内剂量不均匀性,gtvmin:肿瘤总体积内最小剂量,gtvmean:肿瘤总体积内平均剂量,gtvmax:肿瘤总体积内最大剂量,gtvmin/gtvmax:肿瘤总体积内剂量不均匀性;采用卡方检验和t检验wilcoxon检验计算训练数据集和验证数据集之间的统计差异。
[0157]
2.2临床和剂量学因素筛选结果
[0158]
单因素和多因素分析临床、剂量学因素与肺癌sbrt后1年肿瘤局部状态的关系。结果如表2所示:
[0159]
单因素分析显示:临床分期、吸烟史、血小板、plr、血红蛋白、d95、d
max
、ptv
min
、ptv
max
、ptv
mean
、gtv
min
、gtv
max
、gtv
mean
、ptv
min
/ptv
max
在1年肿瘤局部控制与局部失败两组中有显著性差异(p<0.05);
[0160]
将上述有显著性差异的临床、剂量学因素进行多因素分析显示:临床分期、血小板和gtv
min
是影响1年肿瘤局部状态的预后因素。
[0161]
表3进行单因素和多因素分析与肺癌患者局部控制的相关临床和剂量因素
[0162]
[0163]
[0164]
[0165][0166]
gtv:肉眼肿瘤体积,ptv:计划靶体积,nlr:中性粒细胞与淋巴细胞比值,plr:血小板与淋巴细胞比值,d
95
:覆盖95%靶区的处方剂量,d
max
:整个计划中最大剂量,ptv
min
:计划靶区内最小剂量,ptv
mean
:计划靶区内平均剂量,ptv
max
:计划靶区内最大剂量,ptv
min
/ptv
max
:计划靶区内剂量不均匀性,gtv
min
:肿瘤总体积内最小剂量,gtv
mean
:肿瘤总体积内平均剂量,gtv
max
:肿瘤总体积内最大剂量,gtv
min
/gtv
max
:肿瘤总体积内剂量不均匀性。
[0167]
2.3影像组学特征筛选结果
[0168]
如图2所示为提取和选择影像组学特征流程示意图,包括:
[0169]
步骤s201,首先在ct图像分割感兴趣区域:(a)为肺癌患者ct图像,(b)为勾画感兴趣区域,(c)为感兴趣区域的3d图像;
[0170]
步骤s202,接着从感兴趣区域中提取影像组学特征;
[0171]
步骤s203,最后对提取的特征进行降维处理:(d)为计算组间相关系数(icc)示意图,选择大于等于0.75的影像组学特征,(e)(f)为套索回归分析,筛选出具备优良性能但是自变量个数较少的变量合集。(e)(f)为影像组学特征进行套索回归分析,随着惩罚系数越大,变量越少,根据受试者工作特征曲线下的面积选择合适的变量,筛选出具备优良性能但是自变量个数较少的变量合集。影像组学特征分别包括形状特征,一阶特征和纹理特征,纹理特征又包括glcm、gldm、glrlm、glszm、ngtdm。其中,glcm为灰度共生矩阵特征,即一个其行列数表示灰度值、单元格包含灰度值处于一定关系(角度、距离)次数的矩阵,也称为二阶直方图;gldm为灰度相关矩阵,即在图像空间中相隔某距离的两像素之间会存在的灰度关系;glrlm为灰度游程长度矩阵,即其中每个元素(i,j)描述了灰度级在指定的方向上和距离上连续出现的次数或概率;glszm为灰度尺寸区域矩阵,即在行和列处的元素存储具有灰度级和大小的区域(具有相同灰度级的连接体素)数量的矩阵;ngtdm为邻域灰度差矩阵,即像素i的灰度值与距离为d的邻近像素j的平均像素值的绝对差异。
[0172]
经过图2步骤提取与选择影像组学特征,结果显示pyradiomics提取出1502个影像组学特征,包括14个形状特征、288个一阶特征和1200个纹理特征;排除组间icc小于0.75的影像组学特征进而保留出1090个影像组学特征;为了防止过拟合,首先经过t检验和秩和检验中留下p值<0.05的46个影像组学特征,接着进行套索分析筛选出最佳的变量合集,共10个潜在的影像组学特征,最后为了防止共线性,通过逐步回归分析可得最终4个影像组学特征,这4个影像组学特征即筛选影像组学特征,分别是wavelet
‑
lll_glszm_smallareaemphasis、wavelet
‑
lhh_glcm_jointaverage、wavelet
‑
lhh_ngtdm_complexity、squareroot_glcm_differenceentropy。
[0173]
如图3a至3e分别显示在训练集的局部控制与局部失败两组患者中的4个影像组学
特征和在训练集和验证集中局部控制与局部失败两组患者的影像组学评分的数据特点和整体分布。图3a至图3f中,纵坐标是指4个影像组学特征和影像组学评分的数值,横坐标是指局部控制与局部失败分组。其中:
[0174]
图3a为影像组学特征wavelet
‑
lll_glszm_smallareaemphasis在训练集的局部控制与局部失败两组患者中的数据特点,整体分布,组间差异和相应的p值;
[0175]
图3b为影像组学特征wavelet
‑
lhh_glcm_jointaverage在训练集的局部控制与局部失败两组患者中的数据特点,整体分布,组间差异和相应的p值;
[0176]
图3c为影像组学特征wavelet
‑
lhh_ngtdm_complexity在训练集的局部控制与局部失败两组患者中的数据特点,整体分布,组间差异和相应的p值;
[0177]
图3d为影像组学特征squareroot_glcm_differenceentropy在训练集的局部控制与局部失败两组患者中的数据特点,整体分布,组间差异和相应的p值;
[0178]
图3e为影像组学评分在训练集的局部控制与局部失败两组患者中的数据特点,整体分布,组间差异和相应的p值。
[0179]
另外,图3f为影像组学评分在验证集的局部控制与局部失败两组患者中的数据特点,整体分布,组间差异和相应的p值。
[0180]
图3a至3f评估两组影像组学特征和影像组学评分的差异,并指出相应的p值,p值通过独立样本t检验或者wilcoxon秩和检验。图3a至3d显示了在训练组中验证了各个影像组学特征的意义,说明各个影像组学特征数值越大,肿瘤局部越有可能控制。
[0181]
2.4选择最佳分类器
[0182]
应用各种分类器建立影像组学模型的性能如表1所示,当利用决策树、支持向量机建立影像组学模型时,存在的或多或少的问题,如利用dt分类法建立的影像组学模型的分类能力没有统计学意义,模型的auc低于0.5,或者将这些特征输入svm分类器中,得到的模型性能较差,特异性较低;与上述方法相比,lr方法建立的模型表现出了最佳的性能和准确度,因此将用于后续建模。其中,auc是指为受试者工作特征曲线下的面积,是衡量学习器优劣的一种性能评价指标,表示预测的正例排在负例前面的概率。auc=1,指完美分类器,auc=[0.85,0.95],指效果很好,auc=[0.7,0.85],指效果一般,auc=[0.5,0.7],指效果较低,auc=0.5,指跟随机猜测一样以及模型没有预测价值,auc<0.5,比随机猜测还差。
[0183]
2.5预测模型构建
[0184]
由上述所确定的4个影像组学特征作为筛选影像组学特征,建立影像组学模型,影像组学评分=
‑
27.645 14.393
×
wavelet
‑
lll_glszm_smallareaemphasi 8.075
×
wavelet
‑
lhh_glcm_jointaverage
‑
3.386
×
wavelet
‑
lhh_ngtdm_complexity 9.196
×
squareroot_glcm_differenceentropy。
[0185]
上述每个筛选影像组学特征的权重,通过如下方式获得:
[0186]
获取立体定向放疗的肺癌患者治疗前的医学影像图、以及治疗后的肿瘤状态,所述肿瘤状态包括局部控制或局部失败;
[0187]
从所述医学影像图中提取多个筛选影像组学特征的数据,所述筛选影像组学特征从多个影像学特征中筛选得到,且所述筛选影像学特征的组间相关系数大于等于预设影像相关系数阈值;
[0188]
所述影像组学模型为偏置值与多个筛选影像组学特征的数据的加权值之和,以所
述筛选影像组学特征的数据作为影像组学模型的输入,治疗后的肿瘤状态作为所述影像组学模型的输出,对所述影像组学模型采用对数几率回归进行训练;
[0189]
训练后,得到所述影像组学模型的偏置值以及每一所述影像学特征的权重。
[0190]
影像组学模型优选为逻辑回归模型。影像组学模型的模型形式为其中,n为筛选影像组学特征的数量,w
i
为第i个筛选影像组学特征的权重,b为偏置值,k
i
为第i个筛选影像组学特征的数据。
[0191]
以筛选影像组学特征的权重作为参数进行训练,通过肿瘤状态对影像组学模型中的权重进行参数优化,得到最终的影像组学模型。训练后的影像组学模型的参数即包括了每个筛选影像组学特征的权重。
[0192]
为了说明影像组学评分在诺谟图上的有效性,影像组学评分在1年肿瘤局部控制组和局部失败组中的分布如图3e
‑
3f所示,表明影像组学评分在两组中存在显著差异,评分定量值越大,则1年肿瘤局部控制的可能性越大。
[0193]
2.6综合模型
[0194]
采用临床分期、血小板和gtv
min
建立临床模型,影像组学评分结合临床和剂量学因素建立综合模型。
[0195]
具体来说,综合模型为逻辑回归模型。综合模型的模型形式为c m1l1 m2l2 m3l3 m4l4,其中,c为偏置值,m1为临床分期的权重,l1为临床分期的数据,m2为血小板的权重,l2为血小板的数据,m3为gtv
min
的权重,l3为gtv
min
的数据,m4为影像组学评分的权重,l4为影像组学评分的数据。
[0196]
以临床分期、血小板、gtv
min
、影像组学评分的数据作为综合模型的输入,以肿瘤状态作为综合模型的输出,以临床分期、血小板、gtvmin、影像组学评分的权重作为参数进行训练,通过肿瘤状态对综合模型中的权重进行参数优化,得到最终的综合模型。训练后的模型,输入临床分期、血小板、gtvmin、影像组学评分的数据,经过c m1l1 m2l2 m3l3 m4l4的计算,并对计算结果进行分类后,得出预测的肿瘤状态。
[0197]
2.7预测模型评价
[0198]
如表1和图4a至图4c所示,图4a为影像组学模型、临床模型和综合模型在训练组的受试者工作特征曲线roc及roc曲线下面积(auc),图4a展示了影像组学模型受试者工作特征曲线41a、临床模型受试者工作特征曲线42a、以及综合模型受试者工作特征曲线43a。图4b为影像组学模型、临床模型和综合模型在验证组的受试者工作特征曲线roc及roc曲线下面积(auc),图4b展示了影像组学模型受试者工作特征曲线41b、临床模型受试者工作特征曲线42b、以及综合模型受试者工作特征曲线43b。
[0199]
图4c为影像组学模型、临床模型和综合模型在训练组和验证组的roc曲线下面积(auc)比较示意图。其中:p1为训练组的影像组学模型与临床模型的对比结果,p2为训练组的影像组学模型与综合模型的对比结果,p3为训练组的临床模型与综合模型的对比结果,p4为验证组的影像组学模型与临床模型的对比结果,p5为验证组的影像组学模型与综合模型的对比结果,p6为验证组的临床模型与综合模型的对比结果。*为表达显著性(p<0.05)。图4a和图4b用roc曲线和delong检验比较了三个预测模型的auc值,结果显示影像组学模型、临床模型和综合模型的auc(95%置信区间(ci))在训练组中分别为0.811(95%ci:
0.713
‑
0.910)、0.845(95%ci:0.757
‑
0.934)和0.911(95%ci:0.845
‑
0.977),在验证组中分别为0.702(95%ci:0.507
‑
0.898)、0.786(95%ci:0.638
‑
0.933)和0.818(95%ci:0.659
‑
0.978);影像组学模型、临床模型和综合模型的准确率在训练组中分别为67.4%、82.0%和85.4%,在试验组中分别为92.9%、77.5%和82.5%;在训练组中,综合模型预测1年肿瘤局部控制状况明显优于影像组学模型(p=0.025)和临床模型(p=0.033),而影像组学模型和临床模型性能表现相似(p=0.613);在验证集中,综合模型的效果优于比单独模型包括临床因素模型和影像组学模型,由于样本量少或者混杂因素影响表现没有统计学差异,但是也可以看出综合模型效果更好的趋势。综合模型详细情况以及每个选定特征的贡献如图5所示,其中回归系数值是线性预测系数,p值表示特征有无统计学意义。图5中的截距是指模型在y轴上的截距,代表模型的起点;回归系数表示每个选定特征每变动一单位,因变量将平均变动的数量,每个选定特征的回归系数越大,对肿瘤局部控制状态影响越大;p值<0.05表示选定特征的达到显著性,p值>=0.05表示选定特征的没有达到显著性。
[0200]
2.7临床应用
[0201]
基于综合模型最好,为了方便临床医生应用,通过影像组学评分、临床分期、血小板和gtv
min
构建了可视化诺谟图预测肺癌患者的局部控制,如图6a所示;hosmer
‑
lemeshow检验结果每个队列没有显著差异(训练队列,p=0.898,试验队列,p=0.891),表明列线图是可接受的;诺谟图的校正曲线证实在图6b的训练数据集和图6c的验证数据集中,预测1年肿瘤局部控制的概率与实际观察一致。通过对比训练组的影像组学模型诺谟图61d、训练组的临床模型诺谟图62d、训练组的综合模型诺模图63d、训练组的all诺谟图64d和训练组的none诺谟图65d,可以看出综合模型有利于预测1年肿瘤局部控制概率,综合模型诺谟图63d的曲线下面积大于其他两种模型的诺谟图。通过对比验证组的影像组学模型诺谟图61e、验证组的临床模型诺谟图62e、验证组的综合模型诺模图63e、验证组的all诺谟图64e和验证组的none诺谟图65e,可以看出综合模型有利于预测1年肿瘤局部控制概率,综合模型诺谟图63e的曲线下面积大于其他两种模型的诺谟图。因此,图6d和图6e表明综合模型诺谟图具有最高的临床可行性和实用性,all表示所有患者都接受干预即影像学随访的获益率,而none为所有病人都不接受干预的获益率。其中,图6b和图6c显示了实际曲线(apparent)、校正曲线(bias
‑
corrected)与理想曲线(ideal)校正曲线与理想曲线之间越相近,说明模型的预测能力越好。
[0202]
如图7所示为本发明一种电子设备的硬件结构示意图,包括:
[0203]
至少一个处理器701;以及,
[0204]
与至少一个所述处理器701通信连接的存储器702;其中,
[0205]
所述存储器702存储有可被至少一个所述处理器执行的指令,所述指令被至少一个所述处理器执行,以使至少一个所述处理器能够执行如前所述的肿瘤局部控制预测模型的构建方法。
[0206]
图7中以一个处理器701为例。
[0207]
电子设备还可以包括:输入装置703和显示装置704。
[0208]
处理器701、存储器702、输入装置703及显示装置704可以通过总线或者其他方式连接,图中以通过总线连接为例。
[0209]
存储器702作为一种非易失性计算机可读存储介质,可用于存储非易失性软件程
序、非易失性计算机可执行程序以及模块,如本技术实施例中的肿瘤局部控制预测模型的构建方法对应的程序指令/模块,例如,图1所示的方法流程。处理器701通过运行存储在存储器702中的非易失性软件程序、指令以及模块,从而执行各种功能应用以及数据处理,即实现上述实施例中的肿瘤局部控制预测模型的构建方法。
[0210]
存储器702可以包括存储程序区和存储数据区,其中,存储程序区可存储操作系统、至少一个功能所需要的应用程序;存储数据区可存储根据肿瘤局部控制预测模型的构建方法的使用所创建的数据等。此外,存储器702可以包括高速随机存取存储器,还可以包括非易失性存储器,例如至少一个磁盘存储器件、闪存器件、或其他非易失性固态存储器件。在一些实施例中,存储器702可选包括相对于处理器701远程设置的存储器,这些远程存储器可以通过网络连接至执行肿瘤局部控制预测模型的构建方法的装置。上述网络的实例包括但不限于互联网、企业内部网、局域网、移动通信网及其组合。
[0211]
输入装置703可接收输入的用户点击,以及产生与肿瘤局部控制预测模型的构建方法的用户设置以及功能控制有关的信号输入。显示装置704可包括显示屏等显示设备。
[0212]
在所述一个或者多个模块存储在所述存储器702中,当被所述一个或者多个处理器701运行时,执行上述任意方法实施例中的肿瘤局部控制预测模型的构建方法。
[0213]
本发明综合考虑肿瘤全部特征,纳入影像组学特征、临床因素和剂量学因素建立预测原发性和转移性肺癌患者sbrt治疗后1年的局部控制模型,大大提高了肺癌患者sbrt治疗后1年的局部控制预测准确率。
[0214]
本发明一实施例提供一种存储介质,所述存储介质存储计算机指令,当计算机执行所述计算机指令时,用于执行如前所述的肿瘤局部控制预测模型的构建方法的所有步骤。
[0215]
如图8所示为本发明一实施例一种肺癌患者治疗后肿瘤局部控制预测方法的工作流程图,采用如前所述的肿瘤局部控制预测模型的构建方法构建综合模型,所述方法包括:
[0216]
步骤s801,获取立体定向放疗的待预测肺癌患者治疗前的筛选临床因素的数据、筛选剂量学因素的数据、以及治疗前的医学影像图;
[0217]
步骤s802,基于所述医学影像图,得到关于该医学影像图的影像组学评分;
[0218]
步骤s803,将待预测肺癌患者治疗前的筛选临床因素的数据、筛选剂量学因素的数据、以及治疗前的医学影像图的影像组学评分输入所述综合模型,得到待预测肺癌患者的治疗后肿瘤状态,所述肿瘤状态包括局部控制或局部失败。
[0219]
具体来说,在构建了如前所述的综合模型后,执行步骤s801,获取立体定向放疗的待预测肺癌患者治疗前的筛选临床因素的数据、筛选剂量学因素的数据、以及治疗前的医学影像图。然后执行步骤s802,基于所述医学影像图,得到关于该医学影像图的影像组学评分。具体来说可以采用与构建综合模型时相同的影像组学评分计算方法,确定待预测肺癌患者的影像组学评分。
[0220]
然后,执行步骤s803,将待预测肺癌患者治疗前的筛选临床因素的数据、筛选剂量学因素的数据、以及治疗前的医学影像图的影像组学评分输入所述综合模型,得到待预测肺癌患者的治疗后肿瘤状态,所述肿瘤状态包括局部控制或局部失败。
[0221]
具体来说,输入临床分期、血小板、gtv
min
、影像组学评分的数据,经过综合模型对临床分期、血小板、gtv
min
、影像组学评分的数据的加权计算,并对计算结果进行分类后,得
出预测的肿瘤状态概率。
[0222]
本发明综合考虑肿瘤全部特征,纳入影像组学特征、临床因素和剂量学因素建立预测原发性和转移性肺癌患者sbrt治疗后1年的局部控制模型,大大提高了肺癌患者sbrt治疗后1年的局部控制预测准确率。
[0223]
如图9所示为本发明一种电子设备的硬件结构示意图,包括:
[0224]
至少一个处理器901;以及,
[0225]
与至少一个所述处理器901通信连接的存储器902;其中,
[0226]
所述存储器902存储有可被至少一个所述处理器执行的指令,所述指令被至少一个所述处理器执行,以使至少一个所述处理器能够执行如前所述的肺癌患者治疗后肿瘤局部控制预测方法。
[0227]
图9中以一个处理器901为例。
[0228]
电子设备还可以包括:输入装置903和显示装置904。
[0229]
处理器901、存储器902、输入装置903及显示装置904可以通过总线或者其他方式连接,图中以通过总线连接为例。
[0230]
存储器902作为一种非易失性计算机可读存储介质,可用于存储非易失性软件程序、非易失性计算机可执行程序以及模块,如本技术实施例中的肺癌患者治疗后肿瘤局部控制预测方法对应的程序指令/模块,例如,图8所示的方法流程。处理器901通过运行存储在存储器902中的非易失性软件程序、指令以及模块,从而执行各种功能应用以及数据处理,即实现上述实施例中的肺癌患者治疗后肿瘤局部控制预测方法。
[0231]
存储器902可以包括存储程序区和存储数据区,其中,存储程序区可存储操作系统、至少一个功能所需要的应用程序;存储数据区可存储根据肺癌患者治疗后肿瘤局部控制预测方法的使用所创建的数据等。此外,存储器902可以包括高速随机存取存储器,还可以包括非易失性存储器,例如至少一个磁盘存储器件、闪存器件、或其他非易失性固态存储器件。在一些实施例中,存储器902可选包括相对于处理器901远程设置的存储器,这些远程存储器可以通过网络连接至执行肺癌患者治疗后肿瘤局部控制预测方法的装置。上述网络的实例包括但不限于互联网、企业内部网、局域网、移动通信网及其组合。
[0232]
输入装置903可接收输入的用户点击,以及产生与肺癌患者治疗后肿瘤局部控制预测方法的用户设置以及功能控制有关的信号输入。显示装置904可包括显示屏等显示设备。
[0233]
在所述一个或者多个模块存储在所述存储器902中,当被所述一个或者多个处理器901运行时,执行上述任意方法实施例中的肺癌患者治疗后肿瘤局部控制预测方法。
[0234]
本发明综合考虑肿瘤全部特征,纳入影像组学特征、临床因素和剂量学因素建立预测原发性和转移性肺癌患者sbrt治疗后1年的局部控制模型,大大提高了肺癌患者sbrt治疗后1年的局部控制预测准确率。
[0235]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。