1.本发明涉及植物生物技术领域,尤其是农业生物技术和基因编辑以及植物育种。本披露主题涉及使用单倍体诱导品系(无论是现存的还是创造的)并且转化该单倍体诱导品系使得其含有编码能够编辑基因的细胞机器的dna。
2.序列表
3.本技术附有一个序列表,该序列表定名为81771
‑
wo
‑
reg
‑
org
‑
p
‑
1_seq_st25.txt,创建于2019年12月9日,大小为约444千字节。本序列表通过引用以其全文并入本文。本序列表随同此申请经由efs
‑
web提交,并且符合37c.f.r.
§
1.824(a)(2)
‑
(6)和(b)。
背景技术:
4.定向诱变(也称为“基因编辑”)是作物育种中十分重要的技术。现在有许多方法编辑具体的基因靶,包括crispr、talen、兆核酸酶、和锌指。向植物中引入编辑机器的一个方法是使用农杆菌或基因枪转化植物组织。在转化中,将编辑该编辑机器(例如,cas9和指导rna)的dna引入植物愈伤组织、种子或胚组织。然后回收到稳定转化的植物(“事件”),这是任选地在选择性标记的帮助下。但是因为组织培养是基因型依赖性的,这一途径将不会对所有作物都有用,或者甚至不会对它起作用的作物的所有品种都有用。这些被称为转化顽固性作物或品种。这些作物或品种可能因为它们的性能而受到重视,但是它们不能被转化并且因此不能通过转化而直接编辑,这对于生物技术来说是一个挑战。对于顽固性品种,可以使用两种替代性方法中的一种来引入所希望的突变。第一,可通过性状基因渗入来引入编辑。这一途径是昂贵、费力且费时的。它还意味着由遗传连锁导致的最终产物的不纯——即,在渗入的编辑周围将会有连接块,其含有来自可转化供体品系的基因和等位基因。如果那些基因或等位基因中的任一者影响到所述转化顽固性品系(也可被称为“优良品系”)的性能,这一连接可以是组织。第二,可以在无组织培养的情况下,将编辑机器过渡性地引入生长的植物中,例如用于拟南芥转化的花浸渍。所述挑战是确保编辑最终出现在有助于种系的细胞中,因此它们被传递至子代种子中。在作物中,为了这样做,有少数几种已确立或例行的方法。
5.我们先前已在美国专利申请号15/901464中示出在单倍体诱导期间过渡性地引入编辑机器的新方法,美国专利申请号15/901464是pct/us 2017/064512的国家阶段(二者的全部内容通过引用并入本文)。单倍体诱导(“hi”)是一类植物现象,其特征在于在受精期间或之后的某一时间(常常在早期胚发育期间)从胚中缺失了一个亲本的染色体组(单倍体诱导物亲本的染色体)。如果诱导物品系被用作杂交中的雄性,单倍体诱导也被称为单雌生殖,或如果诱导物品系被用作杂交中的雌性,单倍体诱导也被称为单雄生殖。已经在多个植物物种中研究了单倍体诱导,例如高梁、大麦、小麦、玉米、拟南芥、和许多其他物种。
6.普遍地是,在单倍体诱导期间,在诱导杂交中使用的两个亲本品系均是二倍体,因此它们的配子(卵细胞和精细胞)是单倍体。单倍体诱导通常是降低诱导物品系的外显性状的媒介,因此所产生的子代,依赖于物种或情形,可以是二倍体(如果没有发生基因组缺失)
或单倍体(如果事实上发生了基因组缺失)。如果与单倍体诱导物杂交的亲本品系不是二倍体,而是四倍体、六倍体或更高倍性的其他植物,术语单倍体诱导有些用词不当,因为产生的“单倍体”子代将具有配子染色体数,并且因此不是真正的单倍体,而是二倍体(如果亲本是四倍体)或三倍体(如果亲本是六倍体)以及等等。因此,如本文所使用的,“单倍体”具有亲本一半的染色体数量;因此二倍体生物(例如,玉米)的单倍体示出单倍性;四倍体生物(例如,黑麦草)的单倍体示出二倍性;六倍体生物(例如,小麦)的单倍体示出三倍性。
7.单倍体诱导可以在自花授粉或同一物种的两个品系的互交期间发生,或它可以在远缘杂交期间发生,在这种情况下它可以被看做是杂交屏障,阻止了种间杂交种的形成。在玉米中,最常使用的诱导单倍体的方法是通过使用种内单倍体诱导物雄性品系,其主要由1号染色体的区域内的重排、突变、和/或重组、插入或缺失引发,尤其是matrilineal(matl)基因,也称为not like dad1(nld1)和磷脂酶a1(pla1)(最显著的例外是ig型单倍体诱导,其是3号染色体上的indeterminate gametophyte1基因中的突变的结果)。在小麦中,最常见的诱导单倍体的方法是通过与玉米花粉的远缘杂交
‑
无论亲本基因型或谱系如何,这在几乎所有与几乎所有玉米花粉杂交的小麦中有用。
8.hi玉米品系在1号染色体上含有数量性状基因座(“qtl”),其负责至少66%的单倍体诱导变异。当它渗入不同背景时,qtl以不同的比率导致单倍体诱导。种子工业中使用的所有玉米单倍体诱导物品系都是建立的hi品系(称为stock6)的衍生物,并且全部都具有单倍体诱导物1号染色体qtl突变。
9.在玉米中,单倍体种子或胚是通过在单倍体诱导物雄性(即“单倍体诱导物花粉”)与实际上人们选择的任何穗之间进行杂交而特异性产生的
‑
所述穗可以是任何近交种、杂交种或其他种质。当单倍体诱导物花粉dna未通过胚的第一次细胞分裂完全传递和/或维持时产生单倍体。所产生的表型不完全外显,其中一些胚珠含有单倍体胚,并且其他含有二倍体胚、2fricana22胚、嵌合胚或败育胚。单倍体籽粒具有仅含有母本dna的胚加正常三倍体胚乳。在单倍体诱导后,使用表型或遗传标记筛选典型地将单倍体胚或种子从二倍体和2fricana22同胞中分离出来,并使其生长或培养成单倍体植物。然后将这些植物自然地或经由化学操作(例如,使用抗微管剂例如秋水仙碱)转化成双单倍体(dh)植物,所述植物然后产生近交种子。
10.通过使用双单倍体(dh)植物协助植物育种。dh植物的产生使得植物育种者能够获得近交品系而无需多代近交,从而减少了产生纯合植物所需的时间。dh植物为植物育种者提供了宝贵的工具,特别是用于产生近交品系、qtl定位、细胞质转换、性状基因渗入以及用于高通量性状改良的f2筛选。由于一代基本上产生了纯合品系,因此节约了大量的时间,否定了对多代单一种子血统(传统近交)的需要。具体地,因为dh植物是完全纯合的,它们非常适合于数量遗传学研究。单倍体种子的产生对于双单倍体育种过程至关重要。当用来自雌核发育诱导物(如stock 6和stock 6衍生的品系)的花粉受精时,在母本种质上产生单倍体种子。
11.我们先前描述了一个新方法,在所述方法中体内单倍体诱导过程可以被共同选择以通过将其包括在单倍体诱导物亲本中(无论作为转基因稳定整合、或过渡性地表达)将编辑机器过渡性地引入任何种质。在几乎任何作物中通过远缘杂交或从头单倍体诱导例如通过cenh3突变(即,cenh3
‑
修饰的单倍体诱导物;参见,例如,wo 2017/004375,通过引用以其
全文并入本文)或通过脂质喷雾(参见p.c.t.专利申请号pct/us 2016/62548,通过引用以其全文并入本文)可以完成同时编辑加上单倍体诱导。我们示出了在玉米(大田玉米和甜玉米)中的hi的实例,使用了单倍体诱导物雄性作为编辑供体品系。此外,我们示出了拟南芥中的hi的实例,使用了cenh3
‑
修饰的单倍体诱导物品系。
12.我们还提供了小麦中hi的实例,使用了玉米花粉作为远缘杂交中的编辑供体品系。在小麦、稻、大麦、芸苔属和其他作物中,单倍体诱导的途径会是使用通过远缘杂交诱导单倍体的花粉供体。例如,可以在小麦上使用玉米花粉,在小麦上使用粟花粉,在其他大麦物种上使用大麦花粉,或任何其他的远缘杂交方法。在雌核发育单倍体诱导的那些情况下,优选地是雄性品系含有编辑机器,因为父本(花粉衍生的)dna在单倍体诱导过程中被消除。在促成雄性性状的单倍体诱导的情况下,例如在玉米的ig1系统中或通过在任何玉米中改变的cenh3(其可通过雄性或雌性起作用),所述编辑机器最佳地会是出现在母本中,因为雌性染色体在单倍体诱导过程中被消除。
13.在同时编辑加上单倍体诱导中,目标是在无组织培养的情况下,快速和成本效益高地编辑作物和优良品系(“编辑目的品系”)。接受编辑的品系可以是优良种质,并且编辑机器本身会是在单倍体诱导过程中被消除的。同时,产生了经编辑的双单倍体品系。
14.在此,我们特别教导了用于确认单倍体子代(例如,编辑的单倍体子代)的存在的新方法以用于确认单倍体诱导物基因组的存在。
技术实现要素:
15.组织培养顽拗性对作物间的快速优良品系编辑是一个主要的挑战。使用单倍体诱导品系将定向诱变机器递送至优良品系并且同时诱导单倍体表示对这一主要障碍的克服。下一代育种计划可能会依赖于这一过程。
16.通过诱导物品系递送编辑机器。编辑机器最常是dna结合蛋白,其在某些情况下与rna结合,并且在某些情况下也与dna结合。组成编辑机器的dna、rna和蛋白质由诱导物品系编码并且出现在诱导物品系中,因为它们已经被稳定地插入到诱导物中,例如,通过基因枪或农杆菌介导的转化。在其他实例中,编辑机器在受精之前被过渡性地引入配子体中(通过外源性应用)或过渡性地在配子体中表达。受精之后,在消除诱导物染色体之前或过程中,在非诱导物靶基因中通过编辑机器制备编辑。结果是单倍体胚或植物或种子,其含有仅来自非诱导物亲本的染色体组,其中该染色体组含有已编辑的dna序列。可以进一步测试单倍体用以获得单倍体诱导物亲本的证据。可以鉴定、培养这些经编辑的单倍体,并且它们的染色体优选地通过秋水仙碱或其他的有丝分裂抑制剂加倍。然后这一品系可直接用于下游育种计划。
17.在一个实施例中,本发明提供了编辑植物的基因组dna的方法。该方法通过以下完成:取第一植物—其是单倍体诱导植物并且其还编码进其dna中(完成编辑必须的机器)(例如,cas9酶和指导rna)—和使用该第一植物的花粉对第二植物授粉。第二植物是待编辑的植物。从该授粉事件中,产生了子代(例如,胚或种子);至少其中一个将是单倍体种子。这一单倍体种子将仅含有第二植物的染色体;第一植物的染色体已经消失(已被消除、消失或降解),但是在这样做之前,第一植物的染色体允许基因
‑
编辑机器被表达。可替代地,并且不希望受理论束缚,第一植物在通过花粉管授粉时递送已表达的编辑机器。或者,在单倍体诱
导物品系是杂交中的雌性时的情况下,在使用“野生型”或非单倍体诱导花粉粒受精时单倍体诱导植物的卵细胞含有存在并且或许已被表达的编辑机器。通过这些途径中的任一种,通过杂交获得的单倍体子代将还具有经编辑的基因组。可以进一步测试单倍体用以获得诱导物亲本基因组的证据。
18.在一方面,编辑机器是任意dna修饰酶,但优选地是定点核酸酶。定点核酸酶优选地是基于crispr的,但是还可是兆核酸酶、转录激活子样效应子核酸酶(talen)、或锌指核酸酶。在本发明中使用的核酸酶可以是cas9、cfp1、dcas9
‑
foki、嵌合fen1
‑
foki。在一方面,dna修饰酶是定点碱基编辑酶例如cas9
‑
胞嘧啶脱氨酶或cas9
‑
腺嘌呤脱氨酶,其中cas9可具有其灭活的核酸酶活性的一个或两个,即,与胞嘧啶脱氨酶或腺嘌呤脱氨酶融合的嵌合cas9切口酶(ncas9)或失活的cas9(dcas9)。任选的指导rna在旨在被编辑的特定位点靶向基因组。在一方面,任选的指导rna包含18
‑
21个核苷酸的序列,其与seq id no:2、4、8、21、23、25、29、32和33中的任一个具有同源性。
19.一旦获得了经编辑的单倍体子代,它可任选地通过染色体加倍剂(例如秋水仙碱、拿草特、滴停平(dithipyr)、氟乐灵或另一种已知的抗微管剂)使其染色体加倍。
20.在一个实施例中,第一植物是单子叶植物或双子叶植物。第一植物的方面包括玉米、小麦、稻、大麦、燕麦、小黑麦、高梁、珍珠粟、类蜀黍、竹、甘蔗、芦笋、洋葱、和大蒜。在一个实施例中,第二植物是单子叶植物或双子叶植物。第二植物的方面包括玉米、小麦、稻、大麦、燕麦、小黑麦、高梁、珍珠粟、类蜀黍、竹、甘蔗、芦笋、洋葱、和大蒜。在一个实施例中,第一植物是与第二植物不同物种的单子叶植物或双子叶植物。例如,在一方面,第一植物是玉米并且第二植物是小麦。在第二方面,第一植物是小麦并且第二植物是玉米。在另一个实施例中,第一植物是玉米植物,其选自和/或衍生自品系stock6、rwk、rws、uh400、ax5707rs、np2222
‑
matl或若干其他已知的hi品系中的任一种。在又一个实施例中,第一植物包含cenh3基因、ig1基因中的突变、或赋予亲本
‑
单倍体诱导系统的另一突变。在另一个实施例中,第一植物是稻植物,其matl基因被修饰或敲除,使它成为单倍体诱导物品系。
21.在另一个实施例中,第一植物不必须地是单倍体诱导物,然而第一植物包含编辑基因编辑机器所必须的基因。在该实施例中,通过在授粉期间、在紧接授粉之前或紧随授粉之后,通过基于化合物产生了单倍体诱导。在一方面,组合物包含脂质或磷脂酶抑制剂。在另一方面,组合物包含甲基α
‑
亚油酰基氟膦酸酯(malfp)、亚油酸乙酯(llaee)、亚油酸(lla)、玉米油、二硬脂酰
‑
磷脂酰胆碱(dspc)、甲基花生酰基氟膦酸酯(mafp)、棕榈基三氟甲基酮(pacocf3)、花生酰基三氟甲基酮(aacocf3)、海绵类脂、亚麻酸乙酯(lnaee)、亚麻酸乙酯(lnaee)、油酸甲酯(oame)、油酸乙酯(oaee)、棕榈酸乙酯(paee)、棕榈油酸乙酯(plaee)、亚麻籽油、玉米油、α
‑
亚麻酸(alna)、γ
‑
亚麻酸(glna)、油酸、花生四烯酸、硬脂酸、9(z)
‑
11(e)
‑
共轭亚油酸、或2
‑
油酰
‑1‑
棕榈酰
‑
sn
‑
甘油
‑3‑
磷酸
‑
乙醇胺。
22.本披露还包括测试经编辑的单倍体植物子代中第一植物的基因组材料的存在的方法,其中第一植物是植物的单倍体诱导物品系。在一个实施方案中,一种方法包括从经编辑的单倍体子代分离核酸,并检测核酸中多个共显性标记的存在,其中共显性标记对于第二植物具有独特的单倍型并且其中第二植物包含经编辑的单倍体植物子代中基因组dna的来源。
23.可以例如通过以下方法获得经编辑的单倍体,该方法包括:(a)获得第一植物,其
中所述第一植物能够表达dna修饰酶和任选地至少一种指导核酸;(b)获得第二植物,其中所述第二植物包含待编辑的植物基因组dna;(c)用来自所述第一植物的花粉给所述第二植物授粉;和选择由步骤(c)的授粉产生的至少一种单倍体子代,其中所述单倍体子代包含所述第二植物的基因组但是不包含所述第一植物的基因组,并且所述单倍体子代的基因组已经通过由所述第一植物递送的所述dna修饰酶和任选的至少一种指导核酸修饰。dna修饰酶和指导核酸可以是本文所述的那些。典型地,将经编辑的单倍体子代用染色体加倍剂,例如,秋水仙碱、拿草特、滴停平、氟乐灵或另一种已知的抗微管剂处理,在测试后,从而产生经编辑的双单倍体子代。
24.在不同实施方案中,植物可以不同并且可以包括本文所述的那些,例如,在一些实施方案中,第一植物是选自和/或衍生自品系stock 6、rwk、rws、uh400、ax5707rs、np2222
‑
matl或若干其他已知的hi品系中的任一种的玉米植物,并且第一植物作为雄性而第二植物作为雌性。
25.该多个共显性标记包括至少5、至少10、至少15、至少20、至少25、至少30、至少35、至少40、至少45、至少50、至少55、至少60、至少65和至少70个标记中的至少一个。典型地,该多个共显性标记将包括至少两个标记,该标记选自由表12中的标记组成的组。检测可包括使用表13中的至少一个测定组分。
26.序列表中序列的简要说明
27.seq id no:1是载体23396的核苷酸序列。
28.seq id no:2是编码用于在玉米中编辑vlhp1的grna序列的核苷酸序列。
29.seq id no:3是载体23399的核苷酸序列。
30.seq id no:4是用于在玉米中编辑gw2
‑
2的grna序列。
31.seq id no:5是载体22808的核苷酸序列,其包含talen构建体。
32.seq id no:6是22808的talen的靶序列。
33.seq id no:7是载体23123的核苷酸序列,其包含cas9构建体。
34.seq id no:8是用于在玉米中编辑matl的grna。
35.seq id no:9是np2222中matl的相关部分的核苷酸序列。
36.seq id no:10是stock6中matl的相关部分的核苷酸序列。
37.seq id no:11是usr01350333
‑
3等位基因1中matl的相关部分的核苷酸序列。
38.seq id no:12是usr01350333
‑
3等位基因2中matl的相关部分的核苷酸序列。
39.seq id no:13是usr01350344
‑
2等位基因1中matl的相关部分的核苷酸序列。
40.seq id no:14是usr01350344
‑
2等位基因2中matl的相关部分的核苷酸序列。
41.seq id no:15是usr01350343
‑
1等位基因1中matl的相关部分的核苷酸序列。
42.seq id no:16是usr01350328
‑
1等位基因1中matl的相关部分的核苷酸序列。
43.seq id no:17是usr01350337
‑
2等位基因1中matl的相关部分的核苷酸序列。
44.seq id no:18是usr01350337
‑
2等位基因2中matl的相关部分的核苷酸序列。
45.seq id no:19是cdna野生型matl的核苷酸序列。
46.seq id no:20是载体23397的核苷酸序列。
47.seq id no:21是用于在玉米中编辑vlhp2的grna序列。
48.seq id no:22是载体23398的核苷酸序列。
49.seq id no:23是用于在玉米中编辑gw2
‑
1的grna序列。
50.seq id no:24是载体23763的核苷酸序列。
51.seq id no:25是在小麦中的vlhp1的grna序列。
52.seq id no:26是tavlhp2的小麦vlhp靶序列。
53.seq id no:27是tavlhp3的小麦vlhp靶序列。
54.seq id no:28是用于编辑的在zmvlhp2
‑
03中的靶序列。
55.seq id no:29是在zmvlhp2
‑
03中的经编辑的序列。
56.seq id no:30是用于在zmpyl
‑
d中产生e149l突变的修复供体模板序列。
57.seq id no:31是载体23136的核苷酸序列。
58.seq id no:32是载体23136的grna。
59.seq id no:33是稻pla基因os03g27610的核苷酸序列。
60.seq id no:34是载体24038的核苷酸序列。
61.seq id no:35是载体24039的核苷酸序列。
62.seq id no:36是载体24079的核苷酸序列。
63.seq id no:37是载体24091的核苷酸序列。
64.seq id no:38是载体24094的核苷酸序列。
65.seq id no:39至seq id no:97是在鉴定的pcr taqman测定中使用的引物和探针。
66.seq id no:98是载体24075的核苷酸序列。
67.seq id no:99
‑
173是含有表12中所述的共显性标记的核苷酸序列。
68.seq id no:174
‑
473是表13中所述的测定组分的核苷酸序列。
附图说明
69.图1示出usr01350334
‑
3:二倍体的倍性分析(流式细胞术)数据(在200处为主峰,在400处为第二波峰)。
70.图2示出usr01350333
‑
3:单倍体的倍性分析(流式细胞术)数据(在100处为主峰,在200处为第二波峰)。
71.图3示出usr01350333
‑
10:二倍体的倍性分析(流式细胞术)数据(在200处为主峰,在400处为第二波峰)。
72.图4示出usr01350344
‑
2:单倍体的倍性分析(流式细胞术)数据(在100处为主峰,在200处为第二波峰)。
73.图5示出usr01350343
‑
1:单倍体的倍性分析(流式细胞术)数据(在100处为主峰,在200处为第二波峰)。
74.图6示出usr01350341
‑
1:二倍体的倍性分析(流式细胞术)数据(在200处为主峰,在400处为第二波峰)。
75.图7示出usr01350328
‑
1:单倍体的倍性分析(流式细胞术)数据(在100处为主峰,在200处为第二波峰)。
76.图8示出usr01350321
‑
3:二倍体的倍性分析(流式细胞术)数据(在200处为主峰,在400处为第二波峰)。
77.图9是载体23396(seq id no:1)的示意图,载体23396用于将玉米未成熟的胚经农
杆菌
‑
介导的转化以在zmvlhp1基因中产生靶向突变。xzmvlhp
‑
01:指导rna(grna)序列(5
’‑
gcaggaggcgtcgagcagcg
‑3’
,seq id no:2);rsgrnazmvlhp
‑
01:单指导rna(sgrna),其包含grna、tracrna和poliii终止序列。cpmi:pmi选择性标记基因;ccas9:cas9核酸酶基因;rb:t
‑
dna右边界;lb:t
‑
dna左边界;tnos:胭脂碱合成酶终止子。cspec:大观霉素抗性基因。
78.图10是载体23399(seq id no:3)的示意图,载体23399用于将玉米未成熟的胚经农杆菌
‑
介导的转化以在zmgw2基因中产生靶向突变。xzmgw2
‑
02:指导rna(grna)序列(5
’‑
aagctcgcgccctgctaccc
‑3’
,seq id no:4);rsgrnazmgw2
‑
02:单指导rna(sgrna),其包含grna、tracrrna和poliii终止序列。cpmi
‑
09:pmi选择性标记基因;ccas9
‑
01:cas9核酸酶基因;rb:t
‑
dna右边界;lb:t
‑
dna左边界;tnos:胭脂碱合成酶终止子。cspec:大观霉素抗性基因。
79.图11示出经编辑的单倍体甜玉米品系jser82a056的倍性测定并且图12示出经编辑的单倍体甜玉米品系jser82a063的倍性测定。通过与携带crispr
‑
cas9表达载体23399的转基因基因座的rwks单倍体诱导品系杂交,获得了这些品系。
80.图13示出在单倍体甜玉米品系jser82a063中的gw2
‑
02靶位点编辑的测序确认。将与预测的cas9切割位点相邻的单碱基c删除。
81.图14示出野生型对照的倍性分析,并且图15示出经编辑的单倍体小麦品系jswer30a22的倍性分析。
82.图16示出在单倍体小麦品系jswer30a22中的tavlhp1
‑
4b靶位点编辑的测序确认。底部的图示出紧接着预测的cas9切割位点的下游的tavlhp1
‑
4b序列的97bp被删除。97bp
‑
缺失的序列用2个箭头做了标记。
83.图17示出如从携带载体24038、24039、24079、24091和24094的t
‑
dna的转基因玉米t0植物中收集的花粉所测量的花粉表达,其用于给去雄的春季小麦品系ac
‑
nanda授粉。在花粉中该表达高,与在许多玉米和小麦实例中使用的甘蔗泛素启动子相比,在携带t
‑
dna载体24038、24039和24079的植物中平均更高约100倍。当与携带matrilineal启动子构建体(24094和24091)的花粉相比时,该表达在来自含有载体24038、24039和24079的植物的花粉中也更高。
84.图18示出二倍体对照(亲本usr01424135)的倍性分析直方图。第一个峰位于对数x
‑
轴的“2”位置上。因为这是来自拟南芥的叶组织,我们看到多个峰,其说明核内复制的正常水平。
85.图19示出二倍体对照(亲本usr01431603)的倍性分析直方图。第一个峰位于对数x
‑
轴的“2”位置上。因为这是来自拟南芥的叶组织,我们看到多个峰,其说明核内复制的正常水平。
86.图20示出二倍体对照(亲本usr01431609)的倍性分析直方图。第一个峰位于对数x
‑
轴的“2”位置上。因为这是来自拟南芥的叶组织,我们看到多个峰,其说明核内复制的正常水平。
87.图21示出来自板1033、孔c3(usr01424135 x ler
‑
427)的经编辑的单倍体的倍性分析直方图。第一个峰位于对数x
‑
轴的“1”位置,其说明它是单倍体。因为这是来自拟南芥的叶组织,我们看到多个峰,其说明核内复制的正常水平。
88.图22示出来自板1033、孔e4(usr01424135 x ler
‑
437)的经编辑的单倍体的倍性
分析直方图。第一个峰位于对数x
‑
轴的“1”位置,其说明它是单倍体。因为这是来自拟南芥的叶组织,我们看到多个峰,其说明核内复制的正常水平。
89.图23示出来自板1046、孔h12(usr01431609 x ler
‑
123)的经编辑的单倍体的倍性分析直方图。第一个峰位于对数x
‑
轴的“1”位置,其说明它是单倍体。因为这是来自拟南芥的叶组织,我们看到多个峰,其说明核内复制的正常水平。
90.图24示出亲本#usr01424135和来自通过拟南芥兰茨贝格(landsberg erecta)花粉异型杂交的所有测序的经编辑的单倍体中的gl1靶位点序列突变。显然,制造的精确的编辑在不同的单倍体中是不同的。
91.定义
92.虽然认为以下术语可以很好地为本领域的普通技术人员所理解,提出以下定义是为了便于解释本技术披露的主题。
93.除非另有定义,本文所使用的所有技术和科学术语旨在具有与本领域的普通技术人员通常所理解的相同的含义。本文采用的技术的参考文献旨在参考本领域中通常理解的技术,包括对本领域的普通技术人员而言很清楚的那些技术的变化和/或等效技术的替换。虽然认为以下术语可以很好地为本领域的普通技术人员所理解,提出以下定义是为了便于解释本技术披露的主题。
94.根据长期存在的专利法公约,在本技术(包括权利要求书)中使用的术语“一个(a)”、“一种(an)”和“所述(the)”是指“一个/种或多个/种”。例如,短语“一个细胞”是指一个或多个细胞,并且在一些实施例中可以是指组织和/或器官。相似地,短语“至少一个”当在本文中用于指代实体时,是指例如1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、75、100个或更多个该实体,包括但不限于1与100之间的所有整数值以及大于100的整数。
95.除非另外指明,本说明书和权利要求书中使用的表示成分的量、反应条件等的所有数字应被理解为在所有情况下用术语“约”来修饰。如本文所使用的术语“约”,当指代可测量的值例如质量、重量、时间、体积、浓度或百分比的量时,意味着涵盖在一些实施例中与规定量相比
±
20%的变化、在一些实施例中与规定量相比
±
10%的变化、在一些实施例中与规定量相比
±
5%的变化、在一些实施例中与规定量相比
±
1%的变化、在一些实施例中与规定量相比
±
0.5%的变化、以及在一些实施例中与规定量相比
±
0.1%的变化,因为此类变化适合于执行所披露的方法和/或使用所披露的组合物、核酸、多肽等。因此,除非相反地指出,在本说明书和所附权利要求书中所列出的数值参数是可以取决于试图通过本技术披露的主题获得的期望特性而变化的近似值。
96.如本文所使用的,术语“等位基因”是指遗传基因座处的变体或替代序列形式。在二倍体中,在每一个基因座处,单个等位基因分别从每一个亲本遗传给子代个体。存在于二倍体生物体中的给定基因座的两个等位基因占据一对同源染色体上相对应的位置,虽然本领域的普通技术人员理解在任何特定个体中的等位基因不必代表存在于所述物种中的所有等位基因。
97.如本文所使用的,术语“和/或”当在实体列表的背景下使用时,是指实体单独存在或以组合存在。因此,例如,短语“a、b、c和/或d”包括单独地a、b、c和d,但也包括a、b、c和d的任何和所有组合和子组合(例如,ab、ac、ad、bc、bd、cd、abc、abd和bcd)。在一些实施例中,“和/或”所指的一个或多个元素也可以单独存在于组合和/或子组合中的单次或多次出现
中。
98.如本文所使用的,短语“与
……
相关”是指两个实体之间的可识别和/或可测定的关系。例如,短语“与hi相关”是指性状、基因座、基因、等位基因、标记、表型等或其表达,它们的存在或不存在可以影响植物或其子代表现hi的范围和/或程度。因此,当标记与性状连锁并且当标记的存在指示了期望的性状或性状形式是否会和/或会以什么程度发生在包含标记的植物/种质中时,则所述标记与所述性状“相关”。相似地,当标记与等位基因连锁并且当标记的存在指示了等位基因是否存在于包含标记的植物/种质中时,则所述标记与所述等位基因“相关”。例如,“与hi相关的标记”是指其存在或不存在可以用于预测植物是否会和/或会以什么程度展现单倍体诱导的标记。
99.术语“包含”(comprising)与“包括”(including)、“含有”(containing)和“特征在于”(characterized by)是同义的,是包含性的或开放式的,并且不排除另外的未列举的元素和/或方法步骤。“包含”是意指所指定的元素和/或步骤存在,但是其他元素和/或步骤可以添加进来并且仍然落入相关主题的范围内的术语。
100.如本文所使用的,短语“由
……
组成”排除未具体列举的任何元素、步骤或成分。当短语“由
……
组成”出现在权利要求主体的子句中,而不是直接地接在序言后面时,它只限制该子句中所阐述的元素;其他元件并不排除在整个权利要求之外。
101.如本文所使用的,短语“基本上由
……
组成”限制相关的披露或权利要求的范围至规定的材料或步骤,加上并不实质上影响所披露的和/或所要求保护的主题的基本和新颖特征的那些。
102.关于术语“包含”、“基本上由
……
组成”和“由
……
组成”,在本文中使用这三个术语之一的情况下,本技术披露和要求保护的主题可以在一些实施例中包括使用其他两个术语中的任一个。例如,如果主题在一些实施例中涉及编码包含与seq id no:9或19具有至少95%一致性的氨基酸序列的多肽的核酸。应当理解的是,所披露的主题因此还涵盖编码在一些实施例中基本上由与seq id no:9或19具有至少95%一致性的氨基酸序列组成的多肽的核酸、以及编码在一些实施例中由与seq id no:9或19具有至少95%一致性的氨基酸序列组成的多肽的核酸。相似地,还应当理解的是,在一些实施例中,用于所披露的主题的方法包括本文所披露的步骤,在一些实施例中,用于本技术披露的主题的方法基本上由披露的步骤组成,并且在一些实施例中,用于本技术披露的主题的方法由本文中披露的步骤组成。
103.如本文所使用的,术语“从头单倍体诱导”是指通过引入自发单倍体诱导剂来触发单倍体诱导。这样的引入可以通过局部喷雾、手动授粉、诱变或转基因方法来实现。贯穿本说明书,术语“从头单倍体诱导”、“从头hi”和“单倍体诱导从头”可互换使用。
104.如本文所使用的,术语“基因”是指包括dna序列的遗传单位,所述遗传单位占据染色体上的特定位置并且含有生物体中的具体特征或性状的遗传指令。
[0105]“遗传图谱”是对给定物种内的一个或多个染色体上的基因座之间的遗传连锁关系的描述,通常以图表或表格形式描绘。
[0106]
如本文所使用的,称为“单倍体”的植物在单倍体植物中具有减少数量的染色体(n),并且它的染色体组等于配子的染色体组。在单倍体生物中,仅存在染色体正常数量的一半。因此二倍体生物(例如,玉米)的单倍体示出单倍性;四倍体生物(例如,黑麦草)的单
倍体示出二倍性;六倍体生物(例如,小麦)的单倍体示出三倍性;等。如本文所使用的,被称为“双单倍体”的植物通过使单倍体染色体组加倍而开发。从自交到任何数量的世代的双单倍体植物获得的植物或种子仍然可以被鉴定为双单倍体植物。双单倍体植物被认为是纯合植物。如果植物是可育的,即使所述植物的整个营养部分不包含具有双组染色体的细胞,所述植物也被认为是双单倍体;也就是说,如果植物含有存活的配子,即使它在营养组织中是嵌合的,也将被认为是双单倍体。
[0107]
如本文所使用的,术语“人类诱导的突变”是指由于直接或间接人类作用而发生的任何突变。此术语包括但不限于通过任何定向诱变方法获得的突变。
[0108]
如本文所使用的,“引入的”是指递送的、表达的、施用的、运输的、转移的、渗透的或其他相似的术语以说明所希望的物体的核酸或蛋白质或其组合向一个物体的递送。例如,编码定点核酸酶的核酸和任选地至少一种指导rna可通过单倍体诱导引入单倍体胚中。同样地,现存编辑机器(包含定点核酸酶蛋白质和任选地至少一种指导rna)可通过施用适宜的细胞穿透肽引入到单倍体胚中。
[0109]
如本文所使用的,术语“标记探针”和“探针”是指可以用于检测较大序列内序列的存在或不存在的核苷酸序列或核酸分子(例如,通过核酸杂交与标记或标记基因座的全部或部分互补的核酸探针)。包含约8、10、15、20、30、40、50、60、70、80、90、100个或更多个连续核苷酸的标记探针可以用于核酸杂交。
[0110]
如本文所使用的,当鉴定hi相关的基因座的存在/不存在时,术语“分子标记”可以用于指如上文所定义的遗传标记,或其用作参比点的编码产物(例如,蛋白质)。分子标记能够源自基因组核苷酸序列或表达的核苷酸序列(例如,来自rna、cdna等)。该术语也指与标志序列互补或与其侧接的核苷酸序列,如用作能够扩增该标志序列的探针和/或引物的核苷酸序列。当核苷酸序列在溶液中特异性杂交时,所述核苷酸序列是“互补的”(例如,根据沃森
‑
克里克碱基配对原则)。此术语也指通过与标记序列互补或与其侧接的核苷酸序列(例如用作探针和/或能够扩增标记序列的引物的核苷酸序列)的不存在指示性状的遗传标记。
[0111]
如本文所使用的,术语“核苷酸序列”、“多核苷酸”、“核酸序列”、“核酸分子”和“核酸片段”是指单链或双链的rna或dna的聚合物,任选地含有合成的、非天然的、和/或改变的核苷酸碱基。“核苷酸”是从其构建dna或rna聚合物并且由嘌呤或嘧啶碱基、戊糖、和磷酸基团组成的单体单元。核苷酸(通常以其5
’‑
单磷酸酯形式发现)以其单字母名称表示如下:“a”表示腺苷酸或脱氧腺苷酸(分别用于rna或dna),“c”表示胞苷酸或脱氧胞苷酸,“g”表示鸟苷酸或脱氧鸟苷酸,“u”表示尿苷酸,“t”表示脱氧胸苷酸,“r”表示嘌呤(a或g),“y”表示嘧啶(c或t),“k”表示g或t,“h”表示a或c或t,“i”表示肌苷,并且“n”表示任何核苷酸。
[0112]
如本文所使用的,术语“核苷酸序列一致性”是指在两个多核苷酸的对应位置处存在一致的核苷酸。当进行比对以获得最大对应时(例如,在比较窗口中),如果在两个多核苷酸中的核苷酸序列是相同的,则多核苷酸具有“一致的”序列。通常通过在比较窗口上比较这两个序列的部分来进行两个或多个多核苷酸之间的序列比较,以鉴定并比较序列相似性的局部区域。比较窗口通常是从约20至200个连续核苷酸。多核苷酸的“序列一致性百分比”,如约50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、99%或100%序列一致性,可以在比较窗口上通过比较两个最佳比对的序列来确定,其中为了两个序列的
最佳比对,与参比序列相比,在比较窗口中的多核苷酸序列的部分可以包括添加或缺失(即,空位)。在一些实施例中,通过以下方式计算百分比:(a)确定在两个序列中出现一致的核酸碱基的位置的数量;(b)将匹配位置的数量除以比较窗口中位置的总数;并且(c)将结果乘以100。还可以通过已知算法的计算机化实施方式或者通过目视检查进行用于比较的序列的最佳比对。易于获得的序列比较和多重序列比对算法分别是可在因特网(例如,embl
‑
ebi的网站)上获得的基本局部比对搜索工具(blast)和clustalw/clustalw2/clustal omega程序。其他合适的程序包括但不限于,gap、bestfit、plot similarity和fasta,它们是可从accelrys公司(美国,加利福尼亚州,圣地亚哥)获得的accelrys gcg软件包的一部分。还参见smith和waterman,1981;needleman和wunsch,1970;pearson和lipman,1988;ausubel等人,1988;以及sambrook和russell,2001。
[0113]
适于确定百分比序列一致性和序列相似性的算法的一个实例是blast算法,它描述于altschul等人,1990中。在一些实施例中,序列一致性百分比是指进行比较的seq id no:1的最大orf中的gdna、cdna或预测的蛋白质序列之一的全长上的序列一致性。在一些实施例中,确定核酸序列一致性百分比的计算在计算中并不包括所比较的核酸之一包括“n”(即,其中在该位置可以存在任何核苷酸)的任何核苷酸位置。
[0114]
术语“开放阅读框”(orf)是指编码多肽的核酸序列。在一些实施例中,orf包含翻译起始密码子(即,起始密码子)、翻译终止(termination)(即,终止(stop)密码子)、以及其间的编码多肽中存在的氨基酸的核酸序列。术语“起始密码子”和“终止密码子”是指在编码序列中三个相邻的核苷酸(即,密码子)的单位,它对应地指明蛋白质合成(mrna翻译)的起始和链终止。
[0115]
马铃薯糖蛋白样磷脂酶a2α也可以称为pla、ppla、pplaiia pplaiiα、pla2α、或pla2、或其他类似的变体。马铃薯糖蛋白样磷脂酶aiiα也被称为matrilineal(matl)。这些术语自始至终可互换使用。包含四个碱基对移码突变的matrilineal基因称为matrilineal(matl)。
[0116]
如本文所使用的,术语“表型”、“表型性状”或“性状”是指植物或植物细胞的一个或多个性状。表型对于裸眼或通过本领域已知的任何其他评价手段(例如,显微术、生物化学分析、或电子机械测定)是可观察的。在一些情况下,表型直接由单一基因或遗传基因座控制(即,对应于“单基因性状”)。在单倍体诱导的情况下,使用颜色标记(例如r navajo)和其他标记(包括通过种子内颜色的存在或不存在来可视化的转基因)证明种子是否是诱导的单倍体种子。使用r navajo作为颜色标记和使用转基因作为检测雌株上单倍体种子诱导的手段在本领域是熟知的。在其他情况下,表型是几个基因之间相互作用的结果,在一些实施例中,其也由植物和/或植物细胞与其环境相互作用引起。
[0117]
如本文所使用的,术语“植物”可以是指全株植物、其任何部分、或从植物衍生的细胞或组织培养物。因此,术语“植物”可以是指全株植物、植物组分或器官(例如,叶、茎、根等)、植物组织、种子和/或植物细胞中的任何一种。
[0118]
植物细胞是从植物取得的植物细胞,或者是通过培养从取自植物的细胞衍生的植物细胞。因此,术语“植物细胞”包括但不限于种子、悬浮培养物、胚、分生区、愈伤组织、叶、嫩枝、配子体、孢子体、花粉和小孢子内的细胞。短语“植物部分”是指植物的一部分,包括单细胞和细胞组织(例如植物中完整的植物细胞)、细胞团块和可以再生植物的组织培养物。
植物部分的实例包括但不限于来自以下各项的单细胞和组织:花粉、胚珠、叶、胚、根、根尖、花药、花、果实、茎、嫩枝和种子;以及接穗、根茎、原生质体、愈伤组织等。
[0119]
如本文所使用的,术语“引物”是指如下寡核苷酸,当置于诱导引物延伸产物合成的条件下(例如,在核苷酸和用于聚合的试剂(如dna聚合酶)的存在下以及在合适的温度和ph下)时,其能够与核酸靶退火(在一些实施例中,特异性地与核酸靶退火),允许dna聚合酶和/或逆转录酶与其附接,从而用作dna合成的起始点。在一些实施例中,采用一个或多个引物来扩增核酸(例如,使用聚合酶链式反应;pcr)。
[0120]
如本文所使用的,术语“探针”是指可以与靶核酸序列中的互补序列形成氢键合的双链体的核酸(例如,单链核酸或双链或更高级核酸的链、或其子序列)。典型地,探针具有足够的长度以便与其补体形成稳定且序列特异的双链体分子,并且这样可以在一些实施例中用于检测在多个核酸中存在的感兴趣的序列。
[0121]
如本文所使用的,术语“子代”和“子代植物”是指从一个或多个亲本植物通过无性或有性繁殖产生的植物。在单雌生殖
‑
介导的单倍体诱导中,母本上的单倍体胚包含雌性染色体排除雄性染色体—因此它不是雄性单倍体
‑
诱导品系的子代。单倍体玉米种子典型地仍然具有含有雄性染色体组的正常的三倍体胚乳。经编辑的单倍体子代和随后的经编辑的双单倍体植物和随后的种子不是唯一的所希望的子代。还有常常携带cas9转基因的来自单倍体诱导物品系本身的种子、和后续植物以及单倍体诱导植物的种子子代。单倍体种子和单倍体诱导物(自花授粉诱导的)种子可以是子代。子代植物可以通过克隆单一亲本植物或使单一亲本植物自交、或者通过使两个或更多个亲本植物杂交来获得。例如,子代植物可以通过一个亲本植物的克隆或自交或者通过两个亲本植物的杂交而获得,并且包括自交体以及f1或f2或甚至更远的世代。f1是产生自两个亲本的第一代子代(两个亲本的至少一个是第一次用作性状的供体),而第二代(f2)或后续代(f3、f4等)的子代是产生于f1、f2等的自交、互交、回交和/或其他杂交的样本。因此,f1可以是(并且在一些实施例中是)从两个纯育亲本(即,对于感兴趣的性状或其等位基因而言纯育的亲本中的每一个都是纯合的)之间的杂交产生的杂交种,而f2可以是(并且在一些实施例中是)从f1杂交种自花授粉产生的子代。
[0122]
如本文所使用的,短语“重组”是指在相似或相同核苷酸序列的区域中,在配对染色体的两个dna分子或染色单体之间的dna片段的交换(“互换”)。“重组事件”在本文中被理解为在一些实施例中是指减数分裂互换。
[0123]
如本文所使用的,术语“参比序列”是指用作核苷酸序列比较的基础的确定的核苷酸序列。在一些实施例中,seq id no:2、4、8、21、23、25、29、32、和33中的任何一个可以用作参比序列,用于与从植物获得的其他序列进行比较。
[0124]
如本文所使用的,术语“再生”及其语法变体是指从组织培养物中产生植物。
[0125]
如本文所使用的,短语“严格杂交条件”是指多核苷酸通常在复杂的核酸混合物中与其靶子序列杂交(但基本上不与其他序列杂交)的条件。严格条件是序列依赖性的并且在不同的环境下可以是不同的。
[0126]
典型地,较长的序列在较高的温度下特异性杂交。核酸杂交的延伸指南发现于sambrook和russell,2001中。通常,对于在一个限定的离子强度和ph下的特异性序列,严紧杂交条件被选择为比热熔点(tm)大约低5℃至10℃。tm是50%的与靶互补的探针杂交靶序
列处于平衡状态时(在靶序列过量存在时,在tm时,50%的探针被占据处于平衡状态)的温度(在确定的离子强度、ph、和核酸浓度下)。示例性的严紧条件是这些:其中盐浓度小于约1.0m钠离子、典型地在ph 7.0至8.3下大约0.01至1.0m钠离子浓度(或其他盐),并且对于短探针(例如,10至50个核苷酸)温度为至少大约30℃而对于长探针(例如,大于50个核苷酸)至少大约60℃。
[0127]
还可以通过添加去稳定剂(如甲酰胺)来达到严格条件。另外的示例性严格杂交条件包括50%甲酰胺、5x ssc和1%sds,在42℃下孵育;或ssc、1%sds,在65℃下孵育;在65℃下在0.2x ssc和0.1%sds中洗涤一次或多次。对于pcr,约36℃的温度典型地用于低严格扩增,但是取决于引物长度,退火温度可以在约32℃与48℃(或更高)之间变化。在许多的参考文献中提供了用于确定杂交参数的另外的指南(参见例如,ausubel等人,1999)。
[0128]
如本文所使用的,术语“性状”是指感兴趣的表型、促成感兴趣的表型的基因、以及与促成感兴趣的表型的基因相关的核酸序列。例如,“hi性状”是指单倍体诱导表型、以及促成单倍体诱导的基因(例如,玉米中的matl或稻中的os03g27610)和与单倍体诱导表型的存在或不存在相关的核酸序列(例如,hi相关的基因产物)。
[0129]
如本文所使用的,术语“转基因”是指通过某些形式的人工转移技术引入生物体或一个或多个其祖先中的核酸分子。因此,人工转移技术产生“转基因生物体”或“转基因细胞”。应当理解的是,人工转移技术可以在祖先生物体(或其中的细胞和/或可以发育成祖先生物体的细胞)中发生,并且即使一种或多种自然和/或辅助育种导致了人工转移的核酸分子存在于子代个体中,具有人工转移的核酸分子或其片段的任何子代个体仍然被认为是转基因的。
[0130]
如本文所使用的,术语“定向诱变”或“诱变策略”是指导致所选择的基因的有意诱变的任何诱变方法。定向诱变包括方法crispr、tilling、talen和其他尚未发现但可以用于实现相同结果的其他方法。
[0131]
如本文所使用的,单倍体诱导率(“hir”)意指在用单倍体诱导物花粉对穗进行授粉后存活的单倍体籽粒的数量除以籽粒的总数。
[0132]
特定的问题困扰着单倍体诱导:提高的胚败育率和提高的受精失败率(降低的结籽率)。出于这些原因,存在对成功确定hi的原因,并利用该知识来确定稳定或越来越多地产生单倍体植物同时减少受精失败和胚败育的方法的需求。
[0133]
特别考虑到人们可以诱变启动子以潜在地改进元件用于在植物中表达转基因的效用。这些元件的诱变可以随机进行,并且在试错程序(trial
‑
by
‑
error procedure)中筛选诱变的启动子序列的活性。可替代地,可以鉴定为启动子提供希望的表达特征或为启动子提供表达增强活性的特定序列,并且可以经由突变将这些或类似序列引入启动子中。进一步考虑到人们可以诱变这些序列以便增强其转基因在特定物种中的表达。用于诱变编码本发明的启动子序列的dna区段的手段是本领域技术人员熟知的。如所指示的,可以通过随机或位点特异性诱变程序对启动子或其他调节元件进行修饰。启动子和其他调节元件可以通过从编码相应的未修饰序列的序列中添加或缺失一个或多个核苷酸改变它们的结构来进行修饰。
[0134]
可以根据本领域已知的任何技术进行诱变,例如但不限于合成在特定调节序列的序列内具有一个或多个突变的寡核苷酸。具体地,位点特异性诱变是通过对基础dna的特异
性诱变可用于制备启动子突变体的技术。也可以使用rna指导的内切核酸酶(“rgen”,例如crispr/cas9)。例如,结合一个或多个前述考虑,通过将一个或多个核苷酸序列改变引入dna中,所述技术进一步提供制备和测试序列变体的现成能力。位点特异性诱变允许通过使用编码所希望的突变的dna序列的特定寡核苷酸序列以及足够数量的相邻核苷酸来提供足够大小和序列复杂性的引物序列以在正在详细研究的缺失连接片段的两侧形成稳定的双链体而产生突变体。典型地,长度为约17个至约75个核苷酸或更多个核苷酸的引物是优选的,其中序列连接片段的两侧上约10个至约25个或更多个残基被改变。
[0135]
在根据本发明分离出包含启动子的克隆的情况下,人们可能希望界定克隆内的基本启动子区域。用于制备诱变的启动子的一种有效的靶向手段依赖于在启动子序列内鉴定推定的调节元件。这可以通过与已知以相似的组织特异性或发育独特模式表达的启动子序列进行比较来启动。在具有相似的表达模式的启动子之间共享的序列可能是转录因子结合的候选物,并且因此可能是赋予表达模式的元件。这些推定的调节元件的确认可以通过对每个推定的调节序列进行缺失分析,接着通过测定与每个构建体功能性附接的报告基因对每个缺失构建体进行功能分析来实现。因此,一旦提供了起始启动子序列,就可以容易地制备起始启动子的许多不同的缺失突变体中的任何一个。
[0136]
本文中披露的发明提供了包含可以用于构建新颖嵌合调节元件的调节元件片段的多核苷酸分子。包含这些多核苷酸分子的片段和至少一个其他调节元件或片段的新颖组合可以在植物中构建和测试并且被认为是在本发明的范围内。因此,嵌合调节元件的设计、构建和使用是本发明的一个实施例。本发明的启动子包括显示与本发明的启动子序列具有同源性的、已知影响基因调节的顺式元件的同系物。
[0137]
本文所述的转录调节核酸之一的功能等价片段包含至少50、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950或1000个碱基对的转录调节核酸。然后,通过缺失编码mrna的5
′
非翻译区的区域获得的转录调节核酸的等价片段将仅提供(未转录的)启动子区域。5
′
非翻译区可以通过本领域已知的方法(例如5
′‑
race分析)容易地确定。因此,本文所述的一些转录调节核酸是其他序列的等价片段。
[0138]
如上文所指示的,也可以随机制备本发明的启动子的缺失突变体并且然后对其进行测定。按照此策略,制备一系列构建体,每个构建体含有启动子的不同部分(亚克隆),并且然后筛选这些构建体的活性。用于筛选活性的合适手段是将含有缺失区段的缺失启动子或内含子构建体附接至可选择的或可筛选的标记,并且仅分离表达标记基因的那些细胞。以这种方式,鉴定了许多不同的、缺失的启动子构建体,其仍然保留了希望的甚至增强的活性。由此通过比较所选择的构建体来鉴定活性所需的最小区段。然后,此区段可以用于构建用于表达外源基因的载体。
[0139]
如本文所述的表达盒可以包含另外的调节元件。在此背景下的术语应被广义地理解为包含可以影响表达盒的构建或功能的所有序列。例如,调节元件可以修饰原核生物体或真核生物体中的转录和/或翻译。本文所述的表达盒可以在待表达的核酸序列的下游(在3'方向)并且任选地含有另外的调节元件,例如转录或翻译增强子。每个另外的调节元件都可以可操作地连接至待表达的核酸序列(或转录调节核苷酸序列)。另外的调节元件可以包含可以修饰或增强表达调节性质的另外的启动子、最小启动子、启动子元件或转座子元件。表达盒还可以含有一个或多个内含子、一个或多个外显子和一个或多个终止子。
[0140]
此外,考虑到启动子组合来自多于一个启动子的元件可能是有用的。例如,美国专利号5,491,288披露了将花椰菜花叶病毒启动子与组蛋白启动子组合。因此,来自本文披露的启动子的元件可以与来自其他启动子的元件组合。可用于植物转基因表达的启动子包括可诱导的、病毒的、合成的、组成的(odell nature[自然]313:810
‑
812(1985))、时间调节的、空间调节的、组织特异性的和空间时间调节的那些启动子。使用本文所述的调节元件,可以在转化的植物中表达许多农艺学基因。更具体地,可以将植物基因工程化以表达农艺学感兴趣的各种表型。
具体实施方式
[0141]
本发明的一个实施例提供了编辑植物基因组dna的方法,所述方法包括:(i)获得第一植物,其中所述第一植物是植物的单倍体诱导物品系,并且其中所述第一植物能够表达dna修饰酶和任选地指导核酸;(ii)获得第二植物,其中第二植物包含待编辑的植物基因组dna;(iii)用来自第一植物的花粉给第二植物授粉;和(iv)选择由步骤(iii)的授粉产生的至少一种单倍体子代,其中所述单倍体子代包含第二植物的基因组但是不包含第一植物的基因组,并且单倍体子代的基因组通过由第一植物递送的dna修饰酶和任选的指导核酸修饰。
[0142]
在该方法的一个方面中,所述dna修饰酶是定点核酸酶,所述定点核酸酶选自由以下组成的组:兆核酸酶(mn)、锌指核酸酶(zfn)、转录激活子样效应子核酸酶(talen)、cas9核酸酶、cfp1核酸酶、dcas9
‑
foki、dcpf1
‑
foki、嵌合cas9
‑
胞嘧啶脱氨酶、嵌合cas9
‑
腺嘌呤脱氨酶、嵌合fen1
‑
foki、和mega
‑
tal、切口酶cas9(ncas9)、嵌合dcas9非foki核酸酶和dcpf1非foki核酸酶;并且进一步地所述指导核酸是指导rna。
[0143]
在本方法的另一方面中,将经编辑的单倍体子代用染色体加倍剂处理,从而产生经编辑的双单倍体子代。例如,所述染色体加倍剂是秋水仙碱、拿草特、滴停平、氟乐灵、或另一种已知的抗微管剂。
[0144]
在本方法的另一方面中,所述第一植物是单子叶植物或双子叶植物。例如,所述第一植物是单子叶植物,所述单子叶植物选自由以下组成的组:玉米、小麦、稻、大麦、燕麦、小黑麦、高梁、珍珠粟、类蜀黍、竹、甘蔗、芦笋、洋葱、和大蒜。在第二方面,第二植物是单子叶植物或双子叶植物。例如第二植物是单子叶植物,所述单子叶植物选自由以下组成的组:玉米、小麦、稻、大麦、燕麦、小黑麦、高梁、珍珠粟、类蜀黍、竹、甘蔗、芦笋、洋葱、和大蒜。
[0145]
在本方法的另一方面中,任选的指导rna是18
‑
21个核苷酸的序列并且与选自由以下组成的组的序列同源:seq id no:2、4、8、21、23、25、29、32、和33。在第二方面,所述第一植物表达标记基因。例如,所述标记基因选自由以下组成的组:gus、pmi、pat、gfp、rfp、cfp、b1、c1、r
‑
nj、花青素苷色素、和任何其他的标记基因。
[0146]
在本方法的另一方面中,第一植物是玉米植物,其选自和/或衍生自品系stock 6、rwk、rws、uh400、ax5707rs、np2222
‑
matl或若干其他已知的hi品系中的任一种。
[0147]
在一个实施例中,所述第一植物和第二植物是不同的物种。在一方面,第一植物是小麦植物并且第二植物是玉米植物。在第二方面,所述第一植物是玉米植物并且第二植物是小麦植物。
[0148]
本发明的一个目的是通过提供的所述方法产生的经基因编辑的植物。
[0149]
在另一个实施例中,本发明提供了编辑植物基因组dna的方法,其包括:(i)获得第一植物,其中所述第一植物能够表达dna修饰酶和任选地指导核酸;(ii)获得第二植物,其中第二植物包含待编辑的植物基因组dna;(iii)用来自第一植物的花粉给第二植物授粉;(iv)就在步骤(iii)的授粉之前、在其期间或之后施用包含脂质或磷脂酶抑制剂的组合物;和(v)选择由步骤(iii)的授粉产生的至少一种单倍体子代,其中所述单倍体子代包含第二植物的基因组但是不包含第一植物的基因组,并且单倍体子代的基因组通过由第一植物递送的dna修饰酶和任选的指导核酸修饰。在一方面,组合物包含甲基α
‑
亚油酰基氟膦酸酯(malfp)、亚油酸乙酯(llaee)、亚油酸(lla)、玉米油、二硬脂酰
‑
磷脂酰胆碱(dspc)、甲基花生酰基氟膦酸酯(mafp)、棕榈基三氟甲基酮(pacocf3)、花生酰基三氟甲基酮(aacocf3)、海绵类脂、亚麻酸乙酯(lnaee)、亚麻酸乙酯(lnaee)、油酸甲酯(oame)、油酸乙酯(oaee)、棕榈酸乙酯(paee)、棕榈油酸乙酯(plaee)、亚麻籽油、玉米油、α
‑
亚麻酸(alna)、γ
‑
亚麻酸(glna)、油酸、花生四烯酸、硬脂酸、9(z)
‑
11(e)
‑
共轭亚油酸、或2
‑
油酰
‑1‑
棕榈酰
‑
sn
‑
甘油
‑3‑
磷酸
‑
乙醇胺。
[0150]
在另一个实施例中,本发明提供了编辑植物基因组dna的方法,其包括:(i)获得第一植物,其中所述第一植物能够表达dna修饰酶和任选地指导核酸;(ii)获得第二植物,其中第二植物包含待编辑的植物基因组dna;(iii)使第一植物与第二植物杂交;和(iv)选择由步骤(iii)的杂交产生的至少一种单倍体子代,其中所述单倍体子代包含第二植物的基因组但是不包含第一植物的基因组,并且单倍体子代的基因组通过由第一植物递送的dna修饰酶和任选的指导核酸修饰。在一方面,第一植物作为步骤(iii)的杂交中的母本。在第二方面,第一植物包含cenh3基因、ig1基因中的突变、或赋予亲本
‑
单倍体诱导系统的另一突变。
[0151]
实例
[0152]
i.产生新的包含编辑机器的单倍体诱导物品系。
[0153]
我们用talen构建体转化了称为np2222的可转化的玉米品系,并且分别地用cas9和指导rna构建体转化了该品系。设计talen构建体(pbsc22808(seq id no:5),在靶序列中具有talen靶向切割,5
’‑
tccagggtcaacgtggagacagggaggtacgaaccggtg actggcgaaggaagca
‑3’
,seq id no:6;talen识别序列加下划线)和cas9构建体(pbsc23123(seq id no:7),具有xzmplaiia的指导rna序列,5
’‑
gggtcaacgtggagacaggg
‑3’
,seq id no:8)以靶向突变至称为matrilineal的玉米基因(matl;gramene id:grmzm2g471240)的第四外显子。该基因(当通过talen或cas9和指导rna在靶位点突变时)被敲除,产生了蛋白质产物的功能丧失。我们先前确定了由于matl中的功能丧失突变而纯合子的品系是单倍体诱导物品系,这意味着当在杂交中使用它们作为花粉供体时,它们诱导在所得穗上单倍体的形成(参见p.c.t.专利申请号pct/us2016/62548,于2016年11月17日提交,通过引用以其全文并入本文)。
[0154]
我们产生了若干事件并且使它们自花授粉以产生t1种子。我们从事件mzet152408a042a中培养了t1个体。我们回收了五个t1子代,其保留了稳定转化的cas9和指导rna编辑机器的两个拷贝,并且还是matl基因的纯合子突变体。参见表1。
[0155]
表1.包含基因组编辑机器的新hi品系。
[0156][0157]
使用taqman测定检测了matl突变,其扩增了matl的野生型拷贝(本文中称为matl或wt
‑
matl;这些术语在本文中可互换使用)。当两个matl拷贝均发生突变,该测定读为阴性(即,
“‑”
)。通过构建体23123(seq id no:7),将cas9和指导rna编辑机器稳定地插入。通过pcr和亚克隆,我们测序了matl中的突变。测序了每个pcr产物的四个集落,并且给定个体的所有集落具有相同的序列,这说明这些植物都是matl等位基因的纯合子突变体(当引用stock6和其他stock6
‑
衍生的品系中发现的matrilineal中的4个碱基对插入时本文中也称为matl,或当引用matrilineal中的任何其他人类诱导的突变时称为μmatl)。有两种具有8bp缺失的植物,和三种具有13bp缺失的植物。
[0158]
ii.使用新hi品系作为父本和子代分析。
[0159]
我们将上述新hi植物作为雄性花粉供体与雌性测试品系杂交,该雌性测试品系含有隐性颜色标记但是matl基因的野生型。雄性单倍体诱导物品系是相同颜色标记的纯合子野生型。这一雌性品系因此是非单倍体诱导物并且是matl基因的纯合子野生型但是颜色标记的纯合子突变体。我们从杂交中回收了种子和由此产生的发芽的幼苗。
[0160]
子代幼苗经历若干次测定。如果子代幼苗不示出颜色标记(因为隐性标记由雄性诱导物dna补充),则它们评价为二倍体。如果子代幼苗示出颜色标记,它们评价为假定的单倍体,因为隐性标记未被补充。在种植的2656种子中,我们使用了颜色测定并且鉴定了90个幼苗位假定的单倍体。
[0161]
我们进一步使用taqman标记测定分析了90个假定的单倍体中野生型matl基因的存在。在这些之中,82个对于matl是阳性的,这意味着它们不是由父本提供的编辑机器编辑的。使用taqman标记,剩下的8个假定的单倍体幼苗对于野生型matl阴性的,这说明它们可能是由父本提供的编辑机器编辑的。
[0162]
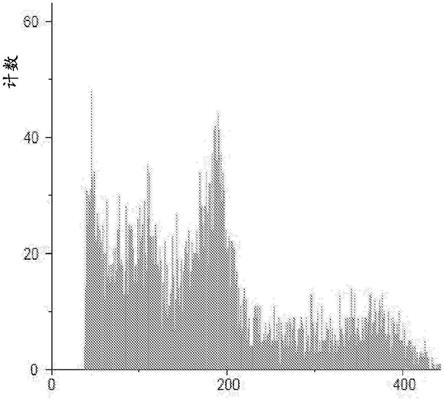
我们通过流式细胞术对这些8个假定的、经编辑的单倍体幼苗使用叶组织在倍数性分析仪中进行了倍性分析。参见图1
‑
8。我们发现它们中的四个是真正的单倍体,而其他的实际上是二倍体。如我们在下文中讨论的,我们进行了pcr并且测序了在这四个真正的单倍体中的matl基因中的突变以及植物usr01350337
‑
2,该植物根据matl taqman测定不是由基因组编辑机器编辑的。
[0163]
在90个假定的单倍体中有四个二倍体的发现不是出乎预料的—所述幼苗测定不是完美的并且偶尔有假阳性出现。我们测试了90个单倍体中cas9构建体(构建体23123)的存在,并且发现90个中有86个缺失,包括以上的四个真正的单倍体。相反,我们在倍性分析期间发现的这四个经编辑的二倍体都具有存在的cas9构建体,这确认了它们作为杂合二倍体的身份,这些杂合二倍体由单倍体幼苗测定错误地鉴定为了单倍体。
[0164]
然后我们使用叶组织来分离基因组dna并且进行了pcr反应以测序这四个真正的单倍体(假定的经编辑的个体)中的matl基因,其具体地针对侧翼于指导rna靶诱变位点的序列。这是为了测定可能或可能不在那里发生的编辑的性质。我们使用可商购的topo blunt iv试剂盒亚克隆了pcr片段,并且测序了每个的至少四个集落(正向和反向测序)。参见以下的表2可见经编辑的等位基因和参照wt
‑
matl等位基因的对比。
[0165]
表2.比较经编辑的等位基因和wt
‑
matl。
[0166][0167]
个体usr01350333
‑
3产生了经编辑的matl等位基因,其在cdna序列的碱基对1143处插入了丙氨酸(表2中加下划线)。这足以在编码序列中引起移码,这将产生提前终止密码子。我们先前想到的是usr01350333
‑
3的经编辑的等位基因#2(gacaagggaggtac的13个碱基对缺失)实际上是pcr污染的结果。在重新测序之后,我们确认了这一植物仅仅具有一个经编辑的等位基因,并且在6个集落中的6个中均发现如此。
[0168]
这一等位基因在如下方面是新颖的,它既不在这一个体的父本植物中,也不在这一个体的母本植物中。这一个体的父本id是usr01283391,并且据发现该植物对于8bp缺失是纯合子。
[0169]
个体usr01350344
‑
2提供了a的缺失(野生型cdna序列的碱基对1143的缺失)。这一突变足以引起编码序列的移码,并产生提前终止密码子。在重新测序和发现了pcr污染之后,我们确认了在6个集落中的6个中均发现如此。先前鉴定为usr01350344
‑
2的经编辑的等位基因#2在此鉴定为pcr污染。
[0170]
个体usr01350343
‑
1提供了cdna序列在碱基对1143处的a的插入。这足以在编码序列中引起移码,并产生提前终止密码子。在4个集落中的4个中均发现如此。
[0171]
个体usr01350328
‑
1提供了a的缺失(来自野生型cdna序列的碱基对1143的缺失)。这一突变足以引起编码序列的移码,并产生提前终止密码子。在4个集落中的4个中均发现如此。
[0172]
个体usr01350337
‑
2没有改变:它的序列与wt
‑
matl的100%一致。
[0173]
总之,我们发现在86个确认的单倍体中的4个中具有matl基因中的突变。我们确认
了这些植物是单倍体并且不含有任何的cas9dna。显然,在胚胎发生期间消除了cas9转基因以及剩下的雄性衍生的dna,并且雌性(卵细胞
‑
衍生的)基因组在胚胎发生过程中产生了编辑。
[0174]
我们知道这些编辑是新颖的并且发生在胚胎发生过程中的雌性基因组中,因为单倍体诱导物品系典型地产生母本单倍体并且我们确认了这些事实上是单倍体。人们可能会试图争辩说有可能这些实际上是父本单倍体,并且我们所看到的编辑实际上是已经存在于父本dna中的编辑。然而,我们可以证明情况不是这样。首先,突变与父系亲本的那些突变不匹配。这在表3和表4中可以清楚地看到(如下所示)。经编辑的单倍体植物usr01350343
‑
1对于插入的单个核苷酸(“a”)是纯合子,但是父本植物具有13个核苷酸的缺失。相似地,植物usr01350328
‑
1对于a的缺失是纯合子,并且父本具有13个核苷酸的缺失。这些实例结合起来证明了在单倍体诱导过程中,可能发生母本基因组的编辑,导致形成了经编辑的母本单倍体。根据这些并且基于检测matl存在的测定和通过倍性分析的确认,并且在雄性方面在玉米泛素启动子的控制下使用了cas9转基因,在单倍体诱导过程中的编辑的比率是约4/86、或4.65%。
[0175]
此外,当使用不同的单倍体诱导物品系或使用远缘杂交时,在单倍体诱导期间编辑的比率可以是很不相同的。可能的是,在玉米中使用matl突变体品系的单倍体诱导和在大麦、小麦、或其他作物的远缘杂交都通过相似的机制发挥作用:受精伴随着基因组消除。还可能的是,受精和基因组消除之间的时间段足够的长,使得编辑机器可以编辑诱导物品系杂交的所述品系的基因组中的靶基因(靶种质)。应注意的是,促进稳定转化的编辑蛋白质系统表达的启动子的选择可能对单倍体中的编辑比率有很大影响。我们使用了组成型甘蔗启动子(prsoubi4)但是促进在胚囊、卵细胞、花粉或精细胞中的高表达或特异性表达的其他的启动子可能更加有效,尤其是在远缘杂交的情况下,其中雄性dna以比在种内单倍体诱导物系统如玉米单倍体诱导物系统或cenh3型单倍体诱导物系统中更加强健和迅速的方式被消除。换言之,在远缘杂交期间,例如当将玉米花粉与小麦穗杂交时(这样做是为了诱导小麦母本单倍体),效果最好的可能是使玉米花粉中的编辑机器由具有强花粉或精细胞表达(或许除合子表达之外)的启动子驱动,因此大量编辑机器(rna和蛋白质)被递送并且出现在合子细胞中和在后续的两个、四个或八分细胞的胚阶段中,即使雄性dna被消除或很快地消失。
[0176]
表3.产生的单倍体子代
without double
‑
stranded dna cleavage.[无需双链dna切割的基因组dna中的靶碱基的可编程编辑]nature[自然]doi:10.1038/nature17946)或任何其他的基因组修饰系统稳定地转化。然后使用也表达编辑机器的转基因单倍体诱导物品系作为花粉供体以通过异交在靶品系中产生突变和单倍体。然后回收了单倍体胚或种子,鉴定为单倍体,并且测试了在靶位点(凭借talen构建体设计或cas9指导rna设计选择了任何靶位点)的编辑。含有所希望的编辑的单倍体使用标准程序使用标准方法例如秋水仙碱、氟乐灵或洽谈的染色体加倍剂进行了染色体加倍。诱导的单倍体的可通过使用颜色标记来碱化,如在玉米双单倍体生产中典型所进行的—这一颜色标记可在所得的胚、种子、幼苗、或成熟植物中呈现。可以通过序列分析(dna测序)、标记分析或表型来检查在靶位点处的突变的存在。因为在单倍体植物中只有一个dna拷贝可以突变,所以应该呈现隐性表型,从而这可能是用来鉴定经编辑的单倍体的另一种方式。
[0182]
a.用在单倍体诱导物品系中直接产生的转基因编辑基因座对优良玉米近交品系中vlhp靶的诱变。
[0183]
vlhp1和vlhp2是同源域
‑
亮氨酸拉链i
‑
类同源框基因和植物特有的一类蛋白质的成员。hd结构域参与dna结合,而zip结构域参与了蛋白质同源和异源二聚化。hd
‑
zip i蛋白通常参与与非生物胁迫、脱落酸(aba)、蓝光、去黄化和胚胎发生相关的反应(elhiti和stasolla,2009.structure and function of homodomain
‑
leucine zipper(hd
‑
zip)proteins.[同源域
‑
亮氨酸拉链(hd
‑
zip)蛋白的结构和功能]plant signal behav.[植物信息与行为]4:86
‑
88)。vlhp1和vlhp2与grassy tillers1(gt1)属于同一基因家族。gt1促进侧芽休眠并抑制玉米侧穗分枝的伸长。
[0184]
在这一实例中,制备了用于表达cas9盒单指导rna(sgrna)的载体23396(seq id no:1;还参见图9)以靶向玉米vlhp1(grmzm2g104204)和其同系物vlhp2(grmzm2g062244)基因。载体23396表达sgrna,其具有20个核苷酸的靶向序列xzmvlhp
‑
01(5
’‑
gcaggaggcgtcgagcagcg
‑3’
,seq id no:2)。xzmvlhp
‑
01在第二外显子处靶向vlhp1和vlhp2基因。使用农杆菌
‑
介导的转化和甘露糖选择将载体23396引入至转化的单倍体诱导物品系np2222
‑
hi中。np2222
‑
hi衍生自可转化的玉米近交品系np2222和stock 6衍生的品系rwks的杂交以渗入单倍体诱导(hi)基因座。np2222
‑
hi具有约9.2%的平均单倍体诱导比率。
[0185]
测定来自载体23396的np2222
‑
hi转化体的基因组vlhp靶序列(5
’‑
gcaggaggcgtcgagca/gcg
‑3’
;seq id no:2)修饰。斜线(“/”)表示cas9切割位置。使用如前所述的定量pcr taqman方法(wo 2016106121,通过引用并入本文中)测定了靶基因座编辑活性。选择具有高靶位点修饰活性的转基因品系
‑
即,vlhp1和vlhp2基因都被修饰,并且优选地含有单拷贝转基因
‑
用于进一步研究并用于杂交或子代的产生。
[0186]
来自23396的t0转化体的花粉直接用于给优良近交品系id5829或其他的玉米品系包括甜玉米品系的穗授粉以诱导单倍体胚的产生。可替代地,在np2222
‑
hi背景中的23396的t0转化体自交以产生携带纯合子转基因的子代品系并且来自子代植物的花粉被用于给玉米品系授粉以诱导单倍体胚形成。诱导的单倍体胚从籽粒中提取并置于胚拯救培养基上以直接发芽或允许其成熟以形成种子。测定来自诱导的单倍体胚和所得植物的组织以确定编辑是否在vlhp靶序列中产生。如果诱导的单倍体胚或植物含有所希望的突变施用染色体加倍处理以从它们中产生双单倍体品系。例如,使用胚拯救方法,在授粉后18
‑
22天从用携
带23396编辑基因座的转基因单倍体诱导物品系授粉的优良品系id5829穗中提取(“dap”,在10
‑
25dap之间提取在理论上是可能的)胚。从发芽的单倍体幼苗中分离dna并用于测定。施用秋水仙碱处理幼苗用于染色体加倍。可替代地,在发芽期间可以将染色体加倍剂施用至分离的胚上。从发芽的幼苗中提取dna并用于确定在xzmvlhp
‑
01靶序列处发生了突变。
[0187]
可以使用替代性的方法。可以允许种子成熟,并且稍后通过另一种表型选择单倍体。可以让种子干燥,并在稍后的时间让种子发芽以确定没有标记的单倍体(例如,使用植物大小而不是赋予颜色标记的基因),此时将测试编辑并在适当情况下应用染色体加倍剂。该方法的优点在于避免了胚筛选和/或拯救。
[0188]
b.用在单倍体诱导物品系中直接引入的转基因编辑基因座对优良玉米近交品系中gw2靶的诱变。
[0189]
稻中e3
‑
泛素连接酶基因da2的突变导致更大的种子(song等人,2007)。稻da2具有2个玉米同系物:gw2
‑
1(grmzm2g170088)和gw2
‑
2(grmzm2g007288)。玉米基因在蛋白质水平上是94%一致的并且在dna水平上是90%一致的。与grmzm2g007288相比,grmzm2g170088具有大的177bp插入(59aa)。
[0190]
在这一实例中,制备了载体23399(seq id no:3,还参见图10)以表达cas9和sgrna来靶向玉米gw2
‑
1(grmzm2g170088)和其同系物gw2
‑
2(grmzm2g007288)基因。gw2
‑
1和gw2
‑
2基因在外显子1中含有靶序列xzmgw2
‑
02(5
’‑
aagctcgcgccctgctaccc
‑3’
,seq id no:4)并且使用这一序列来设计从载体23399表达的sgrna。二元载体23399表达具有20个核苷酸的靶向序列xzmgw2
‑
02的单指导rna(sgrna),其融合至包含crrna和tracrrna的单指导rna支架上。使用农杆菌
‑
介导的转化和甘露糖选择将载体23399引入至转化的单倍体诱导物品系np2222
‑
hi中。np2222
‑
hi衍生自可转化的玉米近交品系np2222和stock 6衍生的品系rwks的杂交以渗入单倍体诱导(hi)基因座。
[0191]
测定了载体23399的np2222
‑
hi转化体的基因组gw2
‑
2靶序列(5
’‑
aagctcgcgccctgcta/ccc
‑3’
,seq id no:4;斜线(“/”)说明cas9切割位置)修饰。使用如前所述的定量pcr taqman方法(wo 2016106121)测定了靶序列编辑活性。选择具有高靶位点修饰活性的转基因品系
‑
即,gw2
‑
1和gw2
‑
2基因都被修饰,并且优选地含有单拷贝转基因
‑
用于进一步研究并用于杂交或子代的产生。
[0192]
来自23399的t0转化体的花粉直接用于给优良近交品系id5829或其他的玉米品系包括甜玉米品系的穗授粉以诱导单倍体胚的产生。可替代地,在np2222
‑
hi背景中的23399的t0转化体自交以产生携带纯合子转基因的子代品系并且来自子代植物的花粉被用于给玉米品系授粉以诱导单倍体胚形成。诱导的单倍体胚从籽粒中提取并置于胚拯救培养基上以直接发芽或允许其成熟以形成种子。测定来自诱导的单倍体胚和所得植物的组织以确定编辑是否在玉米gw2靶序列中产生。如果诱导的单倍体胚或植物含有所希望的突变施用染色体加倍处理以从它们中产生双单倍体品系。例如,使用胚拯救方法,在授粉后18
‑
22天从用携带23396编辑基因座的转基因单倍体诱导物品系授粉的优良品系id5829穗中提取胚。从发芽的单倍体幼苗中分离dna并用于测定。施用秋水仙碱处理幼苗用于染色体加倍。可替代地,在发芽期间可以将染色体加倍剂施用至分离的胚上。从发芽的幼苗中提取dna并用于确定在xzmgw2
‑
02靶序列处是否发生了突变。可替代地,可以允许种子成熟,并且稍后通过另一种表型选择单倍体。甚至可以让种子干燥,并在稍后的时间让种子发芽以确定没有标
taqman测定来测定了幼苗植物以鉴定植物针对转基因cas9
‑
sgrna基因座(测定#2540)和单倍体诱导基因座(测定#2827)是纯合子。
[0199]
针对单倍体诱导基因座和优选地转基因23396、23397、23398和23399cas9
‑
sgrna编辑基因座是纯合子的品系用于给靶优良大田玉米品系id5829和甜玉米品系(swc726或swc412f)的穗授粉以进行单倍体诱导。从授粉的id5829、swc412f、swc726穗中分离了诱导的单倍体胚并在胚拯救培养基上进行发芽。可替代地,允许授粉的穗成熟并使具有单倍体胚的籽粒发芽。收集了叶样品并且对其用taqman测定分析以鉴定在vlhp和gw2基因中含有突变但缺失诱导品系遗传组分例如转基因cas9
‑
sgrna或其他的非转基因标记基因序列的植物。将具有靶gw2或vlhp基因突变的鉴定的单倍体植物用秋水仙碱处理以进行染色体加倍以回收双单倍体植物用于种子生产。可替代地,提取的单倍体胚可以用染色体加倍剂例如秋水仙碱处理并且分析所得植物的倍性水平和在gw2或vlhp基因中靶向突变的存在。具有靶向gw2和vlhp基因突变的植物生长至成熟用于种子生产和进一步的子代评估。
[0200]
例如,从用含有23399cas9
‑
sgrna转基因的单倍体诱导物授粉的甜玉米品系swc412f穗的杂交中鉴定了经编辑的单倍体品系(jser82a056和jser82a063)。品系jser82a056具有突变的gw2
‑
01和gw2
‑
02靶基因,而品系jser82a063仅具有突变的gw2
‑
02基因(参见表5)。由于从单倍体中消除了雄性基因组,这些品系都不含有cas9转基因(cas9的测定#2540或pmi选择性标记基因的#1750)或单倍体诱导物基因(测定#2827)。倍性水平分析确认了两个品系都是单倍体(图11和12)。注意的是,单倍体中的野生型(“wt”)基因的拷贝数为“2”,并且突变体将为“0”,因为拷贝得分记数是相对于内源性adh基因拷贝数。因此,携带wt未经编辑的gw2
‑
01或gw2
‑
02基因的单倍体品系将具有为“2”的拷贝得分记数。wt单倍体诱导物基因座对于测定#2826将具有“2”的拷贝得分记数,并且对于测定#2827(单倍体诱导物变体)具有“0”的拷贝得分记数。如果玉米植物品系是甜玉米和转基因诱导物的二倍体,则它对于单倍体诱导物基因是杂合子,并且因此对于测定#2826和测定#2827都具有为“1”的拷贝得分记数。
[0201]
表5.杂交的子代接合性分析。taqman分析结果示出所述品系不含有花粉供体的转基因或单倍体诱导物基因座,但是在gw2
‑
01和/或gw2
‑
02靶中具有编辑。
[0202]
[0203][0204]
为了进一步确认这些单倍体品系中的靶特异性编辑,通过pcr从jser82a063扩增了gw2
‑
02靶区域并对pcr产物进行测序。与精确地在cas9切割位点的wt序列相比,jser82a063中缺失了单个碱基c(图13)。这些结果清楚地表明,从雄性配子体带入卵细胞中的编辑机器可以在双受精后消除雄性基因组之前编辑雌性基因组以形成单倍体胚。通过在0.5%dmso中的0.125%秋水仙素的注射或在0.06%秋水仙碱溶液中幼苗的浸泡,处理没有转基因的候选经编辑单倍体品系(eder和chalyk,2002,in vivo haploid induction in maize.[玉米中的体内单倍体诱导]theor.appl.genetics[理论与应用遗传学]104:703
‑
708)。将处理过的品系种植在土壤中并在温室中生长以产生子代种子。
[0205]
vi.通过远缘杂交在小麦和其他的单子叶植物中同时单倍体诱导和编辑。
[0206]
使用种间或属间远缘杂交也可以实现单倍体诱导(kasha and kao,1970,high frequency haploid production in barley(hordeum vulgare l.).[大麦(hordeum vulgare l.)中的高频单倍体产生]nature[自然]225:874
‑
886)。例如,小麦单倍体可以通过与玉米(suenaga和nakajima 1989)、珍珠粟(inagaki和mujeeb
‑
kazi 1995)、类蜀黍(ushiyama等人1991)、球茎大麦(h.bulbosum)(barclay 1975)和高梁(ohkawa等人1992)的不同属间杂交的授粉获得。大麦单倍体是通过用球茎大麦花粉授粉获得的。烟草单倍体可以通过与非洲烟草(n.africana)花粉杂交获得。其他作物中也存在许多其他实例。
[0207]
类似于上述将转基因编辑基因座引入stock6诱导品系的实例,可以将转基因编辑基因座引入用于远缘杂交的这些品系中以诱导单倍体诱导和靶向序列突变。表达编辑机器的转基因品系可以通过直接转化或异交的玉米、小麦、大麦、黑麦、珍珠粟、稻、芸苔属、莴苣、番茄、或任何其他作物中的任何品系中产生。优选地,使转基因基因座成为纯合的,并且然后将所述品系用作与其他相容的受体作物的远缘杂交的花粉供体,以诱导单倍体产生所需的编辑。在远缘杂交中受精后基因组消除的过程基本上与玉米matl突变体系统中的过程相同,尽管在某些情况下,外源花粉衍生的dna和编辑机器可能在胚发育中稍早的时候被消除,这就是为什么这一方法优选地使用驱动花粉、精细胞和/或合子细胞中编辑机器的表达的启动子来实施,使得编辑rna和蛋白质存在并且能够编辑靶基因组,即使雄性dna在受精后很快就被消除了。
[0208]
为了证明通过远缘杂交同时进行单倍体诱导和编辑的可行性,产生了表达cas9和靶向小麦vlhp基因序列的sgrna的玉米转基因品系。载体23763(seq id no:24)含有cas9和
sgrna的表达盒(其含有前间区序列xtavlhp1(5
’‑
gacgagcaggcgcagttcc
‑3’
,seq id no:25))用于指导在小麦中tavlhp1靶位点的cas9介导的切割。小麦基因组总共具有三个xtavlhp1靶(tavlhp1
‑
4a、tavlhp1
‑
4b和tavlhp1
‑
4d),其中每个靶在其三个亚基因组中。23397(seq id no:20)中的指导序列xzmvlhp(5
’‑
gctggagctgagcttccggg
‑3’
,seq id no:21)将还指导小麦vlhp靶序列xtavlhp2
‑
1a(5
’‑
gctggagctgagcttccggg
‑3’
,seq id no:26)或xtavlhp2
‑
1b(5
’‑
tctggagctgagcttccggg
‑3’
,seq id no:27)的切割。在中国春小麦基因组中有三个含有xtavlhp2
‑
1a的vlhp2a基因和3个含xtavlhp2
‑
1b序列的vlhp2b基因。使用农杆菌介导的转化将载体23397和23763转化到玉米近交品系np2222中以产生表达cas9和sgrna的转基因品系。转基因玉米品系在温室中生长并自交以产生t1植物。
[0209]
从携带载体23397或23763的t
‑
dna的转基因玉米t0或子代t1植物收集的花粉用于给去雄的春小麦品系ac
‑
nanda授粉。在开花前一至两天,小麦小花被去雄,并且两天后用携带编辑机器的新鲜玉米花粉授粉。为方便起见,来自先正达优良细胞质雄性不育(“cms”)小麦品系(16a300292)的小穗也直接用作雌性供体,以用表达23397或23763cas9
‑
sgrna的转基因玉米花粉诱导单倍体胚形成。在授粉后14
‑
20天从授粉的小花中提取胚用于胚拯救以从小麦x玉米单倍体诱导系统中回收单倍体小植株。将切除的胚在全强度ms(murashige和skoog 1962)或含有不同修改的有机补充物的1/2ms或b5基础培养基上培养,并在20℃
‑
25℃和16小时日长下体外培养3
‑
5周。
[0210]
例如,来自含有载体23763的转基因玉米品系mzet164902a044a的t1子代的花粉用于给cms品系16a300292的穗状花序授粉以诱导小麦单倍体。拯救单倍体胚并取样所得的小麦单倍体幼苗用于qpcr分析以确定vlhp靶序列的拷贝数(参见表6)。据发现一个单倍体品系(jswer30a22)在tavlhp1
‑
4b基因中含有突变,但在a和d亚基因组中的其直向同源物tavlhp1
‑
4a和tavlhp1
‑
4d中没有。倍性水平分析确认了jswer30a22是真正的单倍体(参见图14和15)。通过测序进一步表征tavlhp1
‑
4b靶区域内的突变,并且发现含有从预测的cas9切割位点开始97bp缺失(图16)。我们还鉴定出了在tavlhp1
‑
4a基因中具有“0”个拷贝的另一品系jsw16a07(测定#3252),这说明了靶序列中的靶向编辑。然而,由于我们无法回收用于测序的pcr产物,缺失一个或多个引物结合位点时这一靶基因的缺失可能非常大。在体外培养3
‑
5周后,将具有经编辑的靶位点的单倍体幼苗移植到土壤中。在相同的环境条件下,将移植的幼苗在生长室中硬化一周。在芽形成后添加秋水仙碱。然而,染色体加倍处理可以在胚拯救体外培养阶段之前或移植后进行。当对全麦幼苗进行加倍处理时,修剪单倍体幼苗的根,留下2
‑
3cm的区域,并且然后在20℃浸没在含有2%二甲基亚砜(dmso)和约0.05%吐温
‑
20的0.1%秋水仙碱溶液中5小时。在该处理之后,洗涤根以除去残留的秋水仙碱并将其在泥炭土中盆栽。可以从单倍体幼苗中除去植物组织样品用于突变检测,以鉴定含有tavlhp靶基因序列突变但包括编码转基因编辑机器的序列玉米染色体完全消除的植物。由于jswer30a22来自cms品系,因此所述植物用恢复系授粉以产生子代种子。
[0211]
表6.来自远缘杂交的小麦子代的taqman分析。编辑了品系jsw30a22。
[0212]
[0213][0214]
为了进一步证明通过远缘杂交同时进行单倍体诱导和编辑的可行性,产生了表达来自在花粉中具有高和/或特异性表达的五个启动子的cas9,以及靶向小麦vlhp基因序列的sgrna的玉米转基因品系。这五个载体是24038(seq id no:34)、24039(seq id no:35)、24079(seq id no:36)、24091(seq id no:37)、和24094(seq id no:38)。所有这五种载体均使用含有前间区序列xtavlhp2(5
’‑
gctggagctgagcttccggg
‑3’
,seq id no:21)的相同sgrna,用于指导小麦中tavlhp2靶位点的cas9介导的切割。小麦基因组总共具有三个xtavlhp2靶(tavlhp2
‑
2a、tavlhp2
‑
2b和tavlhp2
‑
2d),其中每个靶在其三个亚基因组中。在这五个构建体中的指导序列还指导小麦vlhp靶序列,xtavlhp2(5
’‑
gctggagctgagcttccggg
‑3’
,seq id no:26)或xtavlhp3(5
’‑
tctggagctgagcttccggg
‑3’
,seq id no:27)的切割。在中国春小麦基因组中有三个含有xtavlhp2的tavlhp2基因和3个含xtavlhp2
‑
1b序列的tavlhp3基因。
[0215]
载体24038(seq id no:34)含有在来自玉米prf3(profilin同系物3)基因的花粉
‑
优选高表达启动子przmgrmzm5g876285和终止子tzmgrmzm5g876285控制下的cas9的表达盒,该基因在花粉中在rna和蛋白质水平具有极高的天然表达,并且具有高精细胞表达的证据。
[0216]
载体24039(seq id no:35)含有在来自玉米expb2(beta expansin2)基因的花粉
‑
优选高表达启动子przmgrmzm2g020852和终止子tzmgrmzm2g020852控制下的cas9的表达
盒,该基因在花粉中在rna和蛋白质水平具有极高的天然表达,并且具有精细胞表达的证据。
[0217]
载体24079(seq id no:36)含有在来自玉米expb1(beta expansin1)基因的花粉
‑
优选高表达启动子przmgrmzm2g146551和终止子tzmgrmzm2g146551控制下的cas9的表达盒,该基因在花粉中在rna和蛋白质水平具有极高的天然表达,并且具有精细胞表达的证据。
[0218]
载体24091(seq id no:37)含有在来自玉米matl(matrilineal)基因的花粉
‑
优选启动子przmgrmzm2g471240和终止子tzmgmrmzm2g471240控制下的cas9的表达盒,该基因示出在rna和蛋白质水平上花粉和可能的精细胞表达的证据。
[0219]
载体24094(seq id no:38)含有在来自玉米matl(matrilineal)基因的花粉
‑
优选启动子przmgrmzm2g471240和终止子tzmgmrmzm2g471240控制下的cas9的表达盒,该基因示出在rna和蛋白质水平上花粉和可能的精细胞表达的证据。这一构建体另外地在cas9分子上具有amcyan荧光蛋白的n
‑
末端融合,用于成像和可视化花粉中cas9的位置。
[0220]
使用农杆菌介导的转化将这五种载体(24038、24039、24079、24091和24094)转化到玉米近交品系np2222中以产生表达cas9和sgrna的转基因品系。
[0221]
转基因玉米品系在温室中生长,并且单拷贝和双拷贝转基因植物与春小麦和cms小麦品系异交。从携带载体24038、24039、24079、24091、和24094之一的t
‑
dna的转基因玉米t0植物收集的花粉用于给去雄的春小麦品系ac
‑
nanda授粉。当cas9由如上所述许多玉米和小麦实例中使用的甘蔗泛素启动子驱动时,花粉也用于qrt实验,其中cas9的表达在rna水平测量并与叶样品中的cas9表达进行比较。如图17所示,花粉中的表达高,与泛素启动子相比,携带t
‑
dna载体24038、24039和24079的植物平均高约100倍。当与携带matrilineal启动子构建体(24094和24091)的花粉相比时,该表达在来自含有载体24038、24039和24079的植物的花粉中也更高,前者已知具有更低的天然基因表达。所有这五种启动子都具有受限于花粉的表达模式。作为启动子正常工作的指示,我们未观察到愈伤组织幼苗叶片中cas9的t0表达,并且在t0玉米叶中没有编辑vlhp靶位点(不希望受理论束缚,当cas9第一次表达时,编辑可能发生在玉米靶位点,十分很可能是在成熟花粉阶段)。
[0222]
在开花前一至两天,从cms品系和ac nanda品系中将小麦小花去雄。两天后,小花用携带来自构建体24038、24039、24091或24094的编辑机器cas9
‑
sgrna的新鲜玉米花粉授粉(用构建体24079转化的t0植物延迟,并且不以这种方式与小麦杂交)。在授粉后14
‑
20天从授粉的小花中提取小麦胚用于胚拯救以从小麦x玉米单倍体诱导系统中回收单倍体小植株。将切除的胚在全强度ms(murashige和skoog 1962)或含有不同修改的有机补充物的1/2ms或b5基础培养基上培养,并在20℃
‑
25℃和16小时日长下体外培养1
‑
5周。例如,来自含有载体24039的转基因玉米品系mzke172601a100a的t0子代的花粉用于给cms品系16a300292的穗状花序授粉以诱导小麦单倍体。拯救单倍体胚并取样所得的小麦单倍体幼苗用于qpcr分析以确定vlhp靶序列的拷贝数(表7)。在该分析中,我们使用测定#2540测试了cas9转基因。被拯救和测试的所有小麦胚都缺乏这一转基因并且给出cas9分数为“0”,因为它们在发育中的胚中没有任何玉米dna,并且因此不具有转基因。在单倍体诱导过程中,玉米dna首先被完全消除,踢除或不能完全递送,这在受精期间和/或受精后发生。除了cas9之外,我们测试了测定#3332和#3333,其给出了vlhp2
‑
2a和vlhp2
‑
2d等位基因的非特异性
扩增。这些测定通常在单倍体小麦中读数为“2”或“>2”,并且我们使用转基因玉米花粉产生的大多数单倍体在这些测定中得分为2或>2。通过寻找0或1的分数,我们使用这些测定来寻找推定的经编辑的单倍体。得分记数“1”可能说明编辑了两个等位基因中的一个,即vlhp2
‑
2a或vlhp2
‑
2d。最后,我们在ac nanda单倍体中测试了测定3255,其特异性地检测vlhp2
‑
2b。cms品系不会扩增这一测定,即使它是野生型,因此我们没有将其用于cms单倍体。未经编辑的单倍体给出“2”的分数,而发现了假定的经编辑的单倍体因为它们具有“0”的分数。分数“1”可能说明读数错误或嵌入的部分经编辑的样本。
[0223]
例如,发现ac nanda单倍体植物之一440
‑
a5含有在tavlhp2
‑
2b基因中的突变,但是在a和d亚基因组中的其直向同源物tavlhp2
‑
2a和tavlhp2
‑
2d中不含有突变(表7)。taqman数据还显示它缺乏cas9转基因。通过测序进一步表征tavlhp2
‑
2b靶区域内的突变,但是尽管我们能够扩增a和d等位基因,但我们不能再扩增b等位基因,这表明存在更大的编辑,可能是大的缺失,导致pcr产物不再扩增。
[0224]
作为另一个实例,根据测定3332和3333的分数“1”发现cms单倍体植物之一450
‑
d11在tavlhp2
‑
2d或tavlhp2
‑
2a同系物中含有突变。(表7)。taqman数据示出它缺乏cas9转基因。通过测序进一步表征了tavlhp2
‑
2a、2b和2d靶区域,但是尽管我们能够扩增a和b等位基因,但我们不能再扩增d等位基因,这表明存在更大的编辑,导致pcr失败。
[0225]
考虑了从携带以下五种优选花粉表达构建体(24038、24039、24091和24094)之一的玉米花粉杂交产生的2295个小麦单倍体,我们发现15个单倍体给出的taqman测定数据表明在vlhp2
‑
2a、vlhp2
‑
2d或vlhp2
‑
2b靶位点处的可能编辑。测序后,发现这些单倍体中的七个在靶位点具有野生型序列,并且由于taqman误差而被称为假阳性。认为这些错误或者是由于测定#3332和#3333给出了vlhp
‑
2a和vlhp
‑
2d等位基因的非特异性扩增,导致一些错过的得分记数,或者是由于低dna量。
[0226]
在剩余的8个推定的经编辑的单倍体中,六个是ac nanda(440
‑
b3、440
‑
d3、440
‑
a5、447
‑
g8、456
‑
g9、459
‑
a2),其中编辑转基因来自构建体24038。这些中的四个(440
‑
b3、440
‑
d3、440
‑
a5、和456
‑
g9)包含在vlhp2
‑
2b中的编辑。发现这些是因为它们对于测定3255具有的taqman分数为“0”。这些植物缺乏cas9(分数为“0”),但对于vlhp2
‑
2a或vlhp2
‑
2d(测定#3332和#3333)具有野生型“2”的分数,这表明它们是未经编辑的那些位点。通过倍性分析确认了这六种植物是单倍体。我们尝试对经编辑的等位基因进行测序,但是虽然pcr和测序反应对2a和2d效果很好,但我们无法获得2b的pcr产物。我们使用一系列反应条件重复pcr几次,但不能从这些单倍体植物中扩增2b同系物。这可能表明编辑引起这些植物中2b基因的大的变化,这可能导致缺失引物退火位点。我们预期许多cms植物也会在vlhp2
‑
2b靶位点具有编辑,但我们没有进行测定检测来自cms品系的vlhp2
‑
2b等位基因。
[0227]
仅考虑ac nanda,我们计算所有构建体的等位基因整体编辑率为0.7%,但构建体24038的编辑率特别高,为1.4%。
[0228]
除了这四个经编辑的单倍体(其中3255的分数为“0”),其他若干种植物给出3255的“0或1”或“1”分数,这表明可能的嵌合性(在胚或小植株的某些细胞谱系中的部分编辑),但我们没有跟进那些植物。对于ac nanda同系物vlhp2
‑
2a,植物447
‑
g8含有编辑,由于pcr反应失败,我们也无法对其测序,即使2b和2d确实扩增了并含有野生型序列。我们使用一系列反应条件重复了pcr几次,但不能扩增2a同系物。相似地,对于vlhp2
‑
2d,植物459
‑
a2含有
编辑,由于pcr反应失败,我们无法测序该编辑。我们使用一系列反应条件重复了pcr几次,但不能扩增2d同系物。我们还在447
‑
h12和440
‑
g6中发现了假定的编辑,但在测序后我们发现这些都是假阳性。
[0229]
对于cms单倍体,植物450
‑
d11在测定#3332和3333(表7)给出了分数“1”。在测序后,我们发现2a同系物具有野生型序列,但我们无法pcr扩增2d同系物,这表明发生了较大的编辑。我们使用一系列反应条件重复了pcr几次,但不能扩增2d同系物。对于植物452
‑
b11,#3332(vlhp2
‑
2a)的taqman分数为“0”,并且即使2d和2b pcr产物和序列正常,我们也无法扩增该等位基因用于测序。我们使用一系列反应条件重复了pcr几次,但不能扩增2a同系物。我们还根据测试3332和3333的taqman数据发现了五种具有推定编辑的植物,但pcr测序示出了这些是假阳性的;所述序列是野生型的(未经编辑的)。
[0230]
总共,我们发现了两个经编辑的cms单倍体和六个经编辑的ac nanda单倍体。可能有更多经编辑的单倍体我们无法检测,因为我们没有针对cms植物的2b基因的测定,也没有针对这五种构建体中的指导rna的vlhp3基因靶位点的测定。
[0231]
来自这些经编辑的单倍体的测序数据与指导rna靶位点周围的大的缺失、易位或重排的概念一致,并且延伸得足够远以可能包括除去一个引物结合位点。这一类型的大变化在cas9编辑过程中并不少见,特别是在通过非同源末端连接的dna修复较慢或被抑制的组织中
‑
在刚受精的合子或早期单倍体小麦胚可能是这样的情况。
[0232]
表7.经编辑的小麦单倍体的测序数据。
[0233]
[0234]
[0235]
[0236][0237]
总体而言,我们发现构建体24038的编辑频率(所鉴定的经编辑的单倍体的数量除以单倍体的总数)为0.79%;对于构建体24039,它是0%;对于构建体24091,它是0%,并且对于构建体24094,它是0.75%。然而,这种编辑率肯定是低估的,因为我们没有进行测定来检测许多指导rna靶位点上的编辑。另外,因为我们使用了1或2拷贝的t0花粉,我们知道使用1拷贝花粉,只有50%的受精花粉粒将含有cas9,并且因此只有一半的胚有机会成为经编辑的;相似地,对于2拷贝亲本,假设在雄性减数分裂中随机分离转基因,我们预计约75%的花粉含有cas9,因此25%的胚不能被编辑。可以合理地得出结论,当人们试图将这一同时编辑加单倍体诱导技术与花粉携带的编辑机器一起使用时,在某些情况下使用在花粉和精细胞中特异性或高表达的启动子可能更为理想,从而cas9可以以更高的水平表达。在基因靶可能影响单倍体诱导物植物发育的情况下,具有不在叶中表达的花粉或精子优选启动子可能是有用的,因为它将避免在发育过程中编辑单倍体诱导物植物中的靶基因
‑
或许在花粉中对其进行第一次编辑。
[0238]
由于精细胞使卵子受精,它们有可能递送cas9 rna和蛋白质(以及转基因dna本身,整合到将被消除的雄性染色体之一中)。正如我们在这一实例中的远缘杂交工作中所证明的那样,将cas9和/或指导rna置于花粉中(并且特别是在精细胞中,当使用单倍体诱导物作为雄性来编辑优良品系时)特异性或高表达的启动子的控制下,可能效果很好。我们不确切地知道matrilineal、expb1、expb2、和prf3是否在营养核、精细胞或两者中表达,以及在合子细胞类型中是否有任何表达,但选择这些是因为它们被认为是在花粉中高和/或特异性表达的。prf3启动子在启动子中具有duo1结合基序,这可能说明它在精细胞中表达。这与具有较高编辑频率的启动子一致。我们在远缘杂交后发现了许多经编辑的小麦单倍体这一事实说明,当花粉中cas9高表达时,使用这些或任何其他启动子,该表达可导致在远缘杂交后在小麦胚中的编辑。这些启动子以及驱动花粉中或特别是精细胞中表达的其他启动子很可能在玉米单倍体诱导或稻单倍体诱导期间增加编辑过程的效率。
[0239]
相似地,在下面的下一个实例中,我们使用cenh3修饰的单倍体诱导物品系在双子叶植物中示出单倍体编辑,并且我们使用组成型启动子来驱动cas9。但是为了提高单倍体编辑的效率,我们可以选择使用在卵细胞中驱动高表达和/或特异性表达的启动子,例如卵器1(egg apparatus1)基因的启动子(“prea1”)(参见,例如,gray
‑
mitsumune,m.和matton,d.p.,the egg apparatus 1gene from maize is a member of a large gene family found in both monocots and dicots[来自玉米的卵器1基因是在单子叶植物和双子叶植
物中发现的大基因家族的成员],planta[植物]223(3):618
‑
625(2006年2月))或卵细胞1(egg cell1,ec1)(参见,例如,sprunck s等人,egg cell
‑
secreted ec1 triggers sperm cell activation during double fertilization.[卵细胞分泌的ec1在双受精期间触发精细胞活化]science[科学]2012;338:1093
‑
97;pmid:23180860;http://dx.doi.org/10.1126/science.1223944)。
[0240]
作为这种启动子的实例,人们可以使用精细胞表达的启动子,如拟南芥精子特异性duo1启动子(参见,例如,engel等人,green sperm.identification of male gamete promoters in arabidopsis[绿色精子.拟南芥雄配子启动子的鉴定],plant physiology[植物生理学]2005年8月,138(4)2124
‑
2133;doi:10.1104/pp.104.054213)或来自其他物种的duo1的同系物(例如,玉米基因grmzm2g105137和grmzm2g046443都是duo1同系物,其具有相似的花粉特异性表达模式)。如果使用其中任何一种来驱动在单倍体诱导物品系如rwk、np2222
‑
hi或matl突变体的精细胞中的cas9表达,它可能会成为一种高效的单倍体编辑品系,用于分别通过种内或远缘杂交编辑不同的优良玉米或小麦种质。
[0241]
用于在精细胞中促进高cas9表达的概念的其他合适的精子表达的启动子将包括小麦、稻、大麦、番茄、向日葵或其他单子叶植物或双子叶植物中的duo1同系物。用于该概念的其他合适的启动子示出在下表8中。这些启动子、或它们在作物物种中的同系物
‑
可能对这一概念非常有用。工作原理是编辑机器的配子细胞表达可以增加本发明的比率或效率,因为这意味着在受精过程中将有丰富的编辑蛋白质或rna存在或递送到胚中,使得编辑可以快速发生。
[0242]
表8.启动子列表:启动子可用于在转基因中驱动编辑机器的高精细胞表达,以提高同时编辑和双单倍体诱导(“sedhi”)的效率。
[0243][0244]
vii.通过远缘杂交或通过与cenh3改变的品系或其他单倍体诱导品系的杂交,在
双子叶植物中的同时单倍体诱导和编辑。
[0245]
体内单倍体诱导也可以使用双子叶植物物种的种间或属间远缘杂交来实现,例如在棉花中(turcotte等人1969,semigametic production of haploids in pima cotton.[比马棉中单倍体的半配子生产]crop sci.[作物科学]9:653
‑
655)和烟草中(burke等人,1979,maternal haploids of nicotiana tabacum l.[烟草(nicotiana tabacum l.)的母本单倍体]science[科学]206:585;wernsman等人1989,androgenetic vs.gynogenetic doubled haploids of tobacco.[烟草单雄生殖与雌核发育的双单倍体]crop sci.[作物科学]29:1151
‑
1155)。通过与来自突变体cenh3植物的花粉杂交,或通过将所述植物作为雌性与野生型花粉杂交,可以获得单倍体拟南芥植物(ravi和chan,2010,haploid plants produced by centromere
‑
mediated genome elimination.[通过着丝粒介导的基因组消除产生的单倍体植物]nature[自然]464:615
‑
618)。可以被修饰以产生单倍体诱导物和sedhi编辑品系的其他候选基因包括knl2和cenpc(两者都可以通过着丝粒介导的单亲基因组消除来操作)以及msi2和向日葵pla2。在这种情况下,单倍体诱导基因组(无论是杂交种的雄性还是雌性)也包含编辑机器,因此可以在单倍体诱导过程中实现了编辑,其结果是没有改变的cenh3或编辑转基因的经编辑的母本或父本单倍体子代植物。参见,例如,wo 2017/004375,通过引用以其全文并入本文中。表达编辑机器的转基因基因座可以引入任何双子叶植物作物或其芸苔属、番茄、胡椒、莴苣、茄子、大豆、向日葵、甜菜、棉花、苜蓿、烟草等的野生近缘种。然后将表达编辑机器的转基因品系用作花粉供体,或者在cenh3的情况下,用作花粉供体或受体,在种间或属间远缘杂交中用于单倍体诱导和同时基因组编辑。例如,通过农杆菌介导的转化产生表达靶向烟草赤霉素20
‑
氧化酶的sgrna的非洲烟草转基因crispr
‑
cas9品系,并用于给去雄的烟草花授粉以诱导单倍体植物,这些植物的基因组在赤霉素20
‑
氧化酶基因座处被编辑。优选地,使用具有大量花粉的易于转化的品系作为用于单倍体诱导的花粉供体并且瞬时提供编辑机器。用于单倍体生产的受体植物具有易于去雄或雄性不育的花。更优选地,颜色或其他视觉标记存在于诱导品系中或包含在编辑基因座中以容易地将单倍体胚或植物与从正常合子发育产生的二倍体区分开。
[0246]
我们通过利用columbia生态型中的拟南芥单倍体诱导物品系,并用编码cas9和靶向glabrous1基因(gl1)的单指导rna(当敲除时,其给出无毛状体的表型)表达的构建体将其转化来例证这一点。我们通过拟南芥兰茨贝格(landsberg erecta)(ler)生态型花粉将t0作为雌性杂交,并回收了gl1经编辑的单倍体子代。
[0247]
单倍体诱导物材料获得自加利福尼亚大学戴维斯分校(uc davis)的comai实验室(comai lab)。这些材料通常用作父本单倍体诱导物品系(当作为雌性与野生型雄性杂交时,引起单雄生殖),但也可以作为母本单倍体诱导物(当作为雄性与野生型雌性杂交时,引起单雌生殖)。通过用玉米cenh3转基因替换天然cenh3基因,已将这些品系改变为单倍体诱导物,如(maheshwari,等人,2017,centromere location in arabidopsis is unaltered by extreme divergence in cenh3 protein sequence.[拟南芥中的着丝粒位置不受cenh3蛋白质序列极端分化的影响]genome research[基因组研究]27(3))所报道。
[0248]
特别地,天然atcenh3基因的两个拷贝被敲除并用稳定插入的zmcenh3转基因补充,其不影响正常植物发育,并且在自花授粉时不产生单倍体,但在异交后确实产生约10%的单倍体。这是对(ravi和chan,2010,haploid plants produced by centromere
‑
mediated genome elimination.[通过着丝粒介导的基因组消除产生的单倍体植物]nature[自然]464:615
‑
618)和许多后续出版物中详细描述的cenh3
‑
tailswap的最初概念的修改。
[0249]
在我们从加利福尼亚大学戴维斯分校获得cenh3*品系后,我们将它们培养,确认了它们具有zmcenh3转基因并且对于天然atcenh3基因是纯合子“无效”的。我们通过以下进行这一点:设计zmcenh3的taqman qpcr测定(测定#2298)并使用pcr和凝胶电泳,通过使用xbal正向和反向引物(seq no tkx和tky)和reddy混合剂(reddy mix)在60℃退火温度下,并在37℃用xbai限制酶切割过夜进行pcr来测试183个幼苗的atcenh3基因型的接合性。野生型等位基因将被该酶切割并产生两个条带(189bp,25bp),而突变体将保持在215bp。这些测试表明,加利福尼亚大学戴维斯分校寄送的所有种子都是突变型等位基因atcenh3
‑
1的纯合子,并且存在多个拷贝的zmcenh3转基因。
[0250]
确信这些获得的种子确实是单倍体诱导物后,我们保留了100株植物,并在两个靶位点处用含有靶向拟南芥(gl1)基因(at3g27920)的sgrna盒的二元载体24075(seq id no:98)开始花浸转化。靶序列是5
’‑
ggaaaagttgtagactgaga
‑3’
和5
’‑
gcagtgatgaacaatgacgg
‑3’
(互补链)。gl1基因的破坏产生部分或完全无毛植物的可见表型(无毛植物缺乏毛状体)。这一载体中的cas9基因(ccas9
‑
05)由拟南芥延伸因子启动子驱动。载体还含有两个选择标记盒,赋予其分别由cmp
‑
02启动子和glycine max ubi
‑
01启动子驱动的kan抗性和amcyan荧光。将载体移入农杆菌菌株eha101中,并且然后将其花浸转化到单倍体诱导物拟南芥植物中。
[0251]
转化方案如下:早上我们将从板获得的24075eha101 reca农杆菌涂布到ypspec100kan50板上。我们将这些在28℃黑暗中培养24小时。我们准备了渗透培养基(4l):1/2xms盐(8.66g)、1xgamborg b5维生素(4ml)、5%(w/v)蔗糖(200g)、0.044μm bap(12.5mg
‑‑‑
12.5ml dmso)40μl,随后进行过滤灭菌。然后我们将250μl 40mg/ml as(20mg/l)和25μl silwet l
‑
77(50μl/l)添加到500ml渗透培养基中。使用环收集农杆菌并将约10ml放入50ml管中,过滤灭菌,我们将农杆菌悬浮直至产生1l,其光密度600为0.54。我们将花序枝条浸入悬浮培养基中20
‑
30秒,并且用盖子盖住托盘。我们第二次重复这一过程,另一悬浮的od600为0.552。
[0252]
转化后约4周,收获大约100,000个自花授粉的种子,并在4℃孵育2天进行春化作用,并且然后通过在70%乙醇中浸泡1分钟并且然后在50%(v/v)漂白剂和0.05%(v/v)triton x
‑
100中浸泡另外10分钟,然后在四次更换的无菌水中洗涤种子将种子灭菌。然后将种子置于卡那霉素(50μg/ml)板上,用于在植物组织培养室中进行发芽筛选/选择(23℃白天,24℃夜晚,16小时照明)。鉴定出38个阳性转化体,因为它们对卡那霉素选择具有抗性,并且它们在转移到土壤中之前长成了幼苗并被取样来测试了cas9 t
‑
dna的存在(测定#3049)以及两个指导rna切割位点的状态(测定#3321和测定#3322)。鉴定了具有gl1突变的等位基因和具有无毛状表型的10个单拷贝和15个2拷贝事件。优先考虑了这些植物,因为它们已示出cas9活性的证据(由于突变的gl1和无毛表型),它们具有cas9转基因并且通过qpcr测定它们具有zmcenh3转基因。通过将这些植物保持在以下生长条件下诱导这些植物长时间开花:16小时光照,23℃白天20℃夜间温度,相对湿度不>60%。
[0253]
在鉴定用cas9构建体转化的这些单倍体诱导物植物的同时,我们播种并培养了从
俄亥俄州立大学的拟南芥生物资源中心获得的拟南芥兰茨贝格(ler)种子群(品系#cs20)。这些是野生型种子,并且cs20中gl1指导rna靶位点的序列与我们构建体中的指导rna的序列匹配。我们允许两个群落开花并进行了约2000个对照杂交,使用了野生型ler植物作为雄性花粉供体,与具有cas9构建体的大约25个单倍体诱导物(其用作雌性)杂交。我们为每只雌性做了100次杂交,用黑色标记对杂交的花朵进行标记,并且除去了我们没有杂交的花朵,以限制收获自花授粉长角果的可能性。在大多数情况下,我们在授粉前通过用镊子除去花药来给雌花去雄,再次避免自花授粉的种子的污染,但在某些情况下这不是必需的,因为花药是幼小或发育不良的。
[0254]
大约15天,我们收获了呈现浅棕色的长角果。然后我们打开了长角果并在土壤中种下种子。然后将它们放入6℃(白天和光照),8小时日长,200umal/m2s照明,60%相对湿度生长室4天。然后我们将它们转移到16小时光照,23℃白天,20℃夜间温度,湿度不>60%生长室中7
‑
10天。我们在几乎所有的长角果中观察到了高频率的败育的种子,平均占种子总数的约40%
‑
50%。在已发表的报道中,该数量的败育胚与该单倍体诱导物材料的性能非常一致。不希望受到该理论的限制,据推测,败育种子最可能是由胚乳中部分或完全基因组消除导致胚乳失衡和失败引起的。这是在异交期间cenh3型单倍体诱导品系中的自然现象,并且可能与cas9转基因的存在无关。这些败育胚不会发芽。由于在每个异交的长角果中胚败育的稳定和可靠率,我们最终使用该表型的缺乏来筛选出意外自花授粉的长角果。就这样,我们让异交的长角果发芽了。
[0255]
总共我们回收了大约2000个发芽子代,其中大部分是异交的。我们通过qpcr标记测定和/或表型筛选的组合鉴定了经编辑的单倍体。我们用来检测经编辑的单倍体的标记如下。
[0256]
首先,我们寻找在zmcenh3测定中的分数“0”。这表明植物是单倍体,因为母本基因组已经丢失,并且因此存在于母本单倍体诱导物植物的多个拷贝中的zmcenh3转基因也已经丢失。相反,二倍体将是母本和父本基因组之间的杂交种,并且对于该测定将具有“1”或“2”或更高的taqman分数,这取决于母株的拷贝数。关键是所有二倍体都会示出这种转基因的证据,但仅具有ler基因组的父本单倍体将不会并且将因此而成为“0”。
[0257]
其次,我们寻找在cas9测定中的“0”分数,这表明它是非转基因的。通过使用荧光并寻找cfp荧光标记物,也可以在视觉上看到这一点。
[0258]
第三,我们寻找gl1靶位点测定之一的分数“0”,这表明该植物已被编辑。对于那些测定,二倍体植物可能示出“0”、“1”或“2”,但单倍体示出“2”或“0”。两个gl1指导rna中的第一个显然具有比第二个更高的编辑效率,因为测定3321在单倍体诱导物t0中具有“0”和“1”的高优势,但是3322大多数为“2”。
[0259]
使用这些测定,我们能够鉴定未经编辑的单倍体(对于zmcenh3和cas9其为“0”,但对于两个gl1靶位点其都具有“2”的分数)和经编辑的单倍体(对于zmcenh3、cas9和gl1(3321)测定其具有“0”)。我们还能够鉴定具有cas9的二倍体杂交种(并且通常在gl1位点被编辑)和不具有cas9的二倍体杂交种(并且通常具有经编辑的gl1的一个拷贝(来自母本)而不是另一个,并且因此,具有gl1测定分数为“1”。我们还能够鉴定若干个假定的经编辑的单倍体,因为它们具有对于靶位点测定(3321)、zmcenh3(2298)和cas9(3049)的分数为“0”。参见下表9的来自亲本usr01424136的子代taqman数据的实例,其含有三个假定的经编辑的单
倍体(孔f2中的植物254、孔d3中的植物260和孔e3中的植物261)。
[0260]
表9.亲本usr01424136的子代分析。
[0261][0262]
只需通过种子发芽和qpcr taqman分析取样,我们就能够识别出8个推定的经编辑的单倍体。还通过表型目视筛选鉴定了经编辑的单倍体,并且然后通过taqman测定稍后进行确认。我们通过寻找无毛状体或无毛(这表明它们没有gl1基因的任何野生型等位基因)的植物和通过寻找胚或幼苗根中缺乏青色荧光蛋白(“cfp”)的表达来筛选经编辑的单倍体。这表明它们缺乏cas9 t
‑
dna。我们观察了若干种这些植物,并将它们提交用于taqman分析。对于我们在表型上鉴定的三种此类的植物,我们能够通过taqman测定确认它们是真正的经编辑的单倍体。我们意识到缺乏cfp的这些无毛植物中的一些可能是假阳性,这是因为cfp是沉默的,或者是因为完全编辑的母株的自花授粉和无效分离体、完全编辑(因此无毛)子代的产生。taqman测定能够检测并筛选出这些假阳性,因为它们不仅直接测试了cas9转基因的存在,还测试了zmcenh3等位基因的存在,zmcenh3等位基因肯定存在于任何自花授粉的污染种子中。我们发现了一些自花授粉种子的例子,这些种子都来自一株母株。该母本的授粉记录表明,花粉十分丰富,可能导致一些自花授粉。我们从总分析中排除了这些子代。
[0263]
对通过taqman测定鉴定的所有推定的经编辑的单倍体进行测序。我们使用pcr扩增经编辑的等位基因,并且然后对每个假定的经编辑的等位基因进行了亚克隆和测序了至少8个集落。参见表10关于我们在第一指导rna(测定#3321)靶位点的经编辑的单倍体中发现的序列变化,以及来自t0亲本的taqman数据。总之,我们发现了19个假定的经编辑的单倍体,并且我们确认3321个靶位点在我们试图测序的12个经编辑的单倍体中的11个中具有突变。其他7个是否也具有突变将在测序时得到确认。参见图24中这些编辑的序列比对。
[0264]
表10. 19个经编辑的单倍体的taqman和序列数据。
[0265][0266][0267]
我们通过倍性分析以及三个二倍体对照(从母本植物取样的组织)进一步运行来自三个经编辑的单倍体植物的叶样品,其示出它们是真正的单倍体(图18
‑
23)。这有助于重新确认它们作为经编辑的单倍体的身份。
[0268]
在我们确信没有自花授粉污染的三个亲本品系中,我们没有进行任何表型预筛选,而是对所有发芽子代进行取样以进行taqman测定(表11)。这些子代的三个母本是usr01431603、usr01431609和usr01431604。我们发现了通过将缺乏zmcenh3和cas9转基因的子代数(59)除以取样子代的总数(605)计算出的单倍体诱导率为约为9.7%。在59个单倍体中,我们发现10个是被编辑的。这意味着在消除母本基因组之前,平均有16.9%的单倍体被母本cas9编辑。不希望受这个最终数量的限制,这意味着,使用该系统,作为总子代的百分比,9.7%*16.9%=所有发芽子代的1.64%是经编辑的单倍体。
[0269]
表11.来自三组子代的单倍体诱导率和编辑率数据,其中每个来自用拟南芥兰茨
贝格花粉杂交的不同的sedhi诱导物母本。
[0270][0271]
通过使用在受精前驱动卵细胞中cas9和/或指导rna表达到更高水平的启动子和/或在受精期间或受精后驱动合子细胞中cas9和/或指导rna表达到更高水平的启动子,可以增加cenh3*型单倍体编辑或其他父本单倍体编辑(使用母本单倍体诱导物品系)的比率。此类启动子的一个实例是ea1(卵器1(egg apparatus1))(grmzm2g456746)的启动子,尽管还有许多其他的实例。人们还可以在卵器
‑
特异性增强子(ease)的背景下表达cas9,其是一个77bp的序列,可刺激卵细胞或早期受合子中相邻基因的表达(参见,例如,yang,等人an egg apparatus
‑
specific enhancer of arabidopsis,identified by enhancer detection[通过增强子检测鉴定的拟南芥卵器
‑
特异性增强子],plant physiology[植物生理学]2005年11月,139(3)1421
‑
1432;doi:https://doi.org/10.1104/pp.105.068262)。viii.通过直接修饰基因组dna序列中的靶碱基的同时进行的单倍体诱导和编辑。
[0272]
dna序列的定向诱变也可以通过将一个dna碱基直接转化为另一个dna碱基而不需要双链断裂(dsb)来实现。例如,胞嘧啶脱氨酶apobec1、腺嘌呤脱氨酶和其他增强组分如尿嘧啶dna糖基化酶(udg)可与cas9(a840h)切口酶或核酸酶灭活的死亡cas9(dca9)融合以直接编辑dna序列而不引入双链dna断裂(komor等人2016.programmable editing of a target base in genomic dna without double
‑
stranded dna cleavage.[无需双链dna切割的可编程编辑基因组dna中的靶碱基]nature[自然]doi:10.1038/nature17946;gaudelli等人2017.programmable base editing of a:t to g:c ingenomic dna without dna cleavage.[无dna切割的基因组dna中a:t至g:c的可编程碱基编辑]nature[自然]doi:10.1038/nature24644;komor等人2017.improved base excisionrepair inhibition and bacteriophage mu gam protein yields c:g
‑
to
‑
t:a base editors with higher efficiency and product purity.[改进的碱基切除修复抑制和噬菌体mu gam蛋白产生更高效率和产品纯度的c:g
‑
至
‑
t:a碱基编辑器]science advances[科学进展],
[0273]
第3卷,第8期,eaao4774,doi:10.1126/sciadv.aao4774)。这种基础编辑机器也可以通过单倍体诱导品系递送,以直接在其他品种中诱导靶序列的碱基编辑。例如,设计了指导rna序列xzmvlhp
‑
03(5
’‑
aggcgtcgagcagcgaggtg
‑3’
,seq id no:28)以胞嘧啶脱氨酶碱基编辑系统以将zmvlhp基因外显子2基因组序列5
’‑
aggcgtcgagcagcgaggtg
‑3’
(seq id no:28)转化为5
’‑
aggcgttgagcagcgaggtg
‑3’
(seq id no:29),从而将精氨酸密码子cga改变为编码序列中的终止密码子(tga)并导致蛋白质序列的过早终止和功能基因的敲除。c到t突变有下划线。相似地,嵌合ncas9
‑
或dcas9
‑
腺嘌呤脱氨酶碱基编辑系统可用于突变zmvlhp或其他基因的编码区、剪接接头或启动子序列以产生具有改变的基因活性的变体。
胞嘧啶脱氨酶和腺嘌呤脱氨酶特别适用于改变转录物剪接位点,因为典型的剪接接头具有5
’‑……
ag/gt
…3’
序列(或在相反链中的5
’‑……
ac/ct
……3’
)。
[0274]
ix.通过dna模板取代等位基因的同时进行的单倍体诱导和编辑
[0275]
体内单倍体诱导系统不仅可以用来引入蛋白质、rna或dna用于切割或转化靶序列,它还可以用于递送dna模板用于以转基因dna形式在靶区域中对精确的序列取代的同源依赖性修复。可以将模板dna插入携带基因组编辑机器(例如crispr
‑
cas9系统)的诱导物品系基因组中,插入在相同的转基因座位或不同的基因座中。当cas9
‑
sgrna和模板dna都存在于诱导的单倍体胚中时,靶序列的切割将导致用同源转基因dna序列作为模板修复染色体断裂。例如,为了在zmpyl
‑
d基因(grmzm2g048733_p02)(参见wo16033230,通过引用以其全文并入本文中)中产生e149l突变,含有供体序列(5
’‑
ccttggtgttgccgtcggggacgtcgacgacgaatgacaggatgacgagcgtccctggccggccgtcgatgacct
‑3’
,seq id no:30)的dna片段用作修复供体。应该注意的是,可以添加另外的同源序列以侧接该核心修复供体序列。将这一修复供体序列的一个或多个拷贝插入cas9
‑
sgrna表达载体23136(seq id no:31)中,其表达指导rna 5
’‑
gtcggggacgtcgacgacga
‑3’
(seq id no:32)以形成等位基因修饰载体pbsc23136
‑
amd。应注意的是,已从供体dna序列中除去潜在的pam位点,使得整合的供体序列不会被pbsc23136
‑
amd表达的cas9
‑
sgrna复合物切割。将pbsc23136
‑
amd转化为单倍体诱导物品系np2222
‑
hi以产生转基因编辑品系。转基因编辑
‑
单倍体诱导品系自交以产生子代品系纯合子编辑基因座。这些纯合子品系用于给靶优良玉米近交品系授粉以诱导单倍体形成,并且还在花粉供体染色体被消除之前通过表达的cas9
‑
sgrna使用瞬时存在的供体dna引入修饰的等位基因。
[0276]
x.在稻中诱导单倍体和同时基因编辑
[0277]
获得了hi
‑
稻品系。例如,稻matl直向同源物,os03g27610(seq id no:33)被突变以产生新的稻hi品系。用包含用于编辑稻基因组的定点诱变系统例如crispr/cas9系统的载体转化所述品系。
[0278]
将稻hi品系与不同的稻品系杂交,优选地为优良品系,以产生至少一个子代单倍体胚。在杂交产生至少一个子代单倍体胚期间,hi亲本稻植物也使基因组编辑机器(例如cas9加上指导rna)被递送至胚。此时,编辑机器操作以编辑单倍体胚的基因组,并且从而获得经编辑的单倍体子代植物。
[0279]
xi.taqman测定和条件。
[0280]
通过数量或目标名称提及了若干种测定。下面提供了上述测定表和相关引物和探针的序列。pcr的条件是所有测定的标准,并且是如下:在98℃变性持续2分钟;随后进行35个循环:(i)在98℃变性30秒,(ii)在60℃退火30秒,(iii)在72℃延伸1分钟;随后在72℃最终延伸10分钟,在4℃保持直至准备好。除非下文另有说明,否则在这些条件下进行测定。
[0281]
表11.测试引物和探针。
[0282]
[0283]
[0284]
[0285][0286]
xii.共显性标记用于单倍体测试的用途。
[0287]
本发明包括测试单倍体植物子代(例如经编辑的单倍体)中诱导物亲本的基因组材料的存在的方法。在一个实施例中,该方法包括从经编辑的单倍体子代中分离核酸,和在核酸中检测多个共显性标记的存在。如本文所用,共显性标记是两个亲本在遗传基因座处具有不同等位基因的标记。例如,一个亲本在一个基因座上是“g”,而另一个亲本在同一基因座上是“a”。标记对于第一植物将产生独特的单倍体(其是单倍体诱导物亲本),并对于第二植物将产生独特的单倍体(其是单倍体子代中的基因组dna的来源)。例如,可以通过上述方法中的任一项获得单倍体。
[0288]
可以使用任何数量的共显性标记,例如,该多个共显性标记包括至少5、至少10、至少15、至少20、至少25、至少30、至少35、至少40、至少45、至少50、至少55、至少60、至少65和至少70个标记。出于说明的目的,表12提供了74个共显性标记,而其他的可能更倾向更多或更少的共显性标记。相似地,应该清楚的是,本领域普通技术人员可以根据需要设计他们自己的共显性标记。
[0289]
表12
[0290]
[0291]
[0292]
[0293]
[0294]
[0295]
[0296]
[0297][0298]
表13提供了可用于通过taqman测定,在如上所述的条件下,检测表12中的共显性标记的测试引物和探针。f1和r1分别对应于正向引物和反向引物。探针通过荧光报道基因(fluo color)指明。检测的雄性品系对应于诱导物品系np2222。检测的雌性品系对应于近交品系,品系b14。
[0299]
表13
[0300]
[0301]
[0302]
[0303]
[0304]
[0305]
[0306]
[0307]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

